Method Article
ODELAY: une méthode à grande échelle pour la quantification multiparamétrique de la croissance de la levure
Dans cet article
Résumé
Nous présentons une méthode pour quantifier les phénotypes de croissance de cellules de levure individuelles à mesure qu'elles se développent dans des colonies sur des milieux solides en utilisant une microscopie temporelle, une évaluation doublée d'une cellule de Living Arrays of Yeast (ODELAY). L'hétérogénéité des populations de cellules génétiquement identiques qui se développent dans des colonies peut être directement observée et quantifiée.
Résumé
Les phénotypes de croissance des microorganismes sont un indicateur important de leur aptitude génétique sous-jacente et peuvent être séparés en 3 régimes de croissance: lag-phase, phase logarithmique et phase stationnaire. Chaque phase de croissance peut révéler différents aspects de la condition physique liés à diverses conditions environnementales et génétiques. Des mesures quantitatives et de haute résolution des 3 phases de croissance sont généralement difficiles à obtenir. Ici, nous présentons une méthode détaillée pour caractériser toutes les 3 phases de croissance sur les milieux solides à l'aide d'un dosage appelé Évaluation doublante à une cellule de Living Arrays of Yeast (ODELAY). ODELAY quantifie les phénotypes de croissance des cellules individuelles qui se développent dans des colonies sur des milieux solides en utilisant une microscopie temporelle. Cette méthode peut observer directement l'hétérogénéité de la population avec chaque paramètre de croissance dans des cellules génétiquement identiques qui se développent dans des colonies. Cette hétérogénéité de la population offre une perspective unique pour la compréhension de la régulation génétique et épigénétique et des réponses àLes perturbations génétiques et environnementales. Alors que la méthode ODELAY est démontrée à l'aide de levure, elle peut être utilisée sur tout microorganisme formant une colonie visible par microscopie à champ clair.
Introduction
Les phénotypes de croissance des microorganismes sont un indicateur important de leur aptitude génétique sous-jacente à une condition environnementale donnée. La croissance est classiquement ségrégée en 3 régimes de croissance différents: lag-phase, log-phase et croissance de la phase stationnaire 1 . Chaque phase de croissance peut révéler différents aspects de la condition physique qui dépendent de diverses conditions environnementales et génétiques. Par exemple, le temps de décalage ou la durée pendant laquelle un organisme passe en phase de latence avant le début de la croissance exponentielle, peut être indicatif de la capacité d'un organisme à répondre à des conditions environnementales altérées 2 . Le temps de doublage pendant la croissance de la phase logarithmique, la mesure la plus fréquente de l'aptitude cellulaire, révèle l'efficacité globale de la capacité d'un organisme à se diviser en métabolisant et en utilisant des matériaux environnementaux pour la réplication. La phase stationnaire, où la croissance après la phase logarithmique est rapidement réduite, est un autre indicateur de conditionnement physique, qui est régulierUtilisé comme critère de croissance dans les essais de croissance de levure à base de taches.
Plusieurs tests de croissance de levure sont actuellement disponibles et considérés comme des méthodes standard pour évaluer les phénotypes de croissance dans la levure 3 , 4 , 5 . Ces analyses reposent principalement sur des méthodes de culture de levure sur des milieux solides ou liquides. Sur les milieux solides, les essais d'épinglage des colonies transfèrent un petit nombre de cellules sur de la gélose solide avec une broche, et les cellules de levure peuvent pousser pendant une période de temps définie. Les colonies sont ensuite imagées et leurs tailles sont comparées à un point terminal terminal 6 . Ces essais de fixation de colonies se sont révélés robustes et évolutifs pour générer des écrans génomiques. Plus récemment, l'imagerie périodique utilisant des scanners à plat et des caméras à réflexion unique (SLR) ont été incorporées dans ces tests pour enregistrer la croissance des colonies au fil du temps 7 , 8, 9 . Cependant, la résolution de ces dispositifs les empêche de détecter des cellules individuelles et, par conséquent, ces essais d'épuration de colonies n'observent pas directement le retard et ne peuvent pas observer de variation entre les cellules individuelles qui se développent en colonies.
Des tests de croissance à base de liquide ont également été utilisés pour réaliser des écrans 3 du génome. Le couplage d'un test de croissance liquide avec une microscopie temporelle a révélé une hétérogénéité de la population au moment du doublement des cellules individuelles génétiquement identiques, ce qui offre une perspective importante pour la compréhension de la régulation génétique et de l'adaptation environnementale. Cependant, ce dosage ne mesure pas d'autres aspects de la croissance tels que le temps de latence et la capacité de charge 10 . Ici, nous présentons une méthode pour caractériser les trois phases de croissance des microorganismes formant des colonies sur des milieux solides en utilisant un dosage, nous appelons ODELAY 11 . ODELAY se compose d'utiliUne microscopie temporelle à haut débit zing pour enregistrer des images de cellules simples qui se développent dans des colonies sur des supports solides. Cette population de cellules individuelles se développant dans des colonies révèle l'hétérogénéité de la population sous-jacente, qui n'est pas détectée par d'autres mesures moins sensibles telles que le pointage terminal. Nous démontrons la méthode sur la levure, mais ODELAY peut être appliqué à tout organisme qui présente un contraste dans le microscope à champ lumineux.
Protocole
1. Préparation du stock de gel d'agarose
- Pesez 2 g d'agarose de haute pureté.
- Ajouter l'agarose dans une bouteille de 500 mL et enregistrer leur masse combinée.
- Calculez la masse cible de la bouteille plus 2 g d'agarose avec 150 g d'eau ultra-pure, puis ajoutez 150 g d'eau ultrapinte à 0,1 g de cette masse cible.
- Notez la masse de la bouteille plus l'agarose et l'eau.
- Placez la bouteille dans un micro-ondes et assurez-vous d'ajuster la bouteille avec un capuchon desserré sur le dessus pour minimiser l'évaporation de l'eau tout en chauffant l'agarose.
- Faire cuire la bouteille dans des rafales de 15 à 20 s, puis faire tourner brièvement la bouteille pour mélanger l'agarose et l'eau. Répétez cette procédure jusqu'à ce que la solution ébullisse et que le mélange soit homogène.
ATTENTION: Veillez à éviter les écailles de peau avec de la vapeur s'échappant de la bouteille. En outre, la bouteille devient chaude au toucher et une protection appropriée, comme un gant autoclave, est nécessaire pour éviter les blessures. - Après que l'agarose fondu est homogène, pesez de nouveau la bouteille et ajoutez de l'eau ultrapure à 0,1 g de la masse d'origine. Cela remplacera toute perte d'eau due à l'évaporation.
- Avant que l'agarose fondu se solidifie, tourbillonner pour mélanger dans l'eau ajoutée pour assurer l'homogénéité.
- Aliquotez 15,2 g d'agarose dans des tubes en plastique de 9 à 50 ml.
- Réfrigérer les tubes jusqu'à ce qu'il soit nécessaire.
2. Préparation de l'ODELAY Agarose Media
- Faire chauffer 400 ml d'eau désionisée pour faire bouillir dans un bécher couvert, sur une plaque chauffante sous agitation douce avec une barre d'agitation magnétique.
- Ajouter 2 mL de milieux 10X ( p . Ex ., Peptone d'extrait de levure (YEP) ou Mélèt complément complémentaire (CSM)) dans une portion aliquote d'agarose de 15,2 g dans un tube conique de 50 ml de l'étape 1.10.
REMARQUE: Le support CSM tend à coller aux diapositives en verre. Si vous utilisez des formulations de média CSM, ajouter 5 μL de polyéthylèneglycol (PEG) à 50% en poids dans de l'eau stérile à la formulation moyenne. Le PEG empêche l'aGar de collage aux diapositives en verre pendant la libération du moule et n'inhibe pas la croissance de la levure. - Ajouter des suppléments nutritifs supplémentaires de 100X, si nécessaire, et utiliser de l'eau pour ramener le volume total ajouté de cette étape à 1 ml.
- Peser l'alipoté d'agarose avec des milieux ajoutés et des suppléments avant de placer le tube conique de 50 ml dans l'eau bouillante de l'étape 2.1.
- Après 16 min, extraire le tube de 50 ml et homogénéiser le mélange en utilisant un vortex. Gardez le capuchon serré sur le tube conique de 50 ml.
REMARQUE: Un couvercle sur le bécher aide à chauffer le tube entier de façon égale, sinon un film d'agarose solide se forme et peut-être ne pas fondre. Aussi pendant ce temps, il est commode d'assembler le moule d'agarose ( Figure 1 ). - Homogénéiser le mélange à l'aide d'un vortex.
- Faire bouillir pendant 2 minutes supplémentaires pour s'assurer que toutes les agar sont mélangées et fondues.
- Peser le tube et remplacer toute perte de masse avec de l'eau stérile ultra-pure.
- Ajouter 2 mL de 10X carbon-azur(Par exemple , 20% p / v de glucose) et le vortex pour obtenir une solution de milieu d'agarose.
REMARQUE: Séparation des diapositives en verre: Lors de l'assemblage du moule, il faut veiller à ce que les entretoises longues soient placées dans le moule avec l'orientation correcte. C'est parce que comme le laser coupe l'acrylique, il a tendance à se couper en tant que cône en laissant la partie avec des côtés légèrement inclinés au lieu de précisément des côtés de 90 °. Ensuite, lorsque le moule est placé sur le dessus de la table pour libérer le verre de la gélose, le bord de l'entretoise doit être à un angle aigu avec la gélose. L'angle aigu aide à comprimer le bord de la gélose loin du morceau supérieur de verre lorsque le bord extérieur de l'entretoise de moule pivote autour du bord inférieur (voir la figure 1 ). Le résultat est une séparation plus constante de la gélose de la partie supérieure du verre.
REMARQUE: Les agents de démoulage appliqués sur les huiles de verre, les pulvérisateurs de silicium ou même les vitrines commerciales ne doivent pas être utilisés car ils contamineront les s. Urface de la gélose et éventuellement inhiber la croissance. Ces méthodes prennent une certaine mesure pour être cohérentes. - Nettoyez quatre diapositives en verre de 2 en x 3 dans x 1 mm d'épaisseur avec 70% d'éthanol et séchez en utilisant de l'air forcé.
- Nettoyez les moules acryliques à 70% d'éthanol, séchez-les et assemblez-les comme le montre la figure 1 . Prenez les trois morceaux inférieurs, comme indiqué, et assemblez-les pour que les deux pièces identiques sèchent la troisième pièce ( figure 1B ). Fixez les pièces de base de chaque côté à l'aide de deux petits agrafes ( Figure 1C ). Placez les montants dans le moule en vous assurant que le laser kerf est correctement positionné ( Figure 1E ).
- Placez la glissière de verre nettoyée et séchée sur le moule et maintenez-la en place en plaçant une deuxième glissière en verre de l'autre côté. Serrer l'ensemble avec un agrafeur plus grand ( Figure 1D ). Fixez les deux glissières avec des clips de liant plus gros (Lass = "xfig"> Figure 1D). Assurez-vous que le clip du classeur supérieur est en contact avec le glissement de verre se chevauchant avec l'acrylique.
- Ajouter les autres agrafes de classeurs. Encore une fois, assurez-vous que les pinces entrent en contact avec la glissière où elles chevauchent l'acrylique ( Figure 1D ).
REMARQUE: Avant de remplir le moule assemblé avec de l'agar en fusion, assurez-vous que les bords sont scellés en pipetant environ 70 μL de milieu de gélose fondu le long du côté intérieur du moule. Cette gélose se solidifie rapidement et empêche toute fuite. - Remplissez le moule avec de l'agar en fusion, en vous assurant d'éviter de piéger les bulles d'air dans le moule.
REMARQUE: ceci peut être réalisé en pipetant lentement l'agar fondu le long du bord du moule. Une fois rempli, laisser refroidir le moule pendant 40 min à 1 h à une température ambiante d'environ 23 ° C. Si on laisse refroidir trop longtemps, l'agar peut se fracture dans le moule.
REMARQUE: Séparation du moule: l'élimination appropriée du moule de l'agar moulé est essentielle pour assurer un solide uniformeAgar-pad pour la croissance de la levure. Le fait de ne pas assurer une séparation efficace du moule à cette étape entraînera des différences de croissance qui sont attribuables aux imperfections dans l'agar-agar solide. Pratiquer cette étape à plusieurs reprises est recommandé. - Commencez par enlever le clip de classeur inférieur. Retirez la partie inférieure du moule qui se compose des trois pièces en sandwich. Tenez les diapositives en les comprimant, puis retirez les clips. Assurez-vous de ne pas heurter les côtés du moule lorsque vous retirez les attaches. Cela déforme les médias.
- Placez le moule sur le bord du dessus du banc afin que le côté du moule avec le point bleu soit vers le haut et dans le coin inférieur gauche ( Figure 1E ). Placez les pouces sous l'acrylique et le premier doigt sur le dessus vers le bord intérieur du moule.
- Poussez doucement et avec précaution avec le pouce contre le moule, comme si le pivotement de l'entretoise de moule à son bord inférieur ( Figure 1F ). Appliquer constanteMais en augmentant lentement la pression. Les utilisateurs verront une rupture et une bulle d'air apparaîtra le long de la ligne où le verre supérieur couvre l'espaceur de moule.
- Après avoir vu la ligne de coupure initiale, continuer à pousser avec des pouces et appliquer une pression constante. L'agar devrait commencer à se détacher du verre à ce point ( Figure 1F ). Continuez à pivoter le moule vers le haut. Cela va soulever le verre sans le glisser. Une ligne où l'agar se détache du verre devrait continuer à s'éloigner de la ligne de rupture initiale.
REMARQUE: à ce stade, la gélose colle au fond et au dessus du verre. Cela se produira parfois avec la plus grande partie de la gauche. Tant que la zone déformée n'est pas dans la zone où la levure est repérée, cela devrait être bien. - Comme le verre est complètement libre, saisissez-le et retirez-le complètement du moule. Ensuite, retirez l'autre pièce de moule en utilisant un mouvement similaire pour soulever la pièce sans déplacer l'agar. Placez les diapositives dans unBoîte à pointe stérile avec une eau stérile de haute pureté dans le fond. Fermez la boîte et conservez à 4 ° CO / N pour l'utilisation le lendemain. Si elles sont stockées plus longtemps, les taux de croissance deviendront incohérents.
3. Préparation de la culture ODELAY
- Disposer des souches dans une plaque de 96 puits pour la croissance O / N.
- Le lendemain, diluer 20 μL de culture de nuit dans 200 μL de média pour 220 μL de volume total dans une nouvelle assiette.
- Mesurer la densité optique à 600 nm (OD600) de chaque culture dans un lecteur de plaques. En utilisant un lecteur de plaques et un robot de manipulation de liquide, suivez le protocole de dilution automatique des étapes 3.3.1 - 3.3.6. Diminuer manuellement les cultures dans la plaque à environ 0,1 OD600 (facultatif).
- Sur le lecteur de plat, appuyez sur "Expérience" sous "Créer nouveau". Choisissez ODELAYDilution.exp et exécutez l'expérience. Entrez le nom de l'expérience comme ODELAY "Date" "Heure" "Itinéraire de l'expérience" itération.
- Cliquez sur le sOnglet tatistics, puis cliquez sur l'icône Excel. Enregistrez les données dans une clé USB et transférez-la à un ordinateur robot de traitement des liquides.
- Ouvrez la mise en page et l'éditeur de méthodes du robot. Ouvrez le fichier Méthode "ODELAYDilution_v1.med". Exécutez l'exécutable "Convert_SynergyFiles.exe". Entrez 0,09 pour la cible OD600.
- Cliquez sur "Glu Correction" et "Gal Correction" à 0.05. Mesurez les supports vierges dans une plaque identique. Cliquez sur "Générer un fichier". Sélectionnez le fichier dans l'éditeur de méthode. Cliquez sur l'icône du feu stop pour démarrer la méthode pour ouvrir le programme de dilution d'exécution.
- Assurez-vous que les tubes ne sont pas pliés et que les plaques ont des bouchons et que les revêtements anti-poussière sont retirés des embouts. Chargez les plaques, les tubes et les pointes sur le pont du robot de traitement des liquides, comme indiqué par la disposition du pont.
- Cliquez sur le bouton "Jouer" pour exécuter le programme de dilution. Sélectionnez le bon nombre de conseils de 50 μL. Sélectionnez le bon nombre de pointes de 300 μL. Attendez à propos de12 min pour le processus à exécuter.
- Prenez la plaque de dilution du robot, recouvrez les pointes et récapitulez les tubes de 15 mL. Cultiver la plaque pendant 5 à 6 heures à 30 ° C.
- Environ 1 à 2 h avant de commencer la deuxième dilution, assurez-vous d'allumer les chambres d'incubation pour le microscope. Laissez-les s'équilibrer à ° C ou à la température requise pour l'expérience.
- Répéter les étapes de dilution 3.3 - 3.4, mais diluer les cultures à une OD600 de 0,01 à 0,02 pour repérer les cultures sur des lames d'agarose.
- Couvrir la plaque de dilution avec un joint de congélation en métal.
- Sonicate la plaque de dilution dans un bain de glace pendant 30 s avec la plaque flottant dans de l'eau glacée à l'aide d'un godet centrifuge pour tenir la plaque ( figure 2A ). Transférer les cultures sonicées de la plaque de dilution à une plaque de fond plat. Étiquetez les plaques à fond plat de 4 x 96 puits 1, 2, 3 et 4 ( figure 2B ).
- Transfert 150 &# 181; L de la plaque de dilution des puits A01 - D06 dans les puits C04 - F09 de la plaque étiquetée 1. Transférer ensuite 150 μL de la plaque de dilution des puits A07 - D12 dans les puits C04 - F09 de la plaque étiquetée 2. Transférer ensuite 150 μL De la plaque de dilution des puits E01 - H06 dans les puits C04 - F09 de la plaque étiquetée 3. Enfin, transférez 150 μL de la plaque de dilution des puits E07 - H12 dans les puits C04 - F09 de la plaque marquée 4.
- Passez à l'étape 4, Spotting on Agar.
4. Spotting on Agar à l'aide d'un robot automatisé de détection de liquide
- Retirez les diapositives d'agarose stockées à 4 ° CO / N (à partir de l'étape 2.19) à partir de leurs boîtes de pipettes stériles humidifiées.
- Si nécessaire, découpez les coins du milieu d'agarose avec une lame de rasoir propre pour s'assurer qu'ils s'adapteront à la chambre à coulisse.
- Retirez la pince de glissement de la monture. Placez soigneusement la plaque de gélose dans la zone en retrait du support de la chambre de scène.
REMARQUE: assurez-vous que le ouL'orientation de la diapositive est cohérente de l'expérience à l'expérience. - Assurez-vous que la pince est alignée avec le fond de la chambre. S'il est tortueux, la glissière peut ne pas être complètement assise dans la zone en retrait. Placez l'entretoise de nivellement dans la position de plaque centrale du robot spotting. Cette entretoise fournit un contact pour les vis de nivellement afin que la chambre à glissière puisse être nivelée avec les pointes.
- Placez les assiettes sur la table dans l'ordre de leur quadrant. Les plaques 1, 2, 3 et 4 commandées de gauche à droite ( figure 2B ).
- Déposez les conseils pour que les 24 puits intérieurs C04 - F09 soient occupés avec des pointes dans 4 boîtes à pointe vide. Une cinquième boîte devra avoir une pointe dans la position C10, ainsi que 4 pointes avec leurs extrémités coupées dans les positions A01, A12, H01 et H12. Ces 4 boutons coupés fournissent une stabilité pour la pince de la plaque de pointe ( Figure 2C et 2D ).
- Retirez le capot supérieur du slMonture de chambre ide.
- Placez le premier poinçon sur le site de départ du programme de repérage du contrôle du robot. Cela devrait perforer un trou dans l'agarose qui sera ensuite utilisé pour aligner la coordonnée d'origine. Placer la plaque 1 sur le robot de traitement des liquides pour repérer le premier quadrant. Assurez-vous que le couvercle est retiré et continuez le programme de repérage.
- Assurez-vous que tous les points sont présents. Aussi, attendez ~ 30 s pour qu'ils sèchent. Lorsque les taches ont environ 1 mm de diamètre, le programme peut continuer. Videz les conseils utilisés dans le récipient à risque biologique et placez des pointes fraîches sur le robot. Échangez la plaque 1 pour la 2ème plaque quadrante.
- Répétez pour le troisième quadrant. Et répétez-vous pour le 4ème quadrant.
- Lorsque les taches sont sèches, remplacez le couvercle de la chambre à coulisse et retournez l'appareil.
- Installez les connexions du tube avec un filtre à air.
- Placez une glissière en verre sur le côté supérieur de la chambre.
REMARQUE: cette diapositive est cruciale pour réduireLe flux de chaleur à la gélose et minimise la formation de condensation sur le côté de recouvrement de l'objectif de la chambre. N'oubliez pas cette couverture. En fonction de la configuration du microscope, ce couvercle empêche le chauffage du côté de l'éclairage de provoquer une condensation du côté de l'objectif. - Placez un ventilateur pour souffler de l'air chaud sur le côté objectif de la chambre. Ce ventilateur empêche la formation de condensation sur le cache. Réglez le débit d'air dans le barboteur à 10 ml / min.
5. Exécuter ODELAY sur le microscope
- Exécutez le script "ODELAY_Microscope_Control.m".
- Cliquez sur le "Obturateur" pour ouvrir l'obturateur lumineux transmis, puis le bouton "Mise au point" pour lancer le taux de caméra élevé ( Figure 3A , Flèches rouges).
- Cliquez sur "Go Origin" et déplacez la scène pour trouver la marque d'origine perforée dans la gélose.
- Puis déplace légèrement vers la droite pourMettez l'accent sur les cellules de levure repérées dans la zone E07.
- Revenez au poinçon d'origine et centrez-le dans le champ de vision.
- Réglez l'origine de cette valeur en appuyant sur le bouton "set" ( Figure 3A , Blue Arrows). Maintenant, passez à la position H18 et concentrez-vous à l'aide de la vis hexagonale la plus proche de cet endroit. Ensuite, passez à la position L07 et concentrez-vous à l'aide de la vis hexagonale la plus proche de cet endroit. Ensuite, passez à la position E07 et concentrez-vous à l'aide de la vis hexagonale la plus proche de cet endroit.
- Répétez les étapes 5.5 - 5.7 si nécessaire jusqu'à ce que ces positions restent en foyer.
- Vérifiez la mise au point au centre et aux bords des points E12, H12, L12. Réglez la plage de mise au point automatique si les valeurs Z de mise au point, telles que indiquées par la valeur Z, sont supérieures à ± la plage de mise au point automatique ( p . Ex ., Réglez la plage de mise au point automatique à 60 μm de la valeur Z pour un point central supérieur à ± 40 μm).
- Appuyez sur le bouton de réinitialisation, car cela activera les propriétés du bouton, puis appuyez surODELAY ( Figure 3A , flèches vertes). Choisissez le répertoire pour enregistrer les données. Assurez-vous que suffisamment d'espace disque disponible.
REMARQUE: Le microscope collecte les données pendant 48 h, ou jusqu'à ce que le programme soit fermé.
6. Traitement des données ODELAY
- Ouvrez ODELAY_IPT.exe ou utilisez le script ODELAY_Image_Processing_Tool_v7.m script ( Figure 3C ).
- Préparez une feuille de calcul * ODELAYExpDisc.xlsx excel.
- Nommez l'expérience dans la cellule B1.
- Sélectionnez le répertoire d'images où les fichiers d'image E07-H18 sont stockés.
- Sélectionnez le répertoire de données où les données seront écrites.
- Écrivez la date à laquelle l'expérience a débuté dans la cellule B04. Utilisez le format MM / DD / AAAA.
- Ecrivez le temps de dilution dans la cellule C04. Cette fois est environ cinq minutes avant que la première image ne soit collectée. Utilisez le format HH: MMpm où HH est pour h et MM pour min.
- Ajouter les noms de contraintes en fonction de tO la plaque source (étape 3.1). En raison de la façon dont les souches sont repérées, elles sont réarrangées sur la lame d'agarose ODELAY. Les cellules de la feuille de calcul B31-B126 sont la plaque source, tandis que les cellules C31-C126 sont les emplacements dans la plaque d'agar ODELAY.
- Ensuite, appuyez sur le bouton "Process Data" et sélectionnez * ODELAYExpDisc.xlsx qui a été préparé.
- Attendre 16-24 h selon le système informatique utilisé pour traiter les données.
- Lorsque les images sont traitées, un répertoire nommé "ODELAY Well Data" et un fichier "* _Index_ODELAYData.mat" apparaîtront. Appuyez sur le bouton "Charger données" et sélectionnez le fichier "* _Index_ODELAYData.mat" qui vient d'être généré. Cela va charger l'ensemble de données qui vient d'être traité. Le "*" dans le nom du fichier sera répertorié selon le nom de l'expérience saisi dans la feuille de calcul Excel.
- Après avoir chargé les données, inspectez-la à l'aide de la barre de temps trouvée en bas, cliquez sur un carré d'image pour voir les courbes de croissance fOu cet endroit, ou trouver un intérêt pour la liste sur la gauche, puis charger les images pour cette liste.
- Générer des histogrammes de paramètres de croissance de la population en appuyant sur le bouton "Violon Plot". Cela générera un graphique illustré à la figure 4 ou à la figure 6 .
Résultats
Des exemples d'images de la levure en croissance en microscopie temporelle sont illustrés à la Figure 3B . Après avoir traité les images temporelles, un ensemble de données représentatif comparant les souches de levure BY4741 et BY4742 est illustré à la figure 4 . Dans cet exemple de base de données, il y a très peu de variations dans le temps de doublement entre différentes positions sur la plaque. Si le milieu d'agarose est mal préparé, un écart évident en temps de doublement et en temps de retard serait évident dans les positions ponctuelles qui coïncident avec la région déformée du gel d'agarose. Alors que les temps de doublement semblent relativement uniformes, cet exemple montre des variations dans les mesures du temps de latence. Un ensemble de données plus cohérent est illustré à la Figure 6 . Dans cet ensemble de données, le temps de décalage et le temps de doublement sont uniformes.
Fichiers / ftp_upload / 55879 / 55879fig1.jpg "/>
Figure 1: Assemblage du moule Agar.
Les composants du moule d'agar sont indiqués en ( A ). Assembler la base comme indiqué sur ( B ), puis serrer la base avec de petits agrafes. Placez les pièces verticales plus longues dans la cavité de la base ( C ), puis faites glisser les glissières sur le moule comme indiqué en ( D ). Une vue latérale montrant l'angle du moule et l'orientation du moule kerf nécessaire pour une séparation constante de la gélose de la glissière en verre ( E ). Notez la position du pouce et des index, ainsi que la ligne droite de la gélose séparant de la glissière ( F ) et notez la flèche horizontale. La ligne de séparation doit se déplacer uniformément dans la direction des flèches verticales. Cliquez ici pour voir une version plus grande de ce chiffre.
= "Jove_content" fo: keep-together.within-page = "1"> 
Figure 2: méthode de sonication et spotting.
Sonicate la plaque dans de l'eau glacée et utilisez un porte-godet centrifuge pour aider à supporter la plaque ( A ). Posez les plaques des étapes 3.8.1 pour repérer sur la plaque d'agarose ( B ). Aussi, organiser les pointes afin que la boîte de pointe la plus à gauche ait une extrémité à la position C10, puis quatre autres extrémités avec leurs extrémités coupées afin qu'elles ne bloquent pas le porte-plaque ( C ). Placez les conseils restants dans quatre boîtes afin que les positions intérieures de 24 pointes soient occupées ( D ). Cliquez ici pour voir une version plus grande de ce chiffre.
55879fig3.jpg "/>
Figure 3: interface utilisateur graphique ODELAY.
Une capture d'écran de l'interface utilisateur graphique pour "ODELAY_Microscopecontrol.m" ( A ). Cette interface permet de surveiller la caméra et d'ajuster les paramètres d'éclairage du microscope pour les modes epifluorescent et champ lumineux. Les flèches rouges indiquent les boutons Focus et Transmitted qui activent la caméra pour acquérir rapidement des images et ouvrent l'obturateur lumineux transmis respectivement. Les flèches bleues sont utilisées pour déplacer le plateau pour l'origine, puis en définissant l'origine avec le bouton "Go Origin" et le bouton "Set". Les flèches vertes indiquent "Reset" et "ODELAY !!!" Les boutons qui réinitialisent les modes d'image ODELAY aux conditions actuelles et initient la collection d'images ODELAY. Images temporelles de levure poussant sur un milieu solide à 0, 3, 6 et 9 h après la tache ( B ). Une capture d'écran de l'interface utilisateur graphique pour "ODELAY_IPT.m" ou th E ODELAY outil de traitement d'image ( C ). Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4: Exemple de sortie ODELAY.
Cet ensemble de données compare les contraintes BY4741 et BY4742 sur les médias YPD. Ce chiffre est un exemple d'une glissière d'agarose bien préparée; Cependant, les paramètres de mise au point automatique ne sont pas optimales. Les données présentées dans chaque colonne, de gauche à droite, sont: la capacité de charge dans Log 2 de la zone de colonie; Temps de doublement, donné en min. Et le temps de retard, donné en min. Dans cet exemple, le temps de doublement de toutes les taches sur la gélose se glisse bien avec une petite quantité de temps de doublement augmenté vers la colonne. Cependant, le temps de retard varie considérablement dans cet ensemble de données._upload / 55879 / 55879fig4large.jpg "target =" _ blank "> Cliquez ici pour voir une version plus grande de cette figure.
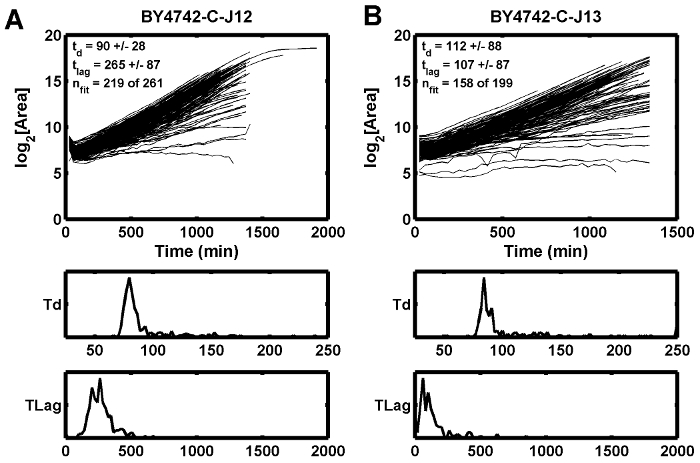
Figure 5: Exemples de courbes de croissance.
Cet exemple démontre que la mauvaise mise au point initiale peut entraîner une augmentation du temps de décalage estimé (t lag ) ( A ), tandis que la position adjacente montre un temps de décalage plus court ( B ). T d est le temps de doublement en min, et t lag est le temps de retard dans min. Cliquez ici pour voir une version plus grande de ce chiffre.
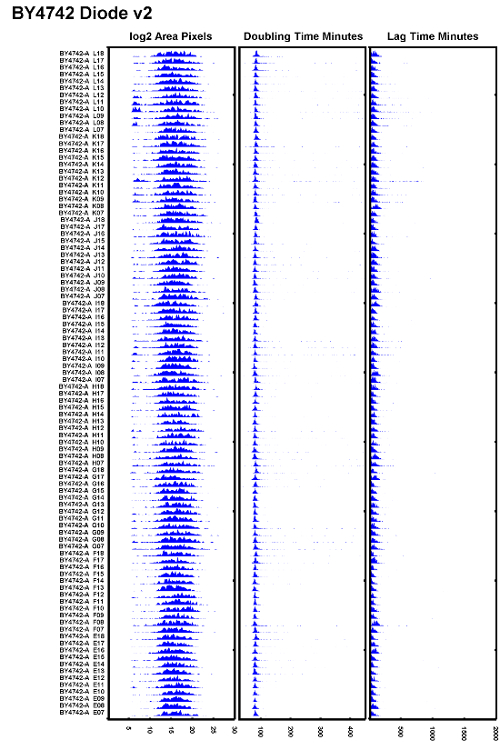
Figure 6: Exemple d'expérience de test bien exécuté.
Un eXample de la souche BY4742 testée après avoir remplacé une ampoule halogène en tungstène par un illuminateur à diodes et en veillant à ce que la mise au point automatique soit correctement réglée. Tous les temps de doublement semblent se chevaucher bien et les temps de retard semblent être cohérents. Cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Le dosage ODELAY comporte plusieurs points critiques pour assurer des mesures phénotypiques reproductibles et fiables. Le premier point critique est la préparation constante des cultures de levure. Il faut prendre soin de récolter les cellules de levure de la croissance logarithmique. Si les cultures sont saturées, leur hétérogénéité de population sera augmentée, ce qui peut nuire à l'hétérogénéité causée par des facteurs génétiques ou environnementaux ( par exemple, source de carbone) 11 . Le deuxième point critique est la préparation uniforme des médias. En général, un grand volume de solution multimédia 10X devrait être généré puis utilisé dans le temps pour minimiser les effets de lot. Formuler des supports par poids, dans la mesure du possible, contribue à améliorer la consistance du milieu dans le temps en assurant la surveillance de la densité d'agar et de la teneur globale en eau de l'agarose. Le troisième point critique implique de minimiser ou d'éliminer toute déformation mécanique de l'agarose moiDia. La déformation mécanique des milieux se produira le plus souvent lors de la séparation de l'agarose des glissières de verre. Comme pour de nombreuses techniques de laboratoire, une pratique est nécessaire pour maîtriser cette étape.
La variation du temps de latence tel que représenté sur la figure 4 est souvent liée à l'un des trois facteurs: la déformation mécanique du milieu d'agarose, la variation de l'épaisseur d'agar moulée ou une source de lumière instable. Si le milieu d'agarose varie en Z-hauteur à travers le réseau tacheté, la variation de hauteur peut submerger la portée de la routine de mise au point automatique, ce qui entraîne une légère désincitation des images initiales. Pour cette raison, vérifiez la hauteur de l'accent sur plusieurs points au centre et le long des bords de la matrice pour s'assurer que la routine de mise au point automatique possède une Z-range suffisante pour trouver la mise au point. Si nécessaire, utilisez le panneau Autofocus pour augmenter la plage de mise au point et augmenter le nombre d'étapes de mise au point.
Une troisième condition possibleL'ion qui peut conduire à une focalisation médiocre est une source de lumière instable ou scintillante, qui peut perturber le score de mise au point calculé pour une hauteur Z spécifique. Les ampoules halogènes au tungstène ont tendance à clignoter avant que les ampoules ne brûlent. L'effet d'une focalisation médiocre est observé dans un exemple où les courbes de croissance s'écoulent entre le premier et le deuxième point de temps ( Figure 5 A ), tandis que l'endroit adjacent n'a pas le même trempe ( Figure 5 B ). Dans ce cas, la mauvaise condition de focalisation a été atténuée en remplaçant la source de lumière halogène au tungstène.
En pratique, les auteurs ont constaté que pour réduire le scintillement des ampoules halogènes à 100W de tungstène, les ampoules doivent être remplacées toutes les 500 h ou environ tous les 2 mois lorsque les microscopes sont très utilisés. Pour éviter des problèmes de focalisation médiocres à partir d'une ampoule scintillante, remplacer souvent la source de lumière halogène de tungstène ou remplacer l'ampoule halogène par une source de diode. UnL'exemple d'un ensemble de données qui montre une variation faible des temps de doublement ainsi que des temps de latence plus uniformes est illustré à la figure 6 . Cet ensemble de données a été pris avec un illuminateur de diodes qui fournit un éclairage plus stable au fil du temps lors de l'autofocus.
Bien que bon nombre des points mentionnés ici pour optimiser la préparation des médias semblent être évidents, dans la littérature, les écrans à grande échelle ne se reproduisent pas correctement 8 , 11 . Par conséquent, nous avons décrit avec soin la préparation des cultures et des milieux d'agarose afin que des écrans phénotypiques plus reproductibles puissent être générés.
Le dosage ODELAY est actuellement limité en débit par rapport aux essais basés sur l'épinglage tels que les tableaux génétiques synthétiques ou le test Scan-O-Matic. Bien que ces méthodes augmentent le nombre de souches mesurées, elles n'ont pas la capacité de résoudre des cellules individuelles.Nd ne peut donc pas mesurer l'hétérogénéité de la population que nous observons dans les souches de levure clonales. L'origine de cette hétérogénéité de la population n'est pas actuellement comprise, mais la fusion de la technologie et du calcul, comme démontré ici, offre une opportunité d'aborder objectivement les mécanismes cellulaires sous-jacents 12 .
Les auteurs souhaitent noter que ODELAY n'est actuellement optimisé que pour une marque et type de microscope spécifique. La modification d'ODELAY pour d'autres systèmes de microscope est simple mais nécessite une connaissance de l'API open source 13 . Cependant, l'API ainsi que les scripts ODELAY sont écrits pour être facilement adaptés à différents systèmes et essais expérimentaux.
Alors que ODELAY a été initialement développé pour la levure, nous avons pu l'utiliser sans modification pour observer la croissance de Mycobacterium smegmatis . L'observation des autres microorganismes formant des colonies estPossible avec des modifications apportées au code source fourni 11 . En général, ODELAY est un outil puissant et flexible pour comparer les microorganismes cultivés dans différentes conditions environnementales et perturbations génétiques.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs reconnaissent le soutien de ce travail par les subventions U54 RR022220 et P50 GM076547 à JDA des National Institutes of Health des États-Unis. FDM est un boursier postdoctoral avec les Instituts de recherche en santé du Canada. Nous remercions également le Centre luxembourgeois pour la biomédecine des systèmes et l'Université du Luxembourg pour le soutien.
matériels
| Name | Company | Catalog Number | Comments |
| Agarose UltraPure | ThermoFisher | 16500500 | Gel Temp 36C, Gel Strength (1%) 1.2 g/sq cm |
| Yeast Extract Peptone (YEP) | Fisher Scientific | BP1422-2 | |
| Complete Suplement Mixture (CSM) | Fisher Scientific | MP114560222 | |
| Polyethylene Glycol 3350 (av. mol. wt. 3000-3700) | SigmaAldrich | P2906 | |
| Yeast Strain BY4741 | ThermoFisher | 95400.BY4741 | |
| Yeast Strain BY4742 | ThermoFisher | 95400.BY4742 | |
| 50 mL Falcon tubes | Corning | 430291 | 1 case |
| 15 mL Falcon tubes | Corning | 352096 | |
| 2 x 3 inch 1.0 mm thick slides 1/2 gross | VWR | 48382-179 | |
| 96-well plate flat bottom | Corning | 353072 | |
| Hydra liquid handleing robot | Thermo | 1096-DT-100 | |
| Hamilton Microlab Star Liquid Handleing Robot | Hamilton | ||
| hydra 100 mL tips Extended Length DARTS | Thermo | 5527 | |
| Synergy H4 Plate Reader | Biotek | H4MLFAD | |
| Leica DMI6000 B Microscope | Leica | ||
| Leica 10X/0.3NA objective | Leica | 11506289 | |
| Hamamatsu ORCA Flash 4.0 Camera | Hamamatsu | C11440-22CU | |
| MATLAB with image processing tool box | Mathworks | ||
| MicroManager | Open Imaging | https://micro-manager.org/ | |
| ODELAY Microscope Control (MATLAB scripts and GUI) | www.aitchisonlab.com\ODELAY for Matlab scripts and software | ||
| ODELAY Microscope Chamber | www.aitchisonlab.com\ODELAY for Mechanincal Drawings | ||
| ODELAY Agar Molds | www.aitchisonlab.com\ODELAY for mold drawings |
Références
- Zwietering, M. H., Jongenburger, I., Rombouts, F. M., van't Riet, K. Modeling of the bacterial growth curve. Appl Environ Microbiol. 56 (6), 1875-1881 (1990).
- Sellick, C. A., Campbell, R. N., Reece, R. J. Galactose metabolism in yeast-structure and regulation of the leloir pathway enzymes and the genes encoding them. Int Rev Cell Mol Biol. 269, 111-150 (2008).
- Yoshikawa, K., et al. Comprehensive phenotypic analysis for identification of genes affecting growth under ethanol stress in Saccharomyces cerevisiae. FEMS Yeast Res. 9 (1), 32-44 (2009).
- Bryan, A. K., Goranov, A., Amon, A., Manalis, S. R. Measurement of mass, density, and volume during the cell cycle of yeast. Proc Natl Acad Sci U S A. 107 (3), 999-1004 (2010).
- Baryshnikova, A., et al. Quantitative analysis of fitness and genetic interactions in yeast on a genome scale. Nat Methods. 7 (12), 1017-1024 (2010).
- Costanzo, M., et al. The genetic landscape of a cell. Science. 327 (5964), 425-431 (2010).
- Collins, S. R., et al. Functional dissection of protein complexes involved in yeast chromosome biology using a genetic interaction map. Nature. 446 (7137), 806-810 (2007).
- Zackrisson, M., et al. Scan-o-matic: High-Resolution Microbial Phenomics at a Massive Scale. G3 (Bethesda). 6 (9), 3003-3014 (2016).
- Bean, G. J., Jaeger, P. A., Bahr, S., Ideker, T. Development of ultra-high-density screening tools for microbial 'omics'. PloS One. 9 (1), e85177 (2014).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS Biol. 10 (5), e1001325 (2012).
- Herricks, T., et al. One-Cell Doubling Evaluation by Living Arrays of Yeast. ODELAY! G3 (Bethesda). 7 (1), 279-288 (2017).
- Mast, F. D., Ratushny, A. V., Aitchison, J. D. Systems cell biology. J Cell Biol. 206 (6), 695-706 (2014).
- Edelstein, A. D., et al. Advanced methods of microscope control using µManager software. J Biol Methods. 1 (2), e10 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon