Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Synthèse et test de la solution solide supportée Pt-Cu Catalyseurs de nanoparticules pour la déshydrogénation au propane
Dans cet article
Résumé
Un procédé pratique pour la synthèse de catalyseurs en Pt-Cu à nanoparticules bimétalliques supportés à 2 nm pour la déshydrogénation au propane est rapporté ici. Les techniques de rayons X synchrotron in situ permettent la détermination de la structure du catalyseur, qui n'est généralement pas accessible à l'aide d'instruments de laboratoire.
Résumé
Une méthodologie pratique pour la synthèse des catalyseurs bimétalliques en Pt-Cu et des tests de performance pour la déshydrogénation et la caractérisation du propane est démontrée ici. Le catalyseur forme une structure de solution solide substitutive, avec une taille de particule petite et uniforme autour de 2 nm. Ceci est réalisé par un contrôle minutieux des étapes d'imprégnation, de calcination et de réduction pendant la préparation du catalyseur et est identifié par des techniques de synchrotron in situ avancées. La performance de la déshydrogénation du catalyseur propane s'améliore continuellement avec l'augmentation du rapport atomique Cu: Pt.
Introduction
La déshydrogénation au propane (PDH) est une étape clé de la production de propylène, en profitant du gaz de schiste, la source de gaz la plus rapide dans le pays 1 . Cette réaction brise deux liaisons CH dans une molécule de propane pour former un propylene et un hydrogène moléculaire. Les catalyseurs métalliques nobles, y compris les nanoparticules Pd, présentent une sélectivité faible pour PDH, rompant la liaison CC pour produire du méthane à haut rendement, avec la production concomitante de coke, ce qui entraîne une désactivation du catalyseur. Des rapports récents ont montré que des catalyseurs sélectifs de PDH pouvaient être obtenus par addition de promoteurs comme Zn ou In à Pd 2 , 3 , 4 . Les catalyseurs favorisés sont près de 100% sélectifs pour PDH, par opposition à moins de 50% pour les nanoparticules Pd monométalliques de même taille. La grande amélioration de la sélectivité a été attribuée à la formation du composé intermétallique PdZn ou PdIn(IMC) sur la surface du catalyseur. Le tableau ordonné de deux types d'atomes différents dans les IMC isolait géométriquement les sites actifs Pd avec des atomes Zn ou In non catalytiques, ce qui a désactivé les réactions secondaires catalysées par un ensemble (groupe) de sites actifs Pd voisins.
Le platine a la plus grande sélectivité intrinsèque parmi les métaux nobles pour la déshydrogénation au propane, mais il n'est toujours pas satisfaisant pour un usage commercial 1 . Typiquement, Sn, Zn, In ou Ga est ajouté comme promoteur pour Pt 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 . Sur la base de l'idée que l'isolement géométrique du site actif contribue à une sélectivité élevée, tout élément non catalytique formant un alliage sLes tructures avec Pt, comme le Cu, devraient également favoriser la performance du catalyseur 14 . Plusieurs études précédentes ont suggéré que l'addition de Cu a en effet amélioré la sélectivité PDH des catalyseurs Pt 15 , 16 , 17 , 18 . Néanmoins, aucune preuve directe n'a été signalée pour déterminer si Pt et Cu forment des nanoparticules bimétalliques ou des structures ordonnées, ce qui est crucial pour comprendre l'effet promotionnel de Cu. Dans le diagramme de phase binaire de Pt-Cu, deux types de structure différents sont possibles sur une large gamme de composition 16 , 18 : composé intermétallique, dans lequel Pt et Cu occupent chacun des sites cristallins spécifiques et une solution solide dans laquelle Cu se substitue aléatoirement à la Pt tretice. Les IMC se forment à basse température et se transforment en solution solide à environ 600 à 800 ° C pour les matériaux en vrac 14. Cette température de transformation peut être plus faible pour les nanoparticules, près de la température de réaction de la PDH ( soit 550 ° C). Par conséquent, il est essentiel d'étudier l'ordre atomique du Pt-Cu dans des conditions réactionnelles. Pour les nanoparticules supportées à petites tailles de particules, il est très difficile d'obtenir des informations structurelles significatives à l'aide d'instruments de laboratoire 19 . La répétition limitée des cellules unitaires conduit à des pics de diffraction très larges avec des intensités très faibles. En raison de la fraction élevée des atomes de surface dans les nanoparticules de 1 à 3 nm, qui sont oxydées dans l'air, la diffraction doit être collectée in situ à l' aide de rayons X à haut flux, généralement disponibles avec des techniques de synchrotron.
Les catalyseurs PDT Pt-Cu précédemment rapportés étaient tous plus grands que 5 nm en taille 15 , 16 , 17 , 18. Cependant, pour les catalyseurs aux nanoparticules de métaux nobles, il existe toujours un fort désir de maximiser l'activité catalytique par coût unitaire en synthétisant des catalyseurs à dispersions élevées (généralement autour ou inférieures à 2 nm) 19 . Bien que la préparation de nanoparticules bimétalliques de cette taille soit possible par des méthodes d'imprégnation standard, un contrôle rationnel des procédures est nécessaire. Les précurseurs de métaux, le pH de la solution d'imprégnation et le type de support doivent être contrôlés pour optimiser l'ancrage des espèces métalliques sur les supports de surface élevée. Les traitements thermiques de calcination et de réduction ultérieurs devraient également être soigneusement contrôlés pour supprimer la croissance des nanoparticules métalliques.
Cet article couvre le protocole pour la synthèse de catalyseurs à nanoparticules bimétalliques Pt-Cu de 2 nm supportés et pour le test de leur performance de déshydrogénation au propane. La structure des catalyseurs est étudiée par Scanning TLa Microscopie électronique à transmission (STEM), la spectroscopie d'absorption des rayons X synchrotron in situ (XAS) et la diffraction des rayons X synchrotron in situ (XRD), qui permettent d'élucider la performance améliorée du catalyseur lors de l'introduction de Cu.
Protocole
1. Synthèse des catalyseurs à nanoparticules bimétalliques Pt-Cu à 2 nm supportés pris en charge
- Préparation de la solution de précurseur de métaux
- Dissoudre 0,125 g de nitrate de cuivre trihydraté (Cu (NO 3 ) 2 · 3H 2 O) dans 1 ml d'eau pour obtenir une solution bleu ciel.
Attention: utiliser des gants de protection lors de la manipulation de produits chimiques. - Ajouter l'ammoniac goutte à goutte à la solution de nitrate de cuivre, formant des précipités bleu foncé d'hydroxyde de cuivre.
Attention: utiliser une hotte pour manipuler des bases et des produits chimiques volatils. - Continuez à ajouter de l'ammoniac jusqu'à ce que les précipités bleu foncé se dissolvent pour former une solution bleu foncé et le pH> 10.
- Ajouter 0,198 g de nitrate de tétraammineplatine ((NH 3 ) 4 Pt (NO 3 ) 2 ) à la solution et de l'eau supplémentaire de sorte que le volume total de la solution soit de 3,5 mL. Ajouter de l'ammoniac supplémentaire si nécessaire pour maintenir le pH de la solution supérieur à 10.
- Faire chauffer la solution à 70 ° C jusqu'à dissolution de tous les sels de nitrate de tétraammineplatinum dans la solution. Laisser refroidir la solution à la température ambiante.
- Dissoudre 0,125 g de nitrate de cuivre trihydraté (Cu (NO 3 ) 2 · 3H 2 O) dans 1 ml d'eau pour obtenir une solution bleu ciel.
- Implantation de la solution de précurseur de métaux
- Avant la préparation du catalyseur, déterminer le volume de pores d'imprégnation du support de silice. Pesez soigneusement environ 5 g de silice sèche dans un plat de pondération. Pendant le mélange, ajouter H 2 O goutte à goutte jusqu'à ce que la silice soit complètement humide, mais sans excès de solution. Repérez la silice humide. Diviser les grammes d'eau ajoutée par les grammes d'échantillon pour calculer le volume des pores.
- Ajouter la solution de précurseur de métal dissous quelques gouttes à la fois à 5 g de silice à haute teneur en pores (SiO 2 ) dans un plat d'évaporation céramique et remuer doucement pour séparer les particules qui se collent pour obtenir une répartition homogène de la solution.
REMARQUE: La silice blanche devient bleu foncé une fois qu'elle adsorbe tous les 3,5 mL de solution de précurseur de métalN.- Assurez-vous que la texture des particules de silice reste comme celle du sable sec. Éviter l'accumulation de solution excédentaire lors de l'imprégnation.
- Placer le précurseur de catalyseur Pt-0.7Cu / SiO 2 imprégné dans un four de séchage et le sécher à 125 ° CO / N.
- Calcination et réduction
- Calcine le catalyseur dans un four à 250 ° C avec une vitesse de rampe de 5 ° C / min dans l'air pendant 3 h.
REMARQUE: La calcination à des températures plus élevées conduit généralement à des nanoparticules de Pt plus grandes. - Placez une couche de 2 cm de laine de quartz au milieu d'un réacteur à tube de quartz de 1 "et chargez le catalyseur Pt-0.7Cu / SiO 2 calciné dans le tube à travers un entonnoir en plastique. Placez le tube dans un four à température programmable.
- Après avoir purgé le tube avec N2 pendant 5 min à température ambiante, commencer à couler H 2 (à température ambiante) à la même vitesse d'écoulement que le N 2 (100 cm) pour réduire le Pt-0.7Cu /Catalyseur SiO 2 .
- Augmenter la température à 150 ° C avec une vitesse de rampe de 5 ° C / min et maintenir pendant 5 min.
- Commencez à ramener lentement la température à une vitesse de 2,5 ° C / min à 250 ° C. Maintenir la température pendant 15 minutes à tous les 25 ° C.
REMARQUE: D'autres métaux peuvent nécessiter des températures inférieures ou supérieures à la réduction. La température exacte peut généralement être déterminée en examinant les changements de couleur du catalyseur ( par exemple, du bleu au noir) pour le Pt-Cu. - Rampe à 550 ° C (ou la température de réaction, si plus haut) à 10 ° C / min et reste pendant 30 minutes pour compléter la réduction. Purger avec N 2 et refroidir à température ambiante.
- Décharger les catalyseurs Pt-0.7Cu / SiO2 et stocker dans un flacon pour une utilisation future.
REMARQUE: Répétez des procédures de synthèse similaires en utilisant différentes quantités de Cu (NO 3 ) 2 · 3H 2 O et (NH 3 ) 4 Pt (NO 3 ) 2 pour préparer l'autre Pt-X Cu / SiO 2 catalyseurs (X = 0,7, 2,3 et 7,3 et représente les rapports atomiques Cu: Pt) et les catalyseurs Pt / SiO2.
- Calcine le catalyseur dans un four à 250 ° C avec une vitesse de rampe de 5 ° C / min dans l'air pendant 3 h.
2. Test de performance au propane-déshydrogénation
- Catalyseur de chargement
- Prenez un réacteur à tube de quartz 3/8 "et placez une couche de 1 cm de laine de quartz contre la fossette au milieu.
Attention: utiliser des gants de protection lors de la manipulation de la laine de quartz, car les aiguilles fines peuvent être imbriquées dans la peau. - Pesez 40 mg de catalyseur Pt-0.7Cu / SiO 2 et 960 mg de silice pour dilution. Mélanger les particules (1 g de poids total) dans un flacon vide.
- Utilisez un entonnoir en plastique pour charger tout le mélange de catalyseur dans le tube de réaction. Essuyez la paroi extérieure des deux extrémités du tube avec des lingettes sans peluches pour éliminer toute saleté pour obtenir un bon joint avec le joint torique.
- Mettez les raccords de tube sur les deux extrémités du tube de réacteur à quartz et attachez-les au système de réacteur équipé d'un four à clapet.
- Prenez un réacteur à tube de quartz 3/8 "et placez une couche de 1 cm de laine de quartz contre la fossette au milieu.
- Test de fuite et prétraitement du catalyseur
- Mettez 50 cm 3 / min N 2 dans le réacteur à tube. Après 1 min, fermez la vanne à bille sur la sortie du réacteur. Attendez que la pression du système augmente jusqu'à 5 psig. Fermez la soupape à bille sur la ligne d'entrée N 2 pour arrêter N 2 et scellez le système du réacteur.
- Attendez 1 minute et enregistrez la pression lue à partir de la jauge. Si la pression baisse, ouvrez la vanne à bille sur la sortie du réacteur pour libérer la pression et remettez les accessoires à l'arrêt. Sinon, ouvrez d'abord la vanne à bille sur la sortie du réacteur pour libérer la pression avant de redémarrer le débit N 2 en allumant la vanne à bille sur la ligne N 2 d' entrée pour purger le système pendant 1 min.
- Commencez à couler 50 cm 3 / min de 5% de H 2 / N 2 pour la réduction du catalyseur avant d'effectuer une réaction et d'arrêter le débit N 2 . Commencez à chauffer le tube à la température de réaction de 550 ° C, avec arA mangé de 10 ° C / min. Attendez 30 minutes après que le four atteint le point de consigne et la température du système se stabilise à la température cible.
- Test de réaction de déshydrogénation au propane
- Démarrez le chromatographe en phase gazeuse (GC) dans le système du réacteur et sélectionnez la méthode appropriée pour l'analyse des composants gazeux.
- Mettre le flux de gaz du réacteur vers une ligne de dérivation. Débit 100 cm 3 / min de 5% de propane / N 2 et 100 cm 3 / min de 5% de H 2 / N 2 . Attendez 1 minute pour que le débit de propane se stabilise et injecte le flux de dérivation dans GC comme échantillon de référence.
- Retournez le flux de gaz à la ligne du tube du réacteur pour commencer la réaction et enregistrez le temps.
- Après la réaction pendant 4 min, injecter le flux de gaz de sortie du réacteur (un échantillon de GC) dans le GC pour obtenir les informations sur les composants du gaz de sortie. Injecter les échantillons toutes les 4 min et exécuter le test jusqu'à ce que la conversion atteigne sta Te ou la conversion est très faible.
- Utilisez le logiciel d'analyse de pointe correspondant pour analyser chaque pic.
- Cliquez pour sélectionner les points de début et de fin du pic. Utilisez la fonction d'intégration pour obtenir la zone de pointe. Noter la zone de pointe pour le réactif propane (C 3 H 8 ); Le produit de propylène (C 3 H 6 ); Et les produits secondaires, le méthane (CH 4 ), l'éthane (C 2 H 4 ) et l'éthylène (C 2 H 6 ).
NOTE: Pour chaque injection, on obtient un diagramme GC avec plusieurs pics dont la zone se rapporte au nombre de moles de différentes espèces de gaz.
- Cliquez pour sélectionner les points de début et de fin du pic. Utilisez la fonction d'intégration pour obtenir la zone de pointe. Noter la zone de pointe pour le réactif propane (C 3 H 8 ); Le produit de propylène (C 3 H 6 ); Et les produits secondaires, le méthane (CH 4 ), l'éthane (C 2 H 4 ) et l'éthylène (C 2 H 6 ).
- Convertissez la surface du pic au nombre de taupes pour chaque espèce en utilisant le facteur de réponse. Déterminer la conversion du propane et la sélectivité du propylène au moment de chaque échantillon selon les formules suivantes:
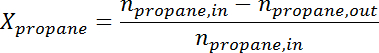
Ad / 56040 / 56040eq2.jpg "/>
où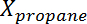 Est la conversion du propane,
Est la conversion du propane, 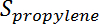 Est la sélectivité du propylène,
Est la sélectivité du propylène, 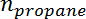 Est le nombre de moles de propane, et
Est le nombre de moles de propane, et 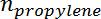 Est le nombre de moles de propylène.
Est le nombre de moles de propylène. - Obtenez la valeur initiale de conversion et de sélectivité à t = 0 en extrapolant la conversion et la sélectivité mesurées en fonction du temps en cours d'utilisation en utilisant un ajustement exponentiel.
- Démarrez le chromatographe en phase gazeuse (GC) dans le système du réacteur et sélectionnez la méthode appropriée pour l'analyse des composants gazeux.
- Post-réaction
- Arrêtez de chauffer le réacteur en éteignant le programme de température. Mettez le flux de gaz à 10 cm 3 / min N 2 .
- Remettez le chromatographe en phase gazeuse en mode veille pour réduire le débit du gaz porteur.
- Décharger le catalyseur usé du réacteur à couche de quartz après refroidissement àtempérature ambiante. Recueillir le poids du catalyseur dans une zone d'élimination des déchets désignée.
3. Caractérisation des échantillons de catalyseur
- Scanning Transmission Electron Microscopy 4 , 20
- Charger le catalyseur dans un mortier et le broyer dans moins de 100 mesh en poudre à l'aide d'un pilon.
- Disperser environ 30 mg de poudre de catalyseur dans environ 5 ml d'alcool isopropylique dans un petit flacon. Secouez le flacon pour un mélange complet puis laissez le flacon reposer pendant 5 minutes pour permettre le dépôt de particules relativement grandes.
NOTE: La suspension obtenue doit contenir de très petites particules de catalyseurs supportés. - Placez une grille prête à l'avance sur un plat d'évaporation. Chauffer le plat à 80 ° C sur une plaque chauffante. Ajouter trois gouttes de la suspension de catalyseur sur la grille.
NOTE: L'alcool isopropylique s'évapore rapidement et laisse les particules de catalyseurE grid. - Chargez la grille sur le support d'échantillon pour l'imagerie d'échantillons à microscopie électronique.
- Spectroscopie d'absorption des rayons X in situ 3 , 4 , 19 , 20
- Chargez le catalyseur dans un mortier et le broyer dans une poudre inférieure à 100 mesh en utilisant un pilon. Chargez les poudres fines dans une matrice et appuyez dessus avec les doigts pour former une plaquette autoportante.
- Chargez un échantillon de ~ 100 mg dans le support d'échantillon.
- Placez le support d'échantillon dans un réacteur à tube à quartz et prétraitez l'échantillon en le réduisant dans 50 cm 3 / min 3% H 2 / He.
- Après le refroidissement à la température ambiante, sceller le tube et le transférer sur la ligne de rayon synchrotron pour collecter les données XAS.
- Diffraction des rayons X in situ 19 , 20
- LoAd le catalyseur dans un mortier et le broyer dans moins de 100 mesh en poudre à l'aide d'un pilon.
- Appuyez sur une plaquette fine en utilisant un ensemble de matrice standard de 7 mm de diamètre.
REMARQUE: Le jeu de matrice contient une pièce femelle et des pièces mâles supérieures et inférieures.- Fixez la pièce mâle inférieure à la partie femelle. Chargez l'échantillon sur la surface polie de la partie inférieure. Fixez la pièce mâle supérieure et transférez la matrice au stade d'échantillonnage de la presse. Appuyez avec la force appropriée.
- Déchargez la plaquette et transférez-la à la tasse en céramique de l'étape d'échantillonnage spécialisée (voir la Table des matières ). Scellez le scénario et fixez-le sur la table d'échantillonnage sur la ligne du faisceau.
- Réduire l'échantillon en écouler et ramener la température à 550 ° C. Recueillir les données de diffraction des rayons X in situ sous un débit de gaz de 3% H 2 / He à 550 ° C et après refroidissement jusqu'à RT 20 .
Résultats
La sélectivité en propylène par rapport au temps pour les catalyseurs Pt et Pt-Cu mesurés à une conversion initiale du propane d'environ 20% est présentée sur la figure 1A . Le catalyseur Pt a une sélectivité initiale de 61%, ce qui augmente à environ 82% avec le temps en cours de circulation lorsque le catalyseur se désactive pendant 1 heure. Le catalyseur Pt-0.7Cu montre une meilleure sélectivité initiale en propylène de 72%. Pour les cat...
Discussion
Les catalyseurs Pt-Cu préparés dans ce travail contiennent des nanoparticules uniformes d'environ 2 nm, similaires aux catalyseurs hétérogènes qualifiés pour une application industrielle. Tous les précurseurs de Pt et Cu forment des structures bimétalliques, par opposition à des particules monométalliques séparées. Cette interaction bimétallique et sa petite taille de particules sont réalisées par un contrôle minutieux des procédures de synthèse. Le procédé d'imprégnation utilise l'adsor...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par l'École de génie chimique de l'Université Purdue. L'utilisation de la source avancée de photons a été soutenue par le ministère américain de l'Énergie, Office of Basic Energy Sciences, en vertu du contrat no. DE-AC02-06CH11357. Les opérations MRCAT, beamline 10-BM sont soutenues par le ministère de l'Énergie et les institutions membres de la MRCAT. Les auteurs reconnaissent également l'utilisation de la ligne de faisceau 11-ID-C. Nous remercions Evan Wegener pour l'aide expérimentale avec le XAS.
matériels
| Name | Company | Catalog Number | Comments |
| 1" quartz tube reactor | Quartz Scientific | Processed by glass blower | |
| drying oven | Fisher Scientific | ||
| calcination Furnace | Thermo Sciencfic | ||
| clam-shell temperature programmed furnace | Applied Test System | Custom made | |
| propane dehydorgenation performance evaluation system | Homemade | ||
| gas chromatography | Hewlett-Packard | Model 7890 | |
| TEM grid | TedPella | 01824G | |
| pellet press | International Crystal Lab | 0012-8211 | |
| die set | International Crystal Lab | 0012-189 | |
| Linkam Sample Stage | Linkam Scientific | Model TS1500 | |
| copper nitrate trihydrgate | Sigma Aldrich | 61197 | |
| tetraammineplatinum nitrate | Sigma Aldrich | 278726 | |
| ammonia | Sigma Aldrich | 294993 | |
| silica | Sigma Aldrich | 236802 | |
| isopropyl alcohol | Sigma Aldrich | ||
| balance | Denver Instrument Company | A-160 | |
| spatulas | VWR | ||
| ceramic and glass evaporating dishes, beakers | VWR | ||
| heating plate | |||
| kimwipe papers | |||
| mortar and pestle | |||
| quartz wool | |||
| Swagelok tube fittings |
Références
- Sattler, J. J., Ruiz-Martinez, J., Santillan-Jimenez, E., Weckhuysen, B. M. Catalytic dehydrogenation of light alkanes on metals and metal oxides. Chem. Rev. 114 (20), 10613-10653 (2014).
- Childers, D. J., et al. Modifying structure-sensitive reactions by addition of Zn to Pd. J Catal. 318, 75-84 (2014).
- Gallagher, J. R., et al. Structural evolution of an intermetallic Pd-Zn catalyst selective for propane dehydrogenation. Phys. Chem. Chem. Phys. 17, 28144-28153 (2015).
- Wu, Z., et al. Pd-In intermetallic alloy nanoparticles: highly selective ethane dehydrogenation catalysts. Catal Sci Technol. 6 (18), 6965-6976 (2016).
- Siddiqi, G., Sun, P., Galvita, V., Bell, A. T. Catalyst performance of novel Pt/Mg (Ga)(Al) O catalysts for alkane dehydrogenation. J Catal. 274 (2), 200-206 (2010).
- Passos, F. B., Aranda, D. A., Schmal, M. Characterization and catalytic activity of bimetallic Pt-In/Al 2 O 3 and Pt-Sn/Al 2 O 3 catalysts. J Catal. 178 (2), 478-488 (1998).
- Virnovskaia, A., Morandi, S., Rytter, E., Ghiotti, G., Olsbye, U. Characterization of Pt, Sn/Mg (Al) O catalysts for light alkane dehydrogenation by FT-IR spectroscopy and catalytic measurements. J Phys Chem C. 111 (40), 14732-14742 (2007).
- Jablonski, E., Castro, A., Scelza, O., De Miguel, S. Effect of Ga addition to Pt/Al 2 O 3 on the activity, selectivity and deactivation in the propane dehydrogenation. Appl Catal A. 183 (1), 189-198 (1999).
- Galvita, V., Siddiqi, G., Sun, P., Bell, A. T. Ethane dehydrogenation on Pt/Mg (Al) O and PtSn/Mg (Al) O catalysts. J Catal. 271 (2), 209-219 (2010).
- Shen, J., Hill, J. M., Watwe, R. M., Spiewak, B. E., Dumesic, J. A. Microcalorimetric, infrared spectroscopic, and DFT studies of ethylene adsorption on Pt/SiO2 and Pt-Sn/SiO2 catalysts. J Phys Chem B. 103 (19), 3923-3934 (1999).
- Silvestre-Albero, J., et al. Microcalorimetric, reaction kinetics and DFT studies of Pt–Zn/X-zeolite for isobutane dehydrogenation. Catal Lett. 74 (1-2), 17-25 (2001).
- Sun, P., Siddiqi, G., Vining, W. C., Chi, M., Bell, A. T. Novel Pt/Mg (In)(Al) O catalysts for ethane and propane dehydrogenation. J Catal. 282 (1), 165-174 (2011).
- Sun, P., Siddiqi, G., Chi, M., Bell, A. T. Synthesis and characterization of a new catalyst Pt/Mg (Ga)(Al) O for alkane dehydrogenation. J Catal. 274 (2), 192-199 (2010).
- Okamoto, H. . Phase diagrams for binary alloys. Desk handbook. , (2000).
- Hamid, S. B. D. -. A., Lambert, D., Derouane, E. G. Dehydroisomerisation of n-butane over (Pt, Cu)/H-TON catalysts. Catal Today. 63 (2), 237-247 (2000).
- Veldurthi, S., Shin, C. -. H., Joo, O. -. S., Jung, K. -. D. Promotional effects of Cu on Pt/Al 2 O 3 and Pd/Al 2 O 3 catalysts during n-butane dehydrogenation. Catal Today. 185 (1), 88-93 (2012).
- Han, Z., et al. Propane dehydrogenation over Pt-Cu bimetallic catalysts: the nature of coke deposition and the role of copper. Nanoscale. 6 (17), 10000-10008 (2014).
- Komatsu, T., Tamura, A. Pt 3 Co and PtCu intermetallic compounds: promising catalysts for preferential oxidation of CO in excess hydrogen. J Catal. 258 (2), 306-314 (2008).
- Gallagher, J. R., et al. In situ diffraction of highly dispersed supported platinum nanoparticles. Catal Sci Technol. 4 (9), 3053-3063 (2014).
- Ma, Z., Wu, Z., Miller, J. T. Effect of Cu content on the bimetallic Pt-Cu catalysts for propane dehydrogenation. Catal Struct React. 3 (1-2), 43-53 (2017).
- Richards, R. . Surface and nanomolecular catalysis. , (2006).
- Jiao, L., Regalbuto, J. R. The synthesis of highly dispersed noble and base metals on silica via strong electrostatic adsorption: I. Amorphous silica. J Catal. 260 (2), 329-341 (2008).
- Miller, J. T., Schreier, M., Kropf, A. J., Regalbuto, J. R. A fundamental study of platinum tetraammine impregnation of silica: 2. The effect of method of preparation, loading, and calcination temperature on (reduced) particle size. J Catal. 225 (1), 203-212 (2004).
- Wei, H., et al. Selective hydrogenation of acrolein on supported silver catalysts: A kinetics study of particle size effects. J Catal. 298, 18-26 (2013).
- Ertl, G., Knözinger, H., Schüth, F., Weitkamp, J. . Handbook of heterogeneous catalysis: 8 volumes. , (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon