Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Extraction de l’échantillon et une quantification par chromatographie en phase simultanée de doxorubicine et mitomycine C après combinaison de médicaments en nanoparticules à des souris de tumeur-roulement
Dans cet article
Résumé
Ce protocole décrit un processus analytique efficace et pratique de l’extraction de l’échantillon et le dosage simultané de plusieurs drogues, doxorubicine (DOX), la mitomycine C (MMC) et un métabolite DOX cardio toxiques, doxorubicinol (DOXol), dans le biologique échantillons d’un modèle de tumeur mammaire précliniques traitement avec des formulations de nanoparticules de combinaison synergique de médicaments.
Résumé
Chimiothérapie d’association est fréquemment utilisée en clinique pour le traitement du cancer ; Cependant, les effets indésirables associés aux tissus normaux peuvent limiter ses bienfaits thérapeutiques. Combinaison de médicaments à base de nanoparticules a été démontré pour atténuer les problèmes rencontrés par le traitement d’association de médicaments gratuits. Nos études antérieures ont montré que la combinaison de deux médicaments anticancéreux, doxorubicine (DOX) et la mitomycine C (MMC), produit un effet de synergie contre les deux murin et cancer du sein humain cellules in vitro. Les nanoparticules de hybride co-chargés polymère-lipidiques DOX et MMC (DMPLN) contourné différentes pompes de transporteur d’efflux qui confèrent une résistance multidrogue et efficacité accrue démontrée dans les modèles de tumeurs du sein. Par rapport aux formes de solution conventionnelle, telle une efficacité supérieure de DMPLN a été attribuée à la pharmacocinétique synchronisée de DOX et MMC et biodisponibilité accrue de drogues intracellulaire dans les cellules tumorales activées par le nanocarrier PLN.
Afin d’évaluer la pharmacocinétique et la bio-distribution de co-administration DOX et MMC en solution gratuite et en forme de nanoparticules, une méthode d’analyse de plusieurs médicaments simples et efficaces à haute performance phase inverse, chromatographie en phase liquide (HPLC) a été mis au point. Contrairement aux méthodes rapportés précédemment analysés individuellement les DOX ou MMC dans le plasma, cette nouvelle méthode HPLC est capable de doser simultanément DOX, MMC et un métabolite majeur de DOX cardio toxiques, doxorubicinol (DOXol), dans diverses matrices biologiques ( par exemple, sang, tumeur du sein et du coeur). Un double fluorescent et ultraviolet absorbant sonde 4-méthylumbelliférone (4-MU) a été utilisé comme étalon interne (RI) pour la détection d’une étape d’analyse des drogues multiples avec des longueurs d’onde de détection différentes. Cette méthode a été appliquée avec succès pour déterminer les concentrations de DOX et MMC livré par les approches de nanoparticules et de solution dans le sang entier et divers tissus dans un modèle murin de tumeur orthotopique du sein. La méthode analytique présentée est un outil utile pour l’analyse préclinique de livraison à base de nanoparticules de combinaisons de médicaments.
Introduction
Pourtant, il est souvent associé à des effets indésirables graves et une efficacité limitée en raison de la résistance aux médicaments et autres facteurs1,2,3, la chimiothérapie est une modalité de traitement primaire pour nombreux cancers. Pour améliorer les résultats de la chimiothérapie, régimes de combinaison de drogue ont été appliquées à la clinique fondée sur des considérations telles que les toxicités non chevauchantes, différents mécanismes d’action des médicaments et drogues non-Croix résistance4,5 , 6. dans les essais cliniques, un meilleur taux de réponse tumorale a été souvent observé en utilisant simultanément administré des combinaisons de médicaments par rapport à un régime de médicaments séquentielle livraison7,8. Cependant, à cause de moins qu’optimale bio-distribution des formes de médicaments gratuits, injection simultanée de plusieurs médicaments peut causer toxicité des tissus normaux qui l’emporte sur l’effet thérapeutique9,10,11. Livraison de médicaments nanocarrier a démontré que modifier la pharmacocinétique et la bio-distribution de médicaments encapsulés, améliorant l’accumulation ciblée tumeur12,13,14. Comme dans nos articles récents, nanoparticules chargés conjointement avec des associations médicamenteuses synergiques ont démontré la capacité d’atténuer les problèmes rencontrés par des combinaisons de médicaments gratuits, en raison de leur prestation conjointe contrôlée temporelle et spatiale de plusieurs médicaments de tissu tumoral, ce qui permet des effets synergiques de médicaments contre le cancer cellules4,15,16. Ainsi, l’efficacité thérapeutique supérieure et une faible toxicité ont été démontrés dans les deux études pré-cliniques et cliniques4,17,18.
Nos études antérieures au in vitro constaté que la combinaison de deux médicaments anticancéreux, doxorubicine (DOX) et la mitomycine C (MMC), produit un effet synergétique contre plusieurs lignées de cellules de cancer du sein et, en outre, co chargement DOX et MMC dans des nanoparticules hybrides polymère lipidique (DMPLN) a surmonté diverses résistantes à plusieurs médicaments associés efflux pompes (p. ex., P-glycoprotéine et protéine résistante du cancer du sein)19,20,21. In vivo, DMPLN permis co-exécutants spatio-temporelle de DOX et MMC aux sites tumoraux et biodisponibilité accrue de médicaments dans les cellules cancéreuses, comme indiqué par la modération de la formation du métabolite DOX doxorubicinol (DOXol)22. En conséquence, le DMPLN amélioré l’apoptose des cellules tumorales, inhibition de la croissance tumorale et la survie prolongée hôte par rapport à la pour libre combinaison DOX / MMC ou un liposomale DOX formulation22,23,24, 25.
Analysant le montant réel de médicaments fourni conjointement par nanocarrier est critique pour la conception de formulations NANOPARTICULAIRES efficace. Plusieurs méthodes ont été développées pour analyser le taux plasmatique de doses uniques de DOX ou MMC à l’aide de la chromatographie liquide haute performance (HPLC) seule ou en combinaison avec la spectrométrie de masse (MS)26,27,28 , 29 , 30 , 31 , 32 , 33 , 34. Toutefois, ces méthodes sont souvent fastidieux et peu pratique pour la thérapie de combinaison comme un grand nombre d’échantillons biologiques doivent être préparés séparément pour l’analyse de plusieurs médicaments (parfois, y compris leurs métabolites). En plus de la liaison aux protéines plasmatiques fort de MMC et DOX, les globules rouges ont également une grande capacité à se lier et se concentrent de nombreux médicaments anticancéreux35,36. Ainsi, analyse du plasma pour DOX ou MMC peut masquer des concentrations sanguines réelles de la drogue. Le présent travail (Figure 1) décrit un simple et robuste, méthode d’analyse de drogues multiples à l’aide de CLHP en phase inverse à extraire simultanément et à quantifier DOX, MMC et le doxorubicinol de métabolite DOX (DOXol) de sang et de tissus différents ( par exemple, des tumeurs). Il a été avec succès appliqué pour déterminer la pharmacocinétique et la bio-distribution de MMC et DOX, ainsi que la formation de DOXol après administration de médicaments par l’intermédiaire des solutions libres ou formes de nanoparticules (c.-à-d., DMPLN et DOX liposomale) dans un orthotopically implanté le modèle murin du sein-tumeur de la souris après par voie intraveineuse (i.v.) injection22.
Protocole
toutes les expérimentations animales ont été approuvées par Animal Care Comité du réseau universitaire de santé à l’Institut ontarien du Cancer et réalisées selon le Canadian Council on Animal Care Guidelines.
1. préparation de l’échantillon biologique
- recueillir le sang entier, les principaux organes et du sein tumeur à des moments prédéterminés après administration par voie intraveineuse (i.v.) de médicaments contenant des formulations (par exemple, DMPLN, DOX liposomale)
- injecter un i.v. de souris avec tumeur du sein avec une formulation préparée contenant un medicament.
- Anesthésier la souris aux moments désignés (par exemple, 15 min) en donnant l’isoflurane inhalables de 2 % dans une enceinte étanche.
- Posez la souris anesthésiée sur son dos et mettre son nez à travers un embout qui alimente constamment 2 % isoflurane.
Remarque : Pour garantir la souris subit une anesthésie profonde, légèrement pincer les membres avant de la souris et recherchez de n’importe quel mouvement contractions. - Nettoyer les régions de poitrine et l’abdomen à l’aide d’éthanol à 70 % et puis effectuez un terminal intérieur de ponction cardiaque sur les souris anesthésiés profondes à l’aide d’une seringue héparinée 1 mL et une aiguille de 23 G.
- Collecter le sang dans une étiquette sodium héparine pulvérisé le tube en plastique et agiter doucement le tube afin de s’assurer que le sang recueilli entre en contact avec l’héparine de revêtement de la paroi du tube. Recueillir un minimum de 50 µL de sang total. Gardez toujours les échantillons sur glace
- Tape tous les quatre membres de la souris à sécuriser et à ouvrir la cavité abdominale et la cage thoracique de la souris à l’aide d’une paire de ciseaux et pinces. Décaler les intestins vers le côté et poussez le foie vers le haut pour exposer suffisamment la veine porte. Couper la veine pour le drainage sanguin.
- Perfuse le corps de toute souris avec 50 mL de glacé salin de 0,9 % à travers le cœur à l’aide d’une seringue de 10 mL avec une aiguille 25 G.
NOTE : Plier l’aiguille à 90° pour guidant la seringue dans la veine porte.
Ordre - organes d’accise dans ce qui suit : cœur, poumons, foie, rate, les reins. Puis, séparer la tumeur du sein les tissus conjonctifs environnants à l’aide d’une paire de ciseaux de l’incision à la coussinets adipeux mammaire droite de la souris. Recueillir tous les organes individuellement dans des tubes en polypropylène de 1,5 mL et congelez-les rapidement dans l’azote liquide.
Remarque : séparer la vésicule biliaire du foie. - Conserver le sang total à 4 ° C et tissus excisés dans le congélateur à-80 ° C jusqu'à l’analyse CLHP.
- Extrait DOX, MMC et DOXol de matrices biologiques.
- Peser tous les tissus disséqués congelés rapidement et de les transférer dans un tube conique arrondie du fond de 13 mL. Pour éviter le métabolisme des médicaments possibles ou dégradation, conserver les échantillons sur Ice.
- Ajouter 1 à 5 mL de tampon de lyse cellulaire glacée dans le tube.
Remarque : Le volume de mémoire tampon à utiliser dépend de la masse de tissu selon le ratio de tissu-tampon de 1 g : 5 mL (p/v) ; pour les petits organes, comme le cœur et la rate, le ratio est de 1 g : 2 mL. - Utiliser un mouvement haut-bas coup pour homogénéiser les échantillons de tissus sur la glace à une vitesse de 18 000 tr/min en utilisant un homogénéisateur main myoélectrique.
Remarque : Homogénéisation terminée nécessite environ 3 à 5 itérations d’un processus d’homogénéisation courte de moins de 15 s, suivi par le tissu de refroidissement sur la glace entre chaque courte homogénéisation. - Laver la sonde de générateur de dent de scie de 10 mm de l’homogénéisateur avec distillée désionisée (DDI) H 2 O, éthanol à 70 %, puis DDI H 2 O entre chaque échantillon de tissu pour éviter la contamination croisée.
- Transférer 50 µL d’homogénat tissulaire ou de sang dans un tube en polypropylène de micro-centrifugeuse de 1,5 mL et spike avec 5 µL d’un intérieur standard (I.S.) 4-méthylumbelliférone (4-MU) (2000 ng/mL) dans le tube.
Remarque : la solution de 4-MU a été préparée dans le méthanol ici. - Ajouter 250 µL d’un solvant d’extraction glacée dans le tube contenant le sang entier ou homogénat tissulaire.
Remarque : Le solvant d’extraction est constitué de 60 % d’acétonitrile (ACN) et l’acétate d’ammonium 40 % (5 mM) avec pH ajusté à pH = 3,5 à l’aide d’acide formique de 0,05 %. Utiliser un échantillon de 1:5 (v/v) : solvant d’extraction ratio volume. - Vigoureusement vortex le mélange pendant 2 min, centrifuger à 3 000 x g force à 4 o C pendant 10 min et ajouter 200 µL de surnageant dans un autre tube de micro-centrifugeuse frais préalablement réfrigéré.
- S’évaporer surnageant à 60 ° C sous un lent courant d’azote gazeux avec protection contre la lumière.
- Reconstituer le résidu séché avec 100 µL de méthanol glacé, vigoureusement les Vortexer pendant 30 s et centrifuger à 3000 x g à 4 ° C pendant encore 5 min.
- Transvaser le surnageant dans un encart de flacon HPLC et placer les flacons d’échantillon dans un bac d’échantillonneur automatique pour injection.
2. Instrumentation HPLC et paramètres d’opération
- préparer HPLC phase mobile avec une reproductibilité compatible
- 500 ml de qualité HPLC H 2 O à l’aide d’une éprouvette graduée.
- 500 ml de qualité HPLC acétonitrile (ACN) à l’aide d’une éprouvette graduée distincte.
- Soigneusement ajouter 0,5 mL d’acide trifluoroacétique (TFA) (CAUTION) dans chacun des 500 mL H 2 O et ACN pour obtenir la phase mobile H 2 O et ACN contenant 0,1 % TFA, respectivement.
NOTE : TFA est corrosif et toxique et doit être manipulé sous une hotte de laboratoire. Tous les mélanges de solvants sont préparés à la température ambiante. - Phases mobiles filtre à travers un filtre à membrane en nylon avec un 0,45 µm taille de pore et le transférer dans des bouteilles de réservoir propres HPLC.
- Instrumentation montage HPLC pour la détection simultanée de 4-MU DOX, MMC et DOXol et I.S..
- Mettre en marche la pompe à gradient, dé-gasser, échantillonneur automatique, détecteur à photodiode et multi détecteur de fluorescence λ.
- D’entrée les conditions initiales de composition de la phase mobile à 16,5 % H 2 O (0,1 % TFA) et 83,5 % ACN (0,1 % TFA) (v/v).
- Régler le détecteur UV sur deux canaux, l’un à 310 nm pour 4-MU (I.S.) et l’autre à 360 nm pour MMC.
- Régler le détecteur de fluorescence sur deux canaux, l’un à λ ex / λ em = 365/445 nm pour 4-MU et l’autre à λ ex / λ em = 480 nm/560 nm pour DOX et DOXol, respectivement.
- Régler un isocratique débit de 1,0 mL/min.
- Équilibrer une colonne de 18 préinstallé phase inverse C (4,6 mm x 250 mm, 5 µm) à température ambiante pendant 10 min pour la création de la ligne de base.
- Séparer les médicaments (DOX, MMC, DOXol et 4-MU) à l’aide d’État gradient de phase mobile.
- Injecter 15 µL d’échantillons extraits et re-concentrés à l’aide de l’échantillonneur automatique.
- Changer progressivement la condition initiale de la phase mobile (reportez-vous à l’étape de protocole 2.2.2) à 100 % ACN (0,1 % TFA) pendant 18 min à l’aide de la pompe à gradient automatisée.
Remarque : Pendant le processus de séparation, quatre canaux (deux absorbants UV et deux fluorescentes) apparaître simultanément avec chaque canal affichant un médicament composé (reportez-vous à l’étape du protocole 2.2.3 et 2.2.4). - Conserver 100 % de ACN (0,1 % TFA) pendant 1 min et puis retour à la condition initiale phase mobile dans 1 min.
- Re-conditionner la colonne avec la phase mobile initiale à débit de 1,5 mL/min, 4 min pour l’injection de l’échantillon suivante.
3. Validation de l’HPLC
- élaborer des normes de travail de DOX, MMC et DOXol et 4-MU (I.S.).
- Peser séparément de 1 mg de poudre de drogue DOX et MMC (prudence) et 4-MU sur une nouvelle petite pesée papier (2 de 3 x 3 pouces).
Notez que tous les médicaments anticancéreux sont considérés comme un danger pour la santé qui peut causer mutagénicité de cellules germinales et de toxicité aiguë par inhalation ou ingestion. Ils doivent être manipulés avec soin avec des gants et des masques. - Transférer la pesée DOX, MMC et 4-MU dans un nouveau tube de la micro-centrifugeuse polypropylène individuels 1,5 mL.
- Ajouter 1 mL de methJerome et vortexer brièvement pour obtenir la concentration de 1 mg/mL de MMC et DOX.
- Ajouter 1 mL de méthanol dans un flacon contenant préalablement pesé à 1 mg de DOXol (prudence) et vortex brièvement pour obtenir la concentration de 1 mg/mL de DOXol.
Remarque : DOXol est un métabolite toxique cardio et doit être manipulé avec soin. - Pipette 20 µL des solutions mères préparées de DOX, MMC, DOXol et 4-MU dans un nouveau séparer le tube micro-centrifuge en polypropylène de 1,5 mL et ajouter 980 µL du méthanol pour obtenir une norme de travail de 20 µg/mL de chaque drogue.
- Diluer 20 µg/mL de DOX, MMC et DOXol à l’aide de méthanol pour obtenir les normes de travail de 50 ng - 20 µg/ml pour DOX, MMC et DOXol et 2000 ng/mL pour I.S. 4-MU.
- Joint le capuchon du tube de solutions de travail avec un morceau étroit de pelliculeuse de paraffine pour éviter l’évaporation du méthanol, enrouler le tube entier avec du papier aluminium pour éviter l’exposition à la lumière directe et les conserver à -20 ° C.
- Peser séparément de 1 mg de poudre de drogue DOX et MMC (prudence) et 4-MU sur une nouvelle petite pesée papier (2 de 3 x 3 pouces).
- Déterminer la linéarité, la précision et l’exactitude de DOX, MMC et DOXol dans des matrices biologiques (c.-à-d., de sang et tumeur homogénat).
- Simultanément spike 5 µL de normes de travail de DOX et DOXol (50 ng/mL - 20 µg/mL), MMC (1 000 ng/mL - 16 µg/mL) et 4-MU (2 µg/mL) dans 50 µL de sang vide ou homogénat tissulaire dans les tubes en polypropylène de micro-centrifugeuse à obtenir la courbe de concentration standard allant de 5-2000 ng/mL pour les composés médicamenteux et 200 ng/mL pour 4-MU (I.S.).
- Effectuer le test d’extraction drogue décrit dans le protocole 1.2.
- Utiliser des concentrations faibles, médianes et hautes de DOX et DOXol (50, 500 et 2 000 ng/mL) et MMC (100, 1000, 2 000 ng/mL) pour la précision intra - et inter - jour.
NOTE : Préparer des concentrations standards frais le jour de l’analyse.
- Analyse des échantillons
- injecter 15 µL de l’échantillon à l’aide de l’échantillonneur automatique.
- Changer progressivement de la phase mobile plus de 0 à 18 min, augmentant la composition d’ACN au cours de l’intervalle.
- Après 18 min, maintenir l’état de phase mobile pendant 1 min.
- Reviennent à l’état initial au cours de la prochaine 2 min, puis ré-équilibrer pendant 4 min avant l’injection suivante.
- Après chaque échantillon exécuter, on remarquera que les pics de composés médicamenteux avec leurs temps de rétention sont indiqués comme suit : MMC, DOXol, 4-MU (I.S.) et DOX.
- Intégrer la surface sous la courbe (AUC) de composés médicamenteux à l’aide de logiciels HPLC du pic.
- Calculer le rapport AUC entre chaque médicament composé et I.S. (équation 1) et les courbes standards établis selon les mêmes procédures d’extraction permet de déterminer les concentrations de médicament de DOX, MMC et DOXol dans la formulation de DMPLN.
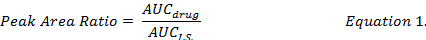
- calculer le pourcentage de récupération de médicaments (équation 2) en comparant les concentrations de médicament reconstituées à l’aide de méthanol des extraits d’échantillons biologiques enrichis à celle de la norme (" pur ") solution dans le méthanol des drogues.
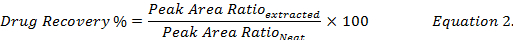
Résultats
Deux médicaments anticancéreux, DOX et MMC, ainsi que le métabolite DOX, DOXol, ont été détecté en même temps sans aucune interférence biologique sous la condition d’HPLC dégradée appliquée même en utilisant 4-MU comme l’I.S. pour la fluorescence et détecteurs UV. DOX, MMC, DOXol et 4-MU étaient bien séparés les uns des autres avec des temps de rétention de 5,7 min pour MMC, 10,4 min pour DOXol, 10,9 min pour 4-MU et 11,1 min pour DOX (Figure 2
Discussion
Par rapport aux autres méthodes chromatographiques qui permettent la détection d’une espèce seul médicament à la fois, le présent protocole HPLC est capable de doser simultanément trois composés médicamenteux (DOX, MMC et DOXol) dans la même matrice biologique sans avoir à changer la phase mobile. Cette méthode de préparation et d’analyse a été appliquée avec succès pour déterminer la pharmacocinétique et la bio-distribution de deux systèmes de délivrance de médicaments à base de nanoparticules...
Déclarations de divulgation
Les auteurs n’ont pas des intérêts financiers divergents et les conflits d’intérêts.
Remerciements
Les auteurs remercient la subvention d’équipement de sciences naturelles et du Conseil de recherche en génie (CRSNG) du Canada pour HPLC, la subvention de fonctionnement de l’Institut canadien de recherche en santé (IRSC) et le Canadian Breast Cancer Research (RSARF) Alliance à X.Y. Wu et la bourse de l’Université de Toronto à R.X. Zhang et T. Zhang.
matériels
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
Références
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon