Method Article
Un In Vivo Duo-color méthode d’imagerie vasculaire dynamique après contusion médullaire
Dans cet article
Résumé
Nous introduisons une in vivo utilisant deux fluorochromes différents pour suivre la dynamiques changements vasculaires de la colonne vertébrale suite à une contusion médullaire chez les rats Sprague-Dawley adultes de méthode d’imagerie.
Résumé
De la moelle épinière (SCI) provoque une perturbation vasculaire importante sur le site de lésion. Pathologie vasculaire se produit immédiatement après la SCI et se poursuit tout au long de la phase de lésions aiguës. En effet, les cellules endothéliales semblent être le premier à mourir après une SCI contondants. Les événements vasculaires précoces, notamment l’augmentation de la perméabilité de la barrière de sang-la moelle épinière (BSCB), induisent un oedème vasogénique et contribuent aux manifestations néfastes lésion secondaire causées par des mécanismes complexes de blessures. Ciblant les perturbations vasculaires, par conséquent, pourrait être une stratégie clé pour réduire les cascades de lésion secondaire qui contribuent à des déficiences histologiques et fonctionnelles après LMÉ. Des études antérieures ont été principalement effectuées sur des échantillons post mortem et étaient incapables de capturer les changements dynamiques du réseau vasculaire. Dans cette étude, nous avons développé une en vivo duo-color biphotonique méthode d’imagerie pour surveiller des changements dynamiques vasculaires aiguës après contusion Sci. Cette approche permet de détecter la circulation sanguine, le diamètre du vaisseau et autres pathologies vasculaires à divers endroits du rat même avant et après l’accident. Dans l’ensemble, cette méthode fournit une excellente occasion pour étudier la dynamique vasculaire.
Introduction
Traumatismes de la moelle épinière (SCI) est une blessure courante menant à l’affaiblissement de la fonction de moteur, sensorielle et autonome. Selon le National moelle épinière lésions statistique Center (NSCISC) en 2016, environ 282 000 personnes ont été touchées alors que 69 % d'entre eux étaient principalement dus à des accidents de la circulation ou tombe1. Ces patients nécessitent souvent des soins intensifs ; Cependant, aucun traitement efficace n’est actuellement disponible. Par conséquent, les nouvelles stratégies efficaces vers SCI sont urgent.
SCI est principalement divisé en deux phases : lésions primaires et lésion secondaire. La lésion primaire comprend l’insulte physique provoquant une nécrose hémorragique au point d’impact2, suivie d’une série d’événements de lésion secondaire, telles que l’inflammation et l’apoptose des cellules démyélinisation des axones restants, qui conduisent progressivement l’expansion des déficits fonctionnels et morphologiques3,4,5,6. L’hémorragie est le premier signe visible de blessure, ce qui indique un perturbation vasculaire immédiat dans la phase aiguë de la SCI7,8. Une stratégie de neuroprotecteur vise à réduire les blessures vasculaires précoces pourrait améliorer la récupération des patients, mais cela requiert une meilleure compréhension du mécanisme physiopathologique des événements vasculaires précoces après l’accident.
Malgré des études antérieures à l’aide de diverses méthodes pour étudier la vascularisation de la moelle épinière, des limitations importantes demeurent. L’inconvénient plus partagé étudie que des échantillons post mortem, par exemple, de dégagement d’hydrogène9, autoradiographie,10, microangiogram8, corrosion vasculaire moulages11et immunohistochimie12 ,,13. Bien que la débitmétrie Doppler Laser assure un suivi en temps réel non invasive de la moelle épinière sang écoulement14, il est impossible de différencier les systèmes vasculaires et de détecter des changements morphologiques vasculaires. Dynamique contraste accentué IRM (IRM-DCE) est également non invasive, mais elle génère des images basse résolution et nécessite une infrastructure coûteuse15.
Bien qu' in vivo d’imagerie utilisant 2 photons laser microscopie (2p-LSM) a été développé pour l’étude de vasodynamics dans le cortex16,17,18, un nombre limité d’études ont démontré des changements vasculaires suite à une SCI. Tang et al. ont montré des changements dans la circulation sanguine au bord de l’emplacement de la lésion dans une hémisection modèle19, mais l’imagerie après qu’une blessure à la contusion est plus difficile pour deux raisons. Tout d’abord, une fenêtre optique en verre traditionnel sur le site de la lésion ne serait pas soutenir l’impact mécanique et restent fonctionnelle pour l’imagerie. Deuxièmement, les fuites de traceur dans le parenchyme dû à hémorragie crée des difficultés avec l’imagerie après l’accident.
Nous présentons ici une méthode d’imagerie roman duo-color, qui permet l’imagerie les navires individuels mêmes aux périodes avant et après l’accident. En outre, il fournit un profil temporelles et spatiales des changements dynamiques vasculaires, suite à une contusion Technol Il a également le potentiel pour l’imagerie à plusieurs moments après l’accident. Ce protocole peut être directement appliqué aux animaux transgéniques pour étudier les interactions neurovasculaires.
Protocole
Toutes les procédures de traitement chirurgical et animaux ont été effectuées tel qu’approuvé en vertu du Guide pour les soins et Use of Laboratory Animals (National Research Council) et les lignes directrices de l’Indiana University School of Medicine institutionnels Animal Care et l’utilisation Comité.
1. préparation chirurgicale
- Stériliser tous les instruments chirurgicaux, y compris le stabilisateur de la colonne vertébrale. Nettoyez la table d’opération chirurgicale et tous les alentours d’éthanol à 70 %. Pour la préparation de cette intervention chirurgicale sans survie, placez un coussin propre chirurgical sur le dessus un 37 ° C coussin chauffant.
- Utilisez six semaine vieux rat Sprague Dawley (SD) pour cette étude. Peser et anesthésier le rat avec une injection intrapéritonéale de kétamine (87,7 mg/kg) et mélange de xylazine (12,3 mg/kg). Confirmer la bonne étape de l’anesthésie lorsque l’animal cesse de répondre à un stimulus de pincée d’orteil. Injecter par voie sous-cutanée de 0,01 à 0,05 mg/kg de buprénorphine et de 5mg/kg carprofène avant la chirurgie.
- Raser le rat dans 2 régions : la région de la colonne cervicale sur le dos et la région du cou du côté maternel. Tamponner les zones de peau avec betadine scrub chirurgicale et lingettes d’alcool 70 %. Pommade oculaire pour prévenir la sécheresse oculaire pendant la chirurgie. Placer l’animal dans une position couchée sur le tampon propre chirurgical.
2. cathétérisme de la veine jugulaire externe
- Repérer la veine jugulaire externe en trouvant le point d’impulsion près de la clavicule et couper avec une paire de ciseaux de petit ressort à pratiquer une incision verticale sur le spot, qui est le point de croix de 3 points anatomiques : rame caudale de la mandibule droite, grand tubercule de l’humérus et le manubrium (Figure 1 a). Isoler le navire à l’aide de ciseaux de printemps et des pinces fines. Nouer l’extrémité distale avec 1 stériles pour sutures chirurgicales ligne (Figure 1)20.
- Préparez une seringue de 1 mL remplie de solution saline et relié à un cathéter spécialisé issu d’une aiguille de calibre 21 (Figure 1 b). Faire une petite incision à l’aide d’une paire de ciseaux micro sur le navire et faire glisser le cathéter dans le vaisseau.
- Fixer l’aiguille en nouant les deux extrémités proximales et distales (Figure 1). Le cathéter spécialisé est issu d’une aiguille de calibre 21. Broyer la pointe plate et souder avec un morceau de 2 mm de la pointe coupée d’une autre aiguille de calibre 21. Cela peut empêcher le cathéter ne glisse à l’extérieur.
Remarque : Une petite quantité de sang qui coule dans l’aiguille indique que l’aiguille est entré avec succès dans un vaisseau sanguin.
- Fixer l’aiguille en nouant les deux extrémités proximales et distales (Figure 1). Le cathéter spécialisé est issu d’une aiguille de calibre 21. Broyer la pointe plate et souder avec un morceau de 2 mm de la pointe coupée d’une autre aiguille de calibre 21. Cela peut empêcher le cathéter ne glisse à l’extérieur.
3. colonne vertébrale stabilisation et laminectomie C5-C7
- Placer l’animal dans une position couchée. Couper la peau le long de la ligne médiane avec une lame de bistouri n ° 15 au niveau de la colonne vertébrale désiré. Disséquer les couches musculaires de la 5ème au 7ème vertèbre cervicale (C5-C7) sur le plan bilatéral pour exposer les faces latérales (Figure 2 a)21.
Remarque : Localiser la deuxième vertèbre thoracique (T2) en trouvant la pointe entre les omoplates. Compter vers le haut de la vertèbre T2 pour trouver le C7 vertèbre21,22,23,24. - Stabiliser la colonne vertébrale du rat en utilisant un appareil stabilisateur modifié. Faire une fente sur les deux côtés de l’OS vertébral latéral. Faites glisser les bras en acier inoxydable sous les facettes exposés apophyse transverse et serrer les vis pour fixer la stabilité (Figure 2 b).
- Retirer délicatement les lamelles de C5-C7 (laminectomie, Figure 2).
- Placer un petit morceau de gélatine imbibé d’une solution saline sur le dessus de la dure-mère exposée pour le garder bien hydratée (Figure 2D).
4. installation de fenêtre d’imagerie biphotonique (2p)
- Trucs petits morceaux de gélatine dans l’écart entre les muscles et les os vertébrales, également farcir une fine ligne de gelfoam entre la moelle épinière et les os vertébrales, puis d’utiliser la colle tissu pour sceller les environs de muscle d’os. Attendre 5 min pour la dessiccation complète (Figure 2E).
Remarque : Cette étape empêche les saignements futurs dans la fenêtre et la perméabilité des solutions d’immersion. - Préparer 4 % d’agar avec FD2O dans un four à micro-ondes. Une fois l’agar est complètement dissoute, attendez jusqu'à ce qu’elle renvoie à une température palpable. Remplir une seringue stérile 1 mL de solution d’agar et redirigez-le sur le bord de la fenêtre pour construire un mur (Figure 2E). La solution se solidifie rapidement et reste souple pour permettre l’objectif ou l’objectif de se déplacer librement.
- Lorsque vous êtes prêt pour l’imagerie, supprimer la gélatine et lieu du liquide d’immersion à l’intérieur de la fenêtre pour 2p imaging (Figure 2F). Transférer l’animal stabilisé à l’intérieur de la chambre noire de 2 photons microscope et placer la fenêtre d’imagerie 2p directement sous l’objectif. Abaisser délicatement la lentille dans la fenêtre d’imagerie.
5. injection de colorant Fluorescent première et imagerie de base
- Préparation de 0,5 mL de Rhodamine B isothiocyanate-Dextran (poids moléculaire moyen de 4 mg/mL ~ 70kDa) dans une solution saline. Remplir une seringue stérile 1 mL de la solution et raccorder la seringue sur le cathéter installé précédemment.
Remarque : Préparation de la solution de colorant fluorescent avant utilisation est recommandée. - Injecter le premier pigment en appuyant sur la seringue très lentement (Figure 3 b). Commencez par utiliser l’oculaire pour repérer la zone d’intérêt. Utiliser une caméra de dispositif couplé (DAC) de frais d’acquérir une image de lumineux-zone des modèles de surface des vaisseaux sanguins à plus faible grossissement comme une image de point de repère. Passer en mode numérisation laser puis ouvrez le 2p, logiciel pour la collecte de ces deux images d’imagerie et données de balayage de ligne.
- Choisir la bonne longueur d’onde de 2P laser excitation, la puissance et fluorescent canal (canal rouge pour le premier pigment) pour correspondre avec les fluorophores utilisés dans le tissu imagé et puis effectuer l’imagerie in vivo (Figure 3E). Garder l’animal sur un coussin chauffant pendant tout le processus.
6. C7 blessure contusion à l’aide du dispositif de LISA
- Effectuer une blessure de contusion de la ligne médiane C7 en utilisant un dispositif de Louisville blessure système appareil (LISA) selon un protocole établi précédemment25,26.
- En bref, placez l’animal sur la scène de LISA après étalonnage.
7. injection de colorant Fluorescent deuxième et l’imagerie après l’accident
- Préparation de 0,5 mL de fluorescéine isothiocyanate-dextran (4 mg/mL, masse moléculaire moyenne ~ 70 kDa) dans une solution saline même comme en 5.1. Remplissez la solution dans une seringue stérile 1 mL et se connecter avec le cathéter installé précédemment.
- Transférer l’arrière animal stabilisé à l’intérieur de la chambre noire de microscope 2P et recréer l’image sur la même zone avec la couche rouge pour le premier pigment et la couche verte pour le deuxième colorant (Figures 3D & G).
- À la fin de l’imagerie, libérer le rat de l’appareil de stabilisation rachidienne et nettoyer le mur de la gélose.
8. animal Sacrifice
- Après l’imagerie, sacrifier le rat suit le transcardial perfusion protocole27. Recueillir des échantillons de la moelle épinière et fixez-les dans 4 % PFA.
9. hors connexion Data Analysis : Quantification des diamètres de navire
- Transférer les fichiers d’image sur un poste de travail pour l’analyse hors ligne.
- Ouvrez ImageJ et sélectionnez « fichier » et ensuite choisir préalablement enregistré les données brutes et ouvrez le fichier image unique associée (Figure 4 b).
- Calibrer l’image en sélectionnant « Analyze » suivie de « Définir Scale » (Figure 4). La valeur placée dans « La Distance en pixels » est calculée à l’aide de l’équation affichée dans la Figure 4 a. L’étalonnage de 2 photons optique détermine la valeur par défaut dans l’équation. La valeur de « opticalZoom » se trouve dans Excel Extensible Markup Languagefile (fichier XML) associé au fichier image unique (Figure 4 b).
- Tracer une ligne perpendiculaire à l’axe longitudinal du bateau (Figure 41 & E1) et sélectionnez « Analyser » suivie de « Mesure ». La mesure du diamètre des vaisseaux est affichée dans la fenêtre de résultats (Figure 42 & E2). Répéter 3 fois sur le navire en vue d’acquérir de la valeur moyenne.
10. hors connexion Data Analysis : Quantification des globules rouges (RBC) Vitesse de cellules
- Transférer les fichiers de balayage linéaire à la station de travail pour l’analyse.
- Démarrez le logiciel ImageJ et sélectionnez « fichier » et ensuite choisir préalablement enregistré les données brutes et ouvrir tous les fichiers de balayage linéaire associé avec le nom de l’extension « .ome ».
- Ouvrez « Image » et sélectionnez « Piles » suivis par « images à empiler ». Convertir tous les fichiers de l’OME en fichier TIFF image unique pile.
- Démarrez le logiciel Matlab et cliquez sur « Ouvrir », sélectionnez le fichier de code « LSPIV_parallel.m ». Remarque : Le code Matlab pour LS-PIV peut être téléchargé à https://sourceforge.net/projects/lspivsupplement/files/18
- Sélectionnez les ordres suivants : « Exécuter » > « Modifier le dossier » > « artère ». Choisissez le fichier TIFF de pile image généré en 10.3.
- Tapez « Y » et appuyez sur entrée.
- Placer un curseur à gauche et à droite de l’image, respectivement, et le programme commence à traiter les données.
- À la fin du programme, entrez 2 valeurs pour calculer la lecture finale : « valeur de conversion de pixel_meter » et « valeur de conversion de balayage-temps ». Les deux se trouvent dans le fichier XML associé aux données de balayage linéaire. La valeur finale est exprimée comme la moyenne et l’écart de vitesse dans les unités du millimètre par seconde (mm/s).
Résultats
La méthode est capable de surveiller en vivo spinal vasculaire changements dynamiques dans des récipients individuels SCI pré et post traumatique. Tout d’abord, un cathéter est installé via la veine jugulaire externe pour fournir l’accès pour les injections ultérieures de colorant fluorescent (Figure 1 a-C, Figure 3). Dans la deuxième étape, un appareil spécialisé est utilisé pour stabiliser les exposés C5-C7 (Figure 1-F, Figure 2 a-B). Cette étape de stabilisation peut éliminer les artefacts respiratoires et fournir régulière d’imagerie. Après laminectomie (Figure 2), la prochaine étape est l’installation de 2p imagerie fenêtre sur C5-C7 (Figure 2D-F). Minimisant les tissus périphériques autour de la fenêtre d’imagerie de la colonne vertébrale est critique pour l’imagerie vasculaire réussie. L’étape suivante est d’injecter le colorant fluorescent rhodamine-dextran (rouge) via le cathéter susmentionné au point de repère et de la carte du réseau vasculaire sous la ligne de base (Figure 3 a-B, E). Après C7 midline contusion blessure avec sévérité modérée, FITC-dextran (vert) est ajoutée aux points de l’heure après l’accident (Figure 3 a & D). La beauté de la méthode de duo-color, c’est que l'on peut encore détecter la structure vasculaire en utilisant le deuxième colorant lorsque le premier pigment a déjà coulé dans le parenchyme en raison de la blessure (Figure 3).
Au cours de la séance d’imagerie, il est conseillé de garder l’animal sur un coussin chauffant pour maintenir la température corporelle après l’induction de l’anesthésie.
En utilisant notre méthode de duo-color, la vitesse de diamètre et de globules rouges (RBC vitesse) des navires individuels peut être mesurée et calculée. Pour le diamètre, on peut utiliser ImageJ pour mesurer le navire à son plus grand diamètre pour 3 répétitions après calibration (Figure 4). Pour la vitesse, images de balayage linéaire sont évalués en utilisant Matlab programme (MATLAB R2013a) pour calculer la RBC vitesse (Figure 5)18. Basé sur la morphologie, la vitesse d’écoulement de sang et le diamètre des vaisseaux, les navires peuvent être classés en 2 catégories : artère et la veine (voir tableau 1).
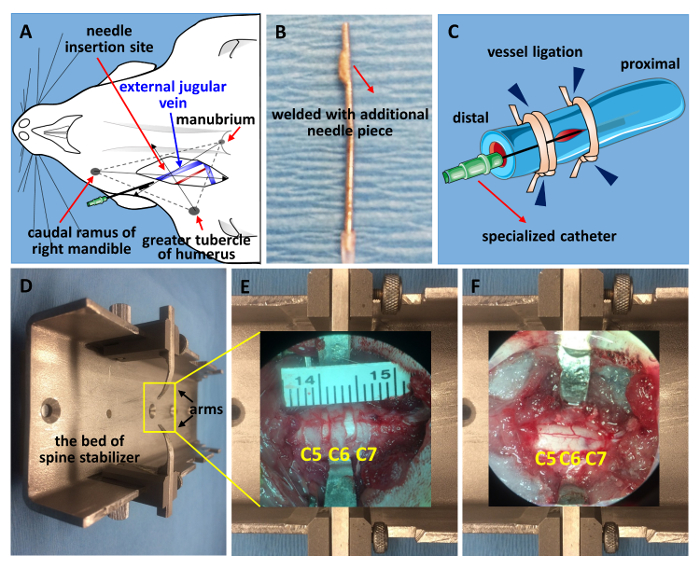
Figure 1 . Veine jugulaire stabilisation de cathétérisme et la colonne vertébrale.
(A) un schéma pour localiser la veine jugulaire externe. (B) le cathéter spécialisé issu d’une aiguille de calibre 21. La pointe était sol plat et soudé avec un morceau de 2 millimètre pointe coupée d’une autre aiguille de calibre 21. (C) un diagramme schématique du cathétérisme. L’extrémité distale est ligaturée tout d’abord, suivie de stabilisation cathéter proximal, qui se termine par la fixation de l’aiguille ainsi que le navire (ligature de navire, pointes de flèches bleues). (D) une image du stabilisateur mis à jour le rachis. Une fenêtre de C5-C7 avant une laminectomie (E) et après laminectomie et contusion SCI (F) s’affiche. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
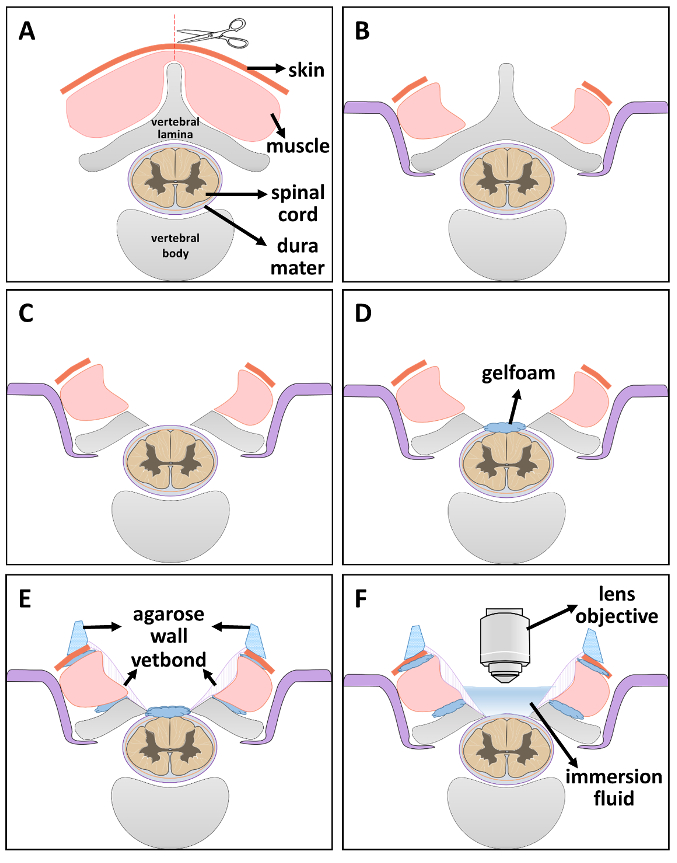
Figure 2 . Diagramme schématique d’installation fenêtre optique étape par étape.
(A) étape 1 : exposer la vertèbre par coupe peau et des muscles le long de la ligne médiane. (B) étape 2 : stabilisation de la colonne vertébrale. (C) étape 3 : laminectomie. (D) étape 4 : maintenir l’humidité de la moelle épinière en plaçant un morceau de gelfoam imbibé d’une solution saline. (E) étape 5 : sceller les lacunes avec gélatine stérile et vetbond. Après séchage, une couche de gélose paroi repose sur le bord de la fenêtre. (F) étape 6 : lorsque vous êtes prêt pour l’imagerie, retirer le liquide d’immersion gelfoam et place à l’intérieur de 2p fenêtre d’imagerie. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
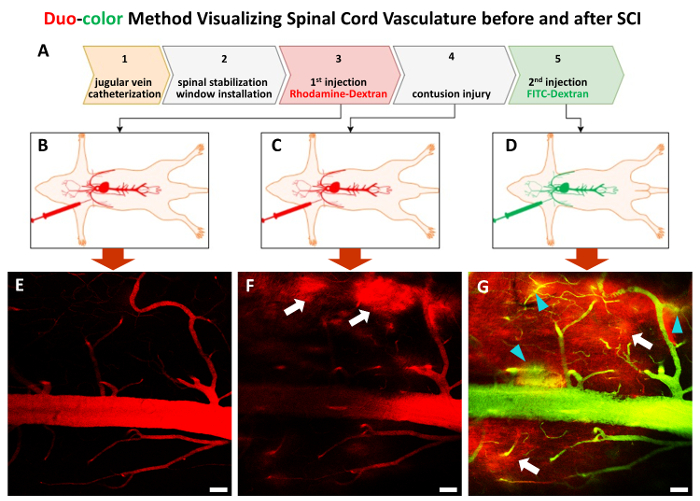
Figure 3 . Le en vivo duo-color méthode procédure étape par étape.
L’ensemble de la procédure se compose de 5 étapes (A). Après l’étape 1 et étape 2, une paire de traceurs dextran avec une taille d’environ 70 KDa sont injecté dans la séquence d’étiqueter la vascularisation de la moelle épinière avant (),B et C) et après contusion SCI (D). (E)-(G) images représentatives de 2p afficheront la vascularisation de la moelle épinière à l’étape 3 à l’étape 5. Flèches blanches pointent vers la première vague teinture rouge qui fuient les zones (F et G), des pointes de flèche turquoises affichent fuite deuxième vague colorant vert (G). Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
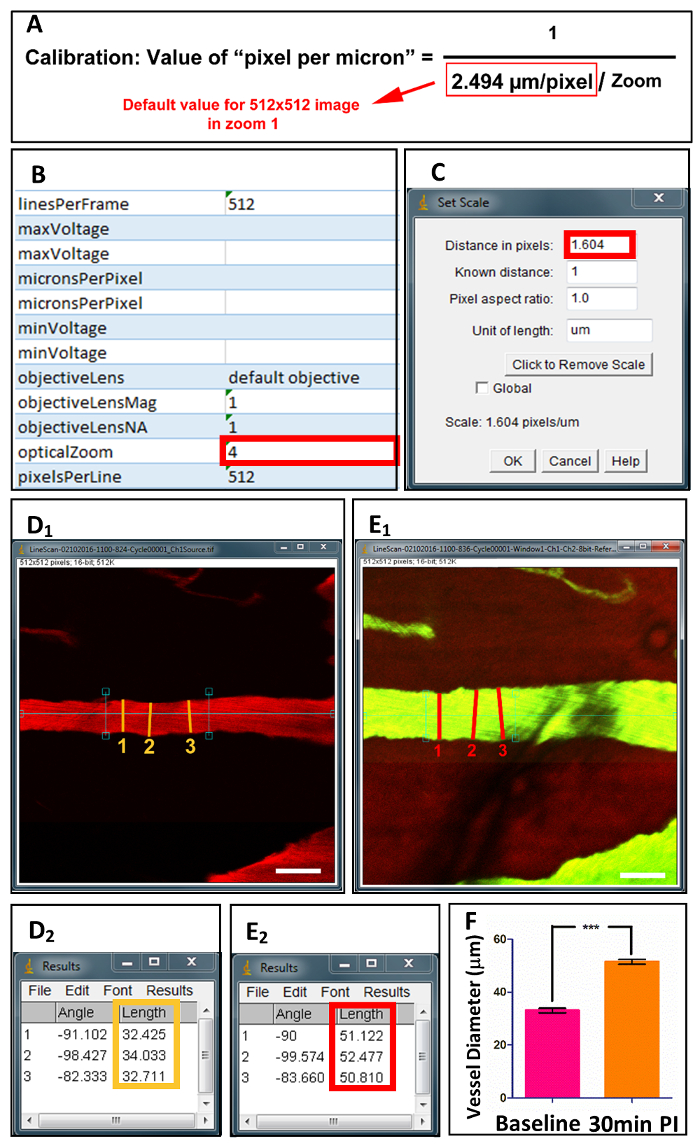
Figure 4 . Acquisition et quantification des diamètres de navire de la colonne vertébrale.
Après préparation, fichiers image unique sont acquis en microscopie de P 2, ainsi que les fichiers XML des valeurs calibrés (B). (A) l’équation affiche le calcul de « pixel par micron », basé sur les valeurs de zoom optique. Après calibration dans ImageJ (C), diamètres de navire sont mesurées en 3 points dans l’ensemble de l’axe longitudinal avant (D1) et après (E1) des blessures. (D2) et (E2) afficher les valeurs mesurées. (F) Quantification des diamètres de navire au départ et 30 min après l’accident. Barre d’échelle = 50 µm. les données sont présentées comme moyenne ± écart-type, *** p < 0,0001, test t apparié à deux queues.S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
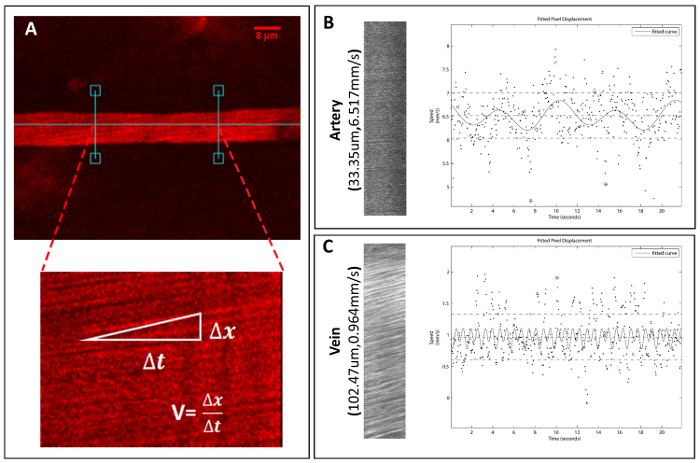
Figure 5 . Acquisition et quantification de la vitesse du navire la colonne vertébrale.
Ligne-analyser les fichiers image sont acquis en vertu de la microscopie P 2 pour calculer les vitesses de bateau isolé. (A) un exemple d’un vaisseau sélectionné et la méthode pour évaluer la vitesse des vaisseaux sanguins RBC. (B) un exemple artériel d’image de balayage linéaire et fichier de tracé correspondante pour le calcul de la vitesse, ainsi un exemple d’une veine (C). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Artère | Veine | |
| Morphologie | Paroi droite, lisse, épaisse | Branches, bords rugueux |
| Vitesse d’écoulement de sang | Rapide | Lent mais varie |
| Diamètre | 30-80 µm | 100-250 µm |
Tableau 1 : Critères d’identification des Types de bateaux
Discussion
Un défi pour les études vasculaires à la suite de SCI est la limitation technique parce que les techniques traditionnelles sont en grande partie limités aux modifications de la structure vasculaire dans des échantillons post mortem. Ce roman en vivo imagerie méthode décrite ci-dessus permet de mesure dynamique de la circulation sanguine et de paramètres (diamètre vitesse et bateau) chez des rats vivants à l’aide de 2p-LSM. Il permet également l’examen répétée dans les mêmes jeux de navires à des moments différents après contusion Sci. Les techniques d’imagerie microscopie 2 photons précédentes ont été incapables de capturer les structures vasculaires post-traumatiques en raison de la fuite d’un traceur unique. Notre duo-couleur design permet une imagerie vasculaire dynamique pour les modèles traumatiques. En outre, la flexibilité de cette méthode permet de générer un profil temporelles et spatiales des changements vasculaires aigus suite Sci.
Il y a plusieurs étapes cruciales dans notre in vivo duo-color méthode d’imagerie. Tout d’abord, il est fondamental de s’assurer de la stabilité physique de la moelle épinière avant l’imagerie Time-lapse, particulièrement réduire les artefacts de mouvement respiratoire. Nous avons conçu la forme de la colonne vertébrale serre-joints pour augmenter la hauteur de la colonne vertébrale vertèbre légèrement au cours de la stabilisation. Ainsi le mouvement de la moelle épinière corréler à l’animal de respirer peut être considérablement réduite (Figure 1-F, 2 b). Il est recommandé de vérifier la stabilité de la moelle épinière avant le début de chaque séance d’imagerie. Si la moelle épinière ne parvient pas à atteindre la stabilité, l’ajustement devrait faire l’alignement et le serrage des colliers de serrage de la moelle épinière. Deuxièmement, périphérique tissus (OS, couche de muscle et la peau) saignements dans la fenêtre d’imagerie risque de contamination de la vue. Pour une session de formation image lisse, gelfoam et tissu colle doit être appliquée pour les tissus environnants pour une prévention efficace. Troisièmement, les colorants fluorescents que nous choisissons ont une taille similaire comme l’albumine (66 kDa), qui est la protéine du plasma sanguin principal haut poids moléculaire. Dans des conditions homéostatiques, les colorants ont été largement conservés à l’intérieur du navire similaire comme l’albumine,28. Après la blessure, les colorants traversaient la structure endothéliale perturbée et se sont échappés dans le parenchyme, causant une intensité de fluorescence une augmentation significative dans la zone périphérique du système vasculaire (Figure 3F-G). En outre, il y a deux raisons pour lesquelles nous choisir cathétérisme de la veine jugulaire externe. Tout d’abord, il peut fournir une route constamment accessible de livraison à tout moment de l’expérience. En second lieu, il peut être utilisé comme une voie pour l’injection de traitement futur.
Bien que notre méthode de duo-color in vivo est en mesure de fournir un nouveau lieu de rendez-vous pour les études d’imagerie vasculaires traumatiques, certaines réserves au sujet de cette technique doivent être abordées. Actuellement, cette technique vise à évaluer les changements vasculaires à 2 points dans le temps (base et 1 point de temps après l’accident), mais il est possible de passer à plusieurs points dans le temps, si les canaux et autres colorants fluorescents est disponibles. Il existe plusieurs études utilisant Vitre implanté pour l’imagerie intravitale chronique, aucun d’eux ne peut fournir de l’information de base sur le même navire après traumatisme19,29,30, 31,32. Contrairement à ces études, notre fenêtre est une fenêtre non-verre. C’est commode pour l’imagerie avant et après l’accident, mais il peut être difficile pour rétablir la fenêtre d’observation à long terme. Nos recherches futures travaille à l’amélioration technique d’imagerie chronique. Le système vasculaire est composé de plusieurs types de vaisseau (artère, veines et capillaires) et chacun est différent dans les aspects de la morphologie et la fonction. Différenciation entre les types de bateaux en imagerie pourrait aider à cerner une tendance claire des changements vasculaires. Le protocole ci-dessus dépend de l’observateur, indication des navires basés sur la morphologie et de la vitesse ; Toutefois, un colorant artère spécifiques peut être facilement ajouté pour donner une classification plus définitive entre types de navire33.
Cette technique est non seulement limitée aux évaluations sur contusion et autres modèles traumatiques, comme blessure par écrasement et rayonnements des blessures, mais également sur des études qui portent sur la perturbation des BSCB, perméabilité ainsi que vasculaire change. En plus de la SCI, il pourrait être utilisé pour étudier les changements vasculaires à la suite d’autres maladies neurodégénératives telles que la sclérose latérale amyotrophique (SLA) et de la sclérose en plaques (MS). En outre, il pourrait être transférable à un modèle animal transgénique pour étudier l’interaction dynamique neurovasculaire. Comme outil de dépistage puissant, les études futures pouvaient utiliser la technique d’imagerie décrite ici pour évaluer l’efficacité du traitement de la moelle épinière.
En conclusion, méthode de duo-color in vivo est un outil fiable et en temps réel, le in vivo approche pour évaluer les changements vasculaires dynamiques, ce qui est idéal pour la caractérisation du profil vasculaire temporelles et spatiales et de dépistage pour les traitements à réduire les dommages secondaires suite Sci.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu en partie par NIH NS059622, NS073636, DOD CDMRP W81XWH-12-1-0562 mérite examen prix I01 BX002356 du US Department of Veterans Affairs, Craig H Neilsen Foundation 296749, Indiana, la moelle épinière et Brain Injury Research Foundation ( ISCBIRF) Indiana State Department of Health (019919), des fonds de dotation Mari Hulman George.
matériels
| Name | Company | Catalog Number | Comments |
| Purdue Products Betadine Surgical Scrub | Fisher Scientific | 19-027132 | Skin sterilization |
| Ketamine (87.7 mg/kg)/Xylazine (12.3 mg/kg) | Patterson Veterinary | 07-881-9413, 07-890-5745 | Anesthetic agent |
| Buprenorphine(0.03 mg/mL) | Patterson Veterinary | 07-891-9756 | Pain relief agent |
| Carprofen | Patterson Veterinary | 07-844-7425 | Non-steroidal anti-inflammatory drug |
| Dukal Gauze Sponges | Fisher Scientific | 22-415-490 | Skin sterilization |
| Decon Ethanol 200 Proof | Fisher Scientific | 04-355-450 | Skin sterilization |
| Artificial Tears Eye Ointment | Webster Veterinary | 07-870-5261 | Prevent drying eyes |
| Cotton Tipped Applicators | Fisher Scientific | 1006015 | |
| Rhodamine B isothiocyanate–Dextran | Sigma-Aldrich | R9379 | Average mol wt 70kDa |
| Fluorescein isothiocyanate–dextran | Sigma-Aldrich | 46945 | Average mol wt 70kDa |
| Instrument Sterilizer | Fine Science Tools | 18000-50 | for sterilizing surgery tool |
| Spine stabilizer set | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Vetbond | 3M Animal Care Products | 1469SB | Tissue adhesive Glue |
| Gelfoam | Henry Schein | 9083300 | Stop bleeding |
| Noyes Spring Scissors | F.S.T | 15013-12 | |
| Fine Forceps- Dumont #5 | F.S.T | 11254-20 | |
| Rongeur | Fine Science Tools | 16021-14 | laminectomy |
| Surgical Retractor | Fine Science Tools | 17005-04 | |
| Scalpel | Fine Science Tools | 10003-12 | skin cut |
| Scalpel Blade #15 | Royal-Tek | BS2982 | skin cut |
| micro angled scissors | World Precision Instruments | 500260 | Can be from any vendor |
| 3-0 vicryl sutures | Ethicon | J393H | Can be from any vendor |
| Silk Black Braided Non-Absorbable Suture, 3-0, C-7, Reverse Cutting, 18" | LOOK | 786 | Can be from any vendor |
| 1 ml syringe | Henke Sass Wolf | 4010.200.V0 | Can be from any vendor |
| 21 gauge needle | BD | 305165 | Can be from any vendor |
| Agar | Sigma-Aldrich | A1296 | Can be from any vendor |
| Two-photon Laser Scanning Microscope | Bruker Fluorescence Microscopy | ||
| LISA device | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| HCImage Live | Hamamatsu Corporation | Imaging software | |
| PrairieView | Prairie Technologies/Bruker | Two-photon imaging software | |
| ImageJ | Image analysis software | ||
| Matlab statistics toolbox | The MathWorks, Inc. | https://www.mathworks.com/products/statistics.html?s_tid=srchtitle | Image analysis software |
Références
- National Spinal Cord Injury Statistical Center. Spinal Cord Injury Facts and Figures at a Glance. SCI Data Sheet 2016. , (2016).
- Dumont, R. J., et al. Acute spinal cord injury, part I: pathophysiologic mechanisms. Clin Neuropharmacol. 24 (5), 254-264 (2001).
- Beattie, M. S., Farooqui, A. A., Bresnahan, J. C. Review of current evidence for apoptosis after spinal cord injury. J Neurotrauma. 17 (10), 915-925 (2000).
- Liu, N. K., et al. A novel role of phospholipase A2 in mediating spinal cord secondary injury. Ann Neurol. 59 (4), 606-619 (2006).
- Wu, X., Xu, X. M. RhoA/Rho kinase in spinal cord injury. Neural Regen Res. 11 (1), 23-27 (2016).
- Li, X. G., et al. Combination of methylprednisolone and rosiglitazone promotes recovery of neurological function after spinal cord injury. Neural Regen Res. 11 (10), 1678-1684 (2016).
- Kulkarni, M. V., et al. Acute spinal cord injury: MR imaging at 1.5. T. Radiology. 164 (3), 837-843 (1987).
- Tator, C. H., Koyanagi, I. Vascular mechanisms in the pathophysiology of human spinal cord injury. J Neurosurg. 86 (3), 483-492 (1997).
- Kobrine, A. I., Doyle, T. F., Martins, A. N. Spinal cord blood flow in the rhesus monkey by the hydrogen clearance method. Surg Neurol. 2 (3), 197-200 (1974).
- Rivlin, A. S., Tator, C. H. Regional spinal cord blood flow in rats after severe cord trauma. J Neurosurg. 49 (6), 844-853 (1978).
- Koyanagi, I., Tator, C. H., Theriault, E. Silicone rubber microangiography of acute spinal cord injury in the rat. Neurosurgery. 32 (2), 260-268 (1993).
- Noble, L. J., Wrathall, J. R. Correlative analyses of lesion development and functional status after graded spinal cord contusive injuries in the rat. Exp Neurol. 103 (1), 34-40 (1989).
- Maikos, J. T., Shreiber, D. I. Immediate damage to the blood-spinal cord barrier due to mechanical trauma. J Neurotrauma. 24 (3), 492-507 (2007).
- Tei, R., Kaido, T., Nakase, H., Sakaki, T. Secondary spinal cord hypoperfusion of circumscribed areas after injury in rats. Neurol Res. 27 (4), 403-408 (2005).
- Cohen, D. M., et al. Blood-spinal cord barrier permeability in experimental spinal cord injury: dynamic contrast-enhanced MRI. NMR Biomed. 22 (3), 332-341 (2009).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extend arteriole capacity. Proc Natl Acad Sci U S A. 108 (20), 8473-8478 (2011).
- Schaffer, C. B., et al. Two-photon imaging of cortical surface microvessels reveals a robust redistribution in blood flow after vascular occlusion. PLoS Biol. 4 (2), e22 (2006).
- Kim, T. N., et al. Line-scanning particle image velocimetry: an optical approach for quantifying a wide range of blood flow speeds in live animals. PLoS One. 7 (6), e38590 (2012).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Sci Rep. 5, 9691 (2015).
- Thrivikraman, K. V., Huot, R. L., Plotsky, P. M. Jugular vein catheterization for repeated blood sampling in the unrestrained conscious rat. Brain Res Brain Res Protoc. 10 (2), 84-94 (2002).
- Walker, M. J., et al. A novel vertebral stabilization method for producing contusive spinal cord injury. J Vis Exp. (95), e50149 (2015).
- Anderson, K. D., Sharp, K. G., Steward, O. Bilateral cervical contusion spinal cord injury in rats. Exp Neurol. 220 (1), 9-22 (2009).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. J Vis Exp. (78), (2013).
- Lepore, A. C. Intraspinal cell transplantation for targeting cervical ventral horn in amyotrophic lateral sclerosis and traumatic spinal cord injury. J Vis Exp. (55), (2011).
- Zhang, Y. P., et al. Spinal cord contusion based on precise vertebral stabilization and tissue displacement measured by combined assessment to discriminate small functional differences. J Neurotrauma. 25 (10), 1227-1240 (2008).
- Wu, X., et al. A Tissue Displacement-based Contusive Spinal Cord Injury Model in Mice. J Vis Exp. (124), (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Egawa, G., et al. Intravital analysis of vascular permeability in mice using two-photon microscopy. Sci Rep. 3, 1932 (2013).
- Farrar, M. J., et al. Chronic in vivo imaging in the mouse spinal cord using an implanted chamber. Nat Methods. 9 (3), 297-302 (2012).
- Evans, T. A., Barkauskas, D. S., Myers, J. T., Huang, A. Y. Intravital imaging of axonal interactions with microglia and macrophages in a mouse dorsal column crush injury. J Vis Exp. (93), e52228 (2014).
- Davalos, D., Akassoglou, K. In vivo imaging of the mouse spinal cord using two-photon microscopy. J Vis Exp. (59), e2760 (2012).
- Davalos, D., et al. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169 (1), 1-7 (2008).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nat Methods. 9 (3), 273-276 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon