Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Enquête sur les néfastes effets de basse pression Plasma stérilisation sur la survie de Bacillus subtilis Spores en utilisant Live microscopie des cellules
Dans cet article
Résumé
Ce protocole illustre les étapes consécutives importantes nécessaires pour évaluer la pertinence de la surveillance des paramètres de vitalité et des processus de réparation de l’ADN dans la relance des spores de Bacillus subtilis après traitement par plasma basse pression par suivi réparation de l’ADN marquées fluorescence protéines par microscopie confocale résolue dans le temps et la microscopie électronique à balayage.
Résumé
Stérilisation de plasma est une alternative prometteuse aux méthodes de stérilisation conventionnelles fins industrielles, cliniques et de vols spatiaux habités. Décharges de plasma (LPP) basse pression contiennent un large éventail d’espèces actives, qui conduisent à une inactivation microbienne rapide. Afin d’étudier l’efficacité et les mécanismes de la stérilisation par la LPP, nous utilisons les spores de Bacillus subtilis l’organisme d’essai en raison de leur extraordinaire résistance contre les procédures de stérilisation conventionnelles. Les auteurs décrivent la production de b. subtilis monocouches de spore, le procédé de stérilisation par plasma à basse pression dans un réacteur à plasma à couplage inductif double, la caractérisation de la morphologie des spores à l’aide de la microscopie électronique à balayage (SEM) et le analyse de la germination et la croissance des spores par microscopie des cellules vivantes. Une cible majeure des espèces de plasma est matériel génomique (ADN) et la réparation des lésions de l’ADN induite par le plasma à la Renaissance de la spore est cruciale pour la survie de l’organisme. Ici, nous étudions la capacité de germination des spores et le rôle de l’ADN réparation au cours de la germination des spores et une excroissance après traitement avec PPR en pistant fluorescent marqué protéines réparation ADN (RecA) avec la microscopie en fluorescence confocal résolution temporelle. Traités et monocouches de spores non traitées sont activés pour la germination et visualisés avec un microscope confocal inversé de cellules vivantes dans le temps de suivre la réaction de spores individuelles. Nos observations montrent que la fraction de germination et de spores l’étroit dépend de la durée du LPP-traitement pour atteindre un minimum après que 120 s. RecA-YFP fluorescence (protéine de fluorescence jaune) a été détecté que chez quelques spores et développé dans tous les l’étroit des cellules avec une légère élévation dans les spores imprégnées sur la LPP. En outre, certaines des bactéries végétatives provenant de spores LPP-traités ont montré une augmentation de cytoplasme et tendaient à lyser. Les méthodes décrites pour l’analyse des spores individuelles pourraient être exemplaires pour l’étude d’autres aspects de la germination des spores et la croissance.
Introduction
Des principaux objectifs de l’exploration spatiale sont la recherche de signatures de formes de vie et de biomolécules sur d’autres corps planétaires et lunes de notre système solaire. Le transfert des micro-organismes ou des biomolécules d’origine terrestre à des domaines critiques d’exploration est présentant un risque particulier d’influencer le développement et l’intégrité des missions vie-détection sur les corps planétaires tels que Mars et Europe1. Les directives internationales de protection planétaire, mis en place par le Comité de la recherche spatiale (COSPAR) en 1967, imposer des règlements stricts sur les missions habitées et robotisées d’autres planètes, leurs satellites, astéroïdes et autres corps célestes et de réglementer les nettoyage et la stérilisation d’un véhicule spatial et composants matériel critique avant de lancer afin d’éliminer la contamination de micro-organismes terrestres et éviter toute contamination croisée des corps célestes,2. Durant la dernière décennie, l’application des plasmas non thermiques a gagné l’attention dans la recherche biomédicale et nutritionnelle, ainsi que dans le vol spatial applications3,4,5. Stérilisation de plasma est une alternative prometteuse aux méthodes de stérilisation classique car il offre6d’inactivation microbienne rapide et efficace, tout en étant douce à sensible et matériaux labile de la chaleur. Décharges de plasma contiennent un mélange d’agents réactifs tels que les photons dans l’ultraviolet (UV) et du spectre ultraviolet sous vide (VUV) qui conduisent à une inactivation microbienne rapide3, neutre/excités des atomes, particules chargées, radicaux libres. Dans cette étude, nous utilisons plasma basse pression généré par double torche à plasma basse pression (RCID) source7,8 pour inactiver les endospores Bacillus subtilis distribués sur le revêtement de verre.
Bactéries Gram-positives de la famille des Bacillaceae sont largement distribués dans les habitats naturels du sol, des sédiments et aériens ainsi que dans des environnements inhabituels tels que les salles blanches et de la Station spatiale internationale9,10 ,11. La caractéristique plus particulière du genre Bacillus est la capacité à former des endospores dormants très résistants (ci-après dénommés "spores") pour survivre à des conditions défavorables, telles que l’épuisement des nutriments,12. Les spores sont généralement beaucoup plus résistants que leurs homologues de la cellule végétative d’une variété de traitements et des contraintes environnementales, y compris la chaleur, UV, irradiation gamma, dessiccation, rupture mécanique et produits chimiques toxiques, tels que les oxydants ou des agents de changement de pH (révisés dans les références13,,14) et sont donc des objets idéales pour tester l’efficacité des méthodes d’inactivation microbienne. Puisque l’ADN génomique est un objectif majeur du traitement plasma des bactéries15,16, la réparation des lésions de l’ADN induite par le plasma (comme les ruptures double brin d’ADN) sur spore revival est crucial pour la survie de bactéries13, 17.
Ainsi, nous étudions la capacité de germination des spores et le rôle de réparation de l’ADN au cours de la germination des spores et une excroissance après avoir traité les spores avec plasma d’argon basse pression par des spores individuels suivants et réparer leur expression d’ADN marqués par fluorescence protéine RecA avec la microscopie en fluorescence confocal résolution temporelle. Nous donnons une instruction étape par étape de la préparation des spores de b. subtilis en monocouches pour parvenir à des résultats de test reproductible, le traitement des monocouches de spore avec plasma basse pression pour la stérilisation, la préparation des spores du plasma traité pour ultrastructurale évaluation au moyen de la microscopie électronique à balayage (SEM) et l’analyse de microscopie de cellules vivantes au niveau des spores individuelles de concert avec l’ADN actif de surveillance processus survenant dans la cellule en réponse à un traitement plasma de réparation.
Protocole
1. Production de spores de bacillus subtilis et Purification
- Pour la production de spores, transférer une culture nuit 5 mL de la souche de b. subtilis , complétée avec des antibiotiques appropriés, à 200 mL double résistance Schaeffer sporulation milieu liquide (par litre bouillon nutritif de 16 g, KCl 2 g, 0,5 g MgSO 4* 7 H2O 2 mL 1 M Ca (NO3)2, 2 mL 0,1 M MnCl2 * • 4 H2O, 2 mL 1 mM FeSO4, 2 mL de glucose 50 % (p/v)18) et de cultiver avec aération vigoureuse à 37 ° C pendant 72 h ou jusqu'à ce que > 95 % de la culture a sporulé. Les spores des souches suivantes sont utilisées : b. subtilis PY79 (type sauvage) b. subtilis PY79ΔrecA:: neo (carence de réparation d’ADN protéine RecA) b. subtilis PY79 recA-yfp:: chat (RecA fusionné avec jaune protéine fluorescente [YFP]19).
- Récolter des spores par centrifugation pendant 15 min à 3 000 x g, en tubes de 50 mL et de purifier les échantillons par des lavages répétés étapes (jusqu'à 15 fois) à l’aide de stérile distillée H2O et cocher pour état de pureté et de germination par microscopie à contraste de phase. Veiller à ce que les suspensions de spores sont constitués d’une phase brillante spores (> 99 %) et sont libres de cellules végétatives (tiges), les spores germées (aspect noir / gris) et les débris cellulaires, autrement plus amples expériences microscopie peuvent être perturbés. Laver l’échantillon jusqu'à ce que la pureté désirée est atteinte.
- Déterminée, le titre de spores par ensemencement sur 50 µL de dilutions en série 10 fois sur LB-agar (c.-à-d. : utilisation 30 µL d’échantillon + 270 µL d’eau stérile pour un 01:10 dilution. Prendre 30 µL de la dilution particulier à 270 µL H2O pour une dilution au 1/100, etc.) pour calculer l’UFC (unités formant des colonies) et incuber les plaques à 37 ° C pendant la nuit. Après détermination de l’UFC, ajuster l’échantillon à 109 spores / mL de concentration ou de dilution avec de l’eau stérile.
2. préparation des Spores déposé par aérosol Bacillus subtilis
Remarque : L’Accumulation et le chevauchement des spores pourraient conduire à l’occultation des effets pendant le traitement, entraînant finalement cinétique de l’inactivation falsifiés. Pour minimiser ce problème, préparer les échantillons de spores par une technique de dépôt aérosol-20. En bref, contrôler la buse de deux substances de haute précision avec une minuterie électrique qui régule le débit de liquid en concert avec le débit de gaz pressurisé transporteur (ici N2). Disperser l’échantillon liquide injectée par le biais de la prise de bec avec le débit de gaz d’azote.
- Placer un support de l’échantillon sous forme de stérilisé diapositives microscopiques (pour la cinétique de survie) ou ronds 25 mm lamelles couvre-objet (fluorescent suivi de réparation de l’ADN des processus/cLSM ; laser confocal, microscopie à balayage) à l’intérieur de l’aérosol électrovanne unité de pulvérisation en alignement avec la buse. La concentration de spores utilisé doit correspondre à un cent fois de la concentration finale souhaitée.
- Transférer 1 mL de la culture de spore dans l’admission de fluide de buse et entamer le processus de pulvérisation de 0,1 s à une pression de 1,3 bar. La suspension de spores pulvérisée (1 x 107) forme une couche mince sur la lame microscopique qui sèche rapidement en quelques secondes pour former une monocouche de spore uniformément distribuée. Stocker les entreprises de l’échantillon dans un flacon stérile à la température ambiante.
3. basse pression traitement au Plasma
- Préparer le système plasma pour le traitement d’échantillons biologiques et exploiter le système à 5 Pa avec plasma d’argon à 500 W pendant 5 min. Par la présente, toutes les surfaces du système sont nettoyées et réchauffés. Cela réduit le collage des molécules de l’air ambiant, à savoir d’azote, d’oxygène et d’eau, tandis que le système d’évacuation. Après le prétraitement du système, aérer la chambre et placer les échantillons soigneusement dans le centre de la cuve du réacteur avec l’aide de grilles de verre.
- Utilisez au moins trois réplicats biologiques. Fermer la chambre et évacuer inférieures à 2 PA. Remplissez par la suite, le gaz de procédé dans le compartiment. Régler la pression dans le système à 5 PA.
- Après le temps de processus définis, coupez l’alimentation électrique et gaz et aérer soigneusement le système pour éviter de souffler les échantillons du porte-échantillon. Après aération, supprimer les échantillons et placer les échantillons pour le paramètre suivant dans le système. Pour les contrôles non traités-plasma exposent échantillons d’aspirer uniquement (5 Pa) en présence du gaz processus équivalent à la fois appliquée plasmatique plus longue.
4. récupération et évaluation de survie des spores
- Préparer une solution d’autoclave 10 % acétate de polyvinyle (PVA) et couvrir le transporteur échantillon soigneusement avec environ 500 µL et laissez-les sécher à l’air pendant 4 h. bande de hors la couche séchée de PVA (maintenant contenant l’échantillon de spore) en utilisant une pince stérile et la transférer à une 2 mL tube à essais. Ajouter 1 mL d’eau stérile dans le tube et dissoudre la couche PVA via Vortex. Cette procédure conduit à > 95 % de récupération des spores et n’affecte pas leur capacité de germination21.
- En série, diluer l’échantillon à 01:10 dans de l’eau stérile dans une plaque à 96 puits (c.-à-d. 270 µL stérile H2O + dilution d’échantillon/ancienne 30 µL). Plaque de 50 µL de chaque dilution sur gélose nutritive de bouillon lysogénie (LB), incuber les plaques à 37 ° C pendant la nuit et énumérer le nombre de colonies cultivées (CFU).
5. vivre la microscopie des cellules et le suivi des processus de réparation de l’ADN dans la germination des Spores
- Pour les essais de germination, préparer un tampon de LB-agar 1 mm épaisseur 1,5 %, en faisant bouillir 700 µL de milieu et pipette dans une boîte de Pétri stérile de la microscopie. Après 10 min, coupez un 8 x 8 mm x 1 tampon mm LB-agar avec un scalpel stérile et transférer l’agar soigneusement sur le dessus les monocouches de spore qui reposent sur des lamelles de verre de 25 mm.
Remarque : Cette étape est cruciale pour la visualisation des spores individuels et laisser suite à leur réaction, vers l’activation de germination induite par la gélose nutritive. Ainsi, le LB-agar sert à deux fins, (1) pour fixer les spores à la surface, ce qui évite la relocalisation, le long de la surface et hors foyer optique et (2) pour activer la spore pour la germination. - Après avoir couvert l’échantillon avec l’agar, transférer la lamelle de verre rapidement dans une imagerie chambre et microscope les échantillons avec un microscope à balayage laser confocal automatisé avec une optique inversée à l’aide d’un 63 X / 1.3 avion apochromatique objectif à immersion d’huile.
-
Effectuer l’imagerie de fluorescence (YFP) avec une excitation de longueur d’onde de 514 nm et d’émission peut être détectée entre 520 et 560 nm.
- Enregistrer des images lumineuses-champ dans la numérisation de mode en utilisant un des multiplicateurs de photo (chemin de la lumière transmise).
- Enregistrer une série Time-lapse avec une puissance de laser de 2,6 % et régler l’ouverture confocale à 5 unités aérées et à une fréquence d’échantillonnage de 1 images / 30 s de 0 h à 5 h, selon l’expérience. On notera en particulier que des doses élevées de monochromatique laser éclairage au 514 nm complètement inhiber la germination (Figure 1A, B).
- Conserver les échantillons à 37 ° C (humidité de l’air ambiant) dans une phase de chauffage durant tout le processus d’imagerie. Utilisez au moins trois réplicats biologiques pour chaque condition. Dans le cas d’agrégation de spore, distribution de spore multicouches ou contamination par des particules de poussière, blocage du traitement plasma (« ombrage ») peut-être se produire et activer la germination des spores occultées (Figure 1C, D).
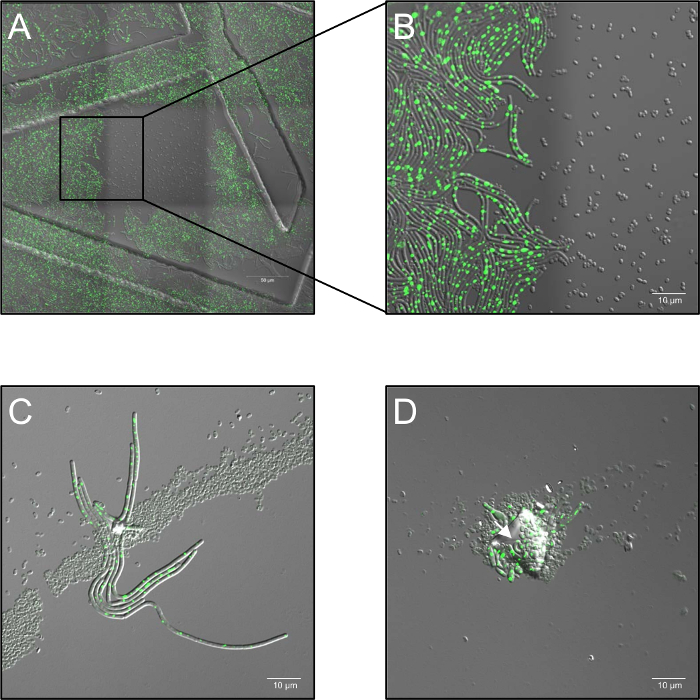
Figure 1 : les problèmes potentiels observés au cours de la microscopie de fluorescence des cellules vivantes confocal du plasma traité spores. (A, B) L’inhibition de la germination des spores par de fortes doses de monochromatique (514 nm) illumination au laser. (A) vue d’ensemble (3 x 3 images piquées) de b. subtilis (LAS72, RecA-YFP) spores 180 min après le début de la germination. Le cadre au milieu a été exposé à intervalles de 30 s à de fortes doses de lumière laser (514 nm, puissance du laser de 70 %), tandis que les régions environnantes (= cadres) n’étaient pas allumées (image fusionnée de lumineux-zone canal et fluorescence RecA-YFP ; commandés étaient des structures causés par l’utilisation de 35 mm d’imagerie plats avec une grille imprimée 500 µm). (B) montre un 4 X vue agrandie de la frontière entre la région lumineuse et non lumineuses, montrant que les spores, qui ont été exposés à des doses élevées d’illumination laser monochromatique n’ont pas germer et croître, alors que des spores dans régions non éclairée se remettre complètement de bactéries végétatives, exprimant la fluorescence brillante de RecA-YFP (signal vert). (C, D) Spores couvertes par contamination des particules ou des couches multiples de spore (flèches) semble protéger les spores sous-jacente de l’inactivation par traitement au plasma et permettre leur germination et la croissance (« effet d’ombrage »). (C) les Spores ont été imprégnées sur le plasma pour 60 s et imagé 180 min après le début de la germination ou en (D) pour 120 s et imagés après 240 min. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
6. microscopie électronique par balayage (SEM)
- Microscopie électronique à balayage permet de fournir des informations ultrastructurales sur la morphologie de la surface des spores de plasma traité par rapport aux témoins non traités. Enrober les monocouches de spores sèches sur les lamelles couvre-objet avec or-palladium (3 nm) à l’aide d’un pulvérisation-coater. Utiliser un microscope électronique à balayage-émission de champ pour l’imagerie des échantillons, exploités à 5 kV tension d’accélération notamment un détecteur d’électrons secondaires à l’objectif pour faire apparaître le contraste de la topographie.
7. analyse de données
- Déterminer la survie des spores au quotient N/N0, où N est la moyenne UFC des échantillons traités et N0 correspond à la moyenne UFC des témoins sous vide. Tracer l’inactivation des spores par traitement au plasma argon en fonction de la durée (en secondes). Exprimer toutes les données en valeurs moyennes et écarts-types (n = 3).
- Analyser les images obtenues par imagerie de cellules vivantes en utilisant le logiciel d’imagerie. Quantifier la proportion de la germination des spores et l’étroit après traitement au plasma, compter les spores dans des cadres représentant au début de l’expérience, ainsi qu’après 4 h. Pour la détermination de l’importance dans les essais de survie de spores, utilisez unidirectionnels tests ANOVA (analyse de variance) avec un logiciel de statistique). Les valeurs P < 0,05 sont considérés comme statistiquement significatifs.
Résultats
Des spores de survie du plasma traité b. subtilis
Traitement plasma des spores b. subtilis utilisés dans cette étude démontrent une diminution de la survie avec l’augmentation de la durée du traitement plasma (Figure 2). Les spores de la souche exprimant la recA-gène fusionné à YFP montre les courbes de survie semblables à des spores de la souche de type sauvage, c...
Discussion
Stérilisation des surfaces à l’aide de basse température, plasma basse pression est une alternative prometteuse aux procédures de stérilisation plutôt classiques tels que le traitement par rayonnements ionisants, produits chimiques (p. ex. gaz comme H2O2 ou l’oxyde d’éthylène) ou23de la chaleur sèche et humide. Les méthodes de stérilisation ordinaires fournissent principalement une stérilisation efficace, mais ils sont connus pour influencer la mati...
Déclarations de divulgation
Aucun conflit d’intérêts ne déclarés.
Remerciements
Les auteurs remercient Andrea Schröder pour son aide technique excellente pendant certaines parties de ce travail et Ulrich J. Nikea pour son aide pendant le tournage vidéo. Nous tenons également à remercier Lyle A. Simmons pour son don généreux des souches de Bacillus subtilis : LAS72 et LAS24. Ce travail a été soutenu en pièces grâce à des subventions de la Fondation allemande de la recherche (DFG) Paketantrag (PlasmaDecon PAK 728) pour PA (AW-7/3-1) et RM (2023 MO/2-1) et le DLR accordent le DLR-ICMSA-Projekt ISS vie, Programm RF-ICMSA, 475 Teilprogramm (pour F.M.F, M.R. et R.M.). F.M.F. a été soutenue par une bourse de doctorat de l’école de recherche Helmholtz espace Sciences de la vie (SpaceLife) dans le centre aérospatial allemand (DLR) à Cologne, en Allemagne, qui a été financé par l’Association Helmholtz (Helmholtz-Gemeinschaft) sur une période de six ans ( Grant no VH-Ko-300) et reçu des fonds supplémentaires de la DLR, y compris le Conseil d’administration aérospatiale et de l’Institut de médecine aérospatiale. Les résultats de cette étude doivent figurer dans la thèse de doctorat de Felix M. Fuchs.
matériels
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
Références
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon