Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Observation et analyse de clignement diffusion Raman exaltée de Surface
Dans cet article
Résumé
Ce protocole décrit l’analyse de clignement Raman exaltée de surface en raison de la marche aléatoire d’une molécule unique sur une surface d’argent à l’aide des lois de puissance de diffusion.
Résumé
D’une seule molécule à une jonction d’argent nanoaggregate, clignotant Raman exaltée de surface scattering (SERS) est observée. Ici, un protocole est présenté sur la façon de préparer la SERS-active nanoaggregate d’argent, enregistrer une vidéo de certaines taches clignotants dans l’image microscopique et d’analyser les statistiques de clignotants. Dans cette analyse, une loi de puissance reproduit les distributions de probabilité des événements lumineux par rapport à leur durée. Les distributions de probabilité des événements sombres sont montées par une loi de puissance avec une fonction exponentielle. Les paramètres de la Loi de puissance représentent comportement moléculaire dans les États claires et sombres. On peuvent estimer le modèle de marche aléatoire et la vitesse de la molécule sur toute la surface argentée. Il est difficile d’estimer la même lors de l’utilisation de moyennes, fonctions d’autocorrélation et Super-résolution SERS imagerie. À l’avenir, analyses de loi de puissance devraient être combinées avec l’imagerie spectrale, parce que les origines de clignotement ne peuvent être confirmées par cette méthode d’analyse.
Introduction
Diffusion (SERS) de Raman exaltée de surface est la spectroscopie Raman hautement sensible d’une surface de métal noble. Étant donné que le spectre Raman fournit des informations détaillées sur la structure moléculaire basée sur les positions de pic, à travers les modes vibrationnels de groupes fonctionnels dans les molécules, les informations d’une seule molécule sur une surface métallique peuvent être étudiées à l’aide de « sers »1,2,3. D’un nanoaggregate d’argent avec un adsorbat à l’échelle de la molécule unique, un signal clignotant on observe1,2,3,4,5,6, 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16et le spectre fluctue de1,2,3,4,5,6,7,8, 9,10,11,12,13,14. Clignotement peut être induite par une seule molécule qui se déplace au hasard dans et hors d’un champ électromagnétique amélioré de (EM) à un carrefour de taille nanométrique argent nanoaggregate. Par conséquent, clignotant est considéré comme une preuve simple pour la détection de molécules simples, par rapport à une technique utilisant une distribution de Poisson des intensités SERS et un bi-analyte2,3,17. Cependant, les mécanismes détaillés du spectre clignotant et fluctuant, qui peut dépendre fortement de comportement moléculaire sur la surface de l’Ag, sont encore controversés.
Dans des études antérieures, clignotant SERS a été analysée à l’aide de la fonction d’autocorrélation, qui permet de calculer le coefficient de diffusion et de la concentration des molécules se déplaçant dans et hors l’amélioration EM champ12,13,14 . En outre, un score normalisé écart-type, qui représente l’instabilité dans l’intensité totale, a été dérivé de la courbe de temps du signal15. Cependant, ces approches analytiques peuvent être basées sur le comportement de quelques molécules. En revanche, dans une imagerie Super-résolution de clignement SERS, comportement de molécules simples dans un champ électromagnétique amélioré peut être identifié16. Cependant, ces techniques peuvent obtenir des paramètres tels que dans un champ électromagnétique amélioré. Le comportement aléatoire d’une seule molécule dans une large gamme (par exemple, en clignotant « SERS ») peut être représenté comme une loi de puissance plutôt que d’une moyenne de4,5,6,7,8 ,9,10,11, similaire à fluorescence clignotant d’un semi-conducteur simple quantum dot (QD)18,19. En utilisant une alimentation droit analyse4,5,6,7,8,9,10,11, comportement moléculaire peut être estimée dans l’état lumineux (dans le champ EM amélioré) et état foncé10; autrement dit, on peut estimer le comportement de la molécule sur toute la surface argentée.
Pour cette technique, l’argent colloïdales nanoaggrégats sont utilisés4,5,6,7,8,9,10,11. Ces nanoaggrégats montrent diverses bandes de résonance (LSPR) plasmon de surface localisées qui affectent fortement améliorée des champs électromagnétiques, lorsqu’ils sont excités à certaines longueurs d’onde. Ainsi, argent de SERS-active nanoparticules existent en suspension colloïdale et certaines données peut immédiatement être obtenue. Dans le cas de simples nanostructures, qui ont des arrangements, des formes et des tailles spécifiques, la dépendance LSPR de SERS clignotant peut cacher des autres dépendances7; à savoir, si la nanostructure bonne ou mauvaise à LSPR est utilisée, les paramètres seront constants, et les autres dépendances seront donc cachées. Analyse Loi de puissance a été utilisée pour découvrir les différentes dépendances de la SERS clignotant argent colloïdal nanoaggrégats4,5,6,7,8, 9 , 10 , 11.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. préparation de l’échantillon
-
Préparation de nanoparticules d’argent colloïdales 20
- Pour fabriquer des nanoparticules d’argent colloïdales, dissoudre 0,030 g de nitrate d’argent et 0,030 g de citrate de sodium dihydraté dans 150 mL d’eau dans un ballon à fond rond de 200 mL.
- Combiner la fiole avec un réfrigérant à reflux (Dimroth).
- Agiter la solution dans le ballon d’un agitateur magnétique. Ensuite, faire chauffer la solution en remuant dans la fiole dans un bain d’huile à 150 ° C pendant 60 min.
Remarque : La solution devient jaune, puis laiteux gris. - Laisser refroidir la suspension à la température ambiante et garder la suspension dans le flacon, recouvert de papier d’aluminium dans un réfrigérateur.
Remarque : Le protocole peut être suspendu à ce stade. Utilisez les nanoparticules colloïdales, après avoir entreposé au réfrigérateur, dans le mois.
-
Préparation de l’échantillon pour multicolores clignotant d’émission 11
- Prêt d’une lame de microscope, laver avec du savon, une plaque de verre à la main et rincez-le à l’eau.
- Ajouter 0,1 % solution aqueuse de poly-L-lysine à la plaque de verre et supprimer la solution avec un ventilateur.
- Ajouter l’argentée suspension colloïdale à la plaque de verre et supprimer la suspension à l’air comprimé.
- Délimitent une zone de déposer sur la plaque de verre avec un stylo liquide bloqueur.
- Laisser tomber de l’eau distillée sur la plaque de verre et couvrir avec une autre plaque de verre pour créer une lame de microscope et empêcher l’eau de s’évaporer.
-
Préparation de l’échantillon pour SERS clignotant couleur monotone 7 , 8 , 9 , 10
- Prêt d’une lame de microscope, laver avec du savon, une plaque de verre à la main et rincez-le à l’eau.
- Mélanger la suspension colloïdale argentée avec thiacyanine ou thiacarbocyanine du colorant (25 ou 4 µM, respectivement) et une solution aqueuse de NaCl (10 mM) dans un rapport de volume de 2:1:1.
- Laisser tomber la suspension de l’échantillon sur la plaque de verre et supprimer la suspension à l’air comprimé.
- Délimitent une zone de déposer sur la plaque de verre avec un stylo liquide bloqueur.
- Laisser tomber une solution aqueuse de NaCl (1 M) sur la plaque de verre pour immobiliser les nanoparticules d’argent et le couvrir avec une autre plaque de verre pour créer un disque de glissement du microscope et empêcher l’évaporation de la solution.
2. observation de clignotement des nanoparticules d’argent
-
Illumination de l’échantillon
- Placer la plaque de verre échantillon préparée en utilisant le protocole 1.2 ou 1.3 sur la scène d’un microscope inversé.
- Éclairer la plaque de verre d’échantillon à l’aide de la lumière blanche à travers un condenseur de champ sombre et de se concentrer sur différents spots de couleurs (bleus, verts, jaunes et rouges) sur la plaque de verre à l’aide d’une lentille d’objectif (60 X).
- Éclairer la plaque de verre d’échantillon à l’aide d’un faisceau atténué, livré à un angle de 30° par rapport à la surface de l’échantillon, d’un laser à diode pompé à l’état solide (DPSS) onde continue (cw) à travers un filtre d’interférence.
- Pour l’illumination laser permet d’observer l’argent nanoaggrégats comme des taches de couleur monotones dans un entourage de même couleur, déplacer la zone d’illumination laser vers le centre de la vue et se concentrer sur les taches sur la plaque de verre en ajustant la scène dans la direction z.
-
Observation de clignotement
- Insérer un filtre passe-longue après la lentille de l’objectif et éclairer la plaque de verre d’échantillon à l’aide d’un faisceau de cw-laser DPSS envoyée à un angle de 30° par rapport à la surface de l’échantillon à travers un filtre d’interférence.
- Trouver le clignotement taches tel qu’illustré à la Figure 1 (voir aussi Figure S1 dans les documents supplémentaires) en déplaçant la scène dans les directions x et y.
- Enregistrer des vidéos des taches clignotantes avec le microscope inversé, couplé à une caméra refroidie numérique couplé dispositif de charge (CCD), qui a une résolution temporelle de 61 à 120 ms, pendant 20 min.
3. analyse de clignement SERS
-
Dérivation de courbe de temps de vidéo
- Dans le logiciel qui contrôle la caméra CCD, ouvrez le fichier vidéo.
- Pour sélectionner les taches clignotants et la zone sombre, faites glisser les zones qui couvrent séparément des régions avec et sans taches dans l’image vidéo.
- Pour calculer les signaux intensité en fonction du temps des taches clignotantes et des zones sombres dans la vidéo, sélectionnez Analyse temporelle dans l’analyse, puis cliquez sur le calcul dans la fenêtre d’Analyse temporelle .
- Enregistrer les données dans un fichier texte.
-
Analyse de la courbe de temps
- Aplatir une ligne de base de la courbe de temps en soustrayant le profil temporel de la zone sombre et/ou de montage avec une fonction polynomiale, tel qu’illustré dans les Figures 2 a et 2 b.
- Évaluer une intensité moyenne de base se compose d’environ 2000 points, j’aibaseet un écart-type des intensités de base, σ, comme illustré dans les Figures 2 et 2D.
- Distinguer les événements lumineux de sombres événements à l’aide de grandes intensités à un seuil de j’aibase + 3σ et enregistrer la durée de chaque épreuve. Dans la Figure 3, par exemple, enregistrer l’événement de 0 à 3.5476 s que l’événement sombre (avec une durée t = 3.5476 s) et d’enregistrer l’événement de 3.5476 à 4.0981 s que l’événement lumineux (avec une durée t = 0.5505 s). Répétez la procédure comme indiqué dans le tableau 1.
- Compter le nombre d’événements claires et foncées pour chaque durée, telle qu’exprimée dans les première et deuxième lignes du tableau 2.
- Additionner le nombre d’événements pour chaque durée, à l’exception des événements plus courtes que la durée t. Tel qu’exprimé dans les deuxième et troisième lignes du tableau 2, par exemple, additionner le nombre d’événements pour chaque durée (à l’exception des événements pour t = 0,0612 s) sous la forme 41 + 18 + 9 +... ; le résultat est égal à la somme pour t = 0.1223 s, c'est-à-dire 103.
- Diviser les sommations par chaque durée et normaliser. Comme indiqué dans le tableau 2, par exemple, diviser la somme pour la durée t = 0,0612 s par la durée 0,0612 s. Le résultat est 3,351.5791. Ensuite, divisez le résultat par le nombre total des résultats à la quatrième ligne du tableau 2. La distribution de probabilité est dérivée pour être 0.64494.
- Tracer les distributions de probabilité pour les événements lumineux Psur(t) contre leur durée t dans un graphe de logarithme-logarithme et fit Log10Psur(t) Journal des10 (
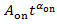 ) pour déduire la puissance Loi exposant αsur un particulier clignotant spot. Si Psur(t) est monté par
) pour déduire la puissance Loi exposant αsur un particulier clignotant spot. Si Psur(t) est monté par 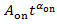 , la ligne équipée écarte les parcelles de petites valeurs de Psur(t), comme indiqué par la ligne pointillée en Figure 4A.
, la ligne équipée écarte les parcelles de petites valeurs de Psur(t), comme indiqué par la ligne pointillée en Figure 4A. - Tracer les distributions de probabilité pour les sombres événements Poff(t) contre leur durée t dans un graphe de logarithme-logarithme et fit Log10Poff(t) par (10) Journal
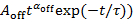 d’en déduire la loi exposant αoff et la troncature temps τ du clignotement même spot. Si Poff(t) est monté par
d’en déduire la loi exposant αoff et la troncature temps τ du clignotement même spot. Si Poff(t) est monté par 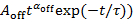 , la courbe ajustée écarte les parcelles de petites valeurs de Poff(t).
, la courbe ajustée écarte les parcelles de petites valeurs de Poff(t). - Répétez 3.2.1 à 3.2.8 pour les autres taches clignotants dans la vidéo.
Access restricted. Please log in or start a trial to view this content.
Résultats
De l’argent nanoaggrégats avec poly-L-lysine, établie par le protocole 1.2, des taches clignotantes multicolores de SERS et fluorescence exaltée de surface sont observés, comme illustré à la Figure 111. En revanche, des taches de clignotants couleur monotones du SERS ont été observées pour l’argent nanoaggrégats avec les molécules de colorant préparés par protocole 1,37,
Access restricted. Please log in or start a trial to view this content.
Discussion
De la jonction nanoaggregate argent, SERS est émis. Par conséquent, nous devons préparer les nanoaggrégats plutôt que des nanoparticules colloïdales, qui sont couverts avec les anions de citrate. Agrégats argent sont formés à partir de l’effet créé par l’ajout de la poly-L-lysine, qui a -NH3+ et est à l’origine de la SERS, le salage ou Na+ cation de NaCl, tel qu’illustré dans Figure S2 du matériel supplémentaire. Par ailleurs, pour éclairer les nom...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
L’auteur n’a rien à divulguer.
Remerciements
L’auteur remercie le Prof. Y. Ozaki (Kwansei Gakuin University) et Dr T. Itoh (National Institute of Advanced Industrial Science and Technology) pour leur discussion fructueuse de ce travail. Ce travail a été soutenu par KAKENHI (subvention pour la recherche scientifique C) depuis le ministère de l’éducation, Culture, Sports, Science et technologie (no 16K 05671).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Silver nitrate, 99.8% | Wako | 194-00832 | |
| Trisodium citrate dihydrate, 99. % | Wako | 191-01785 | |
| Poly-L-lysine aqueous solution, 0.1% | Sigma-Aldrich | P8920 | |
| 3,3'-disulfopropylthiacyanine triethylamine | Hayashibara Biochemical Laboratories | NK-2703 | a kind of thiacyanine dyes |
| 3,3'-diethyl-5,5'-dichloro-9-methylthiacarbocyanine iodine salt | Hayashibara Biochemical Laboratories | SMP-9 | a kind of thiacarobocyanine dyes |
| Sodium chloride, 99.5% | Wako | 191-01665 | |
| Dimroth condenser | Iwaki | 61-9722-22 | perchased from AS ONE |
| Magnetic stirrer | Corning | DC-420D | |
| Oil bath | Advantech | OS-220 | |
| Glass plate | Matsunami | S-1112 | Microscope slide |
| Blower | Hozan | Z-288 | Air duster |
| Liquid blocker pen | Daido Sangyo | LIQUID BLOCKER (Super Pap Pen). Ready-to-use hydrophobic barrier pen designed for immunohistochemistry applications | |
| Inverted microscope | Olympus | IX-70 | |
| Objective lens | Olympus | LCPlanFl 60× | NA 0.7 |
| Dark field condenser | Olympus | U-DCD | NA 0.8–0.92 |
| Cooled digital CCD camera | Hamamatsu | ORCA-AG | controlled by software Aqua Cosmos |
| Software for the cooled digital CCD camera | Hamamatsu | AquaCosmos | used for also derivation of the time-profiles from the blinking spots in the video |
| Color CCD camera | ELMO | TNC-C920 | not used for analysis |
| DPSS laser | RGB laser system | NovaPro532-75 | λ = 532 nm; 60 mW (corresponds to a power density of 600 W/cm2) |
| Interference filter | Semrock | LL01-532-12.5 | |
| Long pass filter | Semrock | BLP01-532R-25 | |
| Software for the distinguishment and counting of the bright/dark events | home-maid | programmed by C++ | |
| Software for the fitting by a power law | LightStone | Origin6.1 |
Références
- Qian, X. M., Nie, S. M. Single-molecule and single-nanoparticle SERS: from fundamental mechanisms to biomedical applications. Chem. Soc. Rev. 37, 912-920 (2008).
- Pieczonka, N. P. W., Aroca, R. F. Single molecule analysis by surfaced-enhanced Raman scattering. Chem. Soc. Rev. 37, 946-954 (2008).
- Kneipp, J., Kneipp, H., Kneipp, K. SERS -a single-molecule and nanoscale tool for bioanalytics. Chem. Soc. Rev. 37, 1052-1060 (2008).
- Kitahama, Y., Ozaki, Y. Analysis of blinking SERS by a power law with an exponential function. Frontiers of Surface-Enhanced Raman Scattering: Single-Nanoparticles and Single Cells. , Wiley. Chichester. Chapter 6 (2014).
- Kitahama, Y. Truncated Power Law Analysis of Blinking SERS. Frontiers of Plasmon Enhanced Spectroscopy Volume 1 (ACS Symposium series Vol. 1245). , American Chemical Society. Washington DC. Chapter 4 (2016).
- Bizzarri, A. R., Cannistraro, S. Lévy Statistics of Vibrational Mode Fluctuations of Single Molecules from Surface-Enhanced Raman Scattering. Phys. Rev. Lett. 94, 068303(2005).
- Kitahama, Y., Tanaka, Y., Itoh, T., Ozaki, Y. Power-law analysis of surface-plasmon-enhanced electromagnetic field dependence of blinking SERS of thiacyanine or thiacarbocyanine adsorbed on single silver nanoaggregates. Phys. Chem. Chem. Phys. 13, 7439-7448 (2011).
- Kitahama, Y., Tanaka, Y., Itoh, T., Ozaki, Y. Analysis of excitation laser intensity dependence of blinking SERRS of thiacarbocyanine adsorbed on single silver nanoaggregates by using a power law with an exponential function. Chem. Commun. 47, 3888-3890 (2011).
- Kitahama, Y., Enogaki, A., Tanaka, Y., Itoh, T., Ozaki, Y. Truncated power law analysis of blinking SERS of thiacyanine molecules adsorbed on single silver nanoaggregates by excitation at various wavelengths. J. Phys. Chem. C. 117, 9397-9403 (2013).
- Kitahama, Y., Araki, D., Yamamoto, Y. S., Itoh, T., Ozaki, Y. Different behaviour of molecules in dark SERS state on colloidal Ag nanoparticles estimated by truncated power law analysis of blinking SERS. Phys. Chem. Chem. Phys. 17, 21204-21210 (2015).
- Kitahama, Y., Nagahiro, T., Tanaka, Y., Itoh, T., Ozaki, Y. Analysis of blinking from multicoloured SERS-active Ag colloidal nanoaggregates with poly-L-lysine via truncated power law. J. Raman. Spectrosc. 48, 570-577 (2017).
- Habuchi, S., et al. Single-Molecule Surface Enhanced Resonance Raman Spectroscopy of the Enhanced Green Fluorescent Protein. J. Am. Chem. Soc. 125, 8446-8447 (2003).
- Weiss, A., Haran, G. Time-Dependent Single-Molecule Raman Scattering as a Probe of Surface Dynamics. J. Phys. Chem. B. 105, 12348-12354 (2001).
- Emory, S. R., Jensen, R. A., Wenda, T., Han, M., Nie, S. Re-examining the origins of spectral blinking in single-molecule and single-nanoparticle SERS. Faraday Discuss. 132, 249-259 (2006).
- Itoh, T., Iga, M., Tamaru, H., Yoshida, K., Biju, V., Ishikawa, M. Quantitative evaluation of blinking in surface enhanced resonance Raman scattering and fluorescence by electromagnetic mechanism. J. Chem. Phys. 136, 024703(2012).
- Willets, K. A. Super-resolution imaging of SERS hot spots. Chem. Soc. Rev. 43, 3854-3864 (2014).
- Dieringer, J. A., Lettan, R. B., Scheidt, K. A., Van Duyne, R. P. A Frequency Domain Existence Proof of Single-Molecule Surface-Enhanced Raman Spectroscopy. J. Am. Chem. Soc. 129, 16249-16256 (2007).
- Cichos, F., von Borczyskowski, C., Orrit, M. Power-law intermittency of single emitters. Curr. Opin. Colloid Interface Sci. 12, 272-284 (2007).
- Tang, J., Marcus, R. A. Mechanisms of fluorescence blinking in semiconductor nanocrystal quantum dots. J. Chem. Phys. 123, 054704(2005).
- Lee, P. C., Meisel, D. Adsorption and surface-enhanced Raman of dyes on silver and gold sols. J. Phys. Chem. 86, 3391-3395 (1982).
- Krichevsky, O., Bonnet, G. Fluorescence correlation spectroscopy: the technique and its applications. Rep. Prog. Phys. 65, 251-297 (2002).
- Hess, S. T., Huang, S., Heikal, A. A., Webb, W. W. Biological and Chemical Applications of Fluorescence Correlation Spectroscopy: A Review. Biochemistry. 41, 697-705 (2002).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon