Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microsonde électrophorèse capillaire spectrométrie de masse pour la métabolomique unicellulaires dans les embryons de grenouilles vivent (Xenopus laevis)
Dans cet article
Résumé
Les auteurs décrivent les étapes permettant d’échantillonnage rapide in situ d’une petite portion d’une cellule individuelle avec haute précision et une atteinte minimale à l’aide de base capillaire Microprélèvement, pour faciliter la caractérisation chimique d’une capture instantanée de l’activité métabolique dans embryons vivants à l’aide d’une cellule unique sur mesure électrophorèse capillaire et la plate-forme de la spectrométrie de masse.
Résumé
La quantification des petites molécules dans des cellules individuelles déclenche des nouvelles possibilités pour mieux comprendre les processus fondamentaux qui sous-tendent le développement embryonnaire. Pour activer unicellulaires enquêtes directement en embryons vivants, nouvelles approches analytiques sont nécessaires, notamment ceux qui sont sensibles, sélectif, quantitative, robuste et évolutive à la taille des cellules différentes. Nous présentons ici un protocole qui permet l’analyse in situ du métabolisme dans des cellules individuelles à développer librement des embryons de la sud africaine Xenopus laevis (Xenopus laevis), un puissant modèle cellulaire et biologie du développement. Cette approche utilise une microsonde capillaire pour aspirer une partie définie de simples cellules identifiées dans l’embryon, laissant les cellules voisines intactes pour analyse ultérieure. Le contenu de cellules recueillies est analysé par une microéchelle électrophorèse capillaire electrospray ionisation (CE-ESI) interface couplée à un spectromètre de masse à haute résolution en tandem. Cette approche est extensible à différentes tailles de cellule et compatible avec la structure complexe en trois dimensions de l’embryon en développement. Ainsi, nous démontrons que microsonde qu'unicellulaires CE-ESI-MS permet à l’élucidation de l’hétérogénéité métabolique cellulaire qui se déploie comme une cellule progénitrice donne lieu aux descendants au cours du développement de l’embryon. Outre cellulaire et biologie du développement, les protocoles d’analyse unicellulaires décrites ici sont prêtent d’autres tailles de cellules, types de cellules ou des modèles animaux.
Introduction
Une compréhension approfondie du développement embryonnaire nécessite la caractérisation de tous les changements moléculaires qui se déroulent dans chaque cellule de l’organisme en développement. Tandis que Next-Generation Sequencing avec amplification moléculaire permet de mesure profonde des unicellulaires transcriptomes1 en développement systèmes2,3, beaucoup moins on connaît la suite de molécules plus petites produite dans les cellules embryonnaires unique, y compris les protéines et, surtout, de métabolites (masse moléculaire < ~ 1 500 Da). Avec une réponse rapide et dynamique aux événements intrinsèques et extrinsèques, le métabolome est un puissant descripteur d’État moléculaire de la cellule. Le métabolome unicellulaires, soulève donc la possibilité de suivre le développement spatial et temporel de l’hétérogénéité des cellules dans l’embryon précoce et d’identifier de nouvelles molécules pour les études fonctionnelles. Cependant, sans amplification moléculaire disponible pour ces molécules, détection du métabolome exige une sensibilité exceptionnelle à l’aide de la spectrométrie de masse (MS), qui est la technologie de choix pour l’analyse des métabolites.
Unicellulaire MS est une collection de technologies avec une sensibilité suffisante pour mesurer les métabolites dans des cellules individuelles (voir commentaires 4,5,6,7,8,9 ,10,11,12,13,14,15). Échantillonnage reproductible des cellules et l’extraction efficace des métabolites sont essentiels à la réussite détection des métabolites dans des cellules individuelles. Dissection de la cellule entière de cellules identifiées d’embryons de Xenopus a permis la caractérisation des petites molécules et de peptides16. Autres approches emploient micropipettes pour échantillonner des cellules vivantes individuelles suivies de détection par ionisation par électrospray (ESI) MS. Par exemple, métabolites ont été mesurés en usine ou des cellules de mammifères par cellule unique vidéo MS17, sonde de pression18, seule sonde19et microscopie force fluidique20, parmi d’autres techniques21, 22,23,24. En outre, l’incorporation de séparation chimique avant d’ionisation dans le flux de travail MS unicellulaires simplifie efficacement le métabolome, atténuant ainsi les interférences potentielles pendant la génération d’ions avant la détection. Ce qui est important, séparation renseigne également composé spécifique afin d’aider à l’identification moléculaire. Électrophorèse capillaire (EC) a été utilisé pour détecter des métabolites dans unique disséqués25,26 microsampled27nerveuses, capture de petites molécules différences entre les phénotypes de neurone. Récemment, nous avons adapté CE au tandem ESI MS pour permettre la détection de niveau de trace de centaines de métabolites dans des cellules individuelles qui ont été disséqués de jeunes embryons de Xenopus laevis16,28. Ces études ont révélé des différences métaboliques surprenants entre les cellules à un stade précoce du développement embryonnaires et conduit à la découverte de métabolites avec précédemment inconnue des impacts du développement16.
Ici, nous fournissons un protocole permettant la détection des métabolites dans des cellules individuelles directement dans un embryon de vertébrés vivant à l’aide de la microsonde unicellulaires CE-ESI-MS29,30. L’organisme modèle choisi est la 8 à 32-cellule embryonnaire de X. laevis , bien que l’approche est également applicable aux derniers stades de développement et d’autres types d’organismes modèles. Ce protocole utilise capillaires affûtées multi-axes contrôle traductionnel sous direction par un système d’imagerie à haute résolution d’aspirer une partie de nL ~ 10 de cellules identifiées in situ dans l’embryon en développement morphologiquement complexe. Cette microsonde est évolutif à petites cellules et fonctionne dans les secondes, ce qui est suffisamment rapide pour suivre les lignées cellulaires chez l’embryon. Après extraction de polar ou de petites molécules apolaires, tels que les métabolites et de peptides, de l’échantillon prélevé en environ 4-5 µL de solution d’extraction, un 10 ~ nL de l’extrait obtenu est analysé dans une plate-forme de CE fait sur mesure, couplée à un spectromètre de masse ESI. Construction et l’exploitation de la plate-forme de CE-ESI-MS s’appuie sur les protocoles décrits ailleurs. 31 , 32 l’interface CE-ESI coaxiale est construit comme décrit ailleurs. 31 cette plate-forme est maintenue dans le régime de pulvérisation de cône-jet pour atteindre trace-niveau sensibilité avec une capacité pour la quantification sur une plage de dynamique de journal-ordre de 4-5 (relative28,29,30 ou absolue16). La plateforme de CE-ESI-MS offre 60-amol limite inférieure de détection avec 8 % écart-type relatif (RSD) en analyse quantitative sur une gamme éprouvée de 10 nM à 1 µM pour les petites molécules16, qui suffisent à caractériser les métabolites endogènes dans X. laevis cellules. Microprobed cellules continuent à se diviser au fur et l’embryon par le biais de développement30, permettant une analyse temporellement et spatialement résolue du métabolisme cellulaire. En effet, seule cellule CE-ESI-MS peut être utilisé pour trouver les différences métaboliques entre les cellules qui occupent la dorsale-ventral16,29, animal-végétal16et gauche-droite28 axes du développement ainsi que les cellules qui forment la lignée dorsale vouée de tissu nerveux d’une cellule d’ancêtre commun dans X. laevis30. Outre l’interrogation des différences métaboliques entre différentes cellules embryonnaires à différents stades de développement de l' embryon de X. laevis 30, nous prévoyons que les protocoles décrits ici soient appliquent à un large éventail de biomolécules et microsampled de cellules individuelles des différents stades du développement embryonnaire, mais aussi des autres types de cellules et des organismes modèles. En outre, la microsonde pourrait servir pour Microprélèvement alors qu’une autre plateforme compatible avec minuscules échantillons pourrait être utilisée pour la séparation et/ou la caractérisation des biomolécules.
Protocole
Tous les protocoles liés à l’entretien et la manutention de Xenopus laevis ont été approuvées par le Comité de l’urbanisme à l’Université George Washington et d’institutionnels animalier (IACUC pas. A311).
1. préparation de l’échantillonnage des Instruments, des médias, des solvants et de plats
- Préparer 1 x solution de Steinberg (SS) en dissolvant les sels dans l’eau ultrapure (~18.2 MΩ.cm à 25 ° C) dans l’ordre suivant et aux concentrations indiquées car elles suivent une norme protocole33: chlorure de Sodium (58,2 mM), chlorure de potassium () 0,67 mM), nitrate de calcium (0,34 mM), le sulfate de magnésium (0,83 mM), Tris-chlorhydrate (4,19 mM) et la base Tris (0,66 mM). Faire 0,5 x SS par deux fois et 0,1 x SS par dilution dix fois, de 1 x SS à l’aide de l’eau ultrapure.
- Préparent des plats d’échantillonnage par première faisant 2 % d’agarose dans 1 x art. Autoclave à 120 ° C pendant 20 min à se dissoudre. Alors que c’est encore liquide, étalé au fond des boîtes de Pétri de 60 mm avec la solution. Une fois le gel d’agarose a refroidi et solidifié, flamme à l’extrémité de la pipette Pasteur de six pouces jusqu'à ce qu’elle forme une boule et appuyer légèrement sur l’extrémité chauffée pour imprimer 5-10 puits, ~ 1 mm de profondeur, dans l’agarose.
Remarque : Ces puits sont utilisés pour immobiliser les embryons lors de l’échantillonnage. - Préparer le solvant d’extraction de métabolites. Adapter les propriétés physico-chimiques du solvant (p. ex., la polarité et pH) pour les classes de molécules qui présentent un intérêt dans l’étude.
NOTE : par exemple, nous utilisons méthanol 40 % et 40 % d’acétonitrile dans l’eau LC-MS-qualité comme une approche de découverte pour cibler les métabolites polaires principalement et quelques apolaire de métabolites et peptides de28. - Faire des boucles de cheveux à l’aide de cheveux propres et une pipette Pasteur comme décrit ailleurs33 pour déplacer doucement des embryons dans les boîtes de Pétri avec une perturbation minimale.
- Fabriquer des micropipettes embout conique tel qu’illustré dans la Figure 1 a.
- Tout d’abord, tirez capillaires de borosilicate (1 000/500 µm de diamètre extérieur/intérieur) dans un extracteur capillaire flamboyante-Brown-type avec les paramètres suivants : chaleur = 355 ; traction = 65, vélocité = 80 ; temps = 150.
- Ensuite, pause-large de la pointe de la micropipette extraite à l’aide d’une paire de pinces forte amende pour obtenir une pointe capillaire de diamètre extérieur d’environ 20 µm. Effectuez cette étape sous un stéréomicroscope de précision et la reproductibilité de l’aide.
Remarque : Les capillaires avec une petite pointe sont tendance à encrasser pendant l’aspiration du cytoplasme visqueux. Tandis que capillaires avec une pointe plue certainement aident à éviter l’encrassement et aspirer plus au contenu cellulaire, gros calibre capillaires peuvent posent des défis au cours de l’échantillonnage des cellules plus petites et éventuellement d’endommager la cellule pour l’échantillonnage subséquent. Un réglage judicieux de la pression et le temps d’aspiration peuvent atténuer partiellement ces défis. Nous trouvons micropipettes avec environ 20 µm de diamètre extérieur idéal pour le travail présenté ici.
2. Microprélèvement Single cellules et Extraction de métabolites
- Obtenir des embryons (fécondés) par induite par gonadotrophines naturelles accouplement des adultes Xenopus laevis ou par fécondation in vitro comme décrit dans les protocoles ailleurs33,34.
NOTE : Accouplement naturel assure que les stades de développement embryonnaires sont décalés tandis que les embryons obtenus par fécondation in vitro sont plus fiables dans l’alimentation. Cependant, la fécondation in vitro nécessite sacrifier la grenouille mâle adulte. - Préparer fraîchement solution consiste de 2 % cystéine dissoudre 4 g de cystéine dans 200 mL d’eau ultrapure et ajuster goutte à goutte la solution à pH 8 à l’aide de la solution d’hydroxyde de sodium 10 N.
- Enlever les couches de gelée entourant les embryons lorsqu’elles commenceront à s’attacher au stade 2 cellules comme suit : laisser les embryons reposent dans la solution dejellying pendant 2 min, puis agiter doucement pour un 2 min supplémentaire empêcher des embryons d’adhérer à la surface de la collection plat.
- Verser doucement le plat contenu dans un bécher propre et décanter rapidement la solution dejellying du bécher. Couvrir immédiatement les œufs avec 0,1 x SS rince le reste consiste solution, agiter doucement et puis décanter la solution. Répétez cette opération quatre fois de laver soigneusement les embryons.
NOTE : Limiter l’exposition des embryons à la solution dejellying à 4 min pour assurer la viabilité. Les protocoles complets pour enlever les couches de gelée sont disponibles ailleurs33. - Transférer les embryons dejellied dans 1 x SS dans une boîte de Pétri. Pour minimiser l’encombrement dans les assiettes, placez les embryons de ~ 100 par 100 mm plat33.
Remarque : Les plats contenant des embryons peuvent être stockés entre 14 et 18 ° C pour ralentir le développement et d’obtenir des embryons à des stades de développement échelonnés de mêmes parents. Nouvelles lignes directrices sur la dépendance de la température de croissance et de développement sont publiés sur Xenbase et ailleurs33,35,36,37. - Sorte de clivage des embryons au stade 2 cellules dans un plat séparé dans lequel pigmentation stéréotypée avec confiance marque l’axe de la dorsale-ventral, en ce qui concerne les cellulaires établies sort cartes38,39,40.
- Identifier correctement clivage embryons en veillant à ce qui divise le premier sillon de clivage, qui dénote le plan sagittal médian, la sombre (ventrale) et légèrement (dorsal) pigmenté pôle animal tel que les deux moitiés sont des images miroir41.
- Monter une micropipette fabriquée sur un micromanipulateur multi-axes (manuel ou télécommandé). Se connecter à la micropipette à un microinjector.
- Utiliser une pipette de transfert en plastique pour aspirer 5 ~ de l’embryon de 8 cellules et de les transférer dans le plat de prélèvement contenant 0,5 x SS.
NOTE : Identifier les cellules basées sur la pigmentation et la position dans l’embryon, en ce qui concerne la cellule sort cartes38,39,40.
NOTE : par exemple, nous aspirer régulièrement environ 10-15 volume nL de la cellule en appliquant ~ 3 pulsations-30 PSI pour le capillaire. Cette étape toute dure ~ 5 s pour aspiration30.
- Bien fermer le flacon pour éviter l’évaporation et remettre le flacon dans le seau à glace 4 ° C jusqu'à ce que l’échantillonnage soit complète. Jeter la micropipette utilisée dans un conteneur pour objets tranchants pour éviter les risques par piqûre d’aiguille.
Remarque : Pour déterminer le volume du contenu cellulaire aspiré, injecter l’aspirer dans l’huile minérale, où il obtient une forme sphérique. Le diamètre de cette sphère peut être mesuré à l’aide d’un microscope. Calculer le volume aspiré : V = 4/3 π r3, où V est le volume, et r est le rayon de la sphère.
3. CE-ESI-MS mesure
- Élaboration de normes et de Solutions pour CE-ESI-MS
- Préparer l’électrolyte de fond (BGE) composé de 1 % d’acide formique dans l’eau de la SM-qualité.
- Préparer la solution de gaine contiennent 50 % de méthanol dans la catégorie SM-0,1 % d’eau et de l’acide formique.
- Préparer 50 nM l’acétylcholine solution dans la solution de gaine pour évaluation quotidienne de la performance du système CE-ESI-MS.
- Préparer une solution de chlorure de sodium 150 mM masse-étalon pour la gamme basse m/z en mode d’ions positifs. Une précision de la masse (m/z) de < 10 ppm est recommandé. Suivez les instructions du fournisseur spectromètre de masse à effectuer cette étape.
NOTE : Alternativement, autres normes avec les valeurs connues de m/z peuvent être utilisés pour le spectromètre de masse de masse-étalonner.
- Construction de la plate-forme de CE-ESI
- Construire une plate-forme d’injection CE capable de translation verticale rapide d’une scène en tenant le flacon BGE et l’échantillon microtube de chargement. Pour la construction et l’exploitation de la plate-forme, voir détails en référence31.
- Assembler comme suit à l’interface de CE-ESI (Figure 1C). Monter l’émetteur métal electrospray (longueur intérieure/extérieure ~ 35 mm et de diamètre de 130/260 µm) dans une 3-port T-union. Nourrir le capillaire de séparation CE (40/105 µm intérieur/extérieur diamètre et ~ 100 cm de longueur) par l’intermédiaire de l’émetteur par électronébulisation lui permettant pour dépasser ~ 40-100 µm au-delà de l’extrémité de l’émetteur. Travailler sous un stéréomicroscope de précision de l’aide.
- Connectez le capillaire de solution de gaine (75/360 µm intérieur/extérieur diamètre et ~ 100 cm de longueur) au port restant à fournir la solution electrospray. Utiliser les douilles appropriées et serrez les connexions pour un fonctionnement sans fuite de l’interface de CE-ESI. Se reporter aux précédents protocoles31,32 pour plus de détails sur le montage et le dépannage de cette interface.
Remarque : Les dimensions capillaire affectent le rapport signal sur bruit (S/N) et la durée de la séparation. Par exemple, courts et étroit-alésage capillaires facilitent des séparations rapides utilisant plus séparation tensions42,43. En outre, selon le type de molécules qui présentent un intérêt dans une étude, les capillaires de séparation peuvent revêtir pour minimiser ou éviter d’interactions indésirables capillaires-molécule mur44.
- Connectez le capillaire de solution de gaine (75/360 µm intérieur/extérieur diamètre et ~ 100 cm de longueur) au port restant à fournir la solution electrospray. Utiliser les douilles appropriées et serrez les connexions pour un fonctionnement sans fuite de l’interface de CE-ESI. Se reporter aux précédents protocoles31,32 pour plus de détails sur le montage et le dépannage de cette interface.
- À l’aide d’un porte-plaque, monter l’interface de CE-ESI sur une scène de trois axes de translation et positionner la pointe d’émetteur electrospray ~ 2 mm de l’orifice du spectromètre de masse (Figure 1C).
- Aux propres composants de l’interface, rincer en fournissant la solution de gaine electrospray par l’intermédiaire de l’émetteur par électronébulisation à 1 µL/min et le BGE grâce à la séparation de CE capillaire. Pompes à seringue permet de nourrir les solvants à un rythme régulier.
- Rincer le capillaire de séparation CE avant chaque mesure en connectant une seringue à la fin de l’aspiration capillaire. Utiliser des seringues suffisamment importantes pour minimiser les remplissage et amorçage de câbles d’alimentation solvant.
Remarque : Expériences typiquement utilisent 1 mL seringues étanches au gaz pour alimenter le solvant de gaine électrospray et une seringue de 500 µL de rincer le capillaire de séparation.
- Validation de la plate-forme de CE-ESI-MS et la mesure des métabolites
Remarque : Cette étape vise à confirmer la sensibilité analytique de l’instrument de CE-ESI-MS quotidiennement avant d’analyser des extraits de cellules individuelles.
- Après le rinçage, la séparation capillaire pendant environ 5 min, transférer son entrée dans la solution BGE, située dans une cuvette d’acier inoxydable.
- Positionner la pointe d’émetteur electrospray ~ 2 mm de l’orifice du spectromètre de masse et amende-régler cette distance en utilisant une traduction pour générer electrospray dans le régime de cône-jet stable tout en surveillant la pulvérisation à l’aide d’un stéréomicroscope (voir les références 31,,45). Contrôler la stabilité de l’ion totale actuelle (TIC) pour environ 30-45 min pour assurer un fonctionnement stable.
- Appliquer environ 20 kV dans le flacon BGE par progressivement montée en puissance du potentiel de plus de 15 ans ~ s, généralement générer ~7.5 µA actuelle à travers le capillaire de séparation à l’aide de l’acide formique 1 % comme le BGE. Avant chaque mesure, assurer la stabilité du système de surveillance du profil TIC pendant ~ 5-10 min et ensuite lavage abaisser le potentiel de séparation (CE) à 0V (sol).
NOTE : Semi automatiser ce processus, nous utilisons un logiciel d’écriture personnalisée pour télécommander le CE haute tension électrique d’alimentation31. Si la plate-forme CE-ESI-MS est instable, soigneusement évaluer la source de l’instabilité en testant la plate-forme CE-ESI-MS tout d’abord en mode ESI seule et ensuite dans le mode de fonctionnement de CE-ESI comme recommandé ailleurs31. Brièvement, pour tester la plateforme en mode ESI seule, éteignez la haute tension CE et surveiller le TIC pour ~ 30 min dans le régime de pulvérisation de cône-jet. Pour les erreurs d’adresse si nécessaire, procédez comme suit : (i) vérifier les connexions pour déceler les fuites ; (ii) nettoyer l’émetteur electrospray avec eau, alcool isopropylique, eau et méthanol ; (iii) gaz de solvants ; (iv) l’émetteur pendant environ 25 min à égalité avant de tester à nouveau. Si la plate-forme CE-ESI est trouvée stable en mode ESI seule mais devient instable au cours de la séparation de CE, inspecter le système pour Joule chauffage ou électrolyse : (i) vider le capillaire de séparation avec BGE pendant environ 25 minutes et répéter l’expérience ; (ii) utiliser les potentiels de séparation plus bas pour maintenir une réponse linéaire ohmique (c'est-à-direlinéaire CE courant contre la courbe de tension de séparation) ; (iii) inspecter le capillaire de CE responsable de dommages potentiels, tels que des fissures et éventuellement remplacer le tube capillaire. - Analyser 6 ~ nL de l’échantillon comme suit :
- Pipetter 1 µL de la solution étalon de l’acétylcholine dans le flacon d’injection.
- Transférer le capillaire de séparation à partir du flacon BGE dans le flacon d’injection.
- Soulevez la phase d’injection CE 15 cm en 1 s.
- Tenir la scène surélevée pendant 60 s hydrodynamique d’injecter 6 ~ nL de l’échantillon dans la séparation capillaire.
- Par la suite, traduire la scène à partir de niveaux (conformément à la sortie du capillaire).
- Déplacer doucement l’extrémité du capillaire inlet dans le BGE.
- Immédiatement après, la montée de la tension de CE pour démarrer la séparation électrophorétique.
- MS de début d’acquisition de données.
NOTE : Performances du système peuvent être qualifiés à l’aide de toute norme chimique. La livre de CE-ESI-MS unicellulaires abaisser les limites de détection à environ 10 nM (~ 60 amol) pour l’acétylcholine, la méthionine et histidine16. Le volume injecté (Vinj), dans le capillaire en nL, dépend de la différence de hauteur (H, cm) pendant l’injection, la densité (ρ, g cm-3) et de la viscosité (η, kg m-1s-1) de la BGE, longueur (L, m) et le rayon (r, µm) de la CE capillaire et la durée de l’injection (tinj, s). Cette relation est exprimée par la formule suivante, où g (m s-2) est l’accélération gravitationnelle :
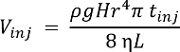
- Une fois que la norme a été détectée, arrêter d’acquisition de données, abaisser la tension de séparation par étapes de 0 V (sol), puis récupérer l’émetteur à 2 cm de l’orifice. Rincer le capillaire de séparation pendant 5 min avant d’analyser l’extrait cellulaire.
- Mesure 10 nL de la cellule unique extrait en répétant les étapes 3.3.1-3.3.5 à l’aide de 90 s à hydrodynamique injecter l’échantillon.
Remarque : Le but du traitement des données consiste à identifier et quantifier les composés entre cellules individuelles. Le protocole de CE-ESI-MS unicellulaires génère des pics electropherographic étroite avec des largeurs de base typiques de quelques secondes. En effectuant l’analyse des données semi manuellement, il est possible de trouver des caractéristiques moléculaires (valeurs unique m/z avec des temps de migration unique) en suivant les étapes suivantes. Représentante séparation apparaît pour certains métabolites identifiés dans la Figure 2 a.
- Masse-calibrer les fichiers de données brutes après acquisition de données.
Remarque : Nous utilisons des signaux de sodium formate clusters qui sont générés lors de la séparation des ions sodium abondante de l’échantillon, qui sont en mode natif présent dans les cellules ou extrait des milieux de culture d’embryons. Cette étape vise à améliorer l’identification des métabolites dans les étapes ultérieures en assurant une précision de haute masse (m/z), de préférence < mDa 5, ou < 10 ppm, entre m/z 50-1, 000. Ici, étalonnage post d’acquisition des données permet d’obtenir régulièrement des exactitudes massives < 1 mDa, ou < 2 ppm pour m/z 50-500. - À l’aide d’un script de traitement, Rechercher des caractéristiques moléculaires sur toute la gamme de masse détectée. Moyenne des spectres de masse à travers chaque pic à déterminer la masse exacte et noter leurs temps de migration correspondants. Pour l’identification des métabolites de faible masse de l’ordre de m/z 50-500, utiliser une fenêtre d’étape 500 mDa pour surveiller les caractéristiques moléculaires avec S/N > 3.
- Intégrer la pointe zone sous-la courbe pour chaque fonction moléculaire manuellement ou automatiquement. Les valeurs résultantes de la zone sont utilisées comme mesure de l’abondance de métabolite.
- Identifier les caractéristiques moléculaires d’intérêt avec le degré de confiance élevé comme suit (voir Fig.
- Tout d’abord, comparer la masse exacte des caractéristiques moléculaires contre une base de données de métabolite (p. ex., Metlin46 et47de la BDMH) avec une précision de 10 ppm pour obtenir une liste de correspondances de massives putatifs.
- Ensuite, évaluer ces matches de massives en comparant leur spectre de masse en tandem obtenu à partir de la cellule extraits avec les données disponibles dans les bases de données de métabolite ou le spectre de masse en tandem mesurée du produit correspondant chimique standard.
- Enfin, valider ces cessions en comparant le temps de migration des caractéristiques moléculaires enregistré dans les extraits de cellules avec des normes chimiques analysés par le même instrument et CE-ESI-MS.
Remarque : Pour améliorer le débit expérimental, nous identifions typiquement seulement les caractéristiques moléculaires qui sont statistiquement significativement différents entre les conditions expérimentales ou de types de cellules. Identifications représentatifs sont indiquées à la Figure 2. Pour identifier des métabolites avec une grande précision de masse, nous recommandons de calibrage externe tous les jours, le spectromètre de masse procéder recalibrage en temps réel lors de chaque mesure à l’aide d’un étalon interne et/ou externe masse-calibrer chaque mesure acquisition de données post de fichier (par exemple, pour les clusters de formiate de sodium ici) sont recommandés.
NOTE : Dans nos expériences, de plates-formes logicielles en ligne47 ont été utilisés pour effectuer toutes les étapes de l’analyse ultérieure des données, comme suit : J’ai) filtrage des caractéristiques moléculaires avec apparition au moins 50 % de chaque ensemble d’échantillons (par exemple, cellule type) ; II) normalisation des données ; III) statistique (p. ex., t-test) et l’analyse de données multivariées, telles que l’analyse en composantes principales (PCA) et analyse de groupement hiérarchique (HCA). Nous utilisons p < 0,05 (de Student t-test) pour marquer la signification statistique et pli-changement ≥ 1,5 de noter l’importance biologique.
Résultats
Nous avons récemment utilisé microsonde unicellulaires CE-ESI-MS pour caractériser les métabolites dans des cellules individuelles identifiés à développer librement des embryons de Xenopus laevis 29,30. La microsonde permet rapide (~ 5 sec/cellule), in situ l’aspiration d’environ 10 nL d’une cellule individuelle, des aspirations multiples de la même cellule ou plusieurs cellules différentes au sein...
Discussion
Microprobe CE-ESI-MS permet la caractérisation directe des métabolites dans des cellules individuelles en direct, librement des embryons en développement. Au cœur de l’approche sont deux sous-composants techniques, à savoir in situ les Microprélèvement capillaire et haute sensibilité CE-ESI-Mme comparativement à germes entiers dissection, Microprélèvement capillaire a l’avantage d’un fonctionnement rapide (quelques secondes par rapport à 5 min / élément de dissection), compatibilité avec la ...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par les instituts nationaux de santé subventions GM114854 (pour avis) et CA211635 (pour avis), le Arnold et Mabel Beckman Foundation Beckman Young Investigator grant (pour avis), le prix DuPont jeune professeur (pour avis), l’American Society for Mass Bourse de recherche de spectrométrie (pour avis) et bourses de la Fondation du Club COSMOS (à R.M.O. et E.P.P.). Les opinions et les conclusions exprimées dans cette publication sont celles des auteurs et ne reflètent pas nécessairement l’opinion officielle des sources de financement.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents for Embryo Culture Media | |||
| Potasium chloride | Fisher Scientific | BP 366-1 | |
| Magnesium sulfate | Fisher Scientific | M 65-3 | |
| Calcium nitrate | Sigma Aldrich | C1396 | |
| Cysteine | MP Biomedicals | 101444 | |
| Trizma hydrochloride | Sigma Aldrich | T3253 | |
| Trizma base | Sigma Aldrich | T1503 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Name | Company | Catalog Number | Comments |
| Metabolite Extraction Solvents | |||
| Acetonitrile (LC-MS-grade) | Fisher Scientific | A955 | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Name | Company | Catalog Number | Comments |
| Solvents and Standards for CE-ESI-MS | |||
| Formic acid (LC-MS-grade) | Fisher Scientific | A11710X1-AMP | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456-4 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Acetylcholine chloride | Acros Organics | 159170050 | |
| Name | Company | Catalog Number | Comments |
| Microprobe Fabrication Setup | |||
| Micropippette puller | Sutter Instrument Co. | P-1000 | |
| Borosilicate capillaries | Sutter Instrument Co. | B100-50-10 | |
| Fine sharp forceps: Dumont #5, Biologie/Dumoxel | Fine Science Tools (USA) Inc | 11252-30 | Corrosion resitant and autoclavable. |
| Name | Company | Catalog Number | Comments |
| Microprobe Sampling Setup | |||
| Micromanipulator | Eppendorf, Hauppauge, NY | TransferMan 4r | |
| Stereomicroscope | Nikon | SMZ18 | Should be vibrationally isolated. |
| Illuminator e.g. Goosenecks | Nikon | C-FLED2 | |
| Microinjector | Warner Instrument, Handem, CT | PLI-100A | |
| Transfer pipettes (Plastic, disposable) | Fisher Scientific | 13-711-7M | |
| Petri dish 60 mm and 80 mm | Fisher Scientific | S08184 | |
| Glass Pasteur Pipets ( Borosilicate, disposable) | Fisher Scientific | 13-678-20A | |
| Centrifuge | Thermo Scientific | Sorvall Legend X1R | |
| Name | Company | Catalog Number | Comments |
| CE-ESI-MS Setup | |||
| High voltage power supply | Spellman | CZE1000R | The HVPS may be controlled remotely using a low-voltage program generated by a personal computer. Caution: High voltage presents electrical shock hazard; all connective parts must be grounded or carefully shielded to prevent users from accidental exposure. |
| Syringe pumps (2) | Harvard Apparatus | 704506 | |
| Stereomicroscope | Amscope | SM-3BZZ | Stereomicroscope capable of 4.5× magnification, equipped with an illuminator to monitor the spraying mode of the CE-ESI interface. |
| XYZ translation stage | Thorlabs | PT3 | |
| XYZ translation stage | Custom-built | This platform is capable of loading nanoliter-amounts of sample into the separation capillary via hydrodynamic injection and supplying the BGE for CE. Both interfaces described in this work were able to inject 6–10 nL of sample within 1 min into a 1 m separation capillary | |
| Stainless steel sample vials | Custom-built | ||
| Stainless steel BGE vial | Custom-built | ||
| Fused silica capillary (40 µm/105 µm ID/OD; 100 cm) | Polymicro technologies | TSP040105 | |
| Fused silica capillary (75 µm/360 µm ID/OD; 100 cm) | Polymicro technologies | TSP075375 | |
| Stainless steel emitter with blunt tips (130/260 µm ID/OD) | Hamilton Co. | 21031A | For better performance, laser-cleave and fine-polish the emitter tip. |
| Syringes (gas-tight): 500 - 1000 µL | Hamilton Co. | 1750TTL | |
| Digital multimeter | Fluke | Fluke 117 | |
| High-resolution Mass Spectrometer | Bruker Daltonics | Maxis Impact HD | High-resolution tandem mass spectrometer equipped with an atmospheric-pressure interface configured for ESI |
| Tunning mixture for mass spectrometer calibration | Agilent technologies | ESI-L G1969-85000 | |
| Data Analysis ver. 4.3 software | Bruker Daltonics | ||
| Name | Company | Catalog Number | Comments |
| Ancillary Equipment | |||
| Vacuum concentrator capable of operation at 4–10°C | Labconco | 7310022 | |
| Analytical microbalance (XSE105DU) | Fisher Scientific | 01911005 | |
| Freezer (-20 °C) | Fisher Scientific | 97-926-1 | |
| Freezer (-80 °C) | Fisher Scientific | 88300ASP | |
| Refrigerated Incubator | Fisher Scientific | 11475126 | |
| Vortex-mixer | Benchmark | BS-VM-1000 |
Références
- Tang, F. C., Lao, K. Q., Surani, M. A. Development and applications of single-cell transcriptome analysis. Nat. Methods. 8 (4), S6-S11 (2011).
- Veselovska, L., et al. Deep sequencing and de novo assembly of the mouse oocyte transcriptome define the contribution of transcription to the DNA methylation landscape. Genome Biol. 16 (209), (2015).
- Tran, D. A., Bai, A. Y., Singh, P., Wu, X. W., Szabo, P. E. Characterization of the imprinting signature of mouse embryo fibroblasts by RNA deep sequencing. Nucleic Acids Res. 42 (3), 1772-1783 (2014).
- Wang, D. J., Bodovitz, S. Single cell analysis: the new frontier in 'omics'. Trends Biotechnol. 28 (6), 281-290 (2010).
- Svatos, A. Single-cell metabolomics comes of age: new developments in mass spectrometry profiling and imaging. Anal. Chem. 83 (13), 5037-5044 (2011).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nat. Methods. 8 (4), S20-S29 (2011).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat. Biotechnol. 30 (9), 858-889 (2012).
- Rubakhin, S. S., Lanni, E. J., Sweedler, J. V. Progress toward single cell metabolomics. Curr. Opin. Biotechnol. 24 (1), 95-104 (2013).
- Kleparnik, K., Foret, F. Recent advances in the development of single cell analysis: A review. Anal. Chim. Acta. 800, 12-21 (2013).
- Zenobi, R. Single-cell metabolomics: Analytical and biological perspectives. Science. 342 (6163), 1243259 (2013).
- Gholipour, Y., Erra-Balsells, R., Nonami, H. In situ pressure probe sampling and UV-MALDI MS for profiling metabolites in living single cells. Mass Spectrom (Tokyo). 1 (1), A0003 (2012).
- Comi, T. J., Do, T. D., Rubakhin, S. S., Sweedler, J. V. Categorizing cells on the basis of their chemical profiles: progress in single-cell mass spectrometry. J. Am. Chem. Soc. 139 (11), 3920-3929 (2017).
- Lombard-Banek, C., Portero, E. P., Onjiko, R. M., Nemes, P. New-generation mass spectrometry expands the toolbox of cell and developmental biology. Genesis. 55, e23012 (2017).
- Yang, Y. Y., et al. Single-cell analysis by ambient mass spectrometry. Trac-Trends Anal. Chem. 90, 14-26 (2017).
- Lanni, E. J., Rubakhin, S. S., Sweedler, J. V. Mass spectrometry imaging and profiling of single cells. J. Proteomics. 75 (16), 5036-5051 (2012).
- Onjiko, R. M., Moody, S. A., Nemes, P. Single-cell mass spectrometry reveals small molecules that affect cell fates in the 16-cell embryo. Proc. Natl. Acad. Sci. U. S. A. 112 (21), 6545-6550 (2015).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass Spectrom. 43 (12), 1692-1700 (2008).
- Nakashima, T., et al. Single-cell metabolite profiling of stalk and glandular cells of intact trichomes with internal electrode capillary pressure probe electrospray ionization mass spectrometry. Anal. Chem. 88 (6), 3049-3057 (2016).
- Pan, N., et al. The single-probe: A miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Guillaume-Gentil, O., et al. Single-cell mass spectrometry of metabolites extracted from live cells by fluidic force microscopy. Anal. Chem. 89 (9), 5017-5023 (2017).
- Saha-Shah, A., Green, C. M., Abraham, D. H., Baker, L. A. Segmented flow sampling with push-pull theta pipettes. Analyst. 141 (6), 1958-1965 (2016).
- Hu, J., et al. Synchronized polarization induced electrospray: Comprehensively profiling biomolecules in single cells by combining both positive-ion and negative-ion mass spectra. Anal. Chem. 88 (14), 7245-7251 (2016).
- Zhang, L. W., Vertes, A. Energy charge, redox state, and metabolite turnover in single human hepatocytes revealed by capillary microsampling mass spectrometry. Anal. Chem. 87 (20), 10397-10405 (2015).
- Zhang, L. W., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Lapainis, T., Rubakhin, S. S., Sweedler, J. V. Capillary electrophoresis with electrospray ionization mass spectrometric detection for single-cell metabolomics. Anal. Chem. 81 (14), 5858-5864 (2009).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Metabolic differentiation of neuronal phenotypes by single-cell capillary electrophoresis electrospray ionization mass spectrometry. Anal. Chem. 83 (17), 6810-6817 (2011).
- Aerts, J. T., et al. Patch clamp electrophysiology and capillary electrophoresis mass spectrometry metabolomics for single cell characterization. Anal. Chem. 86 (6), 3203-3208 (2014).
- Onjiko, R. M., Morris, S. E., Moody, S. A., Nemes, P. Single-cell mass spectrometry with multi-solvent extraction identifies metabolic differences between left and right blastomeres in the 8-cell frog (Xenopus) embryo. Analyst. 141 (12), 3648-3656 (2016).
- Onjiko, R. M., Plotnick, D. O., Moody, S. A., Nemes, P. Metabolic comparison of dorsal versus ventral cells directly in the live 8-cell frog embryo by microprobe single-cell CE-ESI-MS. Anal. Methods. , (2017).
- Onjiko, R. M., Portero, E. P., Moody, S. A., Nemes, P. In situ microprobe single-cell capillary electrophoresis mass spectrometry: Metabolic reorganization in single differentiating cells in the live vertebrate (Xenopus laevis) embryo. Anal. Chem. 89, 7069-7076 (2017).
- Nemes, P., Rubakhin, S. S., Aerts, J. T., Sweedler, J. V. Qualitative and quantitative metabolomic investigation of single neurons by capillary electrophoresis electrospray ionization mass spectrometry. Nat. Protoc. 8 (4), 783-799 (2013).
- Knolhoff, A. M., Nemes, P., Rubakhin, S. S., Sweedler, J. V., Wevers, R., Lutz, N., Sweedler, J. V. . Methodologies for Metabolomics. , 119-139 (2013).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: a laboratory manual. , (2000).
- Moody, S. A. Cell lineage analysis in Xenopus embryos. Methods Mol Biol. 135, 331-347 (2000).
- Bowes, J. B., et al. Xenbase: a Xenopus biology and genomics resource. Nucleic Acids Res. 36, D761-D767 (2008).
- Karpinka, J. B., et al. Xenbase, the Xenopus model organism database; new virtualized system, data types and genomes. Nucleic Acids Res. 43 (D1), D756-D763 (2015).
- James-Zorn, C., et al. Xenbase: expansion and updates of the Xenopus model organism database. Nucleic Acids Res. 41 (D1), D865-D870 (2013).
- Moody, S. A. Fates of the blastomeres of the 16-cell stage Xenopus embryo. Dev. Biol. 119 (2), 560-578 (1987).
- Moody, S. A. Fates of the blastomeres of the 32-cell-stage Xenopus embryo. Dev. Biol. 122 (2), 300-319 (1987).
- Dale, L., Slack, J. M. W. Fate map for the 32-cell stage of Xenopus laevis. Development. 99 (4), 527-551 (1987).
- Klein, S. L. The first cleavage furrow demarcates the dorsal-ventral axis in Xenopus embryos. Dev. Biol. 120 (1), 299-304 (1987).
- Rollman, C. M., Moini, M. Ultrafast capillary electrophoresis/mass spectrometry of controlled substances with optical isomer separation in about a minute. Rapid Commun. Mass Spectrom. 30 (18), 2070-2076 (2016).
- Moini, M., Martinez, B. Ultrafast capillary electrophoresis/mass spectrometry with adjustable porous tip for a rapid analysis of protein digest in about a minute. Rapid Commun. Mass Spectrom. 28 (3), 305-310 (2014).
- Huhn, C., Ramautar, R., Wuhrer, M., Somsen, G. W. Relevance and use of capillary coatings in capillary electrophoresis-mass spectrometry. Anal. Bioanal. Chem. 396 (1), 297-314 (2010).
- Nemes, P., Marginean, I., Vertes, A. Spraying mode effect on droplet formation and ion chemistry in electrosprays. Anal. Chem. 79 (8), 3105-3116 (2007).
- Zhu, Z. J., et al. Liquid chromatography quadrupole time-of-flight mass spectrometry characterization of metabolites guided by the METLIN database. Nat. Protoc. 8 (3), 451-460 (2013).
- Wishart, D. S., et al. HMDB 3.0 The Human Metabolome Database in 2013. Nucleic Acids Res. 41 (D1), D801-D807 (2013).
- Liu, J. X., Aerts, J. T., Rubakhin, S. S., Zhang, X. X., Sweedler, J. V. Analysis of endogenous nucleotides by single cell capillary electrophoresis-mass spectrometry. Analyst. 139 (22), 5835-5842 (2014).
- Hubrecht, L., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin). A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1967).
- Grant, P. A., Herold, M. B., Moody, S. A. Blastomere explants to test for cell fate commitment during embryonic development. J. Vis. Exp. (71), (2013).
- Sellick, C. A., Hansen, R., Stephens, G. M., Goodacre, R., Dickson, A. J. Metabolite extraction from suspension-cultured mammalian cells for global metabolite profiling. Nat. Protoc. 6 (8), 1241-1249 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon