Method Article
Variations sur négatif tachent les méthodes de microscopie électronique : outils pour s’attaquer à contester les systèmes
Dans cet article
Erratum Notice
Résumé
Colorant négatif EM est une technique puissante pour visualiser la structure macromoléculaire, mais différentes techniques de coloration peuvent produire des résultats variables dans une manière dépendante de l’échantillon. Ici, plusieurs approches de coloration négatives sont décrites en détail pour fournir un flux de travail initial pour s’attaquer à la visualisation de systèmes difficiles.
Résumé
Microscopie électronique de colorant négatif (me) permet l’observation relativement simple et rapide de macromolécules et complexes macromoléculaires grâce à l’utilisation de contraste améliorer colorant réactif. Bien que limitées dans la résolution d’un maximum d’environ 18-20 Å, colorant négatif EM est utile pour une variété de problèmes biologiques et fournit également un moyen rapid d’évaluation d’échantillons pour la microscopie de cryo-électronique (cryo-EM). Le workflow de colorant négatif est une méthode simple ; l’échantillon est adsorbé sur un substrat, puis une tache est appliquée, effacée et séchée pour produire une fine couche de tache dense électronique dans laquelle les particules sont intégrées. Toutefois, les échantillons individuels se nettement différemment sous diverses conditions de coloration. Cela a conduit au développement d’une grande variété de techniques de préparation du substrat, réactifs et grille à laver et éponger les techniques de coloration négatives. Déterminer la technique la plus appropriée pour chaque échantillon individuel doit être faite sur une base de cas par cas et une microscopie doit avoir accès à une variété de techniques différentes pour atteindre les résultats de la plus haute qualité de colorant négatif. Des protocoles détaillés pour les deux méthodes de préparation de substrats différents et trois différentes techniques de Blot sont fournis, et montre un exemple d’un échantillon qui montre des résultats sensiblement différents selon la méthode utilisée. En outre, la préparation de certains réactifs de coloration négatives communes et deux nouveaux Lanthanide teintures, est décrite avec la discussion au sujet de l’utilisation de chacun.
Introduction
Malgré la récente attention à la résolution révolution résultant des avancées significatives en cryo-electron microscopy1 (cryo-EM), négatif tache EM reste une technique puissante et une composante essentielle de la boîte à outils des électrons microscopistes. Une coloration négative reste encore la meilleure méthode pour une évaluation rapide d’un échantillon avant l’optimisation des conditions de cryo-grille2. Le contraste élevé et la vitesse de préparation de la grille des échantillons colorés négatifs le rend idéal pour évaluer la pureté de l’échantillon, la concentration, l’hétérogénéité et flexibilité conformationnelle3. Nombreuses structures biologiquement informatives résultent des reconstructions de colorant négatif, malgré la résolution de la technique étant limités à 18 ~ Å résolution4,5,6, et certains échantillons donnent de meilleurs résultats dans tache que cryo-EM pour diverses raisons,7.
En colorant négatif EM, la particule d’intérêt est adsorbée sur la surface d’une grille de EM et enveloppée par une matrice amorphe des taches denses d’électrons composé. Un contraste relatif élevé est obtenu entre le fond et la particule d’intérêt, avec la particule étant moins dense aux électrons que les alentours de tache8. Les particules apparaissent comme des zones claires en raison de leur pouvoir de diffusion des électrons faible par rapport à la tache environnante dense, qui disperse les électrons plus et apparaît plus sombre. Substructurales caractéristiques des particules peuvent être déduits de l’examen détaillé des images obtenues comme tache va pénétrer dans une crevasse et produire irrégulières contraste détail9.
Le processus de coloration négatif commence par la préparation d’un substrat de support sur lequel les particules de l’échantillon sont capturés et la couche de tache séchée pris en charge. Le substrat de soutien plus couramment utilisé est une couche de carbone amorphe, parfois accompagnée d’une fine couche de polyvinyle (p. ex. Formvar) ou polymère de nitrocellulose (p. ex. Collodion). Ces substrats peuvent être achetés dans le commerce ou préparés interne en utilisant les protocoles décrits ci-dessous.
Après que le soutien de substrat est préparé, l’échantillon peut être appliquée, et l’excédent de solution effacé au large. Des échantillons devraient être suspendus dans un tampon approprié pour coloration négative. Il est préférable d’éviter l’utilisation d’un tampon phosphate et de fortes concentrations de sels, ce qui peuvent donner lieu à des précipités cristallines qui peuvent obscurcir le spécimen. Les agents réducteurs, détergents, saccharose, glycérol et des concentrations élevées de nucléotides aussi il faut éviter car ils modifient également tache qualité4. Lorsque la composition du tampon n’est pas modifiable, la surface de la grille EM avec de l’eau de lavage ou un tampon plus adapté après adsorption et avant la coloration peut réduire la formation de la mémoire tampon les artefacts et généralement améliorer le fond de tache. Si les artefacts de tampon sont suspectés, il peut être instructif sur la tache une grille tampon uniquement pour déterminer si les composants de tampons sont la source des objets observés.
Après que l’échantillon est adsorbé et effacé et lavé si nécessaire, un réactif de coloration est appliqué. Une variété de réactifs ont été jugés efficaces taches négatifs (tableau 1), mais la tache doit être choisie en fonction de l’échantillon. Un « halo » de formes de tache autour de la particule en raison de ces deux le déplacement des molécules tache par les régions hydrophobes de la protéine et la répulsion par chargé de groupes. Par conséquent, la tache doit être choisie afin que l’état de protonation de n’importe quel potentiels groupements chargés sur la protéine est la même que la tache au travail pH. En face de charges de la surface de la protéine peut contribuer à une coloration positive effect, qui bien qu’une technique utile dans sa propre droite10 n’est pas dans le cadre du présent document. Les réactifs de coloration négatives plus couramment utilisés sont l’acétate d’uranyle et le formiate d’uranyle. Ces taches ont une taille de grain relativement fin (4-5 Å)9 et fournir des images de résolution supérieure au cours d’autres taches comme phospho-tungstates (8-9 Å granulométrie)9,11, de molybdate d’ammonium11et certains axée sur les lanthanides 12les taches. Formate et l’acétate d’uranyle également agissent comme un fixateur, préservant les nombreuses interactions de protéine-protéine sur une milliseconde temps échelle13, bien que le faible pH de la tache et sa propension à précipiter au pH physiologique peut être préjudiciable à certains échantillons14 . Malgré leur utilité, les sels d’uranyle présentent également des défis logistiques car ils sont toxique et légèrement radioactif, ce qui peut nécessiter spécial de manutention, de stockage, et les exigences de l’élimination, qui conduit certains utilisateurs de chercher des solutions de rechange non radioactif.
Il y a une grande variété de méthodes décrites pour la préparation du substrat, exemple d’application et la coloration des grilles d’EM. La méthode la plus appropriée à utiliser est échantillon dépendant et peut être difficile à déterminer en abordant un nouveau système. Ce manuscrit décrit deux méthodes de préparation du substrat et trois méthodes de transfert ; côté buvard, pichenette5et rapide rinçage15. Côté-Blot est le plus simple des méthodes décrites. La méthode pichenette et la méthode de consommation rapide sont plus difficiles à mettre en œuvre mais limiter le temps de contact de l’échantillon avec le film de support avant la fixation et auraient dû être divulgués afin d’améliorer la formation des artefacts de la tache pour certains échantillons5. L’objectif de ce manuscrit est donc de fournir un flux de travail initial pour s’attaquer à la visualisation de systèmes difficiles de négatif-tache EM.
Protocole
1. préparation des grilles d’EM
- Méthode de feuille de carbone
- Préparer une feuille de mica fraîchement clivé.
- Insérez doucement une aiguille de seringue de précision ou une lame de rasoir à un coin de la feuille de mica, quelques mm entre les couches. Insérer l’outil tel que proche du centre vertical de la feuille tant qu’il est possible de produire deux pièces d’environ la même épaisseur.
- Soigneusement séparer les deux moitiés de la feuille de mica. Cela peut le faire par œil ou sous un microscope à dissection.
- Couper un des coins de chacune des feuilles nouvellement clivées mica. Dans le cas où la feuille retourne dans l’évaporateur de carbone au cours de la libération de vide, du côté de carbone recouvert de la feuille peut être identifié.
- Placez la feuille de mica clivé/s dans la chambre d’un évaporateur de carbone, avec la surface fraîchement coupée vers le haut.
- Assurez-vous que l’évaporateur de carbone est installé correctement avec une électrode de carbone correctement préparée.
Remarque : La méthode de préparation des tiges de carbone varie selon les spécifications de l’évaporateur de carbone. Un protocole pour un seul instrument est le suivant jusqu'à l’étape 1.1.5.- Affûter une canne en carbone avec un taille-crayon pour avoir un bout pointu et puis de le polir avec du papier essuie-tout pour enlever toutes les bavures rugueux.
- À l’aide de papier de verre fin aplatir l’extrémité d’une tige de deuxième et nouveau polonais il lisse avec une serviette en papier.
- Placez les tiges de carbone dans l’évaporateur conformément aux instructions du fabricant. Assurer que la fin aiguisée sur la première tige fait fermement en contact avec la face aplatie de la deuxième tige.
- Placer un petit morceau de papier de filtre propre et sec partiellement sous le mica si l’épaisseur de carbone va être évaluée visuellement. Vous pouvez également placer une lame de microscope givré blanc avec une petite noisette de graisse sous vide aux côtés de mica pour mesurer l’épaisseur de carbone.
- Dépôt de carbone sur le mica conformément aux instructions du fabricant.
- Le vide de la pompe vers le bas et attendez qu’il soit à 10-5 mbar. Régler la tension de l’électrode à 4,0 V (jusqu'à 5 V peut être nécessaire selon la source de tige de carbone).
- Exécuter plusieurs courtes impulsions d’environ 3,5 s dans la durée par le biais de l’électrode pour déposer des évaporations épais de 1 à 2 nm du carbone à la surface de mica.
NOTE : Dans le courant est appliqué à la canne en carbone il s’allume en rouge et blanc puis. Ne regardez pas la lumière vive car ceci pourrait endommager vos yeux. - Permettre le carbone se déposer sur le mica jusqu'à l’épaisseur désirée, telle que mesurée par la jauge d’épaisseur de l’évaporateur de carbone ou par observation visuelle du carbone déposé sur le papier filtre ou une lame de microscope. Assurez-vous que la couche de carbone final est de 5 à 10 nm d’épaisseur.
- Si l’épaisseur de carbone est évaluée visuellement comparer la partie givrée de la lame de microscope graissée sous vide à la surface exposée, elle deviendra plus sombre, plus de carbone est déposé.
Remarque : Il n’existe aucune méthode quantitative pour déterminer l’épaisseur de carbone lors de l’utilisation de cette méthode.
- Si l’épaisseur de carbone est évaluée visuellement comparer la partie givrée de la lame de microscope graissée sous vide à la surface exposée, elle deviendra plus sombre, plus de carbone est déposé.
- Aérer la chambre à vide et retirer le revêtement carbone mica de l’évaporateur de carbone.
Remarque : Le mica enduit de carbone peut être laissé pour régler toute la nuit avant de continuer avec les étapes suivantes - Utilisez l’une des deux récipients d’eau flotter le film carbone sur les grilles de l’EM : un conteneur avec un robinet de vidange au fond afin que l’eau peut être évacuée et la couche de carbone réduit sur les grilles en attente ou une plate-forme de levage qui les grilles peuvent être définies sur sous l’eau surface, ce qui peut augmenter par la suite les grilles jusqu'à la pellicule de carbone à la surface de l’eau.
- Remplissez le réservoir avec de l’eau distillée ultrapure afin que la surface de l’eau est d’environ 5 mm du haut. Nettoyer la surface de l’eau en faisant glisser une feuille ou deux de tissus sur la surface pour enlever les particules flottantes.
- Placez un morceau de treillis en acier inoxydable propre (1 pouce de 2,5 pouces est une taille appropriée) sous la surface de l’eau.
- À l’aide de pinces fines, placer propre et sec EM grilles face vers le haut (selon la description du constructeur) sur le treillis en acier inoxydable. Pack les grilles ensemble aussi étroitement que possible, mais ne leur permettent pas se chevaucher.
- Une fois que les grilles sont disposées, tenez fermement la feuille de mica revêtues de carbone dans une paire de pinces à épiler ou pince à des films.
- Introduire la feuille de mica dans l’eau. Ce que cela se fasse à un angle très faible (environ 10 degrés).
Remarque : Le mica doit briser la surface de l’eau et submerger, tandis que le film de carbone devrait séparer le mica et flottant à la surface de l’eau. Cette étape ne doit pas être exécutée directement sur les grilles, pour éviter des dommages matériels ou contamination.- Pour réduire le risque de la volonté de film carbone ne pas séparer de la feuille de mica, marquer sur le pourtour de la feuille de mica avec une lame de rasoir ou couper un coin avec petits ciseaux avant de l’introduire dans l’eau.
- Une fois le film de carbone s’est détachée, enlevez la feuille de mica ou laisser tomber au fond du récipient.
- À l’aide de pinces à épiler à pointe fine, appliquer une pression très légère et avec des mouvements lents, guider le film carbone sur le dessus des grilles.
- Mettre la feuille de carbone au contact de la surface des grilles soit en levant lentement drainer l’eau ou l’anneau de levage, selon le type d’appareil utilisé en.
- Soulever délicatement la maille inox (maintenant avec les grilles de carbone enduit) de l’appareil et la mèche à certains de l’excès d’eau à l’aide d’un morceau de papier filtre. Faire en sorte que cela se fait en touchant le papier filtre au bord de la maille en acier, mais ne vient ne pas en contact avec les grilles ou un film de carbone.
- Placer le maillage des réseaux dans une boîte de Pétri contenant un morceau sec de papier filtre et laissez lui sécher complètement.
NOTE : Ceci est mieux affectée par séchage du jour au lendemain à la température ambiante, mais l’étape peut être accélérée en plaçant les grilles dans un four à 60 ° c environ.
- Préparer une feuille de mica fraîchement clivé.
- Flotteur et manteau (dépôts de carbone direct). Cette méthode a été décrite en détail précédemment16
- Remplir complètement un bol propre grand verre à ras bord avec de l’eau distillée donc un ménisque se forme au sommet.
- Appliquer une goutte de solution de collodion (nitrocellulose dans l’acétate d’amyle) à la surface de l’eau à l’aide d’une pipette pasteur propre, laisser la goutte à étaler et sécher complètement. Une fois sec, une fine couche de collodion flottant sur le dessus de la surface de l’eau sera visible.
- Retirer délicatement la couche de collodion, à l’aide d’un cure-dent pour enlever la poussière ou autres contaminations de la surface de l’eau.
- Appliquer une goutte de collodion deuxième à l’eau et laisser s’étaler et sécher pendant 2 à 3 minutes.
Remarque : Répétez les étapes 1.2.3-1.2.4 jusqu'à l’obtention d’une feuille libre plat et Ride de collodion. - À l’aide d’une paire de pinces fines lieu EM grilles à l’envers (selon la description du constructeur) sur la feuille flottante de collodion. Pack les grilles ensemble étroitement dans un arrangement hexagonal, mais ne leur permettent pas se chevaucher.
Remarque : Si une grille est égarée ou placée à l’envers, il est généralement préférable de le laisser en place plutôt que de risque d’endommager la feuille du collodion en essayant de le déplacer. - Une fois que toutes les grilles sont placées, poser délicatement une feuille de papier filtre sur eux. Laissez le papier se saturer par capillarité.
Remarque : Toute taille ou l’épaisseur du papier filtre est appropriée si elle couvre complètement les grilles. - Utiliser un cure-dent pour enlever toute pellicule de collodion qui s’étend au-delà du papier filtre.
- Tenez le papier filtre au bord et détachez-le de la surface de l’eau.
Remarque : Les grilles doivent rester collés au papier. - Placer le plat de papier et collodion-face vers le haut dans une boîte de Pétri et laissez-la sécher complètement.
- Placer le papier filtre avec les grilles dans la chambre d’un évaporateur de carbone avec une électrode de carbone correctement préparé comme indiqué au paragraphe 1.1.2.
- Suivez la procédure d’évaporation de carbone comme pour la méthode de feuille de carbone dans
- Attendez plusieurs secondes entre deux impulsions pour éviter une surchauffe et endommager la feuille de nitrocellulose.
Remarque : Si vous le souhaitez la couche de polymère peut être enlevée après les grilles ont été carbone enduit, bien que cette étape est rarement nécessaire. Placer le côté de carbone grilles vers le haut sur un morceau frais de papier filtre et mettre quelques gouttes d’acétone sur le livre près, mais pas sur les grilles. Permettre à l’acétone pour étaler sous les grilles et de dissoudre et d’absorber la couche de polymère.
2. préparation des réactifs de coloration négative
-
Préparation de l’acétate d’uranyle
- Porter un petit volume d’eau ultrapure à ébullition et laisser bouillir pendant 10 min dégazer soigneusement. Laisser refroidir un peu et puis l’utiliser pour dissoudre l’acétate d’uranyle (UA) à 1-2 % (p/v).
Remarque : Exécutez cette procédure dans une hotte et avec des équipements de protection individuelle appropriés. - Une fois la solution refroidie, filtrer à travers un filtre de seringue 0,2 µm ou le papier filtre.
- Stocker l’UA protégé de la lumière et à 4 ° c. La solution est stable pendant 1 an.
- Porter un petit volume d’eau ultrapure à ébullition et laisser bouillir pendant 10 min dégazer soigneusement. Laisser refroidir un peu et puis l’utiliser pour dissoudre l’acétate d’uranyle (UA) à 1-2 % (p/v).
-
Préparation du formiate d’uranyle de poudre. Cette méthode a été décrite en détail précédemment8
- Dissoudre 20 mg de poudre de formiate (UF) uranyle dans 2 mL d’eau ultrapure dégazé bouillie (comme au point 2.1.1) en le remuant.
- Tout en continuant de remuer, ajouter 8 µL de 5 M NaOH, la solution doit passer à une couleur jaune plus foncée, mais ne devrait former aucun précipité.
- Filtrer la solution sur un filtre de seringue 0,2 µm.
- Magasin la tache UF abrie de la lumière. Jeter que la tache devrait précipiter ou brun de décoloration est observée. La solution n’est stable que pendant 1 à 2 jours.
-
Préparation du formiate d’uranyle de l’acétate d’uranyle
- Précipiter 1 mL de teinture UA 1 % (p/v) en ajoutant 100 µL de 1 NaOH M.
- Centrifuger le mélange pendant 2 min à vitesse maximale dans une centrifugeuse de paillasse.
- Jetez toute surnageant et dissoudre le précipité dans 100 µL de 5 % (v/v) d’acide formique par agitation vigoureuse.
- Diluer à un volume final de 1 mL avec 900 µL d’eau ultrapure à céder la tache UF à 0,5 % (v/v) d’acide formique.
- Magasin la tache UF abrie de la lumière. Jeter la tache si toute décoloration brune ou précipitée est observée.
-
Préparation des autres réactifs de coloration
-
Préparation des taches de l’acétate de lanthanide.
- Dissoudre le Samarium Acetate (SmAc), acétate de Gadolinium (GdAc), Thulium Acetate (TmAc) ou Erbium Acetate (ErAc) à 1-2 % (p/v) dans de l’eau ultrapure.
Remarque : Si les échantillons montrent une coloration positive ou mauvaise adhérence à la grille lorsque vous utilisez ces taches, ils peuvent être acidifiés avec jusqu'à 0,5 % (v/v) d’acide formique. Une coloration positive se traduit par l’échantillon, apparaissant comme un objet sombre entouré d’un halo blanc. Mauvaise adhérence à la grille se traduira par moins de molécules qu’attendus étant observé sur la grille.
- Dissoudre le Samarium Acetate (SmAc), acétate de Gadolinium (GdAc), Thulium Acetate (TmAc) ou Erbium Acetate (ErAc) à 1-2 % (p/v) dans de l’eau ultrapure.
-
Préparation de Molybdate d’Ammonium et de Sodium Phosphotungstate
- Dissoudre la tache à 1-3 % (p/v) dans de l’eau ultrapure. Ajuster le pH à 7.0 à l’aide de 5 M NaOH, si vous le souhaitez.
-
Préparation des taches de l’acétate de lanthanide.
3. adsorbant les échantillons au carbone substrat et coloration
-
Préparation de la Surface de la grille pour exemple d’Application en rendant hydrophiles
- Placez la grille vers le haut sur une lame de microscope dans une unité de décharge de lueur.
- Traiter la grille pour un minimum de 30 s à 10 mA.
Remarque : La méthode exacte de lampe à décharge luminescente dépendra les spécifications de la pièce d’équipement utilisée. - Sinon, cela peut être accompli par irradiation aux rayons UV pendant 10 minutes à l’aide d’une table de lampe UV4.
-
Méthode de buvard côté. Cette méthode a été décrite en détail précédemment8
- Saisir le bord de la grille avec une paire de pincettes de pression négative et appliquer 3 à 5 µL de l’échantillon sur la surface de support.
- Laisser l’échantillon s’adsorber sur la surface de la grille pour 10 s à 1 min. optimiser le temps d’adsorption doit pour des échantillons individuels.
- Touchent le bord de la grille sur une feuille de papier filtre et permettre l’action capillaire retirer le liquide.
- En option : Laver la grille. Place 50 µL gouttes d’eau ultrapure ou solution tampon volatils approprié sur une feuille de film de laboratoire. Doucement, touchez la surface de carbone de la grille à la baisse et soulever une petite goutte sur la surface de la grille. Touchent le bord de la grille sur une feuille de papier filtre et permettre l’action capillaire retirer le liquide.
- Répétez cette étape de lavage autant de fois que désiré.
- Place deux 50 µL gouttes de réactif sur une feuille de film de laboratoire de coloration.
- Doucement, touchez la surface de carbone de la grille à la baisse et soulever une petite goutte sur la surface supérieure de la grille.
Remarque : Si la tache migre vers l’arrière de la grille puis la grille devrait être jeté. - Touchent le bord de la grille sur une feuille de papier filtre et permettre l’action capillaire retirer le liquide. Exécuter cette étape de coloration à deux reprises.
- Laisser la grille à air sec ou sèche sous une lampe à incandescence.
-
Pichenette méthode
- Saisir le bord de la grille avec une paire de pincettes de pression négative et appliquer 3 à 5 µL de l’échantillon sur la surface de support.
- Tenir la pince à épiler dans une main, afin que la grille soit inclinée à environ 45° autre direction, feuilleter rapidement le poignet de la main pour « flick off », la majorité de la gouttelette située au dessus de la grille.
- Facultatif : À l’aide d’une pipette Pasteur en verre, appliquez une goutte de solution de lavage à la surface d’appui et « flick off » comme en 3.2.2. Répéter au besoin.
- À l’aide d’une pipette Pasteur en verre, appliquez une goutte de réactif à la surface d’appui de coloration et « flick off » comme en 3.2.2. Répétez 1 à 3 fois tributaire de tache profondeur requise pour la visualisation de l’échantillon.
NOTE : Ce n’est pas le seul facteur qui attribue à la profondeur de la coloration finale (Voir discussion). - Enlever tache excès en touchant le bord déchiré d’un morceau de papier filtre au bord de la grille.
- Laisser la grille à air sec ou sèche sous une lampe à incandescence.
-
Méthode rapide de consommation
- Tirer 30-70 µL de tache (1 % UA habituellement utilisé) dans l’extrémité de la pipette de 200 µL, tournez la molette de volume pour aspirer 5 µL de l’air, puis dresser lavage/mélange réactif (5-30 µL), si nécessaire, suivie d’une autre petite brise et puis tirer vers le haut de 5 µL de l’échantillon.
- Poignée au bord d’une grille avec une paire de pincettes de pression négative, tenant la pince à épiler afin que la grille soit inclinée à environ 45°, à l’opposé de l’investigateur, éjecter tout le contenu de la pipette sur la face de la grille de EM enduit de carbone.
- Enlever tache excès en touchant le bord déchiré d’un morceau de papier filtre au bord de la grille.
- Laisser la grille à air sec ou sèche sous une lampe à incandescence.
Remarque : Pour toutes les méthodes, il est conseillé de glisser le bord déchiré d’une feuille de papier filtre le long de la pince jusqu'à ce qu’il atteigne la grille comme cela supprime la solution coincée entre les deux côtés de la pince, qui peut tirer la grille séchée dans les mâchoires de la pince une fois qu’ils sont ouvert. La grille dans la pince à épiler peut être également placée sur le bord d’une hotte aspirante à sécher. Le flux d’air constant peut aider à produire davantage encore la coloration.
Résultats
Tous les réactifs de coloration testés produit une coloration négative dans une certaine mesure, avec UF produisant les échantillons avec le plus grand contraste et particules plus nettes, plus détaillées. Pour les taches de lanthanide basé profondément ancré échantillons (Figure 1) ErAc et TmAc produit une coloration négative de qualité équivalente à l’UA, à en juger par l’apparente contraste et la netteté des particules colorées, avec TmAc produisant plus claire, des images plus nettes que l’ErAc. Bien que la grande taille de grain de TmAc devient apparente à fort grossissement, lorsque les particules de Virus de la mosaïque du tabac (TMV) ont été colorées avec 1 % TmAc le 23 ~ Å répéter de la particule VMT17 était clairement visible par le œil et comme une ligne méridienne couche dans la Transformée de Fourier de l’image raw. Aucun des autres lanthanides taches testés, ErAc, AMCC ou GdAc, n’était en mesure de résoudre cette fonctionnalité. Moyennes de classe ont été générés par l’extraction de segments superposés de particules TMV où la répétition hélicoïdale était visible. Les segments extraits étaient alors alignés et classé selon RELION18 pour mieux visualiser la fonction périodique (Figure 2).
Certains échantillons sont particulièrement sensibles à la méthode de coloration, tels que le muscle dérivé de protéine C. Protéine C, qui se compose d’une chaîne flexible d’Ig et de domaines Fn semblables, produit significativement différentes images en négatif-tache EM dépend de la méthode de coloration utilisés (Figure 3). Quand en utilisant la méthode côté-buvard, s’est effondré des structures annulaires sont observées, alors que lorsqu’elle est colorée par le rinçage rapide ou le claquement des méthodes, protéine C est observée comme une série de domaines qui ressemblent à des perles sur une chaîne.
| Réactif | Concentration de | pH | Type de |
| Molybdate d’ammonium | 1 - 2 % | 5 – 7 | Anionique |
| Acétate de l’erbium (ErAc) | 1 – 2 % | 6 | Cationiques |
| Acétate de gadolinium (GdAc) | 1 – 2 % | 6 | Cationiques |
| Tungstate de méthylamine | 2 % | 6 – 7 | Anionique |
| Acétate de samarium-cobalt (SmAC) | 1 % | 6 | Cationiques |
| Silicotungstate de sodium | 1 – 5 % | 5 – 8 | Anionique |
| Sodium phosphotungstate | 1 -3 % | 5 – 8 | Anionique |
| Thulium Acetate (TmAc) | 1 – 2 % | 6 | Cationiques |
| Acétate d’uranyle (UA) | 1 – 3 % | 3 – 4 | Cationiques |
| Formiate d’uranyle (UF) | 0,75 – 1 % | 3 – 4 | Cationiques |
Tableau 1 : Quelques négatifs coloration réactifs courants.

Figure 1 : les micrographies exemple du Virus de la mosaïque du tabac colorés avec différents réactifs de coloration négative (A) UF 1 % 2,5 % TmAc de (B) (C) 2,5 % ErAc. (D) 1 % UA (E) 2,5 % GdAc) et (F) 2,5 % SmAc. Barreaux de l’échelle est de 100 nm. Images représentatives de plusieurs répétitions avec plusieurs zones imagés par réplicat. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : coloration des Virus de la mosaïque du tabac avec l’acétate de Thulium (A) fort grossissement de zone d’une micrographie de TMV colorées avec 1 % TmAc. Barre d’échelle est de 20 nm. (B) de la classe moyenne des extraits segments TMV. Transformation de Fourier (C) de l’image dans réflexions panneau A affichage couche ligne 23 ~ Å. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
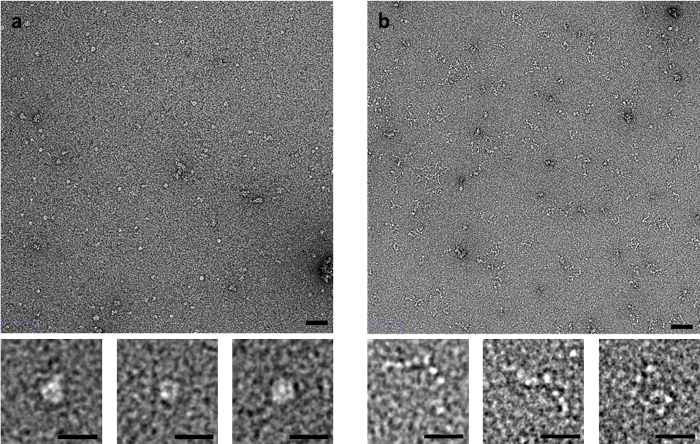
Figure 3 : effets du buvard méthode sur la conformation de la protéine-C. (A) C-protéine colorées avec l’UA, à l’aide de la méthode de tache de côté et (B) méthode pichenette. Barre d’échelle panneau supérieur est de 50 nm, barre d’échelle inférieure panneau est de 20 nm. Images représentatives de plusieurs répétitions avec plusieurs zones imagés par réplicat. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ce manuscrit décrit plusieurs méthodes pour une coloration négative des échantillons pour la microscopie électronique en utilisant une variété de réactifs, y compris les deux réactifs roman lanthanide (TmAc et ErAc) de coloration. Bon nombre des étapes du processus de coloration négatif doivent être optimisées pour des échantillons individuels, y compris le choix de la coloration, la quantité de détergent nécessaire le cas échéant et la technique de transfert. Ce manuscrit fournit donc une base pour les utilisateurs à développer leurs propres flux de travail pour s’attaquer à la coloration négative des systèmes difficiles.
Le choix de tache est l’échantillon fortement dépendants. Les échantillons qui sont particulièrement sensibles à un pH faible peuvent être altérées par UA ou UF, malgré les propriétés fixateur de ces taches19. Dans ces cas, les lanthanides base taches tels que TmAc ou ErAc peut être plus approprié, bien que le pH global de la préparation doit être maintenu sous le point isoélectrique de la protéine de l’échantillon afin d’éviter une coloration positive. Ceci peut être accompli en acidifiant la tache avec de l’acide acétique, si nécessaire. Pour échantillons sensibles pH particulièrement bas, les taches de tungstate ou de molybdate anioniques peut être plus efficaces. Bien que ces taches ont été découvertes à induire la formation d’artefacts dans certains cas, tels que la formation de rouleaux en lipoprotéines échantillons20. Encore une fois, le pH de la tache peut devoir être ajustée, cette fois à au-dessus du point isoélectrique de l’échantillon, afin d’éviter une coloration positive.
Lavage de l’échantillon avant la coloration peut être nécessaire si la mémoire tampon dans lequel le spécimen est maintenu a une forte composante de sel ou de phosphate. Dans de nombreux cas, lavage peut être effectuée avec l’eau ultrapure, mais pour les échantillons plus sensibles, qui peuvent se dégrader ou subissent des changements structurels lorsqu’ils sont exposés à l’eau seulement, lavage peut doivent être exécutées avec un tampon volatil de faible force ionique8. Même dans des conditions soigneusement contrôlées, lavage peut entraîner quelques réarrangement structural sur la surface de carbone21.
La méthode par laquelle une grille est établie en fonction de l’adsorption de l’échantillon, le transfert et la coloration peut également de manière significative affecter ce qui est observé. La méthode la plus appropriée est donc, encore une fois, très échantillon dépendant. Protéine C, par exemple, on observe comme une structure globulaire de la forme d’anneau après coloration de côté-blot, mais cela semble être un artefact du processus de coloration, telle que révélée lorsque les grilles sont préparées par la méthode pichenette (ou par la méthode de consommation rapide) (Figure 3 ). Dans les méthodes de chasse pichenette et rapides, le temps, que l’échantillon doit interagir avec le carbone, surface d’appui avant la fixation est réduite de15. L’échantillon connaît également des forces moins le ménisque recul à éponger avant la fixation. Cela signifie que des changements structurels dans le spécimen pouvant survenir sur le temps d’absorption prolongée sur le film de carbone ou par l’intermédiaire d’action capillaire sont réduits au minimum. La méthode de consommation rapide peut également servir pour l’analyse temporelle des spécimens. L’échantillon peut être mélangé avec un ligand ou additif dans une pipette pour un ensemble période de temps avant l’application d’une grille ou momentanément sur la surface de la grille avant la fixation de quelques millisecondes.
La profondeur de la tache doit fournir des images optimales d’un spécimen particulier est de nouveau échantillon dépendant2. Si la tache est trop peu profonde, les molécules peuvent être endommagés par le faisceau d’électrons, mais si la tache est trop épaisse caractéristiques structurelles peuvent être perdus. Profondeur de la tache est influencée par plusieurs facteurs tels que l’hydrophilicité de la surface de la grille, la régularité de la couche de carbone, la quantité de teinture appliquée à la grille, la durée de tache est en contact avec la grille avant d’éponger, l’étendue de l’éponger et le temps il ta KES pour la grille pour sécher complètement. Une grille n’auront pas une répartition uniforme de tache dans son intégralité et donc de la grille appropriée pour l’imagerie, les zones doivent être soigneusement sélectionnés. En effet, les grilles varient souvent en qualité même lorsque préparés le même jour dans les mêmes conditions. Un bon exemple de comment variation de profondeur de tache affecte l’apparence des molécules et la profondeur de la tache approprié pour l’imagerie est fourni par Burgess et al.,5.
Bien négative coloration qu’une méthode très polyvalente, rapide et simple, pas de tous les spécimens biologiques sont prêtent à la visualisation par cette méthode. Assemblages fragiles peuvent s’effondrer ou démonter l’adsorption, la coloration ou le séchage sur la grille de EM22. Coloration négative peut également conduire à l’aplatissement des molécules et induire des orientations préférentielles de molécules sur le carbone support film7.
Colorant négatif est un outil précieux pour l’évaluation des échantillons à part entière et aussi avant l’analyse de cryo-EM, mais des forces physiques que l’échantillon rencontre au cours du processus sont mal comprises. Par conséquent, la meilleure façon d’utiliser l’échantillon est hautement dépendant et doit être déterminée par essai-erreur plutôt qu’autodidacte suite à un protocole fixe.
Déclarations de divulgation
Les auteurs déclarent sans intérêts financiers concurrents.
Remerciements
Nous sommes extrêmement reconnaissants envers Peter Knight pour discussions utiles et un examen critique du manuscrit. Nous tenons à remercier tous les membres des laboratoires de Neil Ranson et de Stephen Muench et le personnel de laboratoire Biostructure Astbury pour discussions utiles. Ce travail a été financé par le Conseil européen de la recherche (FP7/2007-2013) / ERC Grant entente 322408. Protéine C a été produite en utilisant les ressources fournies par une subvention de la British Heart Foundation (BHF PG/13/83/30485). Nous remercions également le Wellcome Trust pour équipement pour financer la microscopie électronique à Leeds (090932/Z/09/Z et 094232/Z/10/Z). CS est financé par une subvention de ISSF Wellcome Trust.
matériels
| Name | Company | Catalog Number | Comments |
| 200 mesh copper EM grids | Sigma-Aldrich | G4776-1VL | Other materials and/or mesh sizes can also be used |
| Ammonium Molybdate | Sigma-Aldrich | 277908 | |
| Carbon evaporator | Ted Pella Inc. | 9620 | Cressington 208 or equivalent |
| Collodion solution 2% in amyl acetate | Sigma-Aldrich | 9817 | |
| Dumont #5 negative pressure tweezers | World Precision Instruments | 501202 | Or other tweezers as preferred |
| Erbium Acetate | Sigma-Aldrich | 325570 | |
| Gadolinium Acetate | Sigma-Aldrich | 325678 | |
| Mica Sheets. 75x25x0.15mm. | AGAR Scientific | AGG250-1 | |
| Microscope slides, white frosted | Fisher Scientific | 12607976 | Or equivalent |
| Parafilm | Fisher Scientific | 10018130 | Or equivalent |
| Pasteur pipette (glass) | Fisher Scientific | 10343663 | Or equivalent |
| Razor blade | Fisher Scientific | 11904325 | Or equivalent |
| Sandpaper | Hardware store | Wet and dry sandpaper with grit finer that 200 (600 suggested) | |
| Samarium Acetate | Sigma-Aldrich | 325872 | |
| Sodium Hydroxide | Sigma-Aldrich | 1.06462 | |
| Sodium Phosphotungstate | Sigma-Aldrich | P6395 | |
| Stainless Steel Mesh, 150x150 mm (cut to size). | AGAR Scientific | AGG252 | |
| Thulium Acetate | Sigma-Aldrich | 367702 | |
| Two Step Carbon Rod Sharper, for 1/4" rods | Ted Pella Inc. | 57-10 | Or equivalent for carbon evaporator used |
| Ultra pure water | |||
| Uranyl Acetate | Electron Microscopy Sciences | 22400 | |
| Uranyl Formate | Electron Microscopy Sciences | 22450 | |
| Vacuum grease | Fisher Scientific | 12719406 | Or equivalent |
| Whatman #1 Filter paper. | Fisher Scientific | 1001 090 | Or equivalent |
| Whatman #40 filter paper | Fisher Scientific | 10674122 | Or equivalent |
Références
- Merk, A., et al. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell. 165 (7), 1698-1707 (2016).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Ha, J. Y., et al. Molecular architecture of the complete COG tethering complex. Nat Struct Mol Biol. 23 (8), 758-760 (2016).
- Burgess, S. A., Walker, M. L., Thirumurugan, K., Trinick, J., Knight, P. J. Use of negative stain and single-particle image processing to explore dynamic properties of flexible macromolecules. J Struct Biol. 147 (3), 247-258 (2004).
- Fabre, L., Bao, H., Innes, J., Duong, F., Rouiller, I. Negative-stain single particle EM of the maltose transporter in nanodiscs reveals asymmetric closure of MalK2 and catalytic roles of ATP, MalE and maltose. J Biol Chem. , (2017).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51 (5), 1228-1236 (2010).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6 (1), 23-34 (2004).
- Haschemeyer, R. H., Myers, R. J. . Negative Staining in Principles and Techniques of Electron Microscopy. 2, 101-147 (1972).
- Massover, W. H. Positive staining of protein molecules for electron microscopy: polyiodination of the apoferritin shell in ferritin. Ultramicroscopy. 52, 383-387 (1993).
- Harris, J. R., Bhella, D., Adrian, M. Recent Developments in Negative Staining for Transmission Electron Microscopy. Microsc Microanal. 20, 17-21 (2006).
- Hosogi, N., Nishioka, H., Nakakoshi, M. Evaluation of lanthanide salts as alternative stains to uranyl acetate. Microscopy (Oxf). 64 (6), 429-435 (2015).
- Zhao, F., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. J Struct Biol. 141, 43-52 (2003).
- Cao, B., Xu, H., Mao, C. Transmission electron microscopy as a tool to image bioinorganic nanohybrids: the case of phage-gold nanocomposites. Microsc Res Tech. 74 (7), 627-635 (2011).
- Imai, H., et al. Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules. Nat Commun. 6, 8179 (2015).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. J Vis Exp. (58), (2011).
- Kendall, A., McDonald, M., Stubbs, G. Precise determination of the helical repeat of tobacco mosaic virus. Virology. 369 (1), 226-227 (2007).
- Scheres, S. H. A Bayesian view on cryo-EM structure determination. J. Mol. Bio. 415 (2), 406-418 (2012).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy?. Ultramicroscopy. 46, 85-111 (1992).
- Garewal, M., Zhang, L., Ren, G., Kleinschmidt, J. . Lipid-Protein Interactions. Methods Mol Biol (Methods and Protocols). 974, 111-118 (2012).
- Walker, M. L., et al. Two-headed binding of a processive myosin to F-actin. Nature. 405 (6788), 804-807 (2000).
- Orlova, E. V., Saibil, H. R. Structural Analysis of Macromolecular Assemblies by Electron Microscopy. Chem Rev. 111 (12), 7710-7748 (2011).
Erratum
Formal Correction: Erratum: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems
Posted by JoVE Editors on 1/30/2020. Citeable Link.
An erratum was issued for: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems. An author name was updated.
One of the authors' names was corrected from:
Matthew G. Iadaza
to:
Matthew G. Iadanza
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon