Method Article
Préparation, Purification et l’utilisation de Liposomes contenant de l’acide gras
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Liposomes contenant la chaîne unique amphiphiles, particulièrement les acides gras, présentent des propriétés distinctes par rapport à ces diacylphospholipids contenant en raison des propriétés chimiques uniques de la seule chaîne amphiphiles. Nous décrivons ici les techniques de préparation, purification et utilisation des liposomes, composé en partie ou totalité de ces amphiphiles.
Résumé
Liposomes contenant la chaîne unique amphiphiles, particulièrement les acides gras, présentent des propriétés distinctes par rapport à ceux contenant du diacylphospholipids en raison des propriétés chimiques uniques de ces amphiphiles. En particulier, les liposomes d’acide gras améliorent caractère dynamique, en raison de la solubilité relativement élevée de la chaîne unique amphiphiles. De même, les liposomes contenant des acides gras libres sont plus sensibles aux cations divalents et de sels, en raison de l’interaction forte entre l’acide carboxylique groupes de tête et les ions métalliques. Ici, nous illustrons techniques de préparation, de purification et utilisation des liposomes, composé en partie ou totalité d’amphiphiles seule chaîne (par exemple, les acides oléique).
Introduction
Liposomes ou vésicules – compartiments délimitées par des membranes de bicouche composés de lipides amphiphiles - ont trouvé usage dans de nombreuses applications biomédicales, comme véhicules de livraison pour les produits pharmaceutiques, les modèles des membranes cellulaires et pour le développement du synthétique cellules. Nous et autres avons également employé des liposomes comme modèles de membranes de cellules primitives en début de vie. 1 , 2 , 3 , 4 en règle générale, dans ces systèmes, nous employons amphiphiles chaîne unique contenant la queue d’hydrocarbure de lipides qu’une seule (par exemple, l’acide oléique), que ces molécules sont plus simples à synthétiser sans le bénéfice des enzymes des protéines codées cellules modernes emploient.
Liposomes composés de lipides de chaîne unique sont semblables à ceux formés à partir de diacylphospholipids (p. ex., 1-palmitoyl-2-oleoyl -sn- glycéro-3-phosphocholine ou POPC) car la limite est constituée de membranes bicouches. Liposomes formés de deux classes de lipides peuvent retenir une charge dissoute et peuvent être réduits et purifiées par différentes techniques. Plusieurs différences importantes résultent les caractéristiques chimiques des lipides de chaîne unique. Vésicules, formés par des phospholipides sont stables sur une plage de pH large, tandis que les vésicules acides gras ne sont pas stables à pH neutre à légèrement base (ca. 7-9), qui exige certaines tampon de pH pour la préparation de la vésicule. La plupart du temps, ce tampon peut également contenir des molécules solubles spécifiques pour l’encapsulation de vésicules, qui peut être soit matériaux fonctionnels (p. ex., RNA) pour les réactions biochimiques compartimentées ou des colorants fluorescents simples (p. ex., calcéine ) pour la caractérisation de la vésicule.
La présence d’une chaîne unique d’hydrocarbures produit une membrane qui est plus perméable aux solutés, tant que plus dynamique. En outre, le groupe acide carboxylique tête présent dans les résultats des acides gras dans les vésicules qui sont plus sensibles à la présence de cations divalents et de sels (p. ex., Mg2 +). Le magnésium est un des plus importantes cations divalents pour catalyser des réactions biochimiques dans protocells pour les études de l’origine de la vie. Au début de la vie, avant l’évolution des enzymes de protéines sophistiqué, RNA peut avoir été le polymère dominant, en raison de sa double capacité à se répliquer et d’effectuer de catalyse. Un exemple représentatif d’un ARN nécessitant de magnésium associés réaction est non enzymatiques ARN copie, la première fois dans les années 1960. 5 lorsque les nucléotides de RNA chimiquement activés (c.-à-d. les nucléotides 2-methylimidazolide) lient à un complexe amorce-modèle préexistant, le groupe hydroxyle en 3' de l’apprêt attaque la 5'-phosphate d’un monomère activé adjacent à déplacer le groupe (c'est-à-dire 2-méthylimidazole) laissant et formes un nouveau phosphodiester bond. Cette chimie copie RNA exige une forte concentration de Mg2 +, qui doit être chélaté pour être compatible avec les acides gras protocells. 6 un autre Mg2 +-dépendante réaction est catalysé par le ribozyme hammerhead, qui est peut-être l’ARN catalytique mieux caractérisé. Cette ribozyme, qui peut être reconstitué à partir de deux courts oligonucléotides, effectue une réaction auto-clivage qui est pratique pour surveiller par un décalage de gel. Par conséquent, il est fréquemment employé comme un ribozyme de modèle dans les études de l’origine de la vie. 7 en raison d’une exigence de cette ribozyme aboutissent magnésium, liposomes sont généralement construits par un mélange d’acides gras et esters de glycérol d’acides gras, qui sont plus stables au magnésium. 8 , 9 dans le présent protocole, nous présentons les techniques nous ont mis au point pour la préparation, la manipulation, la caractérisation de ces vésicules et démontrer l’application de ces vésicules protocells à l’hôte non enzymatique RNA copie et marteau ribozyme catalyse.
Protocole
1. préparation de la vésicule
-
Préparation des couches minces
- Seringues serré de gaz permet de transférer certaine quantité de lipides comme décrit dans le tableau 1.1 au chloroforme dans un flacon en verre.
- Faire évaporer la solution obtenue sous un courant d’azote ou argon sous la hotte.
- Sous réserve de la couche mince qui en résulte au vide de la maison pendant au moins 2 h éliminer tout résidu de chloroforme. Les lipides peuvent être laissés sous vide du jour au lendemain à ce stade.
-
Réhydratation des vésicules
- Préparer 10 mL de tampon de 5 mM calcéine 250 mM tris-HCl pH 8,0 hydratation en dissolvant 31 mg de poudre de calcéine dans 2,5 mL de tampon de 1 M tris-HCl pH 8,0 et en ajoutant un autre 7,5 mL d’eau désionisée de (DI).
- Distribuer 250 µL d’au-dessus de tampon d’hydratation dans un tube à vide et ajouter 1.875 µL de 10 M de NaOH pour un final base 75 mM (½ équivalent des acides gras totaux). Transvaser la solution dans la couche mince de lipide sec aux vésicules de forme avec une concentration de lipides totaux de 0,15 M.
- Utilisation haute vitesse (> 3000 tr/min) vortexer à vortex le mélange obtenu pour 4-5 s.
- Laissez le mélange lipidique-tampon sur un agitateur rotatif basse vitesse (ca. 30 tr/min) pour se réhydrater, au moins pendant la nuit.
-
Dimensionnement des vésicules (facultatifs)
- À l’aide de pinces à épiler, appliquer un support de filtre à chaque surface intérieure des ports seringue de l’extrudeuse.
- Mouillez chaque support de filtre avec 250 mM tris-HCl, pH 8.
- À l’aide de pinces à épiler, appliquer une piste gravée 100 nm en polycarbonate des membranes à l’une de l’extrudeuse toriques et filtre prend en charge. En prenant soin de ne pas déchirer ou perforer la membrane, poussez délicatement la membrane dans le joint torique afin d’établir un bon contact entre les deux surfaces.
- Assembler l’extrudeuse, prenant soin de ne pas pour déplacer la membrane et le filtre prend en charge.
- Remplissez une seringue extrudeuse avec env. 0,5 mL de 250 mM tris-HCl, pH 8. Insérez cette seringue dans un côté de l’extrudeuse.
- Insérer une seringue vide dans l’autre côté de l’extrudeuse.
- À la main, pousser le piston de la seringue contenant un tampon lentement (≤ 50 µL/s) et vérifier que la résistance est ressentie, indiquant que la membrane gravé piste est en place et intact. Il est utile de pratiquer cette étape sans une membrane en place afin d’évaluer le niveau attendu de la résistance.
- Enlever et vider les deux seringues. Il n’est pas nécessaire de nettoyer les deux seringues à ce stade puisqu’ils contiennent tampon de composition identique à la préparation de liposomes.
- Charger la préparation liposome dans une des deux seringues.
- Remonter l’extrudeuse avec seringue contenant l’échantillon de vésicules sur le côté gauche et la seringue vide sur le côté droit.
- À la main, pousser le piston de la seringue contenant l’échantillon de vésicules très lentement (10 à 25 µL/s).
- Observer attentivement la seringue sur le côté droit de l’extrudeuse ; Clear tampon entrera au départ le côté droit de l’extrudeuse (env. 50 µL, cela est dû au volume mort intérieur de l’extrudeuse), suivie d’un petit panache de liposomes extrudés. Immédiatement cesser de pousser à ce stade, retirer la seringue sur le côté droit de l’extrudeuse et jeter cette solution.
- Remplacer la seringue sur le côté droit de l’extrudeuse et extruder jusqu'à ce que la seringue de gauche est vide.
- Inverser l’orientation de l’extrudeuse et répétez l’étape 13. Continuer pour le nombre de cycles (généralement de 7, 9 ou 11) ; un nombre impair est toujours utilisé pour liposomes non extrudés ne sont pas obtenus de la seringue contenant initialement la préparation de liposomes de réduction des effectifs avant.
- Doucement, répartissez le contenu de la seringue droite dans un tube Eppendorf et placer le tube sur un agitateur rotatif basse vitesse (ca. 30 tr/min) pendant environ 0,5 h.
- Procéder à la purification de la vésicule, comme décrit dans la Section 2. Vésicules extrudés doivent être utilisés dans les 24h ou re-extrudés avant la prochaine utilisation.
2. purification de vésicule
-
Préparation de la phase mobile de purification vésicule
- Préparer 5 mL de tampon d’hydratation 8 250 mM tris-HCl pH en ajoutant 1,25 mL de tampon tris-HCl pH 8 1 M, à 3,75 mL de l’eau distillée à un tube de Falcon de 15 mL. Puis ajoutez 37,5 µL de 10 M NaOH (½ équivalent de base par rapport à l’acide gras estérifié) dans le tampon de l’hydratation. Pipetter 235 µL d’acide oléique pur directement dans le tube Falcon résultant d’une solution de la vésicule avec 0,15 M lipides totaux.
- Utilisation haute vitesse (> 3000 tr/min) vortexer à vortex le mélange pendant 4-5 s, puis culbuter sur une faible vitesse de rotation agitateur pendant au moins 2 h. La préparation de lipides peut être laissée toute la nuit sur l’agitateur rotatif à ce stade. Filtrer la phase mobile à travers l’unité de filtre de 0,22 μm seringue avant utilisation pour enlever n’importe quel agrégat potentiels.
-
Purification des vésicules sur Sepharose
- Enlever ca. 5 mL d’éthanol boue de Sépharose 4 b de la bouteille à l’aide d’une pipette. Appliquer à une colonne de chromatographie jetable 10 mL.
- Laisser la boue pour s’installer et accréditives éthanol jusqu'à ce que l’éthanol s’approche haut du lit de résine.
- Appliquer 5 mL d’eau désionisée jusqu’au sommet de la résine et laisser accréditives pour évacuer les résidus de l’éthanol.
- Appliquer 250 mM tris-HCl, pH 8 portions de 1 à 2 mL au sommet de la résine, en appliquant une nouvelle partie chaque fois que le niveau du liquide s’approche le haut du lit de résine. Répéter pour les 3 - 5 fois.
- Fixer la colonne sur le statif, puis connectez le bout de la colonne avec robinet d’arrêt et une tubulure sur le collecteur de fraction. Ajouter une autre partie de la mémoire tampon pour rincer le tube, fermer le robinet quand le niveau du liquide dans la colonne s’approche de la partie supérieure de la résine.
- Appliquer les vésicules extrudés de Section 1 vers le haut de la résine à l’aide d’une pipette de 200 µL, en prenant soin d’appliquer la préparation de la vésicule aussi régulièrement que possible à la résine sans toucher le mur de lit ou d’une colonne de résine.
- Ouvrir le robinet pour commencer l’écoulement et commencer à accumuler des fractions dans une plaque de 96 puits. Appliquer la phase mobile de purification vésicule vers le haut du lit de résine dans 0,5 à 1 mL portions que le tampon est épuisée, en prenant soin de ne pas pour laisser le lit de résine se dessécher. S’accumuler dans les fractions 5-déposer, recueillant au moins 36 puits (trois rangées d’une plaque de 96 puits).
-
Caractérisation de la fluorescence des fractions de purification
- Prendre la plaque à 96 puits de la section précédente et de lire sur un lecteur de plaque (λex= 485 nm, λem= 515 nm).
- Tracer les données résultantes de la fluorescence sous fluorescence par rapport au nombre de fraction. Vésicules éluer tout d’abord, suivie de la fraction « désencapsulées » (Figure 1).
-
Repurification des vésicules pour surveiller les fuites de la vésicule
- Répétez les étapes de purification et caractérisation dans les Sections 2.2 et 2.3. Les vésicules qui ont conservé leur contenu n’exposera aucun Pic de soluté capsulée (ou un très petit d’environ 5 à 10 % de l’intensité du pic vésicule).
3. utilisation des vésicules en présence de magnésium
-
Utilisation de magnésium aboutissent
- Préparer et purifier des vésicules comme décrit dans les sections 1, 2.1 et 2.2.
- Préparer 1 mL de 50 mM MgCl2 solution dans un tampon 250 mM tris-HCl pH 8.0 en ajoutant 250 µL de tampon de 1 M tris-HCl pH 8,0 et 50 µL de 1 M du MgCl2 à 700 µL de DI de l’eau. Vortex pour bien mélanger.
- Pour obtenir la concentration de magnésium souhaitée de 5 mM, mélanger 0,9 mL de vésicules purifiées et 100 µL de solution de magnésium et remuer rapidement pour minimiser les perturbations de la vésicule par exposition transitoire des vésicules à forte concentration locale de magnésium.
NOTE : Mélange rapide de solution de magnésium est essentiel à la stabilité de la vésicule. Si le magnésium et les vésicules ne sont pas mélangés rapidement au vortex immédiat, quelques vésicules seront exposés à des concentrations plus élevées de magnésium, ce qui entraîne des résultats incohérents d’un échantillon à l’autre. - Laisser l’échantillon de vésicules sur un gobelet pendant au moins 30 min avant repurification comme décrit au point 2.4 pour vérifier les fuites de matières. Ajouter la même concentration de magnésium comme dans l’exemple de la vésicule à la phase mobile repurification.
-
Utilisation de magnésium lié
- Préparer et purifier des vésicules comme décrit dans les sections 1, 2.1 et 2.2.
Remarque : Utilisez ½ KOH équivalent au lieu de NaOH pour déprotoner des acides gras ; Il a été constaté que cela produit plus stables liposomes chélatés MgCl2 systèmes. - Préparer la solution de citrate de potassium 2M et ajuster le pH à 8,0 avec KOH.
- Prémélanger MgCl2 et potassium citrate au ratio spécifié (ca. 1:4 pour les vésicules de l’acide oléique stable) dans un tampon 250 mM tris-HCl pH 8.0.
- Ajouter solution de citrate de magnésium prémélangée à l’échantillon de vésicule, brièvement vortex.
NOTE : Mélangez toujours solution magnésium et ligand. N’exposez jamais de vésicules à la solution de magnésium unchelated seule. - Laisser l’échantillon de vésicules sur un gobelet pendant au moins 30 min avant repurification comme décrit au point 2.4. Ajouter la même concentration de magnésium et le citrate comme dans l’exemple de la vésicule à la phase mobile repurification.
- Préparer et purifier des vésicules comme décrit dans les sections 1, 2.1 et 2.2.
4. non enzymatiques ARN copie dans les vésicules
-
Préparation de monodispersés RNA encapsulé vésicules
- Préparer un film sec d’acide oléique comme décrit au point 1.1.
- Préparer la vésicule réhydratation tampon avec 50 µM amorce d’ARN marqué fluorescent descripteur d’ARN µM 150 et 250 mM tris-HCl pH 8.0 contenant ½ KOH équivalente par rapport à l’acide oléique.
- Ajouter 250 µL de tampon de réhydratation du film lipidique et ramenez le pied 1.2.2 et 1.2.3 pour faire des vésicules avec la concentration totale de lipides 0,15 M.
- Afin de rendre unilamellaires petites vésicules monodispersé, suivre la section 1.3 pour l’extrusion de la vésicule.
-
Purification de l’addition et de la vésicule-citrate de magnésium
- Mélangez stocks de magnésium et le citrate, puis mélanger ensuite avec l’échantillon de vésicules à une concentration finale de lipides de 0,1 M.
- Purifier les vésicules sur colonne de Sépharose 4 b taille exclusion, avec 250 mM tris-HCl pH 8,0, lipides 0,1 M et compte tenu de magnésium et le citrate comme phase mobile.
- Accumuler des fractions de la vésicule en suivante section 2.3.
-
Réaction d’extension d’amorce
- Préparer 200 mM 2-MeImpG (guanosine 5'-monophosphate 2-methylimidazolide) solution avec 250 mM tris-HCl pH 8.0. (NOTE : suivi précédent publié le protocole n°10 de synthèse 2-MeImpG.)
- Pour initier la réaction extension amorce, transfert 150 µL de la solution mère de 2-MeImpG à 450 µL d’échantillon vésicule pour atteindre une concentration finale de lipides de 75 mM et 50 mM activé monomère. Démarrer la minuterie et conserver la réaction échantillon dégringolant tout le temps.
- (Facultatif) Destinés à l’alimentation continue monomère frais, transfert 300 µL de solution de réaction à une chambre d’un laboratoire construit petit volume liposome dialyseur11 et mettre 300 µL solution dans l’autre chambre d’alimentation. La solution d’alimentation devrait contenir tous les ingrédients à la même concentration que dans la solution de réaction, à l’exception de remplacement ARN contenant des vésicules avec des vésicules vides. Chaque tour de dialyse prend 1 à 24 heures, selon l’analyte et la membrane utilisée.
- Des études cinétiques, prendre une 100 µL aliquote à chaque instant et repurify l’aliquote à travers une colonne d’exclusion de taille Sépharose 4 b avec 250 mM tris-HCl pH 8.0 comme phase mobile.
- Recueillir les fractions de vésicule dans un tube eppendorf de 1,5 mL.
- Pipetter Triton pour les fractions de la vésicule vers une finale environ 0,1 % v/v.
- Ajouter 0,5 mL d’éthanol froid dans le tube et laisser incuber à-20 ° C pendant au moins 2 h.
- Centrifuger tous ces échantillons à 16,1 × 1000 fibres de céramique réfractaire (16,1 × g) pour 10 min et doucement pipette les liquides. Lavage des pastilles de l’ARN avec 70 % éthanol froid et centrifuger à nouveau pendant 5 min. jeter le liquide et mettre le tuyau avec des boulettes de RNA sur un bloc de chaleur de 80 ° C pendant 2 min évaporer l’éthanol résiduel. Dissoudre les granules dans 50 µL de 8 M urée avec tampon de charge 1xTBE.
-
Analyse de la PAGE
- Préparer 20 % gel de PAGE en mélangeant 200 mL d’UreaGel système concentré, 25 mL de diluant, de système de UreaGel 25 mL de tampon de 10xTBE, 80 µL de TEMED et 250 mg de persulfate d’ammonium. Verser le mélange de gel entre les plaques de gel fixées (35 × 45 cm) et d’insérer le peigne rapidement. Attendez au moins 30 min jusqu'à polymérisation complète.
- Assembler la plaque de gel sur le stand de gel et de remplir les cases de gel 1xTBE gel tampon. Décoller le peigne et vider les puits avec une seringue. Les exécutez le gel avec 60 W pendant 30 min.
- Faites chauffer les échantillons sur bloc chauffant 80 ° C pendant 2 min et charger 5 µL de l’échantillon par puits.
- Allumez gel boîte de puissance et réglez gel en cours d’exécution avec la constante w à 60 W pendant 2,5 heures.
- Démonter la plaque de gel dans le peuplement de gel, essuyez la vitre et mettre une plaque entière en gel scanner pour commencer la numérisation de gel.
- Quantifier le gel avec analyse 1D ImageQuant TL. Tracer le logarithme naturel du rapport entre la quantité d’apprêt restant à un moment donné du montant initial d’apprêt / temps, correspondent à une ligne et calculer la vitesse de réaction pseudo-premier ordre (Figure 2).
5. hammerhead Self de l’ARN clivage dans les vésicules
- Préparation et purification de ribozyme encapsulé dans des vésicules
- Préparer un mince film lipidique (OA : OGM = 9:1) qu’à l’article 1.1 avec composants comme dans tableau 1.2. Remarque : les OGM chaud au moins 60 ° C pour la fusion complète avant d’utiliser.
- Préparer le tampon de réhydratation de vésicules avec 5 µM de chaque brin ribozyme hammerhead et 250 mM tris-HCl pH 8.0.
- Ajouter 250 µL de tampon de réhydratation du film lipidique et suivre la concentration lipidique étapes 1.2.2 et 1.2.3 pour faire des vésicules avec 0,15 M total.
- Afin de rendre unilamellaires petites vésicules monodispersé, suivre la section 1.3 pour l’extrusion de la vésicule.
- Purifier les vésicules sur une colonne d’exclusion de Sépharose 4 b taille, avec 250 mM tris-HCl pH 8,0, 0,15 M mixé lipides comme phase mobile.
-
Réaction de self-clivage de ribozyme Hammerhead
- Préparer une solution de magnésium et mélanger avec vésicules purifiées comme décrit à la section 3.1 pour initier la réaction de self-clivage.
- Pour les études cinétiques, prenez 100 µL du mélange à chaque instant et repurify directement cette partie aliquote à travers une colonne d’exclusion de taille Sépharose 4 b avec 250 mM tris-HCl pH 8.0 comme phase mobile. Recueillir la fraction de la vésicule.
-
Analyse de la PAGE
- Suivez les étapes 4.3.6 à 4.3.8 pour préparer l’ARN chargement d’échantillon.
- Placez commercialement casted gel TBE-urée de 15 % dans la zone de gel et remplir la boîte de gel 1xTBE gel tampon.
- Faites chauffer les échantillons sur bloc chauffant 80 ° C pendant 1 min et charger 5 µL de l’échantillon par puits.
- Exécutez le gel avec la constante 200 V pendant environ 1 h.
- Scannez le gel.
- Quantifier le gel avec un logiciel d’analyse, comme TL ImageQuant 1D, pour mesurer l’ampleur du clivage en comparant l’intensité du restant bande de RNA de substrat et l’ARN clivée fragment band (Figure 3).
6. géant acides gras vésicules pour la microscopie
-
Préparation des vésicules géant d’acide gras
- Suivez la section 1.1 et 1.3 de Table pour préparer un film mince de l’acide oléique avec 0,2 mol % de lipides fluorescent étiquetés pour une meilleure observation de membrane.
- Réhydrater les film lipidique avec 500 µL 250 mM tris-HCl pH 8.0 pour rendre les lipides de la vésicule échantillon 10 mM au total. Le tampon peut contenir des colorants fluorescents ou des molécules d’ARN, si vous le souhaitez. Laissez la vésicule échantillon culbutage du jour au lendemain.
- Préparer 150 mL de tampon de dialyse acide gras pur avec 10 mM de lipides totaux en mélangeant 470 µL d’acide oléique et 150 mL de 250 mM tris-HCl pH 8.0 contenant ½ équivalent NaOH.
- Extrudez l’échantillon vésiculaire à travers une membrane de polycarbonate 10 µm pour éliminer les gros agrégats.
- Transférer l’échantillon de vésicules dans la cassette de dialyse de grands pores de 1 µm, comme décrit précédemment. 12
- Placez la cassette de dialyse dans un bécher de 100 mL contenant 30 mL de tampon de dialyse. Agiter le bécher doucement sur un agitateur de table-top à 80-100 t/mn.
- Changer le tampon de dialyse chaque 30 min 5 fois enlever les colorants gratuits ou des ARN et des petites vésicules.
- Retirer délicatement la vésicule d’échantillon de la cassette de dialyse avec une seringue et le transfert dans un tube Eppendorf.
-
Observation de microscopie
- Déposer 10µl de vésicules sur une lame de microscope ordinaire propre et placez une lamelle de verre sur l’échantillon. Joint de couvercle en verre avec vernis à ongles transparent.
- Observer les vésicules avec un 60 X huile-dispersion ou un objectif similaire par microscopie confocale à l’aide de la source laser approprié pour la membrane fluorescent marqué, l’ARN ou l’encapsulé colorant (Figure 4).
Résultats
Généralement, nous effectuons des purifications liposome sur colonnes d’exclusion stérique. Liposome typique préparations contiennent un fluorophore quelconque. Lorsque les liposomes sont générées et extrudés, l’espèce doit être encapsulée est présente à l’intérieur et à l’extérieur les liposomes. Par épuration des liposomes sur une résine d’exclusion stérique (Sépharose 4 b), des solutés capsulées sont retenues dans les pores de la résine, tandis que les liposomes plus gros ne sont pas et Éluer la première (Figure 1 a). Rassemblant des fractions et le tracé de fluorescence par rapport au nombre de fraction (Figure 1 b) en général donne une trace de deux de pointe, avec les fractions à élution de début correspondant aux liposomes, qui sont ensuite collectés et utilisés dans des applications ultérieures.
Nous examinons fréquemment des réactions non-enzymatique primer extension, qui constituaient un moyen susceptible de réplication RNA avant l’émergence des ribozymes et axée sur la protéine ARN polymérases. Ces réactions emploient généralement un apprêt fluorescent étiqueté (Figure 2 a), qui s’étend de monomères activés. Ces réactions peuvent être surveillées par électrophorèse sur gel (Figure 2 b) et la résultante électrophérogrammes intégrée pour obtenir les constantes de vitesse pour un État donné de réaction (Figure 2).
Pour démontrer que RNA pouvait fonctionner à l’intérieur de la protocells, nous employons hammerhead ribozyme self-clivage (Figure 3 a) comme une réaction catalytique de RNA de modèle. Cette réaction nécessite gratuit Mg2 + à la catalyse, et c’est pourquoi nous avons utilisé des vésicules OA/OGM puisqu’ils sont plus stables en présence de 5 mM Mg2 +. Similaires aux réactions d’extension amorce, la réaction de self-clivage de ribozyme hammerhead peut également être surveillées par électrophorèse sur gel (Figure 3 b) et plus tard analysées afin d’acquérir la constante de vitesse dans des conditions particulières (Figure 3).
Nous avons l’image liposomes qui emploient les deux fluorescence et diascopie. Liposomes peuvent être étiquetés à l’aide de lipides fluorescents, qui donnent une étiquette de membrane (Figure 4 a), ou un soluté fluorescent dans leur lumière (Figure 4 b). Lumière transmise permet également d’observer les vésicules (également illustrées dans la Figure 4 b).
| Tableau 1.1 d’acide oléique pur dans le chloroforme | |||
| Composant | Stock | Montant | |
| Acide oléique | > 99 % | 11,7 ΜL | |
| Chloroforme | 1 mL | ||
| Tableau 1.2 acide oléique et monooléate de glycérol (9:1) dans le chloroforme | |||
| Composant | Stock | Montant | |
| Acide oléique | > 99 % | 10.5 ΜL | |
| Monooléate de glycérol | > 99 % | 1,4 ΜL | |
| Chloroforme | 1 mL | ||
| Acide oléique tableau 1.3 avec 0.2mol% Rhodamine-PE dans le chloroforme | |||
| Composant | Stock | Montant | |
| Acide oléique | > 99 % | 1,6 ΜL | |
| Rhodamine-PE dans le chloroforme | 10 mM | 20 ΜL | |
| Chloroforme | 1 mL | ||
Le tableau 1. Solutions de chloroforme de l’acide gras.
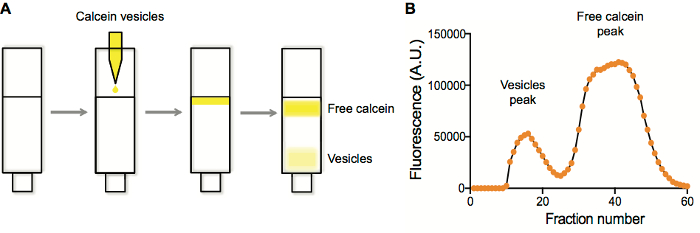
Figure 1. Vésicule purification et fluorescence caractérisation de la fraction de la purification. A. séparation des vésicules contenant de calcéine de calcéine gratuit sur une colonne de Sépharose 4 b. B. vésicule et détection de pics de calcéine gratuit en traçant la fluorescence dans chaque puits par rapport au nombre bien après la collecte de la fraction. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
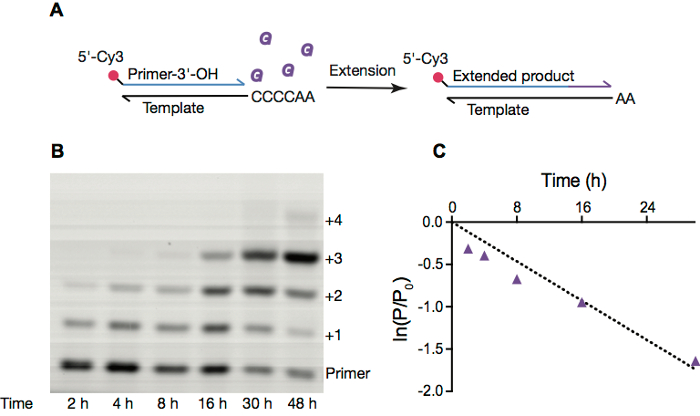
Figure 2. Réplication de RNA non enzymatique à l’intérieur de vésicules OA. A. schéma d’extension d’amorce RNA non enzymatiques. B. les image de PAGE d’une réaction d’extension amorce à l’intérieur de vésicules d’acide oléique pur, aux conditions qu’à l’article 4. C. linéaire ajustement du logarithme naturel du ratio de quantité d’apprêt reste au compte tenu du point dans le temps du montant initial de primer vs temps plus 30 h Vitesse de réaction, calculée à partir de la pente du temps de vs ln (P/P,0), est 0,058 h-1. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
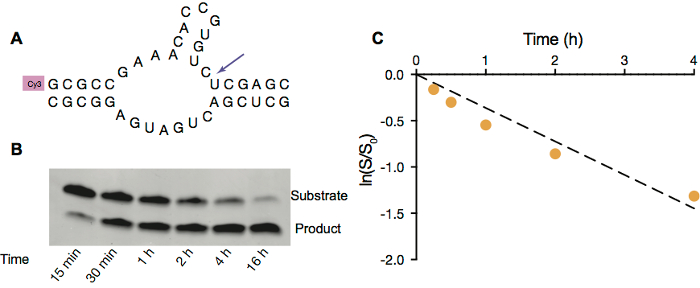
Figure 3. Clivage de ribozyme Hammerhead dans les vésicules OA/OGM. A. plan de clivage ribozyme hammerhead du brin de substrat fluorescent étiquetés (en haut). B. image de la PAGE du clivage ribozyme hammerhead à l’intérieur de vésicules OA/OGM avec 5 mM Mg2 +. C. Ribozyme activité à l’intérieur des vésicules. Ajustement linéaire du logarithme naturel du ratio de quantité de substrat restant au compte tenu du point dans le temps à la quantité de substrat / temps en h 4 première réaction initiale taux, calculé à partir de la pente du temps vs de ln (s/s,0), est de 0,36 h-1. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
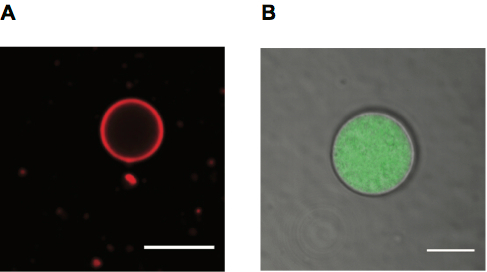
Figure 4. Vésicules de géant des acides gras pour la microscopie. A. image de microscopie confocale d’un PE de Rhodamine étiqueté acide oléique vésicule, échelle bar 10 μm. B. image de microscopie confocale d’acide oléique vésicule contenant Alexa488 étiqueté RNA avec membrane montré dans le canal de transmission détecteur (TD), échelle bar 5 μm.
Discussion
Liposomes formés à partir des acides gras ont été suggérées par beaucoup comme des modèles potentiels pour des cellules primitives en raison de leur haute perméabilité et les propriétés dynamiques. Le groupe de tête carboxylique des acides gras à chaîne unique ne permet auto-assemblage dans les membranes dans une gamme restreinte de pH, et les membranes qui en résultent sont très sensibles à la présence de sels. Ainsi, les vésicules acides gras nécessitent différente préparation et manipulation des méthodes par rapport à des vésicules phospholipidiques.
Dans ce protocole, même si nous utilisons l’acide oléique à titre d’exemple pour la formation de liposomes, autre longue chaîne des acides gras insaturés (C14) et leurs dérivés (ca. acide myristoléique, acide palmitoléique et les alcools correspondants et des esters de glycérol) constituent également des vésicules suivant la méthode de réhydratation de minces tant que la concentration de lipides totaux est au-dessus de la cmc et le pH tampon hydratation se trouve à proximité de la pKa des acides gras au sein de la membrane. Autre que tampon tris-HCl utilisé dans le présent protocole, autres systèmes tampon (ca. bicine, phosphate, borate) ont été signalés à soutenir la formation de vésicules acides gras, si vésicules formées dans un tampon phosphate ou borate sont habituellement très perméables13. Les vésicules acides gras qui en résulte après réhydratation sont polydispersés et multilamellaires, mais sont facilement converti en vésicules unilamellaires petit monodispersés par extrusion, tel que décrit. Comparé à sonication comme une méthode alternative pour générer de petites vésicules, extrusion offre plus d’options pour le contrôle de la taille de la vésicule en appliquant les membranes de taille de pore différente. Vésicules après extrusion sont généralement légèrement plus grands que la taille des pores membranaires, mais en augmentant le nombre de cycles d’extrusion, avec une granulométrie plus étroite et une taille moyenne proche de taille des pores de la membrane des vésicules peuvent être obtenus.
Pour synthétiser protocells fonctionnelle, vésicules acides gras doivent les réactions biochimiques spécifiques hôte résultant de l’encapsulation d’ARN ou d’autres blocs de construction. La méthode de réhydratation minces fournit un moyen facile de vésicules de forme contenant des matériaux encapsulés désirées. Cependant, l’efficacité d’encapsulation est relativement faible et une grande partie des matériaux précieux tels que RNA sont généralement perdues pendant le processus de purification. Dans certains cas l’efficacité de l’encapsulation peut être légèrement améliorée par cycles de gel-dégel répétés avant extrusion. Microfluidique de méthodes pour la préparation de rendement élevé de liposomes de phospholipides permettent presque efficacité d’encapsulation de 100 %, mais des méthodes analogues n’ont pas encore été développés pour vésicules acides gras.
Quelle manipulation protocells avec chélatés ou libre Mg2 +, purification après addition de solution de magnésium et repurification avant chaque instant assure l’enlèvement de fuite encapsulé matériel susceptibles d’affecter la précision de la vitesse de réaction mesures à l’intérieur des vésicules. Puisque chaque purification prend au moins 10 min pour atteindre la bonne séparation et collecter des fractions de la vésicule, l’analyse des réactions rapides est difficile, et la réaction doit être arrêtée avant la repurification de la colonne.
Le protocole que nous présentons ici est bien adapté pour la construction des liposomes d’acide gras qui hébergent des réactions imitant ceux qui pourraient se produire dans les cellules primitives. Nos protocoles permettent également des applications potentielles dans le développement de systèmes biomédicaux et autres réactions biochimiques les bioréacteurs.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrentes.
Remerciements
J.W.S. est un enquêteur du Howard Hughes Medical Institute. Ce travail a été soutenu en partie par une subvention (290363) de la Fondation Simons à J.W.S. A.E.E. tant K.P.A. souligner le soutien des fonds de démarrage de l’Université du Minnesota.
matériels
| Name | Company | Catalog Number | Comments |
| sephorose 4B | SIGMA-ALDRICH INC | 4B200 | |
| calcein | SIGMA-ALDRICH INC | C0875-10G | |
| tris-HCl pH8.0 1M | LIFE TECHNOLOGIES CORP | AM9851 | |
| citric acid | SIGMA-ALDRICH INC | 251275-500G | |
| sodium hydroxide | SIGMA-ALDRICH INC | 71690-250G | |
| potassium hydroxide | Sigma | 30614 | |
| oleic acid | Nu-Chek | U-46-A | |
| glycerol monooleate | Nu-Chek | M-239 | |
| Liss Rhodamine-PE | LIFE TECHNOLOGIES CORP | L1392 | |
| magnesium chloride | Fisher/Thermo Fisher Scientific | AM9530G | |
| sequagel concentrate | National Diagnostics | EC-830 | |
| sequagel DILUENT | National Diagnostics | EC-840 | |
| 15% TBE-UREA GEL | Thermo Fisher Scientific | EC68852BOX | |
| urea | Sigma Aldrich | U6504-500G | |
| titon-100x | SIGMA-ALDRICH INC | T9284-100ML | |
| RNA primer | IDT | 5'Cy3-GCG UAG ACU GAC UGG | |
| RNA template | IDT | 5'-AAC CCC CCA GUC AGU CUA CGC | |
| hammerhead substrate strand | IDT | 5'Cy3-GCG CCG AAA CAC CGU GUC UCG AGC | |
| hammerhead ribozyme strand | IDT | 5'GGC UCG ACU GAU GAG GCG CG | |
| vesicle extruder set | AVANTI POLAR LIPIDS | 610000 | |
| fraction collector | Gilson, Inc. | 171041 | |
| 96-well plates | Fisher | NC9995941/675 | |
| plate reader | Molecular Devices | SpectraMax i3 | |
| confocal microscope | Nikon | Nikon A1R MP Confocal | |
| gel scanner | GE Healthcare Life Sciences | Typhoon 9410 scanner |
Références
- Hanczyc, M. M., Fujikawa, S. M., Szostak, J. W. Experimental Models of Primitive Cellular Compartments: Encapsulation, Growth, and Division. Science. 302, 618-622 (2003).
- Mansy, S. S., Schrum, J. P., Krishnamurthy, M., Tobé, S., Da Treco,, Szostak, J. W. Template-directed synthesis of a genetic polymer in a model protocell. Nature. 454 (7200), 122-125 (2008).
- Apel, C. L., Deamer, D. W., Mautner, M. N. Self-assembled vesicles of monocarboxylic acids and alcohols: conditions for stability and for the encapsulation of biopolymers. Biochim. Biophys. Acta. 1559 (1), 1-9 (2002).
- Walde, P., Wick, R., Fresta, M., Mangone, A., Luisi, P. L. Autopoietic Self-Reproduction of Fatty Acid Vesicles. J. Am. Chem. Soc. 116 (26), 11649-11654 (1994).
- Sulston, J., Lohrmann, R., Orgel, L. E., Todd Miles, H. Nonenzymatic Synthesis of Oligoadenylates on a Polyuridylic Acid Template. Proc. Natl. Acad. Sci. U. S. A. 59 (3), 726-733 (1967).
- Adamala, K., Szostak, J. W. Nonenzymatic template-directed RNA synthesis inside model protocells. Science. 342 (6162), Science. New York, N.Y. 1098-1100 (2013).
- Uhlenbeck, O. C. A small catalytic oligoribonucleotide. Nature. 328 (6131), 596-600 (1987).
- Chen, I. A., Salehi-Ashtiani, K., Szostak, J. W. RNA catalysis in model protocell vesicles. J. Am. Chem. Soc. 127 (38), 13213-13219 (2005).
- Adamala, K. P., Engelhart, A. E., Szostak, J. W. Collaboration between primitive cell membranes and soluble catalysts. Nat. Commun. 7, 1-7 (2016).
- Joyce, G. F., Inoue, T., Orgel, L. E. RNA Template-directed Synthesis on Random Copolymers. J. Mol. Biol. 176, 279-306 (1984).
- Adamala, K., Engelhart, A. E., Kamat, N. P., Jin, L., Szostak, J. W. Construction of a liposome dialyzer for the preparation of high-value, small-volume liposome formulations. Nat. Protoc. 10 (6), 927-938 (2015).
- Zhu, T. F., Szostak, J. W. Preparation of large monodisperse vesicles. PloS one. 4 (4), e5009(2009).
- Zhu, T. F., Budin, I., Szostak, J. W. Vesicle extrusion through polycarbonate track-etched membranes using a hand-held mini-extruder. Methods Enzym. 533, Elsevier Inc. (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon