Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantification spatiale des drogues dans les lésions de la tuberculose pulmonaire par Laser capturer Microdissection liquide chromatographie en spectrométrie de masse (LCM-LC/MS)
Dans cet article
Résumé
Nous décrivons ici un protocole à l’aide de microdissection de saisie de laser couplée à l’analyse de LC/MS dans l’espace-quantifier des distributions de médicaments au sein des granulomes de tuberculose pulmonaire. L’approche a largement applicables à la quantification des concentrations du médicament dans les tissus à haute détails spatiaux.
Résumé
La tuberculose est toujours des principales causes de morbidité et de mortalité dans le monde. Améliorations à des régimes médicamenteux existants et le développement de nouveaux traitements sont requis de toute urgence. La capacité des antituberculeux dosé d’atteindre et de stériliser des bactéries au sein des régions nécrotiques mal vascularisé (caseum) des granulomes pulmonaires est cruciale pour une intervention thérapeutique réussie. Régimes thérapeutiques efficaces doivent donc contenir médicaments ayant des propriétés de pénétration caseum favorable. Les méthodes actuelles de LC/MS pour quantifier les concentrations du médicament dans les tissus biologiques ont limité les capacités de résolution spatiale, rend difficile de déterminer avec précision les concentrations du médicament absolue dans les milieux de petits tissus tels que ceux trouvés dans les granulomes nécrotiques. Nous présentons ici un protocole associant microdissection de saisie de laser (LCM) des régions de tissus pathologiquement distinctes avec quantification de LC/MS. Cette technique fournit quantification absolue de la drogue au sein du Granulome caseum, entourant la lésion cellulaire et tissu pulmonaire non impliqués et, donc, avec précision détermine si des concentrations bactéricides sont réalisées. Outre la recherche de la tuberculose, la technique a de nombreuses applications potentielles pour résolue spatialement quantification des drogues dans les tissus malades.
Introduction
La capacité de résoudre dans l’espace et de quantifier les concentrations du médicament est une condition essentielle pour déterminer si des médicaments antituberculeux atteint sous-populations bactériennes au sein des lésions pulmonaires à des concentrations1de stérilisation. Une importance particulière consiste à déterminer la pénétration de drogue dans le noyau nécrotique de la lésion (appelée caseum), qui généralement contient le plus grand nombre de bacilles et qui peut être difficilement accessibles aux médicaments en raison de l’absence de vascularisation.
Les méthodes traditionnelles pour évaluer la pénétration de la lésion, qui impliquent l’homogénéisation des lésions pulmonaires excisées suivie d’extraction par solvant et l’analyse de spectrométrie de masse (LC/MS) de chromatographie en phase liquide, sont hautement sensible et sélectif pour les médicaments de intérêt. Cependant, ces méthodes offrent l’information spatiale pauvre, limitée à la taille du tissu original homogénéisé. Basé sur la spectrométrie de masse des approches d’imagerie, telles que matrix-assisted laser desorption ionisation (MALDI)2,3, désorption electrospray ionisation (DESI)4 ou extraction surface liquide-enhanced5, 6 offrent des capacités d’imagerie très résolue spatialement, mais quantification directe peut être extrêmement difficile, voire impossible en raison d’effets de suppression ion hétérogènes et différentes efficacité d’extraction de l’analyte de la cellule de divers types de tissu7ou. En outre, des approches d’imagerie tissulaire MS plus directes sont intrinsèquement moins sensibles que LC/MS en raison du manque de séparation chromatographique des espèces endogènes en compétition pour l’ionisation et l’efficacité d’extraction par solvant plus faible de la drogue du tissu.
Microdissection de saisie de laser (LCM) combinée à une analyse LC/MS a été systématiquement appliquée pour isoler et caractériser des regions tissulaires distinctes pour la protéomique étudie8,9 et récemment utilisée pour la quantification de la drogue en ayant reçu une dose 10de tissus d’origine animale. Nous présentons ici un protocole optimisé appliquant LCM couplée à une analyse de LC/MS (LCM-LC/MS) afin de quantifier les antituberculeux dans les compartiments distincts de granulome. Dans le processus de microdissection laser capture, un laser UV vise à travers l’objectif de microscope sur la section de tissu, ce qui coupe et d’isole la zone de tissu désiré en suivant un tracé défini par l’utilisateur. Pour l’assistance gravitationnelle LCM (la technique utilisée pour cette étude), la section de tissu est montée sur une lame de membrane mince polymère (PET ou stylo) et le tissu est capturé dans un bouchon de tube de collection situé en bas de la diapositive. Les médicaments sont extraits des tissus excisés et quantifiées à l’aide des procédures types de LC/MS. La quantité de tissu nécessaire à recueillir est finalement déterminée de la concentration attendue du médicament présent dans le tissu et la sensibilité de la méthode LC/MS. Aire de la surface est suffisante pour la plupart des analyses de drogues dosé à des niveaux thérapeutiques et analysées à l’aide d’un spectromètre de masse quadripolaire triple systématique, 3 millions µm2 (2de 3 mm) de tissu.
Ce protocole décrit la combinaison puissante de profilage spatiale et quantification complet offert par LCM-LC/MS, fournissant des concentrations du médicament absolue dans tous les compartiments des granulomes de TB. La technique peut également être appliquée à la détermination des concentrations du médicament dans de nombreux tissus malades différents fournissant des informations de découverte et le développement de médicaments vitaux.
Protocole
Toutes les études animales ont été effectuées conformément au Guide pour le soin et l’utilisation des animaux de laboratoire de la National Institutes of Health, avec l’approbation de l’animalier institutionnel et Comité d’urbanisme de NIAID (NIH), Bethesda, MD.
1. animales Experiments and prélèvement tissulaire
Cette section du protocole décrit les procédures animales et prélèvement d’échantillons dans des conditions de biosécurité de niveau 3 (BSL3). Des protocoles détaillés de la Mycobacterium tuberculosis aérosol infection procédure and drug administration protocoles chez le lapin ont été décrits précédemment11,12.
- Infecter les lapins blancs de Nouvelle-Zélande (mâles et femelles à 4-5 mois) avec M. tuberculosis HN878 en utilisant un système aérosol nez seulement, comme décrit plus haut11.
- Administrer les médicaments choisis (Ethambutol dans l’exemple présenté ici) via la voie préférée et euthanasier les animaux à 2, 6 et 24 h après l’administration. Tout d’abord, anesthésier le lapin par une injection intramusculaire de la kétamine à 35 mg/kg et de Xylazine à 5 mg/kg. Attendre dix minutes et confirmer le bonne anesthetization en pinçant la queue et toucher doucement les yeux. S’il n’y a aucune réaction, euthanasier par administration intraveineuse de pentobarbital et de la phénytoïne (voir Table des matières) à 1 mL/4,5 kg dans 2 mL de solution saline stérile.
NOTE : Ces points sont optimales pour couvrir le profil pharmacocinétique de l’éthambutol et peuvent nécessiter de réglage/optimisation pour l’étude d’autres drogues. - À l’aide de pinces, ciseaux, et/ou scalpel, enlever les poumons de la cavité thoracique, résection des biopsies pulmonaires contenant des granulomes nécrotiques grands incorporés dans les tissus pulmonaires non impliqués (comme décrit plus haut3) environnants. Granulomes nécrotiques apparaissent beige en couleur et en général dépassent légèrement du poumon environnant de couleur rouge/rose. Pour faciliter la cryosectioning facile, veiller à ce que les biopsies ne sont pas plus grands que 2 x 1,5 x 1,5 cm.
- À l’aide de pinces, placer la biopsie sur un plateau préalablement étiquetées cryomold avec la surface de coupe souhaitée en contact direct avec la base de la barre d’État. Après la congélation, cela vous donnera une surface plate d'où cryosections sera coupées.
- Geler la biopsie en vapeur d’azote liquide. Remplir un contenant de mousse de styrol jusqu'à une profondeur de 2 pouces à l’azote liquide et placer une grille de tube métallique. Le panier doit dépasser au-dessus de la surface de l’azote liquide fournissant une surface plane sur laquelle sont placés les plateaux de tissu. Replacez le couvercle sur le récipient de styromousse et laisser les tissus pendant 10minutes de geler complètement.
- Enlever les plateaux de tissu, rapidement envelopper dans le film d’aluminium et les placer dans individuellement étiquetés seal et des sacs en plastique refermables. Transférer au congélateur-80 ° C pour le stockage.
Remarque : Les étapes 1.1 à 1.6 sont effectuées dans des conditions de BSL3 (y compris tous travaux animale et manipulation des tissus et des organes infectés). Gamma irradient les biopsies pulmonaires à 3 mégarads pour activer le traitement à l’extérieur du confinement BSL3. Microdissection de saisie de laser sur les tissus non stérilisées peut-être être effectuée au sein de la BLS3 établissement s’il est approuvé les protocoles de sécurité sont en place. Cependant, le reste du présent protocole décrit la transformation en aval dans un établissement de BSL-2.
2. tissu de sectionnement
- Définissez le cryostat à la température de coupe souhaitée. Transférer la biopsie pulmonaire irradié gamma de stockage de-80 ° C dans le cryostat et laisser pendant 30 minutes pour équilibrer la température des tissus. Remarque : -20 à-22 ° C est optimale pour les biopsies de lésions de TB.
- À l’aide de pinces à épiler, fixer la biopsie au mandrin cryostat à l’aide d’une petite quantité d’adhésif de température de coupe optimale (OCT) à adhérer à la base du tissu pour le mandrin. Orientez le tissu de sorte que la surface plane (qui était en contact avec la base de la cryomold) est la surface exposée pour la coupe. Assurer que l’OPO ne contamine pas la surface du tissu, car cela peut interférer avec l’analyse de spectrométrie de masse ultérieures.
- Coupez trois coupes de tissus à 25 µm d’épaisseur et l’installer au PET membrane diapositives. Doucement toucher la membrane à la section de tissu et le retirer. Si trop de pression est appliqué, la fine membrane peut se déchirer.
- Éviter la manipulation excessive des diapositives avant de monter, comme cela se traduira par la membrane de PET devenant chargé et mauvaise adhérence des coupes de tissus. Veiller à ce que la lame de la membrane est conservée à température ambiante pour permettre l’adhérence de dégel-montage et réussie du tissu à la membrane.
- Retirez la lame du cryostat et laisser pour sécher à l’air pendant 3 minutes. Si LCM-LC/MS/MS ne sera pas effectuée immédiatement, scellez la lame dans un petit sac scellable hermétique et transfert vers stockage de-80 ° C jusqu'à leur utilisation pour la dissection.
- Couper une section adjacente au 10-12 µm et dégel-monter sur une lame de verre standard pour l’hématoxyline et éosine (H & E) coloration et de référence. Des sections supplémentaires peuvent être coupées en ce moment pour les autres taches histochimie souhaitée (par exemple, Ziehl-Niellsen pour la visualisation de Mycobacterium tuberculosis (MTB)).
3. Microdissection
- Retirer le sachet scellé contenant la diapositive de stockage de-80 ° C et laisser à température ambiante pendant 5 minutes.
Remarque : Si la lame froide est immédiatement exposée à l’atmosphère de laboratoire, le tissu va se recouvrir de condensation, et l’intégrité spatiale de la drogue peut être compromise. - Allumez le microscope et le laser (laser nécessite 5-10 minutes d’échauffement avant découpe peut commencer). Charger des tubes PCR plat-cap 0,20 mL dans le support.
- Retirez la glissière du sac et de prendre une image optique de la section de tissu sur la diapositive de PET à l’aide d’un scanner à plat.
- Placez la lame dans le porte-lame (intrados vers le bas) et assigner des tubes de collecte sélective à des régions spécifiques granulome d’intérêt en utilisant le logiciel de microscope. En général, ceux-ci seront « poumon non impliqué, » « Granulome cellulaire », et « caseum » (Centre nécrotique), mais ils peuvent varier selon la pathologie spécifique de la Granulome/biopsie.
- Mettre l’accent sur le tissu à l’aide de la 5 X objectif de microscope. Ce grossissement devrait fournir une bonne vue d’ensemble du tissu contenant les deux zones de granulome cellulaires et nécrotiques. Dans le logiciel, sélectionnez le tube désigné « caseum » pour le déplacer dans la position sous le tissu.
- Entrez les paramètres souhaités dissection. Paramètres par défaut pour une section de poumon épais 25 µm sont laser puissance 30, vitesse 15 et ouverture 35 (unités arbitraires). Toutefois, ces différera selon le microscope utilisé et le potentiel de baisse de puissance en raison de l’âge du laser.
- Sélectionnez l’outil « dessin » et, à l’aide d’une souris ou un écran tactile stylet, décrire la région souhaitée pour la dissection. La superficie de la région s’affichera dans le logiciel. Garder les régions sélectionnées sous 500 000 µm2 (0. 5 mm2) pour faciliter la dissection plus facile. Répéter la dissection jusqu'à 3 millions µm2 (2de 3 mm) ont été collectés au total dans le capuchon du tube.
- À l’occasion, la région disséquée peut restent accrochée à la membrane environnante (par exemple en raison de l’attraction statique) et ne pas tomber dans le plafond de la collection. Supprimer ces zones de la surface cumulée totale en sélectionnant et en supprimant manuellement dans le logiciel.
- Sélectionnez le bouchon pour « lésion cellulaire » et de recueillir 3 millions µm2 du tissu suivant le même processus, comme indiqué dans l’étape de 3,7.
- Sélectionnez le bouchon pour « poumon non impliqué » et de recueillir 3 millions µm2 du tissu suivant le même processus, comme indiqué dans l’étape de 3,7. Notez que les tissus pulmonaires non impliqués contient beaucoup des bronchioles et des espaces alvéolaires. Être très attentif à exclure ces provenant des régions de tissus définis pour la dissection.
- Retirez le porte-bouchon et soigneusement dégrafer, sceller et étiqueter chaque tube. Protéger les tissus disséqués de perturbations d’air (par exemple, à partir de perturbation flux aérien d’une ouverture de porte) environnantes. Analyser les tissus disséqués immédiatement, ou stocker à-80 ° C et décongeler avant le traitement et l’analyse LCMS.
4. extraction et analyse par LCMS
- Préparer la solution d’extraction de 1:1 dans l’acétonitrile/méthanol contenant l’étalon interne d-10 éthambutol. Lorsque vous sélectionnez une norme interne, utiliser une forme stable marquée de la drogue de l’analyte (tels que EMB marqués au deutérium utilisé dans cette démonstration) avec suffisant Maj masse afin d’éviter des isotopes cross talk entre le médicament de l’analyte et la norme (généralement un minimum de 4 daltons) .
Remarque : La création de normes dans l’homogénat de chaque type de tissu respectif est difficile parce qu’il y a un contrôle très limité des tissus permettant de créer des normes de l’homogénat. Comme alternative à rendre les normes auprès d’un échantillon d’homogénat enrichis, une norme peut être créée en ajoutant le tissu blanc et composé d’essai ensemble et extraction. Un volume de tissu témoin dans un homogénat qui correspond au volume cible de l’étude des sections de tissu échantillon est associé directement à une quantité de la substance d’essai qui serait présent à une concentration donnée. - Calculer le volume de tissu ciblé basé sur la surface et l’épaisseur de la section de tissus et de déterminer le facteur de dilution nécessaire pour l’homogénat en utilisant le volume d’homogénat qui sera ajouté à la norme et les échantillons de CQ. Les calculs sont illustrées ci-dessous pour une zone cible disséqué de µm 3 millions2 (3 mm2) avec un 25 µm d’épaisseur et volume 2 µL d’homogénat.
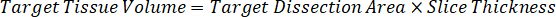
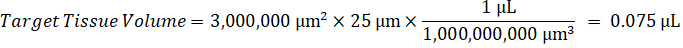
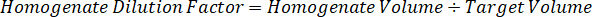

- En supposant une densité de tissu de 1 g/mL, préparer le stock de l’homogénat pesant 50 mg de tissu témoin et ajout de tampon PBS pour diluer (en utilisant le facteur de dilution de le 26,67 homogénat calculé à l’étape 4.2, le diluant est 1,283 mL). Homogénéiser au talon battant des tissus pulmonaires et tampon PBS pendant 5 minutes à 1750 tr/min sur un homogénéisateur de perle.
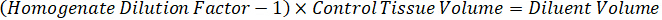
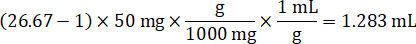
- Diluer la concentration en acétonitrile/eau de 1:1 pour créer la courbe d’étalonnage de fortification des solutions stocks du médicament de 1 mg/mL. Déterminer la concentration standard basée sur le volume de la pointe et le volume de tissu cible de fortification. L’exemple illustré est d’un standard à l’aide d’un volume de pointe 10 µL 100 ng/mL.
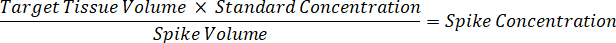
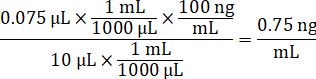
- Retirer les tubes contenant des tissus microdisséqués de stockage de-80 ° C et laisser à température ambiante pendant 5 minutes.
- Ajouter 10 µL de solution d’acétonitrile/eau de 1:1 et 2 µL de tampon PBS aux tubes contenant du tissu microdissected.
- Pour la courbe d’étalonnage et les tubes de contrôle de la qualité, ajouter 10 µL de solution de 2 µL de l’homogénat de poumon de contrôle de dopage.
- Ajouter 50 µL de solution d’extraction dans chaque tube.
- Vortex chaque tube pendant 5 minutes, laisser agir pendant 5 minutes et centrifuger à 5000 tr/min pendant 5 minutes pour former une boulette de film et de tissus dans chaque tube.
- Transférer 50 µL de liquide surnageant d’une plaque 96 puits puits profonds et diluer avec un supplémentaire 50 µL d’eau déionisée dans chaque puits.
- Effectuer une analyse de LC/MS/MS à l’aide de paramètres optimisés pour l’éthambutol et éthambutol-d10 étalon interne (comme décrit dans le détail12).
- Utiliser un facteur de dilution pour corriger le montant exact du tissu découpé pour chaque échantillon.
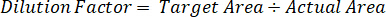
5. Validation de la méthode
- Créer un homogénat de tissu pulmonaire de contrôle en combinant 1 partie du poumon, 2 pièces PBS et 3-4 billes en acier. Battre les tissus pulmonaires et tampon PBS pendant 5 minutes à 1750 tr/min en utilisant un homogénéisateur de perle.
- Doper l’homogénat en ajoutant 10 µL de 1 mg/mL stock DMSO Ethambutol dans 990 µL homogénat de créer une concentration finale de 10 000 ng/mL (10 mg/mL) et vortex pendant 1 minute.
- Créez un bloc congelé homogénat en versant l’homogénat dans un cryomold et congélation rapide sur la glace sèche pendant 5 minutes.
- Préparer 25 µm des coupes d’épaisseur du bloc de l’homogénat comme indiqué aux paragraphes 2.1 à 2.5.
- Disséquer la zone cible de tissu tel que spécifié dans les étapes 3.2-3.10.
- Ajouter 10 µL 1:1 dans l’acétonitrile/eau et 2 µL de tampon PBS aux tubes contenant du tissu microdissected.
- Ajouter 50 µL de solution d’extraction dans chaque tube. Suivez les étapes 4,9-4.12 pour créer une courbe d’étalonnage et déterminer la concentration du médicament dans le bloc de l’homogénat tissulaire.
- Calculer le rendement d’extraction à l’aide de la formule ci-dessous :
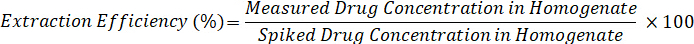
Résultats
Un aperçu de l’approche de LCM-LC/MS est illustré à la Figure 1. Après le tissu de la stérilisation par irradiation gamma, toutes les étapes subséquentes (à partir de tissus à partir de sectionnement) ont lieu en dehors des conditions BSL3. La figure 2 montre la lésion sections biopsie avant et après l’isolement des tissus par LCM. Zones nécrotiques et cellulaires des lésions de la TB peuvent être facilement ide...
Discussion
Résolue spatialement quantification des médicaments au sein des lésions pulmonaires de TB est nécessaire pour déterminer si l’exposition au médicament atteint stérilisant les concentrations de populations bactériennes qui résident dans les compartiments de différentes lésions. La méthode de LCM-LC/MS décrite ici permet une quantification absolue de médicaments antituberculeux dans tous les compartiments de la lésion, y compris le caseum riche en bactéries, en utilisant uniquement des sections de tissu 1...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Paul O'Brien, Marizel Mina et Isabella Freedman pour l’expérimentation animale, Jacquie Gonzalez et Danielle Weiner de NIH/NIAID aide avec irradiation gamma de tissus de lapin avant laser microdissection de saisie et de Jansy Sarathy manuscrit idées et conseils. Ce travail a été financé par la Bill et Melinda Gates Foundation (OPP1174780) et l’instrumentation de NIH partagé accordent 1S10OD018072. Nous remercions Eliseo A. eugénine donnant accès au microscope Leica LMD 6500 et le partage des compétences et des conseils. L’achat et soutien continu, les 6500 LMD a été financé par subvention du National Institute of Mental Health, MH096625, National Institute of Neurological Disorders and Stroke, NS105584, IRSP (à E.A.E) et de contributions de GSK (à E.A.E).
matériels
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
Références
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon