Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Protocole expérimental pour l’utilisation de drosophile comme un système modèle d’invertébrés pour les essais de toxicité en laboratoire
Dans cet article
Résumé
Dans cet article, nous fournissons un protocole détaillé d’exposer des espèces du genre Drosophila aux polluants dans le but d’étudier l’impact de l’exposition sur un éventail de sorties phénotypiques à différents stades de développement et de plusieurs générations.
Résumé
Propriétés émergentes et des facteurs externes (interactions au niveau des populations et échelle des écosystèmes, en particulier) jouent des rôles importants dans la médiation des points de terminaison écologiquement importants, mais ils sont rarement considérés dans les études toxicologiques. D. melanogaster s’impose comme un modèle de toxicologie pour les effets comportements, neurologiques et génétiques de substances toxiques, pour n’en nommer que quelques-uns. Plus important encore, les espèces du genre Drosophila peuvent être utilisés comme système modèle pour une approche intégrative d’incorporer les propriétés émergentes et de répondre à des questions pertinentes sur le plan écologique dans la recherche en toxicologie. Ce document vise à fournir un protocole permettant d’exposer des espèces du genre Drosophila aux polluants à utiliser comme modèle pour une gamme de sorties phénotypiques et des questions pertinentes sur le plan écologique. Plus précisément, ce protocole peut être utilisé pour 1) relient plusieurs niveaux biologiques d’organisation et de comprendre l’impact des substances toxiques sur les deux fitness échelle individuelle et population ; 2) tester l’impact des substances toxiques à différents stades de développement exposition ; 3) test implications multigénérationnelle et évolutive des polluants ; et 4) tester des contaminants et des facteurs de stress multiples simultanément.
Introduction
Chaque année, environ 1 000 nouveaux produits chimiques sont introduits par l’industrie chimique1,2; Cependant, les impacts environnementaux de seulement un petit pourcentage de ces produits chimiques sont testés avant distribution2,3. Bien que les catastrophes à grande échelle sont rares, exposition sublétale ou chronique d’une grande variété de polluants sont très répandues chez les humains et la faune4,5. L’historique de toxicologie environnementale et écotoxicologie visait à tester la létalité, seule exposition aux produits chimique, l’exposition aiguë et effets physiologiques d’une exposition, comme un moyen de mesurer l’impact des polluants sur la survie6, 7 , 8 , 9 , 10. bien qu’il y a un glissement vers des approches éthiques et non invasive à l’expérimentation animale, les approches actuelles limitent en raison du rôle que développement, propriétés émergentes et des facteurs externes (par exemple au niveau des populations et les interactions écosystémiques) jouent dans la médiation des points de terminaison sur le plan écologique important8. Par conséquent, il y a des méthodes qui intègrent une approche plus holistique sans pour autant sacrifier la faune ou vertébrés en laboratoire.
Systèmes modèles d’invertébrés, comme Drosophila melanogaster, sont une alternative intéressante pour répondre au besoin d’une approche plus holistique pour les essais de toxicité. D. melanogaster, a été initialement conçu comme un système modèle invertébrés recherche génétique sur l’homme près d’un siècle il y a11. D. melanogaster est maintenant utilisé en bonne place comme une alternative de vertébrés modèle pour plusieurs raisons : 1) la conservation des gènes et des voies entre d. melanogaster et les humains ; 2) temps de génération court par rapport aux modèles de vertébrés ; 3) peu coûteux frais d’entretien ; 4) faciliter dans la génération de grands échantillons de taille ; et 5) pléthore de phénotypique et écologique-les points de terminaison disponibles pour les tests de11,12,13,14,15,16,17 .
Plusieurs laboratoires11,15,16,17,18,19,20,21,22, 23 , 24 , 25 utilisent maintenant d. melanogaster comme une alternative de vertébrés de modèle pour l’évaluation toxicologique de comprendre les répercussions de la pollution sur les humains. Les espèces sauvages locales de Drosophila peuvent être utilisés, aussi bien, en tant que modèles de toxicité pour la faune (et les humains) répondre sur le plan écologique-, sur le plan comportemental-et évolutivement pertinentes questions à plusieurs niveaux biologiques de l’organisation. En espèces dans le genre de la drosophile comme modèle, plusieurs points de terminaison mesurables sont possible11,15,16,18,19,20 ,21,22,23,24,25. In addition, en utilisant le modèle de la drosophile , toxicologues peuvent : 1) sur le plan éthique lien entre les effets à plusieurs niveaux biologiques de l’Organisation ; 2) intégrer le rôle de facteurs émergents et du développement ; 3) étude des points de terminaison écologiquement importantes (en plus des points de terminaison médicalement importantes) ; 4) tester les stresseurs multiples simultanément ; 5) et essai à long terme multigénérationnelle (p. ex. évolutive et transgénérationnel) conséquences de facteurs de stress. Donc, à l’aide de drosophile comme système modèle permet une multitude d’approches, non limité à l’étude des approches mécanistes avec souches consanguines de d. melanogaster en laboratoire.
Dans cet article, nous présentons les méthodes d’élevage et de collecte de drosophile pour répondre à diverses questions toxicologiques. Plus précisément, nous décrivons la méthodologie pour 1) élevage de drosophile en milieu lacé avec un ou plusieurs polluants ; 2) collecte drosophile au cours du développement (p. ex. errant troisième stade larvaire, nymphales cas, nouvellement éclos adultes et adultes d’âge mûr) ; et 3) élevage de drosophile dans le milieu contaminé de test entre les générations et transmission transgénérationnelle, ainsi que des implications évolutives d’exposition toxique à long terme. Utilisant ce protocole, les précédents auteurs18,19,20,21,22,23,24,,25 ont signalé différents effets comportements, génétiques et physiologiques du développement (Pb2 +) exposition de plomb. Ce protocole permet d’utiliser une approche plus holistique toxicologique, qui est essentielle pour comprendre comment les polluants sont des facteurs de risque pour les humains et les animaux sauvages dans un environnement de plus en plus pollué, les toxicologues.
Access restricted. Please log in or start a trial to view this content.
Protocole
Le protocole suivant est un protocole expérimental utilisé pour élever des espèces du genre Drosophila sur milieu contaminé lors de l’ingestion orale d’une toxine est appropriée ; autres formes d’exposition sont possibles à l’aide de la drosophile modèle11,15,16,26. Les méthodes décrites dans le présent protocole ont été décrits précédemment par Hirsch et coll. 19 et Peterson et al. 23 , 24 , 25.
1. mettre en place des Populations de Stock de la drosophile dans le laboratoire de recherche
- Mettre en place une étuve respectueux de l’environnement (ou petite chambre) aux populations stock maison de drosophile en définissant les incubateurs pour une température constante, le cycle de lumière : obscurité et l’humidité, selon les préférences de l’espèce testée.
Remarque : Les conditions environnementales privilégiées varie selon l’écologie native de l’espèce choisie pour l’étude. Par exemple, d. melanogaster est originaire de l’Afrique subsaharienne27 et est généralement maintenus à 25 ° C, cycle de lumière : obscurité 12:12 et environ 60 % humidité16,18,19,20 , 21 , 22 , 23 , 24 , 25 , 28 , 29 , 30. en revanche, d. montana étend pendant la majeure partie du Canada et les États-Unis midwest, région beaucoup plus froide ; par conséquent, d. montana est généralement maintenue à 19 – 20 ° C et, parfois, un régime de lumière 24h pour simuler les conditions au cours de l' accouplement de la saison31. Pour une description plus détaillée de la répartition géographique des diverses espèces de drosophile, voir la drosophile spéciation modèles site Web32. -
Obtenir une espèce Drosophila préférée ou la lignée inbred chez soit un centre de stock (voir Table des matières), un autre laboratoire de recherche sur les populations génétiquement variables demande, ou à frais viré sauvage, sur le terrain.
Remarque : Les étapes suivantes expliquent les méthodes pour recueillir les populations sauvages, génétiquement variables de drosophile de maintenir dans le laboratoire de recherche. Ces méthodes ont été modifiés de Markow et o ' Grady33 et Werner et Jaenike34 pour recueillir la plus large diversité d’espèces à la fois, plutôt que de l’espèce cible avec une source de l’appât.- Congeler une demi-douzaine bananes mûres dans le congélateur pendant la nuit et dégivrage avant de poser des pièges à appâts.
- Préparer plusieurs litres de 1 – 2 bouteilles en plastique en coupant une fente en forme de u sur le devant de la bouteille pour permettre aux mouches d’être capturés dans la bouteille d’appât et pas de fuite. Cap des bouteilles en plastique avec leurs bouchons de bouteille afin que les mouches n’échappent pas via les couvercles.
- Ajouter la banane décongelée au fond des bouteilles afin que le fond des bouteilles contient environ un pouce du bananier. Déposer une tranche de tomate bien mûre dans la bouteille. Ajouter une suspension de levure (la levure reste du processus décisionnel de la bière) à la banane au fond de la bouteille afin que la banane obtient à tremper dans la boue de la levure.
- Ajouter les bâtons en bois (en position verticale verticale) dans le flacon afin que les mouches ont un substrat propre à pied sur le lisier de levure et de la banane.
La figure 1 illustre le produit final de ces méthodes. - Accrocher l’appât bouteilles dans les arbres pendant la nuit et vérifier que chaque aspiration de bouche de 24 h. vole hors de bouteilles et placer individuellement les femelles en flacons avec un moyen de créer des lignes iso-femelle.
NOTE : Lignes féminines multiples peuvent être créés, cependant, seulement si les femelles de chaque espèce peuvent être clairement identifiées. En outre, les mouches du genre Drosophila occupent des niches écologiques différentes et ont des besoins alimentaires différents selon ces niches (Werner et Jaenike34) ; Voir Werner et Jaenike34 recommandations de régime alimentaire et des recettes de cuisine. - Examiner la progéniture adulte F1 sous le microscope à dissection afin d’identifier les espèces de la recueillies Drosophila (voir Markow et o ' Grady33 et Werner et Jaenike34 pour l’assistance dans l’identification des diverses espèces ).

Figure 1 : Représentation picturale de pièges et d’appâts utilisés pour recueillir des populations sauvages de la drosophile dans le domaine. (A) Fly pièges à un site local dans le Colorado. (B) une vue rapprochée de la mouche pièges à cet endroit du terrain. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Maintenir l’iso-femelle ou les lignes de plusieurs femelles dans une étuve respectueux de l’environnement ou une pièce à température constante, le cycle de lumière : obscurité et l’humidité. Pour ce faire, la maison vole en flacons ou bouteilles en préféraient moyen et laisser les femelles gravides à pondre dans le milieu. Surveiller les flacons pour la présence de larves et de pupes.
Remarque : Les mouches du genre Drosophila occupent des niches écologiques différentes et auront des besoins alimentaires différents et des préférences abiotiques environnementales dépendant de ces niches33,34. Les préférences environnementales et les recommandations diététiques (et plus d’instructions sur l’élevage des mouche) se trouvent dans28Elgin et Miller, Shaffer et al. 29, stocker et Gallant30, Markow et o ' Grady33et Werner et Jaenike34. Si vous utilisez des espèces sauvages, des conditions environnementales locales peuvent être simulées dans les incubateurs jusqu'à ce que les espèces peuvent être identifiés. - Transférer les stocks fréquemment dans un milieu frais, en supprimant les vieux flacons, à maintenir des lignes en bonne santé et éviter l’infection des acariens.
Remarque : La fréquence de transfert dépendra du cycle de vie de l’espèce. Par exemple, transférer Drosophila melanogaster toutes les 2 semaines dans un milieu frais. Pour plus d’informations sur le maintien de lignes dans le laboratoire, consultez Rand et al. 16, Elgin et Miller28, Shaffer et al. 29, stocker et Gallant30, Greenspan35et sciences de l’éducation de base de données36.
2. arrière Drosophila dans le milieu contaminé
Remarque : Si le test drosophile en laboratoire pour la première fois ou avec un nouveaux contaminants, identifier la dose létale (voir Castaneda et al. 37 et Massie et al. 38 pour les méthodes) et la DL50 (voir Castaneda et coll.. 37 et Akins et al. 39 pour les méthodes) premier. Exécutez ensuite une courbe dose-réponse pour identifier des concentrations biologiquement pertinentes pour la sortie désirée phénotypique ; voir Hirsch et coll.. 19 et Zhou et al. 40 pour les méthodes.
- Préparer les solutions du milieu contaminé aux concentrations désirées, dépendant de la composition chimique du contaminant.
NOTE : par exemple, pour préparer les solutions de PbAc : préparer les solutions d’acétate de plomb (PbAc) moyen en ajoutant des contaminants à l’eau distillée (dH20) jusqu’au milieu empreint de contaminant l’eau atteint la concentration désirée. Par exemple, une solution de 1 000 µM PbAc, peut être préparé en ajoutant PbAc à dH20, jusqu'à ce qu’il atteigne 1 000 µM PbAc. En outre, diluer la solution mère (p. ex. les 1 000 µM PbAc une solution) à la concentration désirée (par exemple 500 µM PbAc) et maintenir ces solutions comme stock ainsi. - Préparer le milieu, lignes directrices du fabricant suivant pour servir le fluide. Préparer le support supplémentaire, les directives du fabricant suivant ; solution de contaminant a été préparée pour dH20 cependant, Supplément.
NOTE : par exemple, si vous utilisez un instant Drosophila moyen, ajouter l’environ une cuillère à café instantané moyen dans un flacon en plastique. Ajouter environ 5 à 5,5 mL dH20 au milieu. Parsemer de quelques grains de direct de levure de boulanger pour préparer le milieu témoin. Pour préparer le support expérimental, compléter la solution mère (par exemple 500 µM PbAc) pour dH20. -
Transfert en reproducteurs viables adultes mâles et femelles de stocks dans le contrôle et le milieu expérimental.
Remarque : L’eclosion après temps de maturité reproductive diffère entre les espèces de drosophile 41.- Tapotez doucement le flacon de mouches stocks vers le bas avec la main dominante. Veiller à ce que les mouches se déplacent automatiquement vers le fond du flacon. Avec l’autre main, enlever le bouchon du flacon en tapant le flacon et la placer un nouveau flacon de contrôle ou milieu contaminé sur le flacon avec les mouches. Joignent les flacons et retournez-la eux, tapotant doucement, afin que les mouches sont transférées automatiquement vers le nouveau flacon de contrôle ou milieu contaminé. Tandis que toujours taper le flacon avec les mouches, boucher le flacon.
- Répéter l’opération avec plusieurs flacons, en veillant à normaliser le nombre de mouches dans chaque flacon.
Remarque : Le nombre total d’adultes transférés via un transfert unique ou anesthésie dépendra de la taille des flacons utilisés pour éviter la surpopulation. - Incuber les adultes dans des conditions environnementales standard (c'est-à-dire un incubateur) et laisser les adultes s’accouplent et pondent dans le support de 24 à 96 h.
- Après 24 à 96 h, jeter des adultes dans une morgue (un ballon rempli d’huile minérale et coiffé d’un entonnoir serrés) laissant derrière lui les ovocytes fécondés (qui deviendra plus tard les sujets expérimentaux) à maturité pour les tests. Placer les flacons dans l’incubateur pour permettre les oeufs à développer.
- Surveiller les flacons pour les larves de stade errant en recherchant les larves qui émergent du milieu.
3. Récupérez les sujets expérimentaux à divers stades de développement
Remarque : Des sujets expérimentaux peuvent être recueillies à n’importe quel stade de développement, placé dans l’aveugles tubes coniques codés de 15 mL et testé pour l’accumulation. Méthodes d’essai de l’accumulation de contaminants dépendra de contaminant à l’étude. Par exemple, l’accumulation de PbAc peut être testée à l’aide de la spectrométrie de masse Inductively-Coupled Plasma (ICP-MS)42. En outre, des sujets expérimentaux peuvent être recueillies à n’importe quel stade de développement d’être testés pour une variété d’effets phénotypiques des contaminants. La figure 2 illustre le cycle de vie de Drosophila 43. La figure 3 illustre le protocole expérimental pour l’exposition et les différents stades de développement de la collection.
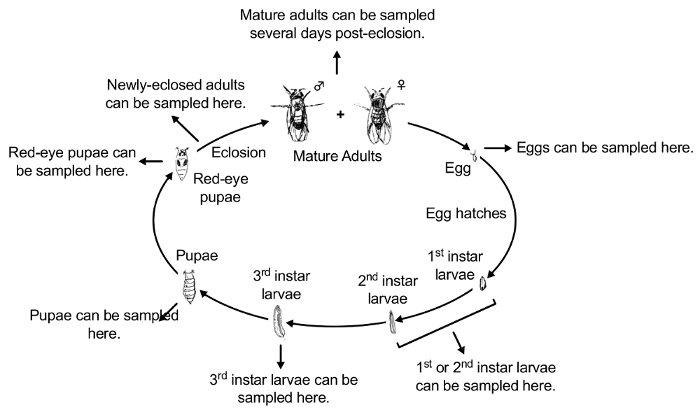
Figure 2 : Vue d’ensemble conceptuelle du cycle de vie de d. melanogaster (le système de modèle drosophile plus couramment utilisé). Les étapes du cycle de vie de drosophile sont : 1) oeuf, larve de premier stade 2), larves de deuxième stade 3), larves de troisième stade 4), 5) errant larve du troisième stade, 6) Zostérops chrysalide, pupe yeux rouges 7), 8) nouvellement-éclos adulte et 9) adulte. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
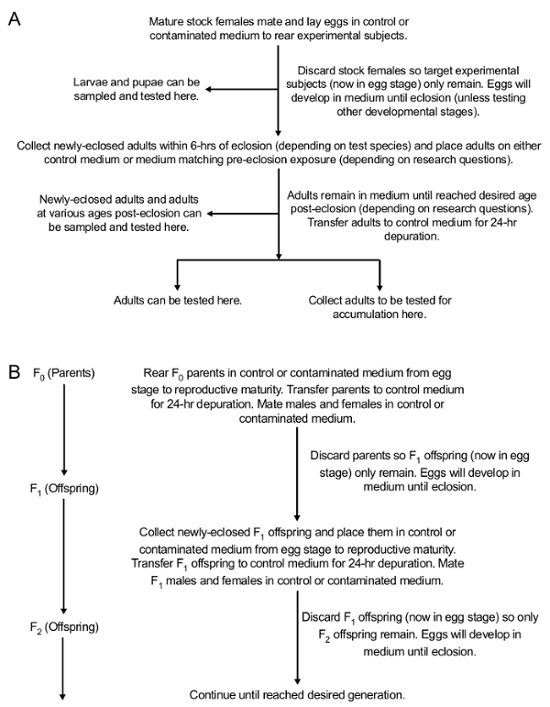
Figure 3 : Vue d’ensemble conceptuelle des méthodes permettant d’exposer oralement drosophile au milieu contaminé dans les générations suivantes et parental (0F) (F1 et au-delà). (A) méthodes pour l’exposition par voie orale au cours du développement dans la génération exposée. (B) méthodes pour tester le transfert de contaminants à la descendance (F1 à la génération désirée). Ce chiffre a été modifié par Peterson et al. 24 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Recueillir l’errance-troisième stade larvaire
- Démarrer le contrôle des flacons lorsque les lumières s’allument dans l’incubateur, car les larves seront émergent du milieu et déplacer vers le haut sur le côté de la fiole dans un h après que les phares s’allument dans l’incubateur. Dans cette h, enlever les côtés du flacon soigneusement à l’aide d’un bâton en bois ou la pince à épiler l’errance-troisième stade larvaire.
Remarque : Le nombre de larves disponibles pour collection dépendra le nombre de œufs pondus dans « 2.3.4 ». - Pour supprimer les excès du milieu de la larve, placez les larves dans un petit bécher avec dH2O. Pour la dH2O hors le bécher et placer les larves sur un essuie-glace de tâche délicate. À l’aide d’un essuie glace délicate, retirez délicatement l’excès dH2O de la larve.
- Maintenir des populations expérimentales dans une étuve respectueux de l’environnement.
- Démarrer le contrôle des flacons lorsque les lumières s’allument dans l’incubateur, car les larves seront émergent du milieu et déplacer vers le haut sur le côté de la fiole dans un h après que les phares s’allument dans l’incubateur. Dans cette h, enlever les côtés du flacon soigneusement à l’aide d’un bâton en bois ou la pince à épiler l’errance-troisième stade larvaire.
-
Recueillir nouvellement éclos adultes
- Flacons de moniteur pour eclosion en observant la coloration de la pupe le long des côtés des flacons.
Remarque : Les nymphes seront assombrit au cours du développement. Durée du développement, en particulier avant éclosion, dépend de l’espèce testée. - Lorsque les premiers adultes commencent à eclose, dump et jeter ces adultes dans une morgue contenant de l’huile minérale.
- Les phares s’allument dans l’incubateur le lendemain matin, dump et jeter des adultes d’âge inconnu (ou la virginité) ayant éclos pendant la nuit ou pendant les feux de morningbefore sur.
- Environ 4 h plus tard, anesthésier les adultes qui ont émergé en tant qu’adultes nouvellement éclos avec un pistolet à CO2 dans les flacons. Placer les adultes sur une plaque de2 CO sous un microscope à dissection. Adultes de sexe en recherchant les peignes de sexe sur les membres antérieurs des mâles et des ovipositeurs chez les femelles.
NOTE : D. melanogaster doivent être prélevés dans les 6 h d’eclosion pour éviter l’accouplement mais d’autres espèces peuvent avoir plus de perfectionnement fois (et donc, n’avez pas besoin d’être collectés dans ce laps de temps). - Adultes séparées sur la plaque de CO2 à l’aide d’un bâton en bois. Doucement le transfert adultes en groupes selon le sexe à l’aide d’un bâton en bois à l’histoire de préexistant moyen correspondant.
- Flacons de moniteur pour eclosion en observant la coloration de la pupe le long des côtés des flacons.
-
Recueillir des adultes après éclosion
- Permettre aux adultes de rester sur l’exposition de l’eclosion pre correspondante moyenne du stade de l’oeuf à l’eclosion après âge désiré dans une étuve respectueux de l’environnement.
- Transférer individuellement adultes pour le fluide de pilotage pendant 24 h avant le test pour permettre aux adultes de toiletter les excès du milieu contaminé hors de leur corps.
4. arrière des sujets expérimentaux pour tester les effets de plusieurs générations ou exposition transgénérationnel.
- Arrière de la génération parentale (a.k.a le P0 ou F0 générations), transfert adultes provenant de populations stocks control et le milieu expérimental suivant les étapes dans « 2.1 » à « 2.3 » et « 3.1 » par « 3.3 ».
- Quand les adultes sont sexuellement matures (voir Pitnick et coll.. 41), seuls un flacon de transfert (comme indiqué en 2.3.1) des mâles à un nouveau flacon de contrôle ou de support expérimental. Le nouveau flacon qui contient maintenant les hommes individuellement transférer un flacon de femelles. Permettez aux adultes de mate et pondent des œufs dans le milieu de 24 à 96 h. Dump et jeter des adultes dans une morgue contenant de l’huile minérale et ré-incuber les flacons pour permettre aux descendants de développer.
- Répétez les étapes 4.1 à 4.2 selon le nombre de générations.
Access restricted. Please log in or start a trial to view this content.
Résultats
Par exposer oralement drosophile à un contaminants tout au long du développement, différentes questions toxicologiques peuvent être testées en exposant drosophile à différents niveaux d’organisation biologique. Cette section présente les résultats représentatifs obtenus à l’aide de ce protocole dans les documents publiés antérieurement23,24. En particulier, le présent protocole précédemment ut...
Access restricted. Please log in or start a trial to view this content.
Discussion
Drosophila melanogaster a été établi comme un puissant modèle pour une série de processus biologiques en raison de la vaste conservation des gènes et des voies entre les humains et d. melanogaster 13,14. Pour les mêmes raisons que c’est un modèle puissant pour la science médicale, Drosophila a émergé comme un système modèle pour étudier l’impact de la pollution anthropique sur un éventail de points-limites toxicologiq...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette publication a été financée par une subvention du ministère de l’éducation (prix PR #P031C160025-17, titre du projet : 84,031 C) auprès des communautés de la Colorado State University-Pueblo (CSU-Pueblo) à l’Engagement de construire des souches actives (C-BASE). Nous remercions zoologie actuel et Elsevier pour fournir les droits d’utiliser les résultats représentatifs publiés dans les documents précédents, ainsi que les éditeurs de JoVE pour nous avoir fourni l’occasion de publier le présent protocole. Nous tenons également à remercier le programme C-BASE, Dr. Brian Vanden Heuvel (C-BASE et département de biologie, CSU-Pueblo), département de biologie de la CSU-Pueblo, Thomas Graziano, Dr Bernard Possidente (département de biologie, Skidmore College) et Dr. Claire Varian Ramos (Département de biologie, Université du Colorado-Pueblo) pour leur soutien et leur assistance.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Carolina Biological Instant Drosophila Medium Formula 4-24 | Carolina Biological | 173204 | |
| Drosophila vials, Narrow (PS), Polystyrene, Superbulk, 1000 vials/unit | Genessee Scientific | 32-116SB | Used to store flies |
| Flugs Closures for vials and bottles, Narrow plastic vials | Genessee Scientific | 49-102 | Used to store flies |
| Cardboard trays, trays only, narrow | Genessee Scientific | 32-124 | Used to organize populations of flies |
| Cardboard trays, dividers only, narrow | Genessee Scientific | 32-126 | Used to organize populations of flies |
| Thermo Scientific Nalgene Square Wide-Mouth HDPE Bottles with Closure | Fischer Scientific | 03-312D | Useful for storage of contaminants |
| Thermo Scientific Nalgene Color-Coded LDPE Wash Bottles | Fischer Scientific | 03-409-17C | Useful for storage of contaminants |
| Eppendorf Repeater M4 Manual Handheld Pipette Dispenser | Fischer Scientific | 14-287-150 | Used to prepare medium |
| Combitips Advanced Pipetter Tips - Standard, Eppendorf Quality Tips | Fischer Scientific | 13-683-708 | Used to prepare medium |
| Flypad, Standard Size (8.1 X 11.6cm) | Genessee Scientific | 59-114 | Used to anesthetize flies |
| Flystuff foot valve | Genessee Scientific | 59-121 | Used to anesthetize flies |
| Tubing, green (1 continguous foot/unit) | Genessee Scientific | 59-124G | Used to anesthetize flies |
| Mineral Oil, Light, White, High Purity Grade, 500 mL HDPE Bottle | VWR | 97064-130 | Used to make a morgue |
| Glass Erlenmeyer Flask Set - 3 Sizes - 50, 150 and 250ml, Karter Scientific 214U2 | Walmart | Not applicable | Used to make a morgue |
| BGSET5 Glass Beaker Set Of 5 | Walmart | ||
| Inbred or wildtype line of Drosophila | Bloomington Drosophila Stock Center at Indiana University | https://bdsc.indiana.edu | |
| Wild popultions of Drosophila | UC San Diego Drosophila Stock Center | https://stockcenter.ucsd.edu/info/welcome.php |
Références
- Postel, S. Defusing the Toxics Threat: Controlling Pesticides and Industrial Waste. , Worldwatch Institute. Washington, DC. (1987).
- Vitousek, P. M., Mooney, H. A., Lubchenco, J., Melillo, J. M. Human domination of earth's ecosystems. Science. 277, 494-499 (1997).
- United Nations Environment Program (UNEP). Saving Our Planet: Challenges and Hopes. , UNEP. Nairobi. (1992).
- Hansen, L. J., Johnson, M. L. Conservation and toxicology: Integrating the disciplines. Conservation Biology. 13, 1225-1227 (1999).
- Johnston, E. L., Mayer-Pinto, M., Crowe, T. P. REVIEW: Chemical contaminant effects on marine ecosystem functioning. Journal of Applied Ecology. 52, 140-149 (2015).
- Dell'Omo, G. Behavioral ecotoxicology. , John Wiley & Sons, LTD. West. Sussex, UK. (2002).
- Clotfelter, E. D., Bell, A. M., Levering, K. R. The role of animal behaviour in the study of endocrine-disrupting chemicals. Animal Behaviour. 68, 665-676 (2004).
- Peterson, E. K., Buchwalter, D. B., Kerby, J. L., LeFauve, M. K., Varian-Ramos, C. W., Swaddle, J. P. Integrative behavioral ecotoxicology: bringing together fields to establish new insight to behavioral ecology, toxicology, and conservation. Current Zoology. 63, 185-194 (2017).
- Scott, G. R., Sloman, K. A. The effects of environmental pollutants on complex fish behaviour: Integrating behavioural and physiological indicators of toxicity. Aquatic Toxicology. 68, 369-392 (2004).
- Zala, S. M., Penn, D. J. Abnormal behaviors induced by chemical pollution: A review of the evidence and new challenges. Animal Behaviour. 68, 649-664 (2004).
- Abolaji, A. O., Kamdem, J. P., Farombi, E. O., Rocha, J. B. T. Drosophila melanogaster as a promising model organism in toxicological studies. Archives of Basic & Applied Medicine. 1, 33-38 (2013).
- Jennings, B. H. Drosophila-a versatile model in biology and medicine. Materials Today. 14, 190-195 (2011).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacology Reviews. 63, 411-436 (2011).
- Rubin, G. M., et al. Comparative genomics of the eukaryotes. Science. 287, 2204-2215 (2000).
- Rand, M. D. Drosophotoxicology: The growing potential for Drosophila in neurotoxicology. Neurotoxicol Teratol. 32, 74(2010).
- Rand, M. D., Montgomery, S. L., Prince, L., Vorojeikina, D. Developmental toxicity assays using the Drosophila model. Current Protocols in Toxicology. 59, 1.12.1-1.12.20 (2015).
- Burke, M. K., Rose, M. R. Experimental evolution with Drosophila. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology. 296, R1847-R1854 (2009).
- He, T., Hirsch, H. V. B., Ruden, D. M., Lnenicka, G. A. Chronic lead exposure alters presynaptic calcium regulation and synaptic facilitation in Drosophila larvae. NeuroToxicology. 30, 777-784 (2009).
- Hirsch, H. V., et al. Behavioral effects of chronic exposure to low levels of lead in Drosophila melanogaster. NeuroToxicology. 24, 435-442 (2003).
- Hirsch, H. V. B., et al. Variations at a quantitative trait locus (QTL) affect development of behavior in lead-exposed Drosophila melanogaster. NeuroToxicology. 30, 305-311 (2009).
- Morley, E. J., Hirsch, H. V. B., Hollocher, K., Lnenicka, G. A. Effects of chronic lead exposure on the neuromuscular junction in Drosophila larvae. NeuroToxicology. 24, 35-41 (2003).
- Ruden, D. M., et al. Genetical toxicologenomics in Drosophila identifies master- modulatory loci that are regulated by developmental exposure to lead. NeuroToxicology. 30, 898-914 (2009).
- Peterson, E. K., et al. Accumulation, elimination, sequestration, and genetic variation of lead (Pb2+) loads within and between generations of Drosophila melanogaster. Chemosphere. 181, 368-375 (2017).
- Peterson, E. K., et al. Asymmetrical positive assortative mating induced by developmental lead (Pb2+) exposure in a model system, Drosophila melanogaster. Current Zoology. 63, 195-203 (2017).
- Peterson, E. K. Consequences of developmental lead (Pb2+) exposure on reproductive strategies in Drosophila. , University at Albany-State University of New York. Dissertation (2016).
- Chifiriuc, M. C., Ratiu, A. C., Popa, M., Ecovolu, A. A. Drosophotoxicology: An emerging research area for assessing nanoparticles interaction with living organisms. International Journal of Molecular Sciences. 17, 36(2016).
- Lachaise, D., Cariou, M. L., David, J. R., Lemeunier, F., Tsacas, L., Ashburner, M. Historical biogeography of the Drosophila melanogaster species subgroup. Evolutionary Biology. 22, 159-225 (1988).
- Elgin, C. R., Miller, D. W. Mass rearing of flies and mass production and harvesting of embryos. The Genetics and Biology of Drosophila. Ashburner, M., Wright, T. R. F. 2a, 112-121 (1978).
- Shaffer, C. D., Wuller, J. M., Elgin, C. R. Chapter 5: Raising large quantities of Drosophila for biochemical experiments. Methods in Cell Biology. 44, 99-108 (1994).
- Stocker, H., Gallant, P. Getting started: an overview on raising and handling Drosophila. Methods in Molecular Biology. 420, 27-44 (2008).
- Jennings, J. H., Etges, W. J., Schmitt, T., Hoikkala, A. Cuticular hydrocarbons of Drosophila montana: geographic variation, sexual dimorphism and potential roles as pheromones. Journal of Insect Physiology. 61, 16-24 (2014).
- Drosophila Speciation Patterns. , http://www.drosophila-speciation-patterns.com/rangemaps.html. (2018).
- Markow, T. A., O'Grady, P. M. Drosophila: A Guide to Species Identification and Use. , Academic Press. London. (2005).
- Werner, T., Jaenike, J. Drosopholids of the midwest and northeast. , River Campus Libraries, University of Rochester. Rochester NY. (2017).
- Greenspan, R. J. The basics of doing a cross. Fly Pushing: The theory and practice of Drosophila genetics. , 2nd, Cold Spring Harbor Laboratory Press, Cold Spring Harbor. New York. 3-24 (1997).
- JoVE Science Education Database. . Biology I: yeast, Drosophila and C. elegans. Drosophila Maintenance. , JoVE. Cambridge, MA. (2018).
- Castañeda, P. L., Muñoz, G. L. E., Durán, D. A., Heres, P. M. E., Dueñas, G. I. E. LD50 in Drosophila melanogaster. fed on lead nitrate and lead acetate. Drosophila Information Service. 84, 44-48 (2001).
- Massie, H. R., Aiello, V. R., Whitney, S. J. P. Lead accumulation during aging of Drosophila and effect of dietary lead on life span. Age. 15, 47-49 (1992).
- Akins, J. M., Schroeder, J. A., Brower, D. L., Aposhian, H. V. Evaluation of Drosophila melanogaster as an alternative animal for studying the neurotoxicity of heavy metals. BioMetals. 5, 111-120 (1992).
- Zhou, S., et al. The genetic basis for variation in sensitivity to lead toxicity in Drosophila melanogaster. Environmental Health Perspectives. 124, 1062-1070 (2016).
- Pitnick, S., Markow, T. A., Spicer, G. S. Delayed male maturity is a cost of producing large sperm in Drosophila. Proceedings of National Academy of Sciences USA. 92, 10614-10618 (1995).
- Beauchemin, D. Inductively Coupled Plasma Mass Spectrometry. Analytical Chemistry. 82, 4786-4810 (2010).
- Tyler, M. S. Development of the fruit fly Drosophila melanogaster. Developmental Biology, a Guide for Experimental Study. Tyler, M. S. , 2nd, Sinauer Associates Inc. Sunderland, MA, USA. 8-27 (2000).
- Ortiz, J. G., Opoka, R., Kane, D., Cartwright, I. L. Investigating arsenic susceptibility from a genetic perspective in Drosophila reveals a key role for glutathione synthetase. Toxicological Sciences. 107, 416-426 (2009).
- Bonilla, E., Contreras, R., Medina-Leendertz, S., Mora, M., Villalobos, V., Bravo, Y. Minocycline increases the life span and motor activity and decreases lipid peroxidation in manganese treated Drosophila melanogaster. Toxicology. 294, 50-53 (2012).
- Guarnieri, D. J., Heberlein, U. Drosophila melanogaster, a genetic model system for alcohol research. International Review of Neurobiology. 54, 199-228 (2003).
- Posgai, R., Cipolla-McCulloch, C. B., Murphy, K. R., Hussain, S. M., Rowe, J. J., Nielsen, M. G. Differential toxicity of silver and titanium dioxide nanoparticles on Drosophila melanogaster development, reproductive effort, and viability: size, coatings and antioxidants matter. Chemosphere. 85, 34-42 (2011).
- Gupta, S. C., et al. Adverse effect of organophosphate compounds, dichlorvos and chlorpyrifos in the reproductive tissues of transgenic Drosophila melanogaster: 70kDa heat shock protein as a marker of cellular damage. Toxicology. 238, 1-14 (2007).
- Wasserkort, R., Koller, T. Screening toxic effects of volatile organic compounds using Drosophila melanogaster. Journal of Applied Toxicology. 17, 119-125 (1997).
- Markow, T. A., O'Grady, P. O. Reproductive ecology of Drosophila. Functional Ecology. 22, 747-759 (2008).
- Dev, K., Chahal, J., Parkash, R. Seasonal variations in the mating-related traits of Drosophila melanogaster. Journal of Ethology. 31, 165-174 (2013).
- Salminen, T. S., Vesala, L., Laiho, A., Merisalo, M., Hoikkala, A., Kankare, M. Seasonal gene expression kinetics between diapause phases in Drosophila virilus group species and overwintering differences between diapausing and non-diapausing females. Nature Scientific Reports. 5, 11197(2015).
- Miller, R. S., Thomas, J. L. The effects of larval crowding and body size on the longevity of adult Drosophila melanogaster. Ecology. 39, 118-125 (1958).
- Peterson, E. K., Ghiradella, H., Possidente, B., Hirsch, H. Transgenerational epigenetic effects of lead exposure on behavior in Drosophila melanogaster. Abstracts of the IBANGS Genes, Brain and Behavior Meeting, May 16-19, 2012, Boulder, CO, 11, Genes, Brain & Behavior 492-493 (2012).
- Soares, J. J., et al. Continuous liquid feeding: New method to study pesticides toxicity in Drosophila melanogaster. Analytical Biochemistry. 537, 60-62 (2017).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon