Method Article
Évaluation vasculaires hyperperméabilité inducteurs enzymatiques de la peau avec le test de Miles
Dans cet article
Résumé
Nous présentons ici un protocole visant à mesurer la perméabilité vasculaire induite par l’administration intradermique des agents favorisant la perméabilité dans la peau de souris. Cette technique peut servir à déterminer la capacité des molécules à promouvoir ou à inhiber une fuite vasculaire ou d’étudier les mécanismes moléculaires qui régissent la perméabilité vasculaire.
Résumé
La fonction première de l’endothélium vasculaire chez les organismes vertébrés est de servir comme une barrière entre le sang et chaque tissu du corps, auquel cas la perméabilité de l’endothélium de globules, macromolécules de plasma et d’eau peut être adaptée selon le besoin physiologique. Dans certaines maladies, cytokines et facteurs de croissance sont libérés qui ciblent la barrière endothéliale pour augmenter temporairement la perméabilité vasculaire ; Toutefois, leur présence prolongée peut provoquer une hyperperméabilité vasculaire chronique et œdème ainsi nocifs pour les tissus. L’essai de Miles est une technique in vivo qui permet aux chercheurs d’étudier l’hyperperméabilité vasculaire grâce à la mesure de la procuration de perméabilité vasculaire. Ici, nous fournissons un protocole détaillé sur la façon d’effectuer cette procédure chez la souris, qui est l’organisme modèle le plus couramment utilisé pour étudier les mammifères physiologie et pathologie. La procédure consiste en l’injection intraveineuse de bleu Evans d’étiqueter l’albumine circulante, suivie de multiples injections intradermiques de perméabilité-inducteurs enzymatiques et solutions de contrôle de véhicule en s’opposant à flancs de la souris. En conséquence, bleu Evans s’infiltre progressivement dans le derme, où il s’accumule et peut être extrait pour la quantification en fuite induite par l’agent induisant la perméabilité par rapport au véhicule. Le dosage de Miles peut être effectué chez le type sauvage ou génétiquement modifié des souris modèles et peut être combiné avec la FDA afin d’étudier les mécanismes moléculaires qui régissent la perméabilité vasculaire et identifient des agents/cibles capables d’induire ou de blocage hyperperméabilité.
Introduction
La fonction première du système cardio-vasculaire est de permettre le transfert des gaz, des nutriments et des déchets produits entre la circulation et les tissus dans tous les organes. Les vaisseaux sanguins ont des niveaux de certains organes de perméabilité basale pour permettre ces échanges1. Par exemple, les vaisseaux sanguins dans les reins sont très perméables, alors que la barrière hémato encéphalique constitue une interface hautement impénétrable serré2,3,4. Les cellules endothéliales qui forment la paroi interne des vaisseaux sanguins constituent une barrière physique entre la circulation et les tissus sous-jacents et réglementent la perméabilité vasculaire de manière spécifiques d’organes. Toutefois, certains stimuli provoque une rupture partielle de la barrière endothéliale pour augmenter l’extravasation fluide de la circulation dans l’interstitium au-dessus du taux de base1. Cette hyperperméabilité est observée, par exemple, sur les sites de traumatisme tissulaire, une inflammation, des tumeurs, au cours de septicémie, yeux atteints de DMLA néovasculaire maladie ou dans le cerveau et le coeur, l’ischémie tissulaire se produit en raison d’un accident vasculaire cérébral ou un infarctus du myocarde, respectivement 5 , 6 , 7 , 8. Lorsque chroniquement élevé, hyperperméabilité conduit à un oedème, qui provoque des lésions tissulaires, tels que la perte de la vision à le œil la maladie9. Modélisation de la réponse de l’hyperperméabilité vasculaire est donc souhaitable pour comprendre les mécanismes qui augmentent la perméabilité endothéliale et de tester l’efficacité des agents conçus pour empêcher cela.
L’essai de Miles est une technique relativement simple, bien établie et couramment utilisée qui mesure une fuite vasculaire en vivo comme une mesure de substitution de l’hyperperméabilité vasculaire. Même s’il ne prend pas en compte les facteurs qui peuvent augmenter la perméabilité vasculaire indépendamment de règlement de la barrière endothéliale, tels que la pression sanguine ou la circulation sanguine, de mélange, le dosage de Miles est généralement considéré pour fournir une méthode fiable pour évaluer le perméabilité-modulation de l’activité des substances et identifier les signalisation des médiateurs qui favorisent leur activité. Par conséquent, le test de Miles a été partie intégrante de nombreuses études qui ont identifié des médiateurs de l’hyperperméabilité vasculaire et leurs mécanismes d’action10,11,12,13, 14,15, tel que le facteur de croissance endothélial vasculaire VEGF-A, qui a été initialement identifiée comme étant le facteur de perméabilité vasculaire VPF16.
Initialement développé par Miles et des Miles pour étudier la perméabilité vasculaire en cobayes17, leur dosage a été par la suite adapté à l’utilisation de souris, qui sont maintenant l’organisme modèle de choix pour élucider les mécanismes moléculaires de la perméabilité vasculaire règlement en raison de leurs qualités exquises de manipulation génétique. En bref, bleu Evans est par voie intraveineuse injectées à des souris adultes et autorisés à circuler pendant 30 minutes (Figure 1). Perméabilité-inducteurs enzymatiques, par opposition à contrôle de véhicule sont ensuite par voie intradermique injectées dans des sites multiples sur l’opposition des flancs de la souris pour induire la fuite vasculaire (Figure 1). Par conséquent, lié à l’albumine bleu Evans extravasates et s’accumule dans le derme (Figure 1). Après la souris d’abattage sans cruauté, bleu Evans est extraite à partir du derme et le niveau de fuite vasculaire calculé comme un rapport de test substance pour véhicule-induite par la densité optique (Figure 2).
Protocole
Tous les travaux d’animaux a été réalisée suite UK Home Office et des lignes directrices de bien-être des animaux et corps d’examen éthique (AWERB).
1. préparation souris
Remarque : Réaliser des expériences sur des souris adultes d’au moins 8 semaines d’âge, jusqu'à à l’âge de 6 mois. Afin de démontrer la reproductibilité technique et un calendrier cohérent pour chaque étape de cette procédure entre différents animaux, utiliser au minimum 2 et maximum de 6 souris pour chaque session expérimentale. Pour évaluer l’effet d’une mutation sur une substance induisant la perméabilité chez des souris génétiquement modifiées, idéalement, utiliser 2 souris mutantes et 2 contrôles de même portée par des expériences.
- 24 h avant l’hyperperméabilité vasculaire stimulante, anesthésier la souris à l’aide d’une inhalation appropriée anesthésique tels qu’isoflurane. Utiliser 3 % isoflurane pour l’induction de l’anesthésie, jusqu'à ce que le réflexe de redressement est perdu et la souris ne répond pas aux stimuli externes. Utiliser l’isoflurane 1,5 % pour l’entretien de l’anesthésie (veiller à ce que la souris a des taux respiratoires constants). Sous anesthésie, soigneusement raser les deux flancs de chaque souris avec un rasoir électrique, éviter les blessures de la peau.
Remarque : L’anesthésie est utilisée pour éviter de causer un stress à l’animal et à minimiser le mouvement durant le rasage, ce qui peut entraîner des lésions cutanées. - Retourner la souris rasée à sa cage maison. Pour les souris mâles, placez chaque mâle dans une cage individuelle après récupération anesthésie pour prévenir les combats et, par conséquent, endommager la peau. Chez les souris femelles, renvoyez-les dans un groupe à leur cage maison.
Remarque : Si un comportement de combat est observé chez les souris mâles dans la cage, avant l’intervention, les séparer dans des cages individuelles pendant 3 jours avant l’expérience pour permettre d’éventuels dommages à la peau de guérir. - Contrôler les souris jusqu'à ce qu’ils reprendre conscience (généralement en quelques secondes) et se déplacent autour de la cage (généralement moins de 1 min).
2. intraveineux Evans Blue Dye
- Dans un flux laminaire, préparer des solutions stériles distinctes du maléate de pyrilamine inhibiteur l’histamine (4 µg/µL de solution saline à 0,9 %) et du colorant bleu d’Evans (1 % p/v dans la solution saline à 0,9 %). Stériliser en passant les solutions au travers d’un filtre 22 µm.
- Utiliser une seringue stérile 1 mL avec une aiguille de 30 G à injecter par voie intrapéritonéale chaque souris avec 10 µL pyrilamine maléate solution/gramme de poids corporel (Figure 1 a). Pour effectuer la peau du cou injection, tout d’abord, le souris et puis basculez-la de sorte que la tête est dirigée vers le sol et de l’abdomen est dirigée vers le haut. Injecter dans les quadrants inférieurs de l’abdomen de la ligne médiane pour éviter de heurter la vessie.
Remarque : Le poids des souris entre 8 semaines et 6 mois d’âge habituellement varie entre 15 et 30 g. maléate Pyrilamine inhibent la libération d’histamine endogène, ce qui favoriserait par ailleurs une fuite vasculaire indépendamment de l’agent à tester. - Placez votre souris dans une chambre de chaleur de 37 ° C pendant 10 min promouvoir une vasodilatation. Sinon, utiliser une lampe de chaleur approprié axée sur la queue pour promouvoir une vasodilatation, si l’utilisation d’une lampe chauffante est autorisée par les directives éthiques locales.
- Déplacer une souris à la fois à une drisse de souris et frotter la queue avec l’éthanol à 70 % pour nettoyer la zone d’injection et de promouvoir davantage la vasodilatation.
- Utiliser une seringue stérile 1 mL avec une aiguille de 30G à administrer 100 µL bleu Evans par voie intraveineuse par l’intermédiaire de la veine caudale (Figure 1 b). Appliquer immédiatement la pression sur le site de l’injection en tenant la queue entre un doigt et le pouce pour empêcher les saignements.
Remarque : La visualisation de la veine caudale peut être améliorée en dirigeant la lumière de la lampe vers la zone d’injection. On trouvera de plus amples détails sur l’exécution d’injections intraveineuses dans la veine de queue de souris dans un protocole publié18. - Laissez le colorant à circuler pendant 30 min.
3. stimuler l’hyperperméabilité vasculaire
- À l’aide de solutions stériles dans une enceinte à flux laminaire, diluer l’agent induisant la perméabilité d’intérêt à une concentration qui permet la dose finale devant être livrés en un volume de 20 µL.
Remarque : Dans l’expérience de l’exemple illustré à la Figure 1-Figure 2, que VEGFA est utilisé pour stimuler une hyperperméabilité vasculaire à une concentration de 2,5 ng/µL de PBS, ce qui donne une dose totale de 50 ng et PBS est utilisé comme un contrôle de véhicule. - Chargez l’agent induisant la perméabilité de l’intérêt et le contrôle du véhicule dans 2 seringues stériles distinctes de 300 µL avec une aiguille de 31 G. Chargez une solution suffisante à injecter chaque souris avec 20 µL de la solution en trois exemplaires (c.-à-d. préparer 60 µL d’agent et de véhicule par la souris, plus un volume supplémentaire pour tenir compte de volume mort de l’aiguille).
- Anesthésier la première souris à tester à l’isoflurane (3 % pour l’induction de l’anesthésie jusqu'à ce que le réflexe de redressement est perdue et la souris ne répond pas aux stimuli externes et 1,5 % pour l’entretien de l’anesthésie, en vous assurant que la souris a des taux respiratoires constants).
- Injecter par voie intradermique 20 µL de l’agent favorisant la perméabilité dans le flanc de la souris (Figure 1). S’assurer que l’aiguille est à un angle de 15° sur la peau. Recherchez la formation d’une bulle soulevée au sein de la peau, ce qui indique une injection réussie. Répéter l’injection intradermique en 2 points supplémentaires, un moins de 1 cm de distance.
- Tourner la souris pour exposer le flanc 2e et répéter les injections en triple avec la solution de véhicule de contrôle. Enregistrer sur le papier, la position de chaque point d’injection pour faciliter leur identification pour la collecte ultérieure des échantillons de peau.
NOTE : Gérer la peau de souris avec précaution à ce stade ; par exemple, ne pas pincer la peau lors de l’exécution des injections intradermiques. - Retourner la souris injectée à sa cage maison et contrôler la souris jusqu'à ce qu’il récupère de la conscience (généralement en quelques secondes) et se déplace autour de la cage.
- Alors que la première souris récupère, immédiatement Répétez les étapes 3.3 et 3.5 avec la souris en deuxième, et ainsi de suite (jusqu'à 6 souris au maximum par session). Tenir un registre du temps que chaque souris a été injecté pour régler l’heure à laquelle passer à l’étape ultérieure.
4. la quantification de bleu Evans accumulés dans le derme
- Après avoir reçu les injections intradermiques, respectant l’ordre dans lequel les souris ont reçu une injection de réforme chaque souris par dislocation cervicale 20 min.
Remarque : La durée de la perméabilité vasculaire peut varier selon l’agent induisant la perméabilité utilisé et, par conséquent, le temps entre l’injection intradermique et l’abattage peut besoin d’optimisation. - Place chaque abattus souris sur son dos et son axe ses pieds sur une planche de Liège enveloppés avec un tissu propre (Figure 1).
- À l’aide de ciseaux émoussé, pratiquer une incision verticale d’environ 3-4 cm du bas du ventre jusqu'à la poitrine de la souris morte. Avec pince et scalpel, taquiner à la peau les deux flancs de révéler à la face interne du derme et des sites d’accumulation de bleu Evans (Figure 1E). Cerner la peau lâche et enlever la graisse provenant de régions autour du site de fuite avec un scalpel. Si nécessaire, prenez une photo représentative pour démontrer l’ampleur de la fuite de bleu Evans dans la peau.
- Régions de peau d’accise comprenant la fuite colorant bleu Evans pour chaque site à l’aide de pinces et un scalpel, injecté avec l’agent inducteur perméabilité ou le véhicule.
Remarque : prendre soin de même taille des régions de la peau pour s’assurer que, à la 4.7 étape subséquente, une portion semblable du formamide volume va être adsorbée par chaque échantillon de la peau, permettant à la teinture extraite à diluer dans un volume semblable de formamide restant de l’accise . La carte d’injection notée à l’étape 3.5 aidera à définir la zone à être excisées. - Placer chaque échantillon dans un tube de 1,5 mL et étiqueté en conséquence, en s’assurant que chaque échantillon repose sur le fond du tube. Stocker les échantillons à - 20 ° C jusqu'à l’utilisation ultérieure. Si le traitement immédiatement, suivez les étapes ci-dessous.
- Sécher les échantillons de peau toute la nuit en plaçant le tube ouvert dans une étuve ou dans le puits d’un bloc de chauffage à 55 ° C.
- Pour extraire le colorant bleu d’Evans, ajouter 250 µL de formamide désionisée dans les échantillons sous une hotte, fermer les tubes. S’assurer que les échantillons de peau sont tous couverts par la formamide et incuber pendant la nuit dans un four ou d’un bloc de chauffage à 55 ° C.
- Centrifuger les échantillons dans une centrifugeuse de paillasse à vitesse maximale (> 10 000 x g) pendant 40 min.
- Sous une hotte, transférer 100 µL de surnageant contenant du colorant chaque échantillon dans un puits distinct d’une plaque de 96 puits de fond transparent, plate (Figure 2 a).
- Pointe de mesure absorbance de bleu Evans à 620 nm avec une lecture de référence de 740 nm sur un spectrophotomètre.
NOTE : 620 nm est l’absorbance de la pointe bleu d’Evans, alors que 740 nm n’est pas absorbé par bleu Evans et agit comme une longueur d’onde de référence. - Moyenne des mesures d’absorbance des injections en triple du même mandataire ou véhicule pour chaque souris pour tenir compte de la variabilité de la technique (Figure 2 b).
- Calculer la différence de pli de lectures de l’agent inducteur perméabilité par le rapport de contrôle du véhicule (Figure 2).
Résultats
Nous avons utilisé le test de Miles pour évaluer la capacité du VEGF-A à induire une fuite vasculaire par rapport au contrôle du véhicule (PBS) chez les souris C57/Bl6 de type sauvage. Ici, nous montrons une expérience représentative avec une souris de type sauvage stimulées avec injection intradermique de 20 µL de solution contenant 50 ng de VEGF-A à PBS ou PBS de véhicule seulement. Une nette augmentation de fuite du colorant bleu Evans dans des échantillons de peau injecté avec le VEGF-A comparé à PBS a été apparente in situ (Figure 1E) et après extraction du colorant en formamide (Figure 2 a). Quantification de multiples expériences montre que 50 ng de VEGF-A induit significativement plus Evans bleu fuite que PBS seul (Figure 2 b), avec en moyenne 3 fois augmenter dans une fuite vasculaire par rapport au véhicule (Figure 2).
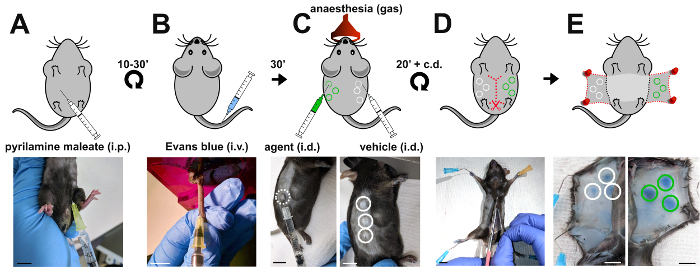
Figure 1 : Induction de la perméabilité vasculaire dans le dosage Miles. Représentation schématique (panneaux supérieure) et les images correspondantes (panneaux de fond) des étapes Lorsque vous effectuez le test de Miles chez la souris. (A) Pyrilamine maléate est injecté par voie intrapéritonéale pour empêcher la libération d’histamine endogène de 10 à 30 minutes avant l’injection par voie intraveineuse (B) de 100 µl 1 % Evans bleue dans la queue de la veine de la souris. (C) 30 min plus tard, vasculaire fuite est induite par l’injection intradermique de l’agent (50 ng de VEGF-A ; vert cercles) par opposition à contrôle de véhicule (PBS ; cercles blancs). (D, E) Pour accéder aux sites d’accumulation de bleu Evans, la souris est de qualité inférieure à 20 minutes après les injections intradermiques et la peau de deux flancs disséqué et cloué. i.p. : intrapéritonéale ; i.v. : par voie intraveineuse ; n° de pièce : intradermique ; échelle de barres, de 1 cm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
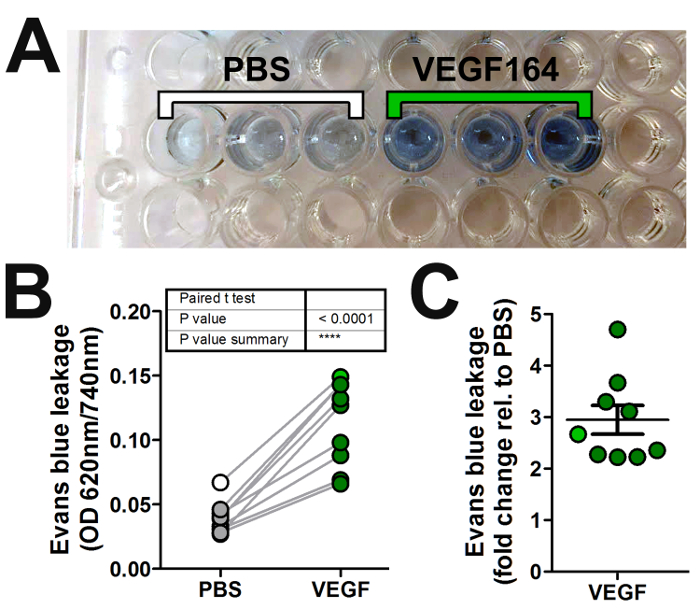
Figure 2 : Quantification de la perméabilité vasculaire dans le dosage de Miles. (A) Evans de teinture bleue est extraite en formamide provenant d’échantillons de peau prélevés à chaque injection intradermique à la Figure 1 et chargé dans une plaque à 96 puits d’absorption de lecture avec un spectrophotomètre. (B, C) Représentation graphique des lectures absorbance de multiples expériences en traçant soit (B) l’absorbance normalisé les valeurs (densité optique, OD) de l’agent inducteur de perméabilité (VEGF-A ; sombre vert cercles) et véhicules (PBS ; gris les cercles), ou (C) le pli change dans OD pour l’agent contre véhicule (barres d’erreur : SEM). Les mesures d’absorbance des PBS en triple et échantillons de VEGF-A montré en (A) sont en moyenne et inscrits à (B, C) comme des cercles blancs ou verts, respectivement. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Depuis sa première description en 1952,17, le dosage de Miles a fourni des chercheurs avec une méthode relativement rapide, simple et fiable pour étudier les mécanismes moléculaires de l’hyperperméabilité vasculaire. Par exemple, le dosage de Miles a été utilisé pour tester la capacité et/ou la puissance de différents agents pour induire l’hyperperméabilité19,20,21 ou pour tester l’efficacité de l’hyperperméabilité blocage agents8 ,22,23. Comme autre exemple, les agents qui induisent la perméabilité vasculaire ont été testés chez des souris génétiquement modifiées et leurs contrôles de même portée pour déterminer les exigences des récepteurs spécifiques et signal transduction de protéines pour l’hyperperméabilité induite par le ligand réponses10,11,12,13,14,15,20,23. Plusieurs versions modifiées du dosage Miles ont depuis été utilisées, par exemple en ce qui concerne le traceur utilisé. Ainsi, le bleu Evans a été substitué dans certaines études avec fluorescence-étiquetée dextrans de différentes tailles ou microsphères11,13.
Le principal avantage de l’essai de Miles sur autres épreuves pour enquêter sur les mécanismes de l’hyperperméabilité vasculaire est qu’il est relativement facile à réaliser et ne nécessite pas de matériel coûteux. En outre, comme une technique in vivo , ce dosage modèles une fuite vasculaire dans le contexte des vaisseaux sanguins intacts, par opposition à la mesure des fuites par in vitro tests tels que trans bien des essais de flux ou trans endothélial résistance électrique ( Essais de TEER), qui, seul, l’accent sur la monocouche endothéliale. Les dosages alternatives in vivo d’hyperperméabilité vasculaire peuvent différer de l’essai de Miles décrite ici en utilisant un itinéraire de livraison différente de l’agent inducteur hyperperméabilité ou en analysant une fuite vasculaire à différents endroits, pour exemple de délivrance systémique d’un agent via la veine caudale, suivie d’une fuite vasculaire examen dans les poumons ou la trachée11,13,15. Une des limites de l’essai de Miles sont que l’injection intradermique de certains agents peut, en principe, influencent également la tension artérielle et le débit en plus de la rupture de la barrière endothéliale et, par conséquent, influer sur la perméabilité vasculaire aussi indirectement. Néanmoins, ce dosage a été récemment montré pour mesurer la perméabilité vasculaire induite par le VEGF-A indépendamment des effets sur la pression artérielle systémique15. Une autre limite de l’essai de Miles, c’est que les lits vasculaires dans différents tissus peuvent répondre différemment aux agents favorisant la perméabilité et les résultats obtenus avec un dosage de Miles dans la peau, donc peut-être pas représentant, par exemple, de ce qui se passe dans le poumons ou du cerveau.
Âge et le poids de l’animal peuvent influencer la fuite observée dans l’essai de Miles. Pour minimiser l’effet de ces variables, les chercheurs devraient utiliser la même portée ou de même taille et âgés de souris sous forme de contrôles. Lors de l’évaluation des souris mutantes pour un gène d’intérêt, souris doivent être générés par un hétérozygote par rapport aux reproducteurs hétérozygotes stratégie et type sauvage de même portée utilisée comme témoins. Par ailleurs, il est conseillé d’utiliser les anesthésiques gaz rapidement réversible, comme l’isoflurane, afin d’éviter une vasoconstriction, ce qui a été décrit pour certains médicaments anesthésiques administrés par injections parentérales24,25. L’injection de bleu Evans dans la veine latérale queue de souris est une étape essentielle dans le présent protocole et peut grandement influencer la qualité de l’expérience et les données. Ainsi, les chercheurs doivent être compétentes dans l’exercice de queue veine injections et fera probablement besoin d’une expérience antérieure ou la pratique avant de débuter que les milles d’analyse des expériences. Sinon, chercheurs peuvent utiliser autres voies intraveineuse pour livrer Evans blue, telles que l’injection rétro-orbitaire s’ils sont expérimentés avec elle. Injection intradermique de favorisant la perméabilité solutions peuvent endommager agent indépendant à la peau. Par conséquent, injections intradermiques ne doit pas dépasser 20 µl volume, devraient toujours être effectuées en présence de l’inhibiteur de l’histamine et normalisées à injections de contrôle de véhicule.
Le dosage de Miles a été utilisé par de nombreux chercheurs d’évaluer les composantes de la voie signalisation de VEGF-A, par exemple, parce que la perméabilité vasculaire induite par VEGF-A cause d’ascite chez cancer patients16 et nuire à la vision de le œdème dans plusieurs néovasculaire sur la maladie de le œil7. Ainsi, nous et autres avons utilisé le test de Miles pour comparer le VEGF-A provoqué une fuite vasculaire chez les souris qui ont été génétiquement modifiés pour manque de composants spécifiques du VEGF-A signalisation cascade12,13,14, 15 , 20 , 23. notre étude récente utilisant cette approche, a révélé que l’isoforme VEGF-A pathologique principal VEGF165, signaux grâce à un complexe de VEGFR2 et NRP1, dans lequel le domaine cytoplasmique NRP1 favorise l’activation induite par la kinase ABL des kinases de la famille SRC pour évoquer une hyperperméabilité réponse14. VEGFA aussi favorise la croissance des vaisseaux sanguins et pourrait, par conséquent, être utilisé thérapeutiquement pour restaurer le flux sanguin vers les tissus ischémiques si ses activités hyperperméabilité pouvaient être inhibées spécifiquement. Recherche élucider le mécanisme moléculaire qui oriente le VEGF-A les réponses des cellules endothéliales vasculaires vers hyperperméabilité vasculaire pourrait, par conséquent identifier les voies qui peuvent être manipulées de manière sélective pour inhiber pathologique oedème de VEGF-A induit dans les maladies, comme le cancer ou les maladies ischémiques oculaires. Le dosage de Miles continuera sans doute à être une méthode utile pour étayer ces et beaucoup d’autres types d’études fonctionnelles d’élucider moléculaires responsables de la réglementation et les effecteurs de l’hyperperméabilité vasculaire.
Déclarations de divulgation
Les auteurs n’ont aucun intérêt en conflit de déclarer.
Remerciements
Nous remercions Laura Denti, Valentina Senatore et le personnel de l’unité de ressources biologiques à l’Institut d’ophtalmologie de l’UCL pour aide avec l’élevage de souris et Camille Charoy pour le support technique. Ce travail a été soutenu par une subvention du Conseil de recherches médicales (MR/N011511/1) C. Ruhrberg et une bourse d’étude British Heart Foundation PhD à J.T. Brash (FS/13/59/30649).
matériels
| Name | Company | Catalog Number | Comments |
| Pyrilamine maleate salt | Sigma-Aldrich | P5514-5G | Resuspend in PBS |
| Deionised Formamide | Sigma-Aldrich | S4117 | Use in fume cupboard |
| Microlance Needles 30g x 0.5" | BD | 305106 | |
| Sterile Plastipak 1ml Luer | BD | 309659 | |
| Sterile MicroFine syriinges 0.3 ml - 8 mm - 30G | BD | 324826 | |
| Evans blue | Sigma Aldrich | E2129 | |
| Mouse restrainer | |||
| Heat chamber | |||
| Hair clippers | |||
| Isoflurane | Merial | ap/drugs/220/96 | |
| Scalpal | |||
| Blunt scissor | |||
| Forceps | |||
| Eppendorf tubes | |||
| Heatblock | |||
| Cork board | |||
| Benchtop refrigerated centrifuge | |||
| Recombinant Vascular Endothelial Growth Factor 165 | Reliatech | M30-004 |
Références
- Nagy, J. A., Benjamin, L., Zeng, H. Y., Dvorak, A. M., Dvorak, H. F. Vascular permeability, vascular hyperpermeability and angiogenesis. Angiogenesis. 11, 109-119 (2008).
- Engelhardt, B. Development of the blood-brain barrier. Cell and Tissue Research. 314, 119-129 (2003).
- Ruhrberg, C. Growing and shaping the vascular tree: multiple roles for VEGF. Bioessays. 25, 1052-1060 (2003).
- Risau, W. Differentiation of Endothelium. FASEB Journal. 9, 926-933 (1995).
- Strbian, D., et al. The blood-brain barrier is continuously open for several weeks following transient focal cerebral ischemia. Neuroscience. 153, 175-181 (2008).
- Weis, S. M., Cheresh, D. A. Pathophysiological consequences of VEGF-induced vascular permeability. Nature. 437, 497-504 (2005).
- Campochiaro, P. A. Molecular pathogenesis of retinal and choroidal vascular diseases. Progress in Retinal and Eye Research. 49, 67-81 (2015).
- Aman, J., et al. Effective Treatment of Edema and Endothelial Barrier Dysfunction with Imatinib. Circulation. , 126(2012).
- Claesson-Welsh, L. Vascular permeability-the essentials. Upsala J Med Sci. 120, 135-143 (2015).
- Schulte, D., et al. Stabilizing the VE-cadherin-catenin complex blocks leukocyte extravasation and vascular permeability. Embo Journal. 30, 4157-4170 (2011).
- Heinolainen, K., et al. VEGFR3 Modulates Vascular Permeability by Controlling VEGF/VEGFR2 Signaling. Circulation Research. 120, (2017).
- Eliceiri, B. P., et al. Selective requirement for Src kinases during VEGF-induced angiogenesis and vascular permeability. Molecular Cell. 4, 915-924 (1999).
- Sun, Z. Y., et al. VEGFR2 induces c-Src signaling and vascular permeability in vivo via the adaptor protein TSAd. Journal of Experimental Medicine. 209, 1363-1377 (2012).
- Fantin, A., et al. VEGF165-induced vascular permeability requires NRP1 for ABL-mediated SRC family kinase activation. Journal of Experimental Medicine. 214, 1049-1064 (2017).
- Li, X. J., et al. VEGFR2 pY949 signalling regulates adherens junction integrity and metastatic spread. Nat Commun. 7, (2016).
- Senger, D. R., et al. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid. Science. 219, 983-985 (1983).
- Miles, A. A., Miles, E. M. Vascular Reactions to Histamine, Histamine-Liberator and Leukotaxine in the Skin of Guinea-Pigs. J Physiol-London. 118, 228-257 (1952).
- Radu, M., Chernoff, J. An in vivo Assay to Test Blood Vessel Permeability. Jove-J Vis Exp. , e50062(2013).
- Roth, L., et al. Neuropilin-1 mediates vascular permeability independently of vascular endothelial growth factor receptor-2 activation. Sci Signal. 9, (2016).
- Acevedo, L. M., Barillas, S., Weis, S. M., Gothert, J. R., Cheresh, D. A. Semaphorin 3A suppresses VEGF-mediated angiogenesis yet acts as a vascular permeability factor. Blood. 111, 2674-2680 (2008).
- Teesalu, T., Sugahara, K. N., Kotamraju, V. R., Ruoslahti, E. C-end rule peptides mediate neuropilin-1-dependent cell, vascular, and tissue penetration. P Natl Acad Sci USA. 106, 16157-16162 (2009).
- Ho, V. C., Duan, L. J., Cronin, C., Liang, B. T., Fong, G. H. Elevated Vascular Endothelial Growth Factor Receptor-2 Abundance Contributes to Increased Angiogenesis in Vascular Endothelial Growth Factor Receptor-1-Deficient Mice. Circulation. 126, (2012).
- Chislock, E. M., Pendergast, A. M. Abl Family Kinases Regulate Endothelial Barrier Function In Vitro and in Mice. PLoS ONE. 8, e85231(2013).
- Busch, C. J., et al. Effects of ketamine on hypoxic pulmonary vasoconstriction in the isolated perfused lungs of endotoxaemic mice. Eur J Anaesth. 27, 61-66 (2010).
- Sinclair, M. D. A review of the physiological effects of alpha2-agonists related to the clinical use of medetomidine in small animal practice. Can Vet J. 44, 885-897 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon