Method Article
Analyse de la fonction des cellules bêta à l’aide d’imagerie calcique résolution unicellulaire dans les îlots de poisson-zèbre
Dans cet article
Résumé
Fonctionnalités de bêta-cellules sont importante pour l’homéostasie du glucose dans le sang, qui est évalué à cellule unique résolution utilisant un journaliste génétiquement codé pour l’influx de calcium.
Résumé
Cellules bêta-pancréatiques répondent aux concentrations croissantes de glucose sanguin en sécrétant de l’insuline, une hormone. La dysfonction des cellules bêta entraîne une hyperglycémie et des conséquences graves, mortelles. Comprendre comment les cellules bêta fonctionnent dans des conditions physiologiques et quels sont les facteurs génétiques et environnementaux pourraient provoquer leur dysfonctionnement pourrait conduire à meilleures options de traitement pour les patients diabétiques. La capacité à mesurer les niveaux de calcium dans les cellules bêta sert comme un indicateur important de la fonction des cellules bêta, comme l’afflux de calcium ions déclencheurs libération d’insuline. Nous décrivons ici un protocole pour la surveillance de l’influx de calcium stimulée par le glucose dans les cellules bêta-poisson-zèbre à l’aide de GCaMP6s, un capteur codé génétiquement de calcium. La méthode permet la surveillance de la dynamique de calcium intracellulaire avec résolution unicellulaire dans les îlots ex vivo monté. La glucose-réactivité des cellules bêta dans le même îlot peut être capturée simultanément sous différentes glycémies, qui suggère la présence d’hétérogénéité fonctionnelle entre cellules bêta-poisson-zèbre. En outre, la technique offre haute résolution temporelle et spatiale, qui révèle la nature oscillatoire de l’influx de calcium lors de la stimulation de la glycémie. Notre approche vous ouvre les portes pour utiliser le poisson-zèbre comme modèle pour étudier la contribution des facteurs génétiques et environnementaux à la fonction des cellules bêta et dysfonctionnement.
Introduction
Notre glycémie est maintenue dans une fourchette étroite, en grande partie grâce à la fonction du pancréas endocrine. Le rôle endocrine du pancréas est interprété par les îlots de Langerhans, qui contiennent des cellules sécrétant des hormones. Les bêta-cellules insulino-sécrétrices sont responsables de la réduction des niveaux de glycémie après un repas contenant des glucides. Diabète1, qui se caractérise par une glycémie élevée soutenue peut provoquer la sécrétion d’insuline insuffisante de cellules bêta. Type 1 et diabète de Type 2, qui ravagent actuellement déjà plus de 400 millions de personnes dans le monde, mène à la morbidité et la mortalité2. En examinant les facteurs moléculaires et environnementaux qui contribuent à la dysfonction des cellules bêta, nous comprendrons mieux comment le diabète de type 2 commence et progresse. En outre, la capacité de différencier les cellules souches humaines en cellules bêta fonctionnelle in vitro peut fournir une source de nouvelles cellules bêta pour les thérapies de remplacement cellulaire dans le diabète de Type 1. À cette fin, il est important d’étudier la fonction des cellules bêta et maturation en organismes modèles génétiques afin d’acquérir les connaissances nécessaires pour faire des bêta-cellules fonctionnelles dans un plat.
Fonctionnalités de bêta-cellules peuvent être surveillée au niveau de l’ensemble-îlot en quantifiant le montant total de l’insuline sécrétée en réponse à la stimulation de la glycémie. Cette approche cumulative étudie l’îlot comme un seul groupe de cellules sans différencier les propriétés individuelles d’une cellule. Cependant, l’analyse de la réponse glycémique de bêta-cellules individuelles ont révélé une diversité dans les propriétés fonctionnelles des cellules bêta et la présence d’hétérogénéité3. Pour évaluer la fonction des cellules bêta individuelles, il est possible de surveiller les changements intracellulaires qui mènent à la sécrétion de l’insuline4. La sécrétion d’insuline est précédée par une entrée du glucose dans les cellules bêta. Le glucose qui pénètre dans les cellules bêta est rapidement métabolisé à l’ATP. Des concentrations plus élevées d’ATP intracellulaires diminuent la probabilité d’ouverture des canaux d’ion potassium ATP-sensibles conduisant à une dépolarisation des cellules bêta. Dépolarisation ouvre les canaux d’ion calcium sensibles à la tension et augmente le calcium intracellulaire. À son tour, calcium déclenche l’exocytose de l’insuline, qui est libérée dans la circulation et diminue la glycémie en favorisant l’utilisation du glucose5,6,7.
Plusieurs stratégies ont été appliquées pour étudier la fonction des cellules bêta, y compris la surveillance du potentiel de membrane8, visualisation directe de l’insuline-vésicules d’exocytose9et la quantification des intracellulaire Ca2 + afflux comme indicateur de glycémie-réactivité10. Parmi eux, l’imagerie du Ca intracellulaire2 + présente l’avantage de l’analyse à plusieurs cellules individuelles dans le même îlot11,12, permettant une comparaison directe de la glycémie-réactivité entre élargissement bêta-cellules individuelles. Ca2 + concentration intracellulaire peut être surveillée à l’aide de colorants fluorescents sensible au calcium13 ou calcium codé génétiquement indicateurs (GECIs)14. Considérant que la spécificité de type cellulaire manque colorants calcium-indicateur, GECIs peut être exprimée dans un type de cellule spécifique de promoteurs spécifiques. En outre, la nouvelle génération de GECIs, tels que GCaMP6, offre meilleur rapport signal-bruit plus rapidement la dynamique temporelle15. Nous décrivons ici l’utilité de la nouvelle génération de GECIs, en particulier GCaMP6s, de visualiser le calcium dans les cellules bêta à cellule unique résolution. Nous appliquons cette méthode à l’îlot principal de poisson-zèbre comme notre modèle de choix. Durant le développement embryonnaire, bêta-cellules dans l’îlot primaire proviennent de la partie dorsale et ventrale du pancréas bourgeons16. L’îlot principal est situé dans une position anatomique stéréotypée dans le pancréas de poisson-zèbre, permettant son identification facile et l’isolement. Bêta-cellules dans l’îlot primaire sont nécessaires pour la régulation du glucose, leur ablation génétique conduit à une hyperglycémie17,18. En outre, ces cellules bêta devient glucose-réactif lors de développement précoces zebrafish19. Ce protocole peut être également appliqué à imagerie les îlots secondaires, qui forment aux stades postembryonnaire. Le protocole permet aux cellules bêta image ex vivo, à un stade ultérieur du développement et sous des concentrations de glucose définie.
Protocole
Toutes les procédures y compris les sujets animaux ont été approuvés par la Loi sur la protection des animaux et avec la permission de le Landesdirektion Sachsen, Allemagne (AZ 24-9168.11-1/2013-14, T12/2016).
1. préparation
Remarque : Ce protocole est pour ex vivo l’imagerie du poisson-zèbre îlot primaire de double transgéniques Tg (ins:nls-Renilla-mKO2 ; cryaa:CFP) ; TG (ins:GCaMP6s ; cryaa:mCherry) 19 poissons zèbres. Dans cette lignée transgénique, le promoteur de l’insuline (ins) lecteurs expression spécifique des cellules bêta des deux transgènes : nls-Renilla-mKO2, qui marque le noyau de cellules bêta avec monomère Kusabira orange 2 (mKO2) fluorescence ; et GCaMP6s15, qui émet une fluorescence verte en réponse à l’augmentation des taux de calcium intracellulaire. L’expression spécifique des bêta-cellules de GCaMP6s permet d’étudier la glucose-réactivité des cellules bêta sans interférence de modifications de calcium qui entourent les types de cellules.
- Préparer le stock de fibrinogène fraîches (10 mg/mL) dissoudre 10 mg de fibrinogène bovin dans 1 mL de Ca2 +/Mg2 +-contenant la solution saline équilibrée de la Hanks (HBSS) dans un tube à centrifuger 1,5 mL. Vortex vigoureusement jusqu'à ce que la poudre de fibrinogène se dissout complètement. Conserver la solution à température ambiante pendant au moins 15 min de plus.
Remarque : Le stock peut être conservé à température ambiante pendant 2 à 3 h. jeter le stock si la solution commence à se polymériser et devient visqueuse. - Préparer la solution de travail de fibrinogène (3,3 mg/mL) en diluant le stock de fibrinogène HBSS en trois volets. Par exemple, mélanger 300 µL de stock de fibrinogène dans 600 µL de HBSS préparer 900 µL de solution de travail de fibrinogène.
- Préparer la solution de thrombine (10 U/mL) en dissolvant les 10 unités de la thrombine dans 1 mL de HBSS ou phosphate buffered saline (PBS).
Remarque : Cette solution peut être préparée à l’avance, aliquotée en 50 parties µL et congelée à-20 ° C. - Préparez 200 mM solution de D-glucose en dissolvant 1,8 g de D-Glucose dans 50 mL d’eau. Conserver à 4 ° C pour le stockage à long terme.
- Préparer 300 mM solution KCl en dissolvant 1,1 g de KCl dans 50 mL d’eau. Conserver à 4 ° C pour le stockage à long terme.
- Se procurer 35 mm plats de fond en verre de diamètre pour le montage des îlots.
- Pour la dissection et le montage de l’îlot, utiliser un microscope stéréo équipé de lampe à fluorescence et le filtre rouge cube (TRITC : excitation : 532 – 554 nm ; émission : 570 – 613 nm ; ou Texas-rouge : excitation : 540 – 580 nm ; émission : 592 – 667 nm).
- D’imagerie de l’influx de calcium dans les cellules bêta, utiliser un microscope inversé confocal (Zeiss LSM 780 ou similaire) avec 20 X (NA 0,8) objectif de l’air et équipé d’un support de plaque pour les plats de fond en verre de diamètre 35 mm.
- Préparer une solution de 200 mg/L de méthane-sulfonate de tricaïne (MS222) pour euthanasier le poisson-zèbre.
- Se procurer des boîtes de Petri de 90 mm pour la dissection du poisson-zèbre.
2. montage et Dissection îlot primaire de poisson-zèbre
- Euthanasier un poisson à l’aide d’une incubation prolongée dans MS222. Pour ce faire, délicatement retirer le poisson de l’aquarium à l’aide d’un filet de pêche et il incuber dans une boîte de Pétri contenant la solution de MS222 jusqu'à ce que l’animal ne présente aucun mouvement operculaire (branchies) ; en général, cela prend 5 min. transfert du poisson à une boîte de Pétri contenant la solution HBSS avec Ca2 +/Mg2 +.
-
Sous un microscope stéréo équipé d’une lampe à fluorescence et un filtre rouge cube, disséquer la peau couvrant le côté droit de l’abdomen de l’animal afin d’isoler le pancréas.
- Pour ce faire, couper la peau du poisson-zèbre de bouche à la nageoire anale avec une pincette pointus. Décollez la peau coupée pour exposer l’abdomen ; cette capture expose les organes internes. En utilisant la fluorescence rouge d’expression mKO2 en bêta-cellules, déterminer l’emplacement des îlots par examen visuel sous le microscope. Si nécessaire, enlever les lobes du foie, car ils pourraient couvrir l’îlot, le rendant difficile à trouver.
Remarque : L’îlot principal se trouve près de la région antérieure de l’abdomen, généralement sur le côté droit.
- Pour ce faire, couper la peau du poisson-zèbre de bouche à la nageoire anale avec une pincette pointus. Décollez la peau coupée pour exposer l’abdomen ; cette capture expose les organes internes. En utilisant la fluorescence rouge d’expression mKO2 en bêta-cellules, déterminer l’emplacement des îlots par examen visuel sous le microscope. Si nécessaire, enlever les lobes du foie, car ils pourraient couvrir l’îlot, le rendant difficile à trouver.
- Nettoyer l’îlot primaire en enlevant soigneusement les tissus environnants comme le foie et les adipocytes. Prendre les précautions pas de blesser ou de fouiller l’îlot ; après l’effacement du tissu environnant, les cellules individuelles sur la surface de l’îlot devient perceptibles.
- Déposer une goutte de 30 µL de HBSS dans le centre d’un plat de fond en verre. Transférer l’îlot disséqué à cette baisse.
- Laver soigneusement l’îlot une fois avec HBSS et une fois avec 30 µL de la solution de travail de fibrinogène (3,3 mg/mL). Veillez à éviter le séchage de l’îlot au cours des étapes de lavage, car si vous provoque la mort cellulaire.
- Lentement et délicatement ajouter 10 µL de la solution de thrombine (10 U/mL). L’îlot et le plat laisser intacte pendant 15 à 20 min. Observe que la baisse du fibrinogène-thrombine deviendra visqueuse et légèrement opaque à ce stade.
3. Ex Vivo Live-imagerie de l’intensité de Fluorescence GCaMP dans les îlots de poisson-zèbre primaire
- Ajouter 200 µL de HBSS sur le dessus du moule et placez le plat délicatement sur le support de plaque du microscope confocal. Utilisez un objectif d’air X, NA 0,8, 20 pour l’imagerie confocale. Localiser l’îlot à l’aide de l’option de fond clair.
- Utilisation du filtre pour fluorescence rouge consulter la fluorescence nucléaire mKO2 aux cellules bêta, se concentrer sur l’îlot. Noyaux individuels doivent être clairement visibles.
- Localiser un plan clair d’imagerie en modifiant manuellement le plan focal du microscope confocal afin de se déplacer dans l’épaisseur de l’îlot le long de son axe z. S’assurer que le plan d’imagerie contient un nombre suffisant (50 – 100) de cellules bêta pour l’imagerie et la luminosité de la fluorescence nucléaire mKO2 est uniforme, en particulier dans le centre de l’îlot.
- Mettre en place une acquisition séquentielle pour GCaMP6s et mKO2 de fluorescence en utilisant les paramètres suivants dans le Menu Setup « Smart » : GCaMP6s, excitation : 488 nm ; émission : 500 555 nm, fausses couleurs : vert (Select « GFP ») ; mKO2, excitation : 561 nm (mCherry), émission : 570 à 630 nm, fausses couleurs : rouge (sélectionnez « mCherry »).
Remarque : Ce paramètre, le canal rouge va enregistrer la position des noyaux des cellules bêta, tandis que la couche verte va enregistrer l’intensité de fluorescence GCaMP. - En Mode « Acquisition », réglez la résolution de l’image à 1 024 x 1 024 pixels, la vitesse à 10 et une moyenne de 1. Initier un continu d’enregistrement en sélectionnant l’option « Time-series », définition de la « durée » pour 500 cycles, avec environ 2 temps d’acquisition de s par image.
Remarque : Les 50 premiers cadres de la série chronologique correspondant à l’activité des bêta-cellules à une concentration de glucose 5 mM. C’est la réponse de la base. Une cellule bêta ayant répondu au questionnaire montrera l’épilation à la cire et le déclin de l’intensité de la fluorescence verte avec le temps. Nous avons observé que quelques (1 à 5 %) des bêta-cellules osciller à 5 mM de glucose. -
Gardez un oeil sur le cycle d’imagerie. Après les 50 premiers cadres, augmenter la concentration en glucose de la solution environnante à 10 mM sans arrêter l’enregistrement.
- Sans perturber l’acquisition d’images, Pipetez doucement 5 µL de la solution de D-glucose surface du gel tenant l’îlot de 200 mM. Acquérir 150 images à 10 mM de glucose.
NOTE : L’augmentation de la concentration de glucose va augmenter le nombre de cellules bêta subissant GCaMP fluorescentes oscillations dans le canal vert. - Veiller à ce que les noyaux des cellules restent stables au cours du processus. Si l’îlot secoue beaucoup lors de l’acquisition et les noyaux sont déplacent hors du plan focal, jeter l’échantillon (si nécessaire).
- Attendre un délai suffisant pour permettre la polymérisation du moule fibrinogène-thrombine afin d’assurer la stabilité des échantillons ultérieures.
- Sans perturber l’acquisition d’images, Pipetez doucement 5 µL de la solution de D-glucose surface du gel tenant l’îlot de 200 mM. Acquérir 150 images à 10 mM de glucose.
- À 200 images, accroître la concentration de la solution à 20 mM de pipetage doucement 10 µL de la solution de D-glucose de 200 mM. Acquérir 150 cadres pour la concentration de 20 mM.
- Après 350 cadres, dépolariser l’îlot à l’aide de 30 mM de KCl. Pour ce faire, ajouter 20 µL de la solution mère de KCl de 300 mM. À ce stade, observer que les oscillations de fluorescence GCaMP6s arrêtera et difficulté à forte intensité ; bêta-cellules qui n’ont pas répondu au glucose peuvent également afficher une augmentation d’intensité de fluorescence vert lors de l’addition de KCL.
4. quantification des GCaMP Trace de Fluorescence pour les bêta-cellules individuelles
Remarque : Pour tracer et quantifier les réponses des bêta-cellules individuelles à différents niveaux de glucose, quantifier l’intensité de fluorescence GCaMP pendant toute la période d’imagerie. Quantification est effectuée à résolution cellulaire. Pour ce faire, utilisez Fidji20 pour extraire les valeurs d’intensité de la fluorescence de la GCaMP de l’images (mesures 4.1 – 4,6) et le tableur ou la R21 pour effectuer l’analyse (4,8 à 4,9).
- Ouvrez le fichier image à Fidji, à l’aide de la boîte à outils « LSM ». Pour ce faire, sélectionnez « Plugin | LSM Toolbox | Voir la boîte à outils LSM ». « LSM boîte à outils », cliquez sur « Open LSM » et sélectionnez le fichier image.
Remarque : Pour les formats ne pas pris en charge par la « boîte à outils de LSM », convertissez-les pour tiff pour l’analyse. - Extraire les réponses des cellules à l’aide de l’outil (ROI) de région d’intérêt dans les îles Fidji. Ouvrir le « gestionnaire de retour sur investissement » dans le menu « Analyser » sous « Outils ». Dessinez manuellement le retour sur investissement avec le « outil de sélection polygone » situé dans la barre d’outils.
- Dessiner le ROI dans le canal rouge dans lequel les noyaux de cellules bêta sont visibles. Sélectionnez le ROI tel qu’il couvre une zone qui est plus grande que le noyau de la cellule afin d’inclure une partie du cytoplasme de la cellule. S’assurer que la position du ROI est cohérente entre les cadres et ajuster la position si nécessaire.
- Ajouter la ROIs sélectionnée dans le « gestionnaire de ROI » en cliquant sur le bouton « Ajouter [traduction] ». Sélectionnez et ajoutez plusieurs ROIs pour le retour sur investissement pour obtenir des données sur plusieurs cellules.
- Ensuite, dans le menu « Analyze », sélectionnez « Définir des mesures ». Sélectionnez « Densité intégrée » pour spécifier l’extraction de l’intensité de fluorescence totale au sein de la zone.
- Passer à la couche verte contenant la fluorescence GCaMP et sélectionnez « Mesure Multi » dans le « gestionnaire de ROI ».
Remarque : Cela vous donnera les mesures d’intensité pour les cellules tout au long de la série chronologique. - Dans le cas où la position du ROI doit être réajustée en raison du mouvement de l’îlot, manuellement compiler les mesures d’intensité dans des cadres différents. Copiez et collez les valeurs dans une feuille de calcul distincte.
- Obtenir les horodatages des cadres image de « Boîte à outils de la LSM ». Utilisation « appliquer timbres | Appliquer timbres t | Nom du fichier | Dump pour le fichier texte » afin d’obtenir l’horodatage. Sauver les horodatages en utilisant l’option « Enregistrer sous », ou copiez-les dans la feuille de calcul.
- Lors de la compilation les valeurs d’intensité pour toutes les cellules, effectuer l’analyse une cellule à un moment ou automatiquement (par exemple, en utilisant des formules Excel ou R).
-
Analyser les cellules individuelles en deux étapes.
- Dans un premier temps, calculer l’intensité de fluorescence au-dessus de la ligne de base. À cette fin, calculer l’intensité de fluorescence de base (F0) la moyenne des intensités de fluorescence pour les 50 premières frames (5 mM de glucose). Puis soustraire la ligne de base (F0) de la série chronologique entière (F – F0).
NOTE : quelques cellules peuvent montrer des oscillations GCaMP claires sous la glycémie basale, qui continuent généralement suite à une stimulation avec des concentrations plus élevées. Pour ces cellules, il est seulement possible d’estimer F0 en prenant l’intensité moyenne des trames initiales dans lequel les cellules ont montré une baisse de fluorescence. - Dans la deuxième étape de l’analyse, obtenir l’intensité de fluorescence GCaMP finale en normalisant l’intensité de la fluorescence.
NOTE : Ceci est réalisé pour supprimer les différences entre les îlots des différents animaux. Îlots individuels affichent différents niveaux d’émission de fluorescence lors de la stimulation de la glycémie. - Normaliser l’intensité de la fluorescence en le divisant par la valeur d’intensité plus élevée. Pour cela, calculer l’intensité du PIC (Fmax -F,0) et diviser les valeurs planifiées soustraite par l’intensité maximale pour obtenir l’intensité de fluorescence GCaMP finale (F – F0) / (Fmax – F0).
- Dans un premier temps, calculer l’intensité de fluorescence au-dessus de la ligne de base. À cette fin, calculer l’intensité de fluorescence de base (F0) la moyenne des intensités de fluorescence pour les 50 premières frames (5 mM de glucose). Puis soustraire la ligne de base (F0) de la série chronologique entière (F – F0).
- Jeter les cellules qui ne montrent pas un changement dans l’intensité après stimulation de KCl, car ils pourraient être endommagés ou malsain.
- Pour effectuer l’analyse (4,9 – 4.10) de R, utilisez le script de R (plotcelltrace. R) fourni avec ce manuscrit.
Résultats
En utilisant le protocole décrit ci-dessus, la réponse glycémique de cellules bêta dans un îlot d’une 45 jours après la fécondation (dpf) zebrafish ont été analysés. Pour ce faire, l’îlot primaire a été disséqué provenant d’un animal euthanasié et monté dans le moule de fibrinogène-thrombine dans un plat à fond en verre. L’îlot a été plongé dans HBSS contenant du glucose 5 mM. La concentration de glucose a augmenté de façon graduelle à 10 mM et 20 mM. On a enregistré les réponses des cellules bêta pour les concentrations croissantes de glucose. Enfin, cellules bêta ont été dépolarisés à l’aide de 30 mM de KCl (Figure 1). La dépolarisation à l’aide de KCl induit entrée de calcium dans les bêta-cellules saines.
À l’aide de Fidji et un logiciel d’analyse de données, l’intensité de fluorescence GCaMP6s de bêta-cellules individuelles est extraite et normalisée (Figure 2). Vu sur la trace de l’intensité de la fluorescence, bêta-cellules individuelles affichent oscillations GCaMP6s fluorescence lors de la stimulation de glucose, qui s’arrête lors de la stimulation de KCl. La technique fournit une résolution cellulaire du glucose bronchique de la bêta-cellule et une fenêtre dans leurs fonctionnalités.
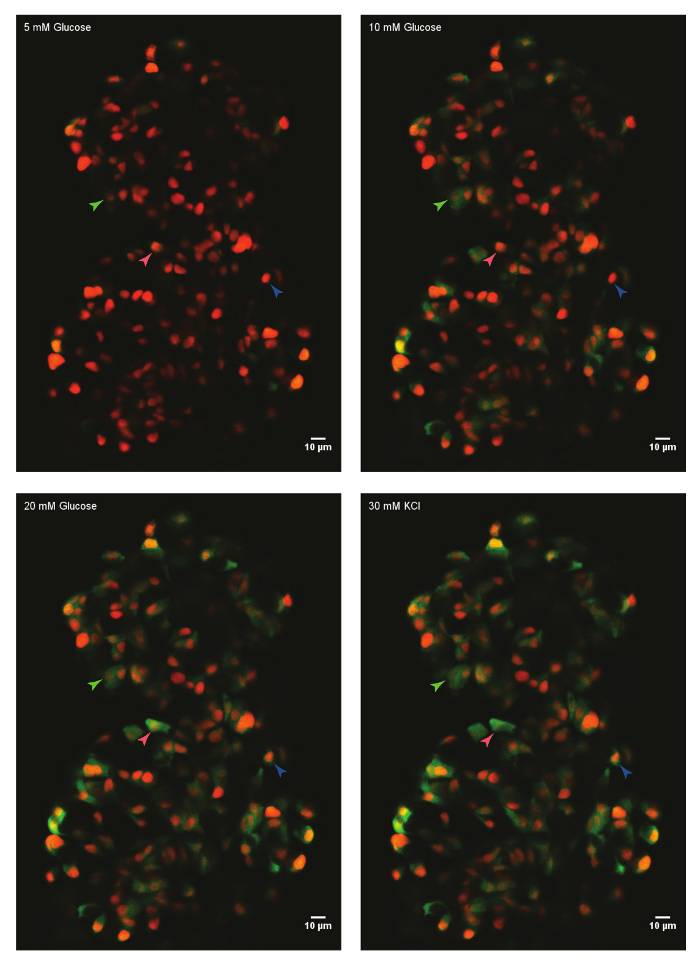
Figure 1 : Ex vivo live-imagerie des influx de calcium à l’aide de GCaMP6s en bêta-cellules de poissons zèbres. Un îlot primaire de Tg(ins:nls-Renilla-mKO2) ; TG(ins:GCaMP6s) poisson-zèbre (45 dpf) était monté dans le moule de la thrombine-fibrinogène et incubée avec le glucose (basales) de 5 mM. Bêta-cellules sont marquées avec un marqueur rouge nucléaire, alors que la fluorescence GCaMP6s est présente dans la couche verte. L’îlot a été stimulé avec une glycémie-rampe composée d’incubation séquentielle avec 10 mM et 20 mM de D-glucose et dépolarisé via l’ajout de 30 mM, KCl. flèches marquent les bêta-cellules individuelles, dont l’activité a été analysée. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
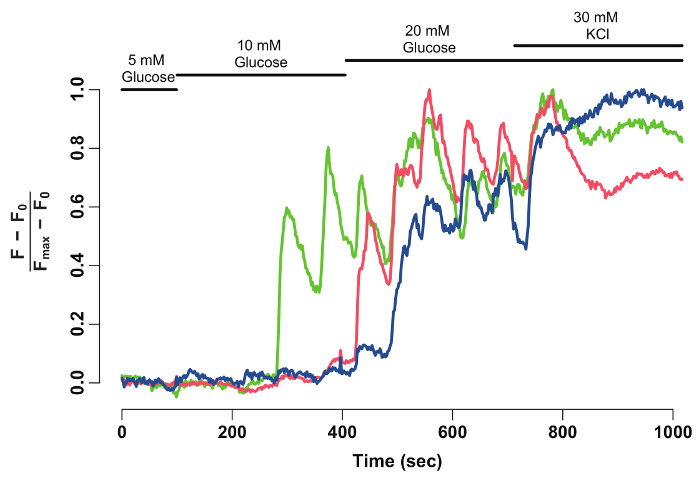
Figure 2 : normalisé GCaMP6s intensité de fluorescence-trace pour bêta-cellules individuelles. Normalisé GCaMP6s fluorescence intensité-trace pour les bêta-cellules munies de pointes de flèches dans la Figure 1. L’axe des abscisses représente le temps en secondes. En haut, barres représentent la concentration de glucose et de KCl dans le milieu HBSS. L’axe des y indique l’intensité de la fluorescence normalisée au cours de la série chronologique. Pour ce faire, intensité (F0) de la ligne de base est calculée comme l’intensité moyenne pendant l’incubation en glucose 5 mM. C’est soustraite de l’ensemble des données chronologiques (F - F,0). La ligne de base intensité-over est normalisée par l’intensité maximale affichée par la cellule (F - F,0) / (Fmax- F0). La trace normalisée montre une réaction oscillante de cellules bêta au glucose, qui se stabilise lorsque les cellules sont dépolarisés avec 30 mM KCl. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Nous démontrons une technique permettant la quantification de la réactivité de glucose des cellules bêta à cellule unique résolution. Ceci est rendu possible en surveillant la concentration intracellulaire en calcium à l’aide d’un indicateur de calcium codé génétiquement, GCaMP6s. L’activité de cellules bêta est capturé ex vivo par le montage de l’îlot dans un moule de thrombine-fibrinogène. Une étape critique du protocole est la stabilité du moule. Un délai suffisant doit être accordée pour le fibrinogène se dissoudre dans la solution HBSS. Sans cela, le moule ne pas polymériser suffisamment pour assurer la stabilité pendant la session d’imagerie. Un îlot monté dans le moule de la thrombine-fibrinogène et plongé dans les milieux de culture de cellules peut rester viable pendant au moins une semaine (données non présentées). Des solutions de rechange au moule thrombine-fibrinogène, tels que l’agarose de la bas point de fusion, peuvent être utilisées pour monter l' îlot22. Un autre paramètre essentiel est la dissection de l’îlot. Au cours de cette étape, les tissus entourant l’îlot doit être retiré sans blesser ou piquer l’îlot. Une dissection habile vient avec la pratique.
Une limitation du protocole d’imagerie est la restriction à un seul plan confocal de l’îlot. Ceci est fait pour saisir la dynamique de l’influx de calcium dans les cellules bêta individuelles. Une Z-pile à travers toute l’épaisseur de l’îlot conduit aux basses vitesses et perte du signal oscillant de cellules individuelles d’imagerie. Cette limitation pourrait être améliorée en utilisant un moyen plus rapide d’imagerie confocale-telles que la microscopie de filature-disque, permettant de saisir la dynamique du calcium en 3 dimensions. Une autre frontière serait in vivo calcium d’imagerie12. La nature transparente de l’embryon de poisson zèbre ou l’utilisation de souches de pigment-moins de poissons zèbres adultes23 pourrait ouvrir la possibilité d’en vivo imagerie dans l’avenir.
L’imagerie de l’activité des cellules bêta à haute résolution spatiale et temporelle permet d’étudier l’hétérogénéité fonctionnelle entre les bêta-cellules individuelles. Cette approche peut faire toute la lumière sur l’existence de certaines sous-populations de cellules bêta. Récemment, plusieurs études ont montré l’existence de sous-populations dans les cellules bêta nominalement homogène24,25,26. Ex vivo imagerie est cumulable avec les journalistes génétiques pour caractériser de la réponse de la population-void au glucose. En outre, combinant le programme d’installation d’imagerie avec stimulation pharmacologique peut permettre de dépister des composés susceptibles d’améliorer la fonctionnalité des cellules bêta.
En résumé, la technique présentée ici permet de quantifier et comparer la réactivité de glucose pour les bêta-cellules individuelles. Il fournit une fenêtre directe dans la fonctionnalité des cellules bêta, un paramètre important dans le développement du diabète.
Déclarations de divulgation
Les auteurs déclarent sans intérêts financiers concurrents.
Remerciements
Nous remercions les membres du laboratoire Ninov pour commentaires sur le manuscrit, membres du Centre pour installation de poisson et microscopie de Dresde de thérapies régénératives (CRTD) pour l’assistance technique. N.N. est financé par la DFG-CRTD, Cluster d’Excellence à TU-Dresden, Fondation allemande de la recherche (DFG) et le Centre allemand de recherche sur la diabète (DZD).
matériels
| Name | Company | Catalog Number | Comments |
| Transgenic Zebrafish line: Tg(ins:nls-Renilla-mKO2; cryaa:CFP); Tg(ins:GCaMP6s; cryaa:mCherry) | By request from authors | ||
| Stereo microscope | ZEISS | 495015-0001-000 | SteREO Discovery.V8 |
| Fluorescence lamp | ZEISS | 423013-9010-000 | Illuminator HXP 120 V |
| Red Filter Cube | ZEISS | 000000-1114-462 | Filter set 45 HQ TexasRed |
| Confocal Microscope | ZEISS | LSM 780 | |
| Bovine fibrinogen | Sigma | F8630 | |
| HBSS (Hanks' Balanced Salt solution) | ThermoFisher | 14025092 | |
| Thrombin | Sigma | T4648 | |
| D-Glucose | Sigma | G8270 | |
| KCl | Sigma | P9333 | |
| 35 mm diameter glass-bottom dishes | ThermoFisher | 150680 | |
| tricaine methane sulfonate | Sigma | E10521 | |
| Fine Forceps | Fine Science Tools | 11445-12 | |
| FIJI, using ImageJ Version: 2.0.0-rc-43/1.50e | https://fiji.sc/ | ||
| R, version 3.2.4 | https://www.r-project.org/ | ||
| RStudio | https://www.rstudio.com/ | ||
| plotcelltrace.R | A custom script provided with the manuscript |
Références
- Kahn, S. E. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia. 46 (1), 3-19 (2003).
- Ogurtsova, K., et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 128, 40-50 (2017).
- Pipeleers, D. G. Heterogeneity in pancreatic beta-cell population. Diabetes. 41 (7), 777-781 (1992).
- MacDonald, P. E., Joseph, J. W., Rorsman, P. Glucose-sensing mechanisms in pancreatic beta-cells. Philos Trans R Soc Lond B Biol Sci. 360 (1464), 2211-2225 (2005).
- Hellman, B., et al. Glucose induces oscillatory Ca2+ signalling and insulin release in human pancreatic beta cells. Diabetologia. 37, S11-S20 (1994).
- Bergsten, P., Grapengiesser, E., Gylfe, E., Tengholm, A., Hellman, B. Synchronous oscillations of cytoplasmic Ca2+ and insulin release in glucose-stimulated pancreatic islets. J Biol Chem. 269 (12), 8749-8753 (1994).
- Wollheim, C. B., Pozzan, T. Correlation between cytosolic free Ca2+ and insulin release in an insulin-secreting cell line. J Biol Chem. 259 (4), 2262-2267 (1984).
- Pace, C. S., Price, S. Electrical responses of pancreatic islet cells to secretory stimuli. Biochem Biophys Res Commun. 46 (4), 1557-1563 (1972).
- Ohara-Imaizumi, M., Nakamichi, Y., Tanaka, T., Ishida, H., Nagamatsu, S. Imaging exocytosis of single insulin secretory granules with evanescent wave microscopy: distinct behavior of granule motion in biphasic insulin release. J Biol Chem. 277 (6), 3805-3808 (2002).
- Soria, B., Martin, F. Cytosolic calcium oscillations and insulin release in pancreatic islets of Langerhans. Diabetes Metab. 24 (1), 37-40 (1998).
- Kenty, J. H. R., Melton, D. A. Testing pancreatic islet function at the single cell level by calcium influx with associated marker expression. PLoS One. 10 (4), e0122044 (2015).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Bootman, M. D., Rietdorf, K., Collins, T., Walker, S., Sanderson, M. Ca2+-sensitive fluorescent dyes and intracellular Ca2+ imaging. Cold Spring Harb Protoc. 2013 (2), 83-99 (2013).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Hesselson, D., Anderson, R. M., Beinat, M., Stainier, D. Y. R. Distinct populations of quiescent and proliferative pancreatic beta-cells identified by HOTcre mediated labeling. Proc Natl Acad Sci U S A. 106 (35), 14896-14901 (2009).
- Pisharath, H., Rhee, J. M., Swanson, M. A., Leach, S. D., Parsons, M. J. Targeted ablation of beta cells in the embryonic zebrafish pancreas using E. coli nitroreductase. Mech Dev. 124 (3), 218-229 (2007).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat Protoc. 3 (6), 948-954 (2008).
- Singh, S. P., et al. Different developmental histories of beta-cells generate functional and proliferative heterogeneity during islet growth. Nat Commun. 8 (1), 664 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676 (2012).
- R Core Team. . R: A Language and Environment for Statistical Computing. , (2016).
- Friedman, R. S., et al. An evolving autoimmune microenvironment regulates the quality of effector T cell restimulation and function. Proc Natl Acad Sci. 111 (25), 9223-9228 (2014).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Bader, E., et al. Identification of proliferative and mature β-cells in the islets of Langerhans. Nature. 535 (7612), 430-434 (2016).
- Dorrell, C., et al. Human islets contain four distinct subtypes of β cells. Nat Commun. 7, 11756 (2016).
- Johnston, N. R., et al. Beta Cell Hubs Dictate Pancreatic Islet Responses to Glucose. Cell Metab. 24 (3), 389-401 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon