Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
In Vitro Élevage des abeilles solitaires : un outil pour évaluer les facteurs de risque larvaire
Dans cet article
Résumé
Pulvérisations sur les plantes à fleurs peuvent vous exposer à de fortes concentrations de résidus de fongicide transmissibles par le pollen des abeilles solitaires. À l’aide d’expériences en laboratoire in vitro-larves d’abeilles élevés, cette étude examine les effets interactifs de consommer le pollen traitées par des fongicides dérivé de plantes hôte et non hôte.
Résumé
Bien que les abeilles solitaires offrent des services de pollinisation crucial pour les cultures sauvages et gérés, ce groupe riche en espèces a été largement négligé dans les études de réglementation des pesticides. Le risque d’exposition à des résidus de fongicide est susceptible d’être particulièrement élevé si le jet se produit sur ou à proximité des plantes hôtes tandis que les abeilles recueillent pollen pour provisionner leurs nids. Pour les espèces de Osmia qui consomment le pollen d’un groupe restreint de plantes (oligolecty), l’impossibilité d’utiliser le pollen provenant de plantes non hôtes peut augmenter leur facteur de risque de toxicité liée à fongicide. Ce manuscrit décrit les protocoles utilisés pour élever avec succès oligolectiques mason bees, Osmia ribifloris sensu lato, de l’oeuf au stade prénymphal au plaques de culture cellulaire dans des conditions de laboratoire normalisées. L' in vitro-élevage d’abeilles sont ensuite utilisés pour étudier les effets de la source de l’exposition et le pollen fongicide sur l’aptitude de l’abeille. Selon un plan factoriel 2 x 2 entièrement traversé, l’expérience examine les effets principaux et interactives de la source de l’exposition et le pollen fongicide sur la forme larvaire, quantifiée par la biomasse prénymphale, durée du développement larvaire et survie. Un avantage majeur de cette technique est que l’utilisation en vitro-élevage d’abeilles réduit la variabilité de fond naturel et permet la manipulation simultanée de multiples paramètres expérimentaux. Le protocole décrit présente un outil polyvalent pour hypothèses essais portant sur la suite des facteurs affectant la santé des abeilles. Pour les efforts de conservation à respecter avec des succès significatifs et durables, ces connaissances sur l’interaction complexe de facteurs physiologiques et environnementales à l’origine des déclins de l’abeille seront révélera pour être critique.
Introduction
Compte tenu de leur rôle comme le groupe dominant des insectes pollinisateurs1, la perte globale dans les populations d’abeilles constitue une menace pour la sécurité alimentaire et l’écosystème stabilité2,3,4,5,6 ,,7. Les tendances à la baisse dans les deux populations d’abeilles sauvages et non managées ont été attribués à plusieurs facteurs de risque partagés, y compris la fragmentation de l’habitat, émergeant des parasites et pathogènes, perte de diversité génétique et l’introduction d’espèces envahissantes3 ,4,7,8,9,10,11,12. En particulier, l’augmentation spectaculaire de l’utilisation des pesticides, (p. ex., les néonicotinoïdes) a été directement liée à des effets néfastes chez les abeilles13,14,15. Plusieurs études ont montré que la synergie entre les néonicotinoïdes et ergostérol-inhibiteur de la biosynthèse des fongicides (EBI) peut entraîner une mortalité élevée à travers plusieurs abeilles espèces16,17,18 , 19 , 20 , 21 , 22. Néanmoins, fongicides, longtemps considéré comme « bee-safe », continuent à être pulvérisés sur les cultures en fleurs sans beaucoup d’examen minutieux23. Abeilles butineuses ont été documentés pour ramener systématiquement les masses polliniques contaminés par des résidus de fongicide24,25,26. La consommation de ce fongicides-ladenpollen peut provoquer une mortalité élevée chez les larves d’abeilles27,28,29,30et une suite d’effets sublétaux chez les abeilles adultes16 , 31 , 32 , 33 , 34. une étude récente suggère que fongicides peuvent provoquer des pertes d’abeilles en altérant la communauté microbienne au sein de la ruche-stockée pollen, perturbant ainsi les symbioses critiques entre les abeilles et les microbes transmis par pollen35.
Bien que les abeilles solitaires sont indispensables à la pollinisation de plusieurs plantes sauvages et agricoles36,37,38, ce groupe diversifié des pollinisateurs a reçu beaucoup moins d’attention dans les études de surveillance des pesticides. Le nid d’une femelle adulte solitaire contient 5-10 chambres de couvée scellées, chacun agrémentés d’une masse finie de maternellement Collector pollen et nectar et un seul oeuf39. Après l’éclosion, les larves s’appuient sur la fourniture de pollen allouée et la microflore transmises par pollen associée afin d’obtenir une nutrition adéquate40,41. Parce qu’ils n’ont pas les avantages d’un mode de vie sociale, abeilles solitaires peuvent être plus vulnérables aux pesticides exposition42. Par exemple, tandis que des déficits sociaux abeilles après une pulvérisation peut être compensée à certains étendent en travailleurs et nouvelles couvées, la mort d’une seule femelle solitaire adulte termine toute activité reproductrice43. Ces différences de sensibilité mettent en évidence la nécessité d’incorporer des taxons divers abeille en études écotoxicologiques pour assurer une protection adéquate pour les abeilles sauvages et non managée comme. Toutefois, mis à part une poignée d’études, enquêtes sur les effets de l’exposition de fongicide a surtout à abeilles sociales18,23,32,44,45 ,46,47,48,49.
Les abeilles solitaires appartenant au genre Osmia (Figure 1) ont été utilisés dans le monde entier comme des pollinisateurs efficaces de plusieurs importants fruits et noix cultures39,50,51,53, 53. comme avec les autres pollinisateurs managé regroupe24,,du5455,56,57,58, abeilles Osmia adultes sont systématiquement exposés aux fongicides pulvérisés sur les cultures en fleurs44. Femelles adultes nourrissent les cultures récemment pulvérisées peuvent recueillir et stocker leurs chambres de couvée avec du pollen de fongicide-laden, qui constitue plus tard le régime unique pour les larves en développement. Consommer les dispositions du pollen contaminé peut exposer ensuite les larves à des résidus de fongicide42. Le risque d’exposition peut être plus élevé chez les espèces d’oligolectiques qui s’alimentent uniquement sur quelques proches hôte plantes59,60,61. Certaines abeilles mégachiles, par exemple, semblent préférentiellement recherchent le pollen de faible qualité des Astéracées, comme un moyen de réduire le parasitisme62. Toutefois, l’étendue des auquel fongicides répercussions de remise en forme larvaire chez les abeilles solitaires oligolectiques n’a pas été empiriquement quantifiée. L’objectif de cette étude est d’élaborer un protocole pour tester les principaux et des effets interactifs de la source de l’exposition et le pollen fongicide sur l’aptitude de in vitro élevés des abeilles solitaires. Pour étudier, oeufs de ribifloris o. sensu lato (s.l.) peuvent être obtenus sur le marché (Table des matières). Cette population est idéale en raison de son importance comme un pollinisateur natif et sa forte prédilection pour les riches en nectar Mahonia aquifolium (Mahonia nervé) trouvés dans la région53,63,64 (Figure 2).

Figure 1. Une photo à haute résolution d’un adulte Osmia ribifloris. Crédit photographique Dr Jim Cane, recherche entomologiste, USDA-ARS s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2. Phragmite nidification roseaux de Osmia ribifloris (s.l.) avec une femelle de nidification à l’avant-plan. Partitions de chambre et prises terminales pour les anches sont construits à partir des feuilles mastiquées. Photo crédit M. Kimball Clark, NativeBees.com s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Le premier objectif de cette étude est d’évaluer l’effet de la consommation de pollen traitées par des fongicides sur la remise en forme larvaire (mesurée en termes de temps de développement et de la biomasse prénymphale). Alors que l’exposition à la propiconazole fongicide couramment appliquée a été associée à une mortalité accrue chez les abeilles adultes à travers plusieurs espèces 23,24,32,44,45, 54,55,56,57,58,65,66,67, son impact sur les abeilles larvaires est inférieur connu. Le deuxième objectif de cette étude est d’évaluer les effets de la consommation de pollen non hôte sur la forme larvaire. Des études antérieures indiquent que les larves d’abeilles oligolectiques ne parviennent pas à se développer lorsque obligés de consommer le pollen non hôtes68. Ces résultats peuvent être attribuées aux variations de l’abeille physiologie69, pollen biochimie70et le microbiome bénéfique associé à pollen naturel dispositions71. Le troisième objectif de cette étude est d’évaluer les effets interactifs de traitement fongicide et diététique pollen sur la remise en forme larvaire.
Nombreux traits biologiques, y compris la taille du corps maternel, provisionnement taux, stratégie de recherche de nourriture et quantité de pollen72,73,74,75 sont connus pour affecter une remise en forme larvaire chez les abeilles solitaires. Ces facteurs peuvent introduire une variation importante entre les roseaux, qui pose un problème dans le développement de modèles expérimentaux défendables lors de l’évaluation de santé larvaire. En outre, étant donné que le développement larvaire se produit à l’intérieur de roseaux de nidification scellé, les effets de cette variabilité sur la descendance sont difficiles à visualiser et quantifiés sans utiliser des techniques non létales (Figure 3). Pour relever ce défi, toutes les hypothèses dans cette étude sont testés à l’aide de larves élevées en dehors de leur nidification roseaux. Le protocole expérimental représente un entièrement croisées 2 × 2 factorielle tables de travail, avec chaque facteur composé de 2 niveaux ; Facteur 1 : Exposition fongicide (fongicide ; Aucun fongicide) ; Facteur 2 : Source de Pollen (hôte pollen, pollen Non-hôte). Abeilles sont déclenchés de le œuf au stade prénymphal dans les plaques de culture cellulaire multipuits stérile dans des conditions contrôlées en laboratoire. Chaque bien est approvisionné individuellement avec une quantité standardisée de provision de pollen et un seul oeuf. Après l’éclosion, la larve se nourrit du pollen alloué dans le puits, remplit le développement larvaire et initie la pupaison. Des études antérieures ont montré que la mortalité inexpliquée est plus faible chez les abeilles soulevées au sein de ce milieu d’élevage artificiel que celle rencontrée dans le sauvage49,76. L’utilisation du in vitro-élevage d’abeilles a plusieurs avantages par rapport aux études sur le terrain : 1) elle minimise les effets confondants de variabilité naturelle et incontrôlée des facteurs généralement associés aux études sur le terrain ; 2) il permet plusieurs niveaux de manipulation pour chaque facteur (s) d’intérêt à être testées simultanément dans l’ensemble des groupes de traitement ; 3) le nombre de répétitions peut être prédéterminé, et facteurs expérimentaux pour chaque répétition peuvent être manipulés individuellement ; 4) variables de réponse larves peuvent être facilement visualisés et enregistrés de façon autonome sans inquiétantes larves adjacents ; 5) le protocole peut être modifié pour tenir compte des conceptions expérimentales plus complexes impliquant de multiples facteurs et variables de réponse.

Figure 3. Contenu dans un roseau de nidification naturel de Osmia ribifloris (s.l.). Près (A) un roseau disséqué montrant des chambres individuelles, dispositions de pollen et des partitions et (B) fraîchement récoltés dispositions de pollen et les œufs associés (indiqués par un cercle noir). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocole
1. Préparez expériences d’exposition fongicide Propiconazole Solutions
- Préparer 0,1 x solution fongicide en dissolvant les volumes appropriés de propiconazole achetés dans le commerce 14,3 % dans de l’eau stérile le jour de l’expérience. Veiller à ce que la seule solution fongicide fraîchement préparé est utilisée pour tous les traitements.
- Ajouter 23 µL de 0,1 x solution fongicide par gramme de provision de pollen pour obtenir la concentration maximale du propiconazole rapportée du pollen d’abeille Collector24 (0,361 PPM ou µg d’ingrédient actif g-1 de pollen).
2. récolte des oeufs et dispositions Pollen hôte Osmia roseaux
- À l’aide d’un scalpel stérilisé, disséquer fraîchement branché nidification roseaux de Osmia, diviser en deux parties sur la longueur de l’anche pour exposer les chambres individuelles.
NOTE : Chaque nid peut contenir entre 8 et 14 chambres et un seul oeuf dans une chambre. - Inspecter les roseaux visuellement afin d’identifier les chambres contenant des œufs mâles issus des directives publiées antérieurement77. Utiliser une aiguille tordue stérilisée pour supprimer chaque disposition de pollen ainsi que le œuf associée de l’anche de nidification et placer dans un endroit propre peser bateau.
- Doucement séparer le œuf de la disposition à l’aide d’un pinceau propre fine et enregistrer le poids frais de la fourniture de pollen et d’oeufs à l’aide d’une balance de laboratoire standard. Calculer le poids moyen des dispositions pollen mâle.
- Effectuez les opérations suivantes avec un délai minimal pour réduire les risques de dommages à l’oeuf d’une exposition à l’échauffement et la déshydratation.
3. préparer l’hôte plante Pollen dispositions
- Inspecter visuellement le pollen de plantes-hôtes maternellement recueillies exhumé dans les chambres de nidification pour s’assurer qu’aucun parasite n’est présent78. Afin de réduire tout biais potentiels maternelle, combiner les dispositions de pollen en une masse unique dans une boîte de petri stérile et mélanger bien à l’aide d’une aiguille stérilisée.
- Divisons la masse combinée des nouvelles dispositions de pollen, s’assurer que le poids de chaque disposition reconstitué est approximativement égal au poids moyen d’une disposition des mâle naturellement attribué (moyenne ± écart-type, 0,35 ± 0,01 g, N = 42).
Remarque : Étant donné que Osmia sp. alloue plus petites dispositions de pollen à la descendance mâle, il en résulte un poids plus faible des larves mâles par rapport à celle des femelles,77. Pour éviter une telle partialité résultant des différences de sexe, utilisez uniquement les oeufs mâles dans les expériences.
4. préparer la fourniture de Pollen de plantes Non hôtes
- Pulvériser le miel acheté dans le commerce Collector bee pollen en poudre fine à l’aide d’un broyeur à billes standard de laboratoire.
- Basé sur la teneur des dispositions de pollen hôte maternellement Collector (~ 20 %), l’hydrate la poudre de pollen à l’aide des volumes appropriés de sucre 40 % stérilisés solution79 et mélanger soigneusement pour former une pâte consistance.
- Diviser en masses de pollen individuels, chacun pesant environ le même que le poids moyen d’une disposition des mâle naturellement attribué.
NOTE : Taux d’humidité de pollen hôte maternellement recueillies dispositions peuvent être normalisées en avant en comparant le poids frais et sec des dispositions de pollen de 30 chambres hommes choisis au hasard,80. Pour obtenir le poids sec, les dispositions de pollen doivent être lyophilisées dans un lyophilisateur (1,5 Pa pendant 72 h).
5. Préparez les plaques de Culture cellulaire multipuits
- La ligne des puits individuels de stérile 48 puits culture avec tasses étain autoclavés (5 × 9 cm). En utilisant une pince stérile, doucement flair sur la bordure supérieure de la capsule afin qu’il peut accueillir la provision de pollen.
- Placez une seule masse d’hôte ou non disposition de pollen à l’intérieur de la coupe d’étain à l’aide des outils stériles basées sur le groupe de traitement.
Remarque : Pour éviter la contamination croisée, utilisez plaques séparées pour le traitement et les groupes témoins.
6. ajouter les fongicides
- Faire une dépression position centrale au sein de la masse de pollen à l’aide d’un bâton en bois stérile. Utilisez un nouveau bâton pour chaque disposition de pollen.
- Ajouter des volumes appropriés de solution fongicide (pour traitement) ou d’eau stérile (pour les contrôles) dans la dépression. Pincez l’ouverture de la dépression à l’aide d’une pince stérile afin de minimiser la surface de contact entre le fongicide / stérile l’eau et l’oeuf.
- Assurez-vous que la factorielle mise en place du plan expérimental s’aligne avec celui représenté dans la représentation schématique (Figure 4).
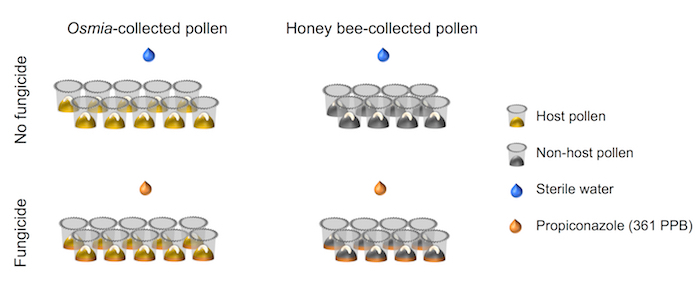
Figure 4. Représentation schématique de l’installation expérimentale. L’expérience représente un entièrement traversé 2 × 2 factorielle des configurations. Facteur 1 représente l’exposition fongicide et se compose de 2 niveaux : (i) Aucun fongicide (N = 10) et (ii) fongicide (N = 10). Facteur 2 représente la source de Pollen et se compose de 2 niveaux : pollen hôte (i) (N = 8) et (ii) Non-hôte pollen (N = 8). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
7. arrière et observer les larves
- Placer un œuf homme choisi au hasard sur la surface supérieure de la provision de pollen à l’aide d’un pinceau propre fine. Une fois que les oeufs ont été placés sur toutes les dispositions, replacez le couvercle de la plaque de culture cellulaire, fixant avec marquage du ruban sur les coins.
- Placer les plaques bien sur un plateau propre et couvrez-la avec un linge foncé pour obstruer le contact avec la lumière directe. Place un puits 6 plaque contenant 30 mL d’eau stérile dans la barre d’État pour éviter la dessiccation. Laisser les bacs d’incubation à l’intérieur d’un incubateur à température ambiante.
- Observer des plaques bien tous les jours sous un microscope à dissection sans enlever le couvercle des plaques bien. Veiller à ce que les larves sont vivants en recherchant les mouvements. Si aucun mouvement n’est détecté, jeter la coupe étain contenant les larves mortes et la fourniture de pollen restants. Permettre à toutes les larves survivantes de développer non perturbée dans les plaques bien jusqu'à ce qu’ils atteignent le stade prénymphal.
- Retirez la larve de la coupe d’étain lorsqu’elle atteint le stade prénymphal41. Utilisez une brosse pour le lavage des déféquer partir du cocon de soie. Soigneusement couper à travers le cocon de soie à l’aide d’un microscope à dissection et extraire le prépupale avec une pince en caoutchouc.
- Gérer le prépupale doucement pour s’assurer que les outils ne pas percent le corps mou. Noter le poids frais de la prépupale (prénymphale biomasse) et la durée du développement de l’oeuf au stade prénymphal (durée du développement larvaire).
Remarque : Toute larve morte doit être jetée immédiatement pour empêcher la croissance microbienne indésirable sur le cadavre et la fourniture de restes de pollen. Cela réduit le risque d’infection pour les larves saines restantes.
Résultats
Remise en forme larvaire a été quantifiée à l’aide de trois temps du développement (i) larvaire métriques, biomasse (ii) prénymphale et (iii) le pourcentage de survie. Une ANOVA bidirectionnelle a été réalisée en utilisant une exposition de fongicide (deux niveaux : aucun fongicide, fongicide) et source de Pollen (deux niveaux : le pollen de l’hôte, pollen Non-hôte) comme les variables indépendantes et la durée du développement larvaire comme variable dépendante. L?...
Discussion
Élevage d’abeilles à l’extérieur de leurs roseaux nidification naturelle, dans des conditions de laboratoire, permet l’essai de plusieurs hypothèses relatives à la remise en forme larvaire. Dans la mesure où les facteurs non identifiés continuent à causer la mortalité des abeilles, des études d’évaluation des risques à l’aide de in vitro expériences peuvent aider à identifier les menaces potentielles et informer des pratiques de gestion pour ce groupe riche en espèces de pollinisateurs s...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient Kimball Clark et Tim Krogh pour fournir des roseaux nidification Osmia , Meredith Nesbitt et Molly Bidwell d’assistance dans le laboratoire, les Drs Cameron Currie, Christelle Guédot, Terry Griswold, Michael Branstetter et trois évaluateurs anonymes pour leurs commentaires utiles qui ont amélioré le manuscrit. Ce travail a été soutenu par des fonds de la USDA-Agricultural Research Service ouvert (Current Research Information System #3655-21220-001), Wisconsin Department of Agriculture, le commerce et la Protection des consommateurs (#197199), National Science Foundation (sous Grant no DEB-1442148), le centre de recherche de bioénergie DOE Great Lakes (DOE Office of Science, DE BER-FC02-07ER64494).
matériels
| Name | Company | Catalog Number | Comments |
| eggs of O. ribifloris sensu lato (s.l.) | Kaysville, Davis County, Utah, USA | ||
| Osmia reeds | Nativebees.com | NA | Freshly plugged reeds |
| Dissection set | VWR | 89259-964 | Sterilize before use |
| Long Nose Pliers | Husky | 1006 | |
| 6 well culture plates | VWR | 10062-892 | Sterile sealed |
| 48 well culture plates | VWR | 10062-898 | Sterile sealed |
| Petri dishes | VWR | 25373100 | Sterile sealed |
| Square Weighing Boats | VWR | 10770-448 | |
| Camel Hair Brush | Bioquip | 1153A | |
| Tin capsules | EA Consumables | D1021 | Sterilize before use |
| Sucrose | VWR | 470302-808 | |
| Propiconazole 14.3 | Quali-Ppro | 60207-90-1 | Propiconazole 14.3% |
| Honey bee pollen | Bee energised | 897098001244 | Untreated, natural, raw pollen |
| Microbalance | VWR | 10204-990 | |
| Pulverisette | LAB SYNERGY INC. | 30334913 | |
| Wooden sticks | VWR | 470146908 | Sterilize before use |
| Sealing tape | VWR | 89097-912 | |
| Microscope | VWR | 89403-384 | |
| Planting tray | VWR | 470150-632 | |
| Ethanol | VWR | BDH1158-4LP | |
| Centrifuge tube | VWR | 21008936 | |
| Microsyringe | Cole-Palmer | UX-07940-07 | |
| Rubber tweezer | Amazon | B0135HWPN4 | |
| Syringe needles | VWR | 89219-334 | |
| Freeze drier | Labcono | LFZ-1L | |
| Statistical software | SPSS | Version 21.0 |
Références
- Klein, A. -. M., et al. Importance of pollinators in changing landscapes for world crops. P Roy Soc Lond B Bio. 274 (1608), 303-313 (2007).
- Biesmeijer, J. C. J., et al. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C., Neumann, P., Schweiger, O., Kunin, W. E. Global pollinator declines: Trends, impacts and drivers. Trends Ecol Evol. 25 (6), 345-353 (2010).
- Cameron, S. A., et al. Patterns of widespread decline in North American bumble bees. P Natl Acad Sci USA. 108 (2), 662-667 (2011).
- Gallai, N., Salles, J. M., Settele, J., Vaissière, B. E. Economic valuation of the vunerability of world agriculture confronted with pollinator decline. Ecol Econ. 68 (3), 810-821 (2009).
- Fontaine, C., Dajoz, I., Meriguet, J., Loreau, M. Functional diversity of plant-pollinator interaction webs enhances the persistence of plant communities. Plos Biol. 4 (1), 0129-0135 (2006).
- Kluser, S., Peduzzi, P. . Global pollinator decline: a literature review. , (2007).
- Brown, M. J. F., Paxton, R. J. The conservation of bees: a global perspective. Apidologie. 40 (3), (2009).
- Lebuhn, G., et al. Detecting insect pollinator declines on regional and global scales. Conserv Biol. 27 (1), (2013).
- Vanengelsdorp, D., Meixner, M. D. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. J Invertebr Pathol. , S80-S95 (2010).
- Pettis, J. S., Delaplane, K. S. Coordinated responses to honey bee decline in the USA. Apidologie. 41 (3), 256-263 (2010).
- Sandrock, C., Tanadini, L. G., Pettis, J. S., Biesmeijer, J. C., Potts, S. G., Neumann, P. Sublethal neonicotinoid insecticide exposure reduces solitary bee reproductive success. Agr Forest Entomol. 16 (2), (2014).
- Van der Sluijs, J. P., Simon-Delso, N., Goulson, D., Maxim, L., Bonmatin, J. M., Belzunces, L. P. Neonicotinoids, bee disorders and the sustainability of pollinator services. Curr Opin Env Sust. 5 (3), (2013).
- Goulson, D., Nicholls, E., Botías, C., Rotheray, E. L. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science. 347 (6229), (2015).
- Johnson, R. M., Ellis, M. D., Mullin, C. A., Frazier, M. Pesticides and honey bee toxicity - USA. Apidologie. 41 (3), (2010).
- Iwasa, T., Motoyama, N., Ambrose, J. T., Roe, R. M. Mechanism for the differential toxicity of neonicotinoid insecticides in the honey bee, Apis mellifera. Crop Protection. 23 (5), 371-378 (2004).
- Glavan, G., Bozic, J. The synergy of xenobiotics in honey bee Apis mellifera: mechanisms and effects. Acta Biol. Slov. 56, 11-27 (2013).
- Biddinger, D. J., et al. Comparative toxicities and synergism of apple orchard pesticides to Apis mellifera (L.) and Osmia cornifrons (Radoszkowski). PLoS ONE. 8 (9), e72587 (2013).
- Thompson, H. M., Fryday, S. L., Harkin, S., Milner, S. Potential impacts of synergism in honeybees (Apis mellifera) of exposure to neonicotinoids and sprayed fungicides in crops. Apidologie. 45 (5), 545-553 (2014).
- Jansen, J. -. P., Lauvaux, S., Gruntowy, J., Denayer, J. Possible synergistic effects of fungicide-insecticide mixtures on beneficial arthropods. IOBC-WPRS Bulletin. 125, 28-35 (2017).
- Robinson, A., Hesketh, H., et al. Comparing bee species responses to chemical mixtures: Common response patterns?. PLoS ONE. 12 (6), (2017).
- Sgolastra, F., Medrzycki, P., et al. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Ladurner, E., Bosch, J., Kemp, W. P., Maini, S. Assessing delayed and acute toxicity of five formulated fungicides to Osmia lignaria and Apis mellifera. Apidologie. 36 (3), 449-460 (2005).
- Mullin, C. A., et al. High levels of miticides and agrochemicals in North American apiaries: implications for honey bee health. PloS one. 5 (3), e9754 (2010).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R., Vanengelsdorp, D. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS one. 8 (7), e70182 (2013).
- David, A., et al. Widespread contamination of wildflower and bee-collected pollen with complex mixtures of neonicotinoids and fungicides commonly applied to crops. Environ Int. 88, 169-178 (2016).
- Zhu, W., Schmehl, D. R., Mullin, C. A., Frazier, J. L. Four common pesticides, their mixtures and a formulation solvent in the hive environment have high oral toxicity to honey bee larvae. PloS one. 9 (1), e77547 (2014).
- Simon-Delso, N., Martin, G. S., Bruneau, E., Minsart, L. A., Mouret, C., Hautier, L. Honeybee colony disorder in crop areas: The role of pesticides and viruses. PLoS ONE. 9 (7), (2014).
- Park, M. G., Blitzer, E. J., Gibbs, J., Losey, J. E., Danforth, B. N. Negative effects of pesticides on wild bee communities can be buffered by landscape context. P Roy Soc B-Biol Sci. 282 (1809), 20150299-20150299 (2015).
- Bernauer, O. M., Gaines-Day, H. R., Steffan, S. A. Colonies of bumble bees (Bombus impatiens) produce fewer workers, less bee biomass, and have smaller mother queens following fungicide exposure. Insects. 6 (2), 478-488 (2015).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. J Exp Biol. 216 (10), 1799-1807 (2013).
- Artz, D. R., Pitts-Singer, T. L. Effects of fungicide and adjuvant sprays on nesting behavior in two managed solitary bees, Osmia lignaria and Megachile rotundata. PLoS ONE. 10 (8), e0135688 (2015).
- Pilling, E. D., Bromleychallenor, K. A. C., Walker, C. H., Jepson, P. C. Mechanism of synergism between the pyrethroid insecticide lambda-cyhalothrin and the imidazole fungicide prochloraz, in the honeybee (Apis mellifera L). Pestic Biochem Phys. 51 (1), 1-11 (1995).
- Johnson, R. M., Wen, Z., Schuler, M. A., Berenbaum, M. R. Mediation of pyrethroid insecticide toxicity to honey bees (Hymenoptera: Apidae) by cytochrome P450 monooxygenases. J. Econ. Entomol. 99 (4), 1046-1050 (2006).
- Steffan, S. A., Dharampal, P. S., Diaz-Garcia, L. A., Currie, C. R., Zalapa, J. E., Hittinger, C. T. Empirical, metagenomic, and computational techniques illuminate the mechanisms by which fungicides compromise bee health. JoVE. (128), e54631 (2017).
- Batra, S. W. T. Solitary bees. Sci Am. 250 (2), 120-127 (1984).
- Linsley, E. G. The ecology of solitary bees. Hilgardia. 27 (19), 543-599 (1958).
- Garibaldi, L. A., et al. Wild Pollinators Enhance Fruit Set of Crops Regardless of Honey Bee Abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Kemp, W. P. . How to manage the blue orchard bee. , (2001).
- Keller, A., Grimmer, G., Steffan-Dewenter, I. Diverse microbiota identified in whole intact nest chambers of the red mason bee Osmia bicornis (Linnaeus 1758). PLoS ONE. 8 (10), e78296 (2013).
- Bosch, J., Kemp, W. P. Development and Emergence of the Orchard Pollinator Osmia lignaria (Hymenoptera: Megachilidae). Environmental Entomology. 29 (1), 8-13 (2000).
- Brittain, C., Potts, S. G. The potential impacts of insecticides on the life-history traits of bees and the consequences for pollination. Basic and Applied Ecology. 12 (4), 321-331 (2011).
- Arena, M., Sgolastra, F. A meta-analysis comparing the sensitivity of bees to pesticides. Ecotoxicology. 23 (3), 324-334 (2014).
- Ladurner, E., Bosch, J., Kemp, W. P., Maini, S. Foraging and nesting behavior of Osmia lignaria (Hymenoptera: Megachilidae) in the presence of fungicides: cage studies. J Econ Entomol. 101 (3), 647-653 (2008).
- Huntzinger, A. C. I., James, R. R., Bosch, J., Kemp, W. P. Fungicide tests on adult alfalfa leafcutting bees (Hymenoptera: Megachilidae). J Econ Entomol. 101 (4), 1088-1094 (2008).
- Tsvetkov, N., et al. Chronic exposure to neonicotinoids reduces honey bee health near corn crops. Science. 356 (6345), 1395-1397 (2017).
- Mao, W., Schuler, M. A., Berenbaum, M. R. Disruption of quercetin metabolism by fungicide affects energy production in honey bees (Apis mellifera). P Natl Acad Sci. 114 (10), 2538-2543 (2017).
- Blacquière, T., Smagghe, G., Van Gestel, C. A. M., Mommaerts, V. Neonicotinoids in bees: A review on concentrations, side-effects and risk assessment. Ecotoxicology. 21 (4), 973-992 (2012).
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (Hymenoptera: Megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Mader, E., Spivak, M., Evans, E. . Managing Alternative Pollinators. , (2010).
- Bosch, J., Kemp, W. P. Developing and establishing bee species as crop pollinators: the example of Osmia spp.(Hymenoptera: Megachilidae) and fruit trees. B Entomol Res. 92 (1), 3-16 (2002).
- Sampson, B. J., Rinehart, T. A., Kirker, G. T., Stringer, S. J., Werle, C. T. Phenotypic variation in fitness traits of a managed solitary bee, Osmia ribifloris (Hymenoptera: Megachilidae). J Econ Entomol. 108 (6), 2589-2598 (2015).
- Sampson, B. J., Cane, J. H., Kirker, G. T., Stringer, S. J., Spiers, J. M. Biology and management potential for three orchard bee species (Hymenoptera: Megachilidae): Osmia ribifloris Cockerell, O. lignaria (Say) and O.chalybea Smith with emphasis on the former. Acta Hort. 810, 549-555 (2009).
- Hladik, M. L., Vandever, M., Smalling, K. L. Exposure of native bees foraging in an agricultural landscape to current-use pesticides. Sci Total Environ. 542, 469-477 (2016).
- Long, E. Y., Krupke, C. H. Non-cultivated plants present a season-long route of pesticide exposure for honey bees. Nat Commun. 7, (2016).
- Krupke, C. H., Hunt, G. J., Eitzer, B. D., Andino, G., Given, K. Multiple routes of pesticide exposure for honey bees living near agricultural fields. PLoS ONE. 7 (1), e29268 (2012).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS ONE. 8 (10), e77550 (2013).
- Sánchez-Bayo, F., Goulson, D., Pennacchio, F., Nazzi, F., Goka, K., Desneux, N. Are bee diseases linked to pesticides? - A brief review. Environ Int. 89, 7-11 (2016).
- Steffan-Dewenter, I., Klein, A. -. M., Gaebele, V., Alfert, T., Tscharntke, T. Bee diversity and plant-pollinator interactions in fragmented landscapes. Specialization and generalization in plant-pollinator interactions. , 387-410 (2006).
- Kremen, C., Ricketts, T. Global perspectives on pollination disruptions. Conserv Biol. 14 (5), 1226-1228 (2000).
- Memmott, J., Waser, N. M., Price, M. V. Tolerance of pollination networks to species extinctions. P Roy Soc B-Biol Sci. 271 (1557), 2605-2611 (2004).
- Spear, D. M., Silverman, S., Forrest, J. R. K. Asteraceae pollen provisions protect Osmia mason bees (Hymenoptera: Megachilidae) from brood parasitism. The American Naturalist. 187 (6), 797-803 (2016).
- Rust, R. W. Biology of Osmia (Osmia) ribifloris Cockerell (Hymenoptera: Megachilidae). J Kansas Entomol Soc. 59, 89-94 (1986).
- Torchio, P. F. Osmia ribifloris, a native bee species developed as a commercially managed pollinator of highbush blueberry (Hymenoptera: Megachilidae). J Kansas Entomol Soc. 63 (633), 427-436 (1990).
- Sanchez-Bayo, F., Goka, K. Pesticide residues and bees - A risk assessment. PLoS ONE. 9 (4), e94482 (2014).
- Kasiotis, K. M., Anagnostopoulos, C., Anastasiadou, P., Machera, K. Pesticide residues in honeybees, honey and bee pollen by LC-MS/MS screening: Reported death incidents in honeybees. Sci Total Environ. 485 (1), 633-642 (2014).
- Stanley, J., Sah, K., Jain, S. K., Bhatt, J. C., Sushil, S. N. Evaluation of pesticide toxicity at their field recommended doses to honeybees, Apis cerana and A. mellifera through laboratory, semi-field and field studies. Chemosphere. 119, 668-674 (2015).
- Praz, C. J., Müller, A., Dorn, S. Specialized bees fail to develop on non-host pollen: Do plants chemically protect their pollen?. Ecology. 89 (3), 795-804 (2008).
- Sedivy, C., Müller, A., Dorn, S. Closely related pollen generalist bees differ in their ability to develop on the same pollen diet: Evidence for physiological adaptations to digest pollen. Funct Ecol. 25 (3), 718-725 (2011).
- Williams, N. M. Use of novel pollen species by specialist and generalist solitary bees (Hymenoptera: Megachilidae). Oecologia. 134, (2003).
- Graystock, P., Rehan, S. M., McFrederick, Q. S. Hunting for healthy microbiomes: determining the core microbiomes of Ceratina, Megalopta, and Apis bees and how they associate with microbes in bee collected pollen. Conserv Genet. 18 (3), 1-11 (2017).
- Bosch, J., Vicens, N. Relationship between body size, provisioning rate, longevity and reproductive success in females of the solitary bee Osmia cornuta. Behav Ecol Sociobiol. 60 (1), 26-33 (2006).
- Bosch, J., Vicens, N. Body size as an estimator of production costs in a solitary bee. Ecol Entomol. 27 (2), 129-137 (2002).
- Radmacher, S., Strohm, E. Factors affecting offspring body size in the solitary bee Osmia bicornis (Hymenoptera, Megachilidae). Apidologie. 41 (2), 169-177 (2010).
- Seidelmann, K. Open-cell parasitism shapes maternal investment patterns in the Red Mason bee Osmia rufa. Behav Ecol. 17 (5), (2006).
- Becker, M. C., Keller, A. Laboratory rearing of solitary bees and wasps. Insect Science. 23 (6), 918-923 (2016).
- Bosch, J. The nesting behaviour of the mason bee Osmia cornuta (Latr) with special reference to its pollinating potential (Hymenoptera, Megachilidae). Apidologie. 25, 84-93 (1994).
- Krunić, M., Stanisavljević, L., Pinzauti, M., Felicioli, A. The accompanying fauna of Osmia cornuta and Osmia rufa and effective measures of protection. B Insectol. 58 (2), 141-152 (2005).
- Elliott, S. E., Irwin, R. E., Adler, L. S., Williams, N. M. The nectar alkaloid, gelsemine, does not affect offspring performance of a native solitary bee, Osmia lignaria (Megachilidae). Ecol Entomol. 33 (2), 298-304 (2008).
- Hendriksma, H. P., Härtel, S., Steffan-Dewenter, I. Honey bee risk assessment: New approaches for in vitro larvae rearing and data analyses. Methods Ecol and Evol. 2 (5), 509-517 (2011).
- Aupinel, P., et al. Improvement of artificial feeding in a standard in vitro method for rearing Apis mellifera larvae. B Insectol. 58 (2), 107-111 (2005).
- Beekman, M., Ratnieks, F. L. W. Long-range foraging by the honey-bee, Apis mellifera L. Funct Ecol. 14 (4), 490-496 (2000).
- Gathmann, A., Tscharntke, T. Foraging ranges of solitary bees. J Anim Ecol. 71 (5), 757-764 (2002).
- Greenleaf, S. S., Williams, N. M., Winfree, R., Kremen, C. Bee foraging ranges and their relationship to body size. Oecologia. 153 (3), 589-596 (2007).
- . Bee Pollen Supplement - Bee Rescued Available from: https://beerescued.com/product/bee-rescued-bee-pollen-supplement/ (2018)
- Cane, J. H., Griswold, T., Parker, F. D. Substrates and Materials Used for Nesting by North American Osmia Bees (Hymenoptera: Apiformes: Megachilidae). Annals of the Entomological Society of America. 100 (3), 350-358 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon