Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation de l’Interface synaptique des cellules primaires humaines T du sang périphérique et le tissu lymphoïde
Dans cet article
Résumé
Le protocole décrit une technique pour étudier la capacité des cellules T humaines primaires polyclonaux pour former des interfaces synaptiques utilisant des bicouches lipidiques planes. Nous utilisons cette technique pour montrer la capacité de formation de synapse différentielle des cellules T primaires humaines dérivées de ganglions lymphatiques et le sang périphérique.
Résumé
La compréhension actuelle de la dynamique et les caractéristiques structurales des interfaces synaptiques de lymphocytes a été en grande partie déterminés par l’utilisation de verre-prise en charge des bicouches planaires et in vitro-T-cellule dérivée des clones ou lignes1,2 ,3,4. Comment ces conclusions s’appliquent aux primaire les cellules T humaines isolées du sang ou lymphoïdes tissus ne connaît pas, en partie en raison d’importantes difficultés à obtenir un nombre suffisant de cellules pour analyse5. Ici nous abordons cela grâce à l’élaboration d’une technique exploitant les diapositives des flux multicanaux pour construire des bicouches lipidiques planes contenant des molécules d’adhésion et d’activation. La faible hauteur des lames débit favorise la sédimentation cellulaire rapide afin de synchroniser l’attachement cellulaire : bicouche, permettant ainsi aux chercheurs d’étudier la dynamique de la formation de l’interface synaptique et la cinétique de la libération de granules. Nous appliquons cette approche pour analyser l’interface synaptique d’aussi peu que 104 105 primaire cryoconservés T cellules isolées de ganglions lymphatiques (LN) et du sang périphérique (PB). Les résultats révèlent que la technique de bicouches lipidiques planes roman permet l’étude des propriétés biophysiques des cellules T humaines primaires dérivés de sang et les tissus dans le contexte de la santé et la maladie.
Introduction
Connaissances scientifiques sur les caractéristiques structurales des synapses immunitaires lymphocytes et leur lien avec l’activité fonctionnelle des cellules T ont été recueillies principalement de l’étude des lignées cellulaires et clones provenant de PB. À quel degré ces constatations se rapportent à des cellules primaires de T a obtenu de sang ou des tissus lymphoïdes humains ne sait pas, comme les interfaces synaptiques des cellules T qui résident dans les tissus lymphoïdes et autres n’ont pas été analysés jusqu'à présent. Ce qui est important, nouvelles données suggèrent que les tissus-résident et organes lymphoïdes-dérivés des cellules T peuvent avoir des différences significatives dans leur phénotype et leur activité fonctionnelle par rapport à celles du PB6,7. Cela se solidifie davantage la nécessité de mieux comprendre les fonctionnalités de l’interface synaptique de lymphocytes dans les cellules T humaines primaires.
À cette fin, nous avons développé une approche nouvelle échelle mini exploitant des bicouches lipidiques incorporés dans les glissières des flux multicanal nous permettant d’effectuer l’imagerie des interfaces de T-cellule/bicouche avec moins de 105 primaire T cellules isolées de PB humaine et LN. Cette nouvelle technique permet d’étudier les propriétés biophysiques de humain lymphocytes synaptiques interfaces primaires pour mieux modéliser et comprendre en vivo les interactions cellule-cellule.
Protocole
Cette étude a été réalisée conformément à la déclaration d’Helsinki. Consentement éclairé a été obtenu de tous les participants, et les échantillons de sang et les ganglions lymphatiques ont été acquises avec l’approbation de l’Institutional Review Board à l’Université de Pennsylvanie (CISR #809316, la CISR # 815056). Tous les sujets humains étaient des adultes. Les échantillons de sang de cordon ont été gracieusement fournis par le travail et l’accouchement de la département d’obstétrique et de gynécologie à l’Université Thomas Jefferson. Tous les échantillons sont dépersonnalisées.
1. isolement des CD4+ T des cellules pour une analyse de l’Image
-
Décongeler une portion de 1 mL contenant 107 congelés les cellules mononucléaires de sang périphérique (PBMC) ou de cellules mononucléées de ganglion lymphatique (LNMCs) des échantillons recueillis. Sous une hotte stérile, ajouter les cellules décongelées dans 9 mL de RPMI additionné de pénicilline/streptomycine et de la glutamine.
- Centrifuger les cellules pendant 10 min à 300 x g à 4 ° C, aspirer le surnageant et remettre en suspension les cellules dans 5 mL de milieu RPMI contenant 10 % SVF (milieu complet). Incuber les cellules pendant la nuit dans un incubateur à CO2 à 37 ° C.
- Le lendemain, purifier CD4+ T cellules en négatif immunomagnetic tri à l’aide d’un kit disponible dans le commerce selon les instructions du fabricant.
- Pour mesurer le nombre de CD4 fraîchement purifié+ T cellules, mélanger 5 µL de la suspension cellulaire avec un volume égal d’une solution de bleu de trypan. Charger un hémocytomètre avec un cellule-trypan mélange de bleu et de compter les cellules vivantes à l’intérieur les 5 sections de l’hémocytomètre.
- Prenez la moyenne du nombre de cellules et de déterminer le nombre de cellules de la suspension cellulaire original : le nombre de cellules/1 mL = la numération moyenne x 2 x 104. Si le nombre total de cellules isolées est trop petit, utilisez les cellules comme c’est sans compter.
- Centrifuger les cellules à 300 g pendant 10 min et remettre en suspension dans un tampon (20 mM HEPES, pH 7,4, 137 mM NaCl, 2 mM Na2HPO4, D-glucose, KCl, 1 mM MgCl2à 5 mM à 5 mM, 2 mM CaCl2et 1 % d’albumine sérique humaine) à 105 < /C13 > cellules/50 µL ou moins et de garder les cellules à 4 ° C (pendant 1 à 2 h) jusqu’au moment de l’utiliser dans les expériences.
- Éliminer tous les déchets biologiques selon les directives institutionnelles pertinentes.
- Si vous le souhaitez comme une population de cellules contrôle, préparer les cellules T CD8 activées provenant de sang ombilical PBMC, placer 107 cellules dans 5 mL de milieu complet dans un flacon de culture T25 recouvert d’un mélange d’anticorps anti-CD3 et anti-CD28 à 10 µg/mL et 1 µg/mL , respectivement.
- Le lendemain, enlever les cellules de sang de cordon activés de la fiole, lavez-les 1 x avec frais moyen de compléter et étendre les cellules en présence de IL-2 recombinante (100 U/mL) pendant 2 semaines.
- Purifier le sang du cordon ombilical CD8+ T cellules en négatif immunomagnetic tri à l’aide de la trousse disponible dans le commerce selon les instructions du fabricant. Compter les cellules et d’échanger les médias pour le tampon comme décrit aux points 1.3 à 1.6 pour LN et CD8 PB+ T des cellules.
2. les composants pour préparer les bicouches lipidiques planes
- Préparer 3 types de liposomes comme décrit ailleurs5: (a) 0. 4 mM DOPC (1, 2-dioléoyl -sn- glycéro-3-phosphocholine) liposomes, liposomes DOPC (b) 0,4 mM contenant 33 mol% de chiens-NTA (1, 2-dioléoyl -sn- glycéro - 3-[(N-(5- amino-1-carboxypentyl) acide iminodiacétique) succinyl] (sel d’ammonium)) lipides, (c) 0,4 mM DOPC liposomes contenant 4 mol % Biotinyl-Cap-PE (1, 2-dioléoyl -sn- glycéro-3-phosphoéthanolamine - N-(cap biotinyl) (sel de sodium)).
-
Préparer une solution 5 % caséine comme précédemment décrit5.
- Dissoudre 5 g de poudre de caséine dans 100 mL d’eau ultrapure et ajouter 350 µL d’hydroxyde de sodium 10 M. Tout mélanger sur un agitateur magnétique ordinaire à une vitesse lente selon l’échelle disponible, à température ambiante pendant 2 h et ensuite la nuit à 4 ° C. Ajuster le pH à 7.3 et ultracentrifugeuse la solution pendant 2 h à 100 000 x g à 4 ° C. Filtrer le liquide surnageant avec un filtre stérile de 0,22 µm et conserver la solution en aliquotes à-80 ° C.
ATTENTION : la solution d’hydroxyde de Sodium peut provoquer des brûlures chimiques et peut provoquer la cécité permanente lors du contact avec les yeux. Utiliser des gants en caoutchouc, vêtements de sécurité et une protection oculaire lors de la manipulation de ce produit chimique ou ses solutions.
- Dissoudre 5 g de poudre de caséine dans 100 mL d’eau ultrapure et ajouter 350 µL d’hydroxyde de sodium 10 M. Tout mélanger sur un agitateur magnétique ordinaire à une vitesse lente selon l’échelle disponible, à température ambiante pendant 2 h et ensuite la nuit à 4 ° C. Ajuster le pH à 7.3 et ultracentrifugeuse la solution pendant 2 h à 100 000 x g à 4 ° C. Filtrer le liquide surnageant avec un filtre stérile de 0,22 µm et conserver la solution en aliquotes à-80 ° C.
-
Anticorps anti-CD3 d’étiquette avec de la biotine pour produire des molécules d’anticorps mono-bionylated avec une approche décrite précédemment8.
- Préparer une solution de biotine-PEO4-NHS dans le diméthylsulfoxyde (DMSO) à 0,1 mg/mL. Ajouter 3,7 µL de la solution de biotine-PEO4-NHS à 1 mg d’anticorps dans 0,5 mL d’une solution saline tamponnée au phosphate (PBS) contenant du bicarbonate de sodium de 100 mM.
- Incuber le mélange pendant 2 h à température ambiante. Préparer une solution d’ester d’Alexa Fluor 488 NHS à 10 mg/mL dans le DMSO. Ajouter la solution d’ester Alexa Fluor 488 NHS à l’anticorps marqué par biotine-PEO4-NHS à un excès molaire 10 fois.
- Incuber le mélange pendant 1 h à température ambiante sous agitation lente sur un agitateur magnétique ordinaire. Séparer le colorant non lié à l’aide de la chromatographie d’exclusion stérique.
- Déterminer la concentration en anticorps en mesurant la densité optique de la solution d’anticorps à 280 nm (un280). Mesurer la densité optique des anticorps étiquetés à 577 nm (un577).
- Déterminer le ratio de colorant-à-anticorps à l’aide de l’équation suivante :
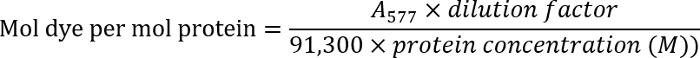
NOTE : Trouver des détails supplémentaires dans le protocole du fabricant.
-
Exprimer une protéine recombinante de ICAM-1 soluble dans un système d’expression de drosophile comme décrit plus haut3,4,9,10.
- Clone, avec cDNA codant, l’ectodomaine de l’ICAM-1 dans l’expression de la drosophile vector pMT/V5-His avec un promoteur inductible métallothionéine pour produire une protéine recombinante ajoutée avec son étiquette de6 sur l’extrémité C-terminale.
- Co transfecter cellules S2 avec le plasmide contenant résultant de ICAM-1 et un vecteur d’expression G418. Sélectionnez les transfectants stables en utilisant les médias de drosophile de Schneider additionnés de 10 % de sérum de veau foetal (FCS) et 0,5 mg/mL de G418 pendant 3 semaines. Développez les cellules dans un milieu sans sérum insecte et induire une expression de la protéine avec 0,5 mM CuSO4 pendant 3 jours.
- Concentrer le surnageant de culture, 10 x et dialyser contre PBS via un concentrateur de flux tangentiel comme décrit précédemment11.
- Appliquez le surnageant de culture concentré à une colonne contenant le Sépharose avec un anticorps monoclonal anti-ICAM-1 immobilisé par liaison covalente et éluer l’ICAM-1 lié avec un tampon de glycine de 50 mM, pH 3.0. Immédiatement neutraliser la protéine éluée d’ICAM-1 avec un tampon Tris de 2 M, pH 8,0.
- Dialyser le matériau éluée contre PBS, pH 8,0 et ajoutez les matières dialysée à une colonne contenant Ni-NTA agarose. Éluer soluble ICAM-1 avec imidazole de 200 mM, pH 8,0. Dialyser le matériau éluée contre un tampon PBS, pH 8,0.
- L’ICAM-1 purifiée avec ester Cy5 NHS selon les instructions du fabricant de l’étiquette.
Remarque : Le meilleur ratio final de colorant-à-protéine est de 1:1.
- Produire des Fab d’un anticorps anti-CD107a des fragments de digestion de la papaïne et de purifier la Fab fragments par chromatographie échangeuse d’ions comme décrit plus haut3. Étiquette de fragments de la Fab avec ester Alexa Fluor 568 NHS selon les instructions du fabricant.
3. formation des bicouches lipidiques planes soutenus par verre
- Préparer une solution fraîche piranha acides en mélangeant 140 mL d’acide sulfurique concentré et 60 mL d’eau oxygénée 30 %. Lavez le couvre-objet en verre pour les diapositives de flux en les trempant dans la solution acide piranha pour 30 min. Maintenez la lamelle de verre avec une pince-ciseaux polypropylène.
ATTENTION : Solution de Piranha est un oxydant très fort. N’oubliez pas de porter des lunettes de sécurité ou des lunettes ou un bouclier intégral ainsi que des gants en caoutchouc épais en tout temps lors de la manipulation de la solution. Ne fonctionne qu’avec la solution de piranha sous une hotte aspirante. Évitez de chauffage, du transport ou secouant à tout moment pendant l’utilisation, car il peut exploser. Collecter les déchets de piranha dans une bouteille en verre avec un trou contenant du plomb. Contacter la Commission institutionnelle de la sécurité sur l’utilisation appropriée des déchets. -
Rincer les lamelles lavé 7 x avec de l’eau ultrapure par séquentiellement les transférer dans des béchers contenant de l’eau fraîche. Ensemble, les lamelles humides côté pour laisser le restant d’eau roulent sur le verre propre, abandonnant le verre sec.
- Sinon, utiliser un embout de la pipette joint à une pompe à vide pour retirer délicatement les gouttelettes d’eau restante de la lamelles couvre-objet.
- Dans la hotte stérile, effectuer des dilutions de lipides divers pour produire le mélange de liposomes pour faire des bicouches. Tout d’abord, mélanger les 37 µL de liposomes DOPC et 3 µL de liposomes Biotinyl-Cap-PE. Ensuite, mélanger 14 µL de liposomes DOPC et 15 µL de liposomes de chiens-NTA. En troisième lieu, ajouter 1 µL du mélange premier à 29 µL du deuxième mélange pour fabriquer le mélange final liposome.
-
Dans la hotte stérile, mis en place un espace de travail avec lamelles sèche à proximité. Aliquote 2 µL du mélange final liposome (voir étape 3.3) précisément dans le centre d’une chaîne de glissière autocollante. Immédiatement et très précisément aligner un lamelle couvre-objet propre et sec avec le toboggan et abaissez doucement la lamelle sur le côté collant de la diapositive.
- Si vous préparez plusieurs diapositives, travailler sur une diapositive à la fois, car le mélange de liposome s’évapore rapidement. Retournez la lame et la bague extérieure des pinces-ciseaux polypropylène permet d’exercer une pression douce sur le contact périphérique de la lamelle avec la diapositive, en vous assurant que le bordereau est amarraient à la diapositive pour empêcher les fuites.
Remarque : Ne pas presser contre les canaux de la diapositive pour éviter la rupture ou la fissuration de la lamelle couvre-objet. - Retournez la diapositive à nouveau et marquer la position de la bicouche formée, qui ressemble à une chute entre la lamelle et la diapositive de canal, de dessin 4 points avec un marqueur permanent autour de la bicouche du côté de la lame externe de l’Assemblée.
- Si vous préparez plusieurs diapositives, travailler sur une diapositive à la fois, car le mélange de liposome s’évapore rapidement. Retournez la lame et la bague extérieure des pinces-ciseaux polypropylène permet d’exercer une pression douce sur le contact périphérique de la lamelle avec la diapositive, en vous assurant que le bordereau est amarraient à la diapositive pour empêcher les fuites.
- Avant la première injection d’un liquide dans le canal, désigner un port du canal comme le port d’entrée et l’autre comme le port de sortie et maintenir cette désignation tout au long de l’expérience.
- Pour éviter la formation de bulles, insérer l’extrémité de la pipette directement dans le port d’entrée du canal. Remplir lentement les canaux de la diapositive avec 50 µL de chaud (au moins la température ambiante) tampon (Voir l’étape 1.5 pour la composition du tampon).
- Préparer une solution de chlorure de nickel (II) de 0,5 M. Décongeler une portion de 2 mL de solution de caséine dans un bain-marie à 37 ° C pendant 30 min et compléter avec une solution de chlorure de nickel à une concentration finale de 200 µM.
- Laver les bicouches en première injection 100 µL de la solution de caséine dans le port d’entrée du chenal puis immédiatement supprimer 100 µL du port de sortie sur la diapositive de pipetage. Bloquer les bicouches avec la même solution en injectant 100 µL de la solution de la caséine dans le port d’entrée de chaque canal et en incubant la lame pendant 45 min à température ambiante.
- Décongelez les aliquotes de protéines de6 et streptavidine Cy5-ICAM-1-His. Combiner les protéines dans le tampon à la concentration finale de 2 µg/mL de chacun. Centrifuger la solution pendant 30 min à 20 000 x g et 4 ° C pour éliminer n’importe quel agrégat.
- Retirer le reste de la solution de blocage de l’orifice de sortie du chenal de la diapositive en pipettant également. Injecter 100 µL de la solution contenant l’ICAM-1 et streptavidine dans le port d’entrée.
- Incuber la lame pendant 45 min à température ambiante. Retirer tout excédent de la solution de protéines de l’orifice de sortie. Laver la bicouche 2 x en première injection 100 µL du tampon dans le port d’entrée du chenal puis immédiatement supprimer 100 µL de l’orifice de sortie.
- Diluer un anticorps anti-CD3 Alexa Fluor-488-marqués avec le tampon à une concentration finale de 2 µg/mL. Injecter 100 µL de la solution d’anticorps dans le port d’entrée de la diapositive et il incuber pendant 45 min à température ambiante. Retirer tout excédent de la solution de protéines de l’orifice de sortie. Laver la bicouche 2 x 100 µl de la tampon comme au point 3.11.
4. imagerie de l’Interaction de cellules T avec la bicouche planaire
-
Préchauffez la scène et l’objectif d’un microscope à fluorescence (FRBR) réflexion interne totale ou confocale jusqu'à ce que la température est équilibrée à 37 ° C. Mettre en place la lame avec la bilayer(s) sur la platine chauffante. Déplacer la scène à une position appropriée selon les marques d’encre et de se concentrer sur la bicouche employant la fluorescence des molécules marquées Cy ICAM-1.
- Utiliser un objectif X 61 pour la microscopie confocale, ou un objectif X 100 pour le microscope TIRF, avec les paramètres de filtre approprié.
-
Pour granule imagerie au microscope TIRF, ajouter Alexa Fluor-568-marqué anti-CD107a des fragments Fab d’anticorps à la suspension de cellules à une concentration finale de 4 µg/mL avant d’injecter les cellules dans les ports d’entrée.
- Resuspendre le CD4 préparés+ T les cellules isolées de LN ou PB ou du cordon de sang et injecter 50 µL de la suspension cellulaire dans le port d’entrée du chenal de la diapositive contenant la bicouche.
- Choisissez le nombre désiré de champs et d’enregistrer des images de chaque champ 1 x toutes les 2 min pendant 30 min après l’injection.
- Exploiter des canaux lumineux et fluorescents lumineux-zone, réfléchies (Alexa 488 et Cy5) du microscope confocal pour acquérir les images. Utilisez le mode de la FRBR pour fluorescence Alexa-Fluor-488 et Alexa-Fluor-568 et widefield pour fluorescence Cy5, ainsi que l’imagerie lumineux-zone, le microscope TIRF.
5. image Analysis
- Analyser les images acquises à l’aide de logiciels appropriés. Observer la morphologie cellulaire en images en lumière transmises et exclure en cluster et visiblement endommagé ou cellules apoptotiques de l’analyse. Inclure dans l’analyse uniquement les cellules qui interagissent de façon productive avec la surface de la bicouche (c.-à-d., les cellules accumulent Alexa-Fluor-488 fluorescence (anticorps anti-CD3) à l’interface).
- Déterminer la taille de la zone d’adhérence cellulaire à 20 min après le début de l’interaction cellule-bicouche.
Remarque : La zone d’adhérence est la zone sombre, développée à l’interface de cellule-bicouche sur les images de microscopie (IRM) de réflexion de brouillage. - Observer une accumulation de fluorescence Cy5-ICAM-1 et une formation de la jonction de l’anneau par des molécules de Cy-ICAM-1 réservés à l’interface de la cellule-bicouche. Si accumulé ICAM-1 molécules formées une jonction adhérence au moins deux images consécutives, désigner ces cellules comme les cellules développant un périphérique supramoléculaire de cluster (pSMAC) Activation12.
- Évaluer la libération des granules en mesurant l’intensité de fluorescence Alexa-Fluor-568 à l’interface de lymphocytes T-bicouche sur la fluorescence de fond à l’extérieur de la zone de contact à proximité de la cellule. Désigner les cellules avec un ratio de Alexa-Fluor-568 signal-à-fond d’au moins 1,3 degranulating cellules.
Résultats
Tout d’abord, nous avons comparé la structure de l’interface synaptique formé par CD8 activés de dérivés du sang-cordon+ T des cellules exposées à des bicouches lipidiques construit soit en écoulement à grande échelle traditionnel systèmes de cellules (voir la Table des matières pour plus de détails)1 ,2,3,4 ou dans ...
Discussion
Cette nouvelle technique décrite ici utilise des réactifs similaires nécessaires pour construire des bicouches planaires dans le débit conventionnel cellule5 et peut être appliquée avec succès pour effectuer l’imagerie du primaire des lymphocytes T humains – bicouche interfaces3,4 ,,15. La technique offre une réduction significative de l’utilisation de molécules fluorescentes et nécessite...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par l’octroi de NIH de R01AI118694 à Michael R. Betts, qui inclut les prix 566950 à Yuri Sykulev. Nous remercions la Sidney Kimmel Cancer Center Bioimaging partagée ressource pour leur excellent soutien.
matériels
| Name | Company | Catalog Number | Comments |
| CD4 T cell isolation kit, human | Miltenyl Biotec | 130-096-533 | |
| CD8 T cells Isolation Kit, human | Miltenyl Biotec | 130-096-495 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| DOGS NTA | Avanti Polar Lipids | 790528C | |
| Biotinyl Cap PE | Avanti Polar Lipids | 870273C | |
| Human Serum Albumin | Octapharma USA | NDC 68982-643-01 | |
| sticky-Slide VI 0.4 | ibidi | 80608 | |
| Coverslips for sticky-Slides | ibidi | 10812 | |
| Bioptech FCS2 Chamber | Bioptech | 060319-2-03 | |
| anti-CD3 antibody | Thermo Fisher Scientific | 16-0037-81 | OKT3 clone, hybridoma cells are available from ATCC |
| anti- CD28 antibody | Genetex | GTX14664 | 9.3 clone |
| Casein | Sigma | C5890 | |
| Biotin-PEO4-NHS | Thermo Fisher Scientific | 21329 | |
| DMSO | Sigma | D2650-5 | |
| Alexa Fluor 488 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10235 | |
| Alexa Fluor 568 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10238 | |
| Amersham Cy5 NHS Ester | GE Life Science | PA15101 | |
| pMT/V5-His A, B, C Drosophila Expression Vectors | Thermo Fisher Scientific | V412020 | |
| pcopneo, G418 Drosophila expression vector for positive selection | ATCC | 37409 | |
| Serum free Drosophial media Insect-XPRESS | Lonza | 12-730Q | |
| Hybridoma YN1/1.7.4 | ATCC | CRL1878 | The hybridoma secrets antibody against ICAM-1. |
| Cyanogen bromide-activated-Sepharose 4B | Sigma-Aldrich | C9142 | Utilized for preparation of Sepharose with covelently bound anti-ICAM antibody. |
| MasterFlex tangential flow concentrator | Cole-Parmer | 77601-60 7592-40 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Centramate Lab Tangential Flow Systems | Pall Laboratory | FS002K10 OS010T12 FS005K10 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Ni-NTA Agarose | QIAGEN | 30210 | |
| Dialysis tubing | Spectra/Por | 131384 | |
| Papain from papaya latex | Sigma | P3125 | |
| mouse anti-human antibody against CD107a | BD Bioscences | 555798 | Clone H4A3 |
| Ansell Natural Blue Gloves | Fisher Scientific | 19-014-539 | |
| Nalgene Polypropylene Scissor-Type Forceps | Thermo Fisher Scientific | 6320-0010 | |
| Streptavidin | ProZyme | SA10 | |
| Confocal microscope | Nikon | Nikon TiE inverted microscope equipped with PFS for long-term image stability control, 60X oil objectives, 4 lasers with excitation lines at 405, 458, 488, 514, 561, and 640 nm, 2 GaAsP detectors and 2 high sensitivity PMTs, DIC transmitted light, Programmable X,Y,Z stage for multiple positions and stitching of large areas, time lapse functions, Tokai-Hit temperature and CO2-controlled chamber for live imaging, and anti-vibration isolation table | |
| TIRF microscope | Andor | Andor Revolution XD system equipped with Nikon TIRF-E illuminator, Lasers with 405,488,561 and 640 lines, DIC transmitted light, Yokogawa CSU-X1 spinning disk head for confocal imaging, 100/1.49 NA objective, Andor iXon X3 EM-CCD camera, objective heater, and a piezoelectric motorized stage with Perfect Focus System (PFS) | |
| MetaMorph Premier Image Analysis Software | Molecular devices |
Références
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Somersalo, K., et al. Cytotoxic T lymphocytes form an antigen-independent ring junction. Journal of Clinical Investigation. 113, 49-57 (2004).
- Beal, A. M., et al. Protein kinase C theta regulates stability of the peripheral adhesion ring junction and contributes to the sensitivity of target cell lysis by CTL. The Journal of Immunology. 181, 4815-4824 (2008).
- Beal, A. M., et al. Kinetics of early T cell receptor signaling regulate the pathway of lytic granule delivery to the secretory domain. Immunity. 31, 632-642 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Current Protocols in Immunology. , (2007).
- Reuter, M. A., et al. HIV-Specific CD8(+) T Cells Exhibit Reduced and Differentially Regulated Cytolytic Activity in Lymphoid Tissue. Cell Reports. 21, 3458-3470 (2017).
- Buggert, M., et al. Limited immune surveillance in lymphoid tissue by cytolytic CD4+ T cells during health and HIV disease. PLoS Pathogens. 14, e1006973 (2018).
- Carrasco, Y. R., Fleire, S. J., Cameron, T., Dustin, M. L., Batista, F. D. LFA-1/ICAM-1 interaction lowers the threshold of B cell activation by facilitating B cell adhesion and synapse formation. Immunity. 20, 589-599 (2004).
- Anikeeva, N., et al. Distinct role of lymphocyte function-associated antigen-1 in mediating effective cytolytic activity by cytotoxic T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America. 102, 6437-6442 (2005).
- Steblyanko, M., Anikeeva, N., Campbell, K. S., Keen, J. H., Sykulev, Y. Integrins Influence the Size and Dynamics of Signaling Microclusters in a Pyk2-dependent Manner. The Journal of Biological Chemistry. 290, 11833-11842 (2015).
- Anikeeva, N., Lebedeva, T., Sumaroka, M., Kalams, S. A., Sykulev, Y. Soluble HIV-specific T-cell receptor: expression, purification and analysis of the specificity. Journal of Immunological Methods. 277, 75-86 (2003).
- Monks, C., Freiberg, B., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Riddell, S. R., Greenberg, P. D. The use of anti-CD3 and anti-CD28 monoclonal antibodies to clone and expand human antigen-specific T cells. Journal of Immunological Methods. 128, 189-201 (1990).
- Lin, S. J., Yu, J. C., Cheng, P. J., Hsiao, S. S., Kuo, M. L. Effect of interleukin-15 on anti-CD3/anti-CD28 induced apoptosis of umbilical cord blood CD4+ T cells. European Journal of Haematology. 71, 425-432 (2003).
- Anikeeva, N., Sykulev, Y. Mechanisms controlling granule-mediated cytolytic activity of cytotoxic T lymphocytes. Immunologic Research. 51, 183-194 (2011).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon