Method Article
Évacuation de l’hémorragie intracérébrale endoscopique mini-invasive
Dans cet article
Résumé
Cet article détaille le protocole chirurgical pour l’évacuation de l’hémorragie intracérébrale endoscopique mini-invasive à l’aide de la technique SCUBA.
Résumé
L’hémorragie intracérébrale (ICH) est un sous-type d’AVC avec une mortalité élevée et de mauvais résultats fonctionnels, en grande partie parce qu’il n’existe aucune option de traitement fondée sur des preuves pour ce processus de maladie dévastatrice. Au cours de la dernière décennie, un certain nombre de chirurgies mini-invasives ont émergé pour résoudre ce problème, dont l’une est l’évacuation endoscopique. L’aspiration sanguine sous-marine stéréotaxique de l’ICH (SCUBA) est une nouvelle technique d’évacuation endoscopique réalisée dans une cavité remplie de liquide à l’aide d’un système d’aspiration pour fournir un degré de liberté supplémentaire pendant la procédure. La procédure de plongée utilise un dispositif d’aspiration, un endoscope et une gaine et est divisée en deux phases. La première phase implique une aspiration maximale et une irrigation minimale pour réduire la charge de caillots. La deuxième phase consiste à augmenter l’irrigation pour la visibilité, à diminuer la force d’aspiration pour une aspiration ciblée sans perturber la paroi de la cavité et à cautériser les vaisseaux saignants. En utilisant l’endoscope et la baguette d’aspiration, cette technique vise à maximiser l’évacuation de l’hématome tout en minimisant les dommages collatéraux au cerveau environnant. Les avantages de la technique SCUBA comprennent l’utilisation d’une gaine endoscopique à profil bas minimisant les perturbations cérébrales et une visualisation améliorée avec une cavité remplie de liquide plutôt qu’une cavité remplie d’air.
Introduction
L’hémorragie intracérébrale est un saignement qui se produit dans le parenchyme cérébral et est le sous-type d’accident vasculaire cérébral le plus dévastateur en termes de mortalité et d’invalidité. L’incidence mondiale de l’ICH est d’environ 24,6 pour 100 000 individus, avec 40 000 à 67 000 cas survenant chaque année aux États-Unis1,2. L’hémorragie intracérébrale est une urgence médicale nécessitant un diagnostic et une prise en charge rapides. Historiquement, les résultats ont été sombres, avec des taux de mortalité de 40% à 1 mois, 51-54% à 1 an et 71% à 5 ans3,4,5,6. L’une des principales raisons d’un si mauvais pronostic est qu’il n’existe aucun traitement fondé sur des preuves pour ce processus pathologique. Les essais cliniques antérieurs (STICH I et II) n’ont pas démontré d’amélioration des résultats de la chirurgie par rapport à la prise en charge médicale conservatrice7,8. Une hypothèse proposée pour l’échec des craniotomies est que tout avantage tiré de l’évacuation du caillot est compensé par le traumatisme cérébral étendu infligé par la nature invasive de la procédure. En conséquence, au cours de la dernière décennie, un certain nombre de techniques mini-invasives ont été développées pour tenter de résoudre ce problème, chacune présentant des avantages et des inconvénients. Les techniques peuvent être regroupées en deux catégories : l’aspiration stéréotaxique avec thrombolyse et l’évacuation active. Le premier consiste à aspirer le caillot à travers un trou de bavure, à administrer un agent thrombolytique et à drainer le caillot résiduel à travers un cathéter sur une période de plusieurs jours. Cette technique est actuellement testée dans l’essai clinique MISTIE et est utilisée par des cliniciens en Chine avec l’aiguille de craniopunctureYL-1 9,10. L’évacuation active, d’autre part, consiste à aspirer le caillot entier en une seule procédure sans avoir besoin d’un cathéter drainant.
Un certain nombre d’essais cliniques sont également en cours pour cette technique, notamment ENRICH, qui utilise le système NICO BrainPath pour l’évacuation transsulfale assistée par endoport; l’essai INVEST11, qui est une étude de faisabilité à bras unique utilisant les systèmes Penumbra Apollo ou Artemis pour l’évacuation endoscopique; et l’essai MIND, qui est un essai clinique randomisé multicentrique évaluant l’évacuation endoscopique à l’aide du dispositif Artemis. L’évacuation endoscopique est une technique prometteuse car elle a le canal de travail le plus bas pour minimiser les traumatismes cérébraux12. Cet article décrit une technique endoscopique spécifique décrite comme l’aspiration sanguine sous-marine stéréotaxique de l’ICH (SCUBA)13. La première phase se concentre sur la réduction de l’hématome en utilisant une aspiration maximale tout en travaillant à l’extrémité de la gaine. La deuxième phase utilise un taux d’irrigation élevé pour aspirer les caillots résiduels et cautériser les vaisseaux saignants de manière très ciblée.
Trois dispositifs sont utilisés dans la procédure de plongée sous-marine: une gaine (6,33 mm), un endoscope et un système d’aspiration. Le système d’aspiration se compose d’une baguette chirurgicale (2,6 mm) conçue pour s’insérer à l’intérieur du canal de travail d’un endoscope, qui est insérée dans la gaine. La baguette est capable d’aspiration et, en appuyant sur un bouton sur la poignée, de morcellation. Le composant de morcellation de l’appareil est un bident en rotation à l’extrémité du tube d’aspiration qui tourne lors de l’activation. L’aspiration est activée en recouvrant le trou au niveau du pouce sur la poignée, et le bident est activé en appuyant fermement sur le bouton. L’activation de l’aspiration à cet égard est similaire aux instruments d’aspiration neurochirurgicaux courants.
Protocole
Avant d’exécuter ce protocole, l’approbation institutionnelle requise et le consentement du patient ont été obtenus. Toutes les procédures ont été approuvées par l’hôpital Mount Sinai.
1. Critères d’inclusion
- Inclure les patients qui répondent à tous les critères suivants : âge > 18 ans, échelle de Rankin modifiée par les lignes de base (mRS) < 4, présentation de l’échelle de coma de Glasgow (GCS) > 4, présentation de l’échelle d’AVC des NIH (NIHSS) ≥ 6, apparition des symptômes < 24 heures avant la tomodensitométrie initiale (l’évacuation minimale invasive de l’ICH peut être effectuée dans les 72 heures suivant l’ictus), emplacement supratentorial de l’ICH, volume de l’ICH > 20 cm3, stabilité du volume de l’ICH mesurée sur deux tomodensitogrammes à 6 heures d’intervalle, pression artérielle systolique contrôlée à < 160 mmHg pendant au moins 6 heures avant la chirurgie.
2. Critères d’exclusion
- Exclure les patients qui répondent à un ou plusieurs des critères suivants : la tomodensitométrie démontre une hémorragie en expansion; signe ponctuel sur l’imagerie CTA; lésion sous-jacente non sécurisée(par exemple, malformation artérioveineuse, anévrisme, tumeur); conversion hémorragique d’un AVC ischémique aigu; l’emplacement infratentorial de l’ICH; grande hémorragie intraventriculaire nécessitant un traitement à la suite d’un effet de masse ou d’un déplacement; extension de l’hémorragie dans le mésencéphale; exigence absolue d’anticoagulation à long terme; coagulopathie; numération plaquettaire < 100 000 cellules/mm3; INR > 1.4; temps élevé de thromboplastine partielle activée (PTAp); présentant gcS < 4, risque élevé d’AVC ischémique; besoin émergent de décompression chirurgicale; l’incapacité de donner son consentement à la procédure; est enceinte, allaite ou affiche un test de grossesse positif; signe d’infection active; ou toute maladie ou affection comorbide susceptible de compromettre la survie.
3. Positionnement et planification
- Administrer une anesthésie générale au patient en utilisant des techniques standard.
- Maintenez des conditions stériles tout au long de la procédure en préparant stérilement la peau et en drapant la zone chirurgicale.
- Planifiez la trajectoire de l’évacuation en utilisant l’imagerie volumétrique préopératoire pour tracer une ligne le long du long axe de l’hématome jusqu’à la surface externe du crâne, de sorte que l’extrémité de la gaine se trouve à 1 à 2 cm de l’extrémité distale de l’hématome.
REMARQUE: Les choses importantes à garder à l’esprit lors de la planification de la trajectoire sont de minimiser la perturbation des tissus cérébraux (en particulier les structures éloquentes) et d’éviter toute vascularisation visible sur l’imagerie non invasive. La planification de trajectoire est effectuée sur un logiciel de navigation stéréotaxique, qui varie selon l’institution. Une comparaison des systèmes de navigation couramment utilisés dans l’évacuation de l’ICH est disponible dans la littérature médicale14. - Placez le patient dans la position anatomique correcte en fonction de l’emplacement de l’hématome.
REMARQUE: La plupart des cas (80%) sont effectués en décubitus dorsal, et une minorité est effectuée couchée (15%) ou couchée avec la tête tournée (5%).
4. Ouverture
- Faites une incision linéaire et horizontale de 2 cm le long de la peau dans un pli naturel de la peau.
- Ouvrez le crâne avec une craniectomie de 1 à 1,2 cm de diamètre à l’aide d’une perceuse à grande vitesse avec une bavure de coupe de 5 mm. Essayez d’aligner la craniectomie avec l’axe long de l’hématome, mais évitez les structures médianes et les territoires cérébraux éloquents.
REMARQUE: Un perforateur est plus grand que nécessaire, surtout si le défaut est sur le front. - Si la trajectoire n’est pas parfaitement perpendiculaire au crâne, percez un cylindre dans l’os le long de la trajectoire prévue pour assurer une mobilité optimale de la gaine et de l’endoscope dans la craniectomie, mais sachez que l’intersection avec la durra ne sera pas perpendiculaire.
- Utilisez de la cire osseuse, de la mousse de gel dans la thrombine et de la cautérisme bipolaire pour obtenir une hémostase.
- Visualisez l’hématome sous-jacent à l’aide d’ultrasons pour confirmer sa taille et sa position.
REMARQUE: La qualité des ultrasons est la plus élevée en utilisant le transducteur de trou de bavure dans un champ humide avant la duromtomie. - Ouvrez la dura de manière croisé et cautériser les feuilles durales à moins d’un millimètre du bord osseux.
REMARQUE: Évitez les grosses veines ou artères. - Inciser la pia mater de 1 cm avec une lame #11 avant la cautérisation. Si vous obtenez une biopsie cérébrale, c’est le moment idéal. Utilisez une pince tumorale ou l’extrémité de la tasse d’un instrument Penfield 1. Évitez la cautérisme jusqu’à ce que la biopsie soit obtenue.
- Cautériser l’incision piale et le cortex sous-jacent avec une cautérisation bipolaire.
5. Phase 1 Évacuation
- Insérez la gaine introducteur le long de la trajectoire prévue avec un stylet de navigation positionné dans la gaine. Le stylet fournit des commentaires en direct sur l’emplacement de la pointe.
NOTE: Compte tenu de la petite taille de la craniectomie de 1 cm, une approche « trans-sulcale » n’est souvent pas possible; par conséquent, la pia est incisée et entrée dans un espace non vasculaire immédiatement en dessous de la craniectomie. - Si le caillot est particulièrement fibreux et qu’une résistance est rencontrée, effectuez un léger ajustement de la gaine pour atteindre le point cible.
- Retirez l’introducteur et la sonde de navigation une fois le point cible atteint, à 1-2 cm de l’extrémité distale de l’hématome.
REMARQUE: Certains opérateurs préfèrent utiliser la navigation stéréotaxique enregistrée sur l’endoscope plutôt que l’introducteur de gaine pour une navigation continue. - Notez la position de la gaine en la marquant au niveau de la peau.
REMARQUE: Si la pression à l’intérieur de l’hématome est élevée, du liquide peut s’écouler de la gaine au cours de cette étape. - Préparez l’endoscope en activant les paramètres préférés, notamment la balance des blancs, la luminosité, le filtre et l’intensité lumineuse.
- Fixez le tube d’irrigation d’un sac salin de 2 L à hauteur d’épaule à l’orifice de travail gauche et réglez le débit à environ 25% sur l’endoscope. Ouvrez le bon orifice de l’endoscope jusqu’au bout, ce qui permet la sortie du liquide d’irrigation.
- Insérez l’endoscope dans la gaine. Insérez la baguette à l’intérieur du canal de travail de l’endoscope et tenez la baguette avec la main dominante.
REMARQUE: Pour cette phase de la procédure, maintenez l’endoscope et la baguette à l’extrémité de la gaine, à environ 0,5 à 2 cm de l’extrémité de la gaine. - Utilisez le doigt pointeur pour tamponner la distance entre l’endoscope et la poignée de la baguette afin de maintenir une conscience constante de l’emplacement de la pointe de l’appareil dans la gaine.
- Réglez la force d’aspiration du système d’aspiration à 100% et réglez le débit d’irrigation à faible (~ 25%).
- Aspirer tout hématome liquide qui se présente à l’extrémité de la gaine tout en gardant la baguette dans le distal 1 cm de la gaine.
REMARQUE: Comme l’hématome est aspiré, la cavité s’effondrera vers l’intérieur en raison de l’effet de masse réduite. L’irrigation constante maintient la structure de la cavité pendant la phase 2 de l’évacuation. - Si un caillot solide est rencontré qui n’aspire pas avec l’aspiration seule, activez le bident dans la baguette pour digérer le caillot.
- Si un morceau de caillot est trop gros ou fibreux pour l’aspiration et adhère à l’extrémité de la baguette, retirez tout l’endoscope et la baguette avec le caillot, en prenant soin de ne pas déloger le caillot de la baguette.
REMARQUE: C’est ce qu’on appelle la technique ADAPT (A Direct Aspiration First Pass Technique), faisant référence à la pratique consistant à enlever le thrombus intravasculaire lors d’une thrombectomie pour un AVC ischémique aigu15. - Si le morceau de caillot est particulièrement gros avec une capsule fibreuse et que les deux techniques précédentes ne fonctionnent pas, utilisez le canal de travail de l’endoscope comme aspiration supplémentaire.
- Pour ce faire, fixez une aspiration chirurgicale conventionnelle au deuxième orifice de l’endoscope (généralement la voie de sortie d’irrigation) avec la valve fermée mais prête à être activation. Dessinez le gros morceau de caillot dans l’extrémité de la gaine à l’aide de la baguette. Fermez l’orifice d’entrée d’irrigation et ouvrez l’orifice d’écoulement pour activer l’aspiration chirurgicale maximale. Le caillot est maintenant coincé sur le bout de la baguette, de l’endoscope et de la gaine. Retirez la baguette, l’endoscope, la gaine et le caillot ensemble.
REMARQUE: C’est ce qu’on appelle la technique double ADAPT.
- Pour ce faire, fixez une aspiration chirurgicale conventionnelle au deuxième orifice de l’endoscope (généralement la voie de sortie d’irrigation) avec la valve fermée mais prête à être activation. Dessinez le gros morceau de caillot dans l’extrémité de la gaine à l’aide de la baguette. Fermez l’orifice d’entrée d’irrigation et ouvrez l’orifice d’écoulement pour activer l’aspiration chirurgicale maximale. Le caillot est maintenant coincé sur le bout de la baguette, de l’endoscope et de la gaine. Retirez la baguette, l’endoscope, la gaine et le caillot ensemble.
- Si le caillot a une capsule fibreuse et est difficile à séparer du tissu cérébral, utilisez l’extrémité de la gaine comme dissecteur émoussé.
REMARQUE: C’est ce qu’on appelle la technique de dissection de la gaine. - Après avoir aspiré, explorez la cavité à la même profondeur en faisant pivoter doucement la gaine latéralement jusqu’à ce qu’il ne reste plus de caillot résiduel à cette profondeur.
- Retirez la gaine de 1 cm et répétez les étapes d’aspiration de la phase 1 jusqu’à ce que la gaine atteigne la paroi proximale de la cavité.
6. Phase 2 De l’évacuation
- Diminuer l’aspiration de la baguette à 25% et augmenter l’irrigation à 100% pour améliorer la visibilité dans la cavité. Explorer l’hématome résiduel et identifier les artères hémorragiques.
REMARQUE: Au cours de cette phase, il est essentiel de minimiser les forces d’aspiration sur le tissu cérébral de péricité. - Aspirer tout hématome résiduel de manière ciblée avec un faible pouvoir d’aspiration, en prenant soin de ne pas endommager la matière cérébrale environnante qui peut entraîner des saignements supplémentaires ou causer un traumatisme à la paroi de la cavité.
REMARQUE: Les produits sanguins peuvent initialement interférer avec la visualisation optimale, mais la cavité se dégagera avec l’irrigation continue du patient. Si la cavité ne se dégage pas, identifiez et cautériser les vaisseaux saignants. - Surveillez les vaisseaux hémorragiques et traitez-les en conséquence en suivant les étapes suivantes:
- Si les petits vaisseaux saignants sont difficiles à visualiser, dirigez un flux constant d’irrigation vers le vaisseau en planant immédiatement au-dessus du site de saignement avec la gaine et en tirant la lunette en arrière de la pointe. Une fois que le récipient est mieux visualisé, cautériser le navire.
REMARQUE: C’est ce qu’on appelle la technique de vol stationnaire de la gaine. - Irriguer la cavité jusqu’à ce que l’hémostase soit atteinte
- Appliquez une pression en utilisant l’extrémité de la gaine si l’irrigation pure ne fonctionne pas.
- Utilisez la cautérisme bipolaire si les deux méthodes précédentes ne fonctionnent pas.
- Aspirer tout hématome résiduel le long des côtés ou dans les crevasses de la cavité.
REMARQUE: Cette étape devient plus facile une fois que les vaisseaux saignants sont traités, ce qui permet une visualisation claire.
- Si les petits vaisseaux saignants sont difficiles à visualiser, dirigez un flux constant d’irrigation vers le vaisseau en planant immédiatement au-dessus du site de saignement avec la gaine et en tirant la lunette en arrière de la pointe. Une fois que le récipient est mieux visualisé, cautériser le navire.
- Assurez-vous que la cavité est débarrassée de tous les hématomes visibles et des vaisseaux hémorragiques.
REMARQUE: S’il y a une fine couche de caillot frais provenant d’un saignement peropératoire, méfiez-vous de provoquer plus de saignement dans la tentative d’aspiration de ce mince revêtement de sang frais. Aspirer doucement ou laisser le sang frais en place. Différencier les caillots de la paroi de la cavité est un défi majeur dans la procédure.
7. Évaluation et clôture
- Retirez l’endoscope et la gaine lentement, avec l’endoscope à l’extrémité de la gaine pour examiner les parois du tractus à la sortie pour surveiller les saignements supplémentaires.
REMARQUE: Certains opérateurs ont préconisé l’injection de thrombine dans la cavité à ce stade, soit en ajoutant de la thrombine directement au liquide d’irrigation, soit en injectant de la gélatine mélangée à de la thrombine à travers l’endoscope. C’est une option raisonnable, mais l’injection de gélatine mélangée à de la thrombine rendra l’imagerie par ultrasons impossible. - Utilisez l’échographie du trou de bavure pour évaluer l’hématome résiduel ou les saignements actifs.
REMARQUE: L’échographie est utile pour déroler les doutes sur les régions douteuses ainsi que pour détecter les grandes zones d’hématome résiduel qui peuvent avoir été manquées sous visualisation directe. - Effectuez une tomodensitométrie peropératoire si disponible pour évaluer le degré d’évacuation.
REMARQUE: L’objectif de la procédure est d’obtenir une évacuation d’au moins 80%. S’il reste plus de 20 % de l’hématome, recommencez la phase 2 de l’évacuation avant de passer aux étapes suivantes. - Appliquez de la mousse de gel hémostatique dans le trou de bavure sur la surface du cerveau.
- Couvrez la craniectomie à l’aide d’une plaque de titane et fixez-la à l’aide de vis en titane.
- Fermez la galée et les couches sous-cutanées à l’aide de sutures 3-0 polyglactine 910.
- Fermez la peau à l’aide de 4-0 poliglycaprone 25 points de suture sous-cuticulaires, suivis de bandes de ruban chirurgical de fermeture de la peau.
Résultats
La technique d’évacuation sous-marine a été décrite chez 47 patients subissant une évacuation endoscopique de l’ICH entre décembre 2015 et septembre 2017. Le volume moyen de l’ICH préopératoire a été rapporté à 42,6 cm3 (écart-type = 29,7 cm3; volume moyen de l’ICH postopératoire = 4,2 cm3, ET 6,6 cm3), ce qui donne un taux d’évacuation moyen de 88,2 % (ET 20,8 %) (tableau 1). Un exemple de tomodensitométrie préopératoire et postopératoire est illustré à la figure 1. Dans 23 (48,9 %) cas, des vaisseaux hémorragiques actifs ont été détectés, et dans 12 (52,2 %) de ces cas, des saignements émanaient de plus d’un vaisseau(tableau 2). Les saignements ont été traités par irrigation seule dans 5 cas (10,6%) et par électrocautérisation dans 18 cas (38,3%)(tableau 2). Les saignements postopératoires ont été isolés à un seul cas (2,1 %) dans lequel la tomotérisation de routine de la tête effectuée le jour 1 de l’opération a démontré que la cavité d’évacuation s’était remplie d’hémorragie qui semblait provenir d’un saignement superficiel du vaisseau galéal dans le tractus d’accès et la cavité (Tableau 2). L’examen de ce patient ne s’est pas aggravé et il n’a pas eu besoin d’une intervention chirurgicale supplémentaire.
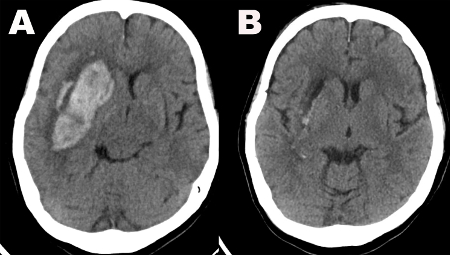
Figure 1: Tomodensitométrie. ( A )L’imagepréopératoire de la tête de tomodensitométrie montre une grande hémorragie des ganglions de la base droite. (B) L’image de la tête de tomotmatique réalisée le jour postopératoire 1 montre une évacuation presque complète de l’hématome. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Variable | Méchant | Écart type |
| Volume préopératoire | 42.6 | 29.7 |
| Volume postopératoire | 4.2 | 6.6 |
| Pourcentage d’évacuation | 88.2% | 20.8% |
Tableau 1 : Détails de l’évacuation. Volumes de l’ICH et taux d’évacuation pour la procédure de plongée sous-marine.
| Variable | Nombre | Pour cent |
| Total Patients | 47 | - |
| Saignement actif identifié | 23 | 48.9% |
| Navires individuels | 11 | 23.4% |
| Navires multiples | 12 | 25.5% |
| Irrigation | 5 | 10.6% |
| Électrocautéristé | 18 | 38.3% |
| Saignement postopératoire | 1 | 2.1% |
Tableau 2 : Détails opérationnels. Détails opératoires (en particulier les vaisseaux saignants) rencontrés pendant la procédure de plongée sous-marine.
Discussion
Il existe plusieurs pratiques exemplaires opérationnelles à apprendre et à mettre en œuvre lors de l’évacuation endoscopique de l’ICH. Tout d’abord, il est essentiel de minimiser la perturbation des tissus cérébraux dans la mesure du possible. Pour ce faire, il commence par optimiser la trajectoire chirurgicale afin que la gaine traverse le cours le plus court possible tout en évitant les structures éloquentes. Pour l’ICH supratentorial, les structures éloquentes comprennent l’aire motrice supplémentaire, les cortex moteurs et sensoriels primaires, le gyri temporal et angulaire supérieur gauche et le cortex visuel primaire. De plus, la trajectoire doit s’aligner sur l’axe longitudinal de l’hématome. Les avantages de cette stratégie comprennent la maximisation de la visualisation de la cavité, la minimisation de la force de couple sur le cerveau adjacent au tractus d’accès, l’augmentation de la probabilité de pouvoir voir les extrêmes de la cavité et la création de la trajectoire la plus courte possible vers le caillot, minimisant ainsi les traumatismes cérébraux.
En plus de minimiser la perturbation des tissus cérébraux, il est également important de minimiser la distorsion de la cavité de l’hématome. L’aspiration dans une cavité fermée peut déformer la matière cérébrale élastique autant que les forces de compression avec des dommages égaux. Pour éviter cela, la force d’aspiration doit être au niveau minimal possible nécessaire pour une aspiration efficace du caillot sanguin. Ceci est particulièrement important si la pointe de la baguette est avancée au-delà de la pointe de la gaine. Le seul moment où la force d’aspiration doit être élevée est pendant la phase 1, lorsque la pointe est en contact direct avec le caillot. La force d’aspiration devrait diminuer au fur et à mesure que la procédure progresse.
Des résultats défavorables ont été rapportés lorsque l’irrigation lors d’une évacuation endoscopique d’un hématome intraventriculaire entraîne une augmentation de la pression intracrânienne16. La procédure SCUBA évite cela en évacuant l’hématome en phase 1, ce qui diminue la pression dans la cavité, puis en irriquant en phase 2. Dans la phase 2, l’endoscope dispose d’un deuxième port d’accès qui permet une sortie d’irrigation, évitant ainsi une distension excessive de la cavité de l’hématome et une pression intracavitaire élevée. De plus, la gaine et le tractus ne forment pas de joint étanche et le liquide d’irrigation est perdu autour de la gaine.
Atteindre et maintenir l’hémostase pendant la phase 2 est une condition cruciale pour une évacuation sous-marine réussie. Il est important de surveiller méticuleusement chaque paroi de la cavité pour les vaisseaux saignants et de les traiter en conséquence avec une irrigation continue ou une cautérisme bipolaire. L’obtention d’une hémostase parfaite garantit un risque minimal de saignement postopératoire.
Étant donné qu’une visualisation claire et directe de l’hématome résiduel dans la cavité peut ne pas toujours être possible pendant la procédure, il est préférable de vérifier l’évacuation par imagerie peropératoire après la phase 2. Il y a eu plusieurs cas dans lesquels l’examen endoscopique direct a suggéré que la cavité était claire, mais un hématome résiduel a été détecté à l’échographie peropératoire ou à la tomotmétrie DYNA, entraînant un autre passage avec la gaine dans la cavité et une évacuation supplémentaire de l’hématome.
À ce stade précoce du développement de cette procédure, il existe des preuves suffisamment solides pour suggérer quelle devrait être la limite inférieure du pourcentage d’évacuation du volume résiduel de caillots. Bien qu’il n’existe actuellement aucune étude évaluant les résultats des pourcentages d’évacuation des procédures endoscopiques, les modèles animaux et l’essai MISTIE suggèrent qu’une évacuation accrue est préférable9. Chez les souris induites par l’ICH, les molécules dans le sang telles que le fer avaient un effet toxique sur le tissu cérébral environnant, tandis que les chélateurs du fer réduisaient les dommages17. L’essai MISTIE II a révélé que le volume d’œdème périhématomique était le plus faible lorsque le pourcentage d’évacuation dépassait 65%, plus élevé lorsque le pourcentage d’évacuation variait de 20 à 65% et le plus important lorsque le pourcentage d’évacuation était inférieur à 20%18. Ces données suggèrent également que les résultats peuvent s’améliorer avec un pourcentage d’évacuation plus élevé, mais l’étude n’a pas été alimentée pour évaluer cette caractéristique. Les essais MISTIE phase III, ENRICH, INVEST et/ou MIND peuvent éclairer cette question.
Un domaine qui reste à résoudre est le calendrier de la procédure. De nombreux protocoles préconisent l’évacuation dans les 72 heures et après un balayage de stabilité de 6 heures pour s’assurer que l’hématome est stable. De nombreux médecins choisissent cette ligne de conduite, car une petite étude de 2004 a rapporté des complications, des saignements et de mauvais résultats chez une petite série de patients qui ont subi une craniotomie pour une chirurgie ultra-précoce19. Des études plus récentes sur l’évacuation endoscopique mini-invasive ont rapporté de bons résultats avec une évacuation ultra-précoce20,21. Des manuscrits faisant état d’une évacuation endoscopique suggèrent que les saignements sont identifiables et contrôlables dans les évacuations ultra-précoces. Le protocole d’étude ENRICH exige une évacuation dans les 24 heures suivant l’ictus et n’exige pas de balayage de stabilité. La chirurgie ultra-précoce peut être une option à l’avenir, mais des études supplémentaires sont nécessaires pour évaluer les risques et les avantages d’une évacuation ultra-précoce.
La procédure SCUBA est une technique d’évacuation de l’hémorragie intracérébrale mini-invasive qui implique un endoscope utilisant un système d’aspiration. Les preuves préliminaires suggèrent que la technique de plongée sous-marine peut être effectuée de manière sûre et fiable, ce qui entraîne un pourcentage d’évacuation élevé. D’autres études sont nécessaires pour évaluer l’impact de cette procédure sur les résultats fonctionnels.
Déclarations de divulgation
Christopher Kellner a reçu une subvention éducative de Penumbra pour un cours de FMC destiné à enseigner l’évacuation endoscopique des hémorragies intracérébrales mini-invasives. J Mocco est co-investigateur principal de l’essai INVEST, qui est une étude de faisabilité visant à évaluer l’évacuation endoscopique de l’hémorragie intracérébrale mini-invasive financée par Penumbra. J Mocco est investisseur et consultant pour Rebound Therapeutics.
Remerciements
Cette recherche a été soutenue en partie par une subvention d’Arminio et Lucyna Fraga et une subvention de M. et Mme Durkovic.
matériels
| Name | Company | Catalog Number | Comments |
| Artemis Device 2.8mm | Penumbra Inc. | AP28 | Cannula Outer Diameter: 2.8mm. Cannula Length: 27cm. Aspiration Tubing Length: 9.5ft; The Food and Drug Administration (FDA) approved the Apollo System in 2014 for use in intraventricular hemorrhage (IVH) evacuation but its indication now includes ICH and the Artemis System was approved for the same IVH and ICH evacuation in 2017. |
| Artemis Device 2.1mm | Penumbra Inc. | AP21 | Cannula Outer Diameter: 2.1mm. Cannula Length: 26cm. Aspiration Tubing Length: 9.5ft |
| Artemis Device 1.5mm | Penumbra Inc. | AP15 | Cannula Outer Diameter: 1.5mm. Cannula Length: 27cm. Aspiration Tubing Length: 9.5ft |
| MAX Canister | Penumbra Inc. | APCAN2 | |
| Pump MAX 110V | Penumbra Inc. | PMX110 | |
| 19-French Sheath | Aesculap USA | FH604SU | Outer Diameter: 6.33mm |
| Storz Lotta 3-port Endoscope | Karl Stortz | 28164 LA / 28164 LS | Outer Diameter: 6.1mm. Two ports for irrigation/suction (1.6mm). One working channel (2.9mm) |
| Medtronic AxiEM | Medtronic | UC201403939 | An advantage of the Medtronic AxiEM system is it does not require pinning or line-of-site navigation. |
| High-speed drill with 5-mm cutting burr | Medtronic | 9BA60 | |
| Bone Wax | Ethicon | W31 | |
| Hemostatic Gel Foam with Thrombin | J&J Healthcare | 2994 | |
| Bipolar Cautery | State of the Art | 401102 | |
| Aloka burr hole ultrasound transducer | Aloka | UST-52114P | |
| 11-blade | Bard Parker | 372611 | |
| Penfield 1 instrument | Sklar Corp | 47-2255 | |
| AxiEM stylet | Medtronic | 9735428 | |
| Titanium plate | Depuy Synthes | 04503023/04503024 | |
| Titanium screws | Depuy Synthes | 0450310301/0450310401 | |
| DYNA CT on the Artis Q | Siemens Healthineers | A91AX-01343-33C1-7600 | |
| 3-0 Vicryl sutures | Ethicon | J416 | |
| 4-0 monocryl subcuticular stitches | Ethicon | Y426 | |
| Steri-Strips | 3M | R1547 |
Références
- van Asch, C. J. J., Luitse, M. J. A., Rinkel, G. J. E., vander Tweel, I., Algra, A., Klijn, C. J. M. Incidence, case fatality, and functional outcome of intracerebral haemorrhage over time, according to age, sex, and ethnic origin: a systematic review and meta-analysis. Lancet Neurology. 9 (2), 167-176 (2010).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373 (9675), 1632-1644 (2009).
- Aguilar, M. I., Freeman, W. D. Spontaneous intracerebral hemorrhage. Seminars in Neurology. 30 (5), 555-564 (2010).
- Broderick, J., et al. Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group. Circulation. 116 (16), 391-413 (2007).
- Caceres, J. A., Goldstein, J. N. Intracranial hemorrhage. Emergency Medicine Clinics of North America. 30 (3), 771-794 (2012).
- Poon, M. T. C., Fonville, A. F., Al-Shahi Salman, R. Long-term prognosis after intracerebral haemorrhage: systematic review and meta-analysis. Journal of Neurology, Neurosurgery, and Psychiatry. 85 (6), 660-667 (2014).
- Mendelow, A. D., Gregson, B. A., Rowan, E. N., Murray, G. D., Gholkar, A., Mitchell, P. M. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH II): a randomised trial. Lancet. 382 (9890), 397-408 (2013).
- Mendelow, A. D., et al. Early surgery versus. initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage (STICH): a randomised trial. Lancet Neurology. 365 (9457), 387-397 (2005).
- Hanley, D. F., et al. Safety and efficacy of minimally invasive surgery plus alteplase in intracerebral haemorrhage evacuation (MISTIE): a randomised, controlled, open-label, phase 2 trial. Lancet Neurology. 15 (12), 1228-1237 (2016).
- Wang, W. -. Z., et al. Minimally invasive craniopuncture therapy vs. conservative treatment for spontaneous intracerebral hemorrhage: results from a randomized clinical trial in China. International Journal of Stroke. 4 (1), 11-16 (2009).
- Fiorella, D., Arthur, A. S., Mocco, J. D. The INVEST Trial: A Randomized, Controlled Trial to Investigate the Safety and Efficacy of Image-Guided Minimally Invasive Endoscopic Surgery With Apollo vs ..... Neurosurgery. , (2016).
- Fiorella, D., Arthur, A., Bain, M., Mocco, J. Minimally Invasive Surgery for Intracerebral and Intraventricular Hemorrhage: Rationale, Review of Existing Data and Emerging Technologies. Stroke. 47 (5), 1399-1406 (2016).
- Kellner, C. P., et al. The Stereotactic Intracerebral Hemorrhage Underwater Blood Aspiration (SCUBA) technique for minimally invasive endoscopic intracerebral hemorrhage evacuation. Journal of NeuroInterventional Surgery. , (2018).
- Chartrain, A. G., et al. A review and comparison of three neuronavigation systems for minimally invasive intracerebral hemorrhage evacuation. Journal of NeuroInterventional Surgery. , (2017).
- Turk, A. S., et al. ADAPT FAST study: a direct aspiration first pass technique for acute stroke thrombectomy. Journal of NeuroInterventional Surgery. 6 (4), 260-264 (2014).
- Trnovec, S., Halatsch, M. -. E., Putz, M., Behnke-Mursch, J., Mursch, K. Irrigation can cause prolonged intracranial pressure elevations during endoscopic treatment of intraventricular haematomas. British Journal of Neurosurgery. 26 (2), 247-251 (2012).
- Wu, H., Wu, T., Xu, X., Wang, J., Wang, J. Iron toxicity in mice with collagenase-induced intracerebral hemorrhage. Journal of Cerebral Blood Flow & Metabolism. 31 (5), 1243-1250 (2011).
- Mould, W. A., et al. Minimally invasive surgery plus recombinant tissue-type plasminogen activator for intracerebral hemorrhage evacuation decreases perihematomal edema. Stroke. 44 (3), 627-634 (2013).
- Morgenstern, L. B., Demchuk, A. M., Kim, D. H., Frankowski, R. F., Grotta, J. C. Rebleeding leads to poor outcome in ultra-early craniotomy for intracerebral hemorrhage. Neurology. 56 (10), 1294-1299 (2001).
- Nishihara, T., et al. Newly developed endoscopic instruments for the removal of intracerebral hematoma. Neurocritical Care. 2 (1), 67-74 (2005).
- Nagasaka, T., Inao, S., Ikeda, H., Tsugeno, M., Okamoto, T. Inflation-deflation method for endoscopic evacuation of intracerebral haematoma. Acta Neurochirurgica. 150 (7), 685-690 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon