Method Article
Microgravimétrie dissipatif pour étudier la dynamique de la liaison des phospholipides Binding Protein annexine A2 de bicouches lipidiques solide soutenu par utilisant un résonateur à Quartz
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici un protocole expérimental qui peut être employé pour déterminer les affinités de liaison et le mode d’interaction de protéine se liant à phospholipides exempte d’étiquette annexine A2 avec immobilisée-prise en charge solide bicouches (SLB) de mesurer simultanément la absorption massive et les propriétés viscoélastiques de la protéine annexin A2.
Résumé
La technique de microbalance à cristal de quartz dissipatif est une approche simple et sans étiquette de mesurer simultanément les propriétés massiques de captation et viscoélastique de la masse absorbée/immobilisé sur des surfaces de capteur, permettant la mesure de l’interaction des protéines avec des surfaces solides-prise en charge, comme des bicouches lipidiques, en temps réel et avec une grande sensibilité. ANNEXINES sont un groupe hautement conservé des phospholipides protéines qui interagissent réversible avec la ménagée chargés négativement par la coordination des ions calcium. Nous décrivons ici un protocole qui a été utilisé pour analyser quantitativement la liaison de l’annexine A2 (AnxA2) de bicouches lipidiques planes préparés sur la surface d’un capteur de quartz. Ce protocole est optimisé afin d’obtenir des données solides et reproductibles et comprend une description détaillée étape par étape. La méthode peut être appliquée à d’autres protéines membranaires et les compositions de la bicouche.
Introduction
Les membranes cellulaires sont des structures très dynamiques et complexes. Le mélange composé de lipides membranaires, ainsi que des protéines de la membrane en périphérie ou intégralement associé, assembler à forme microdomaines. L’organisation coordonnée de tempo-spatiale de ces microdomaines membranaires est impliquée dans les processus physiologiques fondamentaux1. La dynamique microdomaine membranaire est conduite par l’interaction des lipides membranaires, ainsi que par la capacité des protéines membranaires périphériques à reconnaître et à interagir avec les lipides enrichis dans les microdomaines. Le recrutement des protéines pour les lipides spécifiques est souvent réalisé par lipide-reconnaissance modules, comme l’homologie pleckstrine (PH) ou la C2 domaines2,3. Méthodes biophysiques d’analyse à l’aide de membranes modèles sont essentielles pour comprendre les principes fondamentaux régissant ces processus au niveau moléculaire.
ANNEXINES, une grande famille de multigene, sont connus pour leur capacité à lier aux lipides de la membrane chargée négativement, surtout la phosphatidylsérine (PS), d’un Ca2 +-contrôlé de manière2. La deuxième caractéristique de la famille annexin est la présence d’un segment de structure conservée, l’annexine répéter, c’est à présent quatre ou huit fois et héberge le Ca2 +- et phospholipides-liaison sites4. Le Ca2 +-interaction charge lipidique place l’ANNEXINES dans une position parfaite pour ressentir et transmettre Ca2 +-médiation de signalisation aux membranes de la cible. Systématiquement, les ANNEXINES sont capables d’induire la formation de microdomaines enrichis en cholestérol, phosphatidylinositol-4, 5-bisphosphate (PI (4,5) P2) et PS, aussi bien dans les systèmes de membrane cellulaire et/ou artificiel5. Ce protocole décrit une méthode pour analyser les interactions annexine-membrane à l’aide d’une Dissipation de Microbalance à cristal de Quartz (QCM-D)6,7,8.
L’élément de base dans cette microbalance est un cristal oscillant qui sert à la surface du capteur. L’adsorption et/ou de la liaison de molécules à la surface du capteur diminue la fréquence de résonance (f) proportionnelle à l’augmentation de masse. Si la surface est uniformément recouvert d’un film, la liaison des substances supplémentaires peut-être interférer avec l’intégrité structurale de cette couche, et ces changements de viscoélasticité (le facteur dissipation énergétique D) peuvent être en outre surveillés. Il s’agit d’une technique très répandue pour étudier l’interaction des protéines avec des bicouches lipidiques. Dans cette approche, des vésicules lipidiques sont absorbées sur la surface du capteur convenablement enduit. Formation de bicouche lipidique est favorable sur les matériaux à base de silice9,10, comme des vésicules rompent souvent pas sur d’autres surfaces hydrophiles, telles que l' or11 oxydé après exposition UV-ozone, TiO212ou Al 2O313. La rupture des vésicules coalescents libère la phase aqueuse, conduisant à des changements caractéristiques dans la masse et la dissipation. La génération de solid-prise en charge des bicouches (SLB) par la fusion des vésicules est simple et robuste et peut être utilisée pour générer des modèles complexes qui imitent les membranes cellulaires.
Microbalance à cristal de quartz dissipatif est une technique sensible et sans étiquette. Un avantage majeur est la possibilité de revêtir n’importe quel matériel qui génère une couche suffisamment mince sur la surface, offrant ainsi un large éventail d’applications dans divers domaines. L’interaction de protéine-membrane est observée en temps réel, et les résultats peuvent être analysés directement. La même surface de capteur peut être utilisée dans des mesures ultérieures (après avoir effectué un nettoyage minimal tel que décrit dans le présent protocole), ce qui permet des contrôles internes précises et une comparabilité entre les analytes.
Protocole
Remarque : Les tampons doivent être filtrées à l’aide d’un filtre de 0,22 µm et dégazé par un vide pendant 1 h.
1. préparation de vésicules lipidiques
- Utiliser des tubes de verre de 2 mL. Dissoudre chaque lipide, 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC), 1-palmitoyl-2-oléoyl-sn-glycéro-3-phosphocholine (POPC), 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (POP) et cholestérol (Chol), dans un mélange de chloroforme / méthanol (50/50 v/v) pour préparer une solution de lipides clair de 5 mM. Dissoudre 1,2-dioleoyl-sn-glycero-3-phospho-(1'-myo-inositol-4',5'-bisphosphate) (PI (4,5) P2) dans un mélange de chloroforme/méthanol/eau (20:9:1 v/v).
- Combiner les lipides dissous dans un rapport molaire désiré du POPC/pop (80/20), POPC/PI (4,5) P2 (95/5), POPC/pop/Chol (60/20/20), POPC/pop/PI (4,5) P2/Chol (20/17/3/60) et POPC/DOPC/pop/PI (4,5) P2() /Chol (37/20/20/3/20) Le tableau 1) dans des tubes de verre de 10 mL.
Remarque : Le montant final des lipides totaux est de 500 µg. - Faire évaporer les solvants organiques à l’aide d’un courant sec d’azote. Laissez le mélange de lipides sur un système de vide élevé (lyophilisation) pendant 3 h à enlever toutes les traces résiduelles des solvants.
Remarque : Cela se traduit par une pellicule sèche. - Resuspendre le film lipidique dans 1 mL de tampon citrate (10 mM-citrate trisodique, 150 mM NaCl, pH 4,6). Incuber la suspension de lipides à 60 ° C (cette température est autour de 10 ° C au-dessus de la température de transition de phase du lipide fusion plus élevé dans le mélange) pendant 30 min dans un bain d’eau et vortex il vigoureusement toutes les 5 min.
Remarque : Il en résulte la formation de grandes vésicules multilamellaires (VCP). Garder la suspension au-dessus de la température de transition. - Préchauffer l’extrudeuse (à 60 ° C dans le cas présent) équipé d’une membrane en polycarbonate pores de 50 nm de diamètre au-dessus de la température de transition (qui est ici à 40-50 ° C) pendant 30 min.
- Chargez la suspension MLV dans l’extrudeuse préchauffé et passer doucement le mélange 31 x à travers la membrane en polycarbonate pour former unilamellaires petites vésicules (VUS)14. Maintenez la température au-dessus de la température de transition.
- Transférer la suspension SUV dans un réacteur en plastique de 2 mL et ajouter le tampon citrate (Voir l’étape 1.4) pour porter le volume final à 2 mL.
Remarque : Ceci permettra d’obtenir une concentration finale de lipides de 250 µg/mL.
2. manipulation des capteurs à Quartz
NOTE : Toujours en charge les capteurs de quartz avec une pince.
- Incuber à quatre capteurs inséré dans un polytétrafluoroéthylène support dans une solution de SDS de 2 % pendant ≥ 30 min. Lavez les abondamment avec de l’eau ultra pure pour complètement supprimer le SDS et les laisser sécher à l’aide d’un jet d’argon sec ou de l’azote.
- Un système de nettoyage plasma permet de supprimer complètement tous les contaminants. Insérer les capteurs secs dans la chambre de nettoyage plasma, évacuer la chambre et rincez-la x 3 avec de l’oxygène. Allumer l’aspirateur sur le plasma. Utilisez les paramètres suivants : 1 x 10-4 Torr pression, puissance haute fréquence radio (RF) et 10 min de temps d’exécution. Mettre la machine hors tension et retirez les capteurs.
3. microbalance opération
NOTE : Un système de microbalance avec quatre chambres de flux de contrôle de la température dans une configuration parallèle, reliée à une pompe péristaltique et un débit de 80 µL/min, la valeur a été utilisé. Sous le mode ouvert, le tampon était pompé dans le réservoir d’alimentation dans le réservoir de réception. Dans le mode de boucle, le réservoir de réception a été connecté avec le réservoir d’alimentation pour générer une boucle fermée. La température est réglée à 20 ° C.
- Quai soigneusement les capteurs nettoyé à plasma dans les alvéoles de 4 flux, à l’aide de la pince à épiler. Éviter toute pression sur ou la torsion des chambres et des tubes qui pourraient causer des fuites.
- Rincer le système avec tampon citrate (10 mM-citrate trisodique, 150 mM NaCl, pH 4,6) en mode circuit ouvert pendant 10 min.
NOTE : Cela nécessite exactement 3,2 mL de tampon, mais il est conseillé d’utiliser un excès de tampon (10 mL). - Lancez le programme. Commencer à enregistrer toutes les modifications de la fréquence et de la dissipation de la première tonalité fondamentale (n = 1) et les harmoniques (n = 3-13) en utilisant le logiciel, jusqu'à ce que les lignes de base de fréquence et de la dissipation sont stables (cela prendra environ 40-60 min).
Remarque : Niveau de bruit de fréquence (crête à crête) doit être inférieure à 0,5 Hz et, la dissipation, inférieur à 0.1·10-6, avec une dérive maximale (en solution aqueuse) de 1 Hz/h en fréquence et 0.3·10/h-6dans la dissipation. - Lorsque les lignes de base sont stables, demander la suspension SUV en tampon citrate (2 mL dans un petit tube). Un réacteur, prélever 1,5 mL du volume mort. Puis fermez le système en mode boucle débit. Enregistrer le décalage de fréquence/dissipation pendant 10 minutes.
Remarque : Pendant ce temps, les vésicules seront étalé sur le support de2 SiO et fusionnent pour former une bicouche continue15,16 (étape 2 dans les Figures 1, Figure 2et Figure 3). L’adsorption de vus sur la surface du capteur est deux phases et a une fréquence typique minimale et maximale dans la dissipation. Une nouvelle base de fréquence/dissipation stables avec un décalage de fréquence caractéristique (en fonction de la composition des lipides) à partir de 26-29 Hz (voir tableau 1) indique une bicouche continue sur la surface. - Lorsque le SLB est stable (Voir l’étape 3.4), équilibrer le système avec le tampon en cours d’exécution (10 mM HEPES, 150 mM NaCl, pH 7,4) aux requis Ca2 + concentrations (allant de 50 µM à 1 mM CaCl2, selon l’expérience) en mode flux ouverts pour 40 min.
- Ajoutez la protéine (ici, AnxA2) pour le fonctionnement de la mémoire tampon contenant Ca2 + (Voir l’étape 3.5). Effectuer la demande de la protéine dans un mode de boucle débit jusqu'à ce qu’un équilibre stationnaire est atteint (étape 3 de la Figure 1, Figure 2et Figure 3).
Remarque : La concentration de protéine peut varier de 1 à 400 nM. Adsorption de protéines entraîne un décalage de fréquence de concentration-dépendante reflétant l’adsorption de masse (protéine). - Dissocier la protéine liée par chélation des ions Ca2 + avec 5 mM EGTA dans le tampon en cours d’exécution en mode flux libre (étape 4 Figures 1 et Figure 2).
Remarque : Une reprise de la fréquence et de la dissipation de la ligne de base SLB indique une réversibilité totale de liaison aux protéines. Association-dissociation cycles peuvent être répétées pour comparer différentes concentrations ou des protéines.
4. microbalance nettoyage
Remarque : Effectuer une procédure de nettoyage minimale après chaque mesure.
- Régénérer le système de microbalance avec 50 mL de ddH2O en mode ouvert en flux continu, sortir les tubes de la cuve d’eau et laisser le système fonctionner à sec.
- Soigneusement retirer le capteur de cristal et le nettoyer avec la solution de SDS de 2 % à l’aide de la titulaire de polytétrafluoroéthylène (reportez-vous à l’étape 2.1).
- Sécher les parties visibles de l’intérieur du module flux où la sonde a été placée.
Remarque : Effectuez la procédure de nettoyage après une série de 10 mesures intensives. - Nettoyer le système avec une solution de SDS 2 % (50 mL) à 40 ° C (programme d’installation du logiciel) en mode ouvert en flux continu (tube), en utilisant un débit de 20 µL/min pour un contact prolongé avec du détergent.
- Nettoyer avec 250 mL de ddH2O en mode continu de flux ouvert à un débit de 160 µL/min.
NOTE : Après 4 mois, effectuer une vaste procédure de nettoyage selon le manuel du constructeur.
Résultats
La diminution de la fréquence de résonance (Δf) est corrélée de façon linéaire avec la masse adsorbée (Δm), telle que définie par l’équation de Sauerbrey. 17
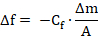
Ici, f est la fréquence de résonance, Cf est une constante qui dépend des caractéristiques géométriques et physiques de la quartz donnée et la fréquence de résonance, et A est la surface du capteur.
Dans la plupart des applications, la couche adsorbée n’est pas complètement rigide mais viscoélastique. L’amortissement résultant de l’oscillation de capteur de quartz est dénommé dissipation (D). La dissipation surveillée les changements (ΔD) sont en corrélation avec les propriétés viscoélastiques de la masse liée18 et sont définis comme suit8.
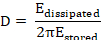
Ici, Edissipée est l’énergie perdue pendant une oscillation, et Estocké l’énergie totale du capteur oscillant librement.
Pour analyser et quantifier les paramètres de liaison, les isothermes de fréquence sont dérivés en traçant les changements de fréquence d’équilibre (ΔΔfe) contre les concentrations de protéine. ΔΔfe est défini comme

Ici, Δft1 représente le début de la protéine adsorption et Δft2 l’état d’équilibre. Ajustement de courbe non linéaire peut être effectuée à l’aide d’une expansion de la colline de l’équation de Langmuir comme suit6,8.
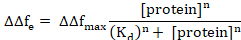
Ici, ΔΔfmax est ΔΔfe de la concentration de protéine résultant dans la liaison maximale (saturation), Kd est la constante de dissociation apparente de la protéine/membrane complexe et n est le coefficient de Hill.
Le coefficient de Hill (n) décrit la coopérativité de liaison. Pour n = 1, le modèle d’adsorption de Hill est une isotherme de Langmuir simple (les sites de liaison égale et toutes les molécules se lient indépendamment les uns des autres à la bicouche lipidique). Si n ≠ 1, un ligand lié modifie l’affinité pour les autres ligands de liaison à la membrane, soit augmenter (n > 1, coopérativité positive) ou diminuer (n < 1, coopérativité négative) l’affinité.
La figure 1 présente un schéma du flux de travail expérimental utilisé dans notre laboratoire pour mesurer les déplacements en résonance et en fréquence lors de Ca2 +-liaison dépendant et le rejet de AnxA2 dans la bicouche lipidique dans la phase liquide. Un enregistrement exemplaire est illustré à la Figure 2. Figure 2 A montre l’enregistrement de la courbe de fréquence et la Figure 2B montre les déplacements de dissipation. La diminution importante fréquence lors de l’addition des liposomes (Figure 2A [étape 1]) indique leur adsorption. Parce que les vésicules remplis de tampon ne sont pas rigides, mais viscoélastique, la dissipation augmente (Figure 2B [étape 1]). Par la suite, la rupture des vésicules coalescent. La sortie concomitante de la mémoire tampon à l’intérieur des vésicules diminue la masse adsorbée jusqu'à obtenir un plateau stable (Figure 2A [étape 2]). À noter l’ajout de vésicules entraîne un décalage de dissipation élevée, tandis que le passage en réponse à la bicouche est beaucoup plus petit en raison de la nature homogène rigide de la SLB (Figure 2B [étape 2]). Étape 3 dans les documents Figure 2 a et 2 b la liaison de la AnxA2 pour les lipides, ce qui ajoute de la masse, comme on le voit par le décalage de fréquence nette, mais n’interfère pas avec la structure bicouche, comme en témoigne le seul petit changement dans la dissipation. Quand Ca2 + est supprimé de l’agent chélateur EGTA (Figure 1 et Figure 2 [étape 4]), AnxA2 se dissocie du film lipidique. La fréquence, ainsi que les enregistrements de dissipation, passer aux niveaux observés avec la bicouche seulement (Comparez les étapes 2 et 4 dans la Figure 2 a et 2 b,), indiquant que la liaison AnxA2 est totalement dépendant de Ca2 + et que le film lipidique reste intacte.
AnxA2, comme le font plus de l’ANNEXINES, dépend des lipides chargés négativement comme Psaume Cela est visible quand la pop est absent dans la bicouche lipidique (Figure 3). Figure 3 A montre l’enregistrement de la courbe de fréquence etB de la Figure 3montre les déplacements de dissipation. Remarque que la fréquence passe à un niveau de référence stable à-25 Hz, pourtant la dissipation n’est pas modifiée (Figure 3B [étape 2]), l’indicatif d’une formation adéquate bicouche. Toutefois, aucun changement de fréquence (Figure 3A) ou de dissipation (Figure 3B) n’est observés après l’ajout de AnxA2 en présence de Ca2 + (Figure 3 a et 3 b [étape 3]) ou l’EGTA (Figure 3 a et 3 b [étape 4]), comme AnxA2 ne peut pas interagir avec le film lipidique.

Figure 1 : Modèle graphique du flux de travail expérimental. Ce flux de travail illustre l’absorption de vésicules à la surface de la sonde hydrophile (étape 1), la fusion de vésicules/rupture conduisant à la formation de SLB (étape 2) et le Ca2 +-dépendante adsorption (étape 3) et la désorption EGTA dépendant de AnxA2 (étape 4). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
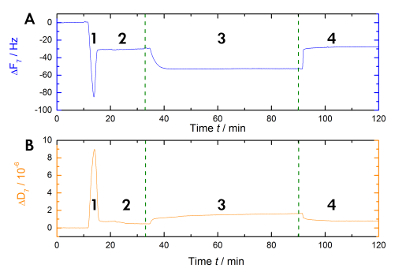
Figure 2 : Enregistrement exemplaire. Ces panneaux montrent (A) la surveillance dépendante du temps de la fréquence de résonance harmonique 7e et quarts de (B), la dissipation des capteurs quartz pendant la mesure. L’application des liposomes provoque une chute rapide dans la ligne de base de fréquence, alors que la ligne de base de dissipation augmente (étape 1). La stabilisation de la référence indique la formation de la bicouche (étape 2). Le AnxA2 (200 nM) adsorption (en présence de Ca2 +) sur la bicouche lipidique contenant des polluants organiques persistants ajoute masse sans modifier sensiblement la dissipation, indiquant que le film lipidique n’est pas perturbé (étape 3). La récupération de la base de fréquence sur Ca2 + chélation avec l’EGTA indique la désorption totale de la protéine (étape 4). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
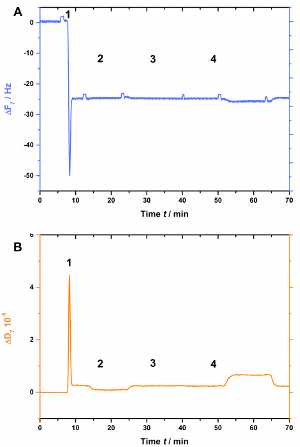
Figure 3 : Expérience de contrôle négatif, démontrant que AnxA2 ne soit pas lié à SLBs en l’absence de pop. Ces panneaux montrent l’ajout des liposomes et à la formation de SLB (étapes 1 et 2). Aucun changement dans la fréquence (A) ou (B) dissipation n’apparaissent après l’ajout de AnxA2 (étape 3 ; 200 nM, en présence de Ca2 +) ou EGTA (étape 4). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Composition | ΔΔF/Hz après formation de SLBs | ΔΔD * 10-6 après la formation du SLB |
| POPC/POP (80 : 20) | 26.3 ± 0,2 | 0,26 ± 0,03 |
| POPC/PI (4,5) P2 (95 : 5) | 26,5 ± 0,5 | 0,31 ± 0,02 |
| POPC/pop/Chol (60 : 20 : 20) | 29.2 ± 0,2 | 0,45 ± 0,09 |
| POPC/pop/PI (4,5) P2/Chol (60 : 17 : 03:20) | 29,6 ± 0,6 | 0,43 ± 0,10 |
| POPC/DOPC/pop/PI (4,5) P2/Chol (37 : 20 : 20 : 03:20) | 29,4 ± 0,4 | 0,39 ± 0,14 |
Tableau 1 : données composition et formation de lipides de la SLB 7 .
Discussion
Pour répondre aux questions concernant la relation structure-fonction des membranes cellulaires tant de manière quantitative et qualitative, bénéfices biologie cellulaire énormément de l’utilisation de méthodes biophysiques basé sur bien établis et largement utilisé des techniques , y compris atomique force microscopy (AFM), résonance plasmonique de surface (SPR), et la technique de QCM-D utilisée ici. Nous avons montré dans des études antérieures qui ANNEXINES protéines lient d’un Ca2 +-façon dépendante de la membrane immobilisée avec une haute affinité. Nous utilisons des fréquences et dissipation se déplace de la 7e harmonique (Δf7) parce que cela représente le meilleur compromis de stabilité de sensibilité et d’oscillation de détection.
Cette technique permet également une description quantitative de l’interaction de la protéine de la membrane. AnxA2 de liaison à la membrane est caractérisée par une coopération positive qui est véhiculée par le domaine de noyau annexin conservé et dépend de la présence de cholestérol. Les données quantitatives obtenues AnxA2 et AnxA8 sont déclarés en détaillent ailleurs6,8.
Il y a plusieurs étapes cruciales dans le présent protocole. Utilisez les liposomes immédiatement ; dans le cas contraire, petites vésicules peuvent fusionner en vésicules plus grandes avec moins de tension surface, conduisant à l’inhibition de la formation de bicouche lipidique. Maintenir une température constante pendant les mesures. Chaque petit écart de température entraîne un décalage de fréquence et de la dissipation non négligeable. Éviter les bulles d’air ; dans le cas contraire, le système est instable et n’établira pas une ligne de base.
L’équation de Sauerbrey permet la conversion directe de la fréquence observée se transforme en changements de masse et est donc largement utilisée. Cependant, l’hypothèse d’une corrélation linéaire entre le changement de fréquence de résonance et la masse ajoutée est seulement vrai pour composants formant une pellicule rigide et uniforme sur la surface du capteur. L’équation de Sauerbrey ne peut être utilisée pour viscoélastique adsorbants, tels que les films de protéine riche en eau, couches lipidiques d’eau incorporé, ou même adsorbé de cellules. Ici, les modèles mathématiques plus complexes sont nécessaires. Par conséquent, il est extrêmement important de contrôler simultanément les changements de fréquence et de la dissipation. Pour détecter les changements structurels au cours de la mesure, ΔD versus Δf ratios peuvent être tracées, avec une ligne droite n’indiquant aucun changement conformationnel.
Un avantage majeur de cette technique est la possibilité d’utiliser une très large gamme de matériaux comme substrats. C’est d’ailleurs une méthode fiable et directe d’étudier un large éventail d’interactions macromoléculaires, comme la formation adéquate des films revêtement (par exemple, SLB), ainsi que d’autres interactions de protéine-lipides, peut être surveillée en ligne.
Ce protocole peut être appliquée à d’autres protéines membranaires-interaction, par exemple, BAR domaine protéines19, l’ERM (ezrin, radixine et moésine) famille de protéines qui a un rôle important dans la membrane-cytosquelette linkage20,21 ,22, ou des protéines contenant des domaines C2 ou PH. En outre, un large éventail d’applications de cette technique pour étudier le matériel biologique a été avec succès publié, établissant ainsi QCM comme une plate-forme expérimentale bien adaptée pour étudier les interactions des assemblages macromoléculaires plus complexes ou même les cellules23,24.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Deutsche Forschungsgemeinschaft sous les subventions SFB 858/B04, EXC 1003, SFB 1348/A04 et SFB 1348/A11.
matériels
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Calciumchloride | Merck | 017-013-00-2 | 99% |
| Chloroform | Roth | 4432.1 | 99% |
| DOPC | Avanti | 850375P | |
| EGTA | PanReac AppliChem | A0878 | 99% |
| HEPES | PanReac AppliChem | A1069 | |
| Methanol | PanReac AppliChem | A3493 | |
| PiP2 | Avanti | 850155P | |
| POPC | Avanti | 850457P | |
| POPS | Avanti | 840034P | |
| Sodiumchloride | PanReac AppliChem | A1149 | |
| SDS | Roth | 183 | |
| Trisodium citrate | PanReac AppliChem | A3901 | |
| Equipment | |||
| Extruder Liposofast | Avestin | ||
| Qsense E4 Analyzer | Qsense | ||
| QSense Dfind | Qsense | ||
| Pump IPC 4 | Ismatec | ISM 930 | |
| QSX 303 SiO2 Silicon dioxide 50nm | Qsense | QSX 303 | |
| PC Membranes 0.05μm | Avanti polar lipids | 610003 | |
| OriginPro | OriginLab Corporation | Version 8 and 9 |
Références
- Simons, K., Toomre, D. Lipid rafts and signal transduction. Nature Reviews Molecular Cell Biology. 1 (1), 31-41 (2000).
- Gerke, V., Creutz, C. E., Moss, S. E. Annexins: linking Ca2+ signalling to membrane dynamics. Nature Reviews Molecular Cell Biology. 6, 449-461 (2005).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends in Biochemical Science. 37, 526-533 (2012).
- Rescher, U., Ruhe, D., Ludwig, C., Zobiack, N., Gerke, V. Annexin 2 is a phosphatidylinositol (4,5)-bisphosphate binding protein recruited to actin assembly sites at cellular membranes. Journal of Cell Science. 117, 3473-3480 (2004).
- Gerke, V., Moss, S. E. Annexins: from structure to function. Physiological Reviews. 82, 331-371 (2002).
- Heitzig, N., et al. Cooperative binding promotes demand-driven recruitment of AnxA8 to cholesterol-containing membranes. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1863 (4), 349-358 (2018).
- Drücker, P., Grill, D., Gerke, V., Galla, H. J. Formation and characterization of supported lipid bilayers containing phosphatidylinositol-4,5-biphosphate and cholesterol as functional surfaces. Langmuir. 30, 14877-14886 (2014).
- McConnell, H. M., Watts, T. H., Weis, M. R., Brian, A. A. Supported planar membranes in studies of cell-cell recognition in the immune system. Biochimica et Biophysica Acta - Reviews on Biomembranes. 864, 95-106 (1986).
- Anderson, T. H., et al. Formation of supported bilayers on silica substrates. Langmuir. 25, 6997-7005 (2009).
- Pfeiffer, L., Petronis, S., Koper, I., Kasemo, B., Zach, M. Vesicle adsorption and phospholipid bilayer formation on topographically and chemically nanostructured surfaces. Journal of Physical Chemistry B. 114, 4623-4631 (2010).
- Cho, N. J., Jackman, J. A., Liu, M., Frank, C. W. pH-Driven assembly of various supported lipid platforms: a comparative study on silicon oxide and titanium oxide. Langmuir. 27, 3739-3748 (2011).
- Jackman, J. A., Tabaei, S. R., Zhao, Z., Yorulmaz, S., Cho, N. J. Self-Assembly formation of lipid bilayer coatings on bare aluminium oxide: overcoming the force of interfacial water. ACS Applied Materials & Interfaces. 7, 959-968 (2015).
- Olson, F., Hunt, C. A., Szoka, F. C., Vail, W. J., Papahadjopoulos, D. Preparation of liposomes of defined size distribution by extrusion through polycarbonate membranes. Biochimica et Biophysica Acta(BBA) - Biomembranes. 557 (1), 9-23 (1979).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of lipid vesicle deposition on solid surfaces: a combined QCM-D and AFM study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik A Hadrons and Nuclei. 155 (2), 206-222 (1959).
- Rodahl, M., Höök, F., Krozer, A., Brzezinski, P., Kasemo, B. Quartz crystal microbalance setup for frequency and Q-factor measurements in gaseous and liquid environments. Review of Scientific Instruments. 66 (7), 3924-3930 (1995).
- Drücker, P., Pejic, M., Grill, D., Galla, H. J., Gerke, V. Cooperative binding of annexin A2 to cholesterol-and phosphatidylinositol-4, 5-bisphosphate-containing bilayers. Biophysical Journal. 107 (9), 2070-2081 (2014).
- Galic, M., et al. External push and internal pull forces recruit curvature-sensing N-BAR domain proteins to the plasma membrane. Nature Cell Biology. 14 (8), 874-881 (2012).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nature Reviews Molecular Cell Biology. 11 (4), 276-287 (2010).
- Braunger, J. A., Kramer, C., Morick, D., Steinem, C. Solid supported membranes doped with PIP2: influence of ionic strength and pH on bilayer formation and membrane organization. Langmuir. 29 (46), 14204-14213 (2013).
- Bianco, M., et al. Quartz crystal microbalance as cell-based biosensor to detect and study cytoskeletal alterations and dynamics. Biotechnology Journal. , 1700699(2018).
- Chen, J. Y., Penn, L. S., Xi, J. Quartz crystal microbalance: Sensing cell-substrate adhesion and beyond. Biosensors and Bioelectronics. 99, 593-602 (2018).
- Bragazzi, N. L., et al. Quartz-Crystal Microbalance (QCM) for Public Health: An Overview of Its Applications. Advances in Protein Chemistry and Structural Biology. Donev, R., et al. 101, Academic Press. 149-211 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon