Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Fabrication d’un Hydrogel de dérivés de matrice extracellulaire rein Cortex
Dans cet article
Résumé
Nous présentons ici un protocole pour fabriquer un rein cortex extracellulaire dérivé de matrice hydrogel pour conserver la composition biochimiques et structurales du rein natif de la matrice extracellulaire (MEC). Le processus de fabrication et ses applications sont décrites. Enfin, un point de vue sur l’utilisation de cet hydrogel pour soutenir la bioingénierie et la régénération cellulaire et tissulaire rénale spécifique est discutée.
Résumé
Matrice extracellulaire (ECM) fournit des indices biochimiques et biophysiques importants pour maintenir l’homéostasie tissulaire. Hydrogels synthétiques actuels offrent soutien mécanique robuste pour in vitro culture cellulaire, mais n’ont pas la composition protéique et ligand nécessaire pour provoquer un comportement physiologique des cellules. Ce manuscrit décrit une méthode de fabrication pour un rein cortex dérivés ECM hydrogel avec bonne robustesse mécanique et la composition biochimique favorable. L’hydrogel est fabriquée par mécaniquement l’homogénéisation et cortex DECELLULARISE rein humain ECM de solubilisation. La matrice conserve les rapports de protéine native rein cortex ECM tout en permettant aussi de gélification à des rigidités mécaniques physiologiques. L’hydrogel sert de substrat sur lequel rein cortex dérivées des cellules peuvent être maintenus dans des conditions physiologiques. En outre, la composition de l’hydrogel peut être manipulée pour modéliser un environnement malade qui permet l’étude future des maladies rénales.
Introduction
Matrice extracellulaire (ECM) fournit des indices biochimiques et biophysiques importants pour maintenir l’homéostasie tissulaire. La composition moléculaire complexe régit les propriétés structurales et fonctionnelles du tissu. Protéines structurales confèrent des cellules la conscience spatiale et permettent pour l’adhérence et la migration1. Ligands liés interagissent avec les récepteurs de surface cellulaire pour contrôler le comportement de cellule2. Rein ECM contient une multitude de molécules dont la composition et structure varie selon la localisation anatomique, stade de développement et maladie état3,4. Récapitulant la complexité de l’ECM est un élément clé dans l’étude des cellules rénales in vitro.
Les tentatives précédentes à reproduire des micro-environnements ECM ont porté sur decellularizing tissus ensemble pour créer des échafaudages capables de recellularization. DÉCELLULARISATION a été exécutée avec des détergents chimiques comme le dodécylsulfate de sodium (SDS) ou détergents non ioniques, et il utilise soit organe entier perfusion ou immersion et agitation méthodes5,6,7 ,8,9,10,11,12,13. Les échafaudages présentées ici préserver les indices biochimiques et structurales, trouvés dans les tissus natifs ECM ; en outre, recellularization avec les cellules de donneur spécifique a pertinence clinique en chirurgie reconstructive14,15,16,17,18, 19. Toutefois, ces échafaudages manquent de flexibilité structurelle et sont donc incompatibles avec de nombreux appareils actuelles utilisés pour des études in vitro . Pour contourner cette limitation, de nombreux groupes ont transformés DECELLULARISE ECM en hydrogels20,21,22,23,24. Ces hydrogels sont compatibles avec bioink et moulage par injection et contourner les contraintes spatiales d’échelle micromètre qui DECELLULARISE lieu d’échafaudages sur les cellules. En outre, composition moléculaire et ratios trouvés dans les natif CME sont conservés3,25. Nous démontrons une méthode pour fabriquer un hydrogel dérivé du cortex rénal ECM (kECM).
Ce protocole vise à produire un hydrogel qui réplique le microenvironnement de la région corticale du rein. Tissu de cortex rénal est DECELLULARISE dans une solution à 1 % SDS sous agitation constante pour enlever les matières cellulaires. SDS est couramment utilisé pour decellularize les tissus en raison de sa capacité à supprimer rapidement immunologique cellulaire matériau6,7,9,26. Le kECM est ensuite soumis à l’homogénéisation mécanique et lyophilisation5,6,9,11,26. Solubilisation dans un acide fort avec la pepsine se traduit par un hydrogel final solution mère20,27. Protéines kECM indigènes qui sont importants pour la structure support et signalent transduction sont conservés3,25. L’hydrogel peut également être gélifié à un ordre de grandeur du rein humain natif cortex28,29,30. Cette matrice fournit un environnement physiologique qui a été utilisé pour maintenir la quiescence des cellules de rein spécifiques par rapport aux hydrogels d’autres protéines de la matrice. En outre, composition de la matrice peut être manipulée, par exemple, grâce à l’ajout de collagène-je, aux milieux de maladie de modèle pour l’étude de la fibrose rénale et autres reins maladies31,32.
Access restricted. Please log in or start a trial to view this content.
Protocole
Reins humains ont été isolées du Nord-Ouest LifeCenter, suivant les directives éthiques fixés par l’Association des organisations de marchés orgue. Ce protocole suit animaux soins et cellule culture lignes directrices établies par l’Université de Washington.
1. préparation du tissu rénal humain
- Préparation de la solution de DÉCELLULARISATION
- Stériliser un bécher de 5000 mL et d’un bar de remuer de 70 x 10 mm.
- Mélanger 1/1000 (poids : volume) dodécylsulfate de sodium (SDS) dans l’eau désionisée autoclavé dans le bécher. Laisser la solution sur une plaque de remuer à environ 200 tr/min pendant 24 h ou jusqu'à ce que le SDS soit complètement dissout.
Remarque : En général, 2 500 mL de solution de SDS 1 % est suffisante pour decellularize un seul rein humain. - Transvaser la solution dans un filtre stérile sous vide de 500 mL et filtrer dans des contenants scellés stérilisés.
- Traitement du tissu rénal
- Laver et stériliser une paire de pinces, pince hémostatique deux pinces, une paire de ciseaux de qualité des services généraux, deux poignées de lame de bistouri Swann-Morton, un bécher de 1 000 mL, recouvert de papier d’aluminium et d’un bar de remuer de 36 x 9 mm.
- Ligne une hotte de culture tissulaire avec thibaude. Placer le bécher, un plat de vitroplants stérile (150 x 25 mm) et de l’organe rein entier dans la hotte. Remplir le bécher de 500 mL de solution de SDS de 1 %.
Remarque : Reins humains ont été reçus sur la glace du Nord-Ouest de LifeCenter. - Placer le rein dans le plat de vitroplants stérile (Figure 1 a). Enlevez toute la graisse périrénales en rasant légèrement autour de la capsule rénale avec un scalpel (Figure 1 b).
- Faire une incision peu profonde 8-10 cm avec le scalpel, juste assez profonde pour briser la capsule rénale sans endommager les tissus sous-jacents du cortex, à l’extrémité supérieure du rein. Retirer la capsule rénale par peeling il loin le tissu cortex avec deux colliers de serrage de pince hémostatique (Figure 1).
- Coupent les reins le long du plan coronal en utilisant le scalpel le long du côté latéral du rein (Figure 1). Isoler des tissus de cortex sur les deux moitiés de tailler la région médullaire avec le scalpel (Figure 1E) et couper en dés le tissu de cortex en morceaux de3 cm 0,5 (Figure 1F). Supprimer n’importe quel gros vaisseaux visibles.
- Isolement de la matrice extracellulaire
- Sous une hotte de culture tissulaire, remplir un bécher de 1 000 mL avec 500 mL de solution de SDS de 1 %. Placez la barre de tissu et remuez de cortex en dés dans le bécher contenant la solution SDS. Couvrir le bécher d’une feuille d’aluminium autoclavé et placez-le sur une plaque de remuer à environ 400 tr/min à l’extérieur de la hotte de la culture de tissus.
- Après que le tissu de cortex a été sur la plaque de remuer pendant 24 h, amener le bécher dans une hotte de culture de tissus et ajouter une crépine de cellules stériles de 40 µm faite d’un filet en nylon. Remplir un bécher distinct 1000 mL avec 200 mL d’eau de Javel et placez-le dans la hotte de la culture de tissus.
- Distribuer la solution SDS à travers le tamis cellulaire dans le bécher contenant l’eau de Javel. Pipetter tous la solution SDS jusqu'à ce que seulement le tissu DECELLULARISE et la crépine de la cellule restent dans le bécher.
Remarque : La crépine de la cellule devrait empêcher n’importe quel tissu de se détacher pendant l’aspiration de la solution. - Laissez la crépine de la cellule dans le gobelet et le remplir avec 500 mL d’une solution fraîche SDS. Couvrir le bécher avec la même feuille d’aluminium et placer sur une plaque de remuer à la même vitesse qu’avant.
- Répétez les étapes 1.3.1-1.3.3 toutes les 24 heures avec une solution fraîche SDS pour un total de cinq jours.
- Rincer le tissu DECELLULARISE avec autoclave DI l’eau toutes les 24 h pour total de 3 jours, suivant la technique décrite dans les étapes 1.3.1-1.3.3.
- TISSU DECELLULARISE rinçage avec l’eau de qualité de culture cellulaire toutes les 24 h pour 2 jours au total, selon la technique décrite dans étapes 1.3.1-1.3.3.
- Répétez les étapes 1.3.1-1.3.2. Transférer le tissu DECELLULARISE (dénommé kECM de ce point sur) dans un 30 mL autoportante tube à fond conique et remplissez-le d’eau de qualité de culture cellulaire jusqu'à ce que tous les tissus sont immergé.
2. fabrication de Solution-mère d’Hydrogel
- Traitement mécanique du tissu DECELLULARISE
- Sous une hotte de culture tissulaire, mécaniquement homogénéiser le kECM dans le tube à fond conique avec un homogénéisateur de tissu pendant 2 min.
Remarque : KECM homogénéisé doit ressembler à une solution opaque avec aucune pièce visible d’ECM. - Immerger le tube conique contenant le kECM dans l’azote liquide jusqu'à ébullition entourant le tube n’est plus persiste. Stocker le kECM à-4 ° c durant la nuit.
- Sous une hotte de culture tissulaire, mécaniquement homogénéiser le kECM dans le tube à fond conique avec un homogénéisateur de tissu pendant 2 min.
- Lyophilisation des gelées de tissu DECELLULARISE
- Desserrer légèrement le bouchon du tube à fond conique pour permettre l’échange de gaz et placer le tube dans une machine de lyophilisation. Lyophiliser le kECM pendant trois jours, ou jusqu'à ce qu’elle ressemble à une fine poudre blanche. Magasin à-4 ° c.
- Solubilisation de gel et de la digestion chimique
- Autoclave un flacon de 20 mL à scintillation et cap, un bar de remuer 15,9 x 7,9 mm et une paire de pinces de fine pointe.
- Peser le kECM lyophilisée et calculer le volume de HCl et de la masse de pepsine nécessaire à solubiliser le kECM à une solution à 3 % (30 mg/mL) en utilisant les équations suivantes, où lapepsine de m est la masse de la pepsine, mtissu est la masse de tissu lyophilisé et VHCl est le volume de 0,01 N HCl :
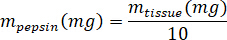
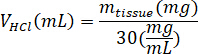
- Sous une hotte de culture de tissus, s’ajoute la pepsine gastrique porcine, 0,01 N HCl et la barre de remuer le flacon à scintillation et laissez-le dans une assiette mélanger à environ 500 tr/min, jusqu'à ce que toute la pepsine a dissous. Transférer le kECM lyophilisé dans le flacon à scintillation et laisser la solution sur une plaque de remuer à environ 500 tr/min pendant trois jours.
3. Hydrogel gélification
- Préparation d’hydrogel rein ECM
- L’hydrogel de gel en mélangeant la solution kECM hydrogel avec NaOH N 1, 10 x Media supplément (M199) et les milieux de culture de cellules. Garder toutes les solutions sur la glace.
Remarque : Gel définitif des concentrations de 7,5 mg/mL ont été utilisées pour la culture cellulaire. 1 mL de gel kECM suffisait pour les expériences de culture cellulaire présentés. - Déterminer le volume de gel kECM réalisable produit et le volume d’hydrogel kECM stock nécessaire à l’aide de l’équation suivante, où Vfinal est le volume de gel créé, Vstock kECM est le volume d’hydrogel kECM stock nécessaire, CkECM stock est la concentration de l’hydrogel kECM stock et Cfinal est la concentration du gel définitif :
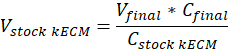
- Déterminer le volume de neutraliser les réactifs utilisés en utilisant les équations suivantes, où VNaOH est le volume de NaOH N 1, V10 X est le volume de M199 s’ajoutent 10 médias de X et V1 X est la volume de milieux de culture cellulaire :
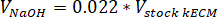
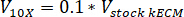
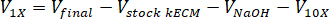
- Sous une hotte de culture tissulaire, Pipetter les réactifs neutralisants (NaOH, M199 et milieux de culture cellulaire) dans un 30 mL stérile autoportante tube à fond conique. Mélanger la solution de réactif neutralisant avec une microspatula.
- Utiliser une seringue stérile 1 mL pour transférer le volume approprié de stock kECM hydrogel à la solution de réactif neutralisant. Utiliser un microspatula pour mélanger doucement la solution jusqu'à l’obtention d’une homogène en solution d’hydrogel de couleur.
Remarque : Éviter l’introduction de bulles d’air en remuant délicatement. - Pour intégrer les cellules dans l’hydrogel kECM, soustraire les calculs de volume de solution neutralisante en étape 3.1.1.3 10 µL de milieux de culture cellulaire (V,1 X).
- Suspendre les cellules dans 10 µL de milieux de culture cellulaire. Déterminer le nombre de cellules ne s’appliquera pas à l’aide de l’équation suivante, où #cellules indique le nombre de cellules à suspendre et Vfinal est le volume de gel créé :
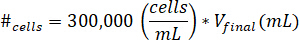
Remarque : 300 000 cellules/mL est la concentration de cellules utilisées dans le gel kECM. - Pipeter le 10 µL de solution de cellule suspendu dans le gel kECM final après que la solution kECM a été mélangée avec la solution de réactif de neutralisation. Agiter la solution avec un microspatula jusqu'à ce que les cellules sont réparties uniformément.
- Suspendre les cellules dans 10 µL de milieux de culture cellulaire. Déterminer le nombre de cellules ne s’appliquera pas à l’aide de l’équation suivante, où #cellules indique le nombre de cellules à suspendre et Vfinal est le volume de gel créé :
- L’hydrogel de gel en mélangeant la solution kECM hydrogel avec NaOH N 1, 10 x Media supplément (M199) et les milieux de culture de cellules. Garder toutes les solutions sur la glace.
- Utiliser une seringue de 1 mL pour remplir un dispositif de culture de cellule désirée avec l’hydrogel kECM.
- Laisser le gel à fixé à 37 ° c pendant 1 h avant de transférer ou d’électrodéposition de cellules.
Access restricted. Please log in or start a trial to view this content.
Résultats
L’hydrogel kECM fournit une matrice pour culture de cellules de rein avec une composition chimique similaire comme le microenvironnement rein natif. Pour fabriquer l’hydrogel, tissu de cortex rénal est mécaniquement isolé d’un organe rein entier et coupé en dés (Figure 1). DÉCELLULARISATION avec un détergent chimique (Figure 2 a.1-A.3) suivie de rinçages à l’eau pour enlever les particules de dé...
Access restricted. Please log in or start a trial to view this content.
Discussion
Matrices fournissent des signaux mécaniques et chimiques importantes qui régissent le comportement de la cellule. Hydrogels synthétiques sont capables de soutenir la structuration 3-dimensional complexe mais ne parviennent pas à fournir les divers signaux extracellulaires dans des micro-environnements matrice physiologique. Hydrogels dérivés ECM natif sont des matériaux idéaux pour les études aussi bien in vivo et in vitro . Des études antérieures ont utilisé DECELLULARISE ECM hydrogels pour...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à souligner la Lynn et Mike Garvey Imaging de laboratoire à l’Institut des cellules souches et médecine régénérative et LifeCenter du Nord-Ouest. Ils aimerait également remercier le soutien financier de subventions National Institutes of Health, TR000504 UH2/UH3 (à J.H.) et DP2DK102258 (à Y.Z.), NIH T32 formation grant DK0007467 (pour R.J.N.) et un don sans restriction par les centres de rein du Nord-Ouest à la Institut de recherche de rein.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Preparation of Kidney Tissue | |||
| 5000 mL Beaker | Sigma-Aldrich | Z740589 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma-Aldrich | 436143 | |
| Sterile H2O | Autoclaved DI H2O | ||
| Stir Bar (70 x 10 mm) | Fisher Science | 14-512-128 | |
| 500 mL Vacuum Filter | VWR | 97066-202 | |
| Stir Plate | Sigma-Aldrich | CLS6795420D | |
| 1000 mL Beaker | Sigma-Aldrich | CLS10031L | |
| Forceps | Sigma-Aldrich | F4642 | Any similar forceps may be used |
| Scissor-Handle Hemostat Clamp | Sigma-Aldrich | Z168866 | |
| Dissecting Scissors | Sigma-Aldrich | Z265977 | |
| Scalpel Handle, No. 4 | VWR | 25859-000 | Any similar scalpel handle may be used |
| Scalpel Blade, No. 20 | VWR | 25860-020 | Any similar scalpel blade may be used |
| Stir Bar (38.1 x 9.5 mm) | Fisher Science | 14-513-52 | |
| Absorbent Underpad | VWR | 82020-845 | |
| Petri Dish (150 x 25 mm) | Corning | 430597 | |
| Autoclavable Biohazard Bag | VWR | 14220-026 | |
| Sterile Cell Strainer (40 um) | Fisher Science | 22-363-547 | |
| Cell Culture Grade Water | HyClone | SH30529.03 | |
| 30 mL Freestanding Tube | VWR | 89012-778 | |
| Fabrication of ECM Gel | |||
| Tissue Homogenizer Machine | Polytron | PCU-20110 | |
| Freeze Dryer | Labconco | 7670520 | |
| 20 mL Glass Scintillation Vials and Cap | Sigma-Aldrich | V7130 | |
| Stir Bar (15.9 x 8 mm) | Fisher Science | 14-513-62 | |
| Pepsin from Porcine Gastric Mucosa | Sigma-Aldrich | P7012 | |
| 0.01 N HCl | Sigma-Aldrich | 320331 | Dilute to 0.01 N HCl with cell culuture water |
| Kidney ECM Gelation | |||
| 1 N NaOH (Sterile) | Sigma-Aldrich | 415413 | Dilute to 1 N in cell culture grade water |
| Medium 199 | Sigma-Aldrich | M4530 | |
| 15 mL Conical Tube | ThermoFisher | 339651 | |
| Cell Culture Media | ThermoFisher | 11330.032 | Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12) |
| Fetal Bovine Serum (FBS) | Gibco | 10082147 | |
| Antibiotic-Antimycotic 100X | Life Technologies | 15240-062 | |
| Insulin, Transferrin, Selenium, Sodium Pyruvate Solution (ITS-A) 100X | Life Technologies | 51300-044 | |
| 1 mL Syringe | Sigma-Aldrich | Z192325 | |
| Microspatula | Sigma-Aldrich | Z193208 |
Références
- Lelongt, B., Ronco, P. Role of extracellular matrix in kidney development and repair. Pediatric Nephrology. 18 (8), 731-742 (2003).
- Yue, B. Biology of the Extracellular Matrix: An Overview. Journal of Glaucoma. 23, S20-S23 (2014).
- Miner, J. H. Renal basement membrane components. Kidney International. 56 (6), 2016-2024 (1999).
- Petrosyan, A., et al. Decellularized Renal Matrix and Regenerative Medicine of the Kidney: A Different Point of View. Tissue Engineering Part B. 22 (3), 183-192 (2016).
- Caralt, M., et al. Optimization and Critical Evaluation of Decellularization Strategies to Develop Renal Extracellular Matrix Scaffolds as Biological Templates for Organ Engineering and Transplantation. American Journal of Transplantation. 15 (1), 64-75 (2015).
- Nakayama, K. H., Batchelder, C. A., Lee, C. I., Tarantal, A. F. Decellularized rhesus monkey kidney as a three-dimensional scaffold for renal tissue engineering. Tissue Engineering Part A. 16 (7), 2207-2216 (2010).
- Nakayama, K. H., Lee, C. C. I., Batchelder, C. A., Tarantal, A. F. Tissue Specificity of Decellularized Rhesus Monkey Kidney and Lung Scaffolds. Public Library of Science ONE. 8 (5), (2013).
- Orlando, G., et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations. Annals of Surgery. 256 (2), 363-370 (2012).
- Sullivan, D. C., et al. Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials. 33 (31), 7756-7764 (2012).
- Choi, S. H., et al. Development of a porcine renal extracellular matrix scaffold as a platform for kidney regeneration. Journal of Biomedical Materials Research Part A. 103 (4), 1391-1403 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
- Nagao, R. J., et al. Decellularized Human Kidney Cortex Hydrogels Enhance Kidney Microvascular Endothelial Cell Maturation and Quiescence. Tissue Engineering Part A. 22 (19-20), 1140-1150 (2016).
- Gupta, S. K., Mishra, N. C., Dhasmana, A. Decellularization Methods for Scaffold Fabrication. Methods in Molecular Biology. , 1-10 (2017).
- Hudson, T., et al. Optimized Acellular Nerve Graft is Immunologically Tolerated and Supports Regeneration. Tissue Engineering. 10 (11), 1641-1651 (2004).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367 (9518), 1241-1246 (2006).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B., et al. Organ reengineering through development of a transplantable recellularied liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Nagao, R. J., et al. Preservation of Capillary-beds in Rat Lung Tissue Using Optimized Chemical Decellularization. Journal of Materials Chemistry B. 1 (37), 4801-4808 (2013).
- Song, J. J., et al. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Medicine. 19 (5), 646-651 (2013).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29 (11), 1630-1637 (2008).
- Wolf, M. T., et al. A hydrogel derived from decellularized dermal extracellular matrix. Biomaterials. 33 (29), 7028-7038 (2012).
- Fisher, M. B., et al. Potential of healing a transected anterior cruciate ligament with genetically modified extracellular matrix bioscaffolds in a goat model. Knee Surgery, Sports Traumatology, Arthroscopy. 20 (7), 1357-1365 (2012).
- Ghuman, H., et al. ECM hydrogel for the treatment of stroke: Characterization of the host cell infiltrate. Biomaterials. 91, 166-181 (2016).
- Rijal, G. The decellularized extracellular matrix in regenerative medicine. Regenerative Medicine. 12 (5), 475-477 (2017).
- Lennon, R., et al. Global Analysis Reveals the Complexity of the Human Glomerular Extracellular Matrix. Journal of the American Society of Nephrology. 25 (5), 939-951 (2014).
- Bonandrini, B., et al. Recellularization of Well-Preserved Acellular Kidney Scaffold Using Embryonic Stem Cells. Tissue Engineering Part A. 20 (9-10), 1486-1498 (2014).
- O'Neill, J. D., Freytes, D. O., Anandappa, A. J., Oliver, J. A., Vunjak-Novakovic, G. V. The regulation of growth and metabolism of kidney stem cells with regional specificity using extracellular matrix derived from kidney. Biomaterials. 34 (38), 9830-9841 (2013).
- Streitberger, K. -J., et al. High-resolution mechanical imaging of the kidney. Journal of Biomechanics. 47 (3), 639-644 (2014).
- Bensamoun, S. F., et al. Stiffness imaging of the kidney and adjacent abdominal tissues measured simultaneously using magnetic resonance elastography. Clinical Imaging. 35 (4), 284-287 (2011).
- Moon, S. K., et al. Quantification of Kidney Fibrosis Using Ultrasonic Shear Wave Elastography. Journal of Ultrasound in Medicine. 34, 869-877 (2015).
- Genovese, F., Manresa, A. A., Leeming, D. J., Karsdal, M. A., Boor, P. The extracellular matrix in the kidney: a source of novel non-invasive biomarkers of kidney fibrosis? Fibrogenesis & Tissue Repair. 7 (1), (2014).
- Hewitson, T. D. Fibrosis in the kidney: is a problem shared a problem halved? Fibrogenes & Tissue Repair. 5 (1), S14(2012).
- Wolf, M. T., et al. Polypropylene surgical mesh coated with extracellular matrix mitigates the host foreign body response. Journal of Biomedical Materials Research Part A. 102 (1), 234-246 (2014).
- Faulk, D. M., et al. ECM hydrogel coating mitigates the chronic inflammatory response to polypropylene mesh. Biomaterials. 35 (30), 8585-8595 (2014).
- Jeffords, M. E., Wu, J., Shah, M., Hong, Y., Zhang, G. Tailoring Material Properties of Cardiac Matrix Hydrogels To Induce Endothelial Differentiation of Human Mesenchymal Stem Cells. ACS Applied Materials & Interfaces. 7 (20), 11053-11061 (2015).
- Kim, M. -S., et al. Differential Expression of Extracellular Matrix and Adhesion Molecules in Fetal-Origin Amniotic Epithelial Cells of Preeclamptic Pregnancy. Public Library of Science ONE. 11 (5), e0156038(2016).
- Paduano, F., Marrelli, M., White, L. J., Shakesheff, K. M., Tatullo, M. Odontogenic Differentiation of Human Dental Pulp Stem Cells on Hydrogel Scaffolds Derived from Decellularized Bone Extracellular Matrix and Collagen Type I. Public Library of Science ONE. 11 (2), e0148225(2016).
- Viswanath, A., et al. Extracellular matrix-derived hydrogels for dental stem cell delivery. Journal of Biomedical Materials Research Part A. 105 (1), 319-328 (2017).
- Uriel, S., et al. Extraction and Assembly of Tissue-Derived Gels for Cell Culture and Tissue Engineering. Tissue Engineering Part C Methods. 15 (3), 309-321 (2009).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissues: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Faust, A., et al. Urinary bladder extracellular matrix hydrogels and matrix-bound vesicles differentially regulate central nervous system neuron viability and axon growth and branching. Journal of Biomaterials Applications. 31 (9), 1277-1295 (2017).
- Pouliot, R. A., et al. Development and characterization of a naturally derived lung extracellular matrix hydrogel. Journal of Biomedical Materials Research Part A. 104 (8), 1922-1935 (2016).
- Pati, F., et al. Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink. Nature Communications. 5, 3935(2014).
- Pati, F., et al. Biomimetic 3D tissue printing for soft tissue regeneration. Biomaterials. 62, 164-175 (2015).
- Wang, R. M., Christman, K. L. Decellularized myocardial matrix hydrogels: In basic research and preclinical studies. Advanced Drug Delivery Reviews. 96, 77-82 (2016).
- Jang, J., et al. 3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair. Biomaterials. 112, 264-274 (2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (Pt 24), 4195-4200 (2010).
- Mouw, J. K., Ou, G., Weaver, V. M. Extracellular matrix assembly: a multiscale deconstruction. Nature Reviews Molecular Cell Biology. 15 (12), 771-785 (2014).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Hinderer, S., Layland, S. L., Schenke-Layland, K. ECM and ECM-like materials - Biomaterials for applications in regenerative medicine and cancer therapy. Advanced Drug Delivery Reviews. 97, 260-269 (2016).
- Uriel, S., et al. The role of adipose protein derived hydrogels in adipogenesis. Biomaterials. 29 (27), 3712-3719 (2008).
- Singelyn, J. M., et al. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30 (29), 5409-5416 (2009).
- Medberry, C. J., et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials. 34 (4), 1033-1040 (2013).
- Loneker, A. E., Faulk, D. M., Hussey, G. S., D'Amore, A., Badylak, S. F. Solubilized liver extracellular matrix maintains primary rat hepatocyte phenotype in-vitro. Journal of Biomedical Materials Research Part A. 104 (4), 957-965 (2016).
- Hill, R. C., Calle, E. A., Dzieciatkowska, M., Niklason, L. E., Hansen, K. C. Quantification of extracellular matrix proteins from a rat lung scaffold to provide a molecular readout for tissue engineering. Molecular & Cellular Proteomics. 14 (4), 961-973 (2015).
- Li, Q., et al. Proteomic analysis of naturally-sourced biological scaffolds. Biomaterials. 75, 37-46 (2016).
- Tanaka, T., Yada, R. Y. N-terminal portion acts as an initiator of the inactivation of pepsin at neutral pH. Protein Engineering. 14 (9), 669-674 (2001).
- Ligresti, G., et al. A Novel Three-Dimensional Human Peritubular Microvascular System. Journal of the American Society of Nephrology. 27 (8), 2370-2381 (2016).
- Mozes, M. M., Böttinger, E. P., Jacot, T. A., Kopp, J. B. Renal expression of fibrotic matrix proteins and of transforming growth factor-beta (TGF-beta) isoforms in TGF-beta transgenic mice. Journal of the American Society of Nephrology. 10 (2), 271-280 (1999).
- Romanowicz, L., Galewska, Z. Extracellular matrix remodeling of the umbilical cord in pre-eclampsia as a risk factor for fetal hypertension. Journal of Pregnancy. 2011, 542695(2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon