Method Article
Un modèle de lymphome de B-cellule souris syngénique pour évaluation préclinique des cellules de T de voiture CD19
Dans cet article
Résumé
Nous présentons ici un protocole pour la production et les essais précliniques de cellules de T de voiture CD19 murines par transduction rétrovirale et utilisation comme thérapie contre établie syngénique A20 lymphome B chez la souris BALB/c avec ou sans LYMPHODÉPLÉTEUR pré conditionnement.
Résumé
L’étonnant succès clinique de thérapie de T-cell receptor (voiture) CD19 antigène chimérique a mené à l’approbation des récepteurs d’antigènes chimérique de deux seconde génération (RAC) pour les lymphomes de leucémie lymphoblastique aiguë (LLA) et-hodgkiniens (LNH). L’objectif du champ est désormais sur l’émulation de ces succès dans d’autres malignités hématologiques où on observe des taux de réponse complète moins impressionnants. Ingénierie de plus de cellules de T de voiture ou de l’administration concomitante d’autres modalités de traitement peut avec succès surmonter les obstacles à une thérapie réussie dans d’autres contextes de cancer.
Par conséquent, nous présentons un modèle dans lequel d’autres peuvent mener des essais précliniques de cellules CD19 voiture T. Résultats dans ce modèle de lymphome de B-cellule bien testé sont susceptibles d’être informative thérapie de lymphocytes-T de voiture en général.
Ce protocole permet la production reproductible de souris les cellules de T de voiture par le biais de phosphate de calcium transfection des cellules de producteur de Plat-E avec MP71 constructions rétrovirales et plasmide d’emballage pCL-Eco suivie de collecte des particules rétrovirales sécrétées et transduction par centrifugation et fragment de fibronectine humaine recombinante. Validation de transduction rétrovirale et la confirmation de la capacité des cellules de T de voiture pour tuer cible lymphome des cellules ex vivo, grâce à l’utilisation de la cytométrie en flux, luminometry et immuno-assay (ELISA), est également décrite.
Protocoles d’essai voiture T cells in vivo dans lymphoreplete et souris syngénique lymphodepleted, portant des lymphomes établie, systémiques sont décrites. Une activité anticancéreuse est surveillée par in vivo bioluminescence et maladie la progression. Nous montrons les résultats typiques de l’éradication de lymphome à cellules B établie lors de l’utilisation de 1er ou 2ème génération voitures en combinaison avec LYMPHODÉPLÉTEUR le préconditionnement et une minorité de souris atteinte des rémissions à long terme lors de l’utilisation de voiture T cellules exprimant IL-12 chez la souris lymphoreplete.
Ces protocoles peuvent être utilisés pour évaluer des cellules de T de voiture CD19 avec différente modification supplémentaire, combinaisons de cellules de T de voiture et d’autres agents thérapeutiques ou adaptés pour l’utilisation de cellules de T de voiture contre des antigènes cibles différents.
Introduction
Thérapie de T-cell receptor (voiture) antigène chimérique a montré étonnant succès clinique dans le traitement du CD19+ malignes menant à l’approbation du tisagenlecleucel pour les cas de rechute de leucémie lymphoblastique aiguë1 et axicabtagene ciloleucel pour progressive grand B-cellule lymphomes non hodgkiniens2 en 2017.
L’importance des Interactions entre le cancer et le système immunitaire en progression de la maladie et les mécanismes thérapeutiques devient de plus en plus reconnu3,4,5. Par exemple, il est bien documenté que le microenvironnement tumoral (TME) est inondé avec les facteurs qui peuvent supprimer les fonctions effectrices des cellules immunitaires6,7,8. Amorçage de cellules immunitaires endogènes et épitopes peut également être une clé dans l’éradication de la tumeur et la résistance à long terme de tumeur défi9,10. Deux de ces phénomènes ne peuvent être évaluées dans les modèles xénogéniques qui n’ont pas un système immunitaire. De même, les systèmes utilisant des protéines transgéniques ne reflètent pas exactement le défi de la rupture de tolérance immunitaire qui est requise pour des épitopes,11,12. Un modèle syngénique dont le système immunitaire entièrement fonctionnel est donc primordial pour la modélisation de ces aspects importants des traitements de progression et immunitaire de la maladie du cancer.
Une importante mise en garde de la thérapie de lymphocytes-T de voiture est que LYMPHODÉPLÉTEUR conditionnement préalable est nécessaire pour le succès thérapeutique13,14. Ceci est généralement réalisé chez des patients par l’administration d’une chimiothérapie avant la perfusion de cellules de T de voiture15,16. Comme une méthode standard, afin d’imiter les lymphodepletion utilisée dans le cadre de patients, nous administrons 5 irradiation corporelle totale de Gy (TBI) pour atteindre lymphodepletion avant l’administration de cellules de T de voiture thérapeutiques à des souris portant le lymphome à cellules B A20 systémique.
Alors que LYMPHODÉPLÉTEUR conditionnement préalable n’est pas un problème pour la majorité des patients, toxicité qui vient avec des agents chimiothérapeutiques signifie que les patients de faible ne sont pas éligibles à un traitement voiture T-cell. Pour créer un système de test qui représente les patients non éligibles pour lymphodepletion, nous avons établi un modèle de souris syngénique lymphoreplete dans lequel nous modélisons la thérapie voiture T-cellules de lymphome. Dans ce modèle, nous avons montré que la sécrétion d’IL-12 au sein de cellules de T de voiture pourrait conduire à l’éradication du lymphome établie avec un taux de réussite de ~ 25 %17. En outre, nous avons montré que les cellules immunitaires endogènes étaient impliqués dans l’éradication du cancer.
Ici nous décrivons en détail le protocole pour la production des cellules de souris de voiture T, établissant des lymphomes chez la souris syngéniques et traitement du lymphome à cellules T de voiture avec ou sans l’utilisation de LYMPHODÉPLÉTEUR le préconditionnement. Ceci peut être utilisé pour l’étude de la combinaison de cellules de T de voiture avec d’autres agents, tests de cellules de T de voiture avec autres transgènes ou d’utiliser d’autres stratégies de thérapie ou d’immunothérapie adoptive cellulaire contre le lymphome.
Protocole
Toutes les expériences sur des animaux ont été menées sous les auspices de la Loi de 1986 sur les animaux (procédures scientifiques) et sous le Comité de coordination UK pour les orientations de la recherche sur le Cancer. Toutes les études sur des animaux ont été menées à l’Institut CRUK-Manchester et approuvés par le bien-être des animaux locaux et l’évaluation éthique de corps (CRUK-MI AWERB).
1. les préparatifs
- PMP71 Maxiprep retroviral construire plasmide et pCL-Eco rétrovirus emballage plasmides18.
Remarque : pMP71 code mCherry et la voiture, séparés par une séquence de FMDV2A. C’est interchangeable avec les autres constructions rétrovirales. pCL-Eco encode gag, pol et les protéines d’enveloppe ecotropic. - Préparer des lymphocytes T complet moyenne (TCM) pour la culture des cellules de souris T utilisant le milieu RPMI 1640, FCS de 10 %, 1 % 100 x pénicilline-streptomycine-glutamine (PSG).
Remarque : La solution contient 100 UI/mL de pénicilline, 100 µg/mL de streptomycine et 2 mM de L-glutamine), 50 μM β-mercaptoéthanol et l’acide-(2-hydroxyethyl)-1-piperazineethanesulfonic 25 mM 4 (HEPES). - Culture de cellules A20 RPMI 1640, 10 % FCS et 0,05 mM β-mercaptoéthanol à 37 ° C, 5 % de CO2.
- La culture des cellules de platine-E (Plat-E) dans un milieu eagle mis à jour le complet de Dulbecco (DMEM) (DMEM avec du sérum de veau foetal 10 % (FCS), 2 mM de L-glutamine, 1 puromycine μg/mL et 10 μg/mL blasticidine) à 37 ° C, 5 % CO2.
Remarque : Plat-E cellules proviennent de cellules 293 t et expriment gag, pol et ecotropic protéines rétrovirales de l’enveloppe. - Préparer la transfection des solutions médias 1et 2 immédiatement avant la transfection. Préparer la solution 1 (pH 7,9) pour contenir DMEM + 10 % FCS + 25 mM HEPES, solution 2 (pH 7,1) pour contenir DMEM + 25 mM HEPES.
- Préparer 10 μg/mL de solution de fragment fibronectine humaine recombinante en diluant avec stérile solution saline tamponnée au phosphate (PBS) et conserver à-20 ° C jusqu'à l’utilisation.
- STERILE filtrer sur tous les médias 0,2 μm filtres avant utilisation (à l’exclusion des fragment de fibronectine humaine recombinante).
2. retroviral Transduction des lymphocytes T
- Jour 1 : Préparation pour la transfection
- Graine 7,5 x 106 Platinum-E (Plat-E) des cellules dans les plats de vitroplants de2 de 15 cm à 18 mL de DMEM complet et incuber une nuit à 37 ° C, 5 % de CO2.
- Jour 2 : Transfection de lignée de cellules de rétroviraux emballage Plat-E
- Préparer les 20,4 μg du vecteur d’emballage pcl-Eco ADN, 39,6 μg d’ADN de plasmide codant retroviral construction de voiture et 150 μL de 1 M CaCl2 , pour un volume final de 3 mL de solution 2 transfection par plat de 15 cm2 à transfecter. Vortexer pendant 10 s et reste pendant 5 min
- Enlevez DMEM média les plats2 de 15 cm et remplacer avec 12 mL de solution de transfection 1.
Mise en garde Lorsque vous modifiez les médias, les plats de2 cm 15 peuvent sécher au centre. Ceci peut causer la mort substantielle de cellules transfectées de Plat-E. Travailler rapidement et retirer des médias de juste 1-2 plaques à la fois. - Ajouter 3 mL de solution de transfection 2 contenant de l’ADN et CaCl2 à chaque plat de2 cm 15 goutte-à-goutte, uniformément sur chaque plaque. Balançant doucement les plaques avec un mouvement de gauche à droite pour 10 s. Incuber à 37 ° C, 5 % CO2 pendant la nuit.
- Jour 3 : Préparation contenant virus du surnageant pour la transduction
- Remplacer les médias des cellules transfectées de plaque-E avec 18 mL remplir TCM et retournent à l’incubateur.
Mise en garde Quand changer les plats de2 cm 15 médias peut sécher au centre. Ceci peut causer la mort substantielle de cellules transfectées de Plat-E. Travailler rapidement et retirer des médias de juste 1-2 plaques à la fois.
- Remplacer les médias des cellules transfectées de plaque-E avec 18 mL remplir TCM et retournent à l’incubateur.
- Jour 3 : Isolement et in vitro activation des cellules T spléniques de souris
- Retirer la rate de souris BALB/c de 6-8-week-old décrites précédemment par Parkinson et al. 19 et immerge-les dans stérile, glacée, PBS dans un tube conique de 50 mL.
- Pince à épiler permet de transférer une rate à un tube de microtubes de 1,5 mL et homogénéiser à l’aide d’un pilon avec un minimum de force.
- Utiliser une pipette de 1000 μL et ~ 800 μL PBS pour transférer l’homogénat à une crépine de cellule pore 100 μm apposée sur un tube de 50 mL contenant 5 mL de PBS pour atteindre une suspension monocellulaire. Répétez l’étape 2.4.2 pour les rates supplémentaires. Ne pas dépasser 3 rates par tube.
Mise en garde Splénocytes passés filtre peuvent forment des touffes si encore debout. Manuellement à jet hélicoïdal tubes par intermittence si traitement plusieurs rates pour éviter la cellule agglomérante. Restant des fragments sur la crépine de cellule plus empâté à l’aide d’un piston d’une seringue de 5 mL à l’aide de la force minimale. - Supérieure à 20 mL avec du PBS. Couche la suspension cellulaire de 20 mL doucement sur 20 mL de média gradient de densité (Table des matières) dans un tube de 50 mL. Centrifuger la suspension obtenue superposée à 800 x g pendant 20 min et aucun frein rhéostatique.
- Récolter les cellules à couche d’interface à l’aide d’une pipette Pasteur stérile et transférez dans un tube de 50 mL. Supérieure à 50 mL avec PBS et centrifuger à 800 g pendant 10 minutes pour laver. Jeter le surnageant et remettre en suspension les cellules en MTC complet.
- Compter le nombre de cellules à l’aide d’un hémocytomètre.
- La culture de cellules à une densité de 5 x 106 cellules/mL en MTC complète avec 30 ng/mL d’anticorps anti-CD3ε (Clone 11 145-2C), 30 ng/mL d’anticorps anti-CD28 (Clone 37,51), 100 U/mL recombinante humaine il-2 et recombinant de 2 ng/mL murins IL-7. Utilisez une fiole de vitroplants taille appropriée pour le volume des cellules prélevées.
Remarque : Cellules présentatrices d’antigène–sont nécessaires pour l’activation des lymphocytes T par des anticorps CD3 et CD28, si travailler avec purifiée cellules de T, il est nécessaire de plaques de couche avec des anticorps, ou utilisent des billes magnétiques (Table des matières) - Incuber les splénocytes de souris à 37 ° C, 5 % CO2 pendant la nuit.
- Jour 3 : Préparation des plaques pour la transduction
- Manteau sans tissu-culture 6 plats avec 2 mL de 10 μg/mL de fibronectine humaine recombinante fragmentent et incuber une nuit à 4 ° C.
- Jour 4 : Transduction des cellules de souris T
- Transfert en fragment de fibronectine humaine recombinante de plaques revêtues aux plaques de 6 puits non-culture de tissus frais. Ces incuber une nuit à 4 ° C pour le 2ème tour de la transduction.
- Ajouter 2 mL de la MTC dans chaque loge de planches originales de fragment-enduit de fibronectine humaine recombinante et laisser pendant 30 min à température ambiante pour bloquer les liaisons non spécifiques.
- Récolter le surnageant contenant du rétrovirus de cellules transfectées de Plat-E dans les récipients de culture de tissu de 15 cm et remplacer avec 18 mL de TCM complet.
Mise en garde Travailler rapidement pour éviter le dessèchement des cellules Plat-E.
Remarque : Succès de la transfection peut être vérifiée à ce stade par microscopie de fluorescence si utilisant un gène marqueur fluorescent tels que mCherry (Figure 1). - Le surnageant contenant du rétrovirus filtrer sur un filtre de 0,45 μm pour éliminer les débris cellulaires. Enlever TCM de fibronectine humaine recombinante fragment-enduit des plaques 6 puits et ajouter 2,5 mL de filtrée surnageant contenant du rétrovirus ou dans chaque cupule (utilisation toutes les TCM pour la transfection simulée). Étiquetez chaque puits quant à l’ajout de rétrovirus ou simulacre médiatique.
- Centrifuger les plaques à 1200 x g pendant 30 min à température ambiante.
- Tandis que les plaques sont filer, recueillir les lymphocytes T activés et compter à l’aide d’un hémocytomètre.
- La transduction est effectuée avec des splénocytes6 activé 5 x 10 sur un total de 5 mL par puits. Granule le nombre requis de splénocytes pour maquette/transduction dans des tubes distincts par centrifugation à 500 g pendant 5 min.
- Remettre en suspension les splénocytes à une densité de 5 x 106 cellules / 2,5 mL de surnageant de rétrovirus contenant filtré de l’étape 2.6.4 ou TCM comme témoin négatif. Ajouter recombinante il humain Property DelayValidation-2 Implements (hIL-2) et recombinante souris IL-7 (mIL-7) à une concentration finale de 200 UI/mL et 4 ng/mL respectivement.
- Recueillir des plaques 6 puits de la centrifugeuse à la fin de l’étape 2.6.5 et ajouter 2,5 mL/puits remises en suspension splénocytes dans les puits appropriés pour faire un volume final de 5 mL/bien et une concentration finale de 100 U/mL hIL-2 et 2 ng/mL mIL-7.
- Centrifuger les plaques à 1200 x g pendant 90 min à température ambiante. Après centrifugation, incuber les plaques à 37 ° C, 5 % CO2 pendant la nuit.
- Jour 5 : 2ème tour de la transduction
- Recueillir le fragment de fibronectine humaine recombinante des plaques comme cela peut être réutilisée. Répétez les étapes 2.6.2 - 2.6.5.
- Alors que les plaques sont filer, prélever des cellules du 1st round de transduction, à l’aide d’une pipette Pasteur. Rincer chaque puits avec 2 mL de PBS, agiter et recueillir les cellules restantes dans chaque puits.
Remarque : Pipetter haut et bas pour remettre en suspension les cellules sédimentées. Collecter chaque groupe contrôle/transduction dans des tubes distincts. - Tubes à centrifuger à 500 g pendant 5 min. remettre en suspension les cellules en 2,5 mL par puits de transduction avec 200 UI/mL IL-2 et 4 ng/mL IL-7. Répétez les étapes 2.6.7 - 2.6.8.
- Éliminer les cellules de la centrifugeuse et incuber à 37 ° C, 5 % de CO2 pour les cellules de 4 h. recueillir transduites comme étapes 2.7.2-2.7.3.
- Compter les cellules, centrifuger à 500 g pendant 5 min et remettre en suspension en MTC complète à une densité de 1 x 106 cellules/mL avec 100 U/mL hIL-2 et 2ng/mL mIL-7. Transférer dans une fiole de culture taille convenablement et incuber à 37 ° C, 5 % de CO2.
- Ajouter des supports TCM neufs contenant 100U/mL hIL-2 et 2ng/mL mIL-7 tous les 2 jours, maintenir une densité cellulaire de 1 x 106 cellules/mL.
Remarque : Splénocytes récoltés contiennent une variété de types de cellules. Dans ces conditions de culture, les cellules T non meurent au cours des 2 ou 3 jours. Après ~ 4 jours en culture cellulaire, le nombre de lymphocytes T est généralement équivalent au nombre total de splénocytes récoltés le jour 0.
3. mesure de l’efficacité de la Transduction
- Sur la transduction de post J4, prélever un échantillon de cellules de T transduits ou non-transduites (environ 3 x 105 cellules). Centrifuger la suspension cellulaire à 500 g pendant 5 min, jeter le surnageant, laver les cellules pressés une fois avec du PBS et centrifuger à nouveau.
- Jeter le surnageant et ajouter 100 μl de PBS contenant un colorant réactif amine approprié (par exemple, tache de vivre/morts, dilution de 1 à 100) / puits. Incuber pendant 15 min à température ambiante dans l’obscurité.
- Laver deux fois avec du PBS et centrifuger à 500 g pendant 5 min. jeter le surnageant et incuber avec 50 μL de tampon de FACS contenant des anticorps anti-souris du CD16/CD32 pour récepteurs Fc (dilution de 1 à 100). Incuber pendant 10 min à 4 ° C.
- Directement ajouter 50 μL d’anticorps coloration mélange principal contenant anti-souris BV786 CD4 et CD8-BV711 anticorps (concentration finale de 1 μL/puits dans le tampon de FACS). Incuber 30 min à 4 ° C dans l’obscurité. Répétez l’étape de lavage 3.3. Remettre en suspension les cellules dans un tampon 1 % PFA et gardez les dans l’obscurité à 4 ° C jusqu'à l’analyse par cytométrie en flux.
- Analyser les cellules avec équivalent cytomètre approprié à l’aide de fluorescence BV711, BV785 et mCherry comme des marqueurs de sous-ensemble de CD4 et CD8 et expression de voiture gating respectivement (Figure 2).
4. in vitro les cellules de la Validation de voiture T activité
- Semences syngéniques ciblent CD19+ des cellules tumorales avec ou sans expression de la luciférase à une densité de 1 x 104 cellules dans 100 μL TCM/puits dans un fond U 96 puits plaque de culture de tissus.
- Ajouter 1 x 104 T voiture CD19 cellules/puits dans un volume de 100 μL/puits pour atteindre un effecteur ratio cible (E:T) de 1:1.
Remarque : Ratios de E:T devraient être établis pour chaque voiture, construire et cibler la lignée cellulaire. - Cellules d’utilisation T seul et seul comme témoins négatifs des cellules tumorales et des cellules T stimulées par phorbol-myristate-acétate (PMA) (50 ng/mL) et ionomycine (1 μg/mL) comme témoin positif pour la libération de l’interféron gamma (IFNγ). Cellules de co-culture à 37 ° C, 5 % de CO2 pendant 16 à 24 heures.
- Suite de co-culture, centrifuger les plaques à 500 g pendant 5 min et recueillir le surnageant pour une analyse ultérieure IFNγ et ELISA de IL - 12 p 70.
Remarque : Cela peut être conservé à-80 ° C. - Une nouvelle suspension pastilles de cellule dans 100 μl de PBS contenant la luciférine (concentration finale de 1,5 mg/mL). Incuber les boîtes pendant 10 min à 37 ° C. Mesurez ensuite la luminescence de chaque puits avec un luminomètre approprié.
Remarque : Temps d’exposition doivent être optimisés pour la densité et de lignées cellulaires. Résultats représentatifs sont présentés dans la Figure 3 a. Ex vivo cytotoxicité des lymphocytes T de voiture peut être modifiée à la luciférine express par co-culture avec des lignées de cellules exprimant l’antigène cible. Comme cellules de T de voiture tuent les cellules cibles, luciférine est sorti, donc une réduction de luminometry signal est corrélée à tuer cell. Les cellules non-transduites peuvent souvent avoir un effet sur la viabilité des cellules cibles, particulièrement pendant les périodes d’incubation longue. Mesurer la concentration de la murine IFNγ et IL - 12p 70 dans le surnageant conformément aux protocoles ELISA du fabricant. Résultats représentatifs apparaissent (Figure 3 b et 3C). Ex-vivo activation de lymphocytes T de voiture par co-culture avec des lignées de cellules exprimant l’antigène cible peut être dosée par l’analyse de contenu surnageant à l’aide de ELISA. Le ratio de cellules de T de voiture pour cibler les cellules et la durée de la période de culture mixte doivent être optimisés pour chaque construction voiture, lignée de cellules de cible et d’analytes. Traitement de PMA et ionomycine peut servir de témoin positif pour confirmer la qualité des cellules T et leur capacité à réagir.
5. évaluer l’activité de lutte contre le cancer chez les souris
-
Protocole n° 1
- Effectuer la livraison par voie intraveineuse (IV) 100 mg/kg de cyclophosphamide chez des souris BALB/c 6 à 8 semaines. Cela permet la prise de greffe tumorale sans lymphodepletion significative17 (Figure 4).
Remarque : Instituant l’A20 lymphome peut prendre plus de 2 mois avec un taux d’abonnement sous-optimale. Cela peut être améliorée par l’utilisation du cyclophosphamide 1 jour avant la livraison des cellules de lymphome. Afin d’étudier la lymphoreplete souris, nous avons identifié une dose de cyclophosphamide susceptibles d’accroître l’efficacité du lymphome sans causer de lymphodepletion. - Le lendemain, injecter 100 µL de 5 x 105 syngénique A20 B-cell lymphoma cellules modifiées pour exprimer la luciférase et vert fluorescent protein (GFP) chez la souris par une injection intraveineuse (IV).
- Laissez les souris de développer un lymphome systémique pour ~ 17 jours.
- Confirmer la présence de lymphome systémique par une injection intrapéritonéale (IP) de 100 μL de luciférine de 30 mg/mL et d’imagerie utilisant une bioluminescence in vivo , système d’imagerie.
- Utiliser séparateurs pour éviter débordement de signal à des souris adjacentes. Exposer les souris pendant 1 min sur la face ventrale avec une région de taille constante d’intérêt.
- Affiche les unités de lumière relatives (RLU) photons par seconde (p/s). Paramètres doivent être optimisées pour chaque modèle de tumeur ; Utilisez une exposition qui peut ramasser la détection précoce des tumeurs, mais n’entraîne pas de saturation, comme les tumeurs atteignent des points de terminaison.
- Région d’intérêt de taille record RLU total pour chacune des souris avec une constante. (Figure 5 a et b).
- Injecter un lymphome d’une dose unique de 1 x 106 cellules de T de voiture par injection intraveineuse à des souris de lymphoreplete portant établi.
Remarque : (Important) Niveaux de dosage doit être établi pour chaque voiture construire en utilisant un calendrier d’escalade de doses pour que toute toxicité possible des cellules de T de voiture est caractérisées et peut être abordées. Bien que les cellules T voiture CD19 anti-souris n’affichent pas les toxicités, lymphocytes T voiture peuvent donner lieu à toxicités inattendues. Lorsque plusieurs constructions de voiture et de l’efficacité de la transduction n’est pas identiques, le nombre total de lymphocytes T administré doit être égal par l’addition de non-transduites des cellules T dans des préparations de cellules. - Surveiller la progression de la maladie par semaine par injection Intrapéritonéale de 100 μL de luciférine de 30 mg/mL et d’imagerie utilisant une bioluminescence in vivo d’imagerie système (Figure 5C).
- Suivre la souris des signes de toxicité de près et euthanasier une souris qui montrent les premiers signes de paralysie des membres postérieurs (HLP) ou fardeau tumoral pathologique avant toute souffrance peut survenir.
Remarque : Toxicités de lymphome A20 peuvent inclure le membre postérieur paralysie par l’invasion de la tumeur des méninges. Vérifiez régulièrement pour les signes précoces d’altération de la démarche. De même, les grosses tumeurs IP peuvent survenir qui peut conduire à l’inconfort, illustré par un comportement altéré. - Assurer la survie des souris pour 60 à 100 jours (Figure 5 d). Effectuer l’euthanasie par une méthode de formule-1 à l’issue de l’expérience.
- Effectuer la livraison par voie intraveineuse (IV) 100 mg/kg de cyclophosphamide chez des souris BALB/c 6 à 8 semaines. Cela permet la prise de greffe tumorale sans lymphodepletion significative17 (Figure 4).
-
Protocole 2
- Distribuer le cyclophosphamide 200 mg/kg à 6-8 - semaine vieilles souris BALB/c en queue injection dans la veine dans 100 μl de PBS par souris.
- Le lendemain, injecter de 5 x 105 syngénique A20 B-cell lymphoma cellules exprimant luciférase et GFP dans 100 μL PBS via queue injection dans la veine.
- Laissez les souris de développer des lymphomes systémiques pour ~ 7-14 jours
- Confirmer lymphome systémique par injection Intrapéritonéale de 100 μL de luciférine de 30 mg/mL et imagerie utilisant une bioluminescence in vivo , système d’imagerie.
- Effectuer 5 Gy irradiation corporelle totale (TBI) à 0,02 Gy/min pour lymphodepletion.
Remarque : Patients subissant un traitement par voiture T-cellules subissent une série de schémas pour atteindre lymphodepletion avant l’administration de lymphocytes T de la voiture qui augmente de manière significative la prise de greffe de Moutschen transfert des cellules de T de voiture. Cela peut être reproduit chez les souris avec irradiation corporelle totale (TBI) (Figure 6). - Le lendemain, injecter 1 x 106 cellules de T de voiture dans 100 μl de PBS via queue veine injection chez des souris ayant établie des tumeurs.
- Collecte sang échantillons via queue veine saigne après 7 jours.
- Ajouter le tampon de lyse des globules rouges à chaque échantillon de sang, puis préparer pour la cytométrie en flux, tel que décrit à l’article 3. Analyser la persistance de cellules de T de voiture dans la circulation par cytométrie en flux (Figure 2).
Remarque : Ajout de comptage perles immédiatement avant la cytométrie en flux permet de déterminer le nombre de cellules de T de voiture par millilitre de sang. - Surveiller la progression de la maladie comme décrit aux étapes 5.1.5 - 5.1.8 (Figure 7).
Résultats
Pour la transduction de rendement élevé de lymphocytes T, il est nécessaire d’obtenir des particules rétrovirales fraîches. Transfection de la lignée cellulaire de Plat-E avec pCL-Eco producteur plasmide et plasmide rétrovirus pMP71 donne lieu à la sécrétion des particules rétrovirales dans la cellule surnageante. Quand un gène marqueur fluorescent, tels que mCherry, est codé dans le rétrovirus, transfection réussie peut être confirmée par microscopie de fluorescence (Figure 1). Surnageant contenant le virus des cellules transfectées de Plat-E sert à transduce NKT via 2 tours d’essorage-fection sur des plaques de revêtement fragment la fibronectine. L’efficacité de la transduction peut être déterminée en 4 jours après la transduction par cytométrie en flux. Avec succès transduits cellules expriment le gène marqueur encodé dans le rétrovirus (Figure 2). Efficacité de transduction varie de ~ 50-90 % d’efficacité avec les récepteurs de la première génération de ~ 10 à 40 % avec voiture construit à proximité de la capacité de l’emballage rétrovirale. Tandis que l’expression du gène marqueur montre transduction retroviral réussie, il est primordial de montrer la fonctionnalité des cellules de T de voiture à engager avec les cellules de cet antigène cible explicite sur leur surface. Lignées de cellules de cible modifiées à la luciférase express peuvent être utilisées dans les essais de la luciférase pour tester le degré de cellule-tuer par les cellules de T de voiture directement (Figure 3 a). La libération de cytokines effectrices des cellules T de voiture sur co-culture avec des cellules cibles, déterminés par ELISA, peut également être utilisée comme une mesure indirecte de la cytotoxicité des cellules T de voiture (Figure 3 b et 3C).
Cellules de T de voiture produites dans le présent protocole peuvent être évaluées chez des souris lymphoreplete en établissant le lymphome systémique de A20 avec une dose de 100 mg/kg de cyclophosphamide (injectée intraveineuse), 1 jour avant l’injection IV de 5 x 105 cellules A20 (Figure 4). Injection d’IP avec la luciférine et image capture à l’aide d’un imageur de bioluminescence in vivo peut être utilisée pour surveiller la charge tumorale en utilisant un temps de retour sur investissement et l’exposition constant tout au long de la (Figure 5 a-C). Cellules de T de voiture modifiées d’IL-12 express sont capables d’éradiquer le lymphome systémique avec LYMPHODÉPLÉTEUR pré conditionnement donnant la survie sans maladie dans environ 25 % des souris (Figure 5). LYMPHODÉPLÉTEUR préconditionnement, réalisé par 5 Gy TBI 1 jour avant l’administration IV de cellules de T de voiture, améliore significativement la greffe (Figure 6). Dans ce modèle, première génération voiture NKT est capables d’éradiquer systémique A20 lymphome, typiquement induisant la survie sans maladie à 100 % des souris (Figure 7).
Figure 1. Confirmation de la transfection réussie des cellules Plat E. Plat-E des cellules transfectées avec retroviral construction de voiture et de pMP71 et de pcl-Eco Emballages vecteur l’ADN de plasmide. Transfection réussie est illustrée par l’expression du gène marqueur fluorescent mCherry. A) au microscope à fond clair, B) microscopie en fluorescence et C) images fusionnées sont affichées. Grossissement = 50 X. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2. Déterminer l’efficacité de la transduction par cytométrie. Cytométrie en flux est utilisée pour déterminer l’efficacité de la transduction des cellules T de la souris sur la transduction de post jour 4, à l’aide de Zombie UV live/dead, mCherry, BV711 et BV785 pour la détection de la vivre, CAR construire, les cellules CD4 et CD8, respectivement. Des résultats représentatifs de A) Non-transduites, B) mCherry.αmCD19.mCD3z et C) mCherry.αmCD19.mCD3z.mIL12 sont affichés avec blocage de 1) 2 maillots de corps) vivent les cellules 3) CD4 et CD8 4) et 5) évaluation des cellules positives mCherry exprimant la voiture. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
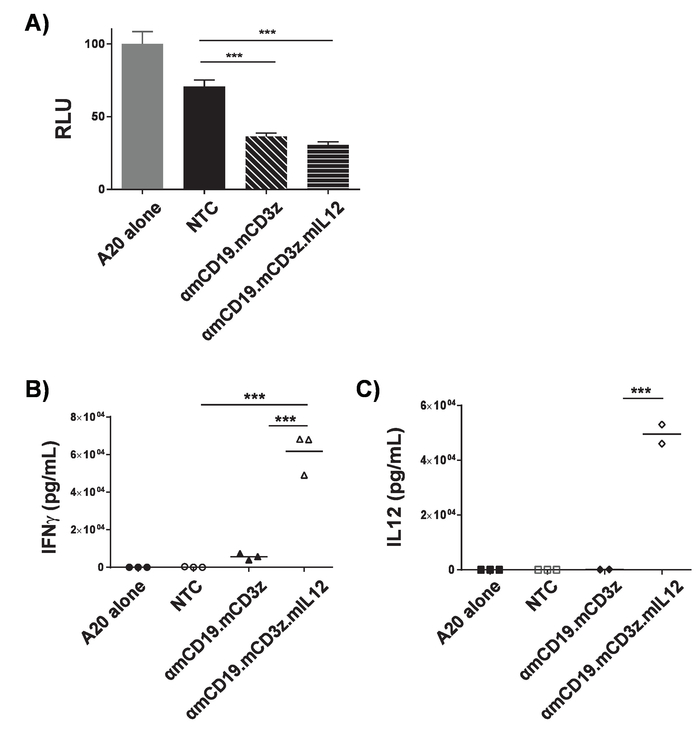
Figure 3. Validation de l’activité des lymphocytes T voiture. ΑmCD19 voiture NKT est cultivés conjointement avec les cellules de lymphome A20 modifiées à la luciférase express (1 x 10,4: 1 x 104) pendant 16 h dans une plaque de fond U 96 puits. Après la co-culture, cellules étaient granulées et surnageant ont été recueilli. A) des cellules ont été remises en suspension dans du PBS et luminometry a été utilisé pour évaluer la viabilité des cellules cibles. Surnageant de culture mixte a été évaluée pour la présence d’IFNγ (B) et d’IL-12 (C). Le ratio de cellules de T de voiture pour cibler les cellules et durée de la période de co-culture doivent être optimisés pour chaque voiture, construire et cibler la lignée cellulaire. Traitement de PMA et ionomycine peut servir de témoin positif pour confirmer la qualité des cellules T et les cellules de leur capacité à répondre. Barres d’erreur afficher SD. statistique analyse a été réalisée à l’aide d’ANOVA à. p < 0,001). Ce chiffre a été modifié par17. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
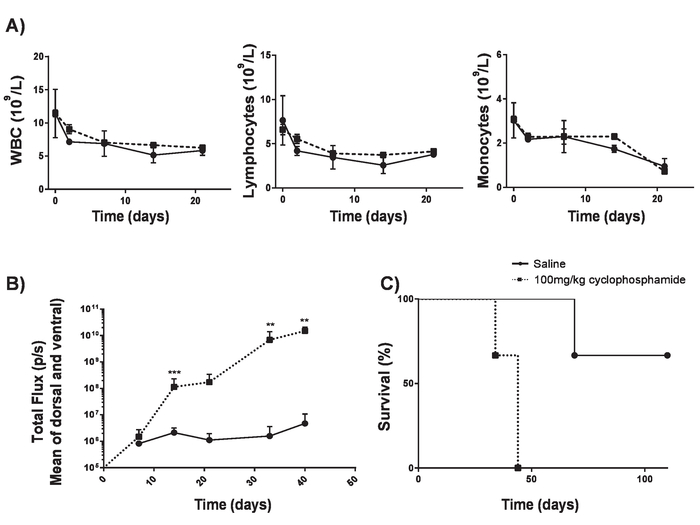
Figure 4. Instituant l’A20 lymphome sans lymphodepletion. Cyclophosphamide peut augmenter l’efficacité de l’induction de lymphome sans causer de lymphodepletion. A) numération globulaire de souris BALB/c 6-8 semaines après l’accouchement IV de 100 mg/kg de cyclophosphamide. Barres d’erreur afficher SD B) charge de lymphome de souris BALB/c 6-8-semaines après livraison IV de 100 mg/kg de cyclophosphamide ou de sérum physiologique le jour -1 et IV des cellules de 5 x 105 A20 au jour 0, mesurée à l’aide d’un luminomètre. C) survie des souris en B). Barres d’erreur afficher SD. statistique analyse a été réalisée à l’aide de 2-way ANOVA. ** p < 0,01, *** p < 0,001). Ce chiffre a été modifié par Kueberuwa et al. 17. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
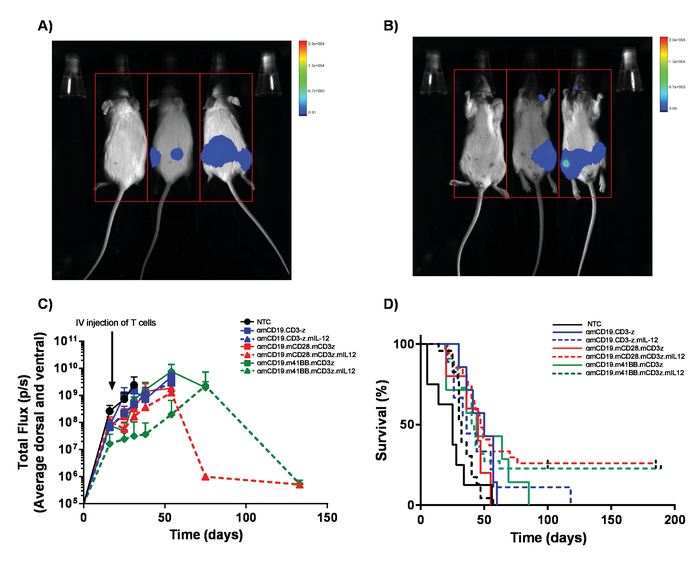
Figure 5. Suivi de charge de lymphome et de survie. Souris porteuses A20 lymphome exprimant la luciférase reçoivent 100 µL (IP) des injections intrapéritonéales de luciférine de 30 mg/mL et ont été photographiés à l’aide d’une bioluminescence in vivo , système d’imagerie. A) souris ont été exposées pendant 1 min sur la face ventrale et immédiatement capotés à image dorsale pour ramasser des masses tumorales sur les deux côtés du corps (B). C) des résultats représentatifs de la charge de lymphome de souris BALB/c recevoir diverses cellules de T de voiture de αmCD19 sans lymphodepletion. Barres d’erreur afficher SEM. D) les taux de survie des souris mêmes. Ce chiffre a été modifié par Kueberuwa et al. 17. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
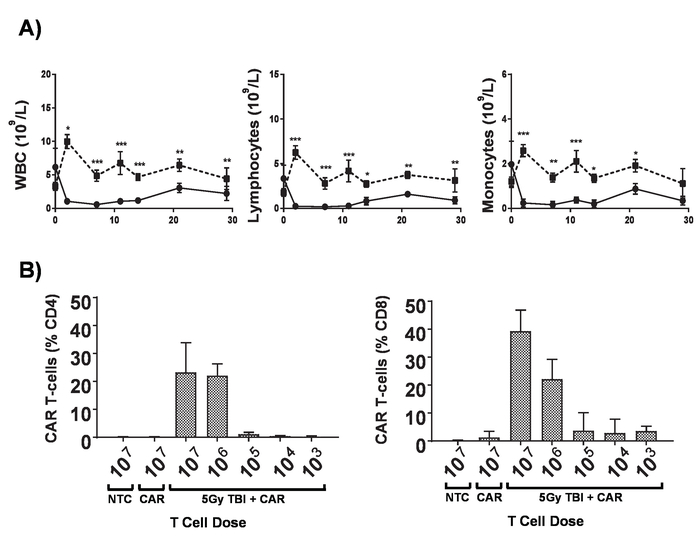
Figure 6. Effets de lymphodepletion. A) numération globulaire de souris BALB/c 6-8-semaines après avoir reçu 5 Gy TBI à un débit de dose de 0,02 Gy/min ; barres d’erreur afficher SD. statistiques analyse de variance bidirectionnelle. p < 0,05, ** p < 0,01, *** p < 0,001. B) CD8 et surveillance des CD4+ + T de voiture des cellules dans le sang périphérique de souris par cytométrie de flux pour l’administration mCherry marqueur génétique 7 jours post. Barres d’erreur afficher SD Ce chiffre a été modifié par Kueberuwa et al. 17. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
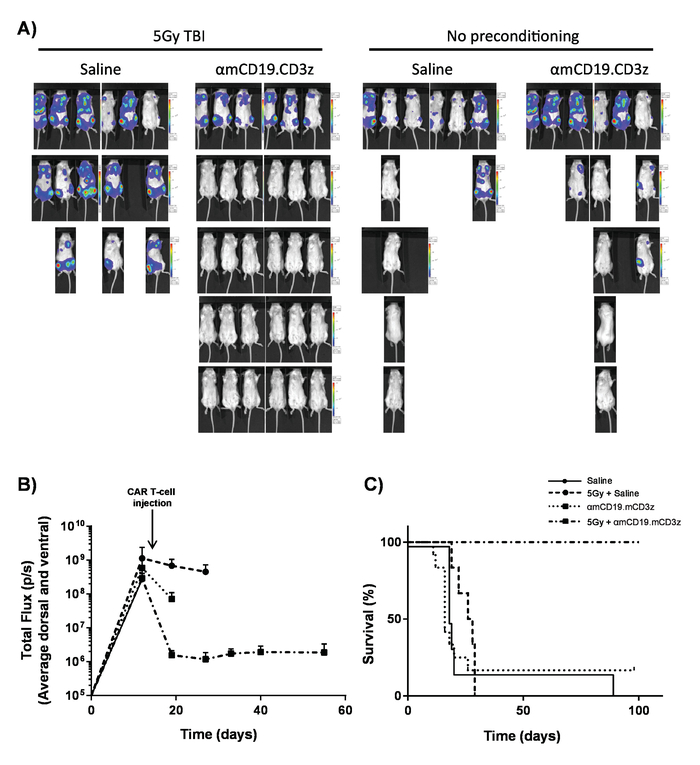
Figure 7. L’activité des cellules de T voiture avec LYMPHODÉPLÉTEUR le préconditionnement. Résultats typiques montrant l’effet de 5 Gy TBI le jour avant l’administration de lymphocytes-T de voiture. A) affichages graphiques imagerie et (B) de l’imagerie des souris après 100 µL (IP) des injections intrapéritonéales de luciférine de 30 mg/mL à l’aide d’une bioluminescence in vivo , système d’imagerie. Barres d’erreur afficher SEM. C) la survie des souris mêmes. Ce chiffre a été mis à jour le fromKueberuwa et al. 17. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Modèles murins syngéniques permettent de tester de thérapie et de la progression de la maladie tout en conservant un système immunitaire intact. Ceci est primordial lorsqu’il s’agit de thérapies qui interagissent avec le système immunitaire et en particulier pour les agents immunothérapeutiques.
Le protocole décrit ici a deux volets de l’essentiel, l’une est modifier génétiquement les lymphocytes T souris pour exprimer des voitures. Cela nécessite 7 jours d’initiation à la validation de la transduction. Concomitante avec la production de lymphocytes T de voiture est la mise en place de lymphome systémique chez la souris. Devrait la production de cellules T voiture échouer ou être de qualité insuffisante, il n’y a généralement pas assez de temps pour produire des cellules de remplacement avant la souris succomber au lymphome. Il est donc essentiel que chercheurs utilisant ces modèles avec précision réaliser des études de tumeur dosage et maladie de progression afin de temps avec succès la production de lymphocytes T de voiture pour l’administration thérapeutique.
Motifs typiques de faible efficacité de transduction cellulaire T comprend l’efficacité médiocre de transfection des cellules de producteur, généralement causé par la pureté du plasmide pauvres ou inexacte détermination du pH des médias de transfection. Il est recommandé de vérifier l’efficacité de transfection cellulaire producteur avant d’entreprendre le protocole complet comme pauvre transfection va limiter l’efficacité de la transduction des lymphocytes T. Les fragments de fibronectine humaine recombinante peuvent être recueillis et stockés à-20 ° C pour la réutilisation, toutefois, plusieurs résultats de gel-dégel l’efficacité réduite de transduction. Traitement rapide des rates de souris après que collection est également importante pour l’obtention de haut rendements des cellules viables de T.
Il est à noter que le protocole décrit ici utilise les cellules A20 exprimant la luciférase. C’est préférable car il permet de mesurer le fardeau tumoral systémique par imagerie de bioluminescence. Toutefois, en présence d’un système immunitaire fonctionnel, les réponses à la luciférase pourraient fausser les résultats. Nous avons déjà testé les réactions immunitaires de survie des souris au marqueur transgènes17. Il est essentiel pour répliquer les expériences clés à l’aide de cellules A20 gratuites de transgènes à valider que ceux-ci ne jouent pas un rôle important dans l’élimination de la tumeur par des cellules immunitaires.
Tandis que les agents cliniques ne peuvent être utilisés in vivo chez des souris immunodéficientes, l’utilisation de cellules de T de voiture souris contre les cellules cancéreuses de souris nous permet d’évaluer la contribution du système immunitaire à la progression de l’efficacité ou la maladie thérapeutique. Ce protocole pourrait être utilisé pour l’évaluation préclinique des voitures ciblant le lymphome à cellules B ou autres voitures avec modifications telles que la sécrétion d’IL-12 comme décrit ici. Il est à noter que bien que l’interaction entre les cellules immunitaires peut être évaluée dans des modèles murins syngéniques, ils peuvent récapituler pas avec précision l’interaction dans les humains en vivo. De particulier noter, humaine et souris voitures variera dans la structure qui peut-être avoir des conséquences en aval ; activation et cell culture des conditions optimales pour la croissance des cellules T sont différents20, distribution tissulaire de l’expression de l’antigène cible peut varier entre les humains et les souris et toxicités expérimentées peuvent être radicalement différentes. Il est donc essentiel d’utiliser ex vivo et modèles xénogéniques pour corroborer les résultats.
En résumé, les syngénique lymphodepleted et lymphoreplete modèle de lymphome récapitulent les patients avec et sans préalable chimio/radiothérapie. Ceci fournit un système modèle imiter les paramètres cliniques pour permettre l’essai d’une gamme de stratégies thérapeutiques qui sera important pour la prochaine vague de nouveaux agents d’immunothérapie.
Avec l’utilisation de pré-conditionnement, on notera que toutes les souris résolvent habituellement le lymphome. Avec jusqu'à des taux de 90 % de réponse complète chez l’homme, c’est représentant. Cependant, les défis pour la thérapie de lymphocytes CD19 voiture dépendra empêchant la fréquence élevée des rechutes observées qui sont souvent CD19. Les rechutes n’ont pas été observées dans ce modèle jusqu'à et souvent au-delà de 100 jours. Modifications pour imiter les rechutes vus la clinique pourraient aider avec les futurs défis de la thérapie de cellules CD19 voiture T.
Déclarations de divulgation
David Gilham travaille pour Celyad qui est impliqué dans la production de lymphocytes T de la voiture. Le reste des auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier Bloodwise pour le financement de cette recherche (subvention 13031) et les installations CRUK Manchester de ressource biologique unité, imagerie et cytométrie en flux et biologie moléculaire de base pour soutenir ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filter | Appleton Woods | FC121 | |
| 0.45 µm syringe filter | Appleton Woods | FC122 | |
| 1.5ml pestle and microtube | VWR | 431-0098 | |
| 100X penicillin-streptomycin-glutamine (PSG) | Gibco | 10378016 | |
| 2-Mercaptoethanol (50 mM) | Gibco | 31350-010 | |
| Blasticidine S hydrochloride | Sigma- Aldrich | 15205 | |
| Bottle Top Filter (0.2 µm) | Scientific Laboratory Supplies | FIL8192 | |
| Brilliant Violet 711 anti-mouse CD8a Antibody | BioLegend | 100759 | 1 in 100 staining dilution. Clone 53-6.7 |
| Brilliant Violet 785 anti-mouse CD4 Antibody | BioLegend | 100552 | 1 in 100 staining dilution. Clone RM4-5 |
| Calcium chloride dihydrate | Sigma- Aldrich | C7902 | |
| Cell counting beads – CountBright absolute counting beads | Molecular Probes | C36950 | |
| Cell Strainer 100μm | VWR | 734-0004 | |
| Cyclophosphamide Monohydrate | Merck | 239785-1GM | |
| Dulbecco’s Modified Eagle medium (DMEM) - High Glucose | Sigma Aldrich | D6546 | |
| Dynabeads | Gibco | 11131D | |
| Ficoll Paque Plus | GE Healthcare | GE17-1440-03 | Sold by Sigma- Aldrich |
| Flow cytometer - LSR Fortessa x20 | BD Biosciences | 658222R1 | |
| Foetal Bovine Serum | Gibco | 10270 | |
| Haemacytometer | Appleton Woods | HC001 | |
| HEPES solution | Sigma- Aldrich | H0887 | |
| IL-12 p70 Mouse Uncoated ELISA Kit | Invitrogen | 88-7121-76 | |
| IL2, Proleukin | Novartis | PL 00101/0936 | |
| in vivo bioluminescence imaging system – in vivo xtreme II imaging system | Bruker | T149094 | |
| Ionomycin Calcium Salt | Sigma- Aldrich | I0634 | |
| Live/dead stain - Zombie Violet Fixable Viability Kit | BioLegend | 423114 | 1 in 100 staining dilution |
| Luminometer - Lumistart Omega | BMG Labtech | 415-301 | |
| Murine IFN-γ ELISA kit | Diaclone | 861.050.010 | |
| Paraformaldehyde | Sigma- Aldrich | 16005 | |
| pCL-Eco | Novus Biologicals | NBP229540 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma- Aldrich | P8139 | |
| Platinum E cell line | Cell Biolabs | RV-101 | (RRID:CVCL_B488) |
| Purified NA/LE Hamster Anti-Mouse CD28 | BD Biosciences | 553294 | Clone 37.51 |
| Purified NA/LE Hamster Anti-Mouse CD3ε | BD Biosciences | 553057 | Clone 145-2C11 |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553142 | 1 in 100 staining dilution. Clone 2.4G2 |
| Puromycin Dihydrochloride | Sigma- Aldrich | P8833 | |
| Recombinant human fibronectin fragment - RetroNectin Reagent | TaKaRa | T100B | |
| Recombinant Mouse IL-7 (carrier-free) | BioLegend | 577806 | |
| Red cell lysis buffer | eBioscience | 004-4333-57 | |
| RPMI 1640 Medium | Lonza | BE12-167F | |
| Trypsin - EDTA solution | Sigma- Aldrich | T3924 | |
| XenoLight D-Luciferin | Perkin Elmer | 122799 |
Références
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/BiologicsBloodVaccines/CellularGeneTherapyProducts/ApprovedProducts/UCM574106.pdf (2017)
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/biologicsbloodvaccines/cellulargenetherapyproducts/approvedproducts/ucm581259.pdf (2017)
- Liu, Y., Zeng, G. Cancer and Innate Immune System Interactions: Translational Potentials for Cancer Immunotherapy. Journal of Immunotherapy. 35 (4), 299-308 (2012).
- Janssen, L. M. E., Ramsay, E. E., Logsdon, C. D., Overwijk, W. W. The immune system in cancer metastasis: friend or foe. Journal for ImmunoTherapy of Cancer. 5 (1), 79 (2017).
- Pandya, P. H., Murray, M. E., Pollok, K. E., Renbarger, J. L. The Immune System in Cancer Pathogenesis: Potential Therapeutic Approaches. Journal of Immunology Research. 2016, 13 (2016).
- Vinay, D. S., et al. Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Seminars in Cancer Biology. 35, S185-S198 (2015).
- Gajewski, T. F., Meng, Y., Harlin, H. Immune Suppression in the Tumor Microenvironment. Journal of Immunotherapy. 29 (3), 233-240 (2006).
- Munn, D. H., Bronte, V. Immune suppressive mechanisms in the tumor microenvironment. Current opinion in immunology. 39, 1-6 (2016).
- Vanderlugt, C. L., Miller, S. D. Epitope spreading in immune-mediated diseases: implications for immunotherapy. Nature Reviews Immunology. 2, 85 (2002).
- Hardwick, N., Chain, B. Epitope spreading contributes to effective immunotherapy in metastatic melanoma patients. Immunotherapy. 3 (6), 731-733 (2011).
- Makkouk, A., Weiner, G. Cancer Immunotherapy and Breaking Immune Tolerance-New Approaches to an Old Challenge. Cancer research. 75 (1), 5-10 (2015).
- Jackson, S. R., Yuan, J., Teague, R. M. Targeting CD8(+) T-cell tolerance for cancer immunotherapy. Immunotherapy. 6 (7), 833-852 (2014).
- Brentjens, R. J., et al. Lymphodepletion and tumor burden govern clinical responses in patients with B-cell malignancies treated with autologous, CD19-targeted T cells. Journal of Clinical Oncology. 29 (15_suppl), 2534 (2011).
- Brentjens, R. J., et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood. 118 (18), 4817 (2011).
- Hay, K. A., et al. Kinetics and Biomarkers of Severe Cytokine Release Syndrome after CD19 Chimeric Antigen Receptor-modified T Cell Therapy. Blood. 130, 2295-2306 (2017).
- Zhang, T., et al. Efficiency of CD19 chimeric antigen receptor-modified T cells for treatment of B cell malignancies in phase I clinical trials: a meta-analysis. Oncotarget. 6 (32), 33961-33971 (2015).
- Kueberuwa, G., Kalaitsidou, M., Cheadle, E., Hawkins, R. E., Gilham, D. E. CD19 CAR T Cells Expressing IL-12 Eradicate Lymphoma in Fully Lymphoreplete Mice through Induction of Host Immunity. Molecular Therapy - Oncolytics. 8, 41-51 (2018).
- Engels, B., et al. Retroviral vectors for high-level transgene expression in T lymphocytes. Human Gene Therapy. 14 (12), 1155-1168 (2003).
- Parkinson, C. M., et al. Diagnostic Necropsy and Selected Tissue and Sample Collection in Rats and Mice. Journal of Visualized Experiments: JoVE. (54), e2966 (2011).
- Kueberuwa, G., et al. CCR7(+) selected gene-modified T cells maintain a central memory phenotype and display enhanced persistence in peripheral blood in vivo. Journal for Immunotherapy of Cancer. 5, 14 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon