Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Suivi à long terme de vidéo d’animaux aquatiques Cohoused : une étude de cas de l’activité locomotrice quotidienne de la langoustine (Nephrops norvegicus)
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici un protocole afin de suivre individuellement les animaux sur une longue période de temps. Il utilise la vision par ordinateur pour identifier un ensemble de balises construits manuellement en utilisant un groupe de homards comme étude de cas, en fournissant des informations sur la façon de la maison, manipuler et marque les homards.
Résumé
Nous présentons un protocole associé à une technique de repérage vidéo basée sur la soustraction de l’arrière-plan et le seuillage d’image qui permet de suivre individuellement les animaux cohoused. Nous avons testé la suivi de routine avec quatre cohoused aux langoustines (Nephrops norvegicus) dans des conditions de lumière-obscurité pendant 5 jours. Les homards ont été étiquetés individuellement. Le montage expérimental et les techniques de suivi utilisées sont entièrement basés sur le logiciel open source. La comparaison de la sortie de suivi à une détection manuelle indique que les homards ont été correctement détecté 69 % du temps. Parmi les homards correctement détectés, leurs balises individuelles ont été correctement identifiés 89,5 % du temps. Compte tenu de la fréquence d’images utilisées dans le protocole et le taux de mouvement de homards, la performance de la vidéo suivi a une bonne qualité et les résultats représentatifs confirment la validité du protocole en produisant des données précieuses pour les besoins de la recherche (individuel occupation de l’espace ou les patterns d’activité locomotrice). Le protocole présenté ici peut être facilement personnalisé et est, par conséquent, transférable à d’autres espèces où le suivi individuel des spécimens dans un groupe peut être utile pour répondre aux questions de recherche.
Introduction
Dans ces dernières années, suivi automatisé en fonction image a fourni des ensembles de données très précis qui peut être utilisé pour explorer les questions de base en écologie et comportement des disciplines1. Ces ensembles de données peuvent être utilisés pour l’analyse quantitative du comportement animal2,3. Cependant, chaque méthode d’image utilisé pour le suivi des animaux et l’évaluation du comportement a ses forces et ses limites. Dans les protocoles de suivi basé sur l’image qui utilisent l’information spatiale des images précédentes dans un film pour suivre les animaux4,5,6, les erreurs peuvent être introduits quand les chemins des deux animaux se croisent. Ces erreurs sont généralement irréversibles et se propagent à travers le temps. Malgré les progrès informatiques qui réduisent ou éliminent presque ce problème5,7, ces techniques encore besoin des environnements expérimentaux homogènes pour le repérage et l’identification précise des animaux.
L’emploi de marques qui peuvent être identifiés de façon unique chez les animaux permet d’éviter ces erreurs et permet le suivi à long terme des individus identifiés. Les marqueurs largement utilisés (par exemple, des codes à barres et codes QR) existent dans l’industrie et du commerce et peuvent être identifiés à l’aide de techniques de vision d’ordinateur bien connus, tels qu’augmentée réalité (p. ex., Artocès8) et la calibration de la caméra (par exemple, CALTag9 ). Tagged animaux avaient déjà été utilisés pour le haut débit des études comportementales chez différentes espèces animales, pour exemple, les fourmis3 ou abeilles10, mais certains de ces systèmes précédents ne sont pas optimisés pour reconnaître les balises isolé3.
Le protocole de suivi présenté dans cet article est particulièrement adapté pour le suivi des animaux dans l’imagerie d’un canal, tels que l’infrarouge (IR) lumière ou lumière monochromatique (en particulier, nous utilisons la lumière bleue). Par conséquent, la méthode mise au point n’utilise pas de repères de couleur, étant également applicable à d’autres environnements où il y a des contraintes à l’illumination. En outre, nous utilisons des balises personnalisées conçues pour ne pas à déranger les homards et, en même temps, permettent l’enregistrement avec les appareils de faible coût. En outre, la méthode utilisée ici est issue de détection étiquette indépendante du châssis (i.e., l’algorithme reconnaît la présence de chaque balise de l’image quel que soit les trajectoires précédentes). Cette fonctionnalité est pertinente dans les applications où animaux peut être temporairement bloqué, ou les trajectoires des animaux peuvent se croisent.
Dessin de l’étiquette permet son utilisation dans différents groupes d’animaux. Une fois définis les paramètres de la méthode, il pourrait être transféré pour s’attaquer aux autres problèmes de suivi des animaux sans la nécessité pour la formation d’un classifieur spécifique (autres crustacés et gastéropodes). Les principales limites de l’exportation du protocole sont de la taille de l’étiquette et le besoin d’attachement à l’animal (qui en fait ne convient pas aux petits insectes, mouches, abeilles, etc.) et l’hypothèse 2D pour le transport d’animaux. Cette contrainte est importante, étant donné que la méthode proposée suppose que la taille de l’étiquette reste constante. Un animal se déplaçant librement dans un environnement 3D (p. ex., poissons) montrerait tailles autre balise en fonction de sa distance à la caméra.
Le but du présent protocole est de fournir une méthodologie facile à utiliser pour le suivi de plusieurs animaux marqués sur une longue période de temps (jours ou semaines) dans un contexte 2D. L’approche méthodologique repose sur l’utilisation du matériel et des logiciels open source. Logiciel gratuit et open source permet des adaptations, modifications et libre redistribution ; par conséquent, le logiciel généré s’améliore à chaque étape11,12.
Le protocole présenté ici se concentre sur un laboratoire mis en place pour suivre et évaluer l’activité locomotrice des quatre animaux aquatiques dans un réservoir pendant 5 jours. Les fichiers vidéo sont enregistrées à partir d’une image de time-lapse s 1 et compilés en une vidéo à 20 images par seconde (1 jour enregistré occupe environ 1 h de vidéo). Tous les enregistrements vidéo sont automatiquement retouche pour obtenir les positions animales, appliquant des algorithmes et des m├⌐thodes de vision informatique. Le protocole permet d’obtenir de grandes quantités de données, évitant leur annotation manuelle, qui s’est avérée être beaucoup de temps et laborieuse dans la précédente experimental papers13de suivi.
Nous utilisons la langoustine (Nephrops norvegicus) pour l’étude de cas ; ainsi, nous offrons des conditions de laboratoire spécifiques à leur maintien. Homards effectuent des rythmes d’émergence de terrier bien étudiés qui sont sous le contrôle de l’horloge circadienne14,15, et quand cohoused, ils forment la hiérarchie de dominance16,17. Par conséquent, le modèle présenté ici est un bon exemple pour les chercheurs intéressés par la modulation sociale du comportement avec un accent particulier sur les rythmes circadiens.
La méthodologie présentée ici est reproduite facilement et peut être appliquée à d’autres espèces, si il est possible de distinguer les animaux avec des balises individuelles. Les exigences minimales pour la reproduction d’une telle approche en laboratoire sont : (i) les chambres isothermes pour le montage expérimental ; (ii) un apport continu de l’eau ; (iii) mécanismes de contrôle de température de l’eau ; (iv) un système de contrôle de la lumière ; (v) une caméra USB et un ordinateur standard.
Dans ce protocole, nous utilisons Python18 et OpenCV19 (Open Source Computer Vision Library). Nous nous appuyons sur les opérations rapides et communément appliquées (à la fois en termes de mise en œuvre et exécution), tels que le fond soustraction20 et image seuillage21,22.
Access restricted. Please log in or start a trial to view this content.
Protocole
Les espèces utilisées dans cette étude ne sont pas une espèce en voie de disparition ou protégée. Les expériences de laboratoire et d’échantillonnage suivi de la législation espagnole et des règlements (ICM-CSIC) institutionnels internes concernant le bien-être des animaux. Animaux échantillonnage a été réalisé avec l’autorisation de l’autorité locale (gouvernement régional de Catalogne).
1. l’échantillonnage et l’entretien animaux
Remarque : Le protocole suivant est basé sur l’hypothèse que les chercheurs pourront savourer norvegicus N. dans le domaine pendant la nuit pour éviter d’endommager les photorécepteurs23. Exposition de N. norvegicus au soleil doit être évitée. Après le prélèvement, les homards sont censés être logé dans un centre d’acclimatation semblable à celui signalé auparavant17,24, avec un débit continu d’eau de mer réfrigérée (13 ° C). Les animaux utilisés dans la présente étude sont des hommes à l’état intermue avec une longueur céphalothorax (CL ; moyenne ± écart type) de 43,92 ± 2,08 mm (N = 4).
- Maintenir les individus dans des compartiments isolés pour éviter tout dommage dû à des combats individuels (voir Figure 1 a-d).
- Nourrissez-les environ 3 x par semaine à des moments aléatoires ne pas interférer avec les rythmes circadiens.
Remarque : Dans cette expérience, les moules (environ 4 g par homard) ont été utilisés comme nourriture. Les moules ont été achetés auprès de fournisseurs d’aliments surgelés et sont prêtaient à la consommation humaine. - Lumière bleue (425-515 nm) permet de simuler des heures de lumière selon la sensibilité spectrale de l' espèce25 et les conditions environnementales à 400 m de profondeur26 (voir Figure 1 c,d).
Remarque : L’installation utilisée ici a un plafond vertical de deux bleues (478 nm) des lampes fluorescentes qui produit une intensité lumineuse de 12 Lux à 1 m de distance entre les lampes. Voir Figure 1 a pour position des plafonniers et la Table des matières pour les caractéristiques techniques des lampes et du fabricant. - Ajustez la photopériode de fonds pour l’acclimatation à 12/12 heures de lumière/obscurité ou simuler la photopériode naturelle de la latitude locale.
- Réguler la température de l’installation à 13 ° C et surveiller 2 fois par jour pour vérifier la température de l’eau de mer affluant est d’environ 13 ° C (voir Figure 1e).
- Réguler l’afflux d’eau de mer à un rythme d’environ 4 L/min pour maintenir la bonne oxygénation.
Remarque : L’eau de mer circule dans un circuit ouvert (aucun filtres et pompes supplémentaires ne sont utilisés). L’approvisionnement en eau dépend des services de plante aquarium principal.

Figure 1 : Vues d’acclimatation installation. (un) étagères de réservoir. (a1) Entrée eau de mer. (a2) Plafonniers fluorescents. illumination (b) détail de la lumière bleue. (c) détail de cellules animales. (d) détail d’un panneau de commande d’installation isolée. (e), à la température de réglage pour une des entrées. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
2. Construction de la balise
Remarque : La balise utilisée ici peut être changée selon les caractéristiques de l’animal de destination ou d’autres considérations spécifiques.
- Couper quatre cercles de 40 mm de diamètre d’une feuille de plastique noire.
- Coupez un blanc PVC plastifié deux triangles équilatéraux avec 26 mm de côté.
- Coupez un blanc PVC plastifié deux cercles de 26 mm de diamètre.
- Marquer le centre des cercles et triangles blancs et faire un trou de 10 mm.
- Coller les quatre formes blanches au centre des quatre cercles noirs.

Figure 2 : Les quatre balises utilisées pour l’étiquetage individuel des homards. Cercle, cercle-trou, triangle, triangle-trou. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
3. expérimental
Remarque : L’arène expérimentale est censé pour être indépendant chambre expérimentale de mais à proximité immédiate de la facilité de l’acclimatation.
- Mettre en place une chambre expérimentale où la température de l’air peut être contrôlée et maintenue à la même température que l’eau de mer dans le domaine expérimental.
-
Modifier un réservoir en fibre de verre (1 500 x 700 x 300 mm) pour être utilisé comme une arène expérimentale. Ajouter quatre terriers à l’aide de tuyaux souples en PVC au fond du réservoir et bâton de sable sur la surface où les homards sont censés pour déplacer (Figure 3 b-e). Pour plus de détails, voir17,27.
- Fournir l’arène expérimentale par des submersibles LED bleues (472 nm, simulant les heures de lumière) et LED IR (850 nm, obscurité) (voir aussi Figure 3 a)17,24.
Remarque : Lumière de LED est utilisée en raison de son impact à basse température et la disponibilité de commande électronique utilisable et matériel libre. Une installation isolée avec une température environnementale et de l’eau de mer de 13 ± 0,5 ° C a été utilisée. - Gardez toujours les LEDs IR allumé.
Remarque : L’IR est nécessaire pour enregistrer de la vidéo dans l’obscurité et dans des conditions de lumière. Il n’est pas nécessaire pour l’éteindre. - Brancher les LEDs bleues avec un appareil pour gérer la photopériode. Voir les conseils dans la Table des matièreset pour plus de détails, consulter. Sbragaglia et al. 17 (également illustré à la Figure 3 a).
Remarque : Illumination dans les analyses vidéo ou image-automatisé est un facteur critique. Régulière éclairage sans ombres partout dans l’arène en évitant les réflexions de surface de l’eau facilite la vidéo postérieure ou l’analyse d’images. Dans le cadre du présent protocole, les conditions de lumière/obscurité seulement 12/12 ont été utilisées. Lumière et les ténèbres ont été réalisés progressivement dans les 30 minutes, et un script de lumière-contrôleur est ajouté comme supplémentaire 1 fichier. - Placer la prise d’eau de mer réfrigérée à un coin de la citerne et la prise correspondante à l’angle opposé.
- Réglementer l’entrée de l’eau de mer à un débit de 4 L/min.
- Entourent le réservoir avec un rideau noir afin de fournir une isolation complète des autre lumière (Figure 3 a).
- Fournir l’arène expérimentale par des submersibles LED bleues (472 nm, simulant les heures de lumière) et LED IR (850 nm, obscurité) (voir aussi Figure 3 a)17,24.
- Placez le trépied à laquelle la caméra web est fixée sur le côté de l’arène expérimentale et la position de la caméra vidéo ci-dessus (130 cm) et au centre de la scène expérimentale (75 cm x 32,5 cm (voir Figure 3 a).
- Vérifier si la caméra est dans la position centrée (reportez-vous à l’étape 3.3) pour s’assurer qu’il n'a pas été déplacé involontairement.
-
Connectez la caméra web sur un ordinateur qui est placé à l’extérieur du rideau (Figure 3 a).
- Installez le logiciel pour gérer l’enregistrement time-lapse avec la caméra vidéo.
Remarque : Time-lapse enregistrements dépendant de la vitesse du mouvement de l’espèce. En outre, voir la Table des matières pour la caméra, objectif fisheye, PC et caractéristiques de logiciels et fabricants utilisés ici. - Ajustez les paramètres de la vidéo d’enregistrement selon les caractéristiques de l’espèce.
Remarque : Étant donné le taux de mobilité du N. norvegicus, un enregistrement time-lapse de 1 s a été utilisé ici, et toutes les 24 h, la vidéo a été enregistrée. - Prenez soin de créer un timestamp (y compris la date) dans la vidéo time-lapse (car cela peut aider les futures cotation manuelle du comportement).
- Installez le logiciel pour gérer l’enregistrement time-lapse avec la caméra vidéo.
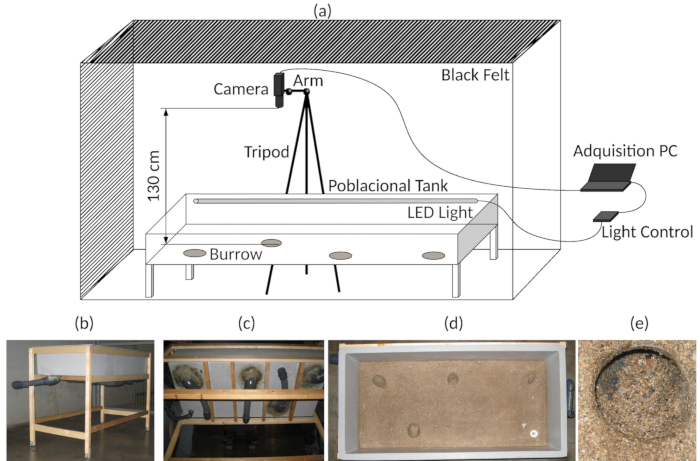
Figure 3 : Montage expérimental. (un) diagramme de l’Assemblée de l’expérimental acquisition de réservoir et de la vidéo. (b) vue d’ensemble de la cuve expérimentale. (c) bas vue du réservoir expérimental, indiquant les terriers artificiels. (d) dessus vue, montrant le fond de la cuve expérimentale. (e) détail de l’une des entrées du terrier. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
4. expérimental essai et préparation animaux
Remarque : Toutes les étapes avec des animaux doivent se faire dans la facilité d’acclimatation et dans des conditions de lumière rouge selon la sensibilité spectrale de l' homard de Norvège25. Lorsque vous déplacez les animaux entre l’acclimatation et l’installation expérimentale, éviter toute exposition des homards à la lumière, à l’aide d’un sac noir opaque pour couvrir la glacière.
- Préparer une glacière précédemment séparé en quatre compartiments submergés avec de l’eau à environ 7 ° C.
- Préparer les quatre balises déjà construite et rapide de la colle, comme cyanoacrylate.
- Préparer un plateau de glace pilée.
- Sélectionnez les quatre homards d’être marqués dans la facilité d’acclimatation et de mettre chacun d'entre eux dans un compartiment de la glacière.
-
Attendez 30 min et, ensuite, démarrez la procédure de marquage.
- Prenez un homard et mettre sur la glace pilée pendant 5 min immobiliser et faciliter l’opération de marquage.
- Sécher la partie supérieure du céphalothorax du homard avec papier adsorbant et mettre une goutte de colle rapide sur elle.
- Placez la balise horizontalement sur le dessus de céphalothorax de l’animal, en contact avec la colle, et attendez suffisamment de temps pour lui de durcir (pour environ 20 s).
- Retourner le homard dans son compartiment dans la glacière et aller de l’avant avec les trois autres animaux de la même manière.
- Remettre les homards dans la cellule où ils étaient auparavant et attendre 24h pour être sûr que la balise est correctement collée sur.
- Transférer les homards de la facilité de l’acclimatation à la chambre expérimentale à l’aide de la glacière même qui a été utilisée pour la procédure de marquage.
- Lancer l’enregistrement vidéo et attendre 5 min avant d’introduire les homards marqués. Obtenir une image de fond sans moyenne des 100 premiers cadres.
Remarque : Attendre un minimum de 1 min est obligatoire pour l’obtention des trames de fond sans les homards marqués ; Ils sont nécessaires pour le traitement vidéo. - Introduire les animaux un par un dans le réservoir de l’expérimentation à l’intérieur de leur logement respectif, maintenant l’eau dans celle-ci.
- Attendre qu’ils s’en sortir ; Si ils ne sortent pas, aidez-les doucement en inclinant le compartiment. Voir la Figure 4 exemple des animaux à l’intérieur de la citerne dans des conditions expérimentales.

Figure 4 : Image vidéo raw. Un exemple d’une image représentative de l’une des vidéos time-lapse recueillies au cours des expériences. Dans le coin supérieur droit, nous montrons l’horodateur avec la date, l’heure et châssis. Notez les différences dans l’illumination de réservoir dans le coin inférieur de l’image. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
5. video analyse Script
-
Effectuer l’analyse après la fin de l’expérience.
- Lancer le script de vision d’ordinateur pour l’analyse vidéo.
- Lancer le programme Java pour calculer les positions et la distance parcourue par les homards et insérer les données dans la base de données.
Remarque : Ce programme est un algorithme de basé sur la distance euclidienne28. - Lancez le script SQL pour binning données comme intervalle de temps souhaité (ex. 10 min).
6. computer Vision Script d’analyse vidéo
Remarque : Le script évite de correction d’image fisheye parce qu’elle n’introduit pas une erreur pertinente dans le montage expérimental. Néanmoins, il est possible de corriger cela avec OpenCV caméra étalonnage fonctions29 issu des vecteurs ou matrices rotation méthodes30,31.
- Sélectionnez le langage de programmation Python18 .
- Sélectionnez l’image19 OpenCV et bibliothèque de traitement vidéo.
- Charger une vidéo.
Remarque : Formats vidéo .avi ou . MP4 ont été utilisés dans cette expérience, mais ce n’est pas obligatoire. Cela dépend les FourCC32 codecs installés dans le système d’exploitation. -
Effectuez les opérations suivantes pour chaque trame Fi dans la vidéo.
- Soustraire le fond20B (moyenne des 100 dernières frames, obtenu à l’étape 4,6) de l’actuel cadre Fiet mettre à jour l’image d’arrière-plan B comme Fi. Utilisez la fonction BackgroundSubtractorMOG2 de la librairie OpenCV19 (voir les scripts dans le dossier complémentaire 2).
- Déterminer l’ensemble des régions d’intérêt (ROIs) R de pixels avec motion pertinente indiquées par le subtractor fond. Utilisez la méthode appliquer de BackgroundSubtractorMOG2 dans la librairie OpenCV19 (voir les scripts dans le dossier complémentaire 2). Dans l’ensemble, comprennent les détections animales de l’image précédente, afin de tenir les animaux immobile compte.
- Effectuez les opérations suivantes pour chaque ROI Ri
- Appliquer la fonction de dilater et calculer le périmètre de rayonnement33 du ROI Ri. Utilisez les fonctions se dilatent et la findContours de la librairie OpenCV19 (voir les scripts dans le dossier complémentaire 2).
- Calculer la coque zone34Salut dans le nombre de pixels. Utilisez la fonction convexHull de la librairie OpenCV19 (voir les scripts dans le dossier complémentaire 2).
- Calculer le rayon35ri de la ROI Ri. Utilisez la fonction minEnclosingCircle de la librairie OpenCV19 (voir les scripts dans le dossier complémentaire 2).
- Calculer la solidité tr de la ROI Ri. Solidité est le rapport entre le contour (obtenu à l’étape 6.4.3.1) à son enveloppe convexe de la Ri(obtenu à l’étape 6.4.3.2).
- Calculer l' allongement Ia de la ROI Ri. Aspect ratio est le rapport entre la largeur et la hauteur de la Ri-rectangle englobant. Le rectangle englobant est calculé à l’aide de la fonction boundingRect de la librairie OpenCV19 .
- Sélectionnez un ensemble réduit de ROIs destinée à contenir les animaux, en ajustant les propriétés pour la région de hull, rayon, solidité et rapport l / h.
- Vérifiez si Salut est inférieure ou supérieure à 100000.0 500,0 . Si oui, jetez le ROI Ri. Sinon, conservez la Ri comme candidat ROI pour l’emplacement de l’animal.
- Vérifiez si le ri est inférieure à 40,0. Si oui, jetez le ROI Ri. Sinon, conservez la Ri comme candidat ROI pour l’emplacement de l’animal.
- Vérifiez si le tr est inférieure à -4,0 jeter le ROI Ri. Sinon, conservez la Ri comme candidat ROI pour l’emplacement de l’animal.
- Vérifier si l' Ia est inférieur à 0,15 ou supérieur à 4,0. Est donc, jetez le ROI Ri. Sinon, conservez la Ri comme candidat ROI pour l’emplacement de l’animal.
Remarque : L’utilisation des ROIs réduit les coûts informatiques, mise au point de la recherche de la balise sur la région du corps de l’animal. Animale détections d’images précédentes sont incluses afin d’éviter les mauvaises détections lorsque les animaux ne se déplacent pas.
- Analyser l’animal ROIs pour déterminer l’identité de la balise. Exécuter de suite d’étapes pour chaque ROI Ri et pour chaque interne du ROI Piet extrayez la ROIs interne P.
- Binarize l’image en niveaux de gris Pi en utilisant l’algorithme de seuillage 36 Otsu.
- Calculer le périmètre de rayonnement33 de Pi, comme à l’étape 6.4.3.1.
- Calculer la coque zone34Salut et le rapport l / h ai, tout comme aux étapes 6.4.3.2 et 6.4.3.5.
- Calculer les momentsde forme37,38mi de Pi. Utilisez la fonction des moments de la librairie OpenCV19 (voir les scripts dans le dossier complémentaire 2).
- Sélectionnez un ensemble réduit de ROIs destinée à contenir les balises, à l’aide des critères suivants.
- Vérifiez si Salut est inférieure ou supérieure à 500,0 150,0 . Si oui, jetez le ROI Pi. Sinon, conservez la Pi comme candidat ROI pour l’emplacement de la balise.
- Vérifiez si l' Ia est inférieur ou supérieur à 1,5 0,5 . Si oui, jetez le ROI Pi. Sinon, conservez la Pi comme candidat ROI pour l’emplacement de l’animal.
- Vérifiez si le mi est supérieure à 0,3. Si oui, jetez le ROI Pi. Sinon, conservez la Pi comme candidat ROI pour l’emplacement de l’animal.
- Classer la balise ROIs. Approximativement un polygone de39 à l’aide de la OpenCV19 fonction38 pour chaque sélectionné ROI Pi19.
- Vérifier s’il y a exactement trois sommets dans le polygone par approximation ; Assignez la balise à la classe de triangle . Sinon, assigner la classe circle à la région de la balise.
Remarque : Polygone approchée est stockée à l’aide d’une matrice avec les sommets. - Vérifier le pixel central de la ROI Pi. Si c’est un pixel noir , assignez le Pi à la classe perforé . Sinon, assignez le Pi à la classe blanche .
Remarque : Le centre de la forme se déduit les moments calculés à l’étape 6.4.5.4. Rechercher les pixels noirs dans une zone d’un rayon de 4 pixels autour du centre.
- Vérifier s’il y a exactement trois sommets dans le polygone par approximation ; Assignez la balise à la classe de triangle . Sinon, assigner la classe circle à la région de la balise.
- Enregistrer les données de trame : cadre date, heure de l’armature, la forme classe, x centre forme coordonnées et y centre forme.
- Continuer avec l’image suivante ou terminer le processus. Voir la Figure 5 ci-dessous comme un exemple visuel de la procédure de script de travail et regarder la vidéo 1 à titre d’exemple du fonctionnement du script.

Figure 5 : Des mesures pertinentes du script de traitement vidéo (1) évaluer la requête de soustraction de fond au-dessus de la moyenne des 100 derniers cadres. (2) résultat de l’algorithme de soustraction du fond. (3) appliquer une opération morphologiques de dilater les zones détectées au blanc. (4) appliquer difficulté, ROI statique, principal ; le polygone jaune correspond à la zone du réservoir inférieur. (5) calculer le périmètre de rayonnement pour chaque région de blanc-détectées dans le retour sur investissement principal et effectuer une analyse structurale pour chaque contour détecté. (6) vérifier les valeurs des propriétés structurelles et, ensuite, sélectionnez les candidats de retour sur investissement de second niveau. (7), Binarize l’image en utilisant un algorithme de seuillage Otsu ; le script fonctionne uniquement avec les ROIs de second niveau. (8) pour chaque binarisées ROI de second niveau, calculer le périmètre de rayonnement des régions blanches et effectuent une analyse structurale pour chaque détectée contour. (9) vérifier la propriété structurelle des valeurs et, puis sélectionne les candidats internes de ROI. (10) pour chaque contour dans le candidat interne du ROI, calculer les descripteurs/moments. (11) vérifier si les matchs forme détecté avec le modèle de forme et environ un polygone pour les meilleurs candidats de match. (12) vérifie le nombre de sommets du polygone approximatif et déterminer la figure géométrique : cercle ou triangle. (13), calculer le chiffre centre et vérifier en cas de pixels noirs ; dans l’affirmative, c’est un chiffre troué. (14) résultat visuel après analyse de l’image. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
Nous avons construit manuellement un sous-ensemble des données expérimentales pour valider l’analyse vidéo automatisée. Un échantillon de 1 308 images avec un niveau de confiance de 99 % (ce qui est une mesure de sécurité qui montre que l’échantillon reflète fidèlement la population, sa marge d’erreur) et une marge d’erreur de 4 % (qui correspond à un pourcentage qui décrit comment fermer la réponse de l’échantillon a donné est la valeur réelle de la population) ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Les résultats de performance et représentant obtenus avec le protocole de suivi vidéo a confirmé sa validité pour la recherche appliquée dans le domaine du comportement animal, avec un accent particulier sur la modulation sociale et rythmes circadiens des animaux cohoused. L’efficacité du dépistage des animaux (69 %) et l’exactitude de la discrimination (89,5 %) de la balise couplé avec les caractéristiques comportementales (c'est-à-dire, les taux de mouvement) des espèces cibles utilisées ici suggèrent...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs sont reconnaissants envers le Dr Joan B. Company qui a financé la publication de cet ouvrage. En outre, les auteurs sont reconnaissants aux techniciens de la zone d’aquarium expérimentale à l’Institut des Sciences marines à Barcelone (ICM-CSIC) pour leur aide pendant les travaux expérimentaux.
Ce travail a été soutenu par le projet RITFIM (CTM2010-16274, chercheur principal : J. Aguzzi) fondé par le ministère espagnol de la Science et l’Innovation (MICINN) et la subvention de TIN2015-66951-C2-2-R du ministère espagnol de l’économie et la compétitivité.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Tripod 475 | Manfrotto | A0673528 | Discontinued |
| Articulated Arm 143 | Manfrotto | D0057824 | Discontinued |
| Camera USB 2.0 uEye LE | iDS | UI-1545LE-M | https://en.ids-imaging.com/store/products/cameras/usb-2-0-cameras/ueye-le.html |
| Fish Eye Len C-mount f = 6 mm/F1.4 | Infaimon | Standard Optical | https://www.infaimon.com/es/estandar-6mm |
| Glass Fiber Tank 1500 x 700 x 300 mm3 | |||
| Black Felt Fabric | |||
| Wood Structure Tank | 5 Wood Strips 50x50x250 mm | ||
| Wood Structure Felt Fabric | 10 Wood Strips 25x25x250 mm | ||
| Stainless Steel Screws | As many as necessary for fix wood strips structures | ||
| PC | 2-cores CPU, 4GB RAM, 1 GB Graphics, 500 GB HD | ||
| External Storage HDD | 2 TB capacity desirable | ||
| iSPY Sotfware for Windows PC | iSPY | https://www.ispyconnect.com/download.aspx | |
| Zoneminder Software Linux PC | Zoneminder | https://zoneminder.com/ | |
| OpenCV 2.4.13.6 Library | OpenCV | https://opencv.org/ | |
| Python 2.4 | Python | https://www.python.org/ | |
| Camping Icebox | |||
| Plastic Tray | |||
| Cyanocrylate Gel | To glue tag’s | ||
| 1 black PVC plastic sheet (1 mm thickness) | Tag's construction | ||
| 1 white PVC plastic sheet (1 mm thickness) | Tag's construction | ||
| 4 Tag’s Ø 40 mm | Maked with black & white PVC plastic sheet | ||
| 3 m Blue Strid Led Ligts (480 nm) | Waterproof as desirable | ||
| 3 m IR Strid Led Ligts (850 nm) | Waterproof as desirable | ||
| 6 m Methacrylate Pipes Ø 15 mm | Enclosed Strid Led | ||
| 4 PVC Elbow 45o Ø 63 mm | Burrow construction | ||
| 3 m Flexible PVC Pipe Ø 63 mm | Burrow construction | ||
| 4 PVC Screwcap Ø 63 mm | Burrow construction | ||
| 4 O-ring Ø 63 mm | Burrow construction | ||
| 4 Female PVC socket glue / thread Ø 63 mm | Burrow construction | ||
| 10 m DC 12V Electric Cable | Light Control Mechanism | ||
| Ligt Power Supply DC 12 V 300 W | Light Control Mechanism | ||
| MOSFET, RFD14N05L, N-Canal, 14 A, 50 V, 3-Pin, IPAK (TO-251) | RS Components | 325-7580 | Light Control Mechanism |
| Diode, 1N4004-E3/54, 1A, 400V, DO-204AL, 2-Pines | RS Components | 628-9029 | Light Control Mechanism |
| Fuse Holder | RS Components | 336-7851 | Light Control Mechanism |
| 2 Way Power Terminal 3.81 mm | RS Components | 220-4658 | Light Control Mechanism |
| Capacitor 220 µF 200 V | RS Components | 440-6761 | Light Control Mechanism |
| Resistance 2K2 7 W | RS Components | 485-3038 | Light Control Mechanism |
| Fuse 6.3 x 32 mm2 3A | RS Components | 413-210 | Light Control Mechanism |
| Arduino Uno Atmel Atmega 328 MCU board | RS Components | 715-4081 | Light Control Mechanism |
| Prototipe Board CEM3,3 orific.,RE310S2 | RS Components | 728-8737 | Light Control Mechanism |
| DC/DC converter,12 Vin,+/-5 Vout 100 mA 1 W | RS Components | 689-5179 | Light Control Mechanism |
| 2 SERA T8 blue moonlight fluorescent bulb 36 watts | SERA | Discontinued/Light isolated facility |
Références
- Dell, A. I., et al. Automated image-based tracking and its application in ecology. Trends in Ecology & Evolution. 29 (7), 417-428 (2014).
- Berman, G. J., Choi, D. M., Bialek, W., Shaevitz, J. W. Mapping the stereotyped behaviour of freely moving fruit flies. Journal of The Royal Society Interface. 11 (99), (2014).
- Mersch, D. P., Crespi, A., Keller, L. Tracking Individuals Shows Spatial Fidelity Is a Key Regulator of Ant Social Organization. Science. 340 (6136), 1090(2013).
- Tyson, L. Hedrick Software techniques for two- and three-dimensional kinematic measurements of biological and biomimetic systems. Bioinspiration & Biomimetics. 3 (3), 034001(2008).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6 (6), 451-457 (2009).
- de Chaumont, F., et al. Computerized video analysis of social interactions in mice. Nature Methods. 9, 410(2012).
- Pérez-Escudero, A., Vicente-Page, J., Hinz, R. C., Arganda, S., de Polavieja, G. G. idTracker: tracking individuals in a group by automatic identification of unmarked animals. Nature Methods. 11 (7), 743-748 (2014).
- Fiala, M. ARTag, a fiducial marker system using digital techniques. 2005 IEEE Computer Society Conference on Computer Vision and Pattern Recognition (CVPR’05). 2, 590-596 (2005).
- Koch, R., Kolb, A., Rezk-Salama, C. CALTag: High Precision Fiducial Markers for Camera Calibration. Koch, R., Kolb, A., Rezk-salama, C. , (2010).
- Crall, J. D., Gravish, N., Mountcastle, A. M., Combes, S. A. BEEtag: A Low-Cost, Image-Based Tracking System for the Study of Animal Behavior and Locomotion. PLOS ONE. 10 (9), e0136487(2015).
- Charpentier, R. Free and Open Source Software: Overview and Preliminary Guidelines for the Government of Canada. Open Source Business Resource. , (2008).
- Crowston, K., Wei, K., Howison, J. Free/Libre Open Source Software Development: What We Know and What We Do Not Know. ACM Computing Surveys. 37, (2012).
- Edmonds, N. J., Riley, W. D., Maxwell, D. L. Predation by Pacifastacus leniusculus on the intra-gravel embryos and emerging fry of Salmo salar. Fisheries Management and Ecology. 18 (6), 521-524 (2011).
- Sbragaglia, V., et al. Identification, Characterization, and Diel Pattern of Expression of Canonical Clock Genes in Nephrops norvegicus (Crustacea: Decapoda) Eyestalk. PLOS ONE. 10 (11), e0141893(2015).
- Sbragaglia, V., et al. Dusk but not dawn burrow emergence rhythms of Nephrops norvegicus (Crustacea: Decapoda). Scientia Marina. 77 (4), 641-647 (2013).
- Katoh, E., Sbragaglia, V., Aguzzi, J., Breithaupt, T. Sensory Biology and Behaviour of Nephrops norvegicus. Advances in Marine Biology. 64, 65-106 (2013).
- Sbragaglia, V., Leiva, D., Arias, A., Antonio García, J., Aguzzi, J., Breithaupt, T. Fighting over burrows: the emergence of dominance hierarchies in the Norway lobster (Nephrops norvegicus). The Journal of Experimental Biology. 220 (24), 4624-4633 (2017).
- Welcome to Python.org. , https://www.python.org/ (2018).
- Bradski, G. OpenCV Library. Dr. Dobb’s Journal of Software Tools. , (2000).
- Piccardi, M. Background subtraction techniques: a review. 2004 IEEE International Conference on Systems, Man and Cybernetics (IEEE Cat. No.04CH37583). 4, 3099-3104 (2004).
- Sankur, B. Survey over image thresholding techniques and quantitative performance evaluation. Journal of Electronic Imaging. 13 (1), 146(2004).
- Lai, Y. K., Rosin, P. L. Efficient Circular Thresholding. IEEE Transactions on Image Processing. 23 (3), 992-1001 (2014).
- Gaten, E. Light‐induced damage to the dioptric apparatus of Nephrops norvegicus (L.) and the quantitative assessment of the damage. Marine Behaviour and Physiology. 13 (2), 169-183 (1988).
- Sbragaglia, V., et al. An automated multi-flume actograph for the study of behavioral rhythms of burrowing organisms. Journal of Experimental Marine Biology and Ecology. 446, 177-186 (2013).
- Johnson, M. L., Gaten, E., Shelton, P. M. J. Spectral sensitivities of five marine decapod crustaceans and a review of spectral sensitivity variation in relation to habitat. Journal of the Marine Biological Association of the United Kingdom. 82 (5), 835-842 (2002).
- Markager, S., Vincent, W. F. Spectral light attenuation and the absorption of UV and blue light in natural waters. Limnology and Oceanography. 45 (3), 642-650 (2000).
- Aguzzi, J., et al. A New Laboratory Radio Frequency Identification (RFID) System for Behavioural Tracking of Marine Organisms. Sensors. 11 (10), 9532-9548 (2011).
- Audin, M. Geometry [Electronic Resource. , Springer Berlin Heidelberg:, Imprint: Springer. Berlin, Heidelberg. (2003).
- OpenCV Team Structural Analysis and Shape Descriptors - OpenCV 2.4.13.7 documentation. , https://docs.opencv.org/2.4/modules/imgproc/doc/structural_analysis_and_shape_descriptors.html?highlight=findcontours#void%20HuMoments(const%20Moments&%20m,%20OutputArray%20hu) (2018).
- Slabaugh, G. G. Computing Euler angles from a rotation matrix. 7, (1999).
- Zhang, Z. A flexible new technique for camera calibration. IEEE Transactions on Pattern Analysis and Machine Intelligence. 22 (11), 1330-1334 (2000).
- www.FOURCC.org - Video Codecs and Pixel Formats. , https://www.fourcc.org/ (2018).
- Suzuki, S., be, K. Topological structural analysis of digitized binary images by border following. Computer Vision, Graphics, and Image Processing. 30 (1), 32-46 (1985).
- Sklansky, J. Finding the convex hull of a simple polygon. Pattern Recognition Letters. 1 (2), 79-83 (1982).
- Fitzgibbon, A., Fisher, R. A Buyer’s Guide to Conic Fitting. , 51.1-51.10 (1995).
- Otsu, N. A Threshold Selection Method from Gray-Level Histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Hu, M. K. Visual pattern recognition by moment invariants. IRE Transactions on Information Theory. 8 (2), 179-187 (1962).
- Structural Analysis and Shape Descriptors - OpenCV 2.4.13.6 documentation. , https://docs.opencv.org/2.4/modules/imgproc/doc/structural_analysis_and_shape_descriptors.html?highlight=cvmatchshapes#humoments (2018).
- Douglas, D. H., Peucker, T. K. Algorithms for the Reduction of the Number of Points Required to Represent a Digitized Line or its Caricature. Cartographica: The International Journal for Geographic Information and Geovisualization. 10 (2), 112-122 (1973).
- Vanajakshi, B., Krishna, K. S. R. Classification of boundary and region shapes using Hu-moment invariants. Indian Journal of Computer Science and Engineering. 3, 386-393 (2012).
- Kahle, D., Wickham, H. ggmap : Spatial Visualization with ggplot2. The R Journal. , 144-162 (2013).
- Venables, W. N., Ripley, B. D. Modern Applied Statistics with S. , Springer. New York. (2010).
- Abbas, Q., Ibrahim, M. E. A., Jaffar, M. A. A comprehensive review of recent advances on deep vision systems. Artificial Intelligence Review. , (2018).
- Menesatti, P., Aguzzi, J., Costa, C., García, J. A., Sardà, F. A new morphometric implemented video-image analysis protocol for the study of social modulation in activity rhythms of marine organisms. Journal of Neuroscience Methods. 184 (1), 161-168 (2009).
- Chapman, C. J., Shelton, P. M. J., Shanks, A. M., Gaten, E. Survival and growth of the Norway lobster Nephrops norvegicus in relation to light-induced eye damage. Marine Biology. 136 (2), 233-241 (2000).
- Video tracking software | EthoVision XT. , https://www.noldus.com/animal-behavior-research/products/ethovision-xt (2018).
- Correll, N., Sempo, G., Meneses, Y. L. D., Halloy, J., Deneubourg, J., Martinoli, A. SwisTrack: A Tracking Tool for Multi-Unit Robotic and Biological Systems. 2006 IEEE/RSJ International Conference on Intelligent Robots and Systems. , 2185-2191 (2006).
- MATLAB - MathWorks. , https://www.mathworks.com/products/matlab.html (2018).
- Leggat, P. A., Smith, D. R., Kedjarune, U. Surgical Applications of Cyanoacrylate Adhesives: A Review of Toxicity. ANZ Journal of Surgery. 77 (4), 209-213 (2007).
- Dizon, R. M., Edwards, A. J., Gomez, E. D. Comparison of three types of adhesives in attaching coral transplants to clam shell substrates. Aquatic Conservation: Marine and Freshwater Ecosystems. 18 (7), 1140-1148 (2008).
- Cary, R. Methyl cyanoacrylate and ethyl cyanoacrylate. , World Health Organization. Geneva. (2001).
- Krizhevsky, A., Sutskever, I., Hinton, G. E. Imagenet classification with deep convolutional neural networks. Advances in neural information processing systems. , http://papers.nips.cc/paper/4824-imagenet-classification-w 1097-1105 (2012).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon