Method Article
Cell-based Assay pour étudier la clairance Tau humoral de la microglie
Dans cet article
Résumé
Nous décrivons ici une analyse axée sur la cellule pour évaluer quantitativement l’absorption tau par la microglie dans le but de créer un outil expérimental pour mieux caractériser les mécanismes d’action des anticorps anti-tau.
Résumé
La maladie d’Alzheimer (ma) est une affection neurodégénérative progressive dans laquelle agrégées tau et accumulent des protéines amyloïdes dans le cerveau, provoquant un dysfonctionnement neuronal qui mène finalement au déclin cognitif. Agrégats de tau hyperphosphorylée dans le neurone sont censés causer la plus grande partie de la pathologie associée à AD. Ces agrégats sont censés être libérés dans le compartiment extracellulaire et repris par les neurones sains adjacents où ils induisent également l’agrégation tau. Cette diffusion « prion-like » peut être interrompu par anticorps lier et « neutraliser » les agrégats extracellulaires tau tel qu’illustré dans les modèles précliniques de souris de AD. Un des mécanismes proposés par lequel des anticorps thérapeutiques réduisent la pathologie est médiée par les anticorps de capture et le dédouanement des pathologiques formes agrégées de tau de la microglie. Nous décrivons ici un test quantitatif sur les cellules afin d’évaluer l’absorption tau de la microglie. Ce test utilise la lignée de cellules microgliales souris BV-2, permet une spécificité élevée, faible variabilité et un débit moyen. Données générées avec ce dosage peuvent contribuer à une meilleure caractérisation des fonctions effectrices anticorps anti-tau.
Introduction
La maladie d’Alzheimer (ma) est une affection neurodégénérative progressive caractérisée par le changement de conformation et d’auto-assemblage de protéine β-amyloïde de peptide et tau en agrégats de pathologiques. Le peptide β-amyloïde soluble normal est converti en oligomère et fibrillaire β-amyloïde, tandis que la protéine tau anormalement phosphorylée accumule en oligomères et enchevêtrements neurofibrillaires1,2. Ces agrégats de protéines causent la mort neuronale conduisant à la perte de mémoire et de déclin cognitif progressif subséquent. Autres facteurs, y compris la neuroinflammation non productives et une diminution de la capacité d’effacer les protéines mal repliées, peuvent aggraver et accélérer la maladie. Actuellement, les stratégies d’intervention contre les AD apporter un soulagement symptomatique en grande partie, mais il n’y a aucun remède modificateurs de la maladie ou la prévention.
Plus en plus évident suggère un rôle clé des agrégats tau hyperphosphorylée dans la pathologie de la ma. Dans son état non pathologique, la protéine tau est une nativement dévoilée de protéine qui se lie aux microtubules et favorise leur assemblage dans le cytosquelette neuronal. Lorsque tau hyperphosphorylée, il se détache du cytosquelette et des grappes dans les agrégats de tau dans les neurones, qui sont censés causer la plus grande partie de la pathologie associée AD3. Agrégées tau commence à s’accumuler tout d’abord dans les cellules, mais que la maladie progresse, il est supposé d’être libéré de neurones touchés dans l’espace extracellulaire, d'où il peut être repris par neurones sains adjacents ou synapses connectées dans un » prion-comme manière ». Une fois intériorisée, l’agrégat de tau induit encore tau agrégation via changement conformationnel basé sur un modèle4.
Selon cette hypothèse, thérapies capables d’interrompre le tau semis pourraient ralentir ou inverser le cours de la maladie neurodégénérative induite par le tau. À l’appui de cela, souris susceptibles d’être tauopathy par mutation génétique et passivement injecté avec des anticorps anti-tau Voir la pathologie tau réduit et amélioration de la fonction cognitive5,6,7,8 ,,9. Toutefois, les mécanismes par lesquels des anticorps thérapeutiques réduisent la pathologie restent toujours insaisissables.
Un des mécanismes proposés est médiée par les anticorps de capture et le dédouanement des pathologiques formes agrégées de tau de cellules microgliales, cellules immunitaires résident du cerveau. Publications récentes suggèrent que la microglie peut efficacement internaliser et dégrader les espèces tau pathologiques et cette capacité est renforcée par les anticorps anti-tau via une Fc-dépendante mécanisme impliquant des récepteurs Fc exprimées à la surface de récepteurs et les cellules microgliales médiée par phagocytose10,11. Ces données identifient microglia comme effecteurs potentiellement importants d’anticorps thérapeutiques.
Nous décrivons ici un test cell pour évaluer quantitativement l’absorption tau de la microglie. Données générées avec ce dosage peuvent aider à élucider les mécanismes d’action des anticorps anti-tau, ce qui représente un outil utile pour faire progresser les anticorps anti-tau aux autres étapes de leur développement comme traitement potentiel de AD.
Protocole
1. Culture de cellules BV-2
NOTE : Poignée BV-2 cellules sous confinement de niveau de biosécurité 2. La lignée cellulaire BV-2 produit un enveloppé ecotropic recombinant rétrovirus (capables d’infecter des cellules uniquement)12; ces virus sont connus pour leur in vitro transformant capacité et in vivo le potentiel tumorigène.
- La culture BV-2 cellules de hyperglycémie Dulbecco modifiées milieu eagle (DMEM) additionné de 10 % sérum fœtal (SVF), 100 U/mL de pénicilline, 100 µg/mL de streptomycine et 2 mM de L-Glutamine (dénommé comme support de culture à l’avenir) en ensemençant des cellules à 4 x 104 cellules/mL.
- Maintenir les cultures dans une atmosphère humidifiée de 5 % de CO2 à 37 ° C.
Remarque : les cellules poussent souplement ci-joint et en suspension.
2. label Recombinant Tau agrégats avec colorant Fluorescent sensibles au pH
Remarque : Les agrégats Tau ont été préparés comme décrit dans Apetri et al. 13 avec la différence qu’aucun thioflavine T (ThT) a été ajoutée au tampon de réaction. Agrégées échantillons ont été prélevés dans des tubes à centrifuger 1,5 mL. Signal de fluorescence final a été vérifié en mélangeant 118 µL de l’échantillon de piscine avec 12 µL d’une solution de ThT 50 µM. Granulats sont séparés par centrifugation du mélange réactionnel agrégation à 20 000 x g pendant 1 h à 4 ° C. Le surnageant a été analysé par SEC-MALS pour confirmer que tous le monomère tau a été transformé en agrégats. Granulés (agrégats de tau) étaient snap congelé et conservé dans un congélateur à-80 ° C.
- Remettre en suspension les agrégats de tau dans un tampon bicarbonate de sodium 0,1 M (NaHCO3) à un pH de 8,5 à une concentration de 1 mg/mL (~ 20 µM).
NOTE : Concentration des agrégats de tau est basée sur la concentration initiale de monomères tel qu’évalué par l’absorption de monomères de tau à 280 nm en utilisant un coefficient d’extinction de 0.31 mLmg-1cm-1. - Laisser agir les agrégats remises en suspension, en utilisant un sonicateur sonde tout en gardant sur la glace pour éviter la surchauffe.
- Utilisez une amplitude de 65 % (avec sonicateur de puissance 250 W).
- Effectuer 8 impulsions de 3 s avec des pauses de 15 s entre les impulsions pour éviter une surchauffe.
- Préparer une solution 8,9 mM sensibles au pH de colorant (désormais référence à comme colorant de pH) dans le diméthylsulfoxyde (DMSO) suivant les instructions du fabricant.
Remarque : Toujours préparer une nouvelle solution et utilisez-la uniquement sur la journée, qu'elle est prête. - Ajouter 10 moles de colorant par mole de protéine à une concentration finale de colorant de 0,2 mM.
- La composition de pipetage doucement verticalement.
- Incuber le mélange réactionnel durant 45 à 60 min à température ambiante, abrie de la lumière.
- En attendant, assembler un gel réticulé dextran dessalage respectant les instructions du fabricant.
- Equilibrer la colonne avec 25 mL de 0.1 M NaHCO3 tampon pH 8,5 contenant 3 % DMSO. Jeter le débit à travers.
- Ajouter le produit de l’agrégat de tau, réaction à la chronique dans un volume total de 2,5 mL d’étiquetage. Si l’échantillon est inférieur à 2,5 mL, ajouter le tampon jusqu'à l’obtention d’un volume total de 2,5 mL.
- Laisser l’échantillon entrer complètement dans le gel emballé, jetez le cheminement.
- Éluer avec 3,5 mL de 0.1 M NaHCO3 tampon pH 8,5 contenant 3 % DMSO et recueillir l’éluat dans 4 fractions équivalentes dans des tubes de 2 mL.
- Déterminer les concentrations de protéine des 4 fractions par bicinchoninic acid test (BCA).
- Stocker les protéines marquées dans un congélateur à-20 ° C.
3. absorption dosage avec lecture de Fluorescence-lancée de cellules triant (FACS)
-
Jour 1 – semences les cellules
- Cellules de lavage BV-2 dans le ballon en retirant la culture moyenne et en ajoutant 1 x solution saline tamponnée au phosphate (PBS).
NOTE : Volume de lavage variera selon la taille de la fiole de cellule utilisée. Par exemple, pour un flacon de T175, laver avec 10 mL de PBS 1 x. - Retirer le flacon de PBS et détacher les cellules en incubant avec la trypsine-tétraacétique (EDTA) l’acide 0,05 % à 37 ° C et 5 % de CO2 jusqu'à ce que les cellules se détachent de la fiole (environ 5 min).
Remarque : Volume de trypsine-EDTA 0,05 % dépend de la taille de la fiole de cellule utilisée. Par exemple, pour un flacon de T175, utiliser 2 mL de trypsine-EDTA 0,05 %. - Remettre en suspension les cellules dans le milieu de culture en pipettant également monter et descendre de trois à cinq fois.
Remarque : Le Volume de milieu de culture varie selon la taille de la fiole de cellule utilisée et donc nombre total de cellules dans le ballon. Par exemple, pour un flacon de T175, utilisez 8 mL de milieu de culture. - Compter les cellules et créer une suspension de cellules à une concentration finale de 1 x 105 cellules/mL dans le milieu de culture contenant 200 héparine μg/mL.
- Plaque de 250 µL de la suspension (2,5 x 104 cellules) de cellules / puits dans une plaque à 96 puits vitroplants fond plat.
- Incuber les plaques pendant une nuit à 37 ° C et 5 % de CO2.
- Cellules de lavage BV-2 dans le ballon en retirant la culture moyenne et en ajoutant 1 x solution saline tamponnée au phosphate (PBS).
-
Jour 1 – préparer Immunocomplexes
- Décongeler le pH colorant-tau sur la glace.
- Préparez 65 μl / condition d’une solution de 500 nM de pH agrégats de colorant-tau dans un milieu sans sérum (SFM) (forte concentration de glucose DMEM additionné de 100 U/mL de pénicilline, 100 µg/mL de streptomycine et 200 µg/mL d’héparine).
- Préparer des dilutions de l’anticorps dans 65 µl de GDF et à une concentration double celui final. Mélanger les agrégats de colorant-tau pH et anticorps dans une plaque de 96 puits u-fond. Volume final par l’État est maintenant 130 µl et la concentration d’agrégats de colorant-tau pH est de 250 nM. Flasque de la dilution et incuber pendant la nuit à 37 ° C.
-
Jour 2 – absorption Immunocomplexes
- Retirez milieu de culture de cellules BV-2. Laver les cellules une fois avec du PBS de 1 x 100 µL température ambiante.
- Transférer 125 µL d’immunocomplexes dans les cellules à l’aide d’une pipette multicanaux. Incuber les cellules avec l’immunocomplexes pendant 2 h à 37 ° C et 5 % de CO2.
- Retirez le milieu d’incubation des cellules et jetez-le. Laver les cellules une fois avec du PBS de 1 x 100 µL température ambiante.
- Retirer 1 x PBS et traiter des cellules avec 50 µL trypsine-EDTA 0,25 % pendant 20 min à 37 ° C et 5 % CO2.
- Ajouter 200 µL de milieu de culture et remettre en suspension bien en pipettant également monter et descendre pour détacher les cellules. Cellules de transfert à 96 puits U fond plat. Plaque de centrifugeuse à 400 x g pendant 5 min à 4 ° C.
- Mettre la plaque sur la glace, enlever cultivant des cellules moyennes et laver deux fois par resuspendant les granules cellulaires dans 150 µL glace froide 1 x PBS. Plaque de centrifugeuse à 400 x g pendant 5 min à 4 ° C.
- Mettre les cellules sur la glace, enlever ajouté 1 x PBS et lavage en resuspendant cellules granulés en tampon froid FACS 150 µL (1 x PBS, 0,5 % sérum d’albumine bovine (BSA), 2 mM EDTA). Plaque de centrifugeuse à 400 x g pendant 5 min à 4 ° C.
- Mettre les cellules sur la glace, enlever l’addition de tampon FACS et remettre en suspension des cellules dans 200 µL de tampon de FACS froid.
- Analyser des échantillons immédiatement par FACS acquérir 2 x 104 événements dans la porte des cellules vivantes (voir point 4.1).
4. FACS Analysis
Remarque : Reportez-vous à la Figure 1 pour la stratégie de blocage.
- En utilisant l’aire de dispersion vers l’avant (FSC-A) par rapport à côté superficie densité (SSC-A) Nuage de points, porte sur des cellules vivantes en excluant les événements avec des niveaux inférieurs de dispersion vers l’avant (c'est-à-dire, les débris et les cellules mortes).
- Au sein de la population de cellules vivantes, utilisez FSC-A par rapport à hauteur de forward scatter (FSC-H) pour exclure les doublets de cellule et d’agrégats. Il s’agit de la porte de singulet.
- Utilisez les événements dans la porte de singulet, générer un histogramme de paramètre unique de colorant de pH.
- Déterminer l’intensité de la fluorescence moyenne. Déterminer le pourcentage de cellules positives de pH colorant-tau en excluant les cellules négatives comme déterminée à l’aide de BV-2 contrôle seul.
5. Immunocomplexes absorption avec lecture de microscopie
-
Jour 1 – semences les cellules
- Préparer les cellules BV-2 comme décrit aux points 3.1.1, 3.1.2 et 3.1.3.
- Compter les cellules et les remettre en suspension en moyenne à une concentration finale de 104 cellules/mL de culture.
- Plaque de 150 µL de suspension cellulaire (1,5 x 103) / puits dans un poly-D-Lysine enduit plaque 96 puits noir avec fond clair plat.
- Incuber les plaques à 37 ° C et 5 % de CO2 pendant 48 h.
-
Jour 3 – préparer Immunocomplexes
Remarque : La sonication douce des agrégats de tau étiquetés avant l’incubation avec l’anticorps, a été réalisée afin d’améliorer les résultats de la microscopie.- Décongeler le pH colorant-tau sur la glace et laisser agir en utilisant un sonicateur sonde tout en gardant sur la glace. Utilisez une amplitude de 15 % (sonicateur puissance de 250 W). Effectuer 30 impulsions de 2 s et attendre 20 s entre les impulsions.
- Préparez 65 μl / condition d’une solution de 500 nM des agrégats de colorant-tau de pH dans la GFD.
- Les anticorps diluées dans 65 µl de GDF à une concentration double finale. Mélanger les agrégats de colorant-tau pH et anticorps dans une plaque de 96 puits u-fond. Volume final par l’État est maintenant 130 µl et la concentration d’agrégats de colorant-tau pH est de 250 nM. Flasque de la dilution et incuber pendant la nuit à 37 ° C.
- Retirer le support de plaque cellulaire et remplacer avec 150 µL de milieu de culture additionné de 200 héparine µg/mL. Incuber les plaques pendant une nuit à 37 ° C et 5 % de CO2.
-
Jour 4 – absorption Immunocomplexes
- Enlever milieu de culture des cellules BV-2. Transférer 125 µL d’immunocomplexes dans les cellules à l’aide d’une pipette multicanaux.
- Incuber les cellules avec l’immunocomplexes pendant 1 h et 45 min à 37 ° C, avec 5 % de CO2.
Tacher les noyaux des cellules avec un colorant spécifique d’ADN et les organites acides avec une sonde qui taches sélectivement les compartiments cellulaires à pH faible. Incuber les cellules 15 min à 37 ° C, avec 5 % de CO2.
NOTE : Diluer les colorants dans la GFD. - Effectuer des cellules vivantes d’imagerie utilisant une teneur élevée en système confocal de dépistage. Réglez la température à 37 ° C et 5 % de CO2. Pour des images de haute qualité, utiliser un objectif à immersion d’eau X 63 et acquérir 0,5 µm avions (20 / Z-pile) par champ imagé.
Résultats
Agrégées tau recombinante a été qualifié par liaison covalente avec un colorant vert sensibles au pH. Ce colorant augmente considérablement sa fluorescence après son internalisation dans les organites acides, permettant ainsi à la quantification intracellulaire. Tau étiquetées agrégats ont été incubées avec des anticorps monoclonaux anti-tau. En particulier, nous avons utilisé une version chimérique (région de Fc IgG1 de souris) de CBTAU-28.1. Cet anticorps humain se lie à la région N-terminale d’insertion de tau et est capable de se lier en vitro généré tau fibrilles13. Dans ce test, nous avons aussi testé une version améliorée à l’affinité du CBTAU-28,1 – dmCBTAU-28,1. Fragments Fab de CBTAU-28.1, chez le mutant parental et haute affinité format et une souris IgG1 isotype contrôle ont été utilisés comme contrôle.
BV-2 cellules ont été incubées avec l’immunocomplexes préformé ou agrégées seul pendant deux heures en présence d’héparine pour bloquer l’absorption anticorps indépendante tau tau. Après incubation, les cellules ont été trypsinisées pour supprimer le tau liée à la membrane extracellulaire et ont été analysés pour l’absorption de tau par cytométrie en flux. Comme nous l’a récemment décrit13, nous avons observé que l’absorption variantes promus CBTAU-28.1 de tau dans les cellules BV-2 d’une manière dose-dépendante. L’absorption est Fc médié puisque des fragments Fab CBTAU-28,1 n’a pas augmenté l’absorption tau basale (Figure 2). En outre, l’anticorps dmCBTAU-28.1 de haute affinité médiée par absorption de tau dans les cellules BV-2 à un degré plus élevé que les anticorps de type sauvage (Figure 2).
Absorption de tau humoral et localisation des agrégats de tau dans le compartiment d’endolysosomal a été confirmée par microscopie confocale (Figure 3) où le compartiment cellulaire acide était Taché en utilisant une sonde sélective des organites à pH faible. Examen intracellulaire de colorant vert pH étiqueté tau agrégats ont été observés à l’intérieur des cellules qui ont été incubées avec CBTAU-28.1. En outre, agrégats de tau intracellulaire souvent colocalisé avec le pH bas compartiment sélective colorant rouge suggérant ainsi la présence d’agrégats de tau dans les organites acides. Des fragments Fab CBTAU-28,1 n’a pas augmenté l’absorption tau indiquant encore une fois un mécanisme d’internalisation médiée par le récepteur Fc (Figure 3).
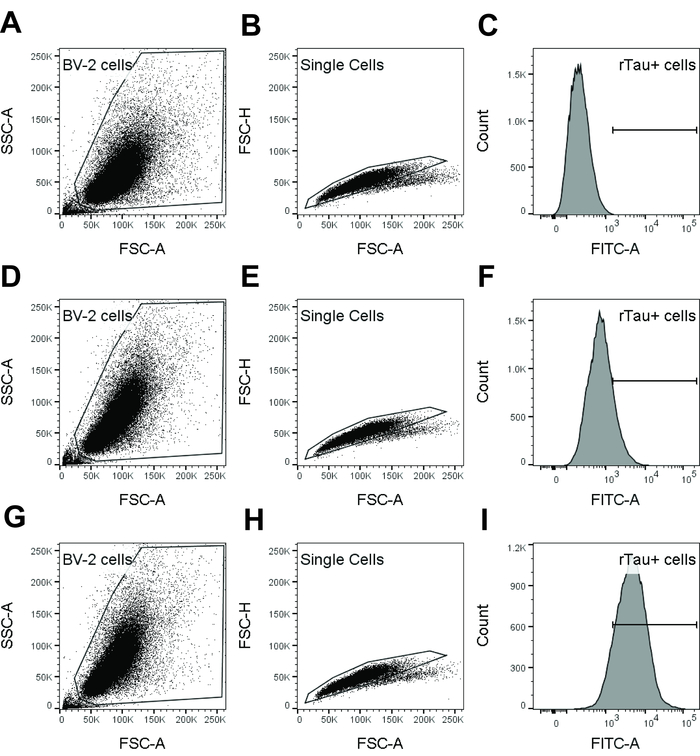
Figure 1 : Gating stratégie utilisée en analyse en cytométrie en flux pour détecter l’internalisation de tau par cellules BV-2. Echantillons de BV-2 contrôle seul (A-C), le contrôle de l’isotype (D-F) et dmCBTAU-28.1 (G-j’ai) sont indiqués. Population de cellules BV-2 a été fermée sur une parcelle de SSC-A densité de FSC-A vs à l’exclusion des débris et des cellules mortes (A, D, G). BV-2 cellules étaient alors encore bloquées sur un terrain de densité de FSC-A vs FSC-H d’exclure les doublets de cellule et agrégats (B, E, H). Porte cellule unique est utilisée pour générer un histogramme de paramètre unique de colorant (FITC dans ces résultats représentatifs) pH (C, F, I) et déterminer l’intensité de fluorescence moyenne géométrique. Alternativement, pourcentage de cellules positives de colorant-tau pH a été calculé à l’exclusion des cellules négatives, tel que déterminé à l’aide de BV-2 contrôle seul. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
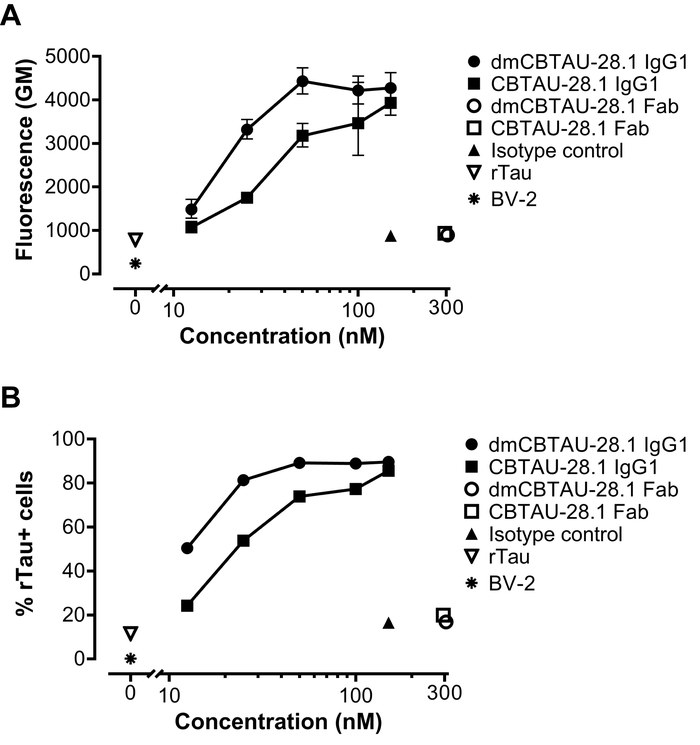
Figure 2 : CBTAU-28,1 intervient dans l’absorption des agrégats de tau dans les cellules microgliales BV-2. Agrégées tau recombinante a été par covalence étiqueté avec des colorants sensibles au pH fluorescence verte et incubée avec une version de souris chimériques de l’anticorps anti-tau humain CBTAU-28.1, son format amélioré d’affinité, dmCBTAU-28.1, fragments du Fab correspondante, un anticorps de contrôle d’isotypes IgG1 de souris ou pas d’anticorps (agrégats de tau seuls). IMMUNOCOMPLEXES sont ensuite incubées avec cellules BV-2 pendant deux heures en présence d’héparine pour bloquer l’absorption anticorps indépendante tau. L’absorption des immunocomplexes a été mesurée par cytométrie et exprimée comme la moyenne géométrique (GM) de l’intensité de la fluorescence (A) ou le pourcentage de tau positive (tau +) (B) des cellules. Barres d’erreur (a) indiquent l’écart de deux expériences indépendantes, tandis que (B) indique une seule expérience. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
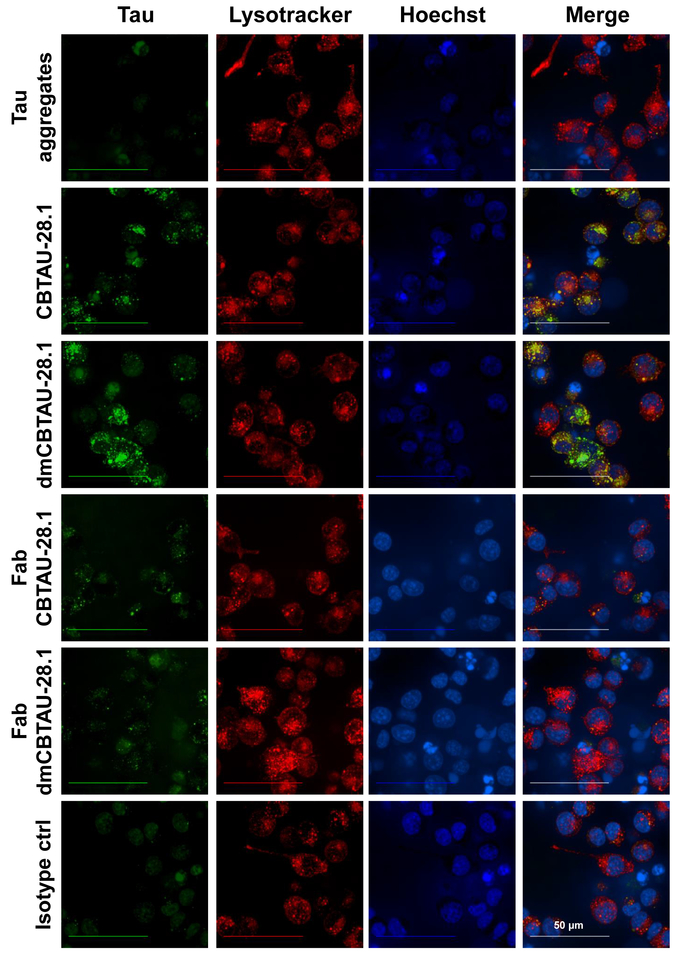
Figure 3 : agrégats de Tau sont internalisés par BV-2 cellules et localiser dans les organites cellulaires acides. Immunocomplexes tau-anticorps préformés sont incubées avec cellules BV-2 pendant deux heures en présence d’héparine pour bloquer l’absorption anticorps indépendante. Après incubation, les noyaux ont été colorés avec un colorant bleu spécifique de l’ADN et le compartiment cellulaire acide avec un colorant rouge sélective de compartiment à pH faible. Imagerie de cellules vivantes a révélé punctums intracellulaire des agrégats de tau étiquetées (verts) à l’intérieur des cellules qui ont été incubées avec CBTAU-28,1 et dmCBTAU-28.1, mais pas avec le contrôle de l’isotype. En outre, agrégats de tau intracellulaire souvent colocalisés avec le rouge colorant (jaunes), suggérant ainsi la présence d’agrégats de tau dans le compartiment cellulaire acide. Des fragments Fab CBTAU-28,1 n’a pas augmenté l’absorption tau indiquant un mécanisme d’internalisation médiée par le récepteur Fc. Images représentent les projections d’intensité maximale d’un Z-pile (avions de 0,5 µm) de 20 avions acquises avec un objectif à immersion d’eau X 63. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Cellules microgliales, cellules immunitaires du cerveau résident, ont été récemment identifiés comme des acteurs importants humorale des approches thérapeutiques pour tauopathies10,11. Clairance de tau humoral de microglie, avec blocage de capture neuronale9, l’inhibition ou la déstabilisation de la fibrille formation13,14 et le dédouanement des fibrilles intraneuronal via la lysosomal parcours15, tous pourraient contribuer à l’efficacité de l’anticorps anti-tau observée chez le modèle murin de tauopathy5,6,7,8,9.
Nous avons décrit ici un test cell pour évaluer quantitativement l’absorption tau par la microglie dans le but de créer un outil expérimental pour mieux caractériser les mécanismes d’action des anticorps anti-tau.
Ce test, adapté du Funk et al. 11, utilise des cellules de BV-2, qui sont les cellules microgliales murine immortalisées. Alors qu’ils ne peuvent pas complètement être comparés aux cellules microgliales primaire, elles disposent de bon nombre des caractéristiques des microglies primaire, y compris la capacité de manière robuste phagocytent Aβ et tau fibrilles11,16,17 ,18,19. En outre, ils ont montré un comportement reproductible in vitro qui les rend très approprié pour le développement de l’analyse et les études quantitatives, qui nécessitent la variabilité expérimentale minimale. À côté de cela, les lignées cellulaires immortalisées permettent des débits plus élevés de dosage et éliminent la nécessité de sacrifices d’animaux par rapport à l’usage des microglies primaire.
Les agrégats de tau, que nous avons utilisé dans cet essai ont été obtenues à l’aide de la procédure agrégation hautement reproductible in vitro que nous avons décrite récemment13et voir la morphologie similaire à jumelé filaments hélicoïdaux (FHJ) isolées du cerveau des AD patients. Alors que nous n’avons pas observé aucun résultat inattendu qui pourrait avoir été causé par tau agrégats adhérence aux surfaces de plastique ou de verre, l’utilisation d’agrégats stables et bien caractérisé tau a joué un rôle crucial dans la reproductibilité de ce test.
Un autre aspect qui a contribué de manière significative à la reproductibilité de dosage est la densité cellulaire. Le nombre de cellules par puits décrits dans le protocole représente la densité cellulaire optimale dans les conditions décrites.
Contrairement à ce que Funk et al. 11 décrit, nous tau agrégats marqués avec un colorant sensible de pH, ce qui augmente considérablement sa fluorescence après internalisation dans les organites acides, ce qui permet la quantification intracellulaire. Ceci, ainsi que la digestion trypsique de surface liées immunocomplexes et/ou tau, garanties ce signal de fluorescence mesurée par cytométrie en flux est le résultat de l’absorption de tau plutôt que la liaison à la surface cellulaire. En outre, l’utilisation d’une facilite de colorant photosensible pH détection d’agrégats de tau intériorisée dans des expériences de microscopie sans avoir besoin de digérer la surface bondissent agrégats immunocomplexes/tau qui seraient ensuite nécessite cellule modification des plaques et récupération.
Nous avons aussi encore optimisé l’affichage de microscopie de notre essai, par rapport à ce qui a été précédemment décrit11, en utilisant un colorant très sélectif pour les organites acides dans nos expériences de microscopie qui nous a permis non seulement de confirmer humoral absorption de Tau, mais aussi la localisation des agrégats de tau dans le compartiment d’endolysosomal.
Le test, nous avons développé, a une spécificité optimale qui se traduit par une bonne fenêtre expérimentale permettant une séparation forte entre les échantillons positifs et négatifs. Fait intéressant, le test détecte indirectement les différences affinité anticorps, ce qui représente un outil puissant pour étudier les fonctions effectrices anticorps anti-tau.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier Alberto Carpinteiro Soares pour son aide technique.
matériels
| Name | Company | Catalog Number | Comments |
| BV-2 cells | ICLC Interlab Cell Line Collection | ATL03001 | |
| Phosphate Buffered Saline (PBS) (1x) | Gibco | 10010-015 | |
| Trypsin-EDTA 0.05% | Gibco | 25300-054 | |
| DMEM 4.5 g/dL glucose | Gibco | 41966-029 | |
| Fetal Bovine Serum | Gibco | 10091-148 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| L-Glutamine 200 mM | Lonza | 17-605E | |
| EasYFlask | Nunc | 156499 / 159910 | |
| pHrodo Green STP ester | Life Technologies | P35369 | |
| Sodium Bicarbonate pH 8.5 100 mM | |||
| DMSO | Sigma | D2650-100ml | |
| PD10 columns | GE Healthcare | 17-0851-01 | |
| BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Greiner CELLSTAR multiwell culture plates | Greiner | 665180 | |
| Falcon 96-Well Assay Plates | Falcon | 353910 | |
| Heparin | Sigma | H3393-50KU | |
| Trypsin-EDTA 0.25% | Sigma | T4049-100ml | |
| BSA | Sigma | A7030-100G | |
| EDTA 0.5 M, pH8 | |||
| FACS Canto II | BD | ||
| Hoechst 33342 Solution (20 mM) | Thermo Fisher Scientific | 62249 | |
| LysoTracker Deep Red | Thermo Fisher Scientific | L12492 | |
| Opera Phenix | Perkin Helmer | HH14000000 |
Références
- Hefti, F., Goure, W. F., Jerecic, J., Iverson, K. S., Walicke, P. A., Krafft, G. A. The case for soluble Aβ oligomers as a drug target in Alzheimer's disease. Trends in Pharmacological Sciences. 34 (5), 261-266 (2013).
- Castillo-Carranza, D. L., Lasagna-Reeves, C. A., Kayed, R. Tau aggregates as immunotherapeutic targets. Frontiers in bioscience (Scholar edition). 5, 426-438 (2013).
- Martin, L., Latypova, X., Terro, F. Post-translational modifications of tau protein: Implications for Alzheimer's disease. Neurochemistry International. 58 (4), 458-471 (2011).
- Holmes, B. B., Diamond, M. I. Prion-like properties of Tau protein: The importance of extracellular Tau as a therapeutic target. Journal of Biological Chemistry. 289 (29), 19855-19861 (2014).
- Giacobini, E., Gold, G. Alzheimer disease therapy--moving from amyloid-beta to tau. Nature Reviews Neurology. 9 (12), 677-686 (2013).
- Asuni, A. A., Boutajangout, A., Quartermain, D., Sigurdsson, E. M. Immunotherapy targeting pathological tau conformers in a tangle mouse model reduces brain pathology with associated functional improvements. Journal of Neuroscience. 27 (34), 9115-9129 (2007).
- Boutajangout, A., Ingadottir, J., Davies, P., Sigurdsson, E. M. Passive immunization targeting pathological phospho-tau protein in a mouse model reduces functional decline and clears tau aggregates from the brain. Journal of Neurochemistry. 118 (4), 658-667 (2011).
- Chai, X., et al. Passive immunization with anti-Tau antibodies in two transgenic models: reduction of Tau pathology and delay of disease progression. Journal of Biological Chemistry. 286 (39), 34457-34467 (2011).
- Yanamandra, K., et al. Anti-tau antibodies that block tau aggregate seeding in vitro markedly decrease pathology and improve cognition in vivo. Neuron. 80 (2), 402-414 (2013).
- Luo, W., Liu, W., Hu, X., Hanna, M., Caravaca, A., Paul, S. M. Microglial internalization and degradation of pathological tau is enhanced by an anti-tau monoclonal antibody. Scientific Reports. 5, 11161 (2015).
- Funk, K. E., Mirbaha, H., Jiang, H., Holtzman, D. M., Diamond, M. I. Distinct Therapeutic Mechanisms of Tau Antibodies: Promoting Microglial Clearance Versus Blocking Neuronal Uptake. Journal of Biological Chemistry. 290 (35), 21652-21662 (2015).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf/v-myc carrying retrovirus. Journal of neuroimmunology. 27 (2-3), 229-237 (1990).
- Apetri, A., et al. A common antigenic motif recognized by naturally occurring human VH5-51/VL4-1 anti-tau antibodies with distinct functionalities. Acta neuropathologica communications. 6 (1), 43 (2018).
- Schneider, A., Mandelkow, E. Tau-based treatment strategies in neurodegenerative diseases. Neurotherapeutics. 5 (3), 443-457 (2008).
- Congdon, E. E., Gu, J., Sait, H. B., Sigurdsson, E. M. Antibody uptake into neurons occurs primarily via clathrin-dependent Fcgamma receptor endocytosis and is a prerequisite for acute tau protein clearance. Journal of Biological Chemistry. 288 (49), 35452-35465 (2013).
- Bocchini, V., Mazzolla, R., Barluzzi, R., Blasi, E., Sick, P., Kettenmann, H. An immortalized cell line expresses properties of activated microglial cells. Journal of Neuroscience Research. 31 (4), 616-621 (1992).
- Koenigsknecht, J. Microglial Phagocytosis of Fibrillar β-Amyloid through a β1 Integrin-Dependent Mechanism. Journal of Neuroscience. 24 (44), 9838-9846 (2004).
- Kopec, K. K., Carroll, R. T. Alzheimer's β-Amyloid Peptide 1-42 Induces a Phagocytic Response in Murine Microglia. Journal of Neurochemistry. 71 (5), 2123-2131 (2002).
- Marsh, S. E., et al. The adaptive immune system restrains Alzheimer's disease pathogenesis by modulating microglial function. Proceedings of the National Academy of Sciences of the United States of America. 113 (9), E1316-E1325 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon