Method Article
Production, Purification et contrôle de la qualité pour les vecteurs de base de Virus Adeno-associé
Dans cet article
Résumé
Nous décrivons ici une stratégie efficace et reproductible pour produire, titre et contrôle de la qualité des lots de vecteurs de virus adeno-associé. Il permet à l’utilisateur d’obtenir une préparation de vecteur avec haut-titre (≥1 x 1013 vecteur génomes/mL) et une grande pureté, prêt à être utilisé in vitro ou in vivo .
Résumé
Outils de livraison de gène issus des virus adéno-associés (AAVs) sont un choix populaire pour la livraison des transgènes au système nerveux central (CNS), y compris les applications de la thérapie génique. Des vecteurs d’AAV sont non répliquées, capable d’infecter des cellules en division et non de division et de fournir l’expression transgénique à long terme. Ce qui est important, certains sérotypes, tels que le PHP nouvellement décrit. B, peut traverser la sang-encéphalique (BHE) dans des modèles animaux, après délivrance systémique. Des vecteurs d’AAV peuvent être efficacement produites en laboratoire. Cependant, les protocoles robustes et reproductibles sont tenus d’obtenir des vecteurs d’AAV avec des niveaux suffisants de pureté et de valeurs titre suffisamment élevées pour des applications in vivo . Ce protocole décrit une stratégie efficace et reproductible pour la production de vecteur AAV, basée sur une stratégie de purification gradient d’iodixanol. La méthode de purification iodixanol est adaptée pour l’obtention de lots de vecteurs AAV haut-titre de haute pureté, par rapport aux autres méthodes de purification. En outre, le protocole est généralement plus rapide que les autres méthodes actuellement décrites. En outre, une quantitative polymerase chain réaction (qPCR)-basé de stratégie est décrite pour la détermination rapide et précise de la titre de vecteur, ainsi qu’une méthode de coloration à l’argent déterminer la pureté du lot vector. Enfin, des résultats représentatifs de l’injection de gène dans le SNC, suite à l’administration systémique d’AAV-PHP. B, sont présentés. Ces résultats devraient être possibles dans tous les laboratoires utilisant les protocoles décrits dans cet article.
Introduction
Au cours des 30 dernières années, AAVs sauvage ont été conçus pour créer des vecteurs d’AAV recombinants, qui sont sont avérées pour être des outils extrêmement utiles pour le transfert de gène dans les CNS1,2,3,4, 5,6 et la thérapie génique s’approche de la maladie (y compris les thérapies et EMA-approuvé par la FDA)4,7. Leur aptitude à l’emploi dans le système nerveux central provient en grande partie de leur capacité à infecter des cellules post-mitotiques, non de division, on trouve généralement dans le CNS8. Cependant, les vecteurs AAV-basés ont également l’avantage de permettre une expression à long terme de toute donnée de transgènes thérapeutiques4,9 , tout en suscitant une réponse immunitaire plus douce par rapport aux autres vecteurs viraux7, 8,10,11,12.
Les principaux éléments d’un vecteur AAV sont le génome et la capside. AAVs sauvage sont monocaténaires (ss) virus à ADN avec un génome d’environ 5 kilobases (kb)13. Pour la production des vecteurs d’AAV recombinants, les gènes de rep et de cap (nécessaires pour la réplication du génome et l’assemblage de la capside virale) sont supprimés à partir du génome de l’AAV sauvage et prévues en trans, laissant la place à une cassette d’expression contenant le transgène14,15. Les ordres terminaux répétition inversées (ITRs) du génome viral initial sont les seuls éléments conservés dans un vecteur AAV, car celles-ci sont essentielles pour la réplication et l’emballage de3,10,14. Des vecteurs d’AAV peuvent être conçues pour amplifier l’expression du transgène ; une mutation dans l’un de l’ITRs conduit à la formation d’une boucle en épingle à cheveux qui effectivement permet la génération d’un ADN complémentaire brin3,7,15. Le principal avantage de cette configuration, appelée un génome complémentaires (sc), est qu’il contourne la nécessité pour la synthèse du deuxième brin typique dans le cycle de vie classique de AAVs, augmentant considérablement la vitesse et les niveaux d’expression de transgènes 1. Néanmoins, à l’aide d’un génome de scAAV réduit la capacité de chargement du vecteur à environ 2,4 kb. Cela inclut des séquences de transgène, ainsi que des séquences régulatrices telles que des promoteurs ou des sites de liaison de micro-ARN, afin de limiter l’expression de types spécifiques de cellules16.
La capside AAV détermine l’interaction de cellule hôte-vecteur et confère un niveau de tropisme cellulaire de type ou de tissu pour un sérotype AAV, qui peut également être exploitée afin de limiter l’expression du transgène à des emplacements spécifiques. Plusieurs sérotypes d’AAV sont trouvent dans la nature, tandis que d’autres ont été produites dans des laboratoires à travers des approches recombinants (c.-à-d., PHP. B). en outre, certains capsides confèrent également autres caractéristiques utiles, telles que la capacité à traverser la BHE, résultant dans la prestation des transgènes dans tout le système nerveux central après administration systémique. Ceci a été démontré pour la AAV9, ainsi que pour le PHP récemment décrit. B capside17. En conséquence, ces sérotypes sont avèrent particulièrement pertinentes pour de nouvelles approches de thérapie génique pour neurodégénératives troubles1,17,18.
Le but du présent protocole est de décrire une méthode rentable pour la production à petite échelle des vecteurs d’AAV avec titre élevé et la pureté. Bien que les résultats présentés ici utilisent le PHP. B capside et une cassette d’expression scAAV, le protocole est convenable pour la production de plusieurs sérotypes de vecteur d’AAV et configurations de génome, ce qui permet une flexibilité maximale expérimentale. Toutefois, le rendement de vecteur et de la pureté finale peuvent varier selon le sérotype choisi.
Le protocole lui-même est une variante de la méthode de tri-transfection classique pour la production de vecteurs viraux et incorpore l’utilisation d’un gradient d’iodixanol pour vecteur nettoyage, qui, par rapport à l’utilisation classique de gradients de césium de chlorure (CsCl), a été rapporté des vecteurs d’AAV de pureté supérieure à un temps plus efficace manière19,20,21.
Les étapes de la transfection, purification et concentration sont destinées à être effectuées selon les bonnes pratiques de laboratoire (bpl) dans un laboratoire de culture tissulaire conçu au travail vecteur viral. Chaque tâche doit être exécutée en conformité avec la législation locale et nationale concernant la production de vecteurs viraux et utiliser. Travail doit être effectué sous une hotte à flux laminaire et dans des conditions stériles. À l’intérieur de l’installation de vecteur, il est recommandé de porter un tablier de laboratoire, en plus de la blouse de laboratoire réguliers de culture tissulaire. Par ailleurs, une double paire de gants, ainsi que les couvre-chaussures en plastique, il faut porter en tout temps.
Avant de commencer la production de vector, s’assurer que tout l’équipement nécessaire et plasmides sont disponibles. 1) pCapsid plasmide contient le gène rep qui encode quatre protéines non structurelles nécessaires pour la réplication, à savoir Rep78, Rep68, Rep52 et Rep40 et le gène de la PAC qui encode les trois protéines de la capside structurelle, à savoir VP1, VP2 et VP3. 2) pHelper plasmide contient les gènes E4, E2Aet VA de l’adénovirus, qui facilitent la production de cellules HEK293T AAV. 3) pTransgene plasmide contient la cassette d’expression de transgènes, flanquée de deux RTI. Ces plasmides peuvent être synthétisés de novo dans le laboratoire à l’aide de séquences disponibles en ligne22. Pour les plasmides, faites de novo, surtout ceux contenant des transgènes roman, séquençage est nécessaire, pour s’assurer que le transgène et la RTI est corrects. Alternativement, premade plasmides peuvent être directement acquises par le biais de dépôts de plasmide en ligne. Lorsque cela est nécessaire, les plasmides peuvent être amplifiés et purifié à l’aide de kits standard, selon instructions23 les directives du fabricant.
Titre de vecteur et de la pureté peuvent compromettre la capacité de transduction du vecteur. Protocoles additionnels sont fournis pour évaluer la qualité du produit vecteur. Les vecteurs finales sera utiles pour l’étude de la fonction de cellule de CNS dans des applications aussi bien in vitro et in vivo .
Protocole
| Solution | Composition | |
| Culture de cellule et de transfection | ||
| DMEM1 | DMEM 1 x | |
| 1 % (v/v) de SVF | ||
| 1 % (v/v) de GlutaMAX | ||
| DMEM10 | DMEM 1 x | |
| 10 % (v/v) de SVF | ||
| 1 % (v/v) de GlutaMAX | ||
| NaCl 150 mM | 4,380 g NaCl | |
| Jusqu'à 500 mL d’eau Ultrapure | ||
| Purification de l’AAV et dessalage | ||
| 5 M NaCl | 146,1 g NaCl | |
| Jusqu'à 500 mL d’eau Ultrapure | ||
| 1 M Tris HCl (pH 8,5) | base de Tris 12,11 g | MISE EN GARDE |
| Jusqu'à 100 mL d’eau Ultrapure | ||
| Ajouter 1 M HCl à l’aide d’une pipette Pasteur pour réduire le pH de 8,5 | ||
| Tampon de lyse | 15 mL de NaCl 5 M | |
| 25 mL de 1 M Tris HCl (pH 8,5) | MISE EN GARDE | |
| Jusqu'à 500 mL d’eau Ultrapure | ||
| 10 x solution saline tamponnée au Phosphate (PBS) | 80 g de NaCl | |
| 2 g de KCl | MISE EN GARDE | |
| 14,4 g Na2HPO4 | ||
| 2.4 g KH2PO4 | ||
| Jusqu'à 1 L d’eau dd | ||
| 1 M MgCl2 | 20,33 g MgCl2-6 H2O | |
| Jusqu'à 100 mL d’eau Ultrapure | ||
| 1 M KCl | 7,45 g KCl | MISE EN GARDE |
| Jusqu'à 100 mL d’eau Ultrapure | ||
| 5 x solution mère PBS magnésium-Potassium (PBS-MK) | 250 mL de PBS de x 10 | |
| 2,5 mL de 1 M du MgCl2 | ||
| 6,25 mL de KCl 1 M | MISE EN GARDE | |
| Vers le haut jusqu'à 500 mL H2O d’eau Ultrapure | ||
| 15 % Iodixanol | 12,5 mL de milieu gradient de densité Optiprep | MISE EN GARDE |
| 10 mL de NaCl 5 M | ||
| 10 mL de 5 x PBS-MK | ||
| 17,5 mL d’eau Ultrapure | ||
| 25 % Iodixanol | 20,8 mL de milieu gradient de densité Optiprep | MISE EN GARDE |
| 10 mL de 5 x PBS-MK | ||
| 19,2 mL d’eau Ultrapure | ||
| 100 µL de rouge de phénol | ||
| 40 % Iodixanol | 33,3 mL de milieu gradient de densité Optiprep | MISE EN GARDE |
| 10 mL de 5 x PBS-MK | ||
| 6,7 mL d’eau Ultrapure | ||
| 60 % Iodixanol | 50 mL de milieu gradient de densité Optiprep | MISE EN GARDE |
| 100 µL de rouge de phénol | MISE EN GARDE | |
| Contrôle de pureté AAV | ||
| 10 x de tampon Tris acétate EDTA (thé) | base de Tris de 44,8 g | MISE EN GARDE |
| 11,4 mL d’acide acétique glacial (17.4M) | ||
| 3,7 g EDTA | ||
| Eau Ultrapure L jusqu'à 1 | ||
| Gel d’agarose | Ultrapure agarose 0,8 g | |
| Jusqu'à 100 mL de tampon de thé 1 x | ||
| Tampon de gel | base de Tris 181,7 g | MISE EN GARDE |
| 1,5 g de SDS | MISE EN GARDE | |
| Ajuster le pH à 8 h 45 avec du 1 HCl M | MISE EN GARDE | |
| Jusqu'à 500 mL d’eau Ultrapure | ||
| Cathode tampon x 10 | base de Tris 121,14 g | MISE EN GARDE |
| 179,2 g Tricine | MISE EN GARDE | |
| SDS 1 % (p/p) | MISE EN GARDE | |
| Eau Ultrapure L jusqu'à 1 | ||
| Anode de tampon x 10 | base de Tris de 242,3 g | MISE EN GARDE |
| Eau Ultrapure L jusqu'à 1 | ||
| Ajuster le pH à 8,9 avec du 1 HCl M | MISE EN GARDE | |
| Échantillon de tampon x 5 | Pour 20 mL : | |
| 605 mg [base Tris | MISE EN GARDE | |
| 4 g SDS | MISE EN GARDE | |
| 10 mg Serva bleu G | ||
| 12 g de glycérol | ||
| Ajuster le pH à 6,8 avec 1 M HCl, aliquote et conserver à-20 ° C | MISE EN GARDE | |
| Gel de concentration | Pour les 2 gels : | |
| Acrylamide 400 µL | MISE EN GARDE | |
| 750 µL de tampon de gel | ||
| 1,85 mL d’eau Ultrapure | ||
| 4 ΜL TEMED | MISE EN GARDE | |
| 20 % de 10 µL APS (v/v) | MISE EN GARDE | |
| Ajouter TEMED et 10 % APS immédiatement avant de verser le gel. Utiliser les deux produits chimiques sous une hotte chimique. | ||
| Résolution de gel | Pour les 2 gels : | |
| acrylamide 3,32 mL | MISE EN GARDE | |
| tampon de gel 3,35 mL | ||
| 1,14 mL d’eau Ultrapure | ||
| 2,12 mL 50 % de glycérol | ||
| 6 ΜL TEMED | MISE EN GARDE | |
| 50 % de 10 µL APS (p/v) | MISE EN GARDE | |
| Ajouter TEMED et 10 % APS immédiatement avant de verser le gel. Utiliser les deux produits chimiques sous une hotte chimique. | ||
| Butanol saturée d’eau | 10 mL de n-butanol | MISE EN GARDE |
| 1 mL d’eau Ultrapure | ||
| Mise en garde : Se référer à la Table des matières pour connaître les instructions sur l’utilisation de produits chimiques dangereux. | ||
Tableau 1 : Composition des solutions requises.
1. Tri-transfection de cellules HEK293T
Remarque : Veuillez vous reporter au tableau 1 pour la composition des tampons et solutions utilisées dans le protocole.
Remarque : Exécution de la présente section du protocole a environ 4 jours.
- Décongeler un flacon de cellules 293 t rein embryonnaire humain (HEK) dans un bain d’eau réglé à 37 ° C.
Remarque : Utilisez uniquement les cellules qui ont été repiquées de moins de 20 x pour garantir une efficacité optimale de la transfection. - Pétri de cellules cellules HEK293T semences à une densité de 2 x 103 6 x 103 cellules/cm2 en DMEM10 de 15 cm de diamètre.
- Cultiver les cellules à confluence de 70 à 80 % dans un incubateur standard fixé à 37 ° C, avec 95 % d’humidité et 5 % de CO2.
Remarque : La production d’un lot de vecteurs AAV utilisant ce protocole nécessite 18 récipients de culture cellulaire (15 cm de diamètre). Une confluence de cellules de 70 à 80 % correspond à 6 x 103 à 7 x 103 cellules/cm2, maintenu en 17-20 mL de milieu de culture DMEM10. -
Préparer le polyéthylènimine (PEI) / ADN mix à un ratio de concentration 1/3.5 (w/w).
- Préparer le mélange de l’ADN pour 18 récipients de culture de cellules dans un tube conique de 50 mL en mélangeant 360 µg de 180 µg de pTransgene en 18 mL de NaCl 150 mM, 180 µg de pCapsid et pΔF6.
- Répartir le mélange de l’ADN sur trois tubes conique de 50 mL (6 mL d’ADN mélanger par tube à fond conique).
- Préparer le mélange de PEI pour six cellule pétri dans un nouveau tube conique de 50 mL en mélangeant 840 µg de PEI (1 µg/µL) dans 6 mL de NaCl 150 mM.
- Préparer le mélange de PEI/ADN en ajoutant 6 mL du mélange PEI (préparé à l’étape 1.4.3), goutte à goutte, à l’un des tubes coniques contenant le mélange de l’ADN (préparé à l’étape 1.4.2) et incuber pendant 20 min à température ambiante.
Remarque : Après 20 min d’incubation, le mélange de PEI/ADN deviendra légèrement trouble.
- Prenez six récipients de culture cellulaire hors de l’incubateur et aspirer complètement le milieu de chaque boîte de pétri dans une hotte à flux laminaire. Éliminer les traces du milieu en rinçant la vaisselle avec 5 mL de solution saline tamponnée au phosphate de Dulbecco préchauffée (SPD).
- Assurer la distribution de SPD sur toute la surface en inclinant légèrement le plat.
- Doucement, aspirer le SPD et ajouter 12 mL de DMEM1 à chaque plat.
Remarque : Évitez de détachement des cellules en ajoutant le support lentement, d’une pipette placée au bord du plat. - La composition de la PEI/ADN de pipetage et descendre 3 x - 5 x. Ajouter 2 mL du mélange PEI/ADN de chacun des six cellules culture plats d’une manière de goutte à goutte, soigneusement le distribuer sur toute la surface. Une fois que le mélange est ajouté à chaque plat, replacez la vaisselle dans l’incubateur. Répétez les étapes 1.4.3– 1.8 pour les récipients de culture restants.
- Incuber les cellules transfectées pendant 5 h à 37 ° C, humidité de 95 % et 5 % CO2.
- Ajouter 12 mL de DMEM10 supplémentaire pour chaque boîte de pétri sans enlever le support préexistant (volume moyen total = 25 mL).
- Incuber les cellules transfectées place de transfection après 72 h à 37 ° C, avec 95 % d’humidité et 5 % de CO2.
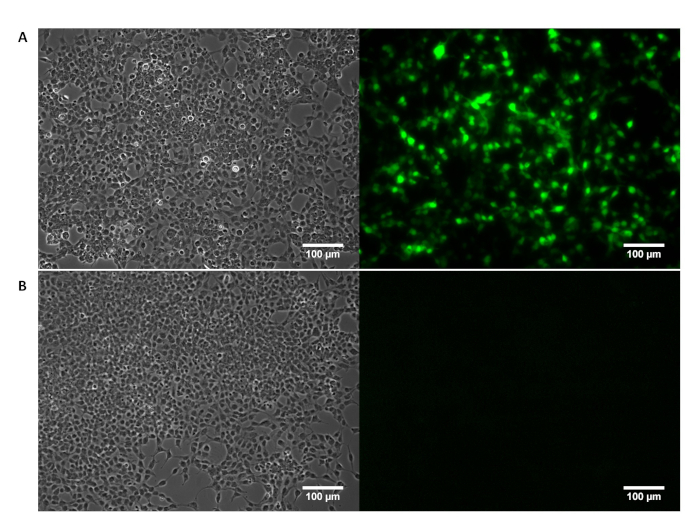
Supplémentaire Figure 1 : morphologie des cellules HEK 293 t visualisée par microscopie de contraste de phase (à gauche) avec confirmation de l’expression de la GFP visualisée par fluorescence imaging (droit). (A) réussie transfection de cellules HEK293T avec un encodage de GFP pTransgene est confirmée par imagerie de fluorescence. (B) HEK293T traitées uniquement avec des réactifs de transfection de cellules ne montrent aucune expression de la GFP. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Récolter le milieu et l’après transfection des cellules 72 h. Utilisez un grattoir de cellules pour détacher soigneusement les cellules de la boîte de Petri. Recueillir le milieu et les cellules dans un tube conique de 50 mL, gardé sur glace.
Remarque : Le contenu des deux plats de culture de cellules peut être recueilli dans un tube conique unique de 50 mL. À la fin de cette étape, chacun des neuf tubes contiendra environ 50 mL de milieu. - Centrifuger les tubes coniques à 420 x g pendant 10 min à 4 ° C, avec l’accélération et la décélération de la centrifugeuse réglée au maximum.
- Soigneusement éliminer le surnageant de chaque éprouvette. Ne pas utiliser les pipettes pour empêcher la perte de matériel. Au lieu de cela, doucement, versez le liquide surnageant dans un contenant de récupération et placer les tubes contenant des granulés de cellule retour sur la glace.
- Resuspendre chaque culot dans 2 mL de tampon de lyse directement dans le tube conique de 50 mL en pipettant également, haut et bas de 5 à 10 fois. Ne pas vortexer. Mettre en commun les lysats de trois tubes ensemble.
Remarque : À ce stade, il y aura trois tubes conique de 50 mL, un contenant chacun 6 mL des cellules remises en suspension dans un tampon de lyse.
2. Purification de vecteurs AAV
Remarque : Exécution de la présente section protocole prend environ 1 jour. Effectuez les opérations suivantes simultanément sur chacun des trois tubes 50 mL conique contenant les cellules resuspendues dans le tampon de lyse (voir la note précédente).
- Congeler et décongeler les cellules resuspendues 3 x leur lyse et de libérer les particules AAV. Effectuez l’étape congélation en plaçant les tubes dans un seau contenant de la glace sèche mélangée à l’éthanol. Effectuer la décongélation en plaçant immédiatement les cellules dans un bain d’eau réglé à 37 ° C.
- Après la troisième étape de dégel, centrifuger à 1 167 x g pendant 15 min à 4 ° C.
Remarque : Une boulette notable composée de débris cellulaires se formera. Lorsque vous manipulez les tubes, éviter les mouvements brusques car ceux-ci peuvent causer le détachement du culot dans le surnageant, ce qui compromettra la pureté du vecteur final. - Transvaser avec soin les surnageants pour nettoyer les tubes coniques de 50 mL, puis ajoutez la nucléase dans chaque tube, à une concentration finale de 50 U/mL surnageant.
- Incuber 30 min à 37 ° C. Agiter les tubes coniques de 50 mL à la main toutes les 10 min pour s’assurer que la nucléase est bien mélangée avec le surnageant.
- Clarifier le surnageant par centrifugation à 13 490 x g pendant 20 min à 4 ° C.
- Fixer un filtre de 0,45 µm à une seringue de 10 mL et placez-le sur le dessus un tube conique propre de 50 mL. Retirez le piston délicatement et remplir la seringue avec le surnageant de l’étape 2.5.
- Le piston permet de forcer le lysat à travers le filtre. Utiliser une seringue et un nouveau filtre pour chaque tube de liquide surnageant obtenu à l’étape 2.5.
Remarque : La fraction obtenue est connue comme « lysate brut ». - Préparer chacune des fractions iodixanol 15 %, 25 %, 40 % et 60 % dans les quatre tubes coniques séparé de 50 mL, selon les instructions fournies dans le tableau 1.
-
Préparer les gradients d’iodixanol dans trois tubes d’ultracentrifugation en utilisant l’ordre suivant des fractions iodixanol : 8 mL d’iodixanol de 15 %, 5,5 mL d’iodixanol de 25 %, 5 mL d’iodixanol de 40 % et 4,5 mL d’iodixanol de 60 %.
Mise en garde : Iodixanol peut causer une irritation des yeux, la peau et le tractus gastro-intestinal et respiratoire. Lors de la manipulation des gradients d’iodixanol, porter des gants et travailler sous une hotte à flux laminaire.- Pipetter 8 mL d’iodixanol de 15 % dans chaque tube d’ultracentrifugation.
- Pipetter 5,5 mL de solution d’iodixanol de 25 % dans un tube à fond conique propre 50 mL (Figure 1 a).
- Utiliser une pipette Pasteur non graduée (le cou du tube ultracentrifugation est trop étroit pour pipettes graduées classiques) à la couche soigneusement 5,5 mL de la solution d’iodixanol de 25 % inférieure à la solution d’iodixanol de 15 % (Figure 1 b).
Remarque : Ceci peut être réalisé avec succès en ajoutant l’iodixanol en trois étapes, étant donné que la pipette Pasteur ne peut contenir environ 2 mL. - Ajouter les solutions iodixanol de 40 % et 60 % comme indiqué au point 2.9.3. Ne pas déranger les interfaces iodixanol différents au cours de la stratification.
Remarque : La bonne préparation des fractions iodixanol différentes peut être assurée par une confirmation visuelle grâce au rouge de phénol, ajouté aux fractions iodixanol (consultez les instructions fournies dans le tableau 1). Chaque fraction ayant une densité spécifique, ils ne seront pas mélangez durant l’étape de stratification, lorsqu’ils sont effectués correctement (consultez la Figure 1).
- Couche du brut lysat au sommet de la pente de 15 % iodixanol avec une pipette Pasteur. Procéder goutte à goutte pour ne pas perturber l’interface entre le lysat brut et la solution iodixanol.
- Remplissez le tube d’ultracentrifugation avec tampon de lyse jusqu'à ce que le ménisque atteint la base du col tube pour s’assurer que le tube ne s’effondre pas sous les forces très élevées générées pendant l’ultracentrifugation (Figure 1).
- Fermer les tubes d’ultracentrifugation avec couvercle approprié. Utiliser une balance numérique pour s’assurer que tous les tubes d’ultracentrifugation trois ont le même poids. Ajuster le poids, si nécessaire, en ajoutant plus tampon de lyse sur le dessus le lysat « brut ».
Remarque : La différence de poids entre les tubes de l’ultracentrifugation doit être inférieure à 0,1 g pour assurer le fonctionnement sécuritaire de l’ultracentrifugeuse. Ultracentrifugeuses sont potentiellement dangereuses pièces d’équipement et ne doivent être utilisés que par un personnel correctement formé. - Centrifuger les tubes à 301 580 x g, en utilisant un rotor à angle fixe titane, pendant 1 h et 40 min à 12 ° C, avec une vitesse maximale d’accélération et de décélération.
-
Insérer une aiguille émoussée en acier inoxydable à l’interface d’iodixanol de 60 % et 40 %.
- Fixer l’aiguille d’une seringue de 5 mL (Figure 1E).
- Aspirer uniquement la fraction claire, contenant des particules de vecteur.
Remarque : Le volume total collecté est environ 2.5 à 3 mL. Éviter la collecte de matériel depuis l’interface de 25 à 40 %, puisque cela augmentera le niveau de contamination dans le lot de vecteur final, en raison de la présence de protéines indésirables. - Traiter la fraction collectée (dessalage et concentration) ou conserver toute la nuit à 4 ° C.

Figure 1 : configuration pour iodixanol purification dégradé et collection vector subséquentes. (A) avant de pipetage les gradients différents iodixanol dans le tube de l’ultracentrifugation, pipette un volume suffisant de chaque solution d’iodixanol dans un tube conique distinct. (B) puis utilisez un Pasteur pipetter à transférer séquentiellement chaque solution iodixanol au tube ultracentrifugation : couches iodixanol de plus en plus forte concentration doivent être ajoutées à la partie inférieure du tube sous les calques précédents. (C) couche vecteur brut lysat sur le dessus une fois le dégradé a été établie. Ce système de collecte de vecteur n’utilise pas d’aiguilles pointues, qui présentent un risque de « piqûres ». (D), un acier inoxydable 316-seringue aiguille est insérée dans le gradient d’iodixanol jusqu'à l’interface 40 % / 60 % iodixanol. Vector (E) des particules sont trouvent dans la phase d’iodixanol de 40 % et sont collectés. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
3. dessalement et Concentration du vecteur AAV
Remarque : Exécution de la présente section du protocole prend environ 2 h.
- Prérincer la membrane filtrante du filtre centrifuge en ajoutant 5 mL 1 x PBS-MK et centrifuger pendant 5 min à 4 000 x g.
- Ajouter 5 mL de 1 x PBS-MK à la fraction de vecteur AAV collectée, mélanger, puis ajouter le volume total du filtre. Lors de l’addition de 1 x PBS-MK, turbidité est observée. Centrifuger à 4 000 x g jusqu'à ce que le volume actuel sur le filtre conique a été réduit à 1 mL. Jeter le cheminement accumulé dans le tube de prélèvement extérieur.
- Ajouter 13 mL de 1 x PBS-MK au filtre conique et répétez la centrifugation étape autant de fois que nécessaire (minimum 3 x), jusque là n’est aucune turbidité plus observée lorsque frais 1 x PBS-MK est ajouté.
- Lors de la finale étape de lavage, ajouter 13 mL de PBS + surfactant non ionique de 0,01 % (v/v) et centrifuger à 4 000 x g jusqu'à ce que le volume est réduit à 300 – 350 µL.
- Recueillir la fraction restante présente sur le filtre en pipettant également, l’ensemble du volume dans un tube stérile microcentrifugeuse jupette.
Remarque : Cette fraction contient le vecteur d’AAV morue dessalée et concentré. Dans les étapes suivantes du présent protocole, cette fraction est dénommée la fraction « primaire ». N’oubliez pas de traiter le tube sous le capot et conserver à 4 ° C. - Rincer le filtre avec 200 µL de 1 x PBS-MK pour recueillir les particules résiduelles vecteur piégés dans le filtre. Rassembler dans un tube de microcentrifuge stérile.
Remarque : Il s’agit d’un stock de vecteur dilué, qui peut-être convenir à certaines applications nécessitant des titres de vecteur plus bas. Dans les étapes futures, cette fraction est dénommée la fraction « secondaire ». - Pour le stockage à court terme, stocker le procède de vecteur à 4 ° C (moins de 2 semaines). Aliquote et magasin le vecteur à ‑20 ° C lorsque l’entreposage à long terme est nécessaire.
- Effectuer le contrôle de la qualité tel que décrit à l’article 4.
4. titrage du vecteur par Quantitative Polymerase Chain Reaction
Remarque : Exécution de la présente section du protocole prend environ 3 h.
-
Courbe d’étalonnage
- Linéariser le plasmide exprimant le transgène (pTransgene) qui est utilisé pour la transfection des cellules HEK-293 t à l’article 1.
- Préparer le mélange de digérer de restriction dans un tube à microcentrifugation 0,5 mL (voir tableau 2 pour la composition du mélange restriction digest).
Remarque : Adapter la composition du mélange digest restriction selon l’enzyme utilisée et les directives y relatives du fabricant. - Incuber le mélange de digérer de restriction pendant 1 h à 37 ° C.
- Vérifier l’efficacité de la digestion de restriction en exécutant le plasmide linéarisé sur un gel d’agarose 0,8 % (p/v) à 100 V pour la digestion complète de 1 h. du plasmide devrait produire un seul fragment de taille définie.
- Purifier le plasmide linéaire ADN à l’aide d’un kit de purification de PCR, suite d’instructions du fabricant24, et mesurer la concentration d’ADN avec un spectrophotomètre en mesurant l’absorption à 260 nm. Après le titrage, et conserver l’aliquote restant du plasmide linéaire à ‑20 ° C pour une utilisation ultérieure.
- Le calcul suivant pour les molécules (c.-à-d. des copies de l’ADN) de l’encours de plasmide par microlitre.
- Tout d’abord, calculer le poids moléculaire du plasmide. En supposant que le poids moyen d’une paire de bases d’ADN (bp) est de 650 Daltons (Da) et qu’une mole d’un bp pèse 650 g, on peut estimer le poids moléculaire de n’importe quel modèle d’ADN double brin en prenant le produit de sa longueur (en PB) et le poids par paires de bases.
Poids moléculaire de plasmide [g/mol] = taille du plasmide [bp] x 650 [Da/bp] - Puis, calculez le nombre de moles du plasmide par microlitre.
Moles de plasmide par microlitre = concentration de plasmide [g/µL] / poids moléculaire de plasmide [g/mol]
Remarque : L’inverse de la masse moléculaire est le nombre de moles du plasmide présent dans 1 g de la matière. - Ensuite, calculez le nombre de molécules de plasmide par microlitre, à l’aide de nombre de d’Avogadro (6.022 x 1023 molécules/mole).
Molécules du plasmide par microlitre = moles de plasmide par microlitre [moles/µL] x nombre d’Avogadro [molécules/mole] - Enfin, diluer le stock de plasmides (molécules/µL) pour obtenir un 100 µL de solution avec la concentration désirée de 1 x 109 molécules (vecteur génomes (vg) par microlitre).
Stock de plasmide (100 µL) = (concentration souhaitée [molécules/µL] x 100 µL) / molécules de plasmide [molécules/µL]
- Tout d’abord, calculer le poids moléculaire du plasmide. En supposant que le poids moyen d’une paire de bases d’ADN (bp) est de 650 Daltons (Da) et qu’une mole d’un bp pèse 650 g, on peut estimer le poids moléculaire de n’importe quel modèle d’ADN double brin en prenant le produit de sa longueur (en PB) et le poids par paires de bases.
- Faire des dilutions successives du stock plasmide (1 x 109 vg/µL) en géométrie :
10 µL de stock de plasmide vg/µL9 1 x 10 + 90 µL d’H2O = 1 x 108 vg/µL de solution
10 µL de la dilution au vg/µL 1 x 108 + 90 µL d’H2O = 1 x 107 vg/µL de solution
10 µL de la dilution de 1 x 107 vg/µL + 90 µL d’H2O = 1 x 106 vg/µL de solution
10 µL de la dilution de 1 x 106 vg/µL + 90 µL d’H2O = 1 x 105 vg/µL de solution
Continuer obtenir une solution de vg/µL1 1 x 10. - Conservez les dilutions en série du stock standard plasmide sur la glace jusqu'à leur chargement sur la plaque de qPCR (section 4.3).
| Composant | Montant |
| 10 x tampon de l’enzyme de Restriction | 5 ΜL |
| Enzyme de restriction | 2,5 ΜL |
| Plasmide | 5 µg |
| H2O | jusqu'à 50 µL |
Tableau 2 : Composition du mélange digest de Restriction.
Tableau 3 : calculateur de volume pour le plasmide Stock. S’il vous plaît cliquez ici pour télécharger ce tableau.
-
Extraction de l’ADN du vecteur d’AAV
- Mélanger 2 µL de l’AAV vector stock (la fraction principale de l’étape 3.5) 198 µl de DNase I (1 x) de la mémoire tampon dans les tubes (tubes PCR) de la bande et ajouter 2 µL de DNase I.
Remarque : DNase qu'i va se dégrader tout matériel génétique qui n’est pas contenue à l’intérieur d’une capside vector (qui fausserait les résultats de qPCR). Cette solution est appelée dilution «dil1 x 10-2». - Incuber 30 min à 37 ° C, suivie de 10 min à 95 ° C.
Remarque : Le protocole peut être arrêté à ce stade et le matériel peut être conservé indéfiniment à 4 ° C, pour éviter la détérioration du produit. - Ajouter 2 µL de protéinase K dans la solution de dil1 x 10-2 (point 4.2.1) et incuber pendant 60 min à 50 ° C, suivie de 20 min à 95 ° C.
Remarque : Cette étape va démonter la capside de vecteur d’AAV et libérer le génome de vecteur d’AAV dans la solution. Ajouter la protéinase K en excès qu’on ne connaît pas la teneur de l’échantillon en protéines (capside). Remarque, il est essentiel de veiller à ce que toute l’activité de protéinase K est enlevée par dénaturation, avant qPCR, pour éviter les problèmes de dégradation de la polymérase (partielle) qui influencent le résultat final. - Préparer, 01:10 série de dilutions de la solution de dil1 x 10-2 de K traité protéinase (point 4.2.3) dans des tubes de microcentrifuge de 1,5 mL comme suit :
10 µL de dil1 x 10-2 + 90 µL d’H2O = dil1 x 10-3 dilution
10 µL de dil1 x 10-3 + 90 µL d’H2O = dil1 x 10-4dilution
10 µL of dil1 x 10-4 + 90 µL d’H2O = dil1 x 10-5 dilution - Garder les dilutions en série de l’ADN extrait du vecteur sur la glace jusqu'à leur chargement sur la plaque de qPCR (section 4.3).
- Mélanger 2 µL de l’AAV vector stock (la fraction principale de l’étape 3.5) 198 µl de DNase I (1 x) de la mémoire tampon dans les tubes (tubes PCR) de la bande et ajouter 2 µL de DNase I.
-
Titrage par qPCR axée sur la détection de SYBR Green
- Préparer le mélange maître qPCR dans un tube de microtubes de 1,5 mL, pour l’échantillon et les normes. Utiliser 10 µL de SYBR Green Master Mix, 1 µL d’apprêt avant (stock de 10 µM), 1 µL d’apprêt inverse (stock de 10 µM) et 3 µL d’H2O par réaction. Voir le protocole dans le tableau 4 pour les séquences d’amorces.
- Pipetter qPCR master mix de haut en bas, mais ne pas vortexer.
- Ajouter 15 µL de qPCR master mix, suivi soit 5 µL de la courbe d’étalonnage établie au paragraphe 4.1 ou de l’ADN extrait du vecteur d’AAV dans section 4.2, dans chaque puits. Parmi les trois puits contenant seulement qPCR master mix, comme témoin négatif. Reportez-vous à la Figure 2 pour le schéma.
- Sceller la plaque avec un film et centrifuger brièvement la plaque qPCR à 1 500 g pendant 30 s à 4 ° C.
- La réaction de qPCR s’exécuter sur un plaque en temps réel PCR amplification et la détection instrument, en utilisant les conditions proposées dans le tableau 5.
| Nom de l’apprêt | Séquence |
| Primer avant | 5'-CCCACTTGGCAGTACATCAA-3' |
| Inverser l’apprêt | 5'-GCCAAGTAGGAAAGTCCCAT-3' |
Tableau 4 : Séquences d’amorces conçus contre le promoteur de l’ABC.
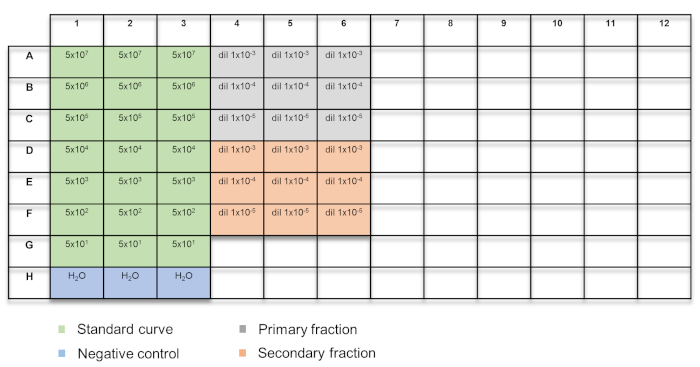
Figure 2 : schéma pour le titrage vectoriel qPCR. Les échantillons sont classés par couleurs : vert = courbe d’étalonnage ; bleu = H2O commande ; gris = fraction primaire ; Orange = fraction secondaire. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Étape | Temps | Température | Cycles | Objectif |
| Pré-incubation | 5 min | 95 ° C | x1 | Dénaturation et polymérase activation de l’ADN (réaction de démarrage à chaud). |
| Amplification | 10 min | 95 ° C | x1 | Amplification de l’ADN. Les paramètres peuvent être optimisés si autres amorces avec température de recuit différente sont utilisés. |
| 10 s | 95 ° C | x40 | ||
| 40 s | 60 ° C | |||
| 1 s | 72 ° C | |||
| De refroidissement | 10 s | 40 ° C | x1 | Plaque de refroidissement. Fin de la PCR. |
Tableau 5 : Protocole de cyclisme thermique pour le titrage de base vert qPCR SYBR.
-
Analyse de données pour déterminer le titre de vecteur d’AAV
- Remplir les cellules de données de feuille de calcul (tableau 6 a) avec les valeurs de Ct obtenues pour les différentes dilutions de l’échantillon étalon établie à la section 4.1 pour générer la courbe d’étalonnage.
Remarque : L’équation de la courbe standard s’affiche (y = a ln (x) + b) ainsi que l’efficacité de2 R(tableau 6 b). Un qPCR doit avoir un rendement proche de 100 % et R2 près 1.0 (≥ 0,96). - Utiliser les valeurs calculées de a et b pour remplir les cellules de données correspondantes dans la feuille de calcul (tableau 6).
- Remplir la feuille de calcul avec les valeurs de Ct obtenues pour les différentes dilutions de l’échantillon d’AAV préparé à la section 4.2.
- Calculer le titre de vecteur AAV moyen dans les génomes de vecteur par microlitre de la « fraction primaire » à l’aide de la formule suivante :
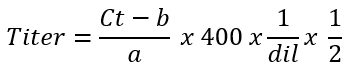
NOTE: le facteur 400 est utilisé pour les génomes brin unique, tandis que les génomes de sc utilisent un facteur de multiplication de 20025. En effet, en tant que quantités d’ADN doubles au cours de chaque cycle de qPCR, sc QU'ADN est détecté 2 x par rapport à un génome de ss. Le but du titrage est de calculer la concentration en ce qui concerne les génomes de vecteur par microlitre. Une correction est nécessaire pour faire fonctionner le qPCR lors de l’utilisation de 2 µL de matériel (étape 4.2.1) de départ. dil représente les facteurs de dilution de l’étape 4.2.4. Le titre de la fraction « secondaire » du vecteur AAV (étape 3.6) peut être calculé en même temps.
- Remplir les cellules de données de feuille de calcul (tableau 6 a) avec les valeurs de Ct obtenues pour les différentes dilutions de l’échantillon étalon établie à la section 4.1 pour générer la courbe d’étalonnage.
Tableau 6 : modèle pour l’analyse de données de qPCR. S’il vous plaît cliquez ici pour télécharger ce fichier.
5. pureté contrôle par SDS-PAGE et coloration à l’argent
Remarque : Exécution de la présente section du protocole prend environ 5 h.
- L’éthanol à 70 % (v/v) permet de bien nettoyer les plaques de verre utilisées pour effectuer le cast les gels.
- Assembler le système de coulée de gel. Veiller à ce que le fond des plaques de verre n'est pas ébréché, pour éviter les fuites du mélange acrylamide lors de la coulée de gel.
- Préparer l’empilage et les solutions de gel résoudre dans deux tubes coniques séparé de 50 mL. Omettre la tétraméthyléthylènediamine (TEMED) et le persulfate d’ammonium 10 % (p/v) (APS), puisqu’ils sont responsables de la polymérisation du gel. Ajouter juste avant la coulée du gel.
Remarque : Le profil de séparation des protéines influe sur le pourcentage final d’acrylamide dans le gel : en règle générale, une concentration finale de 10 % (v/v) d’acrylamide sera suffisante pour tester la pureté d’une préparation de vecteur d’AAV. - Mélanger doucement en agitant le tube contenant les composants du gel. Ne pas vortexer, puisque l’oxygénation excessive peut nuire à la polymérisation.
- Ajouter TEMED et 10 % (p/v) : APS à la solution de gel résolution. Mélanger, puis verser dans le support de gel jusqu'à ce qu’il atteigne 1 à 2 cm sous la surface de la plaque de verre.
- Placer une couche de butanol saturés d’eau sur le dessus le mélange de l’acrylamide. Ceci empêchera la formation d’une surface plane lors de la polymérisation. Ne laissez pas le gel sous alcool pendant plus de 30 min car cela déshydrater le gel et altérer sa fonction.
Attention : Le Butanol est dangereux en cas de contact avec la peau. Il présente également un risque d’incendie. Manipuler avec précaution. - Attendez que le gel à polymériser et décanter ensuite le butanol. Conseil : Vérifiez si le mélange de l’excès de gel dans le tube se solidifie. La polymérisation se produit dans moins de 20 min. laver la surface du gel avec H2O et puis séchez-le à l’aide de papier absorbant, en prenant soin de ne pas pour troubler la surface du gel.
- Ajouter TEMED et 10 % (p/v) : APS pour le gel de concentration et verser le gel dans le support de gel sur le dessus du gel de séparation.
- Placez le peigne fourni dans le gel. Effectuer cette action avec un mouvement régulier pour éviter la formation de bulles d’air à l’intérieur du puits.
- Attendez au moins 20 min pour le gel à polymériser. Astuce : Vérifiez que si le gel excès se mélange le tube conique se solidifie.
- Préparer les deux mélanges (tableau 7) pour le primaire et le secondaire AAV vector fractions (étapes 3.5 et 3.6, respectivement).
| Montant élevé | Faible quantité | |
| Stock de vecteur AAV | 5 ΜL | 1 ΜL |
| 5 x tampon | 3 ΜL | 3 ΜL |
| H2O | 7 ΜL | 11 ΜL |
Tableau 7 : Composition des mélanges échantillon requis pour la coloration à l’argent.
- Dénaturer complètement le mélange de l’échantillon en les chauffant pendant 5 min à 95 ° C. Assembler la cuve d’électrophorèse, prêter attention à l’orientation de l’électrode.
- Remplissez le réservoir avec 1 x tampon de la cathode à l’intérieur de l’électrode et 1 x tampon de l’anode à l’extérieur.
NOTE : Tampon Anode peut être recyclé de run-to-run. Tampon de cathode fraîche doit toujours être utilisé. - Retirer le peigne du gel et nettoyer les puits du gel avec tampon de cathode de 1 x.
- Charge 1 µL d’échelle de la protéine dans un puits. Charger les mélanges dans les différents puits sur le même gel (Figure 3). Exécutez le gel à 50 V jusqu'à ce que les échantillons Entrez le gel résolution. Puis augmentez la tension de 100 V jusqu'à ce que le front de colorant atteigne la limite inférieure du gel.
- Extraire le gel avec soin sur les plaques de verre et utiliser l’argent souillant kit (selon instructions26) les directives du fabricant pour visualiser les protéines virales (VP1, VP2 et VP3 sous-unités) qui composent la capside AAV, aussi bien quant à vérifier pour possible contamination de protéine (Figure 3).

Figure 3 : évaluation de la pureté de vecteur à l’aide de SDS-PAGE et coloration à l’argent. 5 µL de diverses préparations de vecteur à l’aide d’un gel Tricine-SDS, étaient séparés. Les protéines ont été détectés par la suite par coloration à l’argent. Vecteurs sont considérés comme purs quand VP1 (82 kDa), VP2 (67 kDa) et VP3 (60 kDa) sont visibles dans un 1:1:10 ratio (piste 1), sans fond excessif (piste 2) ou bandes non spécifiques (piste 3). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Résultats
AAV9 était considéré, jusqu'à une date récente, d’être le plus efficace sérotype de vecteur AAV en traversant la BHE et transduction des cellules du SNC, après administration périphérique. Une avancée significative dans la conception de la capside a été atteint lorsque Dhalladoo et coll. ont signalé l’utilisation d’une méthode de sélection de capside appelée Cre axée sur la recombinaison ciblées AAV evolution (CREATE)17. En utilisant cette méthode, ils ont identifié une nouveau capside, nommée PHP. B, qui ils ont signalé comme étant en mesure de transmettre la majorité des astrocytes et neurones dans plusieurs régions du CNS, après injection systémique17. À ce stade, il convient de noter que même si PHP. B fournit des résultats positifs chez les souris C57/Bl6 (qui était la souche utilisée dans les expériences d’isolement initial), les rapports préliminaires suggèrent que son efficacité peut varier d’une manière dépendante de la souche. D’autres expériences seront, sans aucun doute, jeter plus de lumière sur cette question31.
Cependant, malgré ces problèmes, PHP. B offre des possibilités passionnantes pour la manipulation de gènes non invasive dans le système nerveux central de souris, y compris les expériences de thérapie de gène de validation dans les modèles de maladies. Par conséquent, nous avons choisi d’évaluer l’efficacité d’expression de transgene en utilisant PHP. B par rapport à AAV9, qui a été le vecteur « étalon-or » pour la transduction CNS après administration périphérique depuis 20092. Pour effectuer une comparaison directe des deux sérotypes, dans des conditions optimales pour l’expression du transgène, nous avons utilisé une configuration de génome du sc32. Les deux vecteurs qui relèvent du transgène pour protéine fluorescente verte (GFP) le contrôle du promoteur omniprésent poulet β-actine (CBA). Les souris C57/Bl6 femelles au jour post-natal 42 (environ 20 g en poids) ont reçu une dose de 1 x 1012 vg par souris soit scAAV2/php. B-ABC-GFP ou scAAV2/9-CBA-GFP. Administration de vecteur a été exécuté par injection dans la veine queue. Les expériences ont été approuvées par le Comité d’éthique de la KU Leuven.
Post-injection de trois semaines, les souris ont subi transcardial perfusion avec du PBS glacee, suivie de 4 % (p/v) de paraformaldéhyde glacee (PFA). Leurs cerveaux ont été récoltés et subit encore postfixation par une incubation durant la nuit dans le fixateur même, avant de les transférer à 0,01 % (p/v) : Na-azoture/PBS pour stockage jusqu'à une analyse plus approfondie. Par la suite, les cerveaux étaient sectionnés à l’aide d’un microtome vibrant et immunohistochimique a été réalisée sur 50 µm de coupes épaisses.
Afin d’évaluer les niveaux d’expression du transgène, sections ont été colorées avec des anticorps primaires contre GFP (lapin anti-GFP), avec détection en utilisant des anticorps secondaires conjugués à un colorant fluorescent (anti-lapin Alexa Fluor 488) (Figure 4 a, B ). Mesures d’intensité de fluorescence (en unités arbitraires [au]) a confirmé une augmentation significative de l’expression de la GFP lorsqu’un sc génome et le PHP. Capside B ont été utilisés par rapport à AAV9. Augmentations GFP ont été observées dans le cerveau (2105 161 en ± vs 1441 de la ± 99 UA ; p = 0,0032), le cervelet (2601 ± 196 vs 1737 ± 135 UA ; p = 0,0032) et le tronc cérébral (3082 ± 319 vs 2485 ± 88 UA ; p = 0,0038) (Figure 4).
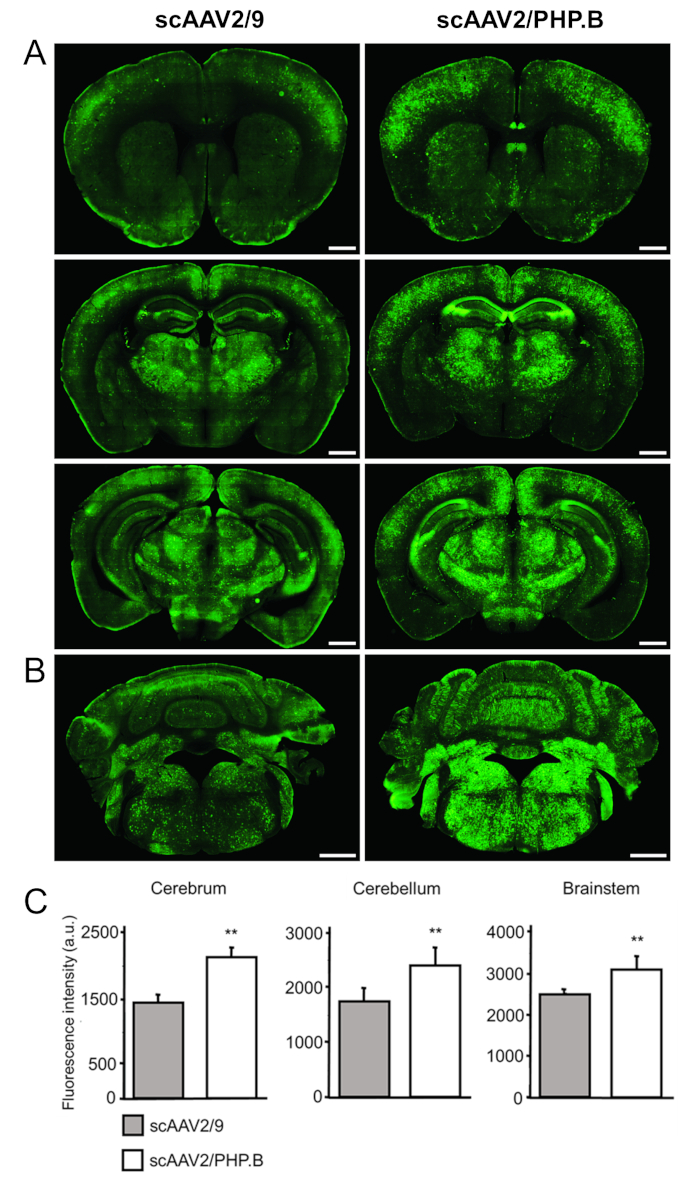
Figure 4 : délivrance systémique de scAAV2/PHP. B-ABC-GFP conduit à une forte expression de GFP dans le SNC. scAAV2/PHP. B-ABC-GFP ou scAAV2/9-CBA-GFP (1 x 1012 vg/souris) a été administré à des souris C57/Bl6 âgés de 6 semaines par injection dans la veine queue. GFP a été détectée par immunohistochimie sur post-injection de cerveau coronale sections 3 semaines. (A) le cerveau et (B) le cervelet et le tronc cérébral sont indiqués. Barreaux de l’échelle = 1 mm. (C) la quantification des intensités de fluorescence relative a été réalisée afin de déterminer les niveaux de signal GFP réalisé avec chaque vecteur (10 articles par souris ; trois souris par groupe vector). Un aller simple test ANOVA a été réalisé, suivie de l’élève à deux t-test ; les données sont exprimées en moyenne ± écart-type ; p < 0,01 ; UA. unités arbitraires. pCapsid, utilisé pour la production de vecteur d’AAV, contient le gène rep de sérotype 2 et le gène cap de sérotype PHP. B ou AAV9, en conséquence. Ce chiffre a été modifié par Rincon Al.32. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La production des vecteurs d’AAV recombinants décrite ici utilise des matériaux et équipements communs à la plupart des laboratoires de biologie moléculaire et des installations de culture de cellules. Il permet à l’utilisateur d’obtenir des vecteurs d’AAV pure, précliniques de qualité qui peuvent être utilisés pour cibler plusieurs types de cellules et de tissus dans un éventail d’applications in vitro et in vivo . Un des plus grands avantages du présent protocole, par rapport aux autres (p. ex., axée sur le CsCl purification), est le plus court temps de travail nécessaire. Prêt-à-utiliser des vecteurs d’AAV peuvent être obtenus dans un délai maximum de 6 jours ouvrables après la transfection initiale de cellules HEK293T.
Plusieurs facteurs peuvent influencer négativement le rendement final ou la qualité du vecteur AAV. Efficacité de transfection pauvre est l’une des principales raisons pour un faible rendement virale33. Une recommandation majeure est l’utilisation de cellules HEK293T qui n’ont pas été repiquées plus de 20 fois et n’ont pas une confluence de cellule supérieure à 90 % au moment de la transfection21. En outre, la méthode de transfection sélectionnée a un impact majeur sur les résultats. Ce protocole est basé sur l’utilisation du PEI. PEI est un polymère cationique avec la capacité de livrer des ADN exogène dans le noyau de la cellule grâce à la génération des complexes de polymère et d’acide nucléique, appelée polyplexes, qui sont absorbés par la cellule et les victimes de la traite par endosomes34. Transfection axée sur le PEI est facile et rapide à réaliser, contrairement aux autres méthodes répandues, comme la coprécipitation d’ADN avec le phosphate de calcium,35. Aussi, transfection axée sur le PEI est beaucoup moins cher par rapport aux autres méthodes nouvellement introduites, telles que l’utilisation des lipides cationiques et36de la transfection induite par l’aimant.
La stratégie de purification joue un rôle clé dans le protocole. Par rapport aux autres méthodes, axée sur l’iodixanol des purifications ont tendance à contiennent un pourcentage plus élevé de particules virales vides (20 %),20. Cela est compensé, dans une certaine mesure, par le fait qu’axée sur l’iodixanol purification résulte systématiquement dans les préparations de vecteur AAV avec un ratio de particules à l’infectivité inférieur à 100. Il s’agit d’une amélioration significative par rapport aux procédures conventionnelles CsCl-basé, pour lesquels une perte substantielle d’infectiosité de la particule est signalé37. Une autre méthode alternative commune à épurer des vecteurs d’AAV est axée sur la chromatographie en phase de purification. Toutefois, cette méthode a l’inconvénient majeur qu’une colonne spécifique est requise pour chaque capside vecteur utilisé : par exemple, tandis que AAV2 est classiquement isolées à l’aide de colonnes de l’héparine, cette méthode ne fonctionne pas avec AAV4 et AAV5, qui ne possèdent pas de liant l’héparine sites sur leurs capsides38. Considérant que la purification par chromatographie est aussi cher, axée sur l’iodixanol purification est généralement plus adaptée pour les laboratoires qui désirent se produire des lots de haute qualité des vecteurs d’AAV sur une petite échelle33,39, 40. Toutefois, afin de maximiser le rendement final et la pureté du vecteur, un soin extrême est nécessaire lors des gradients d’iodixanol. Les diverses fractions d’iodixanol devraient être transférées à l’ultracentrifugation tube à l’aide d’une pipette Pasteur stérile dont l’extrémité est en contact avec la paroi du tube : iodixanol devrait être expulsé de la pipette lentement et continuellement. Comme les particules de vecteur s’accumulent dans la couche d’iodixanol de 40 %, soins doivent être prises pour s’assurer que les interfaces dégradés ne mélangent pas20. Enfin, la fraction contenant le vecteur devrait être recouvrée par l’insertion d’une aiguille émoussée en acier inoxydable avec un calibre ne dépassant pas 20 G. Pour maximiser la récupération de vecteur, la fraction claire doit être récupérée dans son intégralité. Au cours de cette étape, le timing est critique. Pour ne pas compromettre la pureté de la préparation, il est essentiel d’arrêter la collection avant la collecte des autres phases (contamination) du dégradé.
Différences dans le titre de vecteur obtenus peuvent être attribuées aussi à la capacité intrinsèque du vecteur pour produire des particules emballés. Une comparaison entre différents sérotypes d’AAV a montré que certains vecteurs AAV sont plus difficiles à produire à un titre plus élevé que d’autres (p. ex., AAV2)41. Précipitation du vecteur, pendant l’étape de dessalement, peut être une raison possible pour un titre plus faible et facilement prévenue en évitant la surconcentration33. En outre, il est également possible que l’efficacité de la purification d’axée sur le gradient iodixanol diffère légèrement entre sérotypes et, par conséquent, divergences dans le titre obtenu avec des sérotypes différents sont observés en41.
Enfin, il doit être souligné que, même si qPCR est une méthode très précise pour la quantification de l’ADN certaine variabilité inhérente à la technique peut être observée. Précision dans le titrage dépend principalement le pipetage précis et bonne agitation de toutes les solutions. Afin de garantir le titre plus précis de lecture, le qPCR peut être indépendamment répété, et les valeurs obtenues en moyenne. Le choix des amorces présentées dans le présent protocole est basé sur la séquence du promoteur ABC situé dans le plasmide pTransgene utilisé dans notre laboratoire. Le promoteur de l’ABC est un ardent promoteur synthétique qui est largement utilisé dans le champ de vecteurs d’expression en voiture à travers plusieurs types de cellules. Il incorpore plusieurs éléments, y compris l’élément de l’enrichisseur début cytomégalovirus (CMV) ; le promoteur, premier exon et le premier intron du gène ABC ; et l’accepteur d’épissage de la β-globine de lapin. Cependant, les amorces peuvent être conçus pour pratiquement n’importe quel élément situé à l’intérieur de la cassette d’expression (y compris le promoteur, transgène et des éléments réglementaires). La comparaison du titre dans l’ensemble de lots est également possible, fournir des amorces sont utilisés contre les régions communes pour les vecteurs en question.
En conclusion, ce protocole peut être utilisé pour produire des vecteurs d’AAV avec une variété de capsides, configurations de génome, types de promoteur et cargaisons de transgene. Cela permettra aux utilisateurs d’adapter facilement les caractéristiques finales de leurs vecteurs pour satisfaire au mieux les besoins expérimentaux. Dans l’exemple présenté dans les résultats représentatifs, l’utilisation de PHP. Capside de B, qui traverse la BHE efficacement, a donné l’expression des gènes très efficace dans le SNC, suivant queue veine injection32. L’administration systémique de vecteurs par ressuage CNS a des avantages considérables en termes d’effets secondaires possibles de17,2,32. Une alternative possible à injection périphérique, tout en évitant les mises en garde des techniques invasives, est intrathécale, qui se compose de la livraison du vecteur AAV dans le liquide céphalo-rachidien. Cet itinéraire de livraison est avéré efficace, montrant une expression très répandue du transgène à travers le système nerveux central, moins d’effets hors-cible dans les organes périphériques et de faibles niveaux de réponse immunitaire42. Toutefois, des injections intrathécales sont beaucoup plus difficiles, car ils exigent des compétences plus techniques que l’injection dans la veine queue.
Perfectionnement de capside pour affiner cette technologie sera pilotée par les possibilités d’utilisation de vecteurs AAV dans les applications de la thérapie génique. Ces approches offrent des possibilités attrayantes pour traiter les troubles du SNC actuellement incurables, comme la sclérose latérale amyotrophique, maladie de Charcot-Marie-Tooth maladie, maladie de Parkinson et la maladie d’Alzheimer18.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
M.R. est pris en charge par un Fonds voor bourse postdoctorale Wetenschappelijk Onderzoek Vlaanderen (FWO) (133722/1204517N) et reconnaît l’appui continu de la Fundación cardiovasculaire de Colombie et du département des sciences administratives, La technologie et l’Innovation (subvention CT-FP44842-307-2016, le code de projet 656671250485). M.M. est soutenu par une bourse de doctorat de FWO (1S48018N). M.G.H. était soutenu par une subvention institutionnelle du VIB et le soutien extérieur du Thierry Latran Foundation (SOD-VIP), la fondation d’Alzheimer Research (SAO-FRA) (P #14006), le FWO (Grant 1513616N) et le Conseil européen de recherche (CER) (Starting Grant 281961 - AstroFunc ; Preuve de Concept Grant 713755 - AD-VIP). Les auteurs remercient Jeason Haughton pour son aide avec l’élevage de souris, Stephanie Castaldo pour son aide à effectuer les injections de veine de queue et Caroline Eykens pour fournir les images de cellules HEK293T transfectées. M.G.H. reconnaît Michael Dunlop, Peter Hickman et Dean Harrison.
matériels
| Name | Company | Catalog Number | Comments |
| Plasmid production | |||
| pTransgene plasmid | De novo design or obtained from a plasmid repository | N/A | See step 1 of main protocol for further details |
| pCapsid | De novo design or obtained from a plasmid repository | N/A | See step 1 of main protocol for further details |
| pHelper | Agilent | 240071 | |
| Plasmid Plus maxi kit | Qiagen | 12963 | |
| QIAquick PCR purification Kit | Qiagen | 28104 | |
| AAV Helper-Free System | Agilent | 240071 | |
| Cell culture and transfection | |||
| Dulbecco’s Modified Eagle Medium (DMEM), high glucose, no glutamine | Life technologies | 11960-044 | Supplement DMEM with FBS (1% or 10% v/v) and GlutaMAX 200 mM (1% v/v) then filter sterilize the medium using a 0.22 µm filter |
| Fetal bovine serum (FBS) | GIBCO | 10500-064 | |
| GlutaMAX supplement | GIBCO | 35050038 | |
| (200 mM) | |||
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS430769 | |
| Dulbecco’s Phosphate Buffered Saline (DPBS) with no calcium and no magnesium | GIBCO | 14190094 | |
| HEK293T cells | American Tissue Culture Collection | CRL3216 | Upon receipt, thaw the cells and culture as described in the protocol. After a minimal number of passages, freeze a subfraction for future in aliquots. Always use cells below passage number 20. Once cultured cells have been passaged more than 20 times, restart a culture from the stored aliquots |
| Cell culture dishes | Greiner Cellstar | 639160 | 15 cm diameter culture dishes |
| Cell scrapers | VWR | 10062-904 | |
| Polyethylenimine (PEI) | Polyscience | 23966-2 | PEI in powder form is dissolved at 1 µg/µL in deionized water (ddwater) at pH=2 (use HCl). Prepare in a beaker and stir for 2-3 h. When dissolved, bring the pH back to 7 with NaOH. Filter sterilize and store the resuspended stock solution in 1 ml aliquots at -20 °C. PEI aliquots can be freeze/thawed multiple times. |
| Virkon solution | Fisher Scientific | NC9821357 | Disinfect any material that has been in contact with assembled vector particles with Virkon solution |
| Mutexi long-sleeve aprons | Fisher Scientific | 11735423 | Wear an apron over the top of a regular lab coat |
| Fisherbrand maximum protection disposable overshoes | Fisher Scientific | 15401952 | |
| AAV Purification and desalting | |||
| Optiprep density gradient medium | Sigma-Aldrich | D1556 | Optiprep is a 60% (w/v) solution of iodixanol in water (sterile). CAUTION. Use under a laminar flow hood. Wear gloves |
| Phenol red | Sigma-Aldrich | P0290 | CAUTION. Use under a laminar flow hood |
| Pasteur pipette | Sigma-Aldrich | Z627992 | Sterilize before use |
| OptiSeal Polypropylene tubes | Beckman | 361625 | |
| Benzonase (250 U/µL) | Sigma-Aldrich | E1014 | Supplied as a ready-to-use solution |
| Acrodisc syringe filter | Pall corporation | 4614 | |
| Omnifix syringe (5 mL) | Braun | 4617053V | |
| Blunt syringe needle | Sigma Aldrich | Z261378 | Stainless steel 316 syringe needle, pipetting blunt 90° tip gauge 16, L 4 in. Referred to in the text as a blunt-end needle |
| Aqua Ecotainer | B. Braun | 0082479E | Sterile endotoxin-free water. Referred to as 'Ultrapure water' |
| Amicon ultra-15 centrifugal filter unit | Millipore | UFC910024 | These filters concentrate the final product by collecting the vector particles in consecutive centrifugation steps |
| Pluronic F68 (100x) | Thermo Fisher | 24040032 | Non-ionic surfactant. Dilute in sterile PBS to use at 0.01% (v/v) |
| Fisherbrand Sterile Microcentrifuge Tubes with Screw Caps (2 mL) | Fisher Scientific | 02-681-374 | Use skirted tubes for easy handling |
| AAV Titration | |||
| Restriction enzyme: StuI (10 U/µL) | Promega | R6421 | |
| DNAse I (1 U/µL) | Fisher Scientific | EN0521 | |
| Proteinase K | Sigma-Aldrich | 3115852001 | Reconstitute in ultrapure water and use at a final concentration of 10 mg/mL. Solution can be stored at -20 °C |
| EasyStrip Plus Tube Strips (with attached caps) | Fisher Scientific | AB2000 | |
| Eppendorf microtube 3810x | Sigma-Aldrich | Z606340-1000EA | |
| LightCycler 480 SYBR Green I Master Mix | Roche | 4707516001 | |
| LightCycler Multiwell Plates, 96 wells | Roche | 4729692001 | White polypropylene plate (with unique identifying barcode) |
| Microseal 'A' PCR plate and PCR Plate Sealing Film | Bio-Rad | msa5001 | |
| AAV Purity control | |||
| Ammonium persulfate (APS) | Sigma-Aldrich | A3678 | Reconstitute in ultrapure water to 10% (v/v). CAUTION. Use under a laminar flow hood. Wear gloves |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Tris Base ULTROL Grade | Merck | 648311 | CAUTION: Use under a laminar flow hood. Wear gloves |
| UltraPure Agarose | Thermo Fisher | 16500-500 | |
| Rotiphorese® Gel 30 (37,5:1) | Carl Roth | 3029.3 | Aqueous 30% acrylamide and bisacrylamide stock solution at a ratio of 37.5:1. CAUTION: Use under a laminar flow hood. Wear gloves |
| Serva Blue G | Sigma-Aldrich | 6104-58-1 | |
| Precision Plus prestained marker | Bio-Rad | 1610374edu | |
| 1-Butanol | Sigma-Aldrich | B7906 | CAUTION: Use under a laminar flow hood. Wear gloves |
| Immunohistochemistry | |||
| Rabbit anti-GFP | Synaptic Systems | 132002 | 1:300 dilution |
| Anti-rabbit Alexa Fluor 488 | Invitrogen | A21206 | 1:1,000 dilution |
| Equipment | Company | Catalog number | Comments |
| Vector production lab | |||
| Rotina 380 bench-top centrifuge * | Hettich | 1701 | |
| Optima XPN 80 ultracentrifuge * | Beckmann Coulter | A95765 | |
| Type 50.2 Ti fixed-angle titanium rotor * | Beckmann Coulter | 337901 | |
| Entris digital scale * | Sartorius | 2202-1S | |
| Warm water bath * | Set at 37 °C | ||
| Ice bucket * | VWR | 10146-290 | Keep material used in the vector production lab separate from that used in standard lab areas |
| Pipetboy pro * | Integra | 156,400 | |
| Graduated pipettes: Cell star * | Greiner bio-one | 606180 | Capacity of 5 mL |
| Graduated pipettes: Cell star * | Greiner bio-one | 607180 | Capacity of 10 mL |
| Graduated pipettes: Cell star * | Greiner bio-one | 760180 | Capacity of 25 mL |
| CO2 incubator CB150 * | Binder | 9040-0038 | Set at 37 °C, 5% CO2 and 95% humidity |
| Nuaire safety cabinet NU 437-400E * | Labexchange | 31324 | Clean all the surfaces with 70% ethanol and Virkon before and after use |
| Conventional lab | |||
| T100 thermal cycler * | Bio-Rad | 1861096 | |
| LightCycler 480 Instrument II * | Roche | 5015278001 | |
| ThermoMixer * | Eppendorf | C 5382000015 | |
| Nanodrop * | ThermoFisher Scientific | ND 2000 | |
| Mini-Protean Tetra Cell* | Bio-Rad | 1658001FC | For use with handmade or precast gels |
| ProteoSilver silver stain kit | Sigma-Aldrich | PROTSIL1 | High sensitivity protein detection with low background |
| Centrifuge 5804 R * | Eppendorf | B1_022628045 | High speed centrifuge for medium capacity needs (up to 250 mL) |
| Graduated pipettes Cell star * | Greiner bio-one | 606180 | 5 mL |
| Graduated pipettes Cell star * | Greiner bio-one | 607180 | 25 mL |
| Graduated pipettes Cell star * | Greiner bio-one | 760180 | 25 mL |
| Filter tips * | Greiner bio-one | 750257 | 1250 µL |
| Filter tips * | Greiner bio-one | 738257 | 300 µL |
| Filter tips * | Greiner bio-one | 771257 | 10 µL |
| Ice bucket with lid * | VWR | 10146-290 | |
| Mini diaphragm vacuum pump, VP 86 * | VWR | 181-0065 | |
| Pipetman P2 | Gilson | F144801 | |
| Pipetman P20 | Gilson | F123600 | |
| Pipetman P100 | Gilson | F123615 | |
| Pipetman P200 | Gilson | F123601 | |
| Pipetman P1000 | Gilson | F123602 | |
| * Materials marked with an asterisk are expensive pieces of equipment and are usually central infrastructure items shared between multiple labs. These items can also be replaced by equivalents if available. Note, when a different ultracentrifuge is used, care must be taken to select the correct rotor and centrifuge tubes. |
Références
- Daya, S., Berns, K. I. Gene Therapy Using Adeno-Associated Virus Vectors. Clinical Microbiology Reviews. 21 (4), 583-593 (2008).
- Duque, S., et al. Intravenous Administration of Self-complementary AAV9 Enables Transgene Delivery to Adult Motor Neurons. Molecular Therapy. 17 (7), 1187-1196 (2009).
- Bourdenx, M., Dutheil, N., Bezard, E., Dehay, B. Systemic gene delivery to the central nervous system using Adeno-associated virus. Frontiers in Molecular Neuroscience. 7, (2014).
- Kantor, B., McCown, T., Leone, P., Gray, S. J. Clinical Applications Involving CNS Gene Transfer. Advances in Genetics. 87, 71-124 (2014).
- Crystal, R. G. Adenovirus: The First Effective In Vivo Gene Delivery Vector. Human Gene Therapy. 25 (1), 3-11 (2014).
- Weinberg, M. S., Samulski, R. J., McCown, T. J. Adeno-associated virus (AAV) gene therapy for neurological disease. Neuropharmacology. 69, 82-88 (2013).
- Henckaerts, E., Linden, R. M. Adeno-associated virus: a key to the human genome?. Future Virology. 5 (5), 555-574 (2010).
- Howarth, J. L., Lee, Y. B., Uney, J. B. Using viral vectors as gene transfer tools (Cell Biology and Toxicology Special Issue: ETCS-UK 1 day meeting on genetic manipulation of cells). Cell Biology and Toxicology. 26 (1), 1-20 (2010).
- Nathwani, A. C., et al. Adenovirus-Associated Virus Vector-Mediated Gene Transfer in Hemophilia B. The New England Journal of Medicine. 365 (25), 2357-2365 (2011).
- Carter, B. J. Adeno-associated virus and the development of adeno-associated virus vectors: a historical perspective. Molecular Therapy. 10 (6), 981-989 (2004).
- Schambach, A., Zychlinski, D., Ehrnstroem, B., Baum, C. Biosafety Features of Lentiviral Vectors. Human Gene Therapy. 24 (2), 132-142 (2013).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The Role of the Adeno-Associated Virus Capsid in Gene Transfer. Methods in Molecular Biology. 437, 51-91 (2008).
- Rincon, M. Y., VandenDriessche, T., Chuah, M. K. Gene therapy for cardiovascular disease: advances in vector development, targeting, and delivery for clinical translation. Cardiovascular Research. 108 (1), 4-20 (2015).
- Samulski, R. J., Muzyczka, N. AAV-Mediated Gene Therapy for Research and Therapeutic Purposes. Annual Review of Virology. 1 (1), 427-451 (2014).
- McCarty, D. M. Self-complementary AAV Vectors; Advances and Applications. Molecular Therapy. 16 (10), 1648-1656 (2008).
- Choi, J. H., et al. Optimization of AAV expression cassettes to improve packaging capacity and transgene expression in neurons. Molecular Brain. 7, 17 (2014).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nature Biotechnology. 34 (2), 204-209 (2016).
- Jackson, K. L., Dayton, R. D., Deverman, B. E., Klein, R. L. Better Targeting, Better Efficiency for Wide-Scale Neuronal Transduction with the Synapsin Promoter and AAV-PHP.B. Frontiers in Molecular Neuroscience. 9, (2016).
- Lock, M., et al. Versatile Manufacturing of Recombinant Adeno-Associated Viral Vectors at Scale. Human Gene Therapy. 21 (10), 1259-1271 (2010).
- Strobel, B., Miller, F. D., Rist, W., LamLa, T. Comparative Analysis of Cesium Chloride- and Iodixanol-Based Purification of Recombinant Adeno-Associated Viral Vectors for Preclinical Applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Jungmann, A., Leuchs, B., Katus, H. A., Rommelaere, J., Müller, O. J. Protocol for efficient generation and characterization of adeno-associated viral (AAV) vectors. Human Gene Therapy Methods. , (2017).
- Tolmachov, O. Designing Plasmid Vectors. Methods in Molecular Biology. 542, 117-129 (2009).
- . QIAGEN Plasmid Purification Handbook Available from: https://www.qiagen.com/us/resources/download.aspx?id=46205595-0440-459e-9d93-50eb02e5707e&lang=en (2018)
- Lock, M., Alvira, M. R., Chen, S. J., Wilson, J. M. Absolute Determination of Single-Stranded and Self-Complementary Adeno-Associated Viral Vector Genome Titers by Droplet Digital PCR. Human Gene Therapy Methods. 25 (2), 115-125 (2014).
- . ProteoSilver Silver Stain Kit (PROTSIL1) - Bulletin, ProteoSilver Available from: https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Bulletin/protsil1bul.pdf (2018)
- Machholz, E., et al. Manual Restraint and Common Compound Administration Routes in Mice and Rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Puntel, M., et al. Gene transfer into rat brain using adenoviral vectors. Current Protocols in Neuroscience. 50 (1), (2010).
- Bachman, J. Immunohistochemistry on Freely Floating Fixed Tissue Sections. Methods in Enzymology. 533, 207-215 (2013).
- Hordeaux, J., et al. The Neurotropic Properties of AAV-PHP.B Are Limited to C57BL/6J Mice. Molecular Therapy. 26 (3), 664-669 (2018).
- Rincon, M. Y., et al. Widespread transduction of astrocytes and neurons in the mouse central nervous system after systemic delivery of a self-complementary AAV-PHP.B vector. Gene Therapy. 25 (2), 83-92 (2018).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free Production of Laboratory Grade AAV and Purification by Iodixanol Density Gradient Centrifugation. Molecular Therapy. Methods & Clinical Development. 10, 1-7 (2018).
- Merdan, T., Kunath, K., Fischer, D., Kopecek, J., Kissel, T. Intracellular processing of poly(ethylene imine)/ribozyme complexes can be observed in living cells by using confocal laser scanning microscopy and inhibitor experiments. Pharmaceutical Research. 19 (2), 140-146 (2002).
- Meissner, P., et al. Transient gene expression: recombinant protein production with suspension-adapted HEK293-EBNA cells. Biotechnology and Bioengineering. 75 (2), 197-203 (2001).
- Reed, S. E., Staley, E. M., Mayginnes, J. P., Pintel, D. J., Tullis, G. E. Transfection of mammalian cells using linear polyethylenimine is a simple and effective means of producing recombinant adeno-associated virus vectors. Journal of Virological Methods. 138 (1-2), 85-98 (2006).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Therapy. 6 (6), 973-985 (1999).
- Kaludov, N., Handelman, B., Chiorini, J. A. Scalable Purification of Adeno-Associated Virus Type 2, 4, or 5 Using Ion-Exchange Chromatography. Human Gene Therapy. 13 (10), 1235-1243 (2002).
- Nass, S. A., et al. Universal Method for the Purification of Recombinant AAV Vectors of Differing Serotypes. Molecular Therapy. Methods & Clinical Development. 9, 33-46 (2017).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. Journal of Virological Methods. 140 (1-2), 183-192 (2007).
- Holehonnur, R., et al. Adeno-associated viral serotypes produce differing titers and differentially transduce neurons within the rat basal and lateral amygdala. BMC Neuroscience. 15, 28 (2014).
- Wang, H., et al. Widespread spinal cord transduction by intrathecal injection of rAAV delivers efficacious RNAi therapy for amyotrophic lateral sclerosis. Human Molecular Genetics. 23 (3), 668-681 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon