Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluer l’Influence de la personnalité sur la sensibilité aux champs magnétiques chez le poisson zèbre
Dans cet article
Résumé
Les auteurs décrivent un protocole comportemental visant à évaluer l’influence des personnalités du poisson-zèbre sur leur réaction à l’eau des courants et des champs magnétiques faibles. Poissons avec les mêmes personnalités sont séparés selon leur comportement exploratoire. Puis, on observe leur comportement rhéotaxique orientation dans un tunnel de natation avec un débit faible et sous différentes conditions magnétiques.
Résumé
Pour s’orienter dans leur environnement, animaux intègre un large éventail d’indices externes, qui interagissent avec plusieurs facteurs internes, tels que de la personnalité. Nous décrivons ici un protocole comportemental conçu pour l’étude de l’influence de la personnalité de poisson-zèbre sur leur réaction d’orientation aux multiples signaux environnementaux externes, spécifiquement les courants d’eau et les champs magnétiques. Ce protocole a pour but de comprendre si proactive ou réactive zebrafish afficher différents seuils rhéotaxique (c.-à-d., la vitesse d’écoulement au cours de laquelle les poissons commencent à nager en amont) lorsque le champ magnétique entourant change sa direction. Pour identifier le poisson-zèbre avec la même personnalité, poissons sont introduits dans l’obscurité la moitié d’un réservoir reliée avec une ouverture étroite pour une moitié lumineuse. Seuls les poissons proactive explorent le roman, l’environnement lumineux. Poisson réactive ne quittez pas la moitié sombre de la citerne. Un tunnel de natation avec faibles débits est utilisé pour déterminer le seuil de rhéotaxique. Nous décrivons deux configurations pour contrôler le champ magnétique dans le tunnel, au niveau de l’intensité du champ magnétique de la terre : celui qui contrôle le champ magnétique le long de la direction de l’écoulement (une dimension) et l’autre qui permet un contrôle trois-axiale du champ magnétique. Poissons sont filmés tout en découvrant une augmentation progressive de la vitesse d’écoulement dans le tunnel sous différents champs magnétiques. Données sur le comportement d’orientation sont recueillies au moyen d’une procédure de suivi vidéo et appliquées à un modèle logistique pour permettre la détermination du seuil rhéotaxique. Nous rapportons des résultats représentatifs prélevés de bancs de poisson-zèbre. Plus précisément, elles démontrent que poisson seulement réactif, prudent présentent des variations du seuil rhéotaxique lorsque le champ magnétique varie dans sa direction, tandis que les poissons proactive ne répondent pas à des changements de champ magnétique. Cette méthode peut être appliquée à l’étude de la sensibilité magnétique et le comportement rhéotaxique de nombreuses espèces aquatiques, tant affichant solitaires ou bancs de nage stratégies.
Introduction
Dans la présente étude, les auteurs décrivent un protocole comportemental en laboratoire qui a la portée de l’enquête sur le rôle de la personnalité des poissons sur la réponse de l’orientation des bancs de poissons aux signaux de l’orientation externe, tels que les courants d’eau et les champs magnétiques.
Les décisions d’orientation des animaux proviennent des diverses informations sensorielles de pesage. Le processus de décision est influencé par la capacité de l’animal pour naviguer (p. ex., la capacité à sélectionner et garder une direction), son état interne (par exemple, les besoins alimentaires ou de reproduction), sa capacité à se déplacer (par exemple, biomécanique de locomotion) et plusieurs autres facteurs externes (par exemple, l’heure du jour, interaction avec des congénères)1.
Le rôle de l’état interne et de la personnalité animale dans le comportement d’orientation est souvent mal compris ou pas exploré2. Autres défis se posent dans l’étude de l’orientation sociale espèces aquatiques, qui souvent effectuer coordonnée et polarisé groupe mouvement comportement3.
Courants d’eau jouent un rôle clé dans le processus d’orientation des poissons. Poisson oriente l’eau courants grâce à un approvisionnement inconditionel réponse appelé rhéotaxie4, qui peut être positif (c'est-à-dire, en amont orienté) ou négatif (c'est-à-dire en aval orienté) et est utilisé pour plusieurs activités, allant de la recherche de nourriture à la minimisation de les dépenses énergétiques de5,6. En outre, un nombre croissant de la littérature rapporte que plusieurs espèces de poissons utilisent le champ magnétique terrestre pour l’orientation et navigation7,8,9.
L’étude des performances rhéotaxie et nage dans le poisson est généralement menée dans des chambres de flux (flume), où les poissons sont exposés à l’augmentation progressive de la vitesse d’écoulement, de faible à grande vitesse, souvent jusqu'à épuisement (appelée vitesse critique)10, 11. En revanche, des études antérieures a examiné le rôle du champ magnétique dans l’orientation par le biais de l’observation du comportement natation des animaux dans les arènes avec eau plate12,13. Nous décrivons ici une technique de laboratoire qui permet aux chercheurs d’étudier le comportement des poissons tout en manipulant les courants d’eau tant le champ magnétique. Cette méthode a été utilisée pour la première fois sur les bancs de poisson zèbre (Danio rerio) dans notre étude précédente, conduisant à la conclusion que la manipulation du champ magnétique environnant détermine le seuil rhéotaxique (c.-à-d., l’eau minime vitesse à qui rechauffent poisson orient en amont)14. Cette méthode est basée sur l’utilisation d’une chambre de flume avec flux lents combinés avec une configuration conçue pour contrôler le champ magnétique dans le canal, au sein de la gamme d’intensité du champ magnétique de la terre.
Le tunnel de natation utilisé pour observer le comportement du poisson-zèbre est décrite à la Figure 1. Le tunnel (en un cylindre acrylique nonreflecting avec un diamètre de 7 cm et 15 cm de long) est connecté à un programme d’installation pour le contrôle du taux de débit14. Avec cette configuration, la gamme des débits dans le tunnel varie entre 0 et 9 cm/s.
Pour manipuler le champ magnétique dans le tunnel de natation, nous utilisons deux approches méthodologiques : le premier est unidimensionnel et le second est en trois dimensions. Pour toute demande, ces méthodes manipulent le champ magnétique terrestre pour obtenir les conditions magnétiques spécifiques dans un volume défini d’eau — ainsi, toutes les valeurs d’intensité de champ magnétique dans cette étude incluent le champ géomagnétique.
En ce qui concerne la dimension approche15, le champ magnétique est manipulé le long de la direction d’écoulement de l’eau (définie comme l’axe des x) à l’aide d’un solénoïde enroulé autour du tunnel de la natation. Cela est lié à une unité de puissance, et il génère des champs magnétiques statiques uniformes (Figure 2 a). De même, dans le cas de l’approche en trois dimensions, le champ géomagnétique dans le volume contenant le tunnel de natation est modifié à l’aide de bobines de fils électriques. Toutefois, pour contrôler le champ magnétique en trois dimensions, les bobines ont la conception de trois paires de Helmholtz orthogonales (Figure 2 b). Chaque paire de Helmholtz est composé de deux bobines circulaires orientés dans les trois directions orthogonales de l’espace (x, yet z) et équipé d’un magnétomètre trois axes travaillant dans des conditions de la boucle fermée. Le magnétomètre travaille avec des intensités de champ comparables avec champ naturel de la terre, et il est situé près du centre géométrique de l’ensemble de bobines (où le tunnel de natation se trouve).
Nous implantons des techniques décrites ci-dessus pour vérifier l’hypothèse que les traits de personnalité des poissons composer un haut-fond influencent la manière dont ils réagissent aux champs magnétiques16. Nous testons l’hypothèse que les individus ayant une personnalité proactives et réactives17,18 réagissent différemment lorsqu’ils sont exposés à l’eau s’écoule et champs magnétiques. Pour tester ceci, nous avons tout d’abord trier poisson zèbre à l’aide d’une méthodologie éprouvée pour assigner et les individus de groupe qui sont proactive ou réactive17,19,20,21. Ensuite, nous évaluons le comportement rhéotaxique de poisson-zèbre, nager en bancs composé de seulement les personnes réactives ou composé de seulement proactive personnes dans la citerne antiroulis magnétique, qui nous présentent comme des exemples de données.
La méthode de tri est basée sur la tendance différente des individus proactives et réactives pour explorer de nouveaux environnements,21. Plus précisément, nous utilisons un réservoir divisé en un brillant et un côté obscur17,19,20,21 (Figure 3). Animaux est acclimatés au côté obscur. Lorsque l’accès au côté lumineux est ouverte et proactive individus ont tendance à quitter rapidement la moitié sombre de la cuve pour découvrir le nouvel environnement, tandis que les poissons réactifs ne pas laissent le réservoir sombre.
Protocole
Le protocole suivant a été approuvé par le Comité de l’urbanisme de l’Université de Naples Federico II, Naples, Italie (2015) et d’institutionnels animalier.
1. animaux entretien
- Réservoirs d’au moins 200 L permet d’héberger un haut-fond d’au moins 50 personnes des deux sexes dans chaque réservoir.
Remarque : La densité des poissons dans le réservoir doit être un animal par 2 litres ou moins. Dans ces conditions, le poisson-zèbre affichera comportement normal de se regrouper en bancs. - Définir les conditions d’entretien comme suit : température entre 27 et 28 ° C ; conductivité à < 500 μS ; pH de 6,5 à 7,5 ; AUCUN3 à < 0,25 mg/L ; et une photopériode de lumière : obscurité à 10 h de h:14.
Remarque : Les conditions de détention identique doivent être utilisées pour la population mixte et les populations séparées de proactive et réactives.
2. la personnalité sélection chez le poisson zèbre
- Préparez et placez le réservoir de sélection de personnalité dans une salle de repos (Figure 3) avec la même eau que celle utilisée dans les réservoirs de l’entretien.
- Placez une caméra vidéo au-dessus ou à côté de la cuve. Connectez la caméra à un ordinateur équipé d’un écran situé dans une zone où il n’y a aucun contact visuel avec le réservoir.
- Sélectionnez neuf pêche au hasard dans le réservoir de maintenance et de les transférer vers le côté obscur de la citerne de sélection de personnalité, à l’aide d’un filet sans noeuds.
Remarque : Essayez de limiter les interactions avec les chars et les poissons pour le moins de temps possible. Éviter le bruit et les mouvements rapides. Le cas échéant, transférer les animaux dans un petit volume de transport de réservoir (environ 2 L) avec l’eau du réservoir d’eaux noires. Pour éviter l’exposition à l’air des animaux, utiliser un bécher de 250 ml et amener doucement l’animal d’entrer dans le bécher. Essayez de réduire au minimum le temps de capture, éviter la collecte de plusieurs poissons comme il peut causer des dommages physiques aux animaux et ne pas tenir de poisson pendant plus de quelques secondes dans le filet, car ces facteurs peuvent augmenter le stress. Poissons doivent être nourris ad libitum avant le transfert vers le réservoir expérimental. Ce qui limite la possibilité que les différentes tendances du comportement de recherche alimentaire affecterait le comportement des individus pendant le suivant expérience22. Réaliser des expériences répétées au même moment de la journée. Cela minimise la variabilité dans le comportement des groupes expérimentaux causés par des rythmes circadiens possible23. - Après 1 h d’acclimatation, ouvrir la porte coulissante.
Remarque : Les personnes qui sortent du trou, explorer le côté lumineux de la citerne, moins de 10 min, sont considérées proactive21. - Après 10 min, délicatement enlever les individus proactive du réservoir et transférez-les vers le réservoir de maintenance proactive.
- Après 15 min, recueillir les poissons qui restent dans la boîte noire, qui sont considérés comme réactif21et transférez-les vers le réservoir de maintenance réactive.
Remarque : Jeter les poissons qui se déplacent vers le côté lumineux de la cuve après 10 min21. Effectuer le test de personnalité avec neuf poisson à la fois jusqu'à ce que le nombre désiré de poissons proactif et réactifs nécessaires pour les essais décrits à l’article 5 est collecté. Cohérence de la personnalité proactive et réactive peut être vérifiée régulièrement à l’aide de la même approche.
3. Configurez le champ magnétique avec la Manipulation de champ magnétique unidimensionnel27
- Mettez le bloc d’alimentation (Figure 2 a).
- Placez le tunnel lové à l’endroit où le protocole rhéotaxique sera effectué (article 5) mais garder il débranché l’appareil de natation (Figure 2 a). Placez une sonde magnétique reliée avec un Gauss/Teslameter à l’intérieur du tunnel et vérifiez quelle tension est nécessaire pour obtenir la valeur choisie de champ magnétique le long de l’axe principal du tunnel.
Remarque : En raison des propriétés magnétiques d’un solénoïde, le champ est plutôt uniforme à l’intérieur du tunnel ; Ceci peut être vérifié en déplaçant lentement la sonde horizontalement et verticalement. - Débrancher la sonde et le tunnel de l’écoulement à l’appareil de natation.
- Démarrer avec le protocole rhéotaxique (section 5).
4. set Up du champ magnétique avec le champ magnétique tridimensionnelle Manipulation27
- Allumez le CPU, DAC et pilotes de la bobine (Figure 2 b).
- Définissez le champ magnétique choisi sur chacun des trois axes (x, y et z).
- Place du tunnel dans le centre de l’ensemble de paires de Helmholtz.
- Démarrer avec le protocole rhéotaxique (section 5).
5. test de la Rhéotaxie de poisson-zèbre dans la chambre de flux
- Transférer un à cinq poissons vers le tunnel de flux utilise un réservoir de 2 L avec les côtés et le fond obscurci.
- Mettre en marche la pompe et régler le débit dans le tunnel à 1,7 cm/s.
Remarque : Cette eau lent gardera l’eau dans le tunnel oxygéné et il facilitera la récupération de l’animale. - Laissez les animaux à s’habituer au tunnel de natation pendant 1 h.
- Démarrer l’enregistrement vidéo du comportement du poisson dans le tunnel.
Remarque : Nous avons utilisé une caméra (par exemple, Action de Yi 4K) avec commande à distance (p. ex., Bluetooth) et enregistré la vidéo sous la forme .mpg (30 images/s). - Commencer l’augmentation progressive du débit selon le protocole expérimental choisi (1,3 cm/s dans cette étude ; La figure 4).
Remarque : Pour ce protocole, nous avons utilisé des débits faibles qui, pour le poisson-zèbre, comprise entre 0 et 2,8 BL (longueur du corps) / s. Ces vitesses d’écoulement sont dans la plage des débits qui induisent continu orienté nage dans le poisson-zèbre (3 – 15 % de la vitesse de nage critique [Ucrit])24. L’utilisation de faibles débits (protocole25) de Brett suivant est liée aux caractéristiques comportementales spécifiques de cette espèce en présence de courants d’eau. Poisson zèbre ont tendance à nager le long de l’axe principal de la chambre, en retournant fréquemment, même en présence de débit de l’eau et ont tendance à nager tant en amont qu’en aval24,26. Ce comportement est affecté par le taux de flux d’eau, en train de disparaître à une vitesse relativement élevée (> 8 BL/s)26, lorsque ces animaux nagent en permanence face amont (réponse positive complète de rhéotaxique). Les déplacements verticaux et transversaux sont très rares. -
Effectuer morphométrie des animaux (sexe et la longueur totale [TL], longueur à la fourche [FL] ou BL) sur des photos de poissons dans une chambre morphométriques.
- Sélectionnez l’image appropriée.
- Ouvrez l’image dans ImageJ.
- Prendre note du sexe de l’animal (poisson zèbre mâle sont svelte et ont tendance à être jaunâtre, tandis que les femelles sont plus arrondies et tendent à avoir des colorations bleues et blanches).
- Cliquez sur analyser > Échelle définie et jeu de l’échelle de l’image en centimètres, en utilisant la longueur entière horizontale du tunnel comme référence.
- Cliquez sur analyser > mesurer et noter la longueur linéaire de l’animal.
- Calculer son poids corporel (PC).
Remarque : BW est calculé de relations sexe-FL-BW précédemment construites en laboratoire ou à partir de métadonnées. L’ensemble de la procédure évite les stress de la manipulation sur les animaux.
6. lunette Digital video Tracking
- Ouvrez le fichier vidéo avec Tracker 4.84 vidéo outil d’analyse et de modélisation.
Remarque : Si nécessaire, corriger une éventuelle distorsion vidéo à l’aide de la perspective et la distorsion radiale filtres. - Cliquez sur le repère dans le menu supérieur et définir les unités de longueur pour les centimètres et les unités de temps à secondes.
- Cliquez sur fichier > importation > vidéo et ouvrir un des vidéos dans Tracker 4,84.
- Cliquez sur « Axes de coordonnées » et réglez le système de référence pour suivre la position du poisson au fil du temps, avec l’axe des x le long du tunnel. Définissez l’origine à l’angle faible de l' aval se terminant le mur (à la sortied’eau).
- Cliquez sur la bonne voie > New > Point de masse et de commencer à suivre un poisson à la fois. Suivre les 5 dernières min de chaque étape que le poisson a passé pour chaque débit.
- Faire avancer la vidéo manuellement à intervalles de cinq images (0,5 s) et marquer l’heure et la position de l’animal à chaque tour en amont et en aval (UDt ; points rouges sur la Figure 5) et à chaque tour en aval-amont (DUt ; points bleus sur la Figure 5).
Remarque : Utiliser la position des yeux poisson comme référence pour la position du poisson. Suivre la position de l’animal à l’aide d’une masse ponctuelle. Exclure le suivi une période de baignade non orientés (i.e., temps de manœuvre). - À la fin de chaque session de suivi, sélectionnez les valeurs x et temps des valeurs de la table dans le coin inférieur droit de la fenêtre du logiciel. Faites un clic droit sur les données, puis cliquez sur copier les données > précision complète.
- Enregistrer les valeurs d’heure et de la valeur x de toutes les positions de rotation sur un fichier modèle de feuille de calcul pour calculer le temps total en amont (somme de tous les intervalles entre les UDT et DSE) et le temps total en aval (somme des intervalles entre les DSE et UDt), ainsi que les valeurs de l’indice rhéotaxique en pourcentages (% de RI) pour chaque flux étape (voir Figure 5).
Remarque : Le comportement rhéotaxique est quantifié par la proportion du temps total orienté que les poissons passent vers l’amont (natation ou rarement gel [c.-à-d., ils restent encore au fond du tunnel]27). Cette proportion est définie comme le RI % (Figure 5).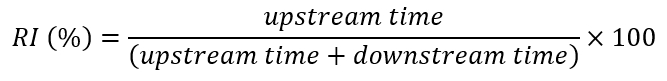
Résultats
Comme exemples de données, nous présentons les résultats obtenus contrôlant le champ magnétique le long de la direction d’écoulement de l’eau sur proactif et réactif se regrouper en bancs poisson zèbre16 en utilisant le programme d’installation illustré à la Figure 2 a (voir la section 3 du protocole). Ces résultats montrent comment le protocole décrit peut mettre en évidence des différences dans les réponses au ch...
Discussion
Le protocole décrit dans la présente étude permet aux scientifiques de quantifier les réponses de l’orientation complexe des espèces aquatiques résultant de l’intégration entre les deux repères externes (champ d’eau courante et géomagnétiques) et un facteur interne de l’animal, tel que personnalité. Le concept général est de créer un modèle expérimental qui permet aux scientifiques de séparer les individus de personnalité différente et étudier leur comportement d’orientation tout en contrôl...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
L’étude a été financée par la fondation de recherche fondamentale du service de physique et le département de biologie de l’Université Federico II de Naples. Les auteurs remercient Dr Claudia Angelini (Institut de Applied Calculus, Consiglio Nazionale delle Ricerche [CN], Italie) pour le soutien statistique. Les auteurs remercient Martina Scanu et Silvia Frassinet pour leur aide technique à la collecte des données et les techniciens du ministère F. Cassese, Passeggio G. et R. Rocco pour leur aide habile dans la conception et la réalisation de l’installation expérimentale. Nous remercions Laura Gentile pour aider à mener l’expérience pendant le tournage vidéo. Nous remercions Diana Rose Udel de l’Université de Miami pour le tournage les déclarations de l’entrevue de Alessandro Cresci.
matériels
| Name | Company | Catalog Number | Comments |
| 9500 G meter | FWBell | N/A | Gaussmeter, DC-10 kHz; probe resolution: 0.01 μT |
| AD5755-1 | Analog Devices | EVAL-AD5755SDZ | Quad Channel, 16-bit, Digital to Analog Converter |
| ALR3003D | ELC | 3760244880031 | DC Double Regulated power supply |
| BeagleBone Black | Beagleboard.org | N/A | Single Board Computer |
| Coil driver | Home made | N/A | Amplifier based on commercial OP (OPA544 by TI) |
| Helmholtz pairs | Home made | N/A | Coils made with standard AWG-14 wire |
| HMC588L | Honeywell | 900405 Rev E | Digital three-axis magnetometer |
| MO99-2506 | FWBell | 129966 | Single axis magnetic probe |
| Swimming apparatus | M2M Engineering Custom Scientific Equipment | N/A | Swimming apparatus composed by peristaltic pump and SMC Flow switch flowmeter with digital feedback |
| TECO 278 | TECO | N/A | Thermo-cryostat |
Références
- Nathan, R., et al. A movement ecology paradigm for unifying organismal movement research. Proceedings of the National Academy of Sciences. 105 (49), 19052-19059 (2008).
- Holyoak, M., Casagrandi, R., Nathan, R., Revilla, E., Spiegel, O. Trends and missing parts in the study of movement ecology. Proceedings of the National Academy of Sciences. 105 (49), 19060-19065 (2008).
- Miller, N., Gerlai, R. From Schooling to Shoaling: Patterns of Collective Motion in Zebrafish (Danio rerio). PLoS ONE. 7 (11), 8-13 (2012).
- Chapman, J. W., et al. Animal orientation strategies for movement in flows. Current Biology. 21 (20), R861-R870 (2011).
- Montgomery, J. C., Baker, C. F., Carton, A. G. The lateral line can mediate rheotaxis in fish. Nature. 389 (6654), 960-963 (1997).
- Baker, C. F., Montgomery, J. C. The sensory basis of rheotaxis in the blind Mexican cave fish, Astyanax fasciatus. Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 184 (5), 519-527 (1999).
- Putman, N. F., et al. An Inherited Magnetic Map Guides Ocean Navigation in Juvenile Pacific Salmon. Current Biology. 24 (4), 446-450 (2014).
- Cresci, A., et al. Glass eels (Anguilla anguilla) have a magnetic compass linked to the tidal cycle. Science Advances. 3 (6), 1-9 (2017).
- Newton, K. C., Kajiura, S. M. Magnetic field discrimination, learning, and memory in the yellow stingray (Urobatis jamaicensis). Animal Cognition. 20 (4), 603-614 (2017).
- Langdon, S. A., Collins, A. L. Quantification of the maximal swimming performance of Australasian glass eels, Anguilla australis and Anguilla reinhardtii, using a hydraulic flume swimming chamber. New Zealand Journal of Marine and Freshwater Research. 34 (4), 629-636 (2000).
- Faillettaz, R., Durand, E., Paris, C. B., Koubbi, P., Irisson, J. O. Swimming speeds of Mediterranean settlement-stage fish larvae nuance Hjort’s aberrant drift hypothesis. Limnology and Oceanography. 63 (2), 509-523 (2018).
- Takebe, A., et al. Zebrafish respond to the geomagnetic field by bimodal and group-dependent orientation. Scientific Reports. 2, 727 (2012).
- Osipova, E. A., Pavlova, V. V., Nepomnyashchikh, V. A., Krylov, V. V. Influence of magnetic field on zebrafish activity and orientation in a plus maze. Behavioural Processes. 122, 80-86 (2016).
- Cresci, A., De Rosa, R., Putman, N. F., Agnisola, C. Earth-strength magnetic field affects the rheotactic threshold of zebrafish swimming in shoals. Comparative Biochemistry and Physiology - Part A: Molecular and Integrative Physiology. 204, 169-176 (2017).
- Tesch, F. W. Influence of geomagnetism and salinity on the directional choice of eels. Helgoländer Wissenschaftliche Meeresuntersuchungen. 26 (3-4), 382-395 (1974).
- Cresci, A., et al. Zebrafish “personality” influences sensitivity to magnetic fields. Acta Ethologica. , 1-7 (2018).
- Benus, R. F., Bohus, B., Koolhaas, J. M., Van Oortmerssen, G. A. Heritable variation for aggression as a reflection of individual coping strategies. Cellular and Molecular Life Sciences. 47 (10), 1008-1019 (1991).
- Dahlbom, S. J., Backstrom, T., Lundstedt-Enkel, K., Winberg, S. Aggression and monoamines: Effects of sex and social rank in zebrafish (Danio rerio). Behavioural Brain Research. 228 (2), 333-338 (2012).
- Koolhaas, J. M. Coping style and immunity in animals: Making sense of individual variation. Brain, Behavior, and Immunity. 22 (5), 662-667 (2008).
- Dahlbom, S. J., Lagman, D., Lundstedt-Enkel, K., Sundström, L. F., Winberg, S. Boldness predicts social status in zebrafish (Danio rerio). PLoS ONE. 6 (8), 2-8 (2011).
- Rey, S., Boltana, S., Vargas, R., Roher, N., Mackenzie, S. Combining animal personalities with transcriptomics resolves individual variation within a wild-type zebrafish population and identifies underpinning molecular differences in brain function. Molecular Ecology. 22 (24), 6100-6115 (2013).
- Toms, C. N., Echevarria, D. J., Jouandot, D. J. A Methodological Review of Personality-related Studies in Fish: Focus on the Shy-Bold Axis of Behavior. International Journal of Comparative Psychology. 23, 1-25 (2010).
- Boujard, T., Leatherland, J. F. Circadian rhythms and feeding time in fishes. Environmental Biology of Fishes. 35 (2), 109-131 (1992).
- Plaut, I. Effects of fin size on swimming performance, swimming behaviour and routine activity of zebrafish Danio rerio. Journal of Experimental Biology. 203 (4), 813-820 (2000).
- Tierney, P., Farmer, S. M. Creative Self-Efficacy Development and Creative Performance Over Time. Journal of Applied Psychology. 96 (2), 277-293 (2011).
- Plaut, I., Gordon, M. S. swimming metabolism of wild-type and cloned zebrafish brachydanio rerio. Journal of Experimental Biology. 194 (1), (1994).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Tudorache, C., Schaaf, M. J. M., Slabbekoorn, H. Covariation between behaviour and physiology indicators of coping style in zebrafish (Danio rerio). Journal of Endocrinology. 219 (3), 251-258 (2013).
- Uliano, E., et al. Effects of acute changes in salinity and temperature on routine metabolism and nitrogen excretion in gambusia (Gambusia affinis) and zebrafish (Danio rerio). Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 157 (3), 283-290 (2010).
- Palstra, A. P., et al. Establishing zebrafish as a novel exercise model: Swimming economy, swimming-enhanced growth and muscle growth marker gene expression. PLoS ONE. 5 (12), (2010).
- Bak-Coleman, J., Court, A., Paley, D. A., Coombs, S. The spatiotemporal dynamics of rheotactic behavior depends on flow speed and available sensory information. The Journal of Experimental Biology. 216, 4011-4024 (2013).
- Brett, J. R. The Respiratory Metabolism and Swimming Performance of Young Sockeye Salmon. Journal of the Fisheries Research Board of Canada. 21 (5), 1183-1226 (1964).
- Quintella, B. R., Mateus, C. S., Costa, J. L., Domingos, I., Almeida, P. R. Critical swimming speed of yellow- and silver-phase European eel (Anguilla anguilla, L.). Journal of Applied Ichthyology. 26 (3), 432-435 (2010).
- Spence, R., Gerlach, G., Lawrence, C., Smith, C. The behaviour and ecology of the zebrafish, Danio rerio. Biological Reviews. 83 (1), 13-34 (2008).
- Engeszer, R. E., Patterson, L. B., Rao, A. A., Parichy, D. M. Zebrafish in the Wild: A Review of Natural History and New Notes from the Field. Zebrafish. 4 (1), (2007).
- Gardiner, J. M., Atema, J. Sharks need the lateral line to locate odor sources: rheotaxis and eddy chemotaxis. Journal of Experimental Biology. 210 (11), 1925-1934 (2007).
- Thorpe, J. E., Ross, L. G., Struthers, G., Watts, W. Tracking Atlantic salmon smolts, Salmo salar L., through Loch Voil, Scotland. Journal of Fish Biology. 19 (5), 519-537 (1981).
- Bottesch, M., et al. A magnetic compass that might help coral reef fish larvae return to their natal reef. Current Biology. 26 (24), R1266-R1267 (2016).
- Boles, L. C., Lohmann, K. J. True navigation and magnetic maps in spiny lobsters. Nature. 421 (6918), 60-63 (2003).
- Dingemanse, N. J., Kazem, A. J. N., Réale, D., Wright, J. Behavioural reaction norms: animal personality meets individual plasticity. Trends in Ecology and Evolution. 25 (2), 81-89 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon