Method Article
Extraction de métabolites aqueux de cellules adhérentes cultivées pour analyse métabolomique par électrophorèse capillaire-spectrométrie de masse
Dans cet article
Résumé
Le but de cet article est de décrire un protocole pour l’extraction de métabolites aqueux de cellules adhérentes cultivées pour l’analyse métabolomique, en particulier, l’électrophorèse capillaire-spectrométrie de masse.
Résumé
L’analyse métabolomique est une approche de l’omiques prometteuse non seulement pour comprendre la régulation métabolique spécifique dans les cellules cancéreuses par rapport aux cellules normales, mais aussi pour identifier les biomarqueurs pour la détection précoce du cancer et la prédiction de la réponse à la chimiothérapie dans patients atteints de cancer. La préparation d’échantillons uniformes pour l’analyse métabolomique est une question cruciale qui reste à traiter. Ici, nous présentons un protocole facile et fiable pour l’extraction de métabolites aqueux de cellules adhérentes cultivées pour l’analyse métabolomique par électrophorèse capillaire-spectrométrie de masse (CE-MS). Les métabolites aqueux des cellules cultivées sont analysés par la culture et le lavage des cellules, le traitement des cellules avec du méthanol, l’extraction de métabolites, et l’élimination des protéines et des macromolécules avec des colonnes de spin pour l’analyse CE-MS. Les résultats représentatifs utilisant des lignées cellulaires de cancer du poumon traitées avec le diamide, un réactif oxydatif, illustrent le déplacement métabolique clairement observable des cellules sous le stress oxydatif. Cet article serait particulièrement utile pour les étudiants et les enquêteurs impliqués dans la recherche sur la métabolomique, qui sont nouveaux à récolter des métabolites de lignées cellulaires pour analyse par CE-MS.
Introduction
Otto Warburg a observé que les cellules cancéreuses acquièrent la capacité inhabituelle de prendre du glucose et de la fermenter pour produire du lactate en présence d’oxygène adéquat — un phénomène appelé effet de Warburg ou glycolyse aérobie1,2. Les anomalies de la respiration mitochondriale sont spéculé comme base sous-jacente pour la glycolyse aérobie dans les cellules cancéreuses3. En effet, l’effet de Warburg est la base de l’imagerie tumorale par le fluorodésoxyglucose (FDG)-tomographie par émission de positrons (PET), qui est largement utilisée dans la pratique clinique4,5. Un taux élevé de glycolyse aérobie est considéré comme une caractéristique clé du cancer et a été récemment adopté comme l’un des «poinçons du cancer bien connus», comme décrit par D. Hanahan et B. Weinberg6. Les mutations somatiques dans les oncogènes et les gènes suppresseurs tumoraux — tels que HRAS/Kras/nras, EGFR, BRAF, myc, TP53, isocitrate déshydrogénase (IDH) et fumarate hydratase (FH ) — ont été liés à des changements métaboliques spécifiques dans les cellules cancéreuses, censés être le résultat de l’effet de Warburg7.
L’analyse métabolomique est une approche prometteuse non seulement pour comprendre la régulation métabolique dans les cellules cancéreuses, mais aussi pour identifier les biomarqueurs du cancer au stade précoce et la prédiction de la réponse chimiothérapique. Après le traitement des cellules cancéreuses sensibles ou résistantes avec des composés anticancéreux, le suivi de leurs réponses métaboliques facilite l’identification des biomarqueurs métaboliques pour prédire l’efficacité des thérapies anticancéreuses spécifiques chez les patients cancéreux8 ,9,10,11. Dans cet article, les lignées cellulaires cancéreuses dérivées d’un adénocarcinome pulmonaire avec une mutation EGFR traitée avec du diamide — qui provoque un stress oxydatif — ont été utilisées comme modèles pour l’analyse métabolomique. L’avantage de cette méthode analytique utilisant l’électrophorèse capillaire-spectrométrie de masse (ce-ms) est sa mesure complète des métabolites chargés avec la gamme de masse m/z 50-100012,13. Le but de cet article est de fournir aux novices un protocole visuel détaillé par étapes pour la préparation des métabolites aqueux des cellules cancéreuses cultivées et l’analyse métabolomique subséquente, en particulier par CE-MS.
Protocole
1. culture cellulaire au jour 1
Note: chaque échantillon d’extraction de métabolite doit être préparé à partir d’un seul plat de culture tissulaire de 100 mm qui est modérément mais pas entièrement anastomosé (contenant approximativement 2 à 5 millions de cellules). Calculez le nombre de plats nécessaires au dosage et préparez-les en conséquence.
- Culture HCC827 et PC-9 cellules dans 5% CO2 à 37 ° c dans le milieu RPMI-1640 complété par 10% de sérum bovin FŒTAL (FBS).
- Aspirer les milieux de culture cellulaire des plats de culture de 100 mm.
- Laver les cellules de chaque plat à l’aide de 2 mL de solution saline tamponnée au phosphate (PBS) sans calcium ni magnésium. Agiter délicatement chaque plat de sorte que la solution PBS recouvre complètement la surface du plat.
- Aspirer le tampon de lavage des plats de culture.
- Réchauffer 0,25% de solution de trypsine-EDTA à 37 ° c et ajouter 2 mL de solution de trypsine-EDTA avec une pipette sérologique de 5 mL. Roche doucement chaque plat de sorte que la trypsine recouvre complètement la surface du plat.
- Incuber les plats de culture à 37 ° c pendant environ 5 min.
- Ajouter 4 mL de milieu de croissance complet préchauffé par plat. Resuspendre les cellules en milieu par pipetage en douceur plusieurs fois.
- Transférer chaque suspension cellulaire dans un tube conique de 15 mL séparé et centrifuger à 800 × g pendant 5 min.
- Resuspendre chaque culot de cellule dans 2 mL de milieu de croissance complet préchauffé.
- Déterminez le nombre total et la viabilité en pourcentage des cellules à l’aide du compteur de cellules automatisé et de la solution bleue 0,4% trypan.
- Mélanger 10 μL de suspension cellulaire et 10 μL de solution de bleu trypan de 0,4%.
- Chargez 10 μL d’échantillon dans la chambre de comptage de cellules par action capillaire.
- Insérez la glissière de la chambre dans le compteur de cellules automatisé. La lumière transmise s’allume automatiquement et l’instrument auto se concentre sur la cellule.
- Appuyez sur le bouton capture pour capturer l’image et afficher les résultats.
- Si nécessaire, ajouter un autre milieu de croissance pour obtenir la concentration de cellules désirée.
- Semences d’environ 1 à 2,5 millions de cellules par plat de culture cellulaire de 100 mm.
Remarque: les concentrations de métabolite déterminées par l’analyse CE-MS seront normalisées en fonction du nombre de cellules viables. Aux fins du comptage de cellules, il est nécessaire de préparer au moins un plat de culture à ensemencement supplémentaire pour chaque groupe. - Incuber les plats de culture dans 5% CO2 à 37 ° c pendant 18 h.
2. préparation des réactifs
- Diluer une solution étalon interne commerciale incluant la L-méthionine sulfone et l’acide d-camphre-10-sulfonique 1000 dans de l’eau ultrapure.
NOTE: pour moins de 80 échantillons, mélanger simplement 50 μL de la solution étalon interne 1 et 45 mL d’eau ultrapure dans une fiole jaugée de 50 mL, puis apporter la solution jusqu’à 50 mL avec de l’eau ultrapure. - Préparer une solution de mannitol de 0,05 g/mL dans de l’eau ultrapure comme tampon de lavage.
Remarque: pour moins de 30 échantillons, dissoudre simplement 25 g de mannitol dans 500 mL d’eau ultrapure. Il faut environ 15 mL de tampon de lavage par plat de culture de 100 mm, afin de préparer un volume suffisant de tampon de lavage en fonction du nombre d’échantillons.
3. prélavage des unités de filtration centrifuge
- Pipetter 250 μL d’eau ultrapure dans la cuvette filtrante de chaque unité de filtration centrifuge (voir le tableau des matériaux).
Remarque: deux unités filtrantes par échantillon sont requises. - Visser hermétiquement les unités filtrantes et centrifuger à 9 100 × g à 4 ° c pendant 5 min.
- Vérifier le volume de chaque filtrat — si un filtrat significatif s’est accumulé pendant la première rotation courte, l’unité filtrante peut être défectueuse. Dans ce cas, jetez l’unité de filtration et utilisez une nouvelle unité de filtrage à la place.
- Fermez fermement les couvercles des unités filtrantes et Centrifugez à nouveau à 9 100 × g à 4 ° c pendant 30 min.
- S’assurer qu’aucune eau ultrapure ne reste dans l’une des tasses filtrantes; enlever l’eau ultrapure filtrée dans chaque tube collecteur avec une pipette et la jeter.
Remarque: n’essayez pas d’enlever l’eau résiduelle dans une cuvette de filtre avec une pipette car elle pourrait endommager le filtre. - Remplacez les tasses filtrantes dans leurs tubes de prélèvement.
Remarque: utilisez les filtres centrifuges en moins d’une heure, car ils risquent d’être endommagés lors du séchage.
4. culture cellulaire au jour 2
-
Sortez les plats de culture de 100 mm de l’incubateur.
Remarque: la durée de culture de la cellule recommandée est de 18 h. - Aspirer le milieu de culture cellulaire de chaque plat de culture de 100 mm.
- Ajouter 10 mL de milieu de culture cellulaire qui comprend les concentrations appropriées de composés ou de médicaments à chaque plat, en prenant soin de ne pas déranger la couche cellulaire.
Remarque: à des fins de démonstration, nous avons ajouté 10 μL de diamure de 250 mM dissous dans le PBS (concentration finale de 250 μM) dans cette expérience. - Incuber les plats de culture à 37 ° c pendant 30 min en présence de diamide ou de PBS comme contrôle.
- Aspirer le milieu de culture cellulaire de chaque plat de culture de 100 mm.
- Lavez les cellules en ajoutant doucement 2 mL de solution de mannitol à 5% au bord de chaque plat, en prenant soin de ne pas déranger la couche cellulaire, puis inclinez légèrement le plat.
Remarque: le PBS ou la solution saline interfère avec l’analyse métabolomique basée sur le CE-MS et affecte négativement les résultats de mesure, et ne doit donc pas être utilisé comme tampon de lavage. - Aspirer le tampon de lavage de chaque plat de culture, puis laver les cellules à nouveau en ajoutant doucement 10 mL de tampon de lavage par plat et en inclinant légèrement le plat.
- Aspirer complètement le tampon de lavage du bord de chaque plat de culture.
NOTE: aspirer autant de tampon de lavage que possible, tout en prêtant attention à ne pas aspirer les cellules. Le mannitol résiduel peut interférer avec l’analyse CE-MS; l’aspiration des cellules diminuera le nombre de cellules et deviendra ainsi une source d’erreur dans la normalisation des données.
5. extraction des métabolites des cellules cultivées
- Ajouter 800 μL de 99,7% de méthanol par plat de culture. Roche doucement chaque plat de culture d’avant en arrière pour couvrir toute sa surface. Laisser la vaisselle à température ambiante pendant 30 s.
- Ajouter lentement 550 μL de la solution étalon interne diluée par plat en immergeant la pointe de la pipette dans le méthanol et en le pipetant doucement plusieurs fois.
- Roche doucement chaque plat de culture d’avant en arrière pour couvrir toute sa surface.
- Laisser la vaisselle à température ambiante pendant 30 s.
6. ultrafiltration des extraits cellulaires
- Transférer la solution extraite de chaque plat de culture à un tube de microcentrifugation de 1,5 mL séparé.
- Centrifuger les tubes à 2 300 × g à 4 ° c pendant 5 min.
- Transférer 350 μL de chaque surnageant dans deux unités filtrantes centrifuges par échantillon.
NOTE: à partir de chaque plat de culture, un total de 700 μL de la solution extraite est transféré dans deux tubes filtrants (350 μL/tube). - Centrifuger les tubes filtrants à 9 100 × g à 4 ° c pendant environ 2 h jusqu’à ce qu’aucun liquide ne reste dans les tasses filtrantes.
- Retirez les tasses filtrantes et Fermez hermétiquement les couvercles des tubes de prélèvement.
7. évaporation de l’échantillon
- Préparez un évaporateur centrifuge — typiquement, il s’agit d’un évaporateur, d’un piège à froid et d’une pompe à vide.
- Placer les tubes de prélèvement dans l’évaporateur centrifuge.
Remarque: laissez les couvercles des tubes ouverts. - Évaporez les solutions d’échantillonnage extraites dans des conditions de vide à température ambiante.
NOTE: les configurations typiques pour le nombre de rotations et la pression sont 1 500 RPM et 1 000 PA, respectivement, et il faut généralement environ 3 h pour évince complètement les échantillons. - Vérifiez qu’aucun liquide ne reste dans l’un des tubes de prélèvement et fermez fermement les couvercles des tubes.
- Conserver les tubes de prélèvement dans un congélateur profond à température ultra basse (− 80 ° c) jusqu’à l’analyse métabolomique.
8. analyse métabolomique par CE-MS
- Resuspendre le filtrat dans 50 μL d’eau ultrapure immédiatement avant l’analyse CE-MS.
- Effectuer l’analyse ce-ms par des méthodes décrites précédemment12,13 utilisant le système d’électrophorèse capillaire et le système de spectromètre de masse de temps de vol équipé d’une pompe isocratique, d’un adaptateur ce-ms, et d’un pulvérisateur ce-ESI-MS.
Remarque: les deux systèmes peuvent être contrôlés par le logiciel des vendeurs du système et sont reliés par un capillaire en silice fondue (50 μM de diamètre interne × 80 cm de longueur totale).- Mettre en place des instruments et des flacons d’échantillon, préparer le capillaire avec une cassette capillaire, reconstituer les liquides de gaine et les tampons d’électrophorèse appropriés en fonction du mode d’analyse des anions ou des cations, puis appliquer des tensions.
Remarque: les conditions d’instrumentation et d’analyse sont décrites en détail ailleurs12,13. - Ouvrez le logiciel et préparez une réserve de travail contenant des méthodes d’acquisition de données et des exemples d’informations.
- Démarrez une série de tests et vérifiez les données telles que l’intensité du signal et la forme maximale des étalons internes et la résolution maximale d’autres composés standard.
- Affiner les conditions analytiques si nécessaire.
- Injecter les solutions d’échantillonnage à 50 mbar pour 3 s et une tension de 30 kV.
Remarque: CE-MS a été effectué soit en mode ion positif ou négatif. Réglez le spectromètre pour numériser la plage de masse m/z 50 – 1000. La tension capillaire a été fixée à 4 kV; le débit d’azote gazeux (température du chauffe-eau 300 ° c). Pour le mode positif, le fragmentor, le skimmer et la tension de RFV OCT ont été fixés respectivement à 75, 50 et 125 V. Pour le mode d’ion négatif, la tension de fragmenteur, d’écumoire et de RFV OCT a été fixée respectivement à 100, 50 et 200 V.
- Mettre en place des instruments et des flacons d’échantillon, préparer le capillaire avec une cassette capillaire, reconstituer les liquides de gaine et les tampons d’électrophorèse appropriés en fonction du mode d’analyse des anions ou des cations, puis appliquer des tensions.
- Analysez les données du spectre.
- Extrayez les pics des données spectrales de masse à l’aide d’un logiciel d’intégration automatique afin d’obtenir des informations de pointe, y compris m/z, zone de crête et temps de migration (MT).
Remarque: la méthode est décrite en détail ailleurs14. - Exclure les pics de signal correspondant aux isotopomères, aux ions d’adduit et à d’autres ions de produits de métabolites connus.
- Annotez les pics restants avec les informations de la base de données du métabolite HMT selon les valeurs m/z et MTS.
- Normalisez les zones des pics annotés aux niveaux standard internes et au nombre de cellules par échantillon.
- Évaluer la concentration de chaque métabolite dans les cellules cultivées (pmol/106 cellules) à l’aide de courbes standard préparées pour chaque métabolite.
- Utiliser les concentrations de métabolite quantifiées pour les analyses statistiques ultérieures et les interprétations biologiques14.
- Extrayez les pics des données spectrales de masse à l’aide d’un logiciel d’intégration automatique afin d’obtenir des informations de pointe, y compris m/z, zone de crête et temps de migration (MT).
Résultats
Étant donné que les concentrations de métabolites dans les cellules cancéreuses (pmol/106 cellules) sont normalisées au nombre de cellules viables, des conditions expérimentales devraient être établies avec précaution afin de minimiser la variation du nombre de cellules viables entre les conditions. Par exemple, le traitement diamide était à une concentration relativement élevée (250 μM), mais pendant une courte période pour permettre à toutes les cellules de croître aussi équitablement que possible, ce qui équivaut à égaliser le nombre de cellules viables analysées. Dans ces conditions expérimentales, les cellules HCC827 et PC-9 ont augmenté également pendant 3 h (figure 1). L’analyse CE-MS des cellules traitées au diamide par rapport aux cellules traitées par PBS (témoins) a révélé des métabolites différentiels 175 et 150 dans les cellules HCC827 et PC-9, respectivement. Parmi ceux-ci, plusieurs intermédiaires dans la voie du pentose phosphate (PPP) et dans la glycolyse supérieure étaient significativement plus élevés dans les conditions traitées au diamide dans les deux lignées cellulaires, alors que quelques intermédiaires du cycle de l’acide tricarboxylique (TCA) étaient plus faibles dans les conditions (figure 2 et figure 3).
Le PPP génère des équivalents réducteurs sous la forme d’une réduction de nicotinamide adénine dinucléotide phosphate (NADPH), qui est utilisé pour l’entretien de l’homéostasie redox et la biosynthèse des acides gras15. Après traitement diamide, le niveau d’acide gluconique — un glucose oxydé — a augmenté de 12 fois dans les cellules HCC827 et de 10 fois dans les cellules PC-9; de même, après un traitement diamide, le taux de glucose 6-phosphate (G6P) — un glucose phosphorylé et le premier produit de glycolyse catalysé par l’hexokinase — a également augmenté de 6,3 et de 3,5 fois dans les cellules HCC827 et PC-9, respectivement (figure 4). De plus, après traitement diamide, les concentrations de 6-phosphogluconate (6PG) — le premier intermédiaire en PPP — ont considérablement augmenté de 89 dans les cellules de HCC827 et de 231 fois dans les cellules PC-9 comparativement aux concentrations observées dans les contrôles du PBS (figure 4). En revanche, les concentrations d’autres intermédiaires glycolytiques, comme le fructose 6-phosphate (F6P) et le fructose 1,6-bisphosphate (F1, 6P), n’ont pas changé dans la condition expérimentale diamide (figure 4). Les concentrations totales de nicotinamide adénine dinucléotide phosphate (NADP+) étaient presque équivalentes entre le traitement diamide et les conditions de contrôle du PBS (figure 4), suggérant que le glucose était principalement catabolisé via le PPP.
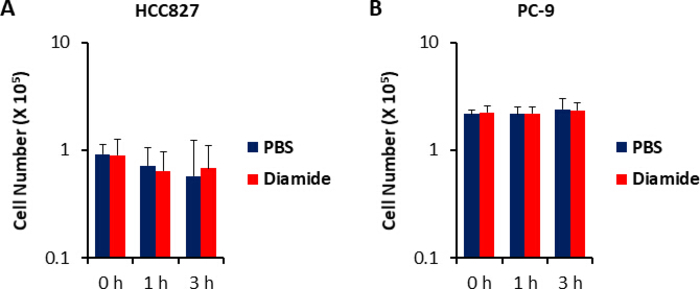
La figure 1. Nombre de cellules inchangé sur traitement diamide. Les réponses de croissance cellulaire à 250 μm de diamide ont été mesurées à l’aide d’une coloration bleue trypane. Les nombres cellulaires de (A) HCC827 et (B) les cellules PC-9 traitées avec PBS (bleu) ou diamide (rouge; 250 μM) pendant 1 ou 3 h sont affichées. Les données sont affichées comme la moyenne ± SD (n = 6). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
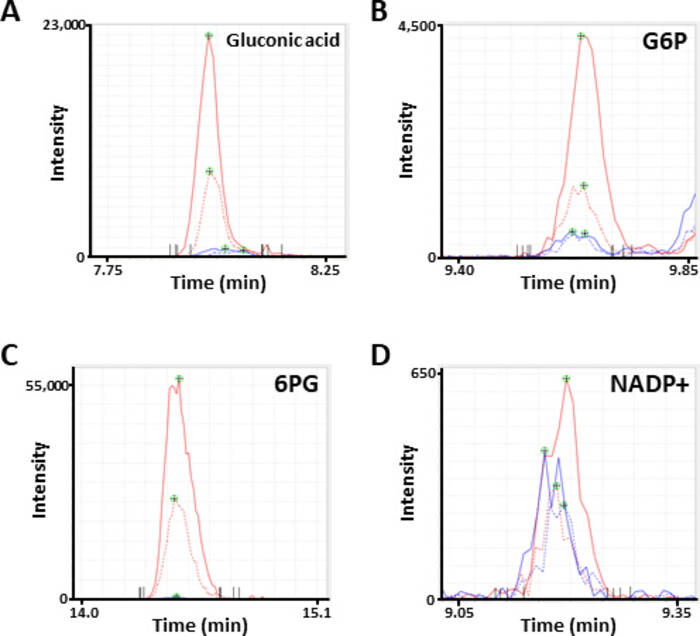
La figure 2. Les pics représentatifs de la SEP des métabolites. Electropherogrammes annotés comme (A) acide gluconique, (B) glucose 6-phosphate (G6P), (C) 6-phosphogluconate (6PG), et (D) nicotinamide adénine dinucléotide phosphate (NADP+) obtenu par analyse ce-ms. Chaque ligne indique la ligne de la cellule (solide, HCC827; pointillé, PC-9) et le traitement (bleu, PBS; rouge, diamide) utilisé. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
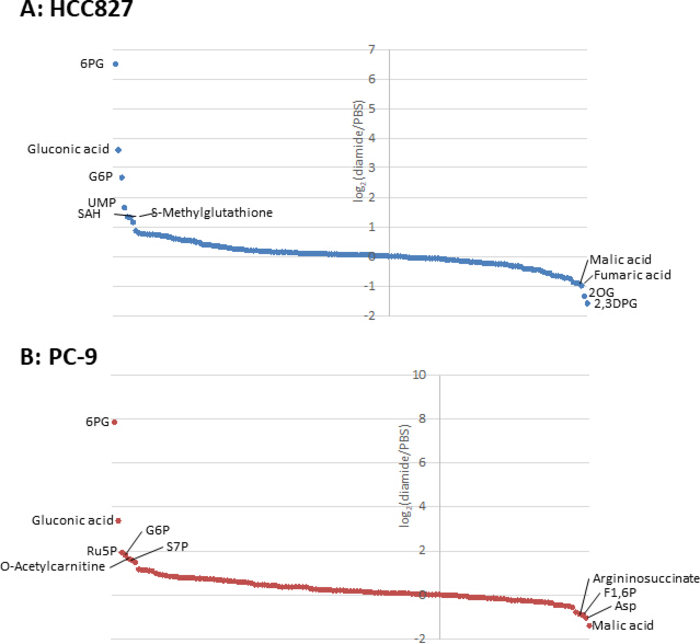
La figure 3. Profils métabolome des métabolites intracellulaires. Les changements de pli des métabolites dans (A) HCC827 et (B) les cellules de PC-9 traitées aveclediamide sont montrées comme log2(diamide/PBS). Au total, 175 et 150 métabolites ont été annotés respectivement dans les cellules HCC827 et PC-9. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
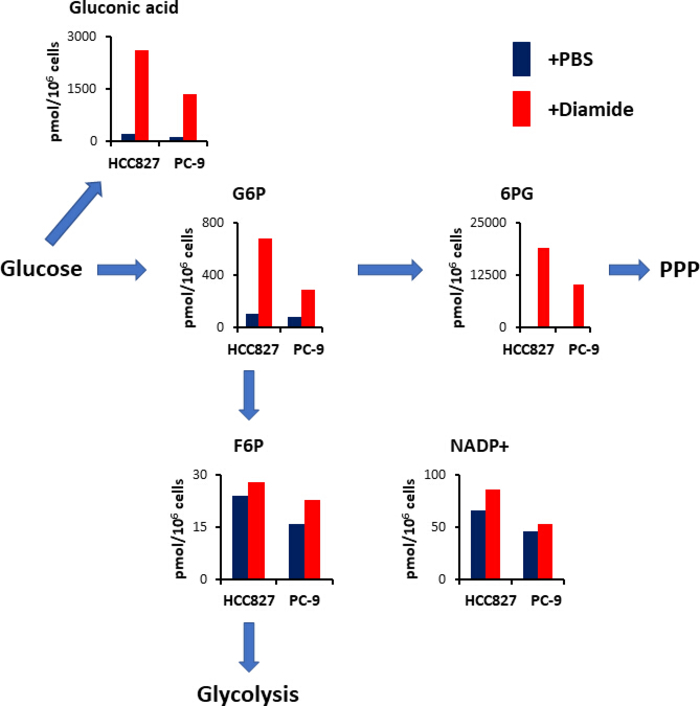
La figure 4. Up-Regulation du PPP sur le traitement diamide. Les concentrations intracellulaires (pmol/106 cellules) des métabolites clés impliqués dans la glycolyse et la voie du pentose phosphate (PPP) après le traitement par le diamide sont montrées. Les métabolites ont été extraits des cellules HCC827 et PC-9 traitées avec du PBS (bleu) ou du diamide (rouge, 250 μM) pendant 30 min. métabolites représentatifs tels que l’acide gluconique, le glucose 6-phosphate (G6P), le fructose 6-phosphate (F6P), 6 -le phosphogluconate (6PG) et le nicotinamide adénine dinucléotide phosphate (NADP+) sont montrés. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Ici, nous décrivons une méthodologie largement accessible pour préparer les métabolites des cellules cancéreuses cultivées pour l’analyse métabolomique basée sur le CE-MS. Un des points les plus critiques dans ce protocole est la préparation appropriée des cellules cancéreuses, parce que les concentrations mesurées de métabolite sont normalisées au nombre de cellules viables. Pour une estimation précise du nombre de cellules, il est nécessaire de préparer au moins un plat de culture supplémentaire par groupe expérimental pour compter le nombre de cellules viables en parallèle avec l’extraction des métabolites pour l’analyse métabolomique. En outre, le même nombre de cellules doit être ensemencé dans chaque plat pour les répliques et dans le plat pour le comptage; à l’avenir, cela serait facilité par un protocole de comptage cellulaire rapide et sans stress (p. ex., sans trypsine) qui permet d’utiliser le même plat pour le comptage de cellules viables et l’extraction de métabolites. Les précautions doivent être prises pendant les lavages afin que les cellules ne se détachent pas de la surface des plats. Des tests de cytotoxicité sévère et d’autres expériences qui réduisent l’adhérence des cellules peuvent ne pas convenir à ce protocole d’extraction en raison d’une perte potentielle de cellules pendant la procédure de lavage.
Il est important d’utiliser une solution de mannitol à 5% comme tampon de lavage pour extraire les métabolites des cellules cultivées pour une analyse métabolomique basée sur le CE-MS, car les tampons à base de sel, tels que le PBS, interfèrent avec l’analyse métabolomique et nuisent à la mesure.
Deux ou trois plats peuvent être combinés en un seul échantillon en extrayant individuellement des métabolites de chaque plat, puis en regroupant des échantillons; Cependant, la combinaison de plusieurs plats augmente souvent le mannitol résiduel dans la solution de métabolite extrait. Cela peut également interférer avec l’analyse métabolomique par CE-MS. par conséquent, il est recommandé de ne pas utiliser plusieurs plats ou des puits comme un seul échantillon.
Cette méthode d’analyse métabolomique utilisant CE-MS a été développée pour la mesure complète des molécules chargées avec des poids moléculaires entre 50 et 1000 da; ainsi, ce protocole est optimisé pour l’extraction de composés aqueux, de faible poids moléculaire. Par conséquent, ce protocole ne convient pas à l’extraction de métabolites hydrophobes tels que les lipides ou les macromolécules telles que les protéines et les acides nucléiques. Étant donné qu’il y a une demande croissante d’analyses lipidiques complètes ou de lipidomique d’échantillons de cellules cultivées, le développement d’un protocole facile et efficace pour l’extraction simultanée de métabolites hydrophiles et hydrophobes est nécessaire.
La première étape de l’extraction du métabolite — milieu aspirant et cellules de lavage avec le mannitol — doit être effectuée aussi rapidement que possible pour minimiser les changements au profil métabolique des cellules. Le traitement des cellules avec le méthanol après le lavage avec le mannitol est supposé pour dénaturer les protéines et ainsi empêcher les enzymes de catalyser d’autres réactions métaboliques. Cependant, même après le traitement au méthanol, des réactions chimiques non enzymatiques — telles que des réactions redox, certains processus de décarboxylation et des liaisons THIOLÉES — peuvent avoir lieu. Ainsi, toutes les concentrations de métabolites impliqués dans ces réactions mesurées par ce protocole doivent être interprétées avec prudence. Contrairement au génome ou au transcriptome, le métabolome est constitué de molécules possédant une grande variété de propriétés chimiques; par conséquent, aucun protocole unique ne peut extraire tous les métabolites sans aucune perte ou perturbation. Pour des mesures plus précises de ces métabolites hautement réactifs, un protocole spécifiquement conçu pour extraire certains groupes de métabolites, qui nécessite des fractionnements et des dérivations, doit être consulté. Le protocole présenté ici, cependant, décrit une extraction simple et rapide de métabolites aqueux à partir d’échantillons de cellules cultivées pour l’analyse métabolomique par CE-MS. Dans ce document, nous ne pouvions pas décrire comment mettre en place CE-MS en détail parce que le présent manuscrit est différent, cependant, décrivant les étapes détaillées pour mettre en place CE-MS peut nécessiter un article distinct dédié.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions tous les membres du centre de promotion de l’industrie régionale de Shonai pour leur aide. Ce travail a été appuyé en partie par des fonds de recherche de la préfecture de Yamagata et de la ville de Tsuruoka, par le Fonds national de recherche et de développement du centre du cancer [Grant number 28-A-9], et par la société japonaise pour la promotion de la science (JSPS) KAKENHI [Grant number 17K07189] à HM.
matériels
| Name | Company | Catalog Number | Comments |
| Automated cell counter | Thermo Scientific | AMQAX1000 | Countess II automated cell counter |
| Automatic integration software | Agilent Technologies | MassHunter G3335-60041 | version B.02.00 |
| CE system | Agilent Technologies | Agilent 7100 CE system | |
| CE/MS adapter kit | Agilent Technologies | G1603A | |
| CE-ESI-MS Sprayer kit | Agilent Technologies | G1607A | |
| Cell counting chamber slide | Thermo Scientific | C10282 | Countess cell counting chamber slides |
| Centrifugal filter device, 5 kDa | Human Metabolome Technologies | ULTRAFREE MC PLHCC, UFC3LCCNB-HMT | |
| Conical sterile polypropylene tube, 15 ml | Thermo Scientific | N339651 | |
| Conical sterile polypropylene tube, 50 ml | Thermo Scientific | N339653 | |
| Costar stripette, 10 ml | Corning | 4488 | |
| Costar stripette, 5 ml | Corning | 4487 | |
| D(-)-Mannitol | Wako | 133-00845 | 500 g |
| Dulbecco's phosphate buffered saline (DPBS) | Sigma-Aldrich | D8537-500ML | |
| Electrophoresis buffer | Human Metabolome Technologies | H3301-1001 | for cation analysis |
| Electrophoresis buffer | Human Metabolome Technologies | H3302-1021 | for anion analysis |
| Fetal bovine serum | Biowest | S1780 | |
| Filter tip, 1000 μl | Watson | 124P-1000S | |
| Filter tip, 20 μl | Watson | 124P-20S | |
| Filter tip, 200 μl | Watson | 1252-703CS | |
| Fused silica capillary | Polymicro Technologies | TSP050375 | 50 μm i.d. × 80 cm total length |
| HCC827 | American Type Culture Collection | CRL-2868 | |
| Internal standard solution | Human Metabolome Technologies | H3304-1002 | |
| Isocratic pump | Agilent Technologies | Agilent 1100 Series Isocratic Pump | |
| Methanol | Wako | 138-14521 | 1 L, LC/MS grade |
| Microtube, 1.5 ml | Watson | 131-415C | |
| Operating Software | Agilent Technologies | ChemStation G2201AA | version B.03.01 for CE |
| PC-9 | RIKEN Bio Resource Center | RCB4455 | |
| RPMI-1640 | Sigma-Aldrich | R8758-500ML | |
| Sterile tissue culture dish, 100 mm | Corning | 430167 | |
| Time-of-flight mass spectrometer | Agilent Technologies | Agilent G1969A Time-of-Flight LC/MS | |
| Trypan blue solution, 0.4% | Thermo Scientific | T10282 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Ultrapure water | Merck | Milli-Q water | 18.2 MΩ·cm pure water |
| Volumetric flask, 50 ml | Iwaki | 5640FK50E | TE-32 |
Références
- Lunt, S. Y., Vander Heiden, M. G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annual Review Cell and Developmental Biology. 27, 441-464 (2011).
- Soga, T. Cancer metabolism: key players in metabolic reprogramming. Cancer Science. 104 (3), 275-281 (2013).
- Zong, W. X., Rabinowitz, J. D., White, E. Mitochondria and Cancer. Molecular Cell. 61 (5), 667-676 (2016).
- Fukuda, H., et al. Experimental study for cancer diagnosis with positron-labeled fluorinated glucose analogs: [18F]-2-fluoro-2-deoxy-D-mannose: a new tracer for cancer detection. European Journal of Nuclear Meddicine and Molecular Imaging. 7 (7), 294-297 (1982).
- Miles, K. A., Williams, R. E. Warburg revisited: imaging tumour blood flow and metabolism. Cancer Imaging. 8, 81-86 (2008).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Levine, A. J., Puzio-Kuter, A. M. The control of the metabolic switch in cancers by oncogenes and tumor suppressor genes. Science. 330 (6009), 1340-1344 (2010).
- Makinoshima, H., et al. Epidermal growth factor receptor (EGFR) signaling regulates global metabolic pathways in EGFR-mutated lung adenocarcinoma. The Journal of Biological Chemistry. 289 (30), 20813-20823 (2014).
- Makinoshima, H., et al. Signaling through the Phosphatidylinositol 3-Kinase (PI3K)/Mammalian Target of Rapamycin (mTOR) Axis Is Responsible for Aerobic Glycolysis mediated by Glucose Transporter in Epidermal Growth Factor Receptor (EGFR)-mutated Lung Adenocarcinoma. The Journal of Biological Chemistry. 290 (28), 17495-17504 (2015).
- Makinoshima, H., et al. Metabolic Determinants of Sensitivity to Phosphatidylinositol 3-Kinase Pathway Inhibitor in Small-Cell Lung Carcinoma. Cancer Research. 78 (9), 2179-2190 (2018).
- Sato, Y., et al. Metabolic Characterization of Antifolate Responsiveness and Non-responsiveness in Malignant Pleural Mesothelioma Cells. Frontiers in Pharmacology. 9, 1129 (2018).
- Ohashi, Y., et al. Depiction of metabolome changes in histidine-starved Escherichia coli by CE-TOFMS. Molecular BioSystems. 4 (2), 135-147 (2008).
- Ooga, T., et al. Metabolomic anatomy of an animal model revealing homeostatic imbalances in dyslipidaemia. Molecular BioSystems. 7 (4), 1217-1223 (2011).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Patra, K. C., Hay, N. The pentose phosphate pathway and cancer. Trends in Biochemical Sciences. 39 (8), 347-354 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon