Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Fonctionnalisation des cantilevers de microscope de force atomique avec des cellules simples-T ou une seule particule pour la spectroscopie immunologique de force unicellulaire
Dans cet article
Résumé
Nous présentons un protocole pour fonctionnaliser le microscope de force atomique (AFM) cantilevers avec une seule cellule T et particule de perle pour des études immunologiques. Des procédures pour sonder la liaison de cellule T-dendritic à paire simple par AFM et pour surveiller la réponse cellulaire en temps réel des macrophages à une seule particule solide par AFM avec la formation image de fluorescence sont montrées.
Résumé
La spectroscopie à force atomique à base de force monocellulaire (AFM-SCFS) est un outil puissant pour étudier les propriétés biophysiques des cellules vivantes. Cette technique permet de sonder les forces d'interaction et la dynamique sur une membrane cellulaire vivante, y compris celles entre les cellules, les récepteurs et les ligands, et aux côtés de nombreuses autres variations. Il fonctionne également comme un mécanisme pour fournir un stimulus physique ou biochimique sur les cellules simples d'une manière spatiotemporellement contrôlée, permettant ainsi l'activation cellulaire spécifique et les événements cellulaires suivants à surveiller en temps réel lorsqu'il est combiné avec la cellule vivante l'imagerie par fluorescence. L'étape clé de ces mesures AFM-SCFS est la fonctionnalisation en porte-à-faux AFM, ou en d'autres termes, l'attachement d'un sujet d'intérêt au porte-à-faux. Ici, nous présentons des méthodes pour modifier des cantilevers d'AFM avec une seule cellule T et une perle de polystyrène simple respectivement pour des études immunologiques. Le premier implique une colle biocompatible qui associe les lymphocytes T simples à la pointe d'un porte-à-faux plat dans une solution, tandis que le second s'appuie sur une colle époxy pour l'adhérence à perles simples dans l'environnement de l'air. Deux applications immunologiques associées à chaque modification de porte-à-faux sont également fournies. Les méthodes décrites ici peuvent être facilement adaptées à différents types de cellules et de particules solides.
Introduction
La microscopie de force atomique (AFM), un outil polyvalent, a trouvé de nombreuses applications dans la recherche en biologie cellulaire1,2,3,4,5. Outre sa capacité d'imagerie à haute résolution, la fonction de recherche de force native permet d'étudier directement in situ les propriétés biophysiques des cellules vivantes au niveau unicellulaire6,7. Il s'agit notamment des rigidités des structures subcellulaires ou même des cellules entières8,9,10,11,12, des forces spécifiques de liaison ligand/récepteur à la niveau d'une seule molécule sur la surface cellulaire13, et les forces d'adhérence entre les paires simples de particules solides et les cellules ou entre deux cellules1,2,14,15. Ces deux derniers sont souvent classés comme spectroscopie de force unicellulaire (SCFS)16. En raison des cantilevers facilement disponibles avec diverses constantes de ressort, la gamme de force accessible à l'AFM est assez large de quelques piconewtons (pN) aux micronewtons (N), qui couvre adéquatement toute la gamme des événements cellulaires impliquant des forces de quelques dizaines de pN, comme la liaison à base de récepteurs à une seule molécule, à nN, tels que les événements cellulaires phagocytiques15. Cette grande plage de force dynamique rend l'AFM avantageux par-dessus d'autres techniques de recherche de force telles que les pinces optiques/magnétiques et une sonde de force de biomembrane, car elles sont plus appropriées pour des mesures de force faible, avec la force typiquement inférieure à 200 pN17 , 18. En outre, l'AFM peut fonctionner comme un manipulateur de haute précision pour délivrer divers stimuli sur des cellules simples d'une manière spatiotemporellement définie4,19. Ceci est souhaitable pour les études d'activation unicellulaire en temps réel. Combinée à l'imagerie par fluorescence des cellules vivantes, la réponse cellulaire subséquente au stimulus spécifique peut être surveillée simultanément, ce qui rend le SCFS à base d'AFM extrêmement robuste comme imagerie optique fournissant un outil pratique pour sonder la signalisation cellulaire. Par exemple, l'AFM a été utilisée pour déterminer les souches nécessaires pour obtenir des transitoires de calcium dans les ostéoblastes20. Dans ce travail, les transitoires de calcium ont été suivis fluorescentpar par l'imagerie ratiométrique de calcium après l'application des forces localisées sur les ostéoblastes cultivés avec une pointe d'AFM. Récemment, l'AFM a été employée à étirer des fibrilles de collagène sur lesquelles les cellules stellates hépatiques (HSC) ont été cultivées et cette activation mécano-transduced de HSC a été en temps réel surveillée par un biocapteur fluorescent src, dont la phosphorylation telle que représentée par le l'intensité de fluorescence du biocapteur estcorrélée avec l'activation de HSC 3.
Dans les expériences SCFS basées sur l'AFM, la bonne fonctionnalisation des cantilevers AFM est une étape clé vers des mesures réussies. Puisque notre intérêt de recherche se concentre sur l'activation des cellules immunitaires, nous fonctionnions systématiquement les cantilevers avec des matières particulaires telles que les particules solides simples qui peuvent déclencher la phagocytose et/ou les réponses immunitaires fortes4,14 , 15 et les lymphocytes T simples qui peuvent former une synapse immunitaire avec des cellules présentant des antigènes, telles que les cellules dendritiques activées (DC)2. Les particules solides simples sont normalement couplées à un porte-à-faux via une colle époxy dans l'environnement de l'air, tandis que les lymphocytes T simples, en raison de leur nature non-adhésive, sont fonctionnalisés à un porte-à-faux via une colle biocompatible en solution. Ici, nous décrivons les méthodes pour effectuer ces deux types de modification de porte-à-faux et donnons deux applications associées aussi bien. La première application consiste à sonder les interactions lymphocytes T/DC avec L'AFM-SCFS pour comprendre le mécanisme suppressif des lymphocytes T régulateurs du point de vue de la mécanique cellulaire. La deuxième consiste à combiner l'AFM avec l'imagerie par fluorescence des cellules vivantes pour surveiller la réponse cellulaire du macrophage à une particule solide en temps réel pour révéler le mécanisme moléculaire du phosphatidylinositol indépendant des récepteurs 4,5-bisphosphate (PIP2)- Moesin a médiatisé la phagocytose. L'objectif de ce protocole est de fournir un cadre de référence pour les chercheurs intéressés à concevoir et à mettre en œuvre leurs propres paramètres expérimentaux avec l'analyse à base d'AFM à une seule cellule pour la recherche immunologique.
Protocole
Le protocole d'expérience de la souris suit les directives de soins aux animaux de l'Université de Tsinghua
1. Fonctionnalisation en porte-à-faux avec des lymphocytes T simples
- Préparation des cellules de la rate de souris
- Sacrifiez la souris (8-16 semaines d'âge (soit sexe); par exemple, c57BL/6 souche) en utilisant le dioxyde de carbone, suivie d'une luxation cervicale.
- Nettoyez la souris avec 75% d'éthanol et faites une incision cutanée médiane suivie d'une splenectomy.
- Homogérisez la rate dans 4 ml de PBS contenant 2 % de sérum bovin fœtal (FBS) à l'aide de lames de verre et retirez les agrégats et les débris en passant la suspension cellulaire à travers une passoire en nylon en maille de 70 m.
- Centrifugelant la suspension cellulaire à 500 x g pendant 5 min, jetez le supernatant et resuspendez les cellules dans 2 ml de tampon de lyse des globules rouges (équilibré à température ambiante) pendant 5 min. Terminer la réaction de lyse en ajoutant 8 ml de solution PBS.
- Centrifugelant la suspension cellulaire à 500 x g pendant 5 min et resuspendles les cellules à une densité de 1 x 108 cellules/mL en PBS contenant 2 % de FBS et 1 mM EDTA (étiqueté comme solution A), généralement 0,25-2 ml selon la densité cellulaire. Transférer les cellules en suspension dans un tube de fond rond en polystyrène de 5 ml (12 x 75 mm).
- Préparation des lymphocytes T CD4MD de souris
- Ajouter 50 sérums de rat L/mL (voir Tableau des matériaux) et 50 cocktails d'isolation des lymphocytes T CD4MD l'Une /L (voir Tableau des matériaux)à l'échantillon cellulaire obtenu à partir de l'étape 1.1.5. Mélanger et incuber 10 min à température ambiante.
- Vortex le stock streptavidin-enduit de solution de particules magnétiques (voir Tableau des matériaux) pour 30 s ou jusqu'à ce que les particules apparaissent uniformément dispersés.
- Ajouter 75 particules magnétiques enduites de streptavidin à l'échantillon cellulaire. Mélanger et incuber 2,5 min à température ambiante.
- Ajouter la solution A pour recharger l'échantillon cellulaire à 2,5 ml et mélanger en pipetting doucement de haut en bas pendant 2-3 fois.
- Placer le tube d'échantillon (sans couvercle) dans l'aimant (voir Tableau des matériaux)et couver pendant 5 minutes à température ambiante. Versez délicatement la suspension cellulaire enrichie dans un nouveau tube à fond rond en polystyrène de 5 ml.
- Centrifuger la suspension cellulaire à 500 x g pendant 5 min. Jetez le supernatant et suspendez les lymphocytes T enrichis dans 500 l l de la solution A.
REMARQUE : Les lymphocytes T CD4Enrichis contiennent à la fois des lymphocytes T conventionnels et réglementaires.
- Séparation réglementaire des lymphocytes T des lymphocytes T conventionnels
- Ajouter 25 l de bloqueur FcR (voir Tableau des matériaux) à l'échantillon enrichi de lymphocytes T obtenu à partir de l'étape 1.2.6. Mélanger et incuber 5 min à température ambiante.
- Ajouter 25 ll de cocktail de sélection positive réglementaire des lymphocytes T (voir Tableau des matériaux)à l'échantillon de lymphocytes T. Mélanger et incuber 10 min à température ambiante.
- Ajouter 10 ll de cocktail de sélection PE (voir Tableau des matériaux) à l'échantillon de lymphocytes T. Mélanger et incuber 5 min à température ambiante.
- Vortex le stock dextran-enduit solution de particules magnétiques (voir Tableau des matériaux) pour 30 s ou jusqu'à ce que les particules apparaissent uniformément dispersés.
- Ajouter 10 l de particules magnétiques enduites de dextran à l'échantillon de lymphocytes T. Mélanger et incuber 5 min à température ambiante.
- Ajouter la solution A pour recharger l'échantillon de cellules T à 2,5 ml et mélanger en pipetting doucement de haut en bas pendant 2-3 fois.
- Placer le tube d'échantillon de cellules T (sans couvercle) dans l'aimant et couver pendant 5 minutes à température ambiante. Verser délicatement le supernatant dans un nouveau tube.
REMARQUE : Le supernatant contient les cellules conventionnelles enrichies de CD4-T. - Centrifugeles les cellules CD4-T conventionnelles enrichies à 500 x g pendant 5 min. Jetez le supernatant et resuspendez les cellules dans 4 mL de RPMI1640 contenant 10 % de FBS, 0,05 mM d'éthanol-mercaptoéthanol, 0,01 M HEPES et 1 % de pénicilline/streptomycine (étiquetée comme Moyen B).
- Retirez le tube dans lequel les lymphocytes T régulateurs sont enrichis de l'aimant. Ajouter 2,5 ml de solution A au tube et mélanger en pipetting doucement de haut en bas pendant 2-3 fois. Remettre le tube dans l'aimant, incuber pendant 5 min, puis verser soigneusement et jeter le supernatant. Répétez cette étape trois fois de plus.
- Resuspendre les lymphocytes T régulateurs enrichis en 2 ml de B moyen.
- Incuber à la fois les lymphocytes T conventionnels purifiés et les lymphocytes T régulateurs avec 100 U/mL hIL-2 pendant la nuit ou pendant au moins 4 h à 37 oC dans un incubateur humidifié avec 5 % de CO2 avant d'être utilisé pour la fonctionnalisation en porte-à-faux.
- Préparation des cellules dendritiques
- Préparer la solution piranha, un mélange de 30% H2O2 (30%) et 70% H2SO4 (conc) (v/v). Verser lentement 3 ml de H2O2 à 7 ml de H2SO4 sous un brassage et un refroidissement constants.
CAUTION: La solution Piranha est très corrosive, et elle peut brûler et détruire les tissus du corps. Par conséquent, il est plus sûr d'utiliser la solution de piranha sous une hotte et porter l'équipement de sécurité approprié, car le mélange éclaboussera autour du bécher. Neutraliser la solution avec NaOH au pH 7 après utilisation. - Immerger la feuille de verre de 24 mm de diamètre dans la solution piranha pendant 30 min et rincer soigneusement ensuite avec l'eau stérile ultrapure.
- Tremper une paire de pinces pointues dans 75 % d'éthanol pendant 30 min pour la désinfection à froid.
- Introduire les couvercles en verre nettoyé dans une plaque de culture de 6 puits par la pince à épiler.
- Inclinez un plat de culture en plastique de 6 cm dans lequel les cellules DC2.4 ont été pré-cultivées avec 4 ml de B moyen et aspirent tout le milieu. Ajouter 2 mL de PBS dans le plat de culture pour rincer les cellules DC2.4 et jeter PBS. Répétez cette étape de rinçant deux fois de plus.
- Ajouter 1 ml de 0,25 % d'EDTA trypsine à la culture pendant 2 min. Ajouter 1 ml de B moyen à ce plat pour mettre fin à la réaction de digestion enzymatique. Transférer la suspension de cellules digérée s'acquiesce à un tube de 15 ml.
- Centrifugelant la suspension cellulaire à 500 x g pendant 5 min et suspendez les cellules DC2.4 à une densité de 2 x 105 cellules/mL dans le moyen B.
- Les cellules DC2.4 de graine sur les couvertures en verre préparées à l'étape 1.4.4 et incuber les cellules pendant la nuit dans une chambre humidifiée à 37 oC avec 5% de CO2.
REMARQUE : Afin de mesurer les forces d'interaction entre deux cellules simples, une concentration relativement faible de cellules DC2.4 (c.-à-d., la confluence de lt;10%) est nécessaire pour avoir un espacement approprié entre les cellules.
- Préparer la solution piranha, un mélange de 30% H2O2 (30%) et 70% H2SO4 (conc) (v/v). Verser lentement 3 ml de H2O2 à 7 ml de H2SO4 sous un brassage et un refroidissement constants.
- Préparation en porte-à-faux De l'AFM
REMARQUE : Les cantilevers qui conviennent aux expériences de spectroscopie à force unique sont ceux avec de faibles constantes printanières, généralement dans la gamme de 0,01-0,06 N/m. Ici, les cantilevers souples sans pointe sont préférés pour la fonctionnalisation des cellules simples et des particules solides simples.- Nettoyez les cantilevers par le traitement Piranha ou le plasma ou le nettoyage uv-ozone.
- Montez le porte-à-faux nettoyé à la tête de balayage de l'AFM.
- Préparer une chambre d'échantillon propre remplie d'eau pure et calibrer le porte-à-faux dans la solution d'eau en exécutant d'abord une courbe de force sur le substrat de verre pour obtenir la sensibilité (la pente de l'ajustement linéaire sur la partie répulsive de la courbe d'approche) et ensuite l'enregistrement d'un spectre de bruit thermique pour extraire la constante du ressort selon le manuel d'instruction de l'AFM.
- Retirez la tête de balayage AFM de la solution, lavez le porte-à-faux monté avec quelques gouttes d'éthanol pur et gardez le porte-à-faux au sec sur la tête de balayage.
- Fixation de lymphocytes T simples au porte-à-faux
- Préchauffer l'enceinte de l'environnement cellulaire vivant avec 5 % de CO2 à 37 oC.
- Montez la glissière en verre avec des cellules DC2.4 cultivées sur elle de l'étape 1.4.8 à un assemblage de chambre d'échantillon, ajoutez 600 l de Moyen B à la chambre immédiatement, puis mettez l'assemblage sur l'étape d'échantillon d'AFM.
- Ajouter des cellules CD4-T incubées hIL-2 (cellules T conventionnelles ou réglementaires) dans la chambre de l'échantillon.
REMARQUE : Le volume total de l'échantillon ne doit pas dépasser 1 ml. - Attendez que les cellules CD4-T ajoutées soient complètement installées au fond de la feuille de couverture.
REMARQUE: Les bulles d'air causeront de grandes perturbations à l'expérience, par conséquent, il est conseillé d'éviter les bulles d'air dans l'étape1.6.2 et 1.6.3. - Ajouter une goutte de 2 l de colle biocompatible à l'extrémité du porte-à-faux monté avec une pipette comme indiqué dans la figure 1, puis placer la tête de balayage sur la scène de l'échantillon rapidement, laissant ainsi le porte-à-faux recouvert de la colle biocompatible plonger dans le solution.
CAUTION: Ne touchez pas le bloc de verre ou le porte-à-faux avec la pointe de la pipette. Étant donné que la colle biocompatible utilisée ici est sujette à l'oxydation dans l'air, cette étape doit être faite aussi rapidement que possible. - Localiser une cellule T saine sous la pointe du porte-à-faux grossièrement sous le microscope en déplaçant l'étape de l'échantillon, puis ajuster finement le positionnement en déplaçant la tête de balayage.
REMARQUE : Une cellule saine de CD4-T a typiquement une taille relativement grande, des bords lisses, et optiquement transmissive dans l'imagerie de champ lumineux. - Abaissez le porte-à-faux manuellement avec des étapes à partir de 50 m puis à 10, 5, 2 et 0,5 m progressivement en contrôlant les moteurs stepper. Maintenez la position des moteurs de stepper et ajustez le positionnement de la tête de balayage pour un meilleur alignement entre la pointe du porte-à-faux et la cellule, une fois que le porte-à-faux fait un contact ferme avec la cellule T cible comme indiqué par un petit déplacement du faisceau laser position dans le photodétecteur correspondant à une plage de force typique de 0,5-1,5 nN.
REMARQUE : Cette étape peut également être effectuée en exécutant une mesure de force unique dans laquelle le point de set (la force appliquée à la cellule) et le temps de contact peuvent être bien définis dans le logiciel. Cependant, en raison de la nature non-adhésive des lymphocytes T, l'approche manuelle offre plus de flexibilité dans le contrôle de la visée, le positionnement et le temps de contact que l'approche automatique et il fonctionne de manière fiable pour l'adhérence des lymphocytes T. Les futurs expérimentateurs devraient essayer à la fois l'approche manuelle et automatique pour savoir ce qui fonctionne le mieux pour leurs systèmes d'intérêt. - Retirez le porte-à-faux après 30 s de contact.
REMARQUE : Si la cellule se déplace avec le porte-à-faux, l'attachement est réussi. Si ce n'est pas le cas, répétez l'étape 1.6.6 mais sur une cellule T différente. La colle biocompatible est facilement oxydée. L'étape 1.6.5-1.6.7 doit être complétée dans un délai de 5 minutes. En outre, si le même porte-à-faux échoue trois fois pour l'attachement de cellule T, un nouveau porte-à-faux doit être utilisé, et la procédure d'attachement devrait commencer à partir de l'étape 1.5.2 à nouveau.
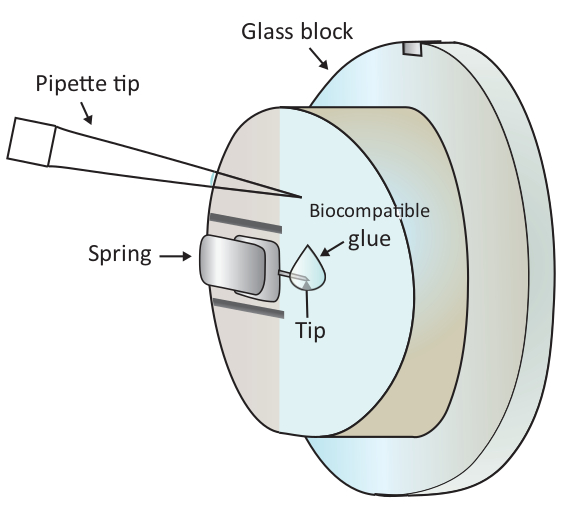
Figure 1 : Représentation schématique de l'ajout d'une petite goutte de colle biocompatible sur le porte-à-faux monté. Le porte-à-faux est monté via un ressort de serrage sur le support de bloc de verre qui est installé sur la tête de balayage AFM (non dessiné ici). Lorsque la tête de balayage se trouve sur une surface nivelée, le porte-à-faux est orienté verticalement comme le montre le dessin. Environ 2 l colle biocompatible peuvent être ajoutées à la pointe du porte-à-faux avec une micro-pipette. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
- Spectroscopie de force de l'interaction cellule T/cellule dendritique monopaire
REMARQUE : Pour sonder les interactions cellules/cellules, un AFM avec une portée Z plus grande que les 10-15 m conventionnels est nécessaire afin de séparer complètement les deux cellules. L'AFM utilisé ici a une gamme Z de 100 m, ce qui est suffisant pour séparer la cellule T de la cellule dendritique après le contact cellulaire/cellule.- Placez la cellule T attachée au-dessus d'une cellule DC2.4 séparée en déplaçant l'étape de l'échantillon et/ou la tête de balayage (voir la figure 2).
- Définiz les paramètres appropriés et exécutez la spectroscopie de force.
REMARQUE : Les paramètres clés suivants sont généralement utilisés : Point de 0,5 nN, Longueur de traction de 50 m, vitesse constante du mouvement Z, Vitesse d'extension 5 m/s, temps de contact 10 s, retard Mode Constant Force. Pour chaque paire T-DC, 20 répétitions de courbes de force sont collectées et un minimum de 14 courbes de force sont utilisées pour une analyse plus approfondie. - Montez un nouveau porte-à-faux nettoyé, étalonnez-le dans de l'eau pure comme à l'étape 1.5.3, et retournez au même échantillon de cellules T-DC pour répéter l'étape 1.6 et 1.7 pour une paire t-DC différente. Sonde au moins 5 paires pour chaque condition.
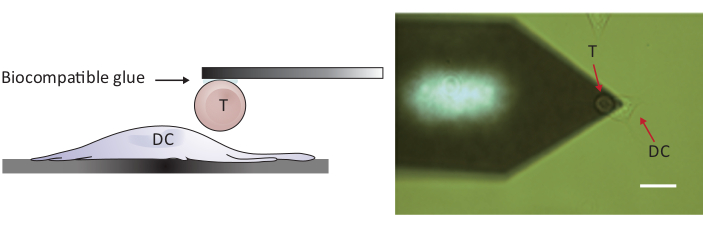
Figure 2 : Configuration expérimentale du sondage de force entre une seule cellule T et DC. (A) Dessin schématique de la configuration expérimentale dans laquelle une cellule T attachée au porte-à-faux est apportée à un DC cultivé sur le substrat pour le sondage de force. (B) Image de champ lumineux d'un porte-à-faux fonctionnalisé à cellule T et d'un DC. Barre d'échelle, 20 m. S'il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
2. Fonctionnalisation en porte-à-faux avec perles de polystyrène unique
- Préparation des perles simples
- Diluer la suspension du stock de perles de polystyrène de 6 m dans 100 % d'éthanol.
REMARQUE : La concentration de perles diluées devrait être suffisamment basse pour que lorsqu'elles soient ajoutées à une surface de couverture en verre, les perles individuelles soient bien séparées sans amas significatif après évaporation du solvant. - Nettoyez le bordereau en verre de 24 mm de diamètre avec de l'éthanol et enlevez toute poussière par le flux d'air N2.
- Montez la glissière en verre nettoyée à un assemblage de chambre d'échantillon et mettez l'assemblage sur le microscope.
- Placez une goutte de perle diluée solution sur le côté gauche, mais près du centre de la couverture (voir Figure 3) et vérifier l'espacement entre les perles après l'évaporation de solvant dans le champ lumineux sous le microscope avec un objectif 20x. Passez à l'étape suivante si les perles individuelles sont bien séparées.
- Trempez une pointe de micropipette ou un cure-dent dans une colle époxy bien mélangée, puis transférez une petite quantité de cette colle à trois taches séparées avec des touches douces successives sur le côté droit, mais près du centre de la couverture.
REMARQUE : Les trois taches de colle doivent être alignées verticalement (voir la figure 3). Le dernier endroit avec le moins de colle sera utilisé plus tard.
- Diluer la suspension du stock de perles de polystyrène de 6 m dans 100 % d'éthanol.
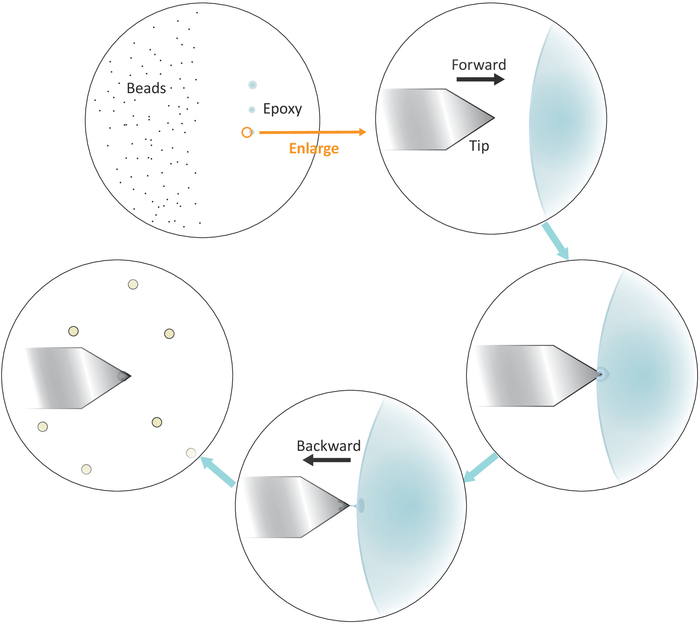
Figure 3 : Représentation schématique du flux de travail pour la fonctionnalisation à perles simples sur le porte-à-faux. Des perles de la taille d'un micron bien séparéesont sur le côté gauche du substrat et une petite quantité de colle époxy est transférée sur le côté droit du substrat par 3 touches douces successives, ce qui donne 3 taches de colle. Seul le dernier endroit avec le moins de colle (indiqué par un cercle) est utilisé pour enrober la toute fin du porte-à-faux. Approchez le porte-à-faux dans la colle de la gauche, puis déplacez le porte-à-faux vers l'arrière une fois qu'il est immergé dans la colle pour confiner la colle à l'extrémité du porte-à-faux. Apportez la perle cible sous le porte-à-faux et alignez-les correctement avant de faire un contact ferme (généralement 2-5 nN) pour l'adhérence de perle. Lorsque la perle est fonctionnelle avec succès sur le porte-à-faux, un nouveau porte-à-faux peut être monté pour commencer un nouveau cycle de fonctionnalisation. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
- Préparation en porte-à-faux De l'AFM
- Montez un porte-à-faux sans pointe nettoyé à la tête de balayage de l'AFM.
- Calibrer ce porte-à-faux dans l'air avec une surface propre pour obtenir la constante du ressort.
- Fixation de perles simples au porte-à-faux
- Placez la pointe en porte-à-faux au-dessus de la limite gauche de la dernière tache de colle époxy, comme le montre la figure 3.
- Apportez le porte-à-faux près de la colle lentement en abaissant les moteurs stepper avec de petites tailles d'étape.
- Retirez le porte-à-faux rapidement de la colle latéralement en déplaçant la tête de balayage AFM vers l'arrière (vers la gauche) manuellement une fois que la pointe est immergée dans la colle.
REMARQUE : Assurez-vous que seule une petite quantité de colle adhère à la toute fin de la pointe. S'il y a colle excessive sur la pointe, il est possible de réduire la quantité de colle en touchant suivie en glissant la pointe sur une surface vide. - Déplacez la pointe en porte-à-faux sur une perle unique bien isolée.
- Approchez le porte-à-faux à la perle unique lentement et faire un contact ferme avec la perle (comme indiqué par le déplacement de la position du faisceau laser dans le photodétecteur correspondant à une plage de force typique de 2-5 nN) pour environ 10 s au cours de laquelle un ajustement fin de la t ip positionnement latéralement aidera à mieux localiser la perle à la toute fin de la pointe. Retirez la pointe à la fin du contact.
REMARQUE: La disparition de la perle même du plan focal d'origine indique un événement adhérent réussi. - Démontez soigneusement le porte-à-faux modifié par perles et rangez-le dans une boîte en porte-à-faux pendant la nuit pour une solidification complète de la colle.
- Imagerie de fluorescence de la réponse cellulaire du macrophage à une perle simple livrée par AFM.
REMARQUE : L'imagerie de fluorescence a été exécutée sur un microscope interne de fluorescence total de type objectif fait maison basé sur un stand commercial de microscope. Ce système d'imagerie est équipé de 4 sources laser (405 nm, 488 nm, 561 nm, 647 nm), d'un visualisateur splitter pour la détection bicolore, et d'un dispositif couplé de charge multiplicateur d'électrons (EMCCD) pour l'imagerie à champ large.- Cultivez des cellules RAW264.7 sur un couvercle en verre à 37 oC dans une chambre humidifiée CO2 de 5 %.
- Transfect Moesin-EGFP et PLCMD-PH-mCherry to RAW264.7 cells using a transfection kit (see Table of Materials) as per the manufacturer's protocol to fluorescently visualize Moesin and phosphatidylinositol 4,5-bisphosphate (PIP2) molecules respectivement.
REMARQUE: Moesin a un motif ITAM qui peut activer Syk, un acteur clé de la phagocytose. PIP2 est connu pour recruter Moesin à la membrane cellulaire. - Placez la glissière en verre avec des cellules sur un assemblage de chambre d'échantillon et montez l'assemblage sur l'étape d'échantillon d'AFM.
- Montez le porte-à-faux modifié par perles à la tête de balayage de l'AFM.
- Exécuter une courbe de force dans une zone vide et calibrer la force avec la sensibilité de cette courbe et la constante du ressort mesurée à l'étape 2.2.2.
- Trouvez une cellule bien isolée avec des intensités de fluorescence appropriées dans les canaux verts (Moesin-EGFP) et rouges (PLCMD-PH-mCherry) avec 488/561 nm excitations.
- Livrez la perle de polystyrène nue de 6 m avec AFM à la surface de la cellule avec une force constante de 1 nN et un temps de contact de 500 s.
- Enregistrez la série d'images de fluorescence de la cellule en contact avec la perle pour analyse (généralement 10 images/s).
REMARQUE : Pour réduire le photoblanchiment des fluorophores, une puissance d'excitation relativement faible devrait être utilisée pour rechercher les cellules d'intérêt. En outre, un système d'excitation intermittente peut être utilisé pour prolonger les traces de temps de fluorescence si la dynamique des réponses cellulaires est sur une échelle de temps lente.
Résultats
La figure 4A montre les courbes de force-distance typiques de l'interaction de liaison entre la cellule simple-T et le seul DC dans un cycle d'approche-rétractation. La courbe rouge clair est la courbe d'extension et la courbe rouge foncé est la courbe de rétraction. Puisque la courbe d'extension est généralement utilisée pour l'indentation ou l'analyse de rigidité, ici seulement la courbe de rétraction est concernée pour l'adhérence cellulaire. La ...
Discussion
La spectroscopie à force unicellulaire à base d'AFM a évolué pour devenir un outil puissant pour aborder les propriétés biophysiques des cellules vivantes. Pour ces applications, le porte-à-faux doit être fonctionnalisé correctement afin de sonder des interactions ou des propriétés spécifiques sur les cellules d'intérêt. Ici, les méthodes pour coucoupler la cellule T simple et la perle de micron simple-classée au porte-à-faux tip-less sont décrites respectivement. Pour attacher une seule cellule T au po...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ces travaux sont appuyés par le National Natural Science Foundation of China General Program (31370878), le State Key Program (31630023) et le Innovative Research Group Program (81621002).
matériels
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
Références
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon