Method Article
Méthodes fonctionnelles et physiologiques d’évaluation de la régénération médiane du nerf chez le rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Présenté est un protocole pour produire différents types de lésions médianes de nerf (MN) et de réparation dans le rat. En outre, le protocole montre comment évaluer la récupération fonctionnelle du nerf à l’aide de plusieurs tests comportementaux non invasifs et des mesures physiologiques.
Résumé
L’objectif principal de cette enquête est de montrer comment créer et réparer différents types de lésions médianes de nerf (MN) dans le rat. En outre, différentes méthodes de simulation de la physiothérapie postopératoire sont présentées. Plusieurs stratégies normalisées sont utilisées pour évaluer la récupération motrice et sensorielle à l’aide d’un modèle MN de lésion et de réparation périphériques de nerf, permettant ainsi la comparaison facile des résultats. Plusieurs options sont incluses pour fournir un environnement postopératoire de physiothérapie-comme aux rats qui ont subi des dommages de MN. Enfin, le document fournit une méthode pour évaluer la récupération du MN à l’aide de plusieurs tests non invasifs (c.-à-d., test de saisie, test de piqûre d’épingle, test de marche échelonné d’échelle, essai d’escalade de corde, et analyse de la piste de marche), et des mesures physiologiques (thermographie infrarouge, électroeuromyographie, évaluation de la résistance de flexion, et la détermination de poids musculaire de fléchille caralis). Par conséquent, ce modèle semble particulièrement approprié pour reproduire un scénario clinique, facilitant l’extrapolation des résultats à l’espèce humaine.
Bien que le nerf sciatique soit le nerf le plus étudié dans la recherche périphérique de nerf, l’analyse du rat MN présente divers avantages. Par exemple, il y a une incidence réduite des contractures communes et de l’automutilation du membre affecté dans des études de lésion de MN. En outre, le MN n’est pas couvert par des masses musculaires, ce qui rend sa dissection plus facile que celle du nerf sciatique. En outre, la récupération de MN est observée plus tôt, parce que le MN est plus court que le nerf sciatique. En outre, le MN a un chemin parallèle vers le nerf ulnaire dans le bras. Par conséquent, le nerf ulnaire peut être facilement utilisé comme greffe de nerf pour réparer les blessures MN. Enfin, le MN chez les rats est situé dans l’avant-partie, semblable au membre supérieur humain; chez l’homme, le membre supérieur est le site de la plupart des lésions nerveuses périphériques.
Introduction
Les lésions nerveuses périphériques se produisent régulièrement à la suite d’un traumatisme, d’une infection, d’une vasculite, d’une autoimmunité, d’une malignité et/ou d’une radiothérapie1,,2. Malheureusement, la réparation périphérique de nerf continue de présenter des résultats cliniquement imprévisibles et fréquemment décevants3,4. On s’entend largement pour dire qu’une recherche fondamentale et translationnelle considérable est encore nécessaire pour améliorer la perspective des personnes touchées4,5,6,7.
Le rat MN montre de grandes similitudes avec celle des humains8,9 (figure 1). Originaire du plexus brachial dans la région axillaire, ce nerf descend dans l’aspect médial du bras, atteignant le coude, et se ramifiant à la majorité des muscles dans le compartiment ventral de l’avant-bras. Le MN atteint la main, où il innerve les muscles thenar et les deux premiers muscles lumbrical ainsi qu’à une partie de la peau de la main du rat9 (figure 1).
En utilisant le rat MN, il est possible de reproduire adéquatement les lésions nerveuses périphériques chez l’homme10,11,12. Ce nerf a plusieurs avantages potentiels de recherche par rapport au nerf sciatique habituellement utilisé. Parce que le MN est situé dans le membre antérieur des rats (semblable aux membres supérieurs humains), il peut être endommagé expérimentalement avec un impact beaucoup plus faible sur le bien-être du rat, par rapport au nerf sciatique, qui innerve une partie substantielle des membres pelviens13. En outre, chez l’homme la plupart des lésions cliniques se produisent dans le membre supérieur, ce qui correspond à l’avant-dernier du rat10,11,12,14,15,16.
Cet article montre comment produire différents types de lésions MN dans le rat. En outre, différentes façons de simuler la physiothérapie postopératoire sont présentées. Enfin, des tests pour évaluer la récupération fonctionnelle du MN sont décrits. Il existe plusieurs stratégies normalisées disponibles pour évaluer la récupération motrice et sensorielle à l’aide d’un modèle MN de lésion et de réparation périphériques de nerf, permettant ainsi une comparaison facile des résultats. Le modèle MN est particulièrement approprié pour reproduire le scénario clinique, facilitant l’extrapolation des résultats à l’espèce humaine.
Protocole
Toutes les procédures impliquant des sujets animaux ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux et le Comité d’éthique de la Nova University Medical School, Lisbonne, Portugal (08/2012/CEFCM).
1. Chirurgie médiane du nerf
REMARQUE : Suivez la technique aseptique pendant la chirurgie. Utilisez des instruments de protection individuelle (PPE) et portez une robe chirurgicale stérile17. Autoclavez tous les instruments chirurgicaux requis avant la chirurgie (voir la Table des Matériaux).
- Utilisez des rats Wistar vieux de 12 semaines. Fournir à eux de la nourriture et de l’eau ad libitum avec 12 h cycles foncés 7 jours avant la chirurgie. Avant l’anesthésie, pesez le rat pour déterminer la quantité d’anesthésique requise.
- Anesthésiez le rat avec une injection intraperitonéale d’un mélange de kétamine (40 à 80 mg/kg de poids corporel) et de xylazine (5 à 10 mg/kg de poids corporel). Vérifiez la profondeur de l’anesthésie par l’absence de réponse à un pincement d’un toe et en observant le taux de respiration tout au long de la procédureentière 18,19. Fournir une analgésie supplémentaire si un taux respiratoire supérieur à 110 cycles/min ou la réponse motrice au pincement des orteils est observée18,20.
- Injecter 1 mg/kg de meloxicam sous-cutanée pour fournir une analgésie préventive20,21.
- Pour éviter l’abrasion cornéenne pendant la chirurgie, appliquez du gel ophtalmique aux deux yeux.
- Utilisez une crème dépilatoire pour enlever les cheveux sur l’aspect médial sur la droite. Une fois fait, laver avec du salin chaud pour enlever la crème17.
- Déposer le rat en position de supine sur un coussin chauffant. Appliquer un gommage chirurgical à base d’iode ou de chlorhexidine sur le site opératoire. Laissez-le pour au moins 15 s, puis essuyez avec de l’éthanol. Répétez l’application 3x. Assurez-vous que le gommage est en contact avec la peau pendant au moins 2 minutes avant de procéder à la chirurgie.
REMARQUE : Communiquez avec l’autorité de contrôle des infections de votre unité de recherche pour obtenir d’autres protocoles pour prévenir l’infection du site chirurgical19. - Drape la zone chirurgicale17.
REMARQUE : Effectuez toutes les procédures dans des conditions aseptiques strictes19. - Incisez la peau dans l’aspect médial du bras droit et de la région pectorale au plan fascial profond, à l’aide d’une lame de scalpel numéro 15. Cautérisez soigneusement tous les vaisseaux saignants à l’aide d’une cautérisation électrique.
- Divisez soigneusement le fascia brachial, qui se présente comme une gaine blanchâtre couvrant les muscles, à l’aide d’une thermocauté ou d’une paire de ciseaux émoussés, en prenant soin de ne pas endommager les structures vasculaires et nerveuses dans l’aspect médial du bras.
- Ouvrez une paire de ciseaux sans ambages sous l’insertion terminale du muscle majeur pectoralis, afin de taquiner ce muscle loin de l’artère et de la veine axillaires sous-jacentes, ainsi que des branches terminales du plexus brachial.
- Diviser l’insertion du muscle majeur pectoralis avec une cautérisation électrique. Exposer et sectionr le muscle mineur pectoralis.
- Disséquez émoussé le MN des vaisseaux brachiaux et du nerf ulnaire à partir de la région axillaire jusqu’au coude. Cela permet l’exposition des différentes branches terminales du plexus brachial, à savoir la médiane, l’ulnaire, le radial, l’axillaire et les nerfs musculocutanés(figure 2).
- Séparer différents groupes expérimentaux comme décrit ci-dessous.
- Créez le groupe Sham en disséquant uniquement le MN.
- Créez le groupe Crush en comprimant le MN dans la partie centrale du bras pour 15 s à l’aide d’un numéro 5 forceps de microchirurgie, ou d’un instrument similaire22,23.
- Créez le groupe Excision à l’aide d’une paire de ciseaux microchirurgie pour exciser un segment de 10 mm de long à partir de la partie centrale du MN dans le bras. Ligate la souche proximale du nerf avec une suture de nylon 8/0 pour empêcher la croissance axonale.
- Créez le groupe Graft à l’aide du segment de 10 mm de long du MN décrit dans cette dernière étape et en le tournant à 180 degrés. Suture les souches proximales et distales de la section MN à la greffe de nerf à l’aide interrompu 10/0 points de nylon.
- Fermez la plaie de peau à l’aide de points de nylon interrompus 5/010,24.
- Fournir une analgésie postopératoire avec 7 ml d’acétaminophène à saveur de cerise mélangé avec 43 ml d’eau du robinet25 pour obtenir une concentration de 4,48 mg/mL dans 50 bouteilles d’eau en plastique mL mis à la disposition des rats adibi ltum pendant 3 jours25.
2. Logement et physiothérapie
- Permettre aux rats d’être en contact avec les appareils de physiothérapie 2 à 4 semaines avant la chirurgie, afin d’assurer une adaptation plus facile et plus rapide aux réglages de l’exercice. Effectuez les exercices en suivant les procédures détaillées ci-dessous.
- Une fois par jour, placez chaque rat à l’intérieur d’une sphère de physiothérapie individuelle, puis placez la sphère dans une pièce avec peu d’obstacles. Laissez le rat ambuler et explorer la pièce librement pendant une demi-heure.
- Loger les rats individuellement dans des cages solitaires avec des roues de course incorporées pour les aider à exercer.
- Formez des groupes de 4 à 5 animaux et logez ces groupes dans des cages personnalisées. Personnalisez les cages en incluant des échelles, des cordes, des roues de course et d’autres éléments enrichissants pour l’environnement.
- Retournez les rats individuels dans des cages personnalisées le lendemain de la chirurgie.
- Reprenez les exercices de physiothérapie 3 jours après la chirurgie.
3. Tests fonctionnels
- Une semaine avant de commencer à effectuer les tests fonctionnels, familiariser les rats avec les friandises alimentaires à utiliser comme renforcement positif. Fournir ce renforcement après l’achèvement réussi de chaque test, avant et après la chirurgie. Après la période d’entraînement initiale de 3 semaines, reprendre tous les tests 1 semaine après la chirurgie.
- Effectuer les tests dans la soirée, lorsque les rats sont naturellement plus actifs. Reprenez les tests 1 semaine après l’opération.
- Effectuez le test de saisie en plaçant le rat sur une grille et le soulever par sa queue, le laissant saisir la grille avec ses avant-pièces11,26. Attribuez un score " positif " si le rat peut saisir la grille avec les deux pattes avant. Attribuez un score " négatif " si le rat ne peut pas saisir la grille avec la patte blessée.
REMARQUE : Un test de saisie positif indique que le composant moteur du MN fonctionne16,27. - Effectuer un pin Prick Test28,29.
- Faire une plate-forme en plastique avec un motif de grille carrée de 4 mm x 4 mm. Fournir un soutien à cette grille avec un cadre métallique de 21 cm de long.
- Placez le rat sur la plate-forme et recouvrez la grille d’une boîte en plastique transparente de 15,5 cm x 15,5 cm x 11 cm. Attendez quelques minutes que les activités normales (p. ex., l’exploration et le toilettage majeur) disparaissent.
- Commencez le test lorsque le rat est immobile et debout sur ses quatre pattes.
- À l’aide d’un miroir, insérez un esesthésiomètre (p. ex., cheveux Von Frey numéro 4 avec une force de flexion de 25 g) à travers le maillage et piquez l’aspect palmar de la prévision dans le territoire de la peau du MN(figure 1). Répétez l’évaluation 5x sur chaque puzzle alternativement, en attente quelques secondes après chaque évaluation.
- Vérifiez la flexion du filament Von Frey30 pour l’évaluation correcte. Marquez les réponses de retrait comme suit: "0" pour aucune réponse de retrait, "1" si le rat enlève lentement la patte du filament, "2" si le rat répond rapidement au stimulus et enlève la patte ou lèche la patte.
REMARQUE : Si l’on observe l’ambulation et la morsure du filament répètent le stimulus, car ce sont des réponses ambigues.
- Formations
REMARQUE : Entraînez les rats tous les jours pendant 3 semaines avant d’effectuer la chirurgie le soir dans un environnement de faible luminosité. Les séances d’entraînement sont recommandées spécialement pour l’escalade de corde, l’échelon d’échelle, et les essais de pistes de marche. Ceux-ci peuvent être faits dans l’ordre présenté avant, en commençant par l’essai d’escalade de corde, l’échelon d’échelle, et enfin l’essai de pistes de marche. Laisser le même animal quelques minutes de repos avant un nouveau test.- Au cours de la première semaine, placez le rat sur le dernier tiers de l’échelle/corde/couloir, près de l’entrée de la boîte. Conditionnez l’animal à se déplacer vers l’ouverture de la boîte en touchant doucement et/ou en tirant le bout de sa queue. Fournir au rat un régal de nourriture une fois qu’il entre dans la boîte, ce qui lui permet quelques secondes de repos avant de répéter le test. Répétez-le 5x par jour pendant 5 jours.
- Au cours de la deuxième semaine, placez l’animal sur le deuxième tiers de l’échelle/corde/couloir Répétez les marches en 3.5.1.
- Au cours de la troisième semaine, placez le rat au bas de l’échelle/corde/couloir, de l’autre côté de l’entrée de la boîte. Répétez les étapes en 3.5.1, mais ne récompensez l’animal que lorsqu’il termine le test correctement.
- Effectuez le test échelle Rung.
REMARQUE : Ce test est utilisé pour évaluer la force du membre antérieur, le pas, le placement et la coordination31.- Placez le rat au bas de l’échelle (120 cm x 9 cm x 2 cm avec 18 marches de 1,5 cm d’épaisseur, espacés de 4 cm) et touchez doucement la queue du rat. Assurez-vous que l’échelle est placée à une inclinaison de 10 degrés et mène à une ouverture de 13,20 cm x 11 cm sur une boîte en bois foncé de 31,5 cm x 35 cm x 35 cm.
- Commencez la minuterie une fois que le rat commence à grimper à l’échelle et arrêtez la minuterie une fois que le museau du rat traverse l’entrée de la boîte.
- Enregistrez le temps et répétez le test 3x, chacun séparé au moins par un intervalle de 1 min.
- Escalade de corde
REMARQUE : Ce test est utilisé pour évaluer la force de saisie, qui dépend de la récupération de MN32.- Placez le rat au fond de la corde et persuadez-le de grimper en touchant doucement sa queue. Commencez la minuterie une fois que l’animal commence à grimper et arrêtez-la dès que le museau des rats traverse l’entrée de la plate-forme.
- Pour chaque essai, enregistrez le temps pris pour monter sur la plate-forme et le nombre de glissades de la patte blessée pendant que le rat monte la corde. Considérez le test valide si l’animal n’hésite pas pendant la tâche ou n’arrête pas d’escalader. Fournir au rat une collation après avoir effectué la tâche correctement.
- Enregistrez le temps et répétez le test 3x, chacun séparé au moins par un intervalle de 1 minute.
- Pistes de marche
REMARQUE : Ce test est utilisé pour l’évaluation de la récupération moteur de membre antérieur33,34.- Installez un appareil composé d’une passerelle confinée de 16,5 cm de hauteur x 8,7 cm de largeur x 43 cm de longueur. Assurez-vous que cela conduit à une ouverture rectangulaire de 8,8 cm x 8,2 cm dans l’un des murs d’une boîte en bois noir de 23 cm x 36 cm x 28 cm. Inclure une porte coulissante verticale pour fermer rapidement l’entrée de la boîte. Inclure un haut amovible à utiliser pour récupérer le rat33,34.
- Placez un morceau de papier graphique sur le plancher du couloir. Saisissez le rat par sa queue et laissez-le tenir un pinceau de peinture trempé dans le bleu méthylène. Placez le rat à l’entrée du couloir pour le faire marcher à l’intérieur de la boîte. Retirez le papier graphique du plancher du couloir et répétez le test jusqu’à ce qu’une bonne impression représentative des deux pattes préalables soit obtenue.
- À partir des tirages obtenus, sélectionnez-en un avec des tirages de la prédit successif clair, photographiez-les dans un format tiff ou jpeg, et mesurez les paramètres suivants à l’aide du logiciel d’accès libre FIJI35.
REMARQUE : Tout d’abord, étalonner chaque image à l’aide des marques du papier graphique (Analyser Échelle de décor) Deuxièmement, convertissez chaque image en format 8 bits (Image Type de type 8 bits). Par la suite, utilisez l’outil de sélection rectangulaire pour sélectionner l’impression de la patte. Crop cette partie de l’image (Image Crop). Dans chaque image, mettez en évidence les empreintes de pattes et supprimez l’arrière-plan en fermant l’image( Ajuster Seuil).- Mesurer le facteur de position en mesurant la zone d’impression de la patte. Utilisez l’outil de sélection rectangulaire pour sélectionner l’impression de patte et le contrôle dela presse M .
- Mesurez le facteur de longueur d’impression en mesurant la plus longue longueur de l’impression de patte (pour les étapes 3.8.3.2-3.8.3.6, utilisez l’outil de sélection straight-Line pour sélectionner les deux points les plus éloignés et le contrôle depresse et M ).
- Mesurez le facteur de propagation du doigt en mesurant la largeur la plus large de l’impression de patte.
- Mesurez le facteur de propagation du doigt intermédiaire en mesurant la largeur la plus large entre les deuxième et troisième doigts.
- Mesurer la longueur de la foulée en mesurant la distance entre les points homologues des impressions successives de patte sur un côté donné.
- Mesurer la base du support en mesurant la distance perpendiculaire entre la partie centrale de l’impression de patte et la direction du mouvement29,33,36.
REMARQUE : Effectuez les deux dernières mesures en deux paires d’impressions bilatérales représentatives de patte33.
4. Mesures physiologiques
- Thermographie infrarouge (IRT)37,38,39.
- Assurez-vous que la température de la pièce où les mesures seront effectuées se situe entre 18 et 25 oC à l’aide d’un hydrothermomètre numérique normal avec une résolution thermique de 0,1 oC. Assurez-vous qu’aucune source de chaleur importante (p. ex., ordinateurs ou réfrigérateurs) n’est présente.
- Acclimatez les rats en les amenant à la salle d’évaluation 2 h avant l’évaluation. Avant de commencer l’expérience, anesthésiez le rat tel que décrit ci-dessus (étapes 1.3-1.6) ou suivant le protocole de l’institution. Vérifiez l’absence de réponse à un pincement d’un toe avant de commencer l’expérience.
- Allumez la caméra thermographique infrarouge 15 min avant l’acquisition et ne l’éteignez pas pendant les évaluations. Définissez le paramètre d’émissivité de la caméra pour correspondre à celui de la peau du rat (0,98)37,40,41.
- Placer le rat sur son dorsum sur une surface propre et stable avec une éponge en polyéthylène. Assurez-vous qu’il n’y a pas de matériaux réfléchissants et d’autres sources possibles d’artefacts. Fixer soigneusement ses pattes avant en supplantation avec du ruban adhésif à double colle. Insérez un thermomètre numérique de 2 cm à l’intérieur du rectum pour surveiller la température centrale du rat pendant toutes les évaluations.
- Tenez la caméra thermographique à un angle de 90 degrés et à 30 cm de distance du rat. Concentrez la caméra sur le corps de l’animal entier. Obtenez trois images de thermographie infrarouge espacées de 30 s.
- Transférer les thermogrammes acquis à un ordinateur et les analyser à l’aide d’un logiciel d’analyse. Définir la température de la surface plantaire des deux forepaws à l’aide d’une zone d’intérêt rectangulaire fixe (p. ex., 9 x 11 pixels) dans le territoire plantaire du MN, par exemple au centre de la première plate-forme de pied métacarpale(figure 1). À l’aide du logiciel gratuit FLIR Tools, sélectionnez la thermographie en cliquant deux fois dessus. Sur la barre d’outils gauche, sélectionnez le bouton «Ajouter l’outilde mesure de la boîte » et dessiner un rectangle de 9 à 11 pixels sur la zone plantaire des deux avant-pièces. Tout en ajustant le rectangle sa dimension en pixels peut être confirmée. Effectuez-le sur les deux pattes avant. Sur le côté droit de l’image trouver les températures maximales, minimales et moyennes.
- Sur le retour sur investissement précédemment dessiné, cliquez à droite et sélectionnez l’exportation. Les températures moyennes, maximales et minimales, ainsi qu’une matrice des températures du retour sur investissement sont ensuite exportées vers un document .csv. Ces données peuvent ensuite être explorées à l’aide d’un logiciel d’analyse de données.
- Évaluation électroeuromyographique (ENMG)
- Installez un stimulateur électrique. Tapez une paire d’aiguilles d’acupuncture jetables (0,25 mm x 25 mm) avec un impédance négligeable [lt;1)) et 25 mm entre eux pour créer des électrodes pour la stimulation. Connectez maintenant le stimulateur et l’électrode à une unité d’acquisition de données pour prendre les signaux entrants et les convertir en signaux numériques qui peuvent être traités avec le logiciel informatique.
- Effectuer les évaluations dans la même pièce, et toujours dans les mêmes conditions environnementales contrôlées42,43,44. Pincez la forepaw pour s’assurer que les rats sont profondément anesthésiés avant de commencer l’acquisition de données.
REMARQUE : L’anesthésie profonde est d’une importance primordiale pour minimiser la variabilité associée aux mouvements volontaires spontanés et/ou involontaires par les rats43. - Exposez le MN des deux côtés sous le microscope chirurgical tel que décrit dans les étapes 1.8-1.13. Utilisez une lame de scalpel numéro 15 pour prolonger les incisions brachiales dans les avant-bras avec une incision ventrale de ligne médiane.
- Exposez l’aspect superficiel des muscles de la variable numérique fléchissante en séparant carrément le fascia antbrachial overlying à l’aide de ciseaux d’iris. Insérez l’aiguille du sol dans le muscle de femoris de quadriceps de l’arrière gauche pour relier la prise de sol de signal.
- Commencez par la bonne pré-amorce et placez les électrodes d’enregistrement dans le ventre de muscle de sublimis de fléchissement de la pré-édation et de l’électrode de stimulation proximal au site de lésion dans le MN. Humidifiez ces électrodes avec du salin.
- Assurez-vous que le logiciel est défini comme suit : port d’entrée de canal 1 (CH1) - stimulateur à 0-10 V ; et canal d’entrée port 2 (CH2) - EMG à 30-1,000 Hz. Commencez par choisir une amplitude de stimulation de 10 mV et enregistrer les potentiels d’action musculaire composé CMAPs taux d’échantillon de 50 kHz pour une durée de 40.000 ms. Augmenter progressivement l’amplitude de stimulation en étapes de 10 mV jusqu’à atteindre 2.000 mV. Répétez la même chose pour la patte gauche42,43,44.
REMARQUE : Le signal est amplifié à 1 000x et filtré à l’aide d’une bande Hz de 30 à 1 000. La sortie de stimulation est réglée pour une seule impulsion d’une durée de 1 ms42,43,44. - Ouvrez le fichier enregistré dans le logiciel de l’appareil d’enregistrement.
REMARQUE : Par défaut, l’écran affichera les fenêtres de remorquage sur le dessus en rouge, les impulsions de stimulateur, et ci-dessous en bleu l’enregistreur ENMGs. Glisser la barre de défilement horizontal sous l’échelle de temps permet de visualiser l’enregistrement complet. Les deux outils principaux, outil Zoom et outil I-Beam, sont en bas à droite du panneau. Grâce à l’outil Zoom, il est possible d’optimiser la visualisation des CMAP et d’explorer les graphiques. Pour garantir un bon ajustement sur l’écran de visualisation, il peut être nécessaire d’ajuster l’affichage après le zoom. Pour ce faire, sélectionnez Affichage Formes d’ondes à l’échelle automatique. L’outil I-beam permet de sélectionr des zones spécifiques des graphiques et des performances des mesures souhaitées. En plus des graphiques, il y a trois petites fenêtres où les mesures sont affichées. P-P montre la valeur moyenne d’amplitude de la zone sélectionnée en volts (à la fois dans l’enregistrement de stimulateur et dans LES ENM), tandis que Delta-T montre l’intervalle de temps de cette sélection. - Mesurer les paramètres du potentiel d’action musculaire composé (CMPAs, décrit dans le tableau 1) à l’aide des outils de mesure homonymes du plug logiciel dans "Toolbox pour la classification non supervisée des MUAP et des potentiels d’action dans EMG"45.
- Pour chaque rat, déterminer une valeur minimale de tension de stimulation après laquelle l’amplitude des CMAP n’augmente pas davantage. Commencez par un stimulus de 0,05 mV, et donnez des stimuli successifs croissants dans des tensions incrémentielles de 0,05 mV.
- Appliquer un stimulus 20% au-dessus de cette tension afin d’obtenir une valeur de stimulation supramaximale.
- Une fois cette dernière valeur déterminée et l’application du stimulus correspondant, enregistrez les paramètres suivants des CMAP.
- Évaluation de la force de flexion
- Utilisez les mêmes électrodes de stimulateur et de stimulation pour stimuler électriquement le MN que dans l’étape 4.2. Définissez le canal d’entrée CH1 comme stimulateur (0-10 V) et les paramètres de sortie pour une durée de stimulation de 30 s avec des impulsions de 1 ms de durée et 1 fréquence Hz. Liez un dynamomètre, avec une résolution de d ' 0.001 N à un ordinateur.
REMARQUE : La visualisation en temps réel des données peut être obtenue en construisant une parcelle de force par fois (N/s) à l’aide du logiciel précédemment installé sur l’ordinateur et relié à un dynamomètre46. - Placez le rat tel que décrit à l’étape 4.1.4. Placez une boucle de suture de soie 5/0 à travers le deuxième espace interosseux des deux pattes avant. Attachez la boucle de suture au crochet du dynamomètre et la forepaw alignée avec le dynamomètre sans mettre une pression excessive sur la ligne de suture.
- Fixez la patte contralatérale avec du ruban adhésif pour éviter les interférences de mouvement fallacieuses dans les lectures de dynamomètres.
- Réglez le dynamomètre à zéro en cliquant sur le bouton ZERO.
- Ajuster le stimulateur à une stimulation supramaximale d’amplitude de 1,5 V en ajustant le noeud de tension.
- Sur le PC, ouvrez le logiciel AFH-01. Ouvrez le séparateur "Appareil" et sélectionnez l’appareil FH5. Créer un nouveau fichier ("Mesures1" est le nom donné par défaut) et renommer le fichier.
- Placez l’électrode sur la partie proximale du MN, cliquez sur le jeu au bas du programme, enregistrez l’attraction sur le dynamomètre pour 30 s.
- Importer les valeurs obtenues dans un logiciel d’analyse de données. Calculez les valeurs de force maximales et moyennes et la zone sous la courbe (AUC) pour le graphique de temps x de force pour chaque évaluation.
- Répétez l’opération pour la balançoire gauche.
- Utilisez les mêmes électrodes de stimulateur et de stimulation pour stimuler électriquement le MN que dans l’étape 4.2. Définissez le canal d’entrée CH1 comme stimulateur (0-10 V) et les paramètres de sortie pour une durée de stimulation de 30 s avec des impulsions de 1 ms de durée et 1 fréquence Hz. Liez un dynamomètre, avec une résolution de d ' 0.001 N à un ordinateur.
- Poids musculaire
- Euthanasier les rats sous anesthésie générale par exsanguination47,48.
- Récoltez le muscle fléchisseur carpi radialis des deux avant-bras, disséquant le muscle de son origine jusqu’à son insertion distale de tendon, utilisant une lame de scalpel numéro 15.
- Peser les muscles avec une échelle de précision9,49.
Résultats
Un total de 34 rats ont été répartis au hasard en groupes suivants : Sham (n - 17), Excision (n - 17), et La greffe de nerf (n - 10) pour l’opération. Tous les rats ont survécu à la chirurgie et à la période postopératoire sans incident. Une semaine après la chirurgie et pendant les 100 jours suivants, tous les animaux ont subi les tests fonctionnels décrits ci-dessus une fois par semaine. Les résultats représentatifs de chacun de ces tests sont décrits ci-dessous.
Test de saisie
Le pourcentage de rats avec une réponse positive dans le test de saisie était le plus élevé pour le groupe Sham. Cette valeur a progressivement augmenté au fil du temps chez les rats des groupes Crush et Nerve Graft (figure 3).
Pin Prick Test
Les rats du groupe Sham ont eu les meilleurs scores dans le test cumulatif de piqûre d’épingle par rapport aux rats du groupe de greffe de nerf. Les deux avaient de meilleurs scores que les rats dans le groupe Excision (figure 4).
Test de course d’échelle
La vitesse des rats dans l’essai de course d’échelle était la plus élevée dans le groupe de Sham que dans les rats soumis à la lésion de MN. Parmi ces derniers, le temps de faire fonctionner l’échelle a eu tendance à diminuer au fil du temps, parallèlement à la récupération MN(figure 5).
Test de corde
Comme dans l’épreuve de course de l’échelle, le temps que les rats ont pris pour monter la corde était plus court dans le groupe Sham par rapport aux groupes dans lesquels le MN a été blessé. La vitesse des rats dans ce test a augmenté lorsque le MN a été autorisé à récupérer (figure 6).
Analyse de la piste de marche
L’analyse des pistes de marche tendait à montrer des changements dans la morphologie des empreintes de pattes(figure 7). Ces changements étaient souvent plus prononcés dans les blessures de concassage que dans les lésions de nerf segmentaire50.
Thermographie infrarouge
La thermographie a été utile lors de l’examen des différences de température entre les pattes avant dans les 30 premiers jours après la chirurgie. Les différences de température étaient plus perceptibles chez les rats atteints d’un MN plus gravement blessé, comme chez ceux du groupe Excision (figure 8 et figure 9).
Electroneuromyographie
Le tableau 1 résume l’importance biologique des mesures de l’électroneuromyographie, fournissant des résultats représentatifs pour les différents groupes expérimentaux. Divers modèles ont été observés avec l’électroeuromyographie. Un CMAP normal était typique d’un rat du groupe Sham, tandis qu’un CMAP polyphasique était associé à un degré variable de lésion du MN, comme dans le Crush et dans les groupes de greffe de nerf (figure 10). Dans le groupe Excision, aucun CMAP n’a été observé.
Force de flexion de poignet
Étant donné que la flexion du poignet dépend principalement de la MN, ce test a été utilisé pour évaluer la récupération motrice dans le territoire de ce nerf. La résistance à la flexion du poignet était plus proche de la normale lorsque la récupération était maximale (figure 11).
Poids musculaire et morphologie
Le poids et la morphologie du muscle fléchisseur carpis radialis dépendaient de la récupération de MN, car ce muscle est innervated exclusivement par le MN9,10. Ainsi, le poids normal et la morphologie ont été observés dans le groupe de Sham. Une perte de poids et de trophisme musculaire a été observée dans les groupes Crush, Nerve Graftet Excision (figure 12).
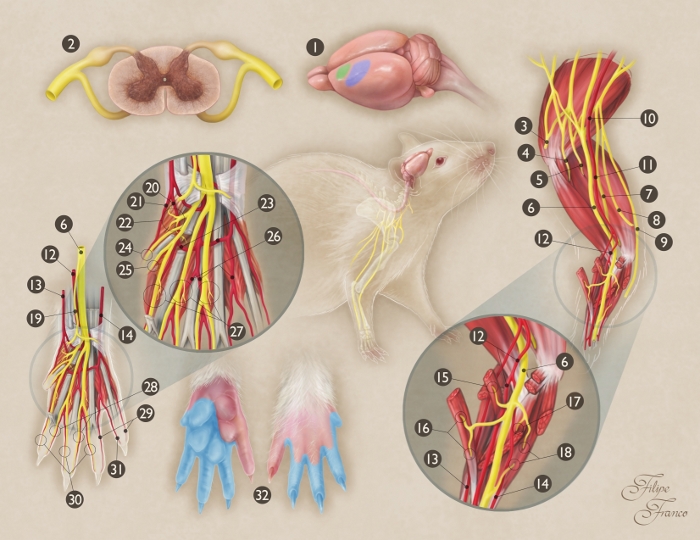
Figure 1 : Représentation schématique de l’anatomie du nerf médian du rat.
(1) Origine et arrêt du nerf médian dans le cerveau de rat (zone verte - zone motrice primaire ; zone bleue - zone sensorielle primaire). (2) Section transversale de la moelle épinière au niveau du segment C7; (3) Nerf axillaire; (4) Nerf musculocutané; (5) Nerf radial; (6) Nerf médian ; (7) Nerf Ulnar; (8) Branche cutanée médiale du bras; (9) Branche cutanée médiale de l’avant-bras; (10) Artère axillaire; (11) Artère brachiale; (12) Artère médiane; (13) Artère radiale superficielle; (14) Artère Ulnar; (15) Branche moteur du nerf médian au muscle de teres de pronator ; (16) Branche moteur du nerf médian au muscle de radialis de carpis de fléchisseur ; (17) Branche moteur du nerf médian au muscle de superficialis de digitorum de flexeur ; (18) Branche moteur du nerf médian au muscle de profundus de fléchisse digitorum ; (19) Branche sensorielle du nerf médian à la région thenar ; (20) Artère de palmar commune du premier espace interosseux ; (21) Radial palmar artère numérique du premier chiffre; (22) Branche motrice du nerf médian aux muscles thenar ; (23) Arche artérielle de Palmar ; (24) Radial palmar nerf numérique du premier chiffre; (25) Ulnar palmar nerf numérique du premier chiffre; (26) Artère de palmar commune du troisième espace interosseux ; (27) Branches de moteur des divisions terminales du nerf médian aux trois premiers muscles lumbrical ; (28) Ulnar palmar nerfs numériques des deuxième, troisième et quatrième chiffres; (29) Ulnar palmar artères numériques aux quatrième et cinquième chiffres; (30) Radial palmar nerfs numériques des deuxième, troisième et quatrième chiffres; (31) Radial palmar artère numérique du cinquième chiffre; (32) Territoire de peau du nerf médian dans la forepaw (région à ombre bleue). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
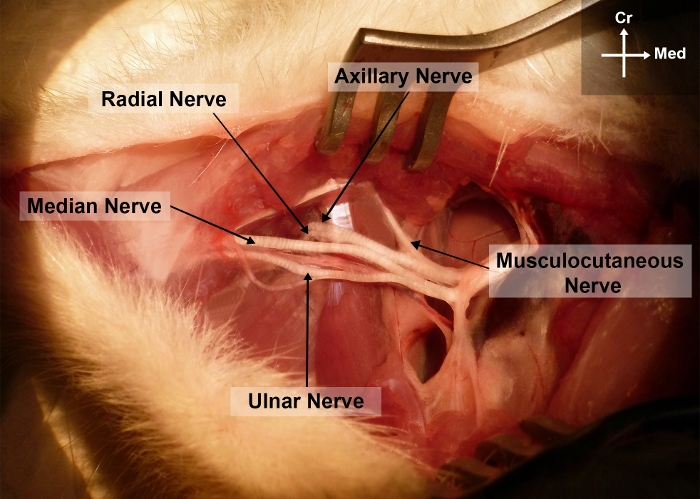
Figure 2 : Photographie du membre antérieur droit du rat montrant l’anatomie chirurgicale du nerf médian dans le bras et les régions axillaires.
Cr, crânien; Moi, medial S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
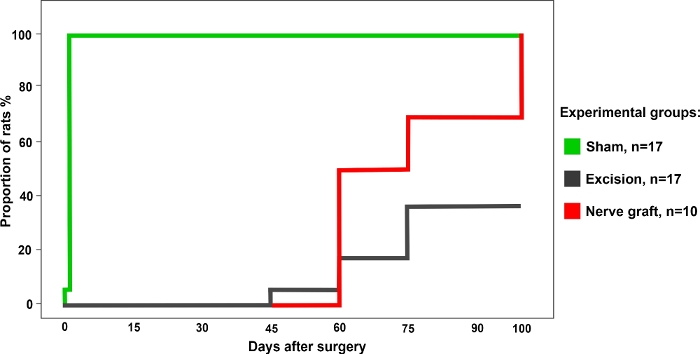
Figure 3 : Pourcentage de rats ayant subi un test positif de saisie dans le groupe expérimental différent sur une période de 100 jours après la chirurgie. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
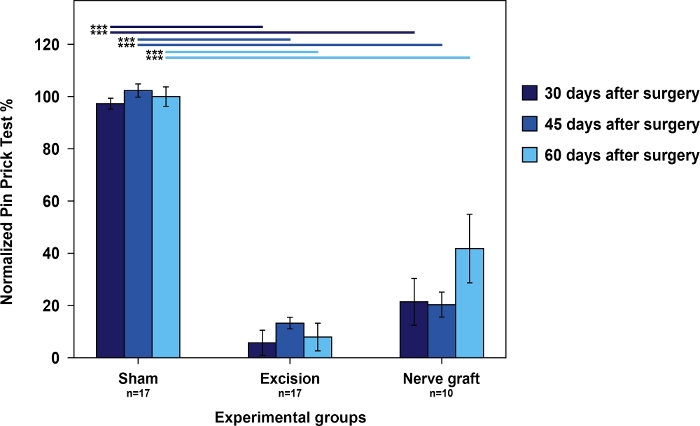
Figure 4 : L’évaluation de nociception utilisant les résultats cumulatifs d’essai de piqûre d’épingle dans la prépaaw actionnée normalisée à la patte contralatérale dans les différents groupes expérimentaux.
Les barres verticales représentent 95 % des intervalles de confiance. Les lignes horizontales dans la partie supérieure du chiffre indiquent des différences statistiquement significatives entre les groupes expérimentaux, le p-lt;0.001. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
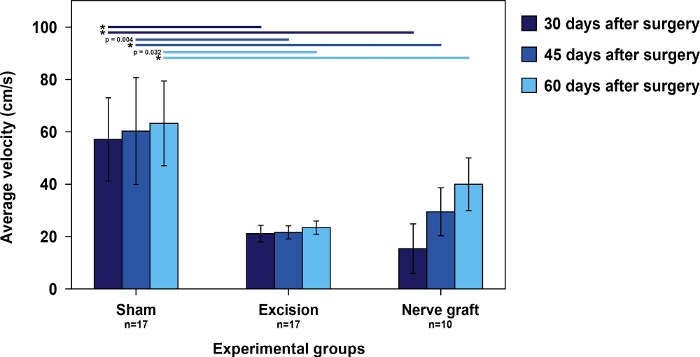
Figure 5 : Vitesse moyenne dans l’essai de fonctionnement de l’échelle dans les différents groupes expérimentaux.
Les barres verticales représentent 95 % des intervalles de confiance. Les astérisques dans la partie supérieure du chiffre indiquent des différences statistiquement significatives entre les groupes, le 'p’lt;0.001. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
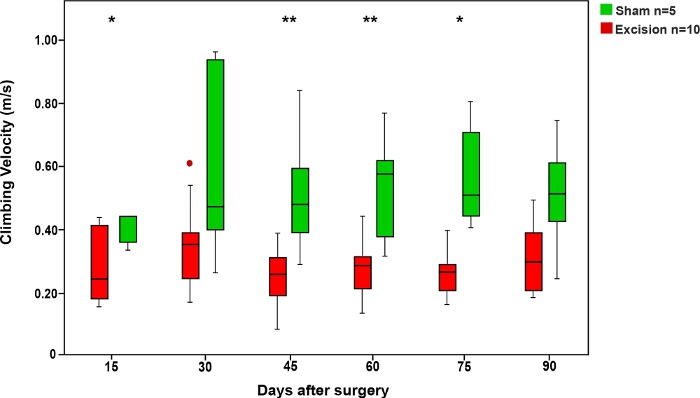
Figure 6 : Vitesse d’escalade moyenne dans le test de corde dans les groupes Sham et Excision.
Les barres verticales représentent 95 % des intervalles de confiance. Les astérisques dans la partie supérieure du chiffre montrent des différences statistiquement significatives entre les groupes, le 'p’lt;0.05; 0,01. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
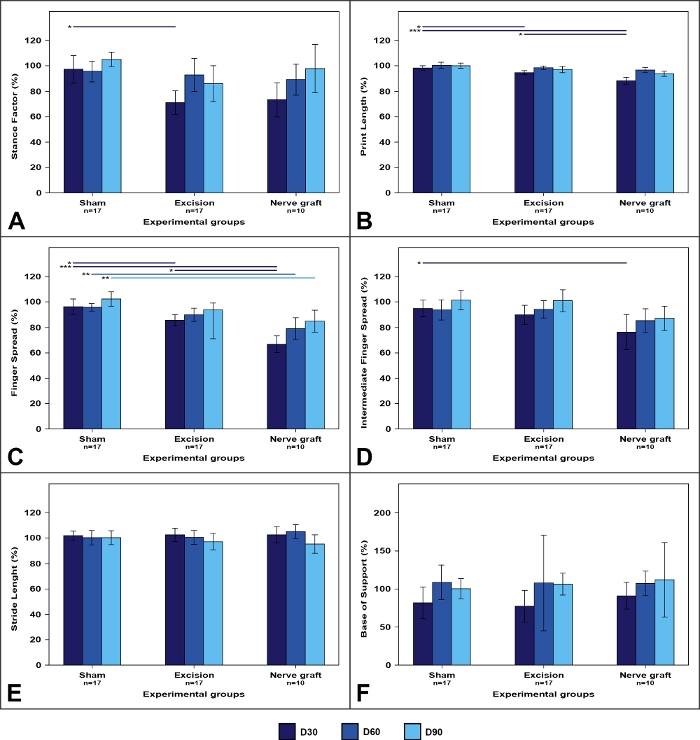
Figure 7 : Paramètres de piste de marche dans les différents groupes expérimentaux.
Les valeurs sur le membre opéré sont exprimées en pourcentage de moyens normalisés au membre contralatéral. (A) Facteur Stance; (B) Longueur d’impression; (C) Facteur de propagation des doigts; (D) Facteur intermédiaire de propagation du doigt; (E) Longueur de foulée; (F) Base de soutien. Les barres verticales représentent 95 % des intervalles de confiance. Les lignes horizontales dans la partie supérieure du chiffre indiquent des différences statistiquement significatives entre les groupes expérimentaux. D30, D60, D90 30, 60 et 90 jours après la chirurgie, 'p’lt;0.05; 0,01; p-lt;0.001. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
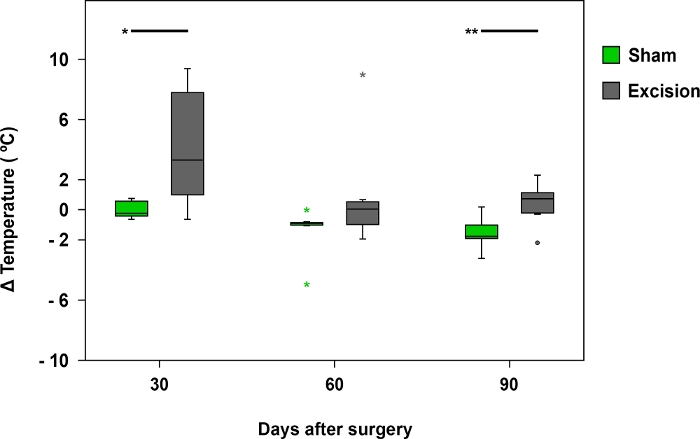
Figure 8 : Différence de température moyenne enregistrée par thermographie infrarouge.
Les parcelles de boîte représentent la différence de température entre la région de palmar du nerf médian sur le côté actionné (côté droit) et le côté contralatéral (gauche) dans les groupes Sham (n - 17) et Excision (n - 17), 'p’lt;0.05; 0,01. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
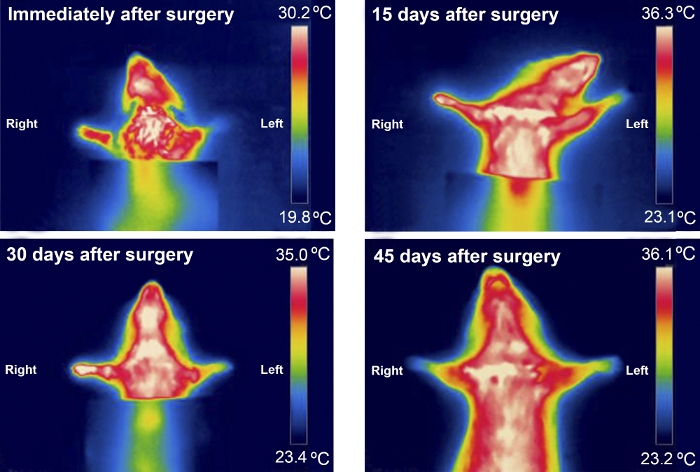
Figure 9 : Modèle typique de thermographie infrarouge d’un animal du groupe d’excision pendant les 45 premiers jours après chirurgie. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
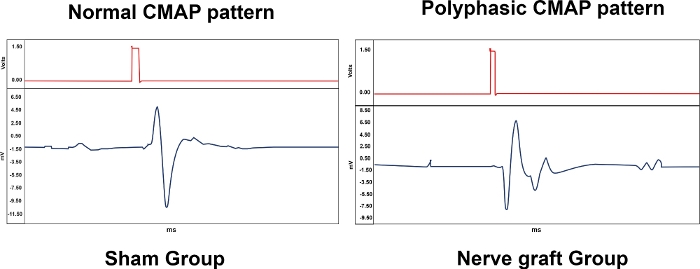
Figure 10 : Modèles typiques des potentiels d’action musculaire composé (CMAPs) d’un animal des groupes Sham et Nerve Graft 90 jours après la chirurgie. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
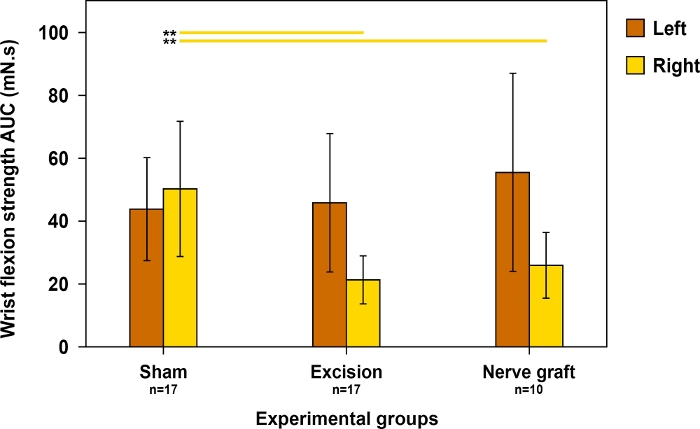
Figure 11 : Évaluation de la force de flexion de poignet sur les deux forepaws 90 jours postopératoirement dans différents groupes expérimentaux.
La force de flexion de poignet a été évaluée utilisant la zone sous la courbe (AUC) sur une période de temps de 30 s et utilisant la stimulation supratétanique. Les lignes verticales indiquent 95 % d’intervalles de confiance. Les lignes horizontales dans la partie supérieure du chiffre mettent<en évidence des différences statistiquement significatives entre les groupes, le 0,01. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
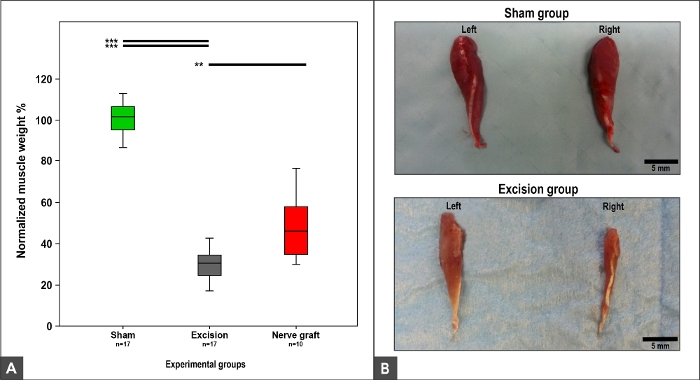
Figure 12 : Poids musculaire de flépi carpi radialis et apparence macroscopique 100 jours après chirurgie.
(A) Les parcelles de boîte représentant le poids musculaire fléchisseur normalisé de carpi radialis dans différents groupes expérimentaux, 'p’lt;0.01 ; p-lt;0.001. (B) Photographies des muscles sur les côtés droit et gauche dans les groupes expérimentaux Sham et Excision. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| Paramètre | Signification du paramètre | Groupe De sham | Groupe Excision | Groupe NG |
| Seuil de stimulation neurologique (%) | Évaluation de la régénération nerveuse, car il ya un nombre minimal de fibres nerveuses nécessaires pour produire soit un CMAP ou une contraction musculaire visible12 | 281,63 à 271,65 | 5359,98 à 3466,52 | 2108,12 à 2115,13 |
| Seuil de stimulation motrice (%) | Évaluation de la régénération nerveuse, car il ya un nombre minimal de fibres nerveuses nécessaires pour produire soit un CMAP ou une contraction musculaire visible12 | 462,52 à 118,91 | 1694,10 à 503,24 | 1249,50 à 503,24 |
| Latence (%) | Évaluation de la vitesse de conduction nerveuse dans les fibres nerveuses les plus rapides, c’est-à-dire les plus grandes fibres myélinées44 | 113,55 à 25,04 | N/A | 132,80 à 69,95 |
| Vitesse de transduction neuromusculaire (%) | Évaluation de la vitesse de conduction nerveuse dans les fibres nerveuses les plus rapides, c’est-à-dire les plus grandes fibres myélinées44 | 92.01 à 20,88 | N/A | 91,30 à 26,51 |
| Amplitude des CMAP (%) | Évaluation du nombre d’unités motrices réinnervables34 | 110,63 45,66 | N/A | 41,60 à 24,84 |
| Durée des CMAP (%) | Évaluation de la synchronisation de l’innervation musculaire, qui dépend du degré de réinnnervation musculaire et de myélinisation des fibres motrices innervassantes44,45 | 101,12 à 23,92 | N/A | 151,06 à 54,52 |
|
NG, greffe de nerf CMAPs, potentiel d’action musculaire composé. N/A, non applicable Tous les paramètres sont exprimés en pourcentage des valeurs contralatérales moyennes. Les variables numériques sont exprimées en moyenne et en écart standard. | ||||
Tableau 1 : Évaluation électroeuromyographique à la fin de l’expérience.
Discussion
Ce document présente un protocole pour créer différents types de lésions MN et de réparation dans le rat. En outre, il illustre comment évaluer la récupération fonctionnelle de ce nerf en utilisant plusieurs tests comportementaux non invasifs et des mesures physiologiques.
Notamment, plusieurs des tests fonctionnels décrits dans ce document, à savoir l’épreuve de fonctionnement de l’échelle et le test de corde, dépendent de manière significative de la volonté du rat d’accomplir la tâche dans l’attente d’obtenir la récompense alimentaire51,52,53. Il convient de noter que certaines souches de rats sont plus agréables à la formation et l’exécution reproductible dans ce type de tests51,52,53. Par exemple, les rats Lewis obtiennent de mauvais résultats dans ces tests à la fois dans la phase d’entraînement et par la suite51,52,53.
Le logement des rats devrait permettre une grande liberté de mouvement en accord avec leur comportement exploratoire naturel, en plus de permettre aux animaux expérimentaux de se familiariser avec certains des éléments présents dans les tests fonctionnels19. Par conséquent, différentes formes de logement permettant une plus grande liberté de mouvement sont montrées. Les grandes cages sont personnalisées avec des éléments d’enrichissement qui sont ensuite utilisés dans les essais fonctionnels (p. ex., cordes et échelles).
Sans doute, ces éléments enrichissants ainsi que les cages avec des roues de course incorporées et les sphères de formation individuelles fournissent une forme de physiothérapie postopératoire similaire à celle offerte aux patients humains opérés sur le système nerveux périphérique10.
De manière significative, bien que quelques auteurs préconisent disséquer les tissus sous-cutanés et les fasciaes de muscle franchement ou par la coupe propre avec un nombre 15 scalpel, l’utilisation de la thermocauté en disséquant ces structures est recommandée pour minimiser le risque d’hématome postopératoire.
Il convient de noter que de nombreux tests ont été conçus pour tester différents aspects de la réparation périphérique des nerfs chez le rat, à savoir la régénération axonale, la réinnervation cible, et la récupération fonctionnelle, dont certains sont au-delà de la portée de cette étude29,54,55,56. Par exemple, l’analyse cinématique29,36,55 et l’évaluation histomorphométrique29,36,57 sont largement employées par plusieurs auteurs. En outre, plusieurs de ces tests impliquent des variations pour maximiser l’efficacité et /ou la reproductibilité54. Par exemple, l’algisémétrie mécanique (c.-à-d. l’évaluation des réponses aux stimuli mécaniques douloureux) peut être évaluée qualitativement à l’aide d’un filament von Frey donné, tel que décrit dans le présent article, ou semiquantitativement en utilisant successivement plus fort von Frey filaments, ou même quantitativement à l’aide d’appareils électroniques qui appliquent des pressions croissantes jusqu’à ce qu’une réponse de retrait est observée30,54.
De même, bien que plusieurs auteurs utilisent l’analyse de la piste de marche pour évaluer la réparation de nerf de membre antérieur dans le rat, d’autres auteurs soutiennent que les lésions MN simples ne produisent souvent pas des changements reproductibles dans les empreintes de pattes10,58,59. En outre, certains ont déclaré que ces changements peuvent ne pas être proportionnels à la récupération musculaire10,60. En gardant cela à l’esprit, certains chercheurs ont préconisé l’utilisation de l’analyse de la piste de marche dans la prévu principalement lors de l’évaluation de la récupération après avoir écrasé les lésions néve plutôt que après la reconstruction du nerf segmentaire10,50,61.
Le test de saisie est largement utilisé pour évaluer la récupération motrice des muscles contrôlés par le MN16,27. Pour garantir l’uniformité et la reproductibilité des données obtenues avec ce test, il est recommandé d’appliquer le test de saisie à l’aide de la méthodologie bien établie proposée par Bertelli et coll.16. Cependant, le protocole actuel diffère en ce qu’il n’immobilise pas systématiquement la patte contralatérale pour éviter un stress indu11,27. Il convient également de noter que d’autres auteurs, après avoir immobilisé la patte non blessée, évaluent quantitativement le test de saisie à l’aide d’un dynamomètre ou d’une échelle27,56. Cependant, cette évaluation quantitative peut être affectée par la force que le chercheur applique à la queue du rat26. En outre, il est difficile de distinguer entre la force générée par les muscles fléchisseurs numériques (uniquement innervated par le MN dans le rat et l’objet de l’essai de grasping9) de la force produite par les fléchisseurs du poignet, qui comprennent le carpi ulnaris fléchisseur qui reçoit son innervation du nerf ulnaire9,10,27. Afin d’essayer de contourner ces biais potentiels, ce protocole utilise une échelle ordinaire similaire à l’échelle du Conseil de recherches médicales couramment utilisé pour classer la force musculaire chez l’homme10,11,62. Alternativement, d’autres auteurs ont décrit l’évaluation détaillée de la compréhension à l’aide de l’analyse vidéo et d’un système de notation vidéo11,63.
Un inconvénient potentiel de l’utilisation du MN par rapport au nerf sciatique est qu’une plus grande quantité d’informations sont disponibles concernant ce dernier nerf. Ceci, à son tour, peut rendre la comparaison des données obtenues avec le MN avec celle des travaux expérimentaux antérieurs plus difficile46,48,64. En outre, la plus petite taille de la MN par rapport au nerf sciatique rend la manipulation chirurgicale plus difficile8,12,27,56,65.
Contrairement à la méthodologie décrite dans cet article, l’évaluation de l’électroeuromyographie peut être effectuée à l’aide d’électrodes monopolisars transcutanées placées dans le bras et les régionsthenar 51. En dépit d’être moins invasive, cette méthode comporte le risque de confusion potentielle en raison de la possibilité de costimulation du nerf ulnaire dans la région du bras9,51.
La plupart des auteurs sont d’accord pour dire que tous les tests utilisés dans le rat fournissent des résultats concordants, car la réparation périphérique des nerfs dépend d’un éventail complexe de facteurs, comprenant la survie des neurones, l’allongement axonal et l’élagage, la synaptogénèse, la récupération réussie des organes sensoriels et des unités motrices dénervables, et la plasticité du cerveau7,10,50,66,67.
Enfin, il convient de noter qu’une mise en garde significative des modèles de rongeurs est que les nerfs périphériques de rat sont beaucoup plus proches de leurs organes finaux et ont des zones transversales beaucoup plus petites que les structures humaines homologues. Cependant, cette différence de taille garantit des données expérimentales plus rapides chez les rongeurs, et de meilleurs résultats globaux chez les rats par rapport à l’homme sont à prévoir68. En effet, plusieurs auteurs avertissent que les soins doivent être utilisés lors de la tentative d’extrapoler les données expérimentales obtenues dans la réparation périphérique des nerfs en utilisant des rongeurs pour les humains7,69. Les modèles primates sont considérés comme pluscomparables 70. Néanmoins, leur utilisation est associée à des contraintes éthiques, logistiques et budgétaires71.
Même si le nerf sciatique est le nerf le plus couramment utilisé dans la recherche périphérique de nerf, le rat MN présente des avantages multiples. Par exemple, les lésions MN sont associées à une plus faible incidence de contractures articulaires et d’automutilation de la patte affectée11,12,16,56. De manière significative, l’autotomie suivant la transection sciatique de nerf affecte 11-70% des rats. Cela peut rendre impossibles les évaluations actuelles comme l’indice sciatique14. Cela, à son tour, rend l’estimation du nombre d’animaux nécessaires pour obtenir un pouvoir statistique donné encombrant15.
En outre, comme le MN est plus court que le nerf sciatique, la récupération des nerfs est observée plus tôt58,72,73,74,75,76. En outre, le MN n’est pas couvert par des masses musculaires, ce qui rend sa dissection techniquement plus facile que celle du nerf sciatique16. En outre, le MN a un chemin parallèle vers le nerf ulnaire dans le bras. Par conséquent, le nerf ulnaire peut facilement être utilisé comme greffe nerveuse pour réparer les blessures MN. Enfin, chez l’homme, la plupart des lésions nerveuses périphériques se produisent dans le membre supérieur, ce qui soutient davantage l’utilisation de ce nerf dans le rat77,78.
On peut soutenir que les rongeurs sont les animaux expérimentaux les plus couramment utilisés dans le domaine de la réparation périphérique des nerfs48,79. Comme indiqué, le rat MN est un modèle pratique de lésion et de réparation périphériques de nerf. En fait, il existe de multiples stratégies normalisées disponibles pour évaluer la récupération motrice et sensorielle, permettant une comparaison plus facile des résultats36,46,60,80,81,82. Bon nombre de ces méthodes sont non invasives, ce qui permet une évaluation quotidienne.
En outre, la physiothérapie fait partie de la norme de soins des patients se remettant de lésions nerveuses périphériques. Comme le démontre le présent document, il existe de multiples stratégies pour fournir un environnement postopératoire de physiothérapie-like aux rats soumis aux blessures de MN4,5. Par conséquent, ce modèle est particulièrement approprié pour reproduire le scénario clinique, facilitant l’extrapolation des résultats à l’espèce humaine12,27,48,56,58,83.
Comme le montre le présent document, plusieurs stratégies normalisées sont disponibles pour évaluer la récupération motrice et sensorielle du modèle MN du rat. La majorité d’entre elles sont des procédures non invasives, ce qui permet une évaluation fréquente. En outre, comme la plupart des lésions périphériques de nerf dans l’espèce humaine se produisent dans le membre supérieur, les arrangements expérimentaux mentionnés de physiothérapie peuvent plus justement imiter la récupération dans le contexte clinique. On peut soutenir que cela peut faciliter l’extrapolation des résultats à l’espèce humaine, validant davantage l’utilisation de ce nerf dans le rat.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Diogo Casal a reçu une subvention du Programme d’éducation médicale avancée, parrainée par Fundaço Calouste Gulbenkian, Fundaço Champalimaud, Ministério da Sade e Fundaçào para a Ciência e Tecnologia, Portugal. Les auteurs sont très reconnaissants à M. Filipe Franco pour le dessin illustratif de la figure 1. Les auteurs souhaitent remercier l’aide technique de M. Alberto Severino dans le tournage et le montage de la vidéo. Enfin, les auteurs tient à remercier Mme Sara Marques pour son aide dans tous les aspects logistiques liés à l’acquisition et à l’entretien des animaux.
matériels
| Name | Company | Catalog Number | Comments |
| Acetaminophen | Amazon | https://www.amazon.com/Childrens-Tylenol-grape-flavor-ages/dp/B0051VVVZG | |
| Acland clamps | Fine Science Tools | 00398 V | http://www.merciansurgical.com/aclandclamps.pdf |
| Acland Single Clamps B-1V (Pair) | Fine Science Tools | 396 | http://www.merciansurgical.com |
| Biogel Surgical Gloves | Medex Supply | 30465 | https://www.medexsupply.com |
| BSL Analysis | BIOPAC Systems | https://www.biopac.com/ | |
| Castroviejo needle holders | Fine Science Tools | 12565-14 | http://s-and-t.ne |
| Clamp applicator | Fine Science Tools | CAF-4 | http://www.merciansurgical.com/acland-clamps.pdf |
| Constante voltage stimulator | BIOPAC Systems | STM200 | https://www.biopac.com/product/constant-voltage-stimulator-unipolar-pulse/ |
| Cutasept skin disinfectant | Bode Chemie | http://www.productcatalogue.bode-chemie.com/products/skin/cutasept_f.php | |
| Dafilon 10-0 | G1118099 | http://www.bbraun.com/cps/rde/xchg/bbraun-com/hs.xsl/products.html?prid=PRID00000816 | |
| Derf Needle Holders 12 cm TC | Fine Science Tools | 703DE12 | http://www.merciansurgical.com |
| Dry heat sterilizer | Quirumed | 2432 | http://www.quirumed.com/pt/material-de-esterilizac-o/esterilizadores |
| Dynamometer | SAUTER | FH5 | https://www.sauter.eu/shop/en/measuring-instruments/force-measurement/FH-S/ |
| Electroneuromiography setup | BIOPAC Systems | MP36 | https://www.biopac.com/product/biopac-student-lab-basic-systems/ |
| Ethilon 5-0 | W1618 | http://www.farlamedical.co.uk/ | |
| FLIR Software | FLIR | ||
| Graeffe forceps 0.8 mm tips curved | Fine Science Tools | 11052-10 | http://www.finescience.de |
| Graph paper | Ambar | ||
| Heat Lamp HL-1 | Harvard Apparatus | 727562 | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Heparin Sodium Solution (Heparin LEO 10000IU/ml) | Universal Drugstore | http://www.universaldrugstore.com/medications/Heparin+LEO/10000IU%2Fml | |
| High-Temperature Cautery | Fine Science Tools | AA03 | http://www.boviemedical.com/products_aaroncauteries_high.asp |
| Homeothermic Blanket System with Flexible Probe | Harvard Apparatus | 507220F | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Infrared camera | FLIR | E6 | http://www.flir.eu/instruments/e6-wifi/ |
| Instrapac - Adson Toothed Forceps (Extra Fine) | Fine Science Tools | 7973 | http://www.millermedicalsupplies.com |
| Iris Scissors 11.5 cm Curves EASY-CUT | Fine Science Tools | EA7613-11 | http://www.merciansurgical.com |
| Ketamine hydrochloride/xylazine hydrochloride solution | Sigma- Aldrich | K113 | https://www.sigmaaldrich.com/catalog/product/sigma/k113?lang=pt®ion=PT |
| Lacri-lube Eye Ointment 5g | Express Chemist | LAC101F | http://www.expresschemist.co.uk/lacri-lube-eye-ointment-5g.html |
| Mayo Scissors 14 cm Straight Chamfered Blades EASY-CUT | Fine Science Tools | EA7652-14 | http://www.merciansurgical.com |
| Meloxicam | Recropharma | Mobic | https://www.recropharma.com/product-pipeline/meloxicam |
| Methylene Blue solution | Sigma- Aldrich | https://www.sigmaaldrich.com/catalog/product | |
| Micro Jewellers Forceps 11 cm straight 00108 | Fine Science Tools | JF-5 | http://www.merciansurgical.com |
| Micro Jewellers Forceps 11cm angulated 00109 | Fine Science Tools | JFA-5b | http://www.merciansurgical.com |
| Micro retractor | Fine Science Tools | RS-6540 | http://www.finescience.de |
| Micro Scissors Round Handles 15 cm Straight | Fine Science Tools | 67 | http://www.merciansurgical.com |
| Micro-vessel dilators 11 cm 0.3 mm tips 00124 | Fine Science Tools | D-5a.2 | http://www.merciansurgical.com |
| Monosyn 5-0 | 15423BR | http://www.mcfarlanemedical.com.au/15423BR/SUTURE-MONOSYN-5_or_0-16MM-70CM-(C0023423)-BOX_or_36/pd.php | |
| Normal saline for irrigation | Hospira, Inc. | 0409-6138-22 | http://www.hospira.com/en/search?q=sodium+chloride+irrigation%2C+usp&fq=contentType%3AProducts |
| Operating microscope | Leica Surgical Microsystems | http://www.leica-microsystems.com/products/surgical-microscopes/ | |
| Skin Skribe Surgical Skin Marker | Moore Medical | 31456 | https://www.mooremedical.com/index.cfm?/Skin-Skribe-Surgical-Skin-Marker/&PG=CTL&CS=HOM&FN=ProductDetail&PID=1740&spx=1 |
| Snacks | Versele-Laga | Complete Crock-Berry | http://www.versele-laga.com/en/complete/products/complete-crock-berry |
| Straight mosquito forcep | Fine Science Tools | 91308-12 | http://www.finescience.de |
| Surgical drapes | Barrier | 800430 | http://www.molnlycke.com/surgical-drapes/ |
| Veet Sensitive Skin Hair Removal Cream Aloe Vera and Vitamin E 100 ml | Veet | http://www.veet.co.uk/products/creams/creams/veet-hair-removal-cream-sensitive-skin/ |
Références
- Lad, S. P., Nathan, J. K., Schubert, R. D., Boakye, M. Trends in median, ulnar, radial, and brachioplexus nerve injuries in the United States. Neurosurgery. 66 (5), 953-960 (2010).
- Murovic, J. A. Upper-extremity peripheral nerve injuries: a Louisiana State University Health Sciences Center literature review with comparison of the operative outcomes of 1837 Louisiana State University Health Sciences Center median, radial, and ulnar nerve lesions. Neurosurgery. 65 (4), 11-17 (2009).
- Dy, C. J., Isaacs, J., Dy, C. J., Isaacs, J. . American Society for Surgery of the Hand surgical anatomy: nerve reconstruction Vol. 1. , (2017).
- Trehan, S. K., Model, Z., Lee, S. K. Nerve Repair and Nerve Grafting. Hand Clinics. 32 (2), 119-125 (2016).
- Boyd, K. U., Fox, I. K., Mackinnon, S. E. . Nerve surgery Vol. 1. , 75-100 (2015).
- Geuna, S., et al. Update on nerve repair by biological tubulization. Journal of Brachial Plexius Peripheral Nerve Injury. 9 (1), 3 (2014).
- Sulaiman, W., Gordon, T. Neurobiology of peripheral nerve injury, regeneration, and functional recovery: from bench top research to bedside application. Ochsner Journal. 13 (1), 100-108 (2013).
- Angelica-Almeida, M., et al. Brachial plexus morphology and vascular supply in the wistar rat. Acta Medica Portuguesa. 26 (3), 243-250 (2013).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16 (2), 77-85 (1995).
- Casal, D., et al. Reconstruction of a 10-mm-long median nerve gap in an ischemic environment using autologous conduits with different patterns of blood supply: A comparative study in the rat. PLoS One. 13 (4), 0195692 (2018).
- Stößel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Manoli, T., et al. Correlation analysis of histomorphometry and motor neurography in the median nerve rat model. Eplasty. 14, 17 (2014).
- Ronchi, G., et al. The Median Nerve Injury Model in Pre-clinical Research - A Critical Review on Benefits and Limitations. Frontiers in Cellular Neuroscience. 13, 288 (2019).
- Weber, R. A., Proctor, W. H., Warner, M. R., Verheyden, C. N. Autotomy and the sciatic functional index. Microsurgery. 14 (5), 323-327 (1993).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. Journal of Pharmacology & Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripheral nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Casal, D., et al. A Model of Free Tissue Transfer: The Rat Epigastric Free Flap. Journal of Visualized Experiments. (119), e55281 (2017).
- Bertens, A. P. M. G., Van Zuthphen, L. F., Baumas, V., Beymen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Pritchett-Corning, K. R., Luo, Y., Mulder, G. B., White, W. J. Principles of rodent surgery for the new surgeon. Journal of Visualized Experiments. (47), e2586 (2011).
- Lee-Parritz, D. Analgesia for rodent experimental surgery. Israel Journal of Veterinary Medicine. 62 (3), 74 (2007).
- Roughan, J. V., Flecknell, P. A. Evaluation of a short duration behaviour-based post-operative pain scoring system in rats. European Journal of Pain. 7 (5), 397-406 (2003).
- Bauder, A. R., Ferguson, T. A. Reproducible mouse sciatic nerve crush and subsequent assessment of regeneration by whole mount muscle analysis. Journal of Visualized Experiments. (60), e3606 (2012).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Matsumine, H., et al. Vascularized versus nonvascularized island median nerve grafts in the facial nerve regeneration and functional recovery of rats for facial nerve reconstruction study. Journal of Reconstructive Microsurgery. 30 (2), 127-136 (2014).
- Mickley, A. G., Hoxha, Z., Biada, J. M., Kenmuir, C. L., Bacik, S. E. Acetaminophen Self-administered in the Drinking Water Increases the Pain Threshold of Rats (Rattus norvegicus). Journal of the American Association for Laboratory Animal Science. 45 (5), 48-54 (2006).
- Mandillo, S., et al. Reliability, robustness, and reproducibility in mouse behavioral phenotyping: a cross-laboratory study. Physiological Genomics. 34 (3), 243-255 (2008).
- Papalia, I., Tos, P., Stagno d'Alcontres, F., Battiston, B., Geuna, S. On the use of the grasping test in the rat median nerve model: a re-appraisal of its efficacy for quantitative assessment of motor function recovery. Journal of Neuroscience Methods. 127 (1), 43-47 (2003).
- Costa, L. M., Simoes, M. J., Mauricio, A. C., Varejao, A. S. Chapter 7: Methods and protocols in peripheral nerve regeneration experimental research: part IV-kinematic gait analysis to quantify peripheral nerve regeneration in the rat. International Reviews in Neurobiology. 87, 127-139 (2009).
- Geuna, S., Varejao, A. S. Evaluation methods in the assessment of peripheral nerve regeneration. Journal of Neurosurgery. 109 (2), 360-362 (2008).
- Howard, R. F., Hatch, D. J., Cole, T. J., Fitzgerald, M. Inflammatory pain and hypersensitivity are selectively reversed by epidural bupivacaine and are developmentally regulated. Anesthesiology. 95 (2), 421-427 (2001).
- Metz, G. A., Whishaw, I. Q. Cortical and subcortical lesions impair skilled walking in the ladder rung walking test: a new task to evaluate fore- and hindlimb stepping, placing, and co-ordination. Journal of Neuroscience Methods. 115 (2), 169-179 (2002).
- Thallmair, M., et al. Neurite growth inhibitors restrict plasticity and functional recovery following corticospinal tract lesions. Nature Neuroscience. 1 (2), 124-131 (1998).
- Brown, C. J., et al. Self-evaluation of walking-track measurement using a Sciatic Function Index. Microsurgery. 10 (3), 226-235 (1989).
- Hruska, R. E., Kennedy, S., Silbergeld, E. K. Quantitative aspects of normal locomotion in rats. Life Science. 25 (2), 171-179 (1979).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 155-161 (2012).
- Dijkstra, J. R., Meek, M. F., Robinson, P. H., Gramsbergen, A. Methods to evaluate functional nerve recovery in adult rats: walking track analysis, video analysis and the withdrawal reflex. Journal of Neuroscience Methods. 96 (2), 89-96 (2000).
- Ludwig, N., Formenti, D., Gargano, M., Alberti, G. Skin temperature evaluation by infrared thermography: Comparison of image analysis methods. Infrared Physics & Technology. 62, 1-6 (2014).
- Bennett, G. J., Ochoa, J. L. Thermographic observations on rats with experimental neuropathic pain. Pain. 45 (1), 61-67 (1991).
- Wakisaka, S., Kajander, K. C., Bennett, G. J. Abnormal skin temperature and abnormal sympathetic vasomotor innervation in an experimental painful peripheral neuropathy. Pain. 46 (3), 299-313 (1991).
- Muntean, M. V., et al. Using dynamic infrared thermography to optimize color Doppler ultrasound mapping of cutaneous perforators. Medical Ultrasonography. 17 (4), 503-508 (2015).
- Shterenshis, M. Challenges to Global Implementation of Infrared Thermography Technology: Current Perspective. Central Asian Journal of Global Health. 6 (1), 289 (2017).
- Wilbourn, A. J., Mackinnon, S. E. . Nerve surgery Vol. 1. , 59-74 (2015).
- Wu, Y., Martínez, M. &. #. 1. 9. 3. ;. M., Balaguer, P. O., Turker, H. . Electrodiagnosis in New Frontiers of Clinical Research. , (2013).
- Werdin, F., et al. An improved electrophysiological method to study peripheral nerve regeneration in rats. Journal of Neuroscience Methods. 182 (1), 71-77 (2009).
- Sedghamiz, H., Santonocito, D. Unsupervised Detection and Classification of Motor Unit Action Potentials in Intramuscular Electromyography Signals. 2015 E-health and Bioengineering Conference IEEE. , 1-6 (2015).
- Hadlock, T. A., Koka, R., Vacanti, J. P., Cheney, M. L. A comparison of assessments of functional recovery in the rat. Journal of the Peripheral Nervous System. 4 (3-4), 258-264 (1999).
- Carstens, E., Moberg, G. P. Recognizing pain and distress in laboratory animals. Ilar Journal. 41 (2), 62-71 (2000).
- Tos, P., et al. Chapter 4: Methods and protocols in peripheral nerve regeneration experimental research: part I-experimental models. International Reviews in Neurobiology. 87, 47-79 (2009).
- Galtrey, C. M., Fawcett, J. W. Characterization of tests of functional recovery after median and ulnar nerve injury and repair in the rat forelimb. Journal of the Peripheral Nervous System. 12 (1), 11-27 (2007).
- Giusti, G., et al. Return of motor function after segmental nerve loss in a rat model: comparison of autogenous nerve graft, collagen conduit, and processed allograft (AxoGen). Journal of Bone and Joint Surgery American. 94 (5), 410-417 (2012).
- Stossel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Nikkhah, G., Rosenthal, C., Hedrich, H. J., Samii, M. Differences in acquisition and full performance in skilled forelimb use as measured by the 'staircase test' in five rat strains. Behavioral Brain Research. 92 (1), 85-95 (1998).
- Whishaw, I. Q., Gorny, B., Foroud, A., Kleim, J. A. Long-Evans and Sprague-Dawley rats have similar skilled reaching success and limb representations in motor cortex but different movements: some cautionary insights into the selection of rat strains for neurobiological motor research. Behavioral Brain Research. 145 (1-2), 221-232 (2003).
- Navarro, X. Functional evaluation of peripheral nerve regeneration and target reinnervation in animal models: a critical overview. European Journal of Neuroscience. 43 (3), 271-286 (2016).
- Costa, L. M., Simões, M. J., Maurício, A. C., Varejão, A. S. P. . International Review of Neurobiology. 87, 127-139 (2009).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Raimondo, S., et al. Chapter 5: Methods and protocols in peripheral nerve regeneration experimental research: part II-morphological techniques. International Reviews in Neurobiology. 87, 81-103 (2009).
- Bontioti, E. K. M., Dahlin, L. B. Regeneration and functional recovery in the upper extermity of rats after various types of nerve injuries. Journal of the Peripheral Nervous System. 8, 159-168 (2003).
- Schönfeld, L. M., Dooley, D., Jahanshahi, A., Temel, Y., Hendrix, S. Evaluating rodent motor functions: Which tests to choose. Neuroscience & Biobehavioral Reviews. 83, 298-312 (2017).
- Urbancheck, M. S. Rat walking tracks do not reflect maximal muscle force capacity. Journal of Reconstructive Microsurgery. 15 (2), 143-149 (1999).
- Cudlip, S. A., Howe, F. A., Griffiths, J. R., Bell, B. A. Magnetic resonance neurography of peripheral nerve following experimental crush injury, and correlation with functional deficit. Journal of Neurosurgery. 96 (4), 755-759 (2002).
- Wang, Y., Sunitha, M., Chung, K. C. How to measure outcomes of peripheral nerve surgery. Hand Clinics. 29 (3), 349-361 (2013).
- Wang, H., Spinner, R. J., Sorenson, E. J., Windebank, A. J. Measurement of forelimb function by digital video motion analysis in rat nerve transection models. Journal of the Peripheral Nervous System. 13 (1), 92-102 (2008).
- Yanase, Y., Tamai, S., Usui, M., Yoshizu, T. . Experimental and Clinical Reconstructive Microsurgery. , 44-51 (2004).
- Barton, M. J., et al. Morphological and morphometric analysis of the distal branches of the rat brachial plexus. Italian Journal of Anatomy and Embryology. 121 (3), 240-252 (2016).
- Vincent, R., Slutsky, D. J., Hentz, V. R. Adult and obstetrical brachial plexus injuries. Peripheral Nerve Surgery: Practical applications in the upper extremity. , 299-317 (2006).
- Dahlin, L. B., Slutsky, D. J., Hentz, V. R. . Peripheral Nerve Surgery: Practical Applications in the Upper Extremity. , 1-22 (2006).
- Vargel, I., et al. A comparison of various vascularization-perfusion venous nerve grafts with conventional nerve grafts in rats. Journal of Reconstructive Microsurgery. 25 (7), 425-437 (2009).
- Grinsell, D., Keating, C. Peripheral nerve reconstruction after injury: a review of clinical and experimental therapies. BioMed Research International. 2014, 698256 (2014).
- Wang, D., et al. A simple model of radial nerve injury in the rhesus monkey to evaluate peripheral nerve repair. Neural Regeneration Research. 9 (10), 1041-1046 (2014).
- Casal, D., et al. Unconventional Perfusion Flaps in the Experimental Setting: A Systematic Review and Meta-Analysis. Plastic Reconstructive Surgery. 143 (5), 1003-1016 (2019).
- Bontioti, E. . End-to-side nerve repair. A study in the forelimb of the rat. , (2005).
- Bodine-Fowler, S. C., Meyer, R. S., Moskovitz, A., Abrams, R., Botte, M. J. Inaccurate projection of rat soleus motoneurons: a comparison of nerve repair techniques. Muscle Nerve. 20 (1), 29-37 (1997).
- Valero-Cabre, A., Navarro, X. H reflex restitution and facilitation after different types of peripheral nerve injury and repair. Brain Research. 919 (2), 302-312 (2001).
- Wall, P. D., et al. Autotomy following peripheral nerve lesions: experimental anaesthesia dolorosa. Pain. 7 (2), 103-111 (1979).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16, 77-85 (1995).
- Wood, M. J., Johnson, P. J., Myckatyn, T. M., Mackinnon, S. E., Yee, A. . Nerve Surgery Vol. 1. , 1-40 (2015).
- Rosberg, H. E. Epidemiology of hand injuries in a middle-sized city in southern Sweden - a retrospective study with an 8-year interval. Scandinavian Journal of Plastic and Reconstructive Surgery and Hand Surgery. 38, 347-355 (2004).
- Gordon, T., Borschel, G. H. The use of the rat as a model for studying peripheral nerve regeneration and sprouting after complete and partial nerve injuries. Experimental Neurology. 287, 331-347 (2017).
- Bertelli, J. A., Ghizoni, M. F. Concepts of nerve regeneration and repair applied to brachial plexus reconstruction. Microsurgery. 26 (4), 230-244 (2006).
- Bertelli, J. A., Mira, J. C. Behavioural evaluating methods in the objective clinical assessment of motor function after experimental brachial plexus reconstruction in the rat. Journal of Neuroscience Methods. 46, 203-208 (1993).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripherla nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Ronchi, G., et al. Standardized crush injury of the mouse median nerve. Journal of Neuroscience Methods. 188 (1), 71-75 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon