Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tuning the Acidity of Pt/ CNTs Catalysts for Hydrodeoxygenation of Diphenyl Ether Tuning the Acidity of Pt/ CNTs Catalysts for Hydrodeoxygenation of Diphenyl Ether Tuning the Acidity of Pt/ CNTs Catalysts for Hydrodeoxygenation of Diphenyl Ether Tun
Dans cet article
Résumé
Un protocole pour la synthèse de HNbWO6, HNbMoO6, HTaWO6 nanofeuille d'acide solide modifié Pt / CNTs est présenté.
Résumé
Nous présentons ici une méthode pour la synthèse de HNbWO6, HNbMoO6, HTaWO6 nanofeuille d'acide solide modifié Pt / CNTs. En variant le poids de diverses nanofeuilles d'acide solide, une série de Pt/xHMNO6/CNTs avec différentes compositions d'acide solide (x - 5, 20 wt%; M - Nb, Ta; N - Mo, W) ont été préparés par le prétraitement de nanotube de carbone, l'échange protonique, l'exfoliation d'acide solide, l'agrégation et enfin l'imprégnation de particules de Pt. Les Pt/xHMNO6/CNT sont caractérisés par la diffraction des rayons X, la microscopie électronique à balayage, la microscopie électronique de transmission et la désorption programmée à la température NH3. L'étude a révélé que les nanofeuilles HNbWO6 étaient fixées sur les CNT, certains bords des nanofeuilles étant pliés en forme. La force acide des catalyseurs Pt soutenus augmente dans l'ordre suivant : Pt/CNTs lt; Pt/5HNbWO6/CNTs 'lt; Pt/20HNbMoO6/CNTs 'lt; Pt/20HNbWO6/CNTs 'lt; Pt/20HTaWO6/CNTs. En outre, l'hydroconversion catalytique du composé modèle dérivé de la lignine : éther de diphenyl utilisant le catalyseur synthétisé de Pt/20HNbWO6 a été étudiée.
Introduction
De nombreux procédés industriels pour la fabrication de produits chimiques impliquent l'utilisation d'acide inorganique aqueux. Un exemple typique est le processus classique H2SO4 pour l'hydratation du cyclohexane pour produire du cyclohexanol. Le processus implique un système biphasique, avec le cyclohexane étant dans la phase organique et le produit cyclohexanol étant dans la phase aqueuse acide, rendant ainsi le processus de séparation par distillation simple difficile. Outre les difficultés de séparation et de récupération, l'acide inorganique est également très toxique et corrosif pour l'équipement. Parfois, l'utilisation d'acide inorganique génère des sous-produits qui abaisseront le rendement du produit et doivent être évités. Par exemple, la déshydratation de 2-cyclohexene-1-ol pour produire 1,3-cyclohexadiene en utilisant H2SO4 conduira à la polymérisation des sous-produits1. Ainsi, de nombreux procédés industriels se déplacent vers l'utilisation de catalyseurs acides solides. Divers acides solides tolérants à l'eau sont utilisés pour résoudre le problème ci-dessus et pour maximiser les rendements des produits, tels que l'utilisation de HZSM-5 et Amberlyst-15. L'utilisation de haute silice HZSM-5 zéolite a été montré pour remplacer H2SO4 dans la production de cyclohexanol à partir de benzène2. Étant donné que la zéolite est présente dans la phase aqueuse neutre, le produit passera exclusivement à la phase organique, simplifiant ainsi le processus de séparation. Cependant, en raison de la formation d'adducts à base d'acide de Lewis des molécules d'eau aux emplacements d'acide de Lewis, les matériaux zéolitiques ont encore démontré la sélectivité inférieure due à la présence des emplacements inactifs3. Parmi tous ces acides solides, Nb2O5 est l'un des meilleurs candidats qui contiennent à la fois des sites d'acide Lewis et Brânsted. L'acidité de Nb2O5nH2O est équivalente à une solution H2SO4 à 70 %, en raison de la présence des protons labiles. L'acidité de Brânsted, qui est comparable aux matériaux de zéolite protonique, est très élevée. Cette acidité se tournera vers l'acidité Lewis suite à l'élimination de l'eau. En présence d'eau, nb2O5 forme les adducteurs tétraèdres NbO4-H2O, qui peuvent diminuer l'acidité de Lewis. Cependant, les sites acides De Lewis sont toujours efficaces puisque le tétraèdre nbO4 a encore des charges positives efficaces4. Un tel phénomène a été démontré avec succès dans la conversion du glucose en 5-(hydroxymethyl)furfural (HMF) et l'allylation du benzaldéhyde avec l'étain tétraallyl dans l'eau5. Les catalyseurs tolérants à l'eau sont donc cruciaux dans la conversion de la biomasse dans les applications d'énergie renouvelable, en particulier lorsque les conversions sont effectuées dans des solvants environnementaux bénins tels que l'eau.
Parmi les nombreux catalyseurs environnementaux bénins d'acide solide, les nanomatériaux de carbone fonctionnalisés utilisant le graphène, les nanotubes de carbone, les nanofibres de carbone, les matériaux de carbone mésoporeux ont joué un rôle important dans la valorisation de la biomasse en raison de la porosité réglable, surface spécifique extrêmement élevée, et excellente hydrophobicité6,7. Les dérivés sulfonés sont des matériaux catalytiques protoniques particulièrement stables et très actifs. Ils peuvent être préparés par carbonisation incomplète des composés aromatiques sulfonés8 ou par sulfonation de sucres incomplètement carbonisés9. Ils se sont avérés être des catalyseurs très efficaces (par exemple, pour l'estérification des acides gras plus élevés) avec une activité comparable à l'utilisation de liquide H2SO4. Les graphènes et les CNT sont des matériaux de carbone avec une grande surface, d'excellentes propriétés mécaniques, une bonne résistance à l'acide, des distributions uniformes de taille de pores, ainsi que la résistance aux dépôts de coke. Le graphène sulfonated a été trouvé pour catalyser efficacement l'hydrolyse de l'acétate d'éthyle10 et les catalyseurs bifonctionnels de graphène ont été trouvés pour faciliter la conversion d'un pot de l'acide levullinic en '-valerolactone11. Les métaux bifonctionnels supportés sur les CNT sont également des catalyseurs très efficaces pour l'application dans la conversion de biomasse12,13 tels que l'oxydation aérobie très sélective de HMF à 2,5-diformylfuran au-dessus de la VO2-PANI/CNT catalyseur14.
Profitant des propriétés uniques de l'acide solide Nb2O5, des CNT fonctionnalisés et du métal bifonctionnel supporté sur les CNT, nous rapportons le protocole de synthèse d'une série de Nanosheet d'acide solide nb(Ta) modifié pt/CNt avec un surface par une méthode d'agrégation de nanofeuilles. En outre, nous avons démontré que pt/20HNbWO6/CNTs, en raison de l'effet synergique des particules Pt bien dispersées et des sites acides forts dérivés de hnbWO6 nanofeuilles, présentent la meilleure activité et sélectivité dans la conversion composés modèles dérivés de la lignine en combustibles par hydrodéoxygénation.
Protocole
CAUTION : Pour les méthodes de manipulation, les propriétés et les toxicités appropriées des produits chimiques décrits dans le présent document, consultez les fiches de données pertinentes sur la sécurité des matériaux (SDM). Certains des produits chimiques utilisés sont toxiques et cancérigènes et une attention particulière doit être prise. Les nanomatériaux peuvent présenter des risques pour la sécurité et des effets sur la santé. L'inhalation et le contact cutané doivent être évités. Des précautions de sécurité doivent être prises, comme effectuer la synthèse du catalyseur dans le capot de fumée et l'évaluation des performances du catalyseur avec les réacteurs autoclave. L'équipement de protection individuelle doit être porté.
1. Prétraitement des CNT13
- Immerger 1,0 g de CNT dans 50 ml d'acide nitrique dans un bécher de 100 ml.
- Sonicate la solution à 25 oC pendant 1,5 h pour éliminer les impuretés de surface et pour améliorer l'effet d'ancrage du catalyseur.
- Transférer la solution dans un flacon de fond rond de 100 ml.
- Reflux de la solution dans un mélange d'acide nitrique (65%) et l'acide sulfurique (98%) à 60 oC pour la nuit. Définir le rapport de volume à 3:1. Cela créera des défauts de surface sur les CNT.
- Filtrer la solution pour obtenir le nanotube de carbone multi-parois solide. Laver le solide avec de l'eau déionisée.
- Sécher le solide à 80 oC pendant 14 h.
2. Préparation de HNbWO6 nanofeuilles d'acide solide15 par échange protonique suivie d'exfoliation
- Mélanger les quantités stoichiométriques de Li2CO3 (0,9236 g) et d'oxydes métalliques Nb2O5 (3,3223 g) et WO3 (5,7963 g) à un rapport molaire de 1:1:2.
- Calcine le mélange solide à 800 oC pendant 24 h avec un broyage intermédiaire.
- Déposer 10,0 g de liNbWO6 poudre dans 200 mL de 2 M HNO3 solution aqueuse à 50 oC et remuer le mélange de solution pendant 5 jours (120 h) avec un remplacement de l'acide à 60 h.
- Échangez le liquide acide tous les jours et répétez l'étape 2.3.
- Filtrer le solide et laver le solide avec de l'eau déionisée 3x.
- Séchez le solide à 80 oC pendant la nuit.
- Ajouter une quantité de 25 wt.% TBAOH (tetra (n-butylammonium) hydroxyde) solution à 150 ml de solution d'eau déionisée avec 2,0 g de composé protoné obtenu à l'étape 2,6 jusqu'à ce que le pH atteint 9,5 - 10,0.
- Remuer la solution ci-dessus pendant 7 jours.
- Centrifugelant la solution ci-dessus et collectez la solution supernatante qui contient les nanofeuilles dispersées.
3. Préparation des nanofeuilles d'acide solide HNbMO6
REMARQUE : La procédure est similaire à celle de l'étape 2, à l'exception des première et troisième étapes.
- Mélanger les quantités stoichiométriques de Li2CO3 et les oxydes métalliques Nb2O5 et MoO3 dans un rapport molaire de 1:1:2.
- Calcine les mélanges solides ci-dessus à 800 oC dans l'air pendant 24 h avec un broyage intermédiaire.
- Déposer 10,0 g de poudre LiNbMoO6 dans 200 ml de 2 M HNO3 solution aqueuse à 50 oC et remuer le mélange de solution pendant 5 jours (120 h) avec un remplacement de l'acide à 60 h.
4. Préparation des nanofeuilles d'acide solide HTaWO6
REMARQUE : La procédure est similaire à celle de l'étape 2, à l'exception des première et troisième étapes.
- Mélanger les quantités stoichiométriques de Li2CO3 et les oxydes métalliques Ta2O5 et WO3 dans un rapport molaire de 1:1:2.
- Calcine les mélanges solides ci-dessus à 900 oC dans l'air pendant 24 h avec un broyage intermédiaire.
- Déposer 10,0 g de poudre de LiTaWO6 dans 200 mL de 2 M HNO3 solution aqueuse à 50 oC et remuer le mélange de solution pendant 5 jours (120 h) avec un remplacement de l'acide à 60 h.
5. Préparation de HNbWO6/MWCNTs par la méthode d'agrégation des nanofeuilles
- Ajouter 2,0 g de CNT multimurs obtenus à l'étape 1 à une solution de 100 ml de feuilles de HNbWO6 dans un flacon rond de 250 ml.
- Ajouter 100 mL de 1,0 M HNO3 solution aqueuse dans le bas rond flacon goutte à goutte. Cela agrégera les échantillons de nanofeuilles.
- Continuer à remuer la solution à 50 oC pendant 6 h.
- Filtrer le solide et laver le solide avec de l'eau déionisée 3x.
- Séchez le solide à 80 oC pendant la nuit.
- Peser le solide séché et enregistrer le pourcentage de chargement de l'acide solide sur le MWCNT.
6. Préparation de Pt/20HNbWO6/CNTs par la méthode d'imprégnation
- Dissoudre le H2PtCl6h2O dans l'eau (1,0 g/100 ml).
- Imprégner les nanofeuilles préparées modifié matériaux CNtavec 1,34 mL de la solution aqueuse Pt ci-dessus.
- Séchez les nanofeuilles de matériaux CNT à 80 oC, et calcinez les matériaux à 400 oC pendant 3 h.
- Obtenir les nanofeuilles d'acide solide nb(Ta) modifiées pt/CNT.
7. Hydrodéoxygénation de l'éther aromatique dérivé de la lignine
REMARQUE : L'éther aromatique dérivé de la lignine choisi est l'éther de diphenyl dans cette expérience. L'éther aromatique dérivé de la lignine choisi est l'éther de diphenyl dans cette expérience. L'activité de Pt/20HTaWO6/CNTs (88,8% de conversion, non indiqué dans cet article) est inférieure à Pt/20HNbWO6/CNTs (99,6%), donc le rendement du cyclohexane diminue. Par conséquent, bien que, une plus grande sélectivité de cyclohexane ait été obtenue au-dessus de Pt/20HTaWO6/CNTs, la conversion plus faible de l'éther de diphenyl limite son utilisation. Utiliser l'équipement de protection approprié et le capot de fumée pour effectuer la réaction utilisant des réactifs cancérigènes.
- Diluer 0,05 grammes de catalyseur dans 5 millilitres de sable de quartz. Chargez la solution au milieu d'un réacteur à lit fixe entre deux oreillers de laine de quartz.
- Réduire le catalyseur en H2 (40 ml/min) à 300 oC pendant 2 h.
- Pompez les matières premières de l'éther de diphenyl (y compris le réagitateur de 5,0 wt.% dans n-decane et 2.0 wt.% n-dodecane comme norme interne pour l'analyse de chromatographie de gaz) dans le réacteur de lit fixe à différents débits (0.05-0.06 mL/min)
- Recueillir les produits à différents moments d'espace définis comme le rapport entre la masse du catalyseur W (g) et le débit du substrat F (g/min).
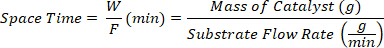
- Identifiez les produits liquides par un GC (HP-5, 30 m x 0,32 mm x 0,25 m) avec 5977A MSD et analysez hors ligne par chromatographie gazeuse (GC 450, FID, colonne capillaire FFAP 30 m x 0,32 mm x 0,25 m).
- Déterminer la conversion des réactifs (conv.%), la sélectivité vers le produit I (Si %), et le rendement du produit i (Yi %) en utilisant les équations suivantes :
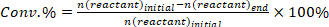 (1)
(1)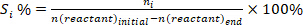 (2)
(2)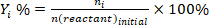 (3)
(3)
Résultats
Des modèles de diffraction des rayons X (DRD) ont été étudiés pour le précurseur LiNbWO6 et l'échantillon de catalyseur hnbWO6 correspondant échangé par proton s'il pour déterminer la phase (figure1 et figure 2). NH3-la desorption programmée par la température (NH3-TPD) a été utilisée pour sonder l'acidité de surface des échantillons de catalyseur (figure 3
Discussion
Le prétraitement des CNT avec de l'acide nitrique augmente considérablement la surface spécifique (SBET). Les CNT crus ont une surface spécifiquede 103 m 2/g tandis qu'après le traitement, la surface a été augmentée à 134 m 2/g. Par conséquent, un tel prétraitement pour créer des défauts sur la surface du CNT aura un effet positif sur la surface spécifique sur les catalyseurs après modification de l'acide solide et l'imprégnation des particules de platine. Étant donné qu...
Déclarations de divulgation
Nous n'avons rien à divulguer.
Remerciements
Les travaux décrits dans le présent document ont été entièrement soutenus par une subvention du Conseil des subventions de recherche de la Région administrative spéciale de Hong Kong, Chine (UGC/FDS25/E09/17). Nous remercions également la National Natural Science Foundation of China (21373038 et 21403026) d'avoir fourni des instruments analytiques pour la caractérisation des catalyseurs et le réacteur à lit fixe pour l'évaluation des performances des catalyseurs. Le Dr Hongxu Qi tient à remercier pour l'assistant de recherche accordé par le Research Grants Council de Hong Kong (UGC/FDS25/E09/17).
matériels
| Name | Company | Catalog Number | Comments |
| Carbon nanotubes (multi-walled) | Sigma Aldrich | 724769 | |
| Nitric acid (65%) | Sigma Aldrich | V000191 | |
| sulphuric acid (98%) | MERCK | 100748 | |
| Lithium carbonate (>99%) | Aladdin | L196236 | |
| Niobium pentaoxide (99.95%) | Aladdin | N108413 | |
| Tungsten trioxide (99.8%) | Aladdin | T103857 | |
| Molybdenum trioxide (99.5%) | Aladdin | M104355 | |
| Tantalum oxide (99.5%) | Aladdin | T104746 | |
| Chloroplatinic acid hexahydrate, ≥37.50% Pt basis | Sigma Aldrich | 206083 | |
| tetra (n-butylammonium) hydroxide 30-hydrate | Aladdin | D117227 | |
| Diphenyl ether, 98% | Aladdin | D110644 | |
| 2-Bromoacetophenone,98% | Aladdin | B103328 | |
| Diethyl ether,99.5% | Sinopharm | 10009318 | |
| n-Decane,98% | Aladdin | D105231 | |
| n-Dodecane,99% | Aladdin | D119697 | |
| Autoclave Reactor | CJF-0.05—0.1L (Dalian Tongda Equipment Technology Development Co., Ltd) | ||
| Tube furnace | SK2-1-10/12 (Luoyang Huaxulier Electric Stove Co., Ltd) |
Références
- Jensen, J. L., Uaprasert, V., Fujii, C. R. Acid-Catalyzed Hydration of Dienes. 2. Changes in Activity Coefficient Ratios, Enthalpy, and Entropy as a Function of Sulfuric Acid Concentration. Journal of Organic Chemistry. 41 (10), 1675-1680 (1976).
- Ishida, H., Ono, M., Kaji, S., Watanabe, A. Synthesis of 1,3-Cyclohexadiene through Liquid Phase Dehydration of 2-Cyclohexen-1-ol in Aqueous Solution using Zeolite Catalyst. Nippon Kagaku Kaishi. 4, 267-275 (1997).
- Ishida, H. Liquid-phase hydration process of cyclohexene with zeolites. Catalysis Surveys from Japan. , 241-246 (1997).
- Ushikubo, T., Iizuka, T., Hattori, H., Tanabe, K. Preparation of highly acidic hydrated niobium oxide. Catalysis Today. 16, 291-295 (1993).
- Nakajima, K., et al. Nb2O5.nH2O as a heterogeneous catalyst with water-tolerant Lewis acid sites. Journal of the American Chemical Society. 133 (12), 4224-4227 (2011).
- Lam, E., Luong, J. H. T. Carbon Materials as Catalyst Supports and Catalysts in the Transformation of Biomass to Fuels and Chemicals. ACS Catalysis. 4 (10), 3393-3410 (2014).
- Sudarsanam, P., et al. Functionalised heterogeneous catalysts for sustainable biomass valorisation. Chemical Soceity Review. 47 (22), 8349-8402 (2018).
- Hara, M., et al. A carbon material as a strong protonic acid. Angewandte Chemie International Edition English. 43 (22), 2955-2958 (2004).
- Toda, M., et al. Biodiesel made with sugar catalyst. Nature. 438 (7065), (2005).
- Ji, J., et al. Sulfonated graphene as water-tolerant solid acid catalyst. Chemical Science. 2 (3), 484-487 (2011).
- Wang, Y., et al. Graphene-Based Metal/Acid Bifunctional Catalyst for the Conversion of Levulinic Acid to γ-Valerolactone. ACS Sustainable Chemistry & Engineering. 5 (2), 1538-1548 (2016).
- Ma, Q., et al. Catalytic depolymerization of lignin for liquefied fuel at mild condition by rare earth metals loading on CNT. Fuel Processing Technology. , 220-225 (2017).
- Rahzani, B., Saidi, M., Rahimpour, H. R., Gates, B. C., Rahimpour, M. R. Experimental investigation of upgrading of lignin-derived bio-oil component anisole catalyzed by carbon nanotube-supported molybdenum. RSC Advances. 7 (17), 10545-10556 (2017).
- Guo, Y., Chen, J. Bicomponent Assembly of VO2and Polyaniline-Functionalized Carbon Nanotubes for the Selective Oxidation of Biomass-Based 5-Hydroxymethylfurfural to 2,5-Diformylfuran. ChemPlusChem. 80 (12), 1760-1768 (2015).
- He, J., et al. Characterization of HNbMoO6, HNbWO6 and HTiNbO5 as solid acids and their catalytic properties for esterification reaction. Applied Catalysis A: General. , 145-152 (2012).
- Tagusagawa, C., Takagaki, A., Hayashi, S., Domen, K. Characterization of HNbWO6 and HTaWO6 Metal Oxide Nanosheet Aggregates As Solid Acid Catalysts. Journal of Physical Chemistry C. 113, 7831-7837 (2009).
- Niwa, M., Katada, N., Sawa, M., Murakami, Y. Temperature-Programmed Desorption of Ammonia with Readsorption Based on the Derived Theoretical Equation. Journal of Physical Chemistry. 99, 8812-8816 (1995).
- Leiva, K., et al. Conversion of guaiacol over supported ReOx catalysts: Support and metal loading effect. Catalysis Today. , 228-238 (2017).
- Deng, W., Liu, M., Tan, X., Zhang, Q., Wang, Y. Conversion of cellobiose into sorbitol in neutral water medium over carbon nanotube-supported ruthenium catalysts. Journal of Catalysis. 271 (1), 22-32 (2010).
- Huang, B., Huang, R., Jin, D., Ye, D. Low temperature SCR of NO with NH3 over carbon nanotubes supported vanadium oxides. Catalysis Today. 126 (3-4), 279-283 (2007).
- Takagaki, A., Tagusagawa, C., Hayashi, S., Hara, M., Domen, K. Nanosheets as highly active solid acid catalysts for green chemical syntheses. Energy & Environmental Science. 3 (1), 82-93 (2010).
- Hu, L. -. F., et al. Structure and photocatalytic performance of layered HNbWO6nanosheet aggregation. Journal of Nanophotonics. 9 (1), (2015).
- Geim, A. K. Graphene: Status and Prospects. Science. 324, 1530-1534 (2009).
- Golberg, D., et al. Boron Nitride Nanotubes and Nanosheets. ACS Nano. 4 (6), 2979-2993 (2010).
- Wilson, J. A., Yoffe, A. D. The transition metal dichalcogenides discussion and interpretation of the observed optical, electrical and structural properties. Advances in Physics. 18 (73), 193-335 (1969).
- Ma, R., Sasaki, T. Nanosheets of oxides and hydroxides: Ultimate 2D charge-bearing functional crystallites. Advanced Materials. 22 (45), 5082-5104 (2010).
- Pope, T. R., Lassig, M. N., Neher, G., Weimar Iii, R. D., Salguero, T. T. Chromism of Bi2WO6 in single crystal and nanosheet forms. Journal of Materials Chemistry C. 2 (17), 3223-3230 (2014).
- Yu, Y., et al. Controlled scalable synthesis of uniform, high-quality monolayer and few-layer MoS2 films. Scientific Reports. 3, 1866 (2013).
- Prasomsri, T., Shetty, M., Murugappan, K., Román-Leshkov, Y. Insights into the catalytic activity and surface modification of MoO3 during the hydrodeoxygenation of lignin-derived model compounds into aromatic hydrocarbons under low hydrogen pressures. Energy & Environmental Science. 7 (8), 2660-2669 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon