Method Article
Plateforme intégrée de manipulation cellulaire couplée à la sonde unique pour l'analyse de spectrométrie de masse des médicaments et des métabolites dans les cellules de suspension unique
Dans cet article
Résumé
Une plate-forme intégrée de manipulation cellulaire est développée pour une utilisation en conjonction avec une configuration de spectrométrie de masse à sonde unique pour l'analyse en ligne des cellules de suspension individuelles dans des conditions ambiantes.
Résumé
La spectrométrie de masse à cellule unique (SCMS) permet la détection sensible et l'analyse précise de larges gammes d'espèces cellulaires au niveau des cellules individuelles. La sonde unique, un dispositif d'échantillonnage et d'ionisation à micro échelle, peut être couplée à un spectromètre de masse pour l'analyse rapide et en ligne des constituants cellulaires dans des conditions ambiantes. Auparavant, la technique SCMS à sonde unique était principalement utilisée pour mesurer les cellules immobilisées sur un substrat, limitant les types de cellules pour les études. Dans la présente étude, la technologie SCMS à sonde unique a été intégrée à un système de manipulation cellulaire, généralement utilisé pour la fécondation in vitro. Cette plate-forme intégrée de manipulation et d'analyse cellulaire s'emploie à une sonde de sélection cellulaire pour capturer les cellules flottantes individuelles identifiées et transférer les cellules à l'extrémité d'une seule sonde pour la lyse à microéchelle, suivie d'une analyse de spectrométrie de masse immédiate. Ce processus de capture et de transfert élimine les cellules de la solution environnante avant l'analyse, minimisant l'introduction de molécules matricielles dans l'analyse de spectrométrie de masse. Cette configuration intégrée est capable d'analyser sCMS des cellules ciblées de patient-isolés présentes dans des échantillons de fluides corporels (par exemple, urine, sang, salive, etc.), permettant des applications potentielles de l'analyse de SCMS à la médecine humaine et à la biologie de la maladie.
Introduction
La biologie humaine, en particulier la biologie des maladies, est de plus en plus comprise comme le résultat d'activités au niveau des cellules individuelles, mais les méthodes analytiques traditionnelles, telles que la spectrométrie de masse de chromatographie liquide (LCMS), sont généralement utilisées pour analyser échantillons préparés à partir de populations de cellules, alors que l'information moléculaire acquise ne peut pas représenter avec précision les processus chimiques au niveau des cellules individuelles. Ces méthodes standard et traditionnelles sont incapables de discerner les effets de l'hétérogénéité cellulaire sur une mesure analytique, et le processus de destruction et de mélange des cellules pour préparer le lysate conduit potentiellement à l'altération ou à la perte de la cellule composants1,2. Ces limitations des méthodes traditionnelles sont particulièrement importantes dans l'analyse des cellules des patients, dans laquelle les échantillons obtenus peuvent contenir un mélange complexe de nombreux types de cellules différentes. Pour surmonter ces carences, des méthodes d'analyse moléculaire à cellule unique, y compris des méthodes de spectrométrie de masse à cellule unique (SCMS), sont de plus en plus développées et appliquées à la bioanalyse, en particulier des métabolites cellulaires et du faible poids moléculaire. biomolécules3,4.
Les premières techniques SCMS développées utilisaient des techniques sous vide pour effectuer les analyses dans des conditions non ambiantes2,5,6,7,8,9, 10,11. Les techniques de SCMS non ambiantes sont capables d'analyser les lipides cellulaires et les métabolites, mais nécessitent un prétraitement de l'échantillon dans des conditions artificielles, et ne sont donc pas adaptés à l'analyse en temps réel. Le processus de préparation de l'échantillon pour l'analyse non ambiante comprend l'ajout de composants de matrice, et cette préparation peut modifier les composants cellulaires de leur environnement naturel12. Par conséquent, les techniques de spectrométrie de masse ambiante (SP), qui ne nécessitent pas de vide pour l'environnement d'échantillonnage, sont utilisées pour analyser les cellules dans un environnement proche de la autochtone. Ne pas avoir un environnement sous vide permet la polyvalence dans la conception expérimentale; des caméras peuvent être ajoutées pour surveiller le processus cellulaire et des techniques d'ionisation plus douces peuvent être combinées avec des techniques de séparation pour recevoir de meilleures informations de chaque expérience à celluleunique 4,12,13 ,14,15,16,17,18,19,20,21,22 ,23,24,25,26,27,28,29,30,31 ,32,33,34,35,36,37,38,39,40 ,41,42.
La méthode SCMS à sonde unique est une technique ambiante qui analyse les lignées de cellules cancéreuses vivantes et mammifères dans un environnement quasi-indigène21,43,44,45,46. En outre, le dispositif à sonde unique a été utilisé pour d'autres applications de spectrométrie de masse, y compris l'analyse des molécules extracellulaires dans les sphéroïdes multicellulaires et l'imagerie de la SP des tissus47,48,49 ,50,51,52. Cependant, puisque l'immobilisation cellulaire sur les substrats est nécessaire pour cette méthode, les cellules de suspension ne peuvent pas être directement analysées à l'aide de cette technique3,53. Par conséquent, le système SCMS à sonde unique ne pouvait pas être directement utilisé pour échantillonner les cellules individuelles non adhérentes, telles que les lignées cellulaires non adhérentes ou les cellules de suspension isolées du sang d'un patient ou d'autres fluides corporels54. Dans ce travail, une plate-forme intégrée de manipulation cellulaire (ICMP) est couplée à la technique SCMS à sonde unique pour analyser en ligne les cellules de suspension en ligne en direct avec une préparation minimale de l'échantillon (figure 1)46. L'ICMP se compose d'un microscope inversé pour surveiller la sélection des cellules, d'une sonde de sélection de cellules en verre, d'un micro-injecteur pour capturer des cellules flottantes individuelles, d'une plaque chauffée pour maintenir la température cellulaire, de deux systèmes de manipulation cellulaire pour contrôler mouvements de la sonde de sélection de cellules en verre et d'une sonde unique, et d'un microscope numérique pour observer le transfert cellulaire de l'extrémité de la sonde de sélection cellulaire à l'extrémité à sonde unique. La fabrication de la sonde unique est détaillée dans les publications précédentes et ne sera pas abordée ici21,48. Le système ICMP/single-probe est couplé à un spectromètre de masse à haute résolution. Cette configuration intégrée permet l'échantillonnage de cellules uniques identifiées à partir d'échantillons biologiques complexes avec des effets minimes à partir de molécules matricielles.
Protocole
1. Fabrication de sonde de sélection de cellules en verre
- Convertir les tubes en verre à un seul alésage en une sonde effilée avec une pointe pointue.
- Placez un tube de verre à un seul perçant (ID : 0,3 mm, OD : 1,1 mm) dans les pinces d'un porte-pipette vertical, en centreant le verre par rapport à la bobine chauffante et serrez pour fixer le tube en place. La bobine chauffante est composée d'un fil de résistance au nickel-chrome de calibre 18 (60 mm de longueur) enroulé autour d'une tige métallique (diamètre de 3,90 mm) 2,5 fois.
- Définir le tube en verre avec le programme de température 19,5 (unité du fabricant). Ce paramètre peut être modifié pour un instrument particulier.
- Définir le piston solénoïde à 4 (unité du fabricant). Ce paramètre peut être modifié pour un instrument particulier.
- Déclencher le solénoïde pour tirer le tube de verre. Cette étape crée deux sondes fusionnées à la pointe.
- Utilisez une pince à épiler pour couper 1 mm de l'extrémité de chaque sonde, créant un orifice de 10 m de diamètre à l'extrémité de la sonde.
- Pliez la sonde en verre pour un couplage facile à la configuration ICMP/single-probe SCMS.
- Placer une sonde en verre tirée dans la microforge, en plaçant la pointe à 3 mm au-dessus du fil chauffant de platine.
- Tourner la chaleur sur le fil de platine à 30% de la température maximale.
- Pliez la sonde à 45 degrés de la position d'origine (Figure 2).
2. Assemblage intégré de la plate-forme de manipulation cellulaire
- Placez le microscope inversé, le micro-injecteur et deux systèmes de manipulation cellulaire sur une table motorisée pour un couplage facile avec le spectromètre de masse.
- Modifier l'un des systèmes de manipulation cellulaire pour accueillir une sonde unique en remplaçant l'extrémité par une pince à bras.
- Utilisez une seringue en plastique avec une aiguille pour remplir le micro-injecteur d'huile minérale. Évitez les bulles dans le tube car cela affectera l'aspiration.
- Remplacer l'insert de scène du microscope inversé par la plaque chauffée. Fixer la plaque chauffée à 37 oC avant l'analyse.
- Configurez le dispositif de sélection des cellules en verre.
- Insérez la sonde de sélection des cellules en verre à l'intérieur du support métallique du micro-injecteur en plaçant le côté long (non plié) dans le support capillaire et en resserrant la vis pour fixer la sonde en place. Placez l'angle de la pointe de la sonde parallèle à la plaque chauffée.
CAUTION: La sonde en verre est très forte et fragile, et il se brise facilement. Protégez vos yeux et soyez très prudent lors de l'insertion de la sonde dans le micro-injecteur. - Fixez le support métallique du micro-injecteur dans le système de manipulation cellulaire. Placez l'extrémité de la sonde près du milieu de la lumière du microscope inversée.
- Insérez la sonde de sélection des cellules en verre à l'intérieur du support métallique du micro-injecteur en plaçant le côté long (non plié) dans le support capillaire et en resserrant la vis pour fixer la sonde en place. Placez l'angle de la pointe de la sonde parallèle à la plaque chauffée.
3. Créer un tube de transfert d'ion étendu pour l'inlet de spectromètre de masse
- Utilisez un coupeur en métal pour couper un morceau de tube en acier inoxydable (OD: 0.0625 (1/16) dans, ID: 0.021 po) '250 mm de longueur.
- Mesurez 135 mm à partir de l'extrémité et placez un métal sauvage de sorte que 135 mm seront exposés à l'atmosphère et 115 mm seront à l'intérieur du spectromètre de masse. Fixer le sauvage à l'aide de deux clés pour le serrer.
4. Coupler l'ICMP avec une configuration à sonde unique
- Fixer la glissière en verre contenant la sonde unique dans la pince à bras du système de manipulation cellulaire.
REMARQUE : Les sondes simples sont fabriquées selon un protocole48 déjà publié avec deux changements mineurs dans la présente étude : l'émetteur nano-ESI est plus long pour un couplage facile au spectromètre de masse, et les sondes simples sont collées au verre côté droit pour éviter d'interférer avec le mouvement spatial du dispositif de sélection des cellules de verre (figure 2). - Connectez le capillaire solvant à une union conductrice en plaçant le capillaire dans la manche (1/16 x 0,005 po) de la ferrule en plastique et en resserrant le doigt de l'ajustement.
- Connectez l'autre côté de l'union conductrice à un capillaire (ID : 40 m, OD : 150 m), qui est relié à une seringue contenant le solvant d'échantillonnage, en plaçant le capillaire dans la manche (1/32 x 0,007 po) et en resserrant le raccord. Utilisez l'acétonitrile avec 0,1 % d'acide formique comme solvant d'échantillonnage dans ces expériences.
REMARQUE : Le solvant d'échantillonnage est flexible, mais il devrait principalement contenir de l'acétonitrile (ou de l'acétonitrile avec de l'acide formique pour une meilleure ionisation) pour une lyse cellulaire à microéchelle rapide. - Fixez la seringue dans la pompe à seringues du spectromètre de masse.
- Placez le cordon de tension d'ionisation sur un fil de cuivre attaché à l'union conductrice.
- Connectez l'autre côté de l'union conductrice à un capillaire (ID : 40 m, OD : 150 m), qui est relié à une seringue contenant le solvant d'échantillonnage, en plaçant le capillaire dans la manche (1/32 x 0,007 po) et en resserrant le raccord. Utilisez l'acétonitrile avec 0,1 % d'acide formique comme solvant d'échantillonnage dans ces expériences.
- Placez l'émetteur nano-ESI 1 mm à l'orifice du tube de transfert d'ion étendu.
- Utilisez le système de manipulation cellulaire pour contrôler les mouvements spatiaux de la sonde unique et positionner l'émetteur nano-ESI au centre devant le tube de transfert d'ion étendu.
5. Préparation suspendue de l'échantillon cellulaire
- La veille de l'analyse (18-24 h), ensemencez les cellules pour les tester dans un flacon de culture cellulaire (T25). Les cellules de leucémie myéloïde humaine de K562 sont employées comme modèles dans cette étude.
- Chaleur 1x phosphate tamponné saline (PBS) et Roswell Park Memorial Institute (RPMI) moyen complété par 10% de sérum bovin fœtal synthétique (FBS) et 1% pénicilline-streptomycine à 37 oC pendant 30 min.
- Graine 1 x 106 cellules dans un volume total de 10 ml en combinant les cellules avec le milieu chaud. En général, utilisez une pipette de 10 ml pour placer 8 ml de milieu RPMI dans un flacon de culture cellulaire. Ensuite, utilisez une pipette de 2 ml pour mettre 2 ml de cellules K562 confluentes le milieu pour 1 x 106 cellules.
- Incuber les cellules à 37 oC et 5 % de CO2 jusqu'à l'analyse.
- Préparer les cellules pour l'analyse.
- Cellules de pipette de la culture cellulaire flasque dans un tube de centrifugeuse de 15 ml.
- Faites tourner les cellules à 400 x g et 37 oC pendant 5 min et jetez le supernatant.
- Resuspendre les cellules dans 4 ml de milieu RPMI contenant le composé médicamenteux à la concentration de traitement désirée.
REMARQUE: Pour l'analyse des cellules témoins, resuspendre les cellules dans 4 ml de milieu RPMI et passer à l'étape 6. - Incuber les cellules pendant la durée du traitement à 37 oC et 5 % de CO2.
- Faire tourner les cellules à 400 x g et 37 oC pendant 5 min. Aspirez le supernatant.
- Les cellules sont remises en suspension dans 10 ml de PBS, et la centrifugeuse à 400 x g et 37 oC pendant 5 min. Après la rotation, jetez le supernatant. Répétez cette étape 3 fois pour minimiser la détection de la drogue à partir d'éléments extracellulaires.
- Resuspendre les cellules dans 4 ml de PBS pour analyse.
6. Effectuer des mesures SCMS à l'aide de la configuration ICMP/single-probe
- Personnalisez les paramètres du spectromètre de masse pour l'expérience.
- Sous le titre du mode Scan du logiciel d'instrument, sélectionnez Définir L'analyse. Utilisez une résolution de 60 000 m/m à m/z 400, 1 microscan, 100 ms de temps d'injection maximum et un contrôle automatique du gain (AGC). Une plage de masse (m/z) de 100-1000 a été utilisée pour les expériences. Les paramètres peuvent être modifiés en fonction du modèle d'instrument.
- Sous Syringe Pump, sélectionnez un débit de 150 nL/min. Le débit doit être optimisé pour chaque expérience.
- Sélectionnez NSI Source et appliquez une tension de 4,5 kV. Ce paramètre doit également être optimisé pour chaque expérience.
- Allumez le microscope inversé (avec un grossissement de 40x sélectionné pour la plaque supérieure et l'objectif inférieur) et connectez-le au port USB d'un ordinateur portable pour capturer les flux vidéo en direct. Allumer la plaque chauffée et la mettre à 37 oC.
- Sur l'ordinateur, allez à l'onglet Acquire Data, et sélectionnez en continu sous Acquire Time.
- Préparer l'échantillon pour l'analyse.
- Pipette 2-3 ml d'échantillon dans le couvercle d'un petit plat Petri (35 mm x 12 mm).
- 6.4.2 Placer l'échantillon au centre de la lumière à partir du microscope inversé sur le dessus de la plaque chauffée.
- Préparer la sonde de sélection de cellules en verre pour l'analyse. Utilisez le système de manipulation cellulaire pour déplacer la sonde de sorte que sa pointe est concentrée sous le microscope inversé dans le même plan que les cellules.
- Sélectionnez une cellule individuelle pour l'analyse.
- Utilisez le système de manipulation cellulaire pour déplacer la pointe de la sonde de sélection cellulaire vers une cellule ciblée. Ce processus est surveillé à l'aide du microscope inversé.
REMARQUE : Si la pointe de la sonde de sélection cellulaire ne peut pas être focalisée dans le même plan que les cellules, il est possible que la partie pliée de la sonde ne soit pas correctement inclinée. Ajuster la position de la sonde de sélection cellulaire jusqu'à ce que les deux bouts de sonde peuvent être concentrés avec les cellules sous le microscope. - Tournez doucement la poignée du micro-injecteur pour ajuster la position de l'huile minérale à l'intérieur du tube. Une aspiration douce est fournie par le micro-injecteur pour fixer la cellule ciblée à l'extrémité de la sonde de sélection cellulaire.
REMARQUE : Si la cellule ne peut pas être capturée par la sonde de sélection cellulaire par la force d'aspiration, vérifiez la sonde de sélection cellulaire pour s'assurer qu'elle est entièrement insérée dans le support capillaire. De plus, inspectez les niveaux d'huile minérale dans le micro-injecteur et le tube, et expulsez l'air s'il y en a. - Utilisez le système de manipulation cellulaire pour déplacer la cellule à l'extrémité de la sonde de sélection cellulaire à l'extrémité de la sonde unique, à l'aide d'un microscope numérique axé sur la pointe à une seule sonde pour surveiller ce processus. En se touchant, une petite gouttelette d'acétonitrile à la pointe d'une seule sonde induit une lyse rapide de la cellule, puis le lysate cellulaire est immédiatement ionisé pour l'analyse en ligne de la SP.
REMARQUE : Étant donné que la cellule sélectionnée est fixée à la pointe de la sonde de sélection cellulaire par une aspiration douce, cette cellule peut être potentiellement détachée lors de son transfert à l'extrémité de la sonde unique. Par conséquent, si les signaux ioniques des lipides cellulaires typiques (voir les résultats représentatifs ci-dessous) ne sont pas observés dans les 5 s, il est possible que la cellule soit devenue non attachée, et la sélection d'une cellule différente est nécessaire.
- Utilisez le système de manipulation cellulaire pour déplacer la pointe de la sonde de sélection cellulaire vers une cellule ciblée. Ce processus est surveillé à l'aide du microscope inversé.
Résultats
Tout d'abord, les cellules K562 non traitées sont utilisées pour établir la méthode expérimentale. Dans une expérience SCMS typique, des changements évidents des spectres de masse peuvent être observés à partir du transfert d'une cellule, lors de la détection du contenu cellulaire, et après avoir terminé la mesure (Figure S1). Trois pics de lipides cellulaires courants (phosphatidylcholine, PC), y compris pc(34:4)(m/z 754.536), PC(36:4)(m/z 782.567), et PC(38:5) (m/z 808.583), sont surveillés pour s'assurer que la cellule est transférée avec succès et cellulaire contenus sont détectés (Figure S2)21,43,46,55,56. Si les pics lipidiques ne sont pas vus dans les 5 s, le niveau d'huile minérale dans le micro-injecteur est modifié pour réduire l'aspiration tenant la cellule à l'extrémité de sonde de cellule-sélection ; la prudence doit être prise de sorte qu'aucune huile minérale ne soit poussée hors de la sonde de cellule-sélection. L'identité de nombreux PC dans la gamme de masse de m/z 750-850 sont confirmées à l'aide de la SP/MS sur des échantillons de lysate cellulaire non traité (Figure 3, Figure S2, Tableau 1)46.
Les cellules K562 sont également soumises à un traitement avec divers composés médicamenteux pour élargir la polyvalence de la méthode. Les cellules K562 sont incubées avec de la gemcitabine (1 M) et du taxol (1 M) pendant 1 h et osW-1 (100 nM, 1 M) pour 4 h et 2 h, respectivement. Les cellules sont ensuite lavées avec du PBS pour minimiser la détection des composés médicamenteux à partir de contenu extracellulaire. La contribution de la matrice (p. ex., ions du milieu de la culture cellulaire, pbS et solvant) aux spectres de masse du contenu cellulaire peut être éliminée par soustraction de données, en raison de leurs signaux ioniques significativement différents (figure S3). Les trois composés médicamenteux sont détectés à l'aide de la configuration ICMP/single-probe MS (Figure S4)46. Ces résultats suggèrent que cette méthode peut être employée pour étudier les lipides intracellulaires, les drogues, et les métabolites sur le niveau unicellulaire des cellules dans la solution dans un environnement presque indigène.
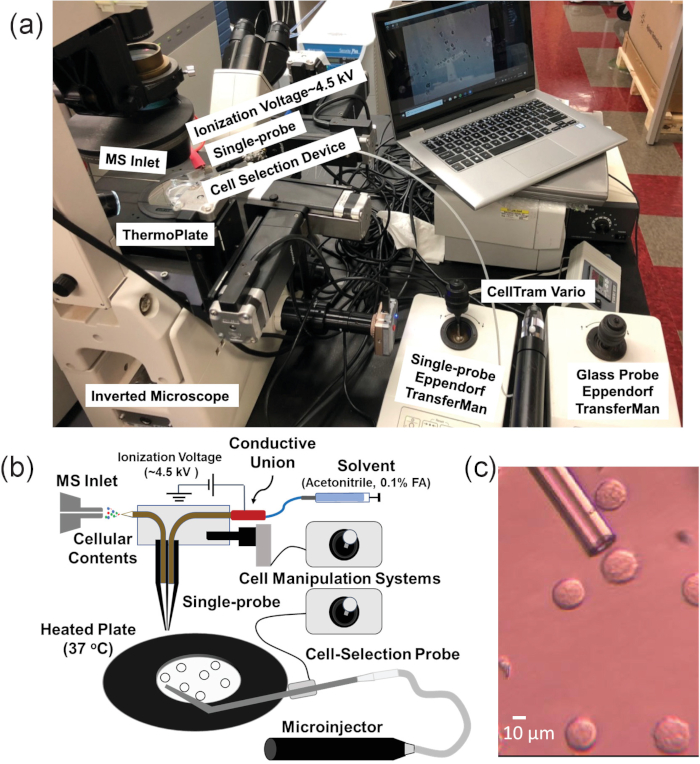
Figure 1. Configuration expérimentale pour les expériences de MS de cellules de suspension simple. (A) La plate-forme intégrée de manipulation cellulaire (ICMP) couplée à un spectromètre de masse. (B) Schématique pour l'analyse des cellules suspendues. (C) Vue expérimentale des cellules K562 à sélectionner à l'aide de la sonde de sélection cellulaire. Réimprimé avec la permission de Standke et coll.46. Copyright 2019 American Chemical Society. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2. Photos d'une sonde unique modifiée et d'une sonde de sélection cellulaire utilisée pour des expériences de SP à une seule cellule de suspension. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
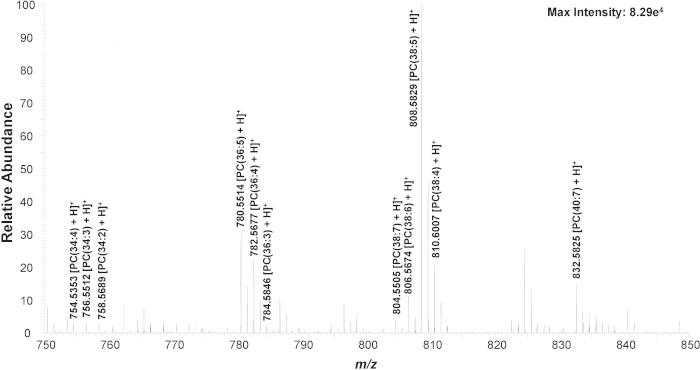
Figure 3. Spectre de masse zoomé à partir d'une seule cellule montrant l'espèce représentative(m/z 750-850). Les structures chimiques sont confirmées à l'aide de l'analyse MS/MS (Figure S1). Réimprimé avec la permission de Standke et al46. Copyright 2019 American Chemical Society. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Molécule de Drogue | m/z | Erreur de masse (ppm) |
| [Gemcitabine et H] + | 264.076 Annonces | à 11h32 |
| [Taxol et Na] + | 876.318 Annonces | 2,74 |
| [OSW-1 et Na] + | 895.445 Annonces | 0,89 |
| Lipides cellulaires | ||
| [PC(34:4) - H] + | 754.535 Annonces | 3,71 |
| [PC(34:3) - H] + | 756.551 Annonces | 3,44 |
| [PC(34:2) - H] + | 758.569 Annonces | 0,66 |
| [PC(36:5) + | 780.551 Annonces | 3,07 |
| [PC(36:4) - H] + | 782.568 Annonces | 2,17 |
| [PC(36:3) - H] + | 784.585 Annonces | 0,64 |
| [PC(38:7) - H] + | 804.551 Annonces | 4.1 (en) |
| [PC(38:6) - H] + | 806.567 Annonces | 2,48 |
| [PC(38:5) + | 808.583 Annonces | 2,72 |
| [PC(38:4) - H] + | 810.601 Annonces | 0 (en) |
| [PC(40:7) + | 832,583 | 3.12 |
Tableau 1. Composants cellulaires identifiés à l'aide de la configuration ICMP/Single-probe. La détection de tous les composés médicamenteux a été confirmée en comparant les résultats de la SP/SP avec le composé standard.
Discussion
La plate-forme intégrée de manipulation et d'analyse cellulaire est conçue pour élargir la polyvalence de la méthode MS à sonde unique, permettant une analyse rapide en ligne des cellules non adhérentes dans un environnement quasi indigène. Un avantage majeur de la technique est que la préparation minimale de l'échantillon est nécessaire, de sorte que les cellules sont analysées dans des conditions qui imitent leur état standard. En particulier, les cellules individuelles d'intérêt peuvent être identifiées visuellement et sélectionnées, minimisant l'influence de l'effet de matrice sur l'efficacité de l'ionisation de la SP tout en maintenant les cellules dans leur environnement naturel, de sorte que les résultats sont plus représentatifs des cellules indigènes statut (Figure S3). Cette technique peut être potentiellement utilisée pour étudier les cellules des patients suspendues dans les biofluides dans de futures études. Un autre avantage de cette technique est la sélection flexible du solvant d'échantillonnage. Il est important d'inclure l'acétonitrile comme solvant d'échantillonnage principal afin que la lyse micro-échelle puisse se produire rapidement. Potentiellement, des normes internes (p. ex., des composés médicamenteux isotopiques) peuvent être ajoutées au solvant d'échantillonnage pour la quantification de molécules d'intérêt (p. ex., des molécules médicamenteuses) à partir de cellules individuelles, y compris celles-ci peuvent jouer un rôle clé dans la révolution personnalisation des traitements médicamenteux à l'avenir54.
Bien que ce système intégré puisse être utilisé commodément pour analyser de larges gammes de cellules, une limitation de la méthode est que ni la sonde à sonde unique ni la sonde de sélection cellulaire n'est disponible dans le commerce; dicter la nécessité d'optimiser de nombreux paramètres (p. ex. débit, tension, longueur entre l'émetteur nano-ESI et les tubes de transfert d'ions, etc.) avant chaque expérience. De plus, en raison de la petitesse de la sonde à sonde unique et de la sonde de sélection cellulaire, la perturbation de l'environnement (p. ex., le débit d'air) peut entraîner des difficultés à établir une jonction entre les deux sondes. Une solution à court terme est la flexion de la sonde de sélection cellulaire près de l'extrémité pour minimiser la longueur de l'effilage. Les travaux futurs comprennent la construction d'un logement pour enfermer les parties critiques de la configuration afin de minimiser les effets environnementaux. En raison de la quantité limitée de contenu cellulaire et du court temps d'acquisition (2-3 s) d'une cellule, l'analyse de la SP/MS ne peut être effectuée que pour des espèces relativement abondantes. D'autres facteurs influençant la sensibilité de détection incluent l'efficacité d'ionisation supprimée due à l'introduction de la matrice avec la perte potentielle d'ions par le tube prolongé de transfert d'ion.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs remercient Naga Rama Kothapalli pour son travail dans le développement de la préparation de l'échantillon pour les deux cellules de suspension et les expériences de lysate cellulaire. De plus, les auteurs remercient les NIH (R01GM116116 et R21CA204706) pour leur financement.
matériels
| Name | Company | Catalog Number | Comments |
| Acetontrile | Millipore Co. | AX0145-1 | Sampling solvent |
| CellTram Vario | Eppendorf | 6221 | ICMP |
| Copper wire | stores.ebay.com/jewelerheaven | Dead soft, round, 20 guage, 25 ft | Conductive union setup |
| Digital stereomicroscope | Shenzhen D&F Co. | Supereyes T004 | Analysis |
| Disposable micropipette, 1-5 µL | Rochester Scientific | 5065 | Cell-selection probe fabrication |
| Dual bore quartz tubing, 1.120"x0.005"x12" | Friedrich & Dimmock, Inc. | MBT-005-020-2Q | Single-probe fabrication |
| Epoxy resin | Devcon | Part No. 20945 | Single-probe fabrication |
| Eppendorf cell manipulation system | Eppendorf | Transferman NK517800397-U.R. | ICMP |
| External nut | VALCO*CHEMINERT | EN1 | Ion transfer tube fabrication |
| Formic acid | Sigma-Aldrich | 399388-500ML | Sampling solvent |
| Fused silica capillary, ID: 40 µm, OD: 100 µm | Polymicro Technologies | TSP040105 | Single-probe fabrication, conductive union setup |
| Fused silica capillary, ID: 50 µm, OD: 150 µm | Polymicro Technologies | 1068150015 | Conductive union setup |
| HyClone Synthetic fetal bovine serum (FBS) | Fischer Sci | SH3006603 | Cell culture |
| Inline MicroFilter | IDEX Health & Science LLC | M-520 | Conductive union setup |
| Laser puller | Sutter Instrument Co. | Model P-2000 | Single-probe fabrication |
| LED UV lamp | Foshan Liang Ya Dental Equipment | LY-C240 | Single-probe fabrication |
| LTQ Orbitrap mass spectrometer | Thermo Scientific | LTQ Orbitrap XL | Analysis |
| Microforge | Narishige, Co. | MF-9 | Cell-selection probe fabrication |
| Microunion | IDEX Health & Science LLC | M-539 | Conductive union |
| PEEK tubing, 1/32x0.005x 5ft | IDEX Health & Science LLC | 1576 | Conductive union setup |
| PEEK tubing, 1/32x0.007x 5ft | IDEX Health & Science LLC | 1577 | Conductive union setup |
| Penicillin/Streptomycin | Gibco/Life Technologies | 15140-122 | Cell culture |
| Petri dish, 35x10 mm | VWR | 25382-334 | Sample preparation |
| Phosphate Buffered Saline (PBS) | VWR | 0780-50L | Cell culture |
| Platinum wire | Narishige, Co. | Model PT-A | Microforge |
| Power supply | Nikon | PSM-2120 | ICMP |
| RPMI, 1X with Corning glutagro | Corning | 10-104-CV | Cell culture |
| Single-bore tubes | Boralex | 5065 | Cell-selection probe fabrication |
| Stainless steel ferrules, for 1/16" OD | IDEX Health & Science LLC | VHP-200-01x | Ion transfer tube fabrication |
| Stainless steel tubing, 1/32x 205 µm x30 cm | IDEX Health & Science LLC | U-1128 | Ion transfer tube fabrication |
| Syringe, 250 µL | Hamilton | 1725LTN250UL | Sampling syringe |
| T25 flask | CellStar | 690160 | Cell culture |
| Thermo LTQ XL ion source interface flange | New Objective | PB5500 | Analysis |
| ThermoPlate | TokaiHit | 55R30N | ICMP |
| TrypLE Express | Gibco | 12605-010 | Cell culture |
| Tube cutter, for 1/16" stainless steel | SUPELCO | 58692-U | Ion transfer tube fabrication |
| USB digital photography microscope | dx.com | SO2 25~500X | Analysis |
| UV curing resin | Prime Dental | Item No. 006.030 | Single-probe fabrication |
| Vertical pipette puller | David Kopf Instruments | Model 720 | Cell-selection probe fabrication |
| Voltage housing | PicoChip | PCH-A00120 | ICMP/MS interface |
| Wire cutter | Craftsman | 4 1/2 in end nipper | Conductive union setup |
Références
- Mao, S., et al. In Scatheless Cell Detachment Reveals Correlation between Adhesion Strength and Viability at Single-Cell Resolution. Angewandte Chemie International Edition. 57 (1), 236-240 (2017).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nature Methods. 8 (4), S20-S29 (2011).
- Linwen, Z., Akos, V. Single-Cell Mass Spectrometry Approaches to Explore Cellular Heterogeneity. Angewandte Chemie International Edition. 57 (17), 4466-4477 (2017).
- Chen, X., et al. Single-cell analysis at the threshold. Nature Biotechnology. 34, 1111(2016).
- Fu, Q., Tang, J., Cui, M., Xing, J., Liu, Z., Liu, S. Application of porous metal enrichment probe sampling to single cell analysis using matrix-assisted laser desorption ionization time of flight mass spectrometry (MALDI-TOF-MS). Journal of Mass Spectrometry. 51, (2016).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-Cell Lipidomics: Characterizing and Imaging Lipids on the Surface of Individual Aplysia californica Neurons with Cluster Secondary Ion Mass Spectrometry. Analytical Chemistry. 85 (4), 2231-2238 (2013).
- Passarelli, M. K., et al. Single-Cell Analysis: Visualizing Pharmaceutical and Metabolite Uptake in Cells with Label-Free 3D Mass Spectrometry Imaging. Analytical Chemistry. 87 (13), 6696-6702 (2015).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary Ion MS Imaging To Relatively Quantify Cholesterol in the Membranes of Individual Cells from Differentially Treated Populations. Analytical Chemistry. 79 (10), 3554-3560 (2007).
- Ibáñez, A. J., et al. Mass spectrometry-based metabolomics of single yeast cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), 8790-8794 (2013).
- Lanni, E. J., Rubakhin, S. S., Sweedler, J. V. Mass spectrometry imaging and profiling of single cells. Journal of Proteomics. 75 (16), 5036-5051 (2012).
- Ong, T. -H., Tillmaand, E. G., Makurath, M., Rubakhin, S. S., Sweedler, J. V. Mass spectrometry-based characterization of endogenous peptides and metabolites in small volume samples. Biochimica et biophysica acta. 1854 (7), 732-740 (2015).
- Yang, Y., Huang, Y., Wu, J., Liu, N., Deng, J., Luan, T. Single-cell analysis by ambient mass spectrometry. TrAC Trends in Analytical Chemistry. 90, 14-26 (2017).
- Sims, C. E., Allbritton, N. L. Analysis of single mammalian cells on-chip. Lab on a Chip. 7 (4), 423-440 (2007).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. Journal of Mass Spectrometry. 43 (12), 1692-1700 (2008).
- Fujii, T., et al. Direct metabolomics for plant cells by live single-cell mass spectrometry. Nature Protocols. 10, 1445(2015).
- Esaki, T., Masujima, T. Fluorescence Probing Live Single-cell Mass Spectrometry for Direct Analysis of Organelle Metabolism. Analytical Sciences. 31 (12), 1211-1213 (2015).
- Tsuyama, N., Mizuno, H., Tokunaga, E., Masujima, T. Live Single-Cell Molecular Analysis by Video-Mass Spectrometry. Analytical Sciences. 24 (5), 559-561 (2008).
- Mizuno, N., Harada, T., Masujima, T., T, H. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. Journal of Mass Spectrometry. , (2008).
- Phelps, M., Hamilton, J., Verbeck, G. F. Nanomanipulation-coupled nanospray mass spectrometry as an approach for single cell analysis. Review of Scientific Instruments. 85 (12), 124101(2014).
- Phelps, M. S., Verbeck, G. F. A lipidomics demonstration of the importance of single cell analysis. Analytical Methods. 7 (9), 3668-3670 (2015).
- Pan, N., Rao, W., Kothapalli, N. R., Liu, R., Burgett, A. W. G., Yang, Z. The Single-Probe: A Miniaturized Multifunctional Device for Single Cell Mass Spectrometry Analysis. Analytical Chemistry. 86 (19), 9376-9380 (2014).
- Gong, X., et al. Single Cell Analysis with Probe ESI-Mass Spectrometry: Detection of Metabolites at Cellular and Subcellular Levels. Analytical Chemistry. 86 (8), 3809-3816 (2014).
- Lorenzo Tejedor, M., Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. In Situ Molecular Analysis of Plant Tissues by Live Single-Cell Mass Spectrometry. Analytical Chemistry. 84 (12), 5221-5228 (2012).
- Shimizu, T., et al. Live Single-Cell Plant Hormone Analysis by Video-Mass Spectrometry. Plant and Cell Physiology. 56 (7), 1287-1296 (2015).
- Yamamoto, K., et al. Cell-specific localization of alkaloids in Catharanthus roseus stem tissue measured with Imaging MS and Single-cell MS. Proceedings of the National Academy of Sciences. 113 (14), 3891(2016).
- Date, S., Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Direct Drug Metabolism Monitoring in a Live Single Hepatic Cell by Video Mass Spectrometry. Analytical Sciences. 28 (3), 201(2012).
- Hiyama, E., et al. Direct Lipido-Metabolomics of Single Floating Cells for Analysis of Circulating Tumor Cells by Live Single-cell Mass Spectrometry. Analytical Sciences. 31 (12), 1215-1217 (2015).
- Masuda, K., Abouleila, Y., Ali, A., Yanagida, T., Masujima, T. Live Single-Cell Mass Spectrometry (LSC-MS) for Plant Metabolomics. BT - Plant Metabolomics: Methods and Protocols. , 269-282 (2018).
- Ferreira, C. R., Eberlin, L. S., Hallett, J. E., Cooks, R. G. Single oocyte and single embryo lipid analysis by desorption electrospray ionization mass spectrometry. Journal of Mass Spectrometry. 47 (1), 29-33 (2012).
- Ferreira, C. R., Pirro, V., Eberlin, L. S., Hallett, J. E., Cooks, R. G. Developmental phases of individual mouse preimplantation embryos characterized by lipid signatures using desorption electrospray ionization mass spectrometry. Analytical and Bioanalytical Chemistry. 404 (10), 2915-2926 (2012).
- Lee, J. K., Jansson, E. T., Nam, H. G., Zare, R. N. High-Resolution Live-Cell Imaging and Analysis by Laser Desorption/Ionization Droplet Delivery Mass Spectrometry. Analytical Chemistry. 88 (10), 5453-5461 (2016).
- Bergman, H. -M., Lanekoff, I. Profiling and quantifying endogenous molecules in single cells using nano-DESI MS. Analyst. 142 (19), 3639-3647 (2017).
- Yin, L., Zhang, Z., Liu, Y., Gao, Y., Gu, J. Recent advances in single-cell analysis by mass spectrometry. Analyst. 144 (3), 824-845 (2019).
- González-Serrano, A. F., et al. Desorption Electrospray Ionization Mass Spectrometry Reveals Lipid Metabolism of Individual Oocytes and Embryos. PLoS ONE. 8 (9), e74981(2013).
- Liu, Y., et al. Study on Variation of Lipids during Different Growth Phases of Living Cyanobacteria Using Easy Ambient Sonic-Spray Ionization Mass Spectrometry. Analytical Chemistry. 86 (14), 7096-7102 (2014).
- Shrestha, B., et al. Subcellular Metabolite and Lipid Analysis of Xenopus laevis Eggs by LAESI Mass Spectrometry. PLoS ONE. 9 (12), e115173(2014).
- Stolee, J. A., Shrestha, B., Mengistu, G., Vertes, A. Observation of Subcellular Metabolite Gradients in Single Cells by Laser Ablation Electrospray Ionization Mass Spectrometry. Angewandte Chemie International Edition. 51 (41), 10386-10389 (2012).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Shrestha, B., Nemes, P., Vertes, A. Ablation and analysis of small cell populations and single cells by consecutive laser pulses. Applied Physics A. 101 (1), 121-126 (2010).
- Stolee, J. A., Vertes, A. Toward Single-Cell Analysis by Plume Collimation in Laser Ablation Electrospray Ionization Mass Spectrometry. Analytical Chemistry. 85 (7), 3592-3598 (2013).
- Zhang, L., Vertes, A. Single-Cell Mass Spectrometry Approaches to Explore Cellular Heterogeneity. Angewandte Chemie International Edition. 57 (17), 4466-4477 (2018).
- Onjiko, R. M., Moody, S. A., Nemes, P. Single-cell mass spectrometry reveals small molecules that affect cell fates in the 16-cell embryo. Proceedings of the National Academy of Sciences. 112 (21), 6545 LP-6550 (2015).
- Liu, R., Pan, N., Zhu, Y., Yang, Z. T-Probe: An Integrated Microscale Device for Online In Situ Single Cell Analysis and Metabolic Profiling Using Mass Spectrometry. Analytical Chemistry. 90 (18), 11078-11085 (2018).
- Pan, N., Rao, W., Standke, S. J., Yang, Z. Using Dicationic Ion-Pairing Compounds To Enhance the Single Cell Mass Spectrometry Analysis Using the Single-Probe: A Microscale Sampling and Ionization Device. Analytical Chemistry. 88 (13), 6812-6819 (2016).
- Sun, M., Tian, X., Yang, Z. Microscale Mass Spectrometry Analysis of Extracellular Metabolites in Live Multicellular Tumor Spheroids. Analytical Chemistry. 89 (17), 9069-9076 (2017).
- Standke, S. J., Colby, D. H., Bensen, R. C., Burgett, A. W. G., Yang, Z. Mass Spectrometry Measurement of Single Suspended Cells Using a Combined Cell Manipulation System and a Single-Probe Device. Analytical Chemistry. 91 (3), 1738-1742 (2019).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. Journal of The American Society for Mass Spectrometry. 26 (6), 986-993 (2015).
- Rao, W., Pan, N., Yang, Z. Applications of the Single-probe: Mass Spectrometry Imaging and Single Cell Analysis under Ambient Conditions. Journal of Visualized Experiments. (112), 53911(2016).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. Journal of the American Society for Mass Spectrometry. 27 (1), 124-134 (2016).
- Liu, R., Zhang, G., Yang, Z. Towards rapid prediction of drug-resistant cancer cell phenotypes: single cell mass spectrometry combined with machine learning. Chemical Communications. 55 (5), 616-619 (2019).
- Sun, M., Yang, Z. Metabolomic Studies of Live Single Cancer Stem Cells Using Mass Spectrometry. Analytical Chemistry. 91 (3), 2384-2391 (2019).
- Tian, X., Zhang, G., Shao, Y., Yang, Z. Towards enhanced metabolomic data analysis of mass spectrometry image: Multivariate Curve Resolution and Machine Learning. Analytica Chimica Acta. 1037, 211-219 (2018).
- Hu, P., Zhang, W., Xin, H., Deng, G. Single Cell Isolation and Analysis. Frontiers in Cell and Developmental Biology. 4, 116(2016).
- Wu, C., Wu, P., Zhao, H., Liu, W., Li, W. Clinical Applications of and Challenges in Single-Cell Analysis of Circulating Tumor Cells. DNA and Cell Biology. 37 (2), 78-89 (2017).
- Schober, Y., Guenther, S., Spengler, B., Römpp, A. Single Cell Matrix-Assisted Laser Desorption/Ionization Mass Spectrometry Imaging. Analytical Chemistry. 84 (15), 6293-6297 (2012).
- Pulfer, M., Murphy, R. C. Electrospray mass spectrometry of phospholipids. Mass Spectrometry Reviews. 22 (5), 332-364 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon