Method Article
Réseaux de cardiomyocytes dérivés de l'iPSC sur des réseaux de micro-électrodes multipuits pour des enregistrements potentiels d'action récurrents
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article contient un ensemble de protocoles pour le développement des réseaux de cardiomyocytes pluripotents induits par l'homme (hiPSC-CM) cultivés sur des plaques MEA multiwell pour électroporater réversiblement la membrane cellulaire pour des mesures potentielles d'action. Les enregistrements à haut débit sont obtenus à partir des mêmes sites cellulaires à plusieurs reprises au cours des jours.
Résumé
Le dépistage de l'innocuité cardiaque est d'une importance primordiale pour la découverte de médicaments et la thérapeutique. Par conséquent, le développement de nouvelles approches électrophysiologiques à haut débit pour les préparations de cardiomyocytes dérivés de hiPSC (hiPSC-CM) est très nécessaire pour un dépistage efficace des drogues. Bien que des réseaux multiélectrodes (MeA) soient fréquemment utilisés pour des mesures potentielles sur le terrain de cellules excitables, une publication récente de Joshi-Mukherjee et de ses collègues a décrit et validé son application pour des enregistrements à potentiel d'action récurrent (AP). de la même préparation hiPSC-CM pendant des jours. L'objectif ici est de fournir des méthodes détaillées étape par étape pour l'ensemencement des MM et pour mesurer les formes d'ondes AP par électroporation avec une haute précision et une résolution temporelle de 1 's. Cette approche répond à l'absence de méthodologie facile à utiliser pour obtenir un accès intracellulaire pour des mesures AP à haut débit pour des études électrophysiologiques fiables. Un flux de travail détaillé et des méthodes pour le placage des hiPSC-CM sur les plaques MEA multiwell sont discutés en mettant l'accent sur les étapes critiques, le cas échéant. En outre, un script MATLAB sur mesure pour la manipulation rapide des données, l'extraction et l'analyse est signalé pour une étude approfondie de l'analyse des formes d'ondes afin de quantifier les différences subtiles dans la morphologie pour divers paramètres de durée AP impliqués dans arythmie et cardiotoxicité.
Introduction
Les cardiomyocytes pluripotents induits par l'homme (hiPSC-CM) sont l'étalon-or d'un nombre croissant de laboratoires1,2,3,4,5,6 ,7,8,9,10. Battre les corps embryonnaires11,12,13 et monocouches3,7,10,11,12, 13,14,15,16,17 la différenciation sont les méthodes préférées pour la production de cardiomyocytes et le tableau multiélectrode (MEA) est devenu une modalité commune pour le suivi de l'électrodynamique de ces réseaux18,19,20. Alors que les paramètres qui peuvent être extraits des potentiels de champ (PF) tels que le taux de battement, l'amplitude, la durée et les intervalles RR sont des réponses électrophysiologiques de base de battre spontanément monocouches18,21, 22,23, les composants du potentiel d'action (AP) sous-jacents à ces signaux FP extracellulaires sont difficiles à extrapoler24. Notre publication récente sur la découverte d'une application des AEM pour des mesures AP récurrentes directes fournit une preuve de méthodologie pour les relectures AP intracellulaires exemplaires avec une analyse approfondie des formes d'onde à diverses phases de repolarisation à travers plusieurs lots de réseaux de cardiomyocytes dérivés de hiPSC3. Dans l'étude, nous avons démontré que la livraison d'impulsions électroporating aux réseaux de cardiomyocytes dérivés de hiPSC permet l'accès intracellulaire pour des enregistrements ap. Ces enregistrements AP transitoires dépendent des récupérations potentielles transmembranaires observées par le site de blessures3,25,26. Les formes d'ondes enregistrées via MEA et patch-clamp dans notre étude ont montré des morphologies AP similaires validant ainsi la fiabilité de l'approche3.
Quelques laboratoires ont rapporté mesurer des APs de diverses cellules électrogéniques utilisant les MEAs sur mesure18,21,26,27,28,29, 30, mais la fiabilité de l'utilisation des AME pour des mesures AP cohérentes et récurrentes n'a pas été évaluée. À l'heure actuelle, la technique de la pince à patch de l'étalon-or est limitée aux enregistrements terminaux7,31 alors que les mesures AP basées sur le MEA sont transitoires et peuvent donc être effectuées plusieurs fois sur la même cellule. Nous montrons également que l'on peut facilement enregistrer des signaux AP de haute qualité dans la gamme millivolt nécessitant un minimum de filtrage. Les chercheurs peuvent donc mener non seulement des études de médicaments aigus mais aussi chroniques dans les mêmes préparations à l'aide d'EAM. De plus, cette technologie permet de mesurer simultanément le FP/AP générant des bibliothèques d'électrobiome en peu de temps. Compte tenu de l'accent croissant sur la prédiction de l'arythmie et la cardiotoxicité associée aux médicaments24,32,33,34,35, l'intégration de la mesure AP amélioreront l'innocuité et l'efficacité des médicaments.
Ici, nous présentons des protocoles pour 1) pré-placage des hiPSC-CM cryoconservés pour la maturation, 2) la dissociation et le placage des hiPSC-CM sur les eMÉ multiwell, 3) l'enregistrement des FP et des AP des réseaux hiPSC-CM, 4) la segmentation et l'extraction des données aux fins d'analyse, et 5) restaurer les tableaux pour une réutilisation multiple. Chaque étape a été optimisée en mettant l'accent sur les étapes critiques, le cas échéant. Les exigences pour l'attachement cellulaire pour assurer un monocouche syncytial de battement sont discutées et des procédures pour la restauration de MEA multiwell pour des études électrophysiologiques répétitives sont expliquées. Enfin, une interface graphique personnalisée développée en laboratoire est présentée pour l'extraction du signal AP, l'assurance de la qualité et le flux de travail de segmentation afin de quantifier et d'analyser les paramètres AP.
Protocole
1. Préparation des solutions et des matériaux (voir Tableau des matériaux)
-
6-puits tissu-culture plaque de substrat-enduit
- Décongeler le substrat de revêtement sur de la glace ou à 4 oC.
- Préparer une dilution du substrat de revêtement 1:100 dans le milieu froid DMEM/F12. Mélanger la solution par pipetage lent.
- Transférer 2 ml de la solution de substrat de revêtement (étape 1.1.2) par puits d'une plaque de culture de tissu de 6 puits.
- Placez immédiatement la plaque de culture de tissu enduite dans l'incubateur de culture cellulaire à 37 oC et 5 % de CO2 pendant au moins 7 h et utilisez-la dans les 7 jours.
-
médium de culture hiPSC-CM
- Ajouter 10 ml de supplément de milieu CM décongelé à 4 oC à 500 ml de milieu de base CM. Conserver à 4 oC jusqu'à 2 semaines.
- Aliquot a exigé la quantité de support pour la journée et apporter à la température ambiante avant utilisation.
- milieu de décongélation hiPSC-CM : Préparer frais en mélangeant le milieu de culture hiPSC-CM (étape 1.2) avec 10% de sérum bovin foetal (FBS). Amener les supports à la température ambiante avant le dégel des machines à sous pour la suspension.
- Solution de bouillon de fibronectin e 1 mg/mL : Aliquot 200 l dans des tubes de microfuge stériles de 1,5 ml et stockés à 4 oC pour une utilisation ultérieure. Préparer la solution de travail de 50 g/mL de concentration fraîchement sur glace.
- Solution de nettoyage multipuits : Combiner 0,5 g de détergent enzymatique avec 50 ml d'eau stérile double distillée (ddH2O). Vortex pour mélanger le contenu. Filtrer et conserver à 4 oC jusqu'à une semaine.
2. Pré-placage de hiPSC-CM cryoconservé pour la maturation (figure 1)
REMARQUE : Cette section est destinée à la décongélation et à la culture des hiPSC-CM qui ont été différenciés à l'aide de la méthode de monocouches sans mangeoire3,16 et cryoconservées dans l'azote liquide 10 jours après la différenciation à 1-2 millions de cellules/flacons. Les cellules d'une fiole sont plaquées dans deux puits recouverts de substrat d'une plaque de culture tissulaire de 6 puits. Cardiomyocytes ont tendance à se déposer au fond du tube si doux mélange au moment du pré-plaquage est important pour atteindre même la densité cellulaire à travers les puits.
- Aliquot 2 ml de FBS par flacon de hiPSC-CMs étant décongelé dans un tube conique de 15 ml et apporter à la température ambiante.
- Décongeler les flacons de hiPSC-CM cryoconservés en les plaçant dans un bain d'eau de 37 oC et tourbillonner doucement pour même dégeler pendant au plus 3 min.
- Transférer immédiatement le contenu de flacon dans le tube contenant fbS (voir l'étape 2.1), mélanger par tourbillonnement et centrifugeuse à 200 x g pendant 5 min.
- Aspirer le supernatant et resuspendre le granule cellulaire dans 1 ml de milieu de décongélation hiPSC-CM (voir l'étape 1.3) par flacon décongelé. Utilisez une pipette de transfert pour resuspendre la pastille par trituration douce. Évaluer la viabilité des cellules.
- Ajouter 3 ml supplémentaires de dégel moyen par flacon de hiPSC-CM décongelé à l'étape 2.4 et suspendre doucement à l'aide d'une pipette de transfert pour dissocier davantage les amas cellulaires.
- Distribuer doucement 2 mL de suspension cellulaire dans chaque puits de plaques de 6 puits recouvertes de substrat (voir l'étape 1.1). Placer dans l'incubateur de culture cellulaireà 37 oC et 5 % de CO 2.
- Remplacer par le milieu de culture hiPSC-CM frais après 24 h et 3 fois par semaine par la suite pendant 20 jours.
REMARQUE : Les cellules doivent adhérer au revêtement du substrat de 24 h et battre spontanément à 48 h après le plaquage (voir la vidéo 1 et la vidéo 2).
3. Stérilisation et revêtement des plaques multiwell MEA (figure 2 et figure 3)
REMARQUE : Le protocole décrit ici est pour la préparation des plaques MEA de 24 puits avec 12 électrodes micro-or enduites pedOT sur le verre pour le placage hiPSC-CM. Évitez de toucher le fond de la plaque car cela peut endommager les électrodes.
- Deux jours avant le placage cellulaire, ajouter 0,5 ml de milieu de culture hiPSC-CM (voir l'étape 1.2) à chaque puits et effectuer un enregistrement de référence pour vérifier le rapport signal-bruit pour le contrôle de la qualité des EEM.
- Aspirez le support, rincez avec le ddH2O stérile et stérilisez sous la lumière UV à l'intérieur d'une hotte à flux laminaire pendant la nuit.
- La veille du placage cellulaire, ajouter 0,1 ml de FBS à chaque puits pour le traitement hydrophile des surfaces MEA. Incuber 30 min à température ambiante. Cette étape est nécessaire pour l'attachement cellulaire.
- Aspirer le FBS et rincer avec 0,5 ml de ddH stérile2O par puits. Répétez une fois de plus.
- Laisser sécher la plaque dans le capot à écoulement laminaire pendant la nuit.
- Préparer une dilution de travail de 50 g/mL de fibronectin dans le milieu froid DMEM/F12 à partir du stock (voir l'étape 1.4). Gardez la solution sur la glace.
- Pipette 5 l de la dilution de fibronectin fonctionnant (voir 3.6) et distribuer soigneusement la gouttelette au centre de chaque puits pour couvrir tous les 12 électrodes. Il est important de travailler rapidement sur les 24 puits pour empêcher la gouttelette de sécher.
- Placez immédiatement la plaque MEA multibienne recouverte de fibronectin sur une surface surélevée à l'intérieur d'une chambre humidifiante contenant le ddH2O stérile pour couvrir toute la surface du plat. Placez la chambre avec la plaque MEA multiwell pendant 3 h dans l'incubateur de culture cellulaire.
REMARQUE : Placer la plaque MEA de 24 puits dans une chambre humidifiante est essentiel pour empêcher les gouttelettes de fibronectine de se dessécher pendant la période d'incubation.
4. dissociation et placage hiPSC-CM sur la plaque MeA Multiwell (figure 3)
REMARQUE : Commencez cette étape environ 1 h avant que l'incubation de fibronectin de MEA soit terminée. Assurez-vous que la solution de dissociation cellulaire est à 37 oC et que le milieu de décongélation iPSC-CM est à température ambiante. Les méthodes de dissociation ont été optimisées pendant 30 jours après la différenciation des hiPSC-CM cultivés sur des plaques de 6 puits recouvertes de substrat (voir l'étape 2) afin d'obtenir environ 90 % de CM viables pour le placage MEA. Il faut prendre soin de ne pas introduire de bulles d'air pendant la trituration pour prévenir la mort cellulaire.
- Aspirez le milieu de culture de chaque puits du plat de culture de tissu de 6 puits avec la culture de hiPSC-CM post-différenciée de 30 jours (voir étape 2.7) et lavez avec 2 ml de D-PBS stérile par puits.
- Ajouter 1 ml de solution de dissociation cellulaire préchauffée (voir Tableau des matériaux) par puits et incuber pendant 4 min à 37 oC. Utilisez une pipette de transfert pour triturer doucement pour desserrer les cellules en cas de dissociation. Si la plupart des cellules sont encore adhérentes, incuber pendant encore 3 min à 37 oC et triturate à nouveau. Cette incubation supplémentaire devrait aider à la récupération maximale des cellules. Ne pas couver pendant plus de 7 min car cela pourrait entraîner une faible viabilité cellulaire.
- À l'aide d'une pipette de transfert, enrouler toutes les cellules dissociées dans un tube conique contenant le milieu de décongélation hiPSC-CM (voir l'étape 1.3). Il est recommandé de suspendre les cellules dans au moins deux fois le volume de la médication (2 ml par puits récolté) pour bloquer l'activité de la solution de dissociation cellulaire.
- Centrifugeuse à 200 x g pendant 5 min.
- Aspirez soigneusement la solution lorsque la pastille est lâchement fixée à la surface et suspendez-la en 0,1 ml de milieu de décongélation hiPSC-CM. Utilisez une pipette de transfert pour resuspendre la pastille à quelques reprises par trituration douce.
- Aliquot 2 L de cellules dissociées et dilue avec 18 l de médias dans un tube de microfuge de 1,5 ml. Ajouter 20 l de Trypan Blue et mélanger pour l'évaluation du nombre cellulaire et de la viabilité.
- Ajustez la densité cellulaire à 6 000 cellules/L en ajoutant le volume approprié de milieu de décongélation hiPSC-CM. Suspendre la pastille en clignotant doucement à quelques reprises. Les hiPSC-CM se détachent facilement des surfaces vitrées, surtout lorsqu'ils sont plaqués à des densités élevées. Nous avons optimisé la densité d'ensemencement et les conditions de placage pour atteindre 15 jours d'enregistrements électriques.
- Une fois prêt, apportez la plaque MEA multiwell dans le capot à flux laminaire pour l'ensemencement cellulaire. Il est essentiel d'effectuer les deux étapes suivantes une bonne à la fois pour empêcher la fibronectine de sécher.
- Retirez soigneusement la gouttelette de fibronectin à l'aide d'une pipette P10 sans toucher les électrodes.
- Distribuez immédiatement une gouttelette de cellules de 5 ll (30 000 cellules) au centre du puits de la plaque MEA couvrant les 12 électrodes. Répétez l'étape jusqu'à ce que tous les 24 puits soient plaqués. Le mélange intermittent de la suspension cellulaire par clignotement est recommandé.
- Placez la plaque MEA multiwell dans la chambre d'humidification vaguement couverte et retournez à l'incubateur de culture cellulaire à 37 oC et 5 % de CO2 pour 3 h pour l'attachement cellulaire.
- Ajouter soigneusement 200 l de milieu de décongélation hiPSC-CM à chaque puits sans déranger les cellules à l'aide d'une pipette P200. Ajouter le support dropwise sur le côté du puits.
- Placez la plaque MEA multiwell dans l'incubateur de culture cellulaire.
- Remplacer par le milieu de culture hiPSC-CM frais à 24 h après le placage. Des battements spontanés de cardiomyocytes peuvent être observés à ce stade (voir la vidéo 3).
- Changez les médias tous les 2 jours jusqu'à la fin des expériences.
5. acquisition d'électroporation et de signal hiPSC-CM (Figures 4 à 6)
REMARQUE : Ce protocole est destiné à l'enregistrement simultané de signaux électrodes à haut débit (12 sites pour chacun des 24 puits). Le système MEA multipuits de 24 puits est utilisé avec le logiciel d'acquisition (voir Tableau des matériaux). Tous les enregistrements de l'AME sont réalisés à 37 oC.
- Activez le tableau d'interface et lancez le logiciel d'acquisition. Prévoyez suffisamment de temps pour que la tête de meA multiwell atteigne une température de 37 oC (voir la flèche no 1 à la figure4).
- Insérez la plaque MEA multiwell de l'étape 4 dans la scène meA multiwell en la plaçant couverte sur la plate-forme d'enregistrement et cliquez sur le bouton Insérer (voir flèche no 2 dans la figure 4). Laisser la température se stabiliser avant de commencer les enregistrements.
-
Ajuster les paramètres d'acquisition et d'électroporation
- Cliquez sur l'icône Définir le flux expérimental (voir flèche no 3 dans la figure 4) et définissez le temps d'enregistrement à 2 min ou au goût.
- Cliquez sur l'icône de configuration d'acquisition de données (voir flèche no 4 à la figure 4) et fixez le taux d'échantillonnage à 20 kHz, filtre à passage élevé à 0,1 Hz et filtre à passage bas à 3500 Hz.
- Cliquez sur l'icône Paramètres de stimulateur (voir Figure 5). Sous l'onglet Définition de stimulus, définissez la stimulation comme des impulsions de tension symétriquebiphysique de 1 mV, 1 ms et 1 Hz. Sous l'onglet Stimulation Electrodes, sélectionnez les sites d'électroporation en mettant en évidence toutes les électrodes pertinentes.
- Cliquez sur le bouton Explorez pour visualiser les signaux dans tous les puits. Vérifier la qualité du signal et les conditions d'état stables. Prenez des notes sur les électrodes avec des signaux FP dans la gamme mV. Cliquez sur le même bouton pour arrêter l'exploration. Aucune donnée n'a été enregistrée jusqu'à présent.
- Commencez à enregistrer en cliquant sur le bouton Go!. Les électrodes de chaque puits afficheront des signaux FP dans la fenêtre de données brutes (Figure 6). Après 30 s d'enregistrement, cliquez sur le bouton Stimuler et permettre à l'électroporation d'avoir lieu sur les sites sélectionnés pour 30 s; puis, cliquez sur le même bouton pour arrêter la stimulation et continuer l'enregistrement pour les 60 s restants.
REMARQUE : Le fichier enregistré peut être lican en passant au mode 'Replayer' dans le menu déroulant 'Application'.
6. Multiwell MEA nettoyage de plaque pour la réutilisation
- Après les expériences finales, nettoyez tous les puits de la plaque multiwell en aspirant tout le contenu média de chaque puits et en évitant soigneusement de toucher la surface de l'électrode.
- Ajouter 1 mL de ddH stérile2O par puits. Aspirer et répéter une fois.
- Ajouter 0,3 ml de solution de nettoyage multipuits (voir l'étape 1.5) par puits. Incuber toute la nuit à température ambiante pour déloger les cellules et les débris.
- Le lendemain matin, aspirer la solution et rincer avec 1 ml de ddH stérile2O. Incubate pendant 5 à 7 min et aspirez. Répéter 5 fois.
- Ajouter 0,5 ml de ddH stérile2O par puits. Enregistrez la ligne de base de la plaque multipuits nettoyée pour vérifier la qualité des EME nettoyés (figure 7).
- Conserver à 4 oC jusqu'à ce qu'il soit prêt à l'emploi.
7. Conversion et exportation de fichiers de données
REMARQUE : Quatre fichiers de données seront générés pour chaque enregistrement : les fichiers MWR, MWC, MWD et MWS. À l'aide du logiciel de convertisseur, le fichier MWD peut être converti en fichier H5 pour analyse ultérieure à l'aide d'un script sur mesure (voir Dossier supplémentaire 1).
- Lancer le logiciel de convertisseur (voir Tableau des matériaux).
- Sélectionnez Le chemin d'entrée de définir dans le menu Fichier. Sélectionnez le dossier contenant des fichiers de données d'intérêt.
- Sélectionnez Le chemin de sortie de définir dans le menu Fichier. Sélectionnez le dossier où les fichiers convertis doivent être enregistrés.
- Mettez en surbrillance le fichier d'intérêt MWD.
- Cliquez sur le bouton EXPORT sur HDF5.
8. Segmentation et analyse des données (figures 8-10)
REMARQUE : Le logiciel personnalisé basé sur Matlab est utilisé pour segmenter et extraire divers paramètres de données FP et AP. Le logiciel est disponible sur demande.
- Exécutez le code d'analyse Waveform à l'aide de Matlab (voir La figure 8 pour voir la fenêtre principale de l'interface graphique).
- Cliquez sur Fichier et sélectionnez Process .h5.
- Trouvez et sélectionnez le fichier mwd.h5 créé en fonction de l'étape 7 ci-dessus.
- Cliquez sur le bouton Enregistrer le répertoire pour modifier l'emplacement de stockage des fichiers de sortie.
- Créez une file d'attente de traitement du signal en sélectionnant des combinaisons d'électrodes/puits d'intérêt, puis en cliquant sur le bouton File d'attente. Répétez cette étape pour annexer plus d'électrodes/combinaisons de puits à traiter dans la file d'attente.
- Modifier la file d'attente en cliquant directement sur Med Name / Med Concentration si les cellules ont été traitées avec des médicaments (Figure 8).
- Une fois la file d'attente finale, cliquez sur le bouton Initialize Waveforms. Cela permettra de commencer le traitement préliminaire dans lequel les signaux sont identifiés et extraits pour la segmentation.
- Cliquez sur le bouton Zoom In et sélectionnez la zone d'action potentielle d'intérêt avec le curseur (Figure 9).
- Cliquez sur le bouton Garder et passer en revue les panneaux. Des pics (x rouge) et des creux (cercles jaunes) sont détectés pour chaque forme d'onde et les potentiels d'action normalisés sont superposés. Cliquez sur le bouton Garder et passer à la trace suivante dans la file d'attente (Figure 10).
- Répétez les étapes 8.8-8.9 pour le reste des signaux de combinaison électrode/puits dans la file d'attente.
REMARQUE : Un fichier .csv sera généré avec des paramètres APD mesurés pour chaque forme d'onde. Un fichier .mat pour chaque fichier .h5 est également enregistré pour permettre un traitement supplémentaire des données segmentées.
Résultats
La viabilité et la densité de placage des hiPSC-CM post-décongelés sont essentielles pour la culture meA multibienne. Pré-placage de 1-2 millions de hiPSC-CMs/vial dans deux puits d'une plaque de culture tissulaire de 6 puits avec une viabilité de 50 % ou plus produira une culture monocouche saine avec des battements spontanés à 48 h. Une mauvaise viabilité des M donnera des cultures avec un pourcentage élevé de populations non-myocytes. Ces monocouches lorsqu'elles sont dissociées pour le placage MEA multiwell produisent généralement des résultats incohérents et des signaux de mauvaise qualité et doivent donc être jetées. La figure 1 montre des exemples de cultures hiPSC-CM s'accommodées optimales par rapport à des cultures sous-optimales à 48 h après le placage. Le dégel des CM sur des plaques de culture tissulaire recouvertes de substrat plutôt que directement sur des AEM multibiens permet la récupération et la maturation cellulaires3. Le placage direct des CM cryoconservés sur le tableau n'est pas recommandé car il a produit des résultats incohérents.
En plus de la qualité des MC dissociés, l'attachement cellulaire sur meA multiwell est fortement dépendant de la densité cellulaire et de la technique de revêtement de fibronectin. La taille des gouttelettes de fibronectine est critique car les CM se conformeront aux limites de la zone enduite de fibronectin. Pour cette raison, seulement 5 L de la solution de fibronectin sont distribués directement sur la zone de tableau d'électrode. Pour s'assurer que la gouttelette ne se disperse pas, la surface du puits doit être complètement sèche au moment du revêtement. La figure 2 montre la disposition de la plaque MEA multiwell avec des schémas de prétraitement étape par étape pour une préparation optimale. De plus, pour empêcher la fibronectine de sécher les plaques MEA multipuits, il faut placer à l'intérieur d'une chambre d'humidification pendant la période d'incubation ne pouvant pas dépasser 3 h (voir l'étape 3.8). Une fois la période d'incubation terminée, il est important d'enlever la gouttelette de fibronectine de chaque puits juste avant le placage CM et seulement ensuite procéder à la prochaine mise en place de puits. Travailler rapidement et soigneusement la distribution des CM est la clé de l'attachement cellulaire réussie.
Les cultures hiPSC-CM à 30 jours après la différenciation sont dissociées pour le placage multiwell MEA utilisant la méthode de dissociation cellulaire enzymatique (voir l'étape 4). Les MC s'attacheront aux surfaces MEA recouvertes de fibronectin par 3 h et une monocouche couvrant les tableaux sera visible après 24 h après le plaquage (figure3). Le battement synchrone de la monocouche sera observé à 24-48 h. La dispersion des gouttelettes cellulaires affectera la densité de la culture ou même entraînera le séchage et la mort cellulaire. Le placement précis des cellules directement sur le tableau est de la plus haute importance et donc la technique doit être pratiquée pour un placage optimal. L'adhérence cellulaire à l'électrode de référence entravera la production de signaux électriques. Voir Figure 3 pour les images de placement CM optimal, et la culture après 24 h.
Les CM cultivés sur les MEA multiwell sont soumis à un contrôle de qualité de l'activité électrique à 48 h après le plaquage. Typiquement, l'amplitude de signal de FP augmente dela gamme de V à mV dans approximativement 4 jours 3. Si 50% des électrodes d'un réseau et 70% du total des réseaux ne produisent pas de signaux FP, alors le réseau ou la culture sont sous-optimaux et doivent être jetés. Seules les cultures qui passent le contrôle de qualité sont traitées pour l'analyse FP et AP. La figure 6 montre des exemples de bons signaux FP de qualité inférieure.
Les enregistrements AP à médiation électroposée peuvent être obtenus plusieurs fois à partir de cultures 48 h post-MEA placage. En utilisant l'électroporation, nous avons obtenu l'accès intracellulaire pour enregistrer des APs à haute résolution de plusieurs réseaux de cardiomyocytes dérivés de hiPSC. Des impulsions à basse tension (1 V, 1 ms, 1 Hz) pour 30 s ont été livrées pour la transformation transitoire et réversible de FP à AP. L'électroporation permet un accès intracellulaire réussi pour la mesure AP dans environ 75% des électrodes. Les signaux électriques sont enregistrés pendant 2 min qui comprennent 30 s pré-électroporation, 30 s pendant et 1 min après l'électroporation. Un train de 10 s AP formes d'onde 10 s post-électroporation sont évalués sur tous les sites pour la qualité du signal et l'analyse. Toute trace non conforme au signal AP pur est écartée. Pour déterminer si les amplitudes AP sont corrélées au signal FP, nous avons électroporated tous les 288 sites pour enregistrer simultanément les formes d'ondes. Les signaux FP et AP représentatifs enregistrés à partir du même site cellulaire à partir de deux électrodes différentes sont indiqués à la figure 11A. Nous n'avons observé aucune corrélation entre les amplitudes de FP et les amplitudes AP de poteau électroporation enregistrées du même emplacement de cellule. De plus, les électroporations multiples d'un même site cellulaire à 0, 24, 48, 72 et 96 h n'ont eu aucun effet significatif sur la forme DE au fil du temps (figure 11B).
Étant donné la nature à haut débit du système, une technique manuelle pour extraire et quantifier les paramètres d'intérêt tels que l'intervalle RR, la fréquence instantanée et la durée potentielle d'action différentielle est inefficace et prend du temps. Un script MATLAB sur mesure mis à la disposition de la communauté de la recherche sur demande est utilisé pour effectuer des mesures de forme d'onde avec une résolution de 1 's. Les points de temps d'électroporation sont recouverts du signal extrait pour identifier 10 s d'AP après l'électroporation pour effectuer l'extraction du signal, l'assurance de la qualité et le flux de travail de segmentation (figure8, Figure 9, Figure 10). L'interface utilisateur permet de sélectionner le segment souhaité à l'aide des indicateurs d'électroporation superposés comme guide. La forme d'onde segmentée est traitée par sous-routines afin d'identifier davantage les formes d'ondes AP individuelles. Ceci est complété par la détection de pointe, où la tension la plus élevée et la plus basse est identifiée pour chaque cycle. Une fois ce processus terminé, les amplitudes sont normalisées, et les vecteurs de temps associés sont décalés pour définir le temps zéro à une valeur maximale de 1. L'interpolation des points d'intersection le long des cycles individuels a été utilisée pour déterminer les mesures de la DPA. Ainsi, le flux de travail d'automatisation partielle pour la segmentation des formes d'ondes AP permet une analyse efficace des données pour divers paramètres APD à travers plusieurs lots de cultures dans un court laps de temps. D'autres critères d'automatisation des critères d'inclusion et d'exclusion pour les PF et les AP sont en cours pour l'analyse des données en temps réel.
Un avantage significatif de la plaque MEA multiwell est qu'elle peut être réutilisée plusieurs fois. Cette restauration permet des études électrophysiologiques répétitives pour une collecte de données rentable et cohérente. Enregistrements des AP du même tableau après 6 restaurations sont affichés dans la figure 12. Le rapport signal-bruit est similaire pour plusieurs réutilisations. Pour démontrer la fiabilité du tableau pour les études électrophysiologiques répétitives, un total de 3815 formes d'ondes AP sont mises en commun à partir de trois lots de restauration et des données de durée AP sont extraites pour examiner la répétabilité des résultats. Les parcelles de distribution pour la forme d'onde individuelle APD30, APD80, triangulation (APD80—APD30) et le raccourcissement fractionnaire ((APD80—APD30)/(APD80)) sont affichées (figure 13).

Figure 1 : Pré-placage de hiPSC-CM cryoconservé pour la maturation. (A) Traitement cellulaire pour pré-plaquage 1 flacon de 10 jours après la différenciation cryoconservé hiPSC-CMs. (B) Phase images contrastées de cultures hiPSC réussies (gauche) et infructueuses (droite). Barre d'échelle : 275 m. Voir les vidéos 1 et 2 pour les exemples de culture post-différenciation de 14 et 24 jours. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Configuration et préparation des plaques MEA Multiwell. (A) Schémas de plaque MEA multiwell : La plaque se compose de 24 puits (A1 à D6) contenant chacun 12 réseaux de microélectrodes et 4 électrodes de référence périphériques. Diamètre de l'électrode : 30 m / Distance interélectrodes : 300 m. Les enregistrements peuvent être obtenus à partir des 288 électrodes simultanément. (B) Étapes de stérilisation et de traitement hydrophile à effectuer avant le placage hiPSC-CM. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : dissociation et placage hiPSC-CM sur la plaque MeA de Multiwell. (A) Schémas de l'adhérence hiPSC-CM MEA pour chaque puits. (B) Image microscopique illustrant le placement correct de gouttelettede de cellule couvrant chacun e de 12 électrodes sans se propager aux 4 électrodes de référence. (C) Phase contrastez les images microscopiques d'un hiPSC-CM exemplaire (gauche) et sous-optimal (droite) sur MEA à 24 h après le plaquage. Barre d'échelle 275 m. Voir la vidéo 3 pour un exemple de placage MEA réussi. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Logiciel d'acquisition à écran multi-puits. Les flèches indiquent l'emplacement des caractéristiques et des fonctions clés référencées dans le texte : le panneau de contrôle de température (1) permet une surveillance de la température en temps réel tout au long de l'expérience. Insérer/Eject (2) bouton engager et libérer la plaque MeA Multiwell. Définir la fonction Experimental Flow (3) permet à l'utilisateur de définir la durée de l'enregistrement. La fonction de configuration d'acquisition de données (4) permet à l'utilisateur de définir le taux d'échantillonnage et les paramètres de filtre d'acquisition. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : hiPSC-CM acquisition d'électroporation et de signal . L'onglet Définition de stimulus permet à l'utilisateur de définir les paramètres d'impulsion électroporating. L'onglet Électrodes de stimulation permet à l'utilisateur de sélectionner les électrodes électroporating. Toute combinaison des 288 électrodes peut être sélectionnée. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 : Vérification de la qualité des AME Multiwell pour l'activité électrique. Multiwell-Logiciel d'acquisition d'écran montrant des fenêtres de données brutes avec des exemples représentatifs de signaux OPTIMaux (A) et de qualité inférieure (B) FP. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 7 : Signaux FP et AP provenant du nouveau tableau restauré. Multiwell MEA étapes de nettoyage enzymatiques (A). Le signal de base du nouveau tableau indique un rapport signal/bruit minimal (B) et les signaux FP montrent l'activité électrique du réseau (C). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 8 : Segmentation et analyse des données. Vue de la fenêtre principale de gui pour l'analyse waveform. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 9 : Segmentation et analyse des données. Initialize Waveforms bouton pour identifier et extraire les formes d'ondes AP pour la segmentation et de commencer le traitement préliminaire en zoomant et en sélectionnant la zone d'action potentielle d'intérêt. Les cercles rouges sont les indicateurs d'électroporation. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 10 : Segmentation et analyse des données. Des pics (x rouge) et des creux (cercles jaunes) sont détectés pour chaque forme d'onde et les AP normalisés sont superposés pour une vérification de la qualité des formes d'onde. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 11 : Dépendance à l'AMplitude AP au signal FP pour plusieurs enregistrements à partir du même site cellulaire. Amplitude FP dans lesgammes V (A , panneau supérieur gauche) ou mV (A , panneau supérieur droit) enregistré à partir de deux électrodes indépendantes produisent l'amplitude AP dans la gamme mV (A, panneaux gauche et droit) ne montrant aucune corrélation entre les amplitudes FP et après électroporation AP amplitudes. Les formes d'ondes AP normalisées pour chaque enregistrement sont superposées comme indiqué pour chaque enregistrement. Les électroporations multiples d'un même site cellulaire à 0 à 96 h ont produit des formes d'ondes AP de haute qualité permettant le suivi de l'électrodynamique membranaire (B). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
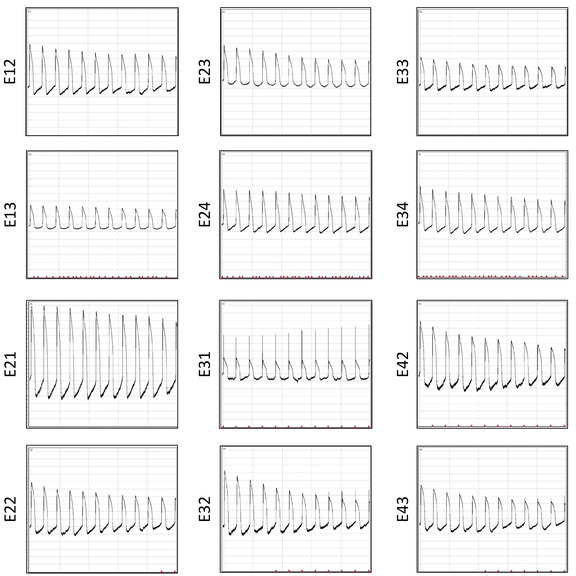
Figure 12 : Enregistrements AP après six restaurations. Les formes d'onde AP enregistrées simultanément 10 s post-électroporation à travers 12 électrodes du même puits sont affichées. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 13 : Histogrammes de paramètres APD provenant de multiples restaurations. Parcelles de distribution pour la forme d'onde individuelle APD30 (A), APD80 (B), triangulation (APD80—APD30) (C) et raccourcissement fractionnaire ((APD80—APD30)/(APD80)) (D) sont affichés. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Fichiers supplémentaires. Vidéos 1-3. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Au fil des ans, l'application des EMA s'est limitée à effectuer des mesures FP de cellules excitables pour étudier leurs propriétés électrophysiologiques36,37,38,39. Seuls quelques groupes ont signalé des traces AP de cellules électrogéniques en utilisant la technologie personnalisée meAbasée 18,29,30. Cependant, ces approches n'ont pas été étudiées pour les enregistrements répétés des mêmes préparations. Nous avons développé une méthodologie innovante et précise pour l'étude des AP à partir du même site cellulaire sur plusieurs jours dans plusieurs réseaux hiPSC-CM simultanément3. Dans notre étude publiée, une plate-forme MEA multi-puits micro-or a été utilisée pour générer des bibliothèques de forme d'onde AP à partir de plusieurs lots de cultures hiPSC-CM avec une grande précision et avec une résolution temporelle de 1 's. Le protocole décrit ici explique l'ensemencement des hiPSC-CM sur le tableau pour le développement efficace des réseaux CM syncytial pour les enregistrements AP à haut débit. Plusieurs étapes critiques du protocole sont : 1) la production de plusieurs lots de haute pureté de CM contrôlés de qualité pour les opérations bancaires de cryoconservation, 2) les CM post-dégel hautement viables pour le pré-plaquage et la maturation, 3) le traitement de la plaque MEA multiwell pour CM l'ensemencement, 4) la dissociation de culture hiPSC-CM à 30 jours après la différenciation pour le placage meA, et 5) la restauration des MEA pour la réutilisation multiple.
Il est important de noter que la variation de lot à lot dans la différenciation hiPSC pourrait affecter les résultats expérimentaux. La méthode monocouche de différenciation a été optimisée en interne pour la production de cardiomyocytes pour centélevé 3,40. L'analyse FACS des marqueurs MLC2v et TNNT2 de nos cultures démontre un phénotype ventriculaire de 90 %3. Ces cultures contrôlées par la qualité sont cryoconservées pour des études expérimentales. Les approches actuelles de différenciation donnent un mélange hétérogène de cellules nodales, auriculaires et ventriculaires3,16,17,41. Par conséquent, les stratégies employées pour l'enrichissement de population de sous-type de CM peuvent encore améliorer la spécificité des cultures. En outre, des approches d'ingénierie tissulaire peuvent être employées pour améliorer leur maturation. Les méthodes proposées ici peuvent facilement être mises en œuvre pour d'autres sources CM.
Les formes d'ondes AP enregistrées à l'aide de MEA étaient similaires à celles enregistrées à partir de réseaux de cardiomyocytes par cartographie optique42,43, oxyde métallique complémentaire à base de semi-conducteurs MEA18,21, et simulé AP en utilisant des enregistrements FP20. Pour aborder le mécanisme des mesures AP par l'intermédiaire de MEA Hai et Spira25 a démontré que l'interface électropore-électrode imite la technique établie de microélectrode de verre pointu. Cependant, le potentiel de la membrane au repos et les vraies valeurs d'amplitude de notre étude ne peuvent pas être établis étant donné que l'interface électropore-électrode dans les systèmes MEA n'est pas calibrée, et que l'amplitude est fonction de la sensibilité et de la résolution de la technique. Notre approche partage des limites similaires à la cartographie optique quand il s'agit de l'amplitude AP.
Les suites de FP/AP multiwell basées sur le MEA ont fait état ici de nouvelles possibilités d'évaluation de l'innocuité des médicaments. Bien que spontanés, ces monocouches hiPSC-CM battent à des rythmes constants. L'analyse des paramètres de la DPA sur plusieurs réseaux donne un aperçu de l'hétérogénéité électrique (figure 13). Cependant, les analyses complètes de restitution d'APD doivent incorporer les intervalles diastoliques précédents. De plus, les formes d'ondes AP de haute qualité enregistrées à partir du même site cellulaire à plus de 96 h (figure 11B) est le premier rapport à suivre l'électrodynamique membranaire au fil du temps qui sera utile dans le développement et dans la maladie.
Le protocole décrit ici pour quantifier les paramètres AP peut être utilisé pour générer des courbes dose-réponse pour tester des composés. Comme récemment rapporté par Edwards et coll.3, la réponse dose de noradrénaline, d'isoproténol et d'E 4031 est tracée pour la DPA à diverses phases de repolarisation. L'étude publiée a démontré l'exactitude et la fiabilité de l'approche pour l'identification des changements subtils dépendants de la dose dans les formes d'ondes AP en temps réel. Cette technique pourrait facilement être étendue pour d'autres composés ou bibliothèques de petites molécules pour comprendre diverses réponses électrophysiologiques.
L'approche meA basée pour les mesures AP présentées dans cette étude sera d'intérêt non seulement pour les électrophysiologistes, mais aussi pour les biologistes cellulaires et les modélisateurs in-silico. De plus, les enregistrements FP/AP provenant du même site cellulaire sur les hiPSC-MC permettront aux chercheurs de générer des bibliothèques de données bioélectriques d'un large éventail de réseaux cellulaires excitables dans un court laps de temps. La disponibilité de ces ressources sera précieuse pour la découverte de médicaments et la modélisation des maladies.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
aucun
matériels
| Name | Company | Catalog Number | Comments |
| Accutase | Sigma Aldrich | A6964-100ML | cell dissociation solution |
| Acquisition software | Multichannel Systems | Multiwell-Screen v 1.9.2.0 | |
| B27 Supplement | ThermoFisher | 17504-044 | CM media supplement |
| Converter software | Multichannel Systems | MultiChannel DataManager | |
| DMEM/F12 | ThermoFisher | 11330-032 | |
| D-PBS | ThermoFisher | 14190-250 | |
| FBS | Fisher Scientific | SH3007103HI | |
| Fibronectin | Sigma Aldrich | F1141-5MG | |
| Geltrex | ThermoFisher | A1413202 | coating substrate |
| Interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot Interface Board | |
| Multiwell MEA Plate | Multichannel Systems | 24W300/30G-288 | |
| RPMI 1640 | ThermoFisher | 11875-093 | CM base medium |
| Terg-a-zyme | Sigma Aldrich | Z273287-1EA | enzymatic detergent |
| Transfer pipettes, individually wrapped | Fisher Scientific | 1371148 | |
| Trypan Blue | Sigma Aldrich | T8154-100ML | |
| Ultrapure sterile water | ThermoFisher | 10977-023 | |
| 6-well tissue-culture treated plates | Fisher Scientific | 08-772-1B |
Références
- Dambrot, C., Passier, R., Atsma, D., Mummery, C. L. Cardiomyocyte differentiation of pluripotent stem cells and their use as cardiac disease models. Biochemical Journal. 434 (1), 25-35 (2011).
- Dunn, K. K., Palecek, S. P. Engineering Scalable Manufacturing of High-Quality Stem Cell-Derived Cardiomyocytes for Cardiac Tissue Repair. Frontiers in medicine. 5, (2018).
- Edwards, S. L., et al. A Multiwell Cardiac muGMEA Platform for Action Potential Recordings from Human iPSC-Derived Cardiomyocyte Constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Huebsch, N., et al. Miniaturized iPS-Cell-Derived Cardiac Muscles for Physiologically Relevant Drug Response Analyses. Scientific Reports. 6, 24726(2016).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sharma, A., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes to assess drug cardiotoxicity. Nature Protocols. , (2018).
- Zhang, D., et al. Tissue-engineered cardiac patch for advanced functional maturation of human ESC-derived cardiomyocytes. Biomaterials. 34 (23), 5813-5820 (2013).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: the matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically Defined Culture and Cardiomyocyte Differentiation of Human Pluripotent Stem Cells. Current Protocols in Human Genetics. 87, (2015).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Burridge, P. W., Zambidis, E. T. Highly efficient directed differentiation of human induced pluripotent stem cells into cardiomyocytes. Methods in Molecular Biology. , 149-161 (2013).
- Laflamme, M. A., et al. Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts. Nature Biotechnology. 25 (9), 1015-1024 (2007).
- Sharma, A., et al. Derivation of highly purified cardiomyocytes from human induced pluripotent stem cells using small molecule-modulated differentiation and subsequent glucose starvation. Journal of Visualized Experiments. (97), (2015).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), (2014).
- Zhang, J., et al. Functional cardiomyocytes derived from human induced pluripotent stem cells. Circulation Research. 104 (4), e30-e41 (2009).
- Jans, D., et al. Action potential-based MEA platform for in vitro screening of drug-induced cardiotoxicity using human iPSCs and rat neonatal myocytes. Journal of Pharmacological and Toxicological Methods. 87, 48-52 (2017).
- Strauss, D. G., Blinova, K. Clinical Trials in a Dish. Trends in Pharmacological Science. 38 (1), 4-7 (2017).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communications. 497 (4), 1135-1141 (2018).
- Braeken, D., et al. Open-cell recording of action potentials using active electrode arrays. Lab Chip. 12 (21), 4397-4402 (2012).
- Otsuji, T. G., et al. Progressive maturation in contracting cardiomyocytes derived from human embryonic stem cells: Qualitative effects on electrophysiological responses to drugs. Stem Cell Research. 4 (3), 201-213 (2010).
- Shinozawa, T., Imahashi, K., Sawada, H., Furukawa, H., Takami, K. Determination of appropriate stage of human-induced pluripotent stem cell-derived cardiomyocytes for drug screening and pharmacological evaluation in vitro. Journal of Biomolecular Screening. 17 (9), 1192-1203 (2012).
- Raphel, F., et al. Identification of Ion Currents Components Generating Field Potential Recorded in MEA From hiPSC-CM. IEEE Transactions on Biomedical Engineering. 65 (6), 1311-1319 (2018).
- Hai, A., Spira, M. E. On-chip electroporation, membrane repair dynamics and transient in-cell recordings by arrays of gold mushroom-shaped microelectrodes. Lab Chip. 12 (16), 2865-2873 (2012).
- Xie, C., Lin, Z., Hanson, L., Cui, Y., Cui, B. Intracellular recording of action potentials by nanopillar electroporation. Nature Nanotechnology. 7 (3), 185-190 (2012).
- Cohen, A., Shappir, J., Yitzchaik, S., Spira, M. E. Reversible transition of extracellular field potential recordings to intracellular recordings of action potentials generated by neurons grown on transistors. Biosensors and Bioelectronics. 23 (6), 811-819 (2008).
- Ojovan, S. M., et al. A feasibility study of multi-site,intracellular recordings from mammalian neurons by extracellular gold mushroom-shaped microelectrodes. Scientific Reports. 5, 14100(2015).
- Shmoel, N., et al. Multisite electrophysiological recordings by self-assembled loose-patch-like junctions between cultured hippocampal neurons and mushroom-shaped microelectrodes. Scientific Reports. 6, 27110(2016).
- Lin, Z. C., Xie, C., Osakada, Y., Cui, Y., Cui, B. Iridium oxide nanotube electrodes for sensitive and prolonged intracellular measurement of action potentials. Nature Communications. 5, 3206(2014).
- Stett, A., Burkhardt, C., Weber, U., van Stiphout, P., Knott, T. CYTOCENTERING: a novel technique enabling automated cell-by-cell patch clamping with the CYTOPATCH chip. Receptors Channels. 9 (1), 59-66 (2003).
- Kanda, Y., Yamazaki, D., Osada, T., Yoshinaga, T., Sawada, K. Development of torsadogenic risk assessment using human induced pluripotent stem cell-derived cardiomyocytes: Japan iPS Cardiac Safety Assessment (JiCSA) update. Journal of Pharmacological Sciences. 138 (4), 233-239 (2018).
- Yang, X., Papoian, T. Moving beyond the comprehensive in vitro proarrhythmia assay: Use of human-induced pluripotent stem cell-derived cardiomyocytes to assess contractile effects associated with drug-induced structural cardiotoxicity. Journal of Applied Toxicology. 38 (9), 1166-1176 (2018).
- Sala, L., Bellin, M., Mummery, C. L. Integrating cardiomyocytes from human pluripotent stem cells in safety pharmacology: has the time come. British Journal of Pharmacology. 174 (21), 3749-3765 (2017).
- Zlochiver, V., Edwards, S., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Del Alamo, J. C., et al. High throughput physiological screening of iPSC-derived cardiomyocytes for drug development. Biochimica et Biophysica Acta. 1863 (7 Pt B), 1717-1727 (2016).
- Clements, M. Multielectrode Array (MEA) Assay for Profiling Electrophysiological Drug Effects in Human Stem Cell-Derived Cardiomyocytes. Current Protocols in Toxicology. 68, 21-22 (2016).
- Navarrete, E. G., et al. Screening drug-induced arrhythmia [corrected] using human induced pluripotent stem cell-derived cardiomyocytes and low-impedance microelectrode arrays. Circulation. 128 (11 Suppl 1), S3-S13 (2013).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Zlochiver, V., Edwards, S. L., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Waas, M., et al. Are These Cardiomyocytes? Protocol Development Reveals Impact of Sample Preparation on the Accuracy of Identifying Cardiomyocytes by Flow Cytometry. Stem Cell Reports. , (2019).
- Gorospe, G., et al. Automated grouping of action potentials of human embryonic stem cell-derived cardiomyocytes. IEEE Transactions on Biomedical Engineering. 61 (9), 2389-2395 (2014).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics & Molecular Biology. 120 (1-3), 3-17 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon