Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cartographie génétique des différences de thermotolérance entre les espèces de levure saccharomyces via Genome-Wide Reciprocal Hemizygosity Analysis
Dans cet article
Résumé
L'hémizygosité réciproque par le séquençage (RH-seq) est une nouvelle méthode puissante pour cartographier la base génétique d'une différence de trait entre les espèces. Les piscines d'hémizygotes sont générées par la mutagénèse transposon et leur condition physique est suivie par la croissance concurrentielle utilisant le séquençage de haut-tout. L'analyse des données obtenues identifie les gènes sous-jacents au trait.
Résumé
Un objectif central de la génétique moderne est de comprendre comment et pourquoi les organismes à l'état sauvage diffèrent dans le phénotype. Jusqu'à présent, le champ a progressé en grande partie sur la force des méthodes de liaison et de cartographie d'association, qui tracent la relation entre les variantes de séquence d'ADN et le phénotype à travers la progéniture recombinante des accouplements entre les individus d'une espèce. Ces approches, bien que puissantes, ne sont pas bien adaptées pour caractéristiquer les différences entre les espèces isolées sur le plan de la reproduction. Nous décrivons ici une nouvelle méthode pour la dissection à l'échelle du génome de la variation naturelle des caractères qui peut être facilement appliquée à des espèces incompatibles. Notre stratégie, RH-seq, est une mise en œuvre à l'échelle du génome du test de l'hémizygote réciproque. Nous l'avons exploitée pour identifier les gènes responsables de la croissance frappante à haute température de la levure Saccharomyces cerevisiae par rapport à son espèce sœur S. paradoxus. RH-seq utilise la mutagénèse transposon pour créer un pool d'hémizygotes réciproques, qui sont ensuite suivis par une compétition à haute température par le séquençage à haut débit. Notre flux de travail RH-seq tel qu'il est présenté ici fournit un moyen rigoureux et impartial de disséquer les caractères anciens et complexes dans le clade de levure en herbe, avec la mise en garde que le séquençage profond à forte intensité de ressources est nécessaire pour assurer une couverture génomique pour la cartographie génétique. Comme les coûts de séquençage baissent, cette approche est très prometteuse pour une utilisation future à travers les eucaryotes.
Introduction
Depuis l'aube du champ, il a été un objectif premier en génétique de comprendre la base mécaniste de la variation entre les individus sauvages. Comme nous cartographions les loci sous-jacents à un trait d'intérêt, les gènes émergents peuvent être d'une utilisation immédiate comme cibles pour le diagnostic et les médicaments, et peuvent faire la lumière sur les principes de l'évolution. La norme de l'industrie à cette fin est de tester une relation entre le génotype et le phénotype à travers une population par le biais de liaison ou d'association1. Aussi puissantes que soient ces approches, elles ont une limitation clé : elles reposent sur de grands panneaux de descendance recombinante provenant de croisements entre individus interfertiles. Ils ne sont d'aucune utilité dans l'étude des espèces qui ne peuvent pas s'accoupler pour former la progéniture en premier lieu. En tant que tel, le champ a eu peu de capacité pour la dissection impartiale des différences de trait entre les espèces isolées sur le volet reproducteur2.
Dans ce travail, nous rapportons les fondements techniques d'une nouvelle méthode, RH-seq3, pour des études à l'échelle du génome de la base génétique de la variation des caractères entre les espèces. Cette approche est une version massivement parallèle du test de l'hémizygote réciproque4,5, qui a d'abord été conçu comme un moyen d'évaluer les effets phénotypiques des différences alléliques entre deux milieux génétiquement distincts à un locus particulier (figure 1A). Dans ce schéma, les deux individus divergents sont d'abord accouplés pour former un hybride, dont la moitié du génome provient de chacun des parents respectifs. Dans cet arrière-plan, plusieurs souches sont générées, chacune contenant une copie interrompue ou supprimée de l'allèle du locus de chaque parent. Ces souches sont hémizygotes puisqu'elles restent diploïdes partout dans le génome, sauf au lieu d'intérêt, où elles sont considérées comme haploïdes, et sont qualifiées de réciproques puisque chacun n'a pas l'allèle d'un seul parent, son allèle restant étant dérivé de la autre parent. En comparant les phénotypes de ces souches réciproques d'hémizygote, on peut conclure si les variantes de séquence séquencédes d'ADN au locus manipulé contribuent au trait d'intérêt, puisque les variantes au locus sont la seule différence génétique entre les souches hemizygote. De cette façon, il est possible de lier les différences génétiques entre les espèces à une différence phénotypique entre elles dans une configuration expérimentale bien contrôlée. Jusqu'à présent, les applications de ce test ont été dans un cadre candidat-gène, c'est-à-dire, les cas dans lesquels l'hypothèse est déjà en main que la variation naturelle à un locus candidat pourrait avoir un impact sur un trait.
Dans ce qui suit, nous énoncons le protocole pour un écran d'hémizygosity réciproque à l'échelle du génome, en utilisant la levure comme un système modèle. Notre méthode crée un complément génomique de mutants hemizygote, en générant des hybrides F1 viables et stériles entre les espèces et en les soumettant à la mutagénèse transposon. Nous regroupez les hémizygotes, mesurons leurs phénotypes dans des analyses basées sur le séquençage et testons les différences de fréquence entre les clones de la piscine portant les allèles des deux parents d'un gène donné. Le résultat est un catalogue de loci à laquelle les variantes entre les espèces influencent le trait d'intérêt. Nous mettons en œuvre le flux de travail RH-seq pour élucider la base génétique des différences de thermotolérance entre deux espèces de levures en herbe, Saccharomyces cerevisiae et S. paradoxus, qui a divergé il y a 5 millions d'années6.
Protocole
1. Préparation du plasmide contenant du piggyBac pour la transformation
- Streak out à des colonies simples de la souche E. coli hébergeant plasmide pJR487 sur une plaque d'agar LB carbenicillin. Incuber pendant 1 nuit à 37 oC ou jusqu'à l'apparition de colonies uniques.
REMARQUE: Une description de la façon dont plasmid pJR487 a été cloné peut être trouvé dans notre travail précédent3. - Inoculer 1 L de LB et de carbenicilline à 100 g/mL avec une seule colonie d'E. coli contenant du pJR487 dans un flacon de verre de 2 L. Cultivez toute la nuit à 37 oC en secouant à 200 tr/min jusqu'à ce qu'ils soient saturés (OD600 et 1,0).
- Purifiez l'ADN plasmide de la culture à l'aide d'un kit de préparation plasmide à grande échelle tel qu'indiqué dans le protocole publié par le fabricant (voir tableau des matériaux pour plus de détails). Éluter l'ADN après une incubation de 10 minutes avec 5 ml de tampon d'élution réchauffé à 37 oC.
- Mesurer la quantité et la qualité de l'ADN plasmide à l'aide d'un spectrophotomètre (voir tableau des matériaux pour plus de détails).
- Répétez les étapes 1,2 à 1,4 jusqu'à ce qu'un total d'au moins 11 mg d'ADN plasmide à un A260:Un rapportde 280 d'au moins 1,8 sont isolés. Cela peut prendre quelques préparations, en fonction de l'efficacité.
- Mélanger toutes les préparations plasmides ensemble dans un seul tube et porter le volume total jusqu'à 20 ml avec tampon d'élution ou de l'eau. Mesurer à nouveau la quantité et la qualité finales à l'égard d'un spectrophotomètre. La concentration de plasmide doit être d'au moins 538 ng/L dans ce volume final de 20 ml. Si la concentration est supérieure à 538 ng/L, diluer le plasmide avec un tampon d'élution ou de l'eau à 538 ng/L. Le plasmide peut être stocké à 4 oC jusqu'à quelques semaines jusqu'à l'utilisation.
2. Création d'un pool d'hémizygotes réciproques non ciblés à l'échelle du génome
- Préparation des cellules de levure hybrides pour la transformation
- Sortir JR507 d'une souche de bouillon de congélation de -80 oC à des colonies simples sur une plaque d'agar yPD. Incuber à 26 oC pendant 2 jours ou jusqu'à l'apparition des colonies.
REMARQUE: JR507 est une souche hybride faite par l'accouplement unicellulaire de spores haploïdes de S. cerevisiae DBVPG1373 et S. paradoxus Z1 (à l'aide d'un microscope tétrade-dissection)3. - Inoculer 100 ml de DPJ liquide dans un flacon de verre de 250 ml avec une seule colonie de JR507 et secouer à 28 oC, 200 tr/min pendant 24 heures, ou jusqu'à ce que la phase stationnaire soit atteinte.
- Le lendemain, mesurer la densité optique à 600 nm (OD600) de la culture du jour au lendemain. Créez une nouvelle culture en diluant une partie de la culture de la nuit avec du YPD liquide frais dans un nouveau flacon de verre de 1 L à un OD600 de 0,2 et un volume de 500 ml.
REMARQUE : Exemple de calcul d'une rétrodilution si la culture du jour au lendemain a un OD600 de 5,0, où C est densité optique et V est volume :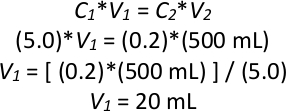
Ainsi, 20 ml de culture saturée de nuit serait ajouté à 480 ml de YPD liquide pour faire un total de 500 ml de culture à un OD600 de 0,2. - Répétez l'étape 2.1.3 trois fois de plus pour faire un total de quatre cultures de 500 ml à un OD600 de 0,2 dans quatre flacons de verre de 1 L, en utilisant la même culture du jour au lendemain pour les quatre nouvelles cultures. Incuber le tout à 28 oC pendant 6 heures (2-3 générations) en secouant à 200 tr/min.
- Combinez deux des cultures de 500 ml pour créer une culture de 1 L. Combinez les deux cultures restantes de 500 ml pour créer une autre culture de 1 L. À ce stade, il ya deux cultures 1 L. Chacune de ces cultures de 1 L sera sujette à transformation avec pJR487 dans les étapes suivantes.
- Sortir JR507 d'une souche de bouillon de congélation de -80 oC à des colonies simples sur une plaque d'agar yPD. Incuber à 26 oC pendant 2 jours ou jusqu'à l'apparition des colonies.
- Transformation du pJR487 en cellules de levure hybrides
- Diviser chacune des cultures de 1 L en vingt-cinq 00m d'aliquots en 20 tubes coniques en plastique pour un total de 40 tubes. Réserver 20 tubes et effectuer les étapes suivantes sur 20 tubes à la fois.
- Centrifuger chacun des vingt tubes pendant 3 min à 1 000 x g pour granuler les cellules de levure. Jetez le supernatant.
- Resuspendre chaque granule avec 25 ml de H2O stérile par vortex. Centrifugeuse de 3 min à 1 000 x g. Jetez le supernatant.
- Resuspendre chaque granule avec 5 ml de 1x TE, 0,1 M de tampon LiOAc par vortexing. Centrifugeuse de 3 min à 1 000 x g. Jetez le supernatant.
- Répétez l'étape 2.2.4. Pendant que les cellules centrifugent, préparez au moins 120 ml d'une solution de 39,52 % de polyéthylène glycol, 0,12 M liOAc et 1,2x tampon Tris-EDTA (12 mM Tris-HCl et 1,2 mM EDTA). Conserver sur la glace.
- Pour préparer l'ADN plasmide pour la transformation, faites bouillir d'abord 4 ml d'ADN de sperme de saumon à 100 oC pendant 5 min et refroidissez-le immédiatement sur la glace pendant 5 min. Ensuite, mélanger 20 ml de pJR487 (obtenu en section 1) à une concentration de 538 ng/L avec les 4 ml d'ADN de sperme de saumon refroidi pour un volume total de 24 ml. Conserver sur la glace jusqu'à utilisation.
- Ajouter 600 l'ADN plasmide mélangé à de l'ADN de sperme de saumon au-dessus de chaque granule de cellule. Ne pas encore se resuspendre.
- Ajouter 3 mL de solution PEG-LiOAc-TE faite à l'étape 2.2.5 à chaque granule. Resuspendre la pastille en faisant monter et descendre et en vortexant.
- Incuber chaque tube pendant 10 min à température ambiante.
- Choc thermique de chaque tube pendant 26 min dans un bain d'eau réglé à 39 oC.
REMARQUE : Toutes les quelques minutes, inverser chaque tube pour empêcher les cellules de se tasser sur le fond du tube. - Centrifuger chaque tube pendant 3 min à 1 000 x g. Jeter le supernatant et resuspendre chaque boulette dans 10 ml de YPD par vortexing. Mélanger les vingt tubes dans un nouveau flacon de verre. Le volume total des cellules devrait être de 200 ml.
- Transférer 66,6 ml de cellules dans un nouveau flacon de verre de 1 L et porter jusqu'à un volume de 500 ml avec du YPD liquide. Répétez deux fois de plus pour utiliser l'ensemble des 200 ml de cellules transformées. Mesurer l'OD600 de chaque nouvelle culture de 500 ml (attendez-vous à un OD600 de 0,35-4).
- Agiter les trois flacons à 28 oC pendant 2 heures pour récupérer (génération 1) à 200 tr/min.
- Ajouter 0,5 ml de 300 mg/mL G418 à chacun des trois flacons, à une concentration finale de 300 g/mL G418 et remettre pour secouer à 28 oC, 200 tr/min.
REMARQUE : Avant cette étape, les cellules hybrides transformées se remettent de la transformation. Lors de l'ajout de G418, la présence du plasmide pJR487 est sélectionnée pour. Toutes les cellules qui n'ont pas pris le plasmide pendant la transformation commenceront à mourir. - Répétez les étapes 2.2.2 -2.2.14 avec les 20 tubes coniques restants des cellules. À ce stade, il devrait y avoir six flacons de verre de 1 L, chacun avec 500 ml de cellules avec G418 ajouté.
- Incuber les six flacons de cellules à 28 oC, en secouant à 200 tr/min, pendant environ 2 jours ou jusqu'à ce qu'un OD600 de 2,3 soit atteint dans chaque flacon. Combinez les six flacons ensemble pour créer une culture unique.
REMARQUE : Bien que toutes les cellules de cette culture ne soient pas utilisées dans les étapes en aval, l'objectif d'utiliser des volumes aussi importants a été de créer autant d'événements de transformation uniques que possible et de normaliser les biais à travers une seule transformation en les mettant en commun tous les ensemble. - Utilisez la culture créée en 2.2.16 pour inoculer deux nouveaux flacons de 1 L avec 500 ml de YPD et G418 (300 g/mL) à un OD600 de 0,2. Il y aura des restes de culture qui pourront être jetés.
- Incuber les deux flacons de 1 L à 28 oC pendant la nuit, en secouant à 200 tr/min, jusqu'à ce que chacun atteigne un OD600 de 2,2 (3,5 générations). Combinez les deux cultures en une seule culture et mesurez à nouveau l'OD600 de la culture combinée.
REMARQUE: À ce stade, la culture devrait être presque entièrement composée de cellules abritant plasmide pJR487. Dans une partie de la population de cellules, le transposon PiggyBac aura été transposé du plasmide dans le génome par la transposase exprimée au large du plasmide. Cependant, l'expression continue de la transposase peut mener à la transposition au cours d'une sélection, qui obscurcirait la relation entre le génotype et le phénotype. Le but des prochaines étapes est d'effectuer une contre-sélection contre la présence du plasmide, pour s'assurer qu'il n'y a plus d'expression de la transposase. Le pool qui en résulte est un mélange de cellules avec ou sans le transposon intégré dans le génome, mais seules les cellules contenant le transposon sont détectées au cours des étapes de cartographie ultérieures. Le temps dans la transformation au cours de laquelle la transposase est exprimée, avant que l'encodage plasmide soit perdu, peut régir la chance qu'un clone donné après la mutagénèse abrite plus d'une insertion de transposon. La fréquence de ces mutations, qui se manifestent sous forme de mutations « secondaires » dans l'analyse d'un gène à la fois, peut être estimée en présentant un nombre défini de colonies après la mutagénèse, puis en combinant leur ADN et en confirmant la séquence le nombre d'insertions indépendantes. positions dans la piscine. - Centrifugeuse 25 ml de cette culture pendant 3 min à 1 000 x g. Calculez le nombre total d'unités oD600 de cellules qui se sitrouvent dans les 25 ml (voir l'exemple de calcul ci-dessous). Jeter le supernatant et resuspendre dans assez de H2O pour créer une suspension cellulaire de 1,85 OD600/mL par vortexing.
REMARQUE : Exemple de calcul pour la suspension des cellules dans l'eau si l'OD600 de la culture combinée était de 2,2 :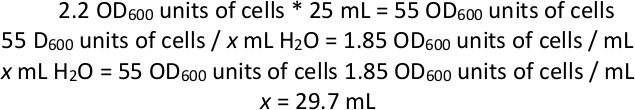
Ainsi, après avoir filé 25 ml de culture cellulaire et jeté le supernatant, ajouter assez de H2O aux cellules pour porter le volume total des cellules et de l'eau jusqu'à 29,7 ml (puisque le granule cellulaire aura également un volume, ajouter moins de 29,7 mL de H2O). - À l'aide de perles de verre, plaque1 ml de cellules en suspension dans l'eau sur chacune des 12 grandes plaques carrées d'agar synthétique complète avec 5-FOA. Incuber chaque assiette à 28 oC pendant 1-2 jours ou jusqu'à ce qu'une pelouse se forme sur l'assiette.
- À l'aide de petits raclettes stériles, gratter les cellules de chacune des 6 plaques et dans un tube avec 35 ml d'eau stérile. Répéter l'opération avec les 6 autres plaques pour un total de deux tubes de cellules et d'eau. Combiner toutes les suspensions cellulaires dans un seul tube. Mesurez l'OD600 de cette suspension, en utilisant l'eau comme un blanc. Porter laconcentration d'OD 600/mL de cellules à 44,4 Unités OD600/mL avec de l'eau. D'après notre expérience, l'efficacité de la transposition (la proportion de cellules KANMD qui sont URA-) est en moyenne de 50%.
- Déterminer le nombre de stocks de congélateurs de -80 oC à stocker. Chaque aliquot peut être utilisé à l'avenir pour une seule expérience.
REMARQUE : Compte tenu du temps de la génération du pool, stockez plusieurs flacons en cas d'abus accidentel ou pour effectuer des expériences de repli. 20-30 stocks sont un nombre raisonnable. - Chaque bouillon de congélation contiendra 40 unités de cellules OD600 dans 1 ml de 10% de DMSO. Ajouter 900 l de cellules à 100 l de DMSO. Répétez l'opération pour le nombre total de stocks de congélateurs créés. Conservez-les à -80 oC pour une utilisation future.
3. Sélection d'hémizygotes réciproques dans un format mis en commun
- Décongeler à partir du congélateur de -80 oC un seul aliquot d'hémizygotes réciproques mis en commun à partir de la section 2 à température ambiante.
REMARQUE : Ne laissez pas l'aliquot s'asseoir longtemps à température ambiante une fois qu'il dégèle, utilisez-le immédiatement. - Utilisez l'aliquot entier de 1 ml pour inoculer 150 ml de YPD liquide dans un flacon de verre de 250 ml. Mesurez l'OD600 de cette culture, puis incuber à 28 oC, en secouant à 200 tr/min, pendant 7 heures, ou jusqu'à ce que la culture ait connu 2 à 3 doubles de population. À ce stade, la culture est prête à être utilisée pour inoculer les cultures en cours de sélection.
REMARQUE : Calcul de l'exemple : Si l'OD600 du flacon original mesure 0,25, incubez la culture jusqu'à ce qu'elle atteigne un OD600 d'au moins 1,0. Si des points d'échantillon sont désirés à "Time-zero" (T-0), comme un moyen d'étudier la population d'hémizygotes avant la sélection, les granulés cellulaires peuvent être prises maintenant en centrifuant 5-10 ml de culture par granule à 1000 x g pendant 3 min, en jetant le supernatant et congélation à -80 oC. - Utilisez la piscine d'hémizygote cultivée pour inoculer les cultures pour la sélection dans un schéma de repli approprié, à la fois à haute température (39 oC) et à température permissive (28 oC). Au minimum, mettre en place trois cultures de sélection de repli biologiques à chaque température, pour un total de six cultures de sélection.
- Créez chaque culture de sélection avec un total de 500 ml dans un flacon de verre de 2 L avec YPD liquide et inoculer à un OD600 de 0,02. Secouez chaque culture de sélection à 100 tr/min à 28 oC ou 39 oC jusqu'à ce que 6 à 7 doubles de population se soient produits (correspondant à un OD600 de 1,28-2,56). Essayez de faire correspondre aussi étroitement que possible l'OD600 final de toutes les cultures de sélection.
REMARQUE : Les cultures de sélection à 28 oC se développeront plus rapidement que les cultures de sélection à 39 oC. Par conséquent, les cultures de sélection à 39 oC passeront plus de temps dans l'incubateur. Procédez aux étapes suivantes avec chaque flacon au fur et à mesure qu'il se prépare, quel que soit le nombre total d'heures passées dans l'incubateur. D'après notre expérience, il a fallu respectivement 12 ou 18 heures pour atteindre une OD de 2,0 ou 39 oC. De longues sélections pourraient avoir l'avantage d'amplifier de petits effets de forme physique, mais aussi permettre de novo mutations de fond de se poser, ce qui introduirait du bruit dans la distribution finale des remises en forme à travers les mutants transposon dans un gène / allèle. En tant que tel, il est important de limiter le temps de sélection dans une expérience RH-seq.
- Créez chaque culture de sélection avec un total de 500 ml dans un flacon de verre de 2 L avec YPD liquide et inoculer à un OD600 de 0,02. Secouez chaque culture de sélection à 100 tr/min à 28 oC ou 39 oC jusqu'à ce que 6 à 7 doubles de population se soient produits (correspondant à un OD600 de 1,28-2,56). Essayez de faire correspondre aussi étroitement que possible l'OD600 final de toutes les cultures de sélection.
- Récoltez les granulés de cellules de chaque culture de sélection. Calculer le volume requis pour obtenir 7 unités OD600 de cellules et de centrifugeuses à 1 000 x g pendant 3 min au moins quatre granulés de ce volume de chaque culture de sélection comme répliques techniques pour la préparation et le séquençage de la bibliothèque (voir les sections 4 et 5 , ci-dessous). Jeter le supernatant et le conserver à -80 oC.
REMARQUE : Exemple si un flacon de sélection a un OD600 final de 2.0 :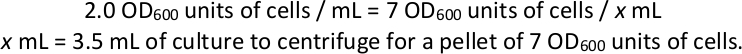
4. Construction de la bibliothèque Tn-seq et séquençage de l'illumina pour déterminer l'abondance des hémizygotes mutants transposon
- Décongeler sur la glace chaque granule cellulaire de la section 3 qui va être séquencé.
- Isolez l'ADN génomique total (ADNc) de chaque granule de cellule à l'aide d'un kit de purification de l'ADNg de levure suivant les instructions du fabricant. Resuspendre l'ADN dans 50 l de tampon d'élution réchauffé à 65 oC.
- Quantifier la quantité d'ADNc de chaque granule à l'aide d'un fluorimètre. La quantité totale minimale d'ADNc requise pour chaque granule de cellule pour créer une bibliothèque de séquençage de nouvelle génération (NGS) pour Tn-seq en utilisant la procédure suivante est de 1 g.
REMARQUE : Moins d'un g d'Adn g peut être utilisé pour créer une bibliothèque, mais la quantité et la qualité finales de la bibliothèque en souffriront. - Suivez un protocole établi pour la création des bibliothèques Tn-seq7. Notez les informations pertinentes suivantes qui sont uniques à ce protocole :
- Après le cisaillement de gDNA, la réparation de fin et la ligature d'adaptateur, amplifiez le gDNA contenant le transposon par l'intermédiaire de PCR. Pour ce PCR, utilisez l'amorce avant et inverse suivante, qui sont spécifiques pour les adaptateurs de transposon PiggyBac et NGS, respectivement :
En avant (N - nucléotide aléatoire)
5e ATGATACGGCGACCGAGATCTACACTTTTCCCTACACGACG
CTCTTCCGATCTNNNNNAGCAATTTCAAGAATGCATGCGTCAAT 3'
Revers (le tronçon de Ns représente un indice unique de 6 pb utilisé pour le multiplexage. Voir ci-dessous pour plus d'informations sur les indices)
5' CAAGCAGAAGACGGCATACGAGATNNNNNNNGTGACTGGAGTCAG
ACGTGTGCTCTTCCGATCT 3' - Utilisez les étapes de nettoyage incluses avec des perles de taille sélective pour minimiser la proportion de fragments clonés dans la bibliothèque finale qui serait trop court pour inclure la séquence génomique mappable.
REMARQUE : Après avoir suivi les exigences minimales de repli jusqu'à présent pour les cultures de sélection, il y aura 24 échantillons individuels de gDNA pour le séquençage. Étant donné le coût actuel du séquençage, il est peu probable que chaque échantillon soit exécuté seul. Pour combiner des échantillons sur la même voie, créez plusieurs amorces inversées, chacune avec un index de paire s'est zonale de 6 bases. Les échantillons avec des index différents peuvent être combinés dans la même voie de séquençage et séparés par voie computationnelle par la suite.
- Après le cisaillement de gDNA, la réparation de fin et la ligature d'adaptateur, amplifiez le gDNA contenant le transposon par l'intermédiaire de PCR. Pour ce PCR, utilisez l'amorce avant et inverse suivante, qui sont spécifiques pour les adaptateurs de transposon PiggyBac et NGS, respectivement :
- Séquence unique 150 bp lit de chaque bibliothèque en utilisant les technologies NGS sur huit voies.
REMARQUE : La quantité de lectures de séquençage requise dépend fortement de la qualité des bibliothèques préparées à l'étape précédente (c.-à-d. la proportion d'ADN dans la bibliothèque contenant réellement de l'ADN transposon, représentant l'ADN provenant d'hémizygotes réciproques). Deux facteurs principaux y contribuent. Tout d'abord, puisque les cellules sans transposon intégré ne sont pas contre-sélectionnées lors de la création de piscine, chaque culture sera un mélange de cellules avec et sans le transposon. Deuxièmement, même dans les génomes des hémizygotes réciproques contenant des transposons, la majeure partie du génome n'est pas transposon contenant la séquence, et cette gDNA fera inévitablement partie de la préparation de la bibliothèque. L'objectif de l'amplification finale de PCR de l'ADN transposon-contenant est d'augmenter le rapport de transposon-contenant l'ADN à ces deux sources de gDNA de fond. Plus cette amplification est efficace, plus la proportion de lectures sera utilisée dans l'analyse en aval. Plus les bibliothèques sont de qualité inférieure, plus le séquençage devra être fait, car une proportion croissante de lectures ne contiendra pas d'ADN transposon et ne sera pas utile. Compte tenu des contraintes susmentionnées, huit voies de séquençage étaient capables de suivre les abondances réciproques d'hémizygotes à un degré raisonnable. Un séquençage plus approfondi permettrait une analyse plus approfondie.
5. Cartographie rinceliser les emplacements des insertions de transposon et l'analyse RH-seq
REMARQUE : L'analyse de données suivante a été réalisée avec des scripts Python personnalisés (trouvés en ligne à https://github.com/weiss19/rh-seq), mais pourrait être refait en utilisant d'autres langages de script. Ci-dessous, les principales étapes du processus sont décrites. Effectuez les étapes suivantes sur chaque fichier de lecture de répétition individuel à moins qu'il ne soit noté de les combiner.
- Couper les séquences d'adaptateur hors des lectures et séparer les lectures de chaque réplique en fonction de l'index.
- Trouvez des lectures contenant des jonctions transposon-génome. Pour ce faire, recherchez dans chacun l'une des 20 dernières paires de base du transposon, CAGACTATCTTTCTAGGGTTATTAA. Jetez toutes les lectures ne contenant pas cette séquence.
REMARQUE : D'après notre expérience, la proportion de lectures de cartographie jusqu'à la fin du transposon est de 83 à 95 %. - Coupez les lectures restantes contenant des transposons pour ne contenir que la séquence en aval de l'extrémité 3' du transposon. En cartographiant cette séquence au génome de la levure, déterminez le contexte génomique de l'insertion du transposon pour chaque lecture (étape 5.4 ci-dessous).
- Utilisez BLAT ou un outil de cartographie équivalent pour cartographier la séquence en aval du transposon jusqu'au génome hybride S. cerevisiae DBVPG1373 x S. paradoxus Z1 (nom du script : map-and-pool-BLAT.py).
- Jetez toutes les lectures pour lesquelles il y a moins de 50 paires de base de séquence utilisable en aval de 3' extrémité du transposon. Les séquences courtes sont difficiles à cartographier de façon unique.
- Si vous utilisez BLAT, utilisez les paramètres suivants : identité 95, taille de la tuile 12.
- Créer un génome hybride de base à utiliser pour la cartographie en concatéentant les dernières versions des génomes de référence de S. cerevisiae S288c et S. paradoxus CBS432.
REMARQUE : Un fichier d'annotation de base décrivant les limites génomiques des gènes individuels à travers le génome hybride peut être trouvé au dépôt Github énuméré ci-dessus (Nom de fichier : YS2-CBS432-plasmid-clean). L'utilisation de l'utilisation de la carte à un seul endroit dans le génome hybride (c.-à-d. sont uniques à S. cerevisiae ou S. paradoxus). On s'attend à une fréquence uniforme des événements d'insertion à travers le génome ; la distribution des positions d'insertion à travers les génomes est rapportée ailleurs3.
- Tally le nombre total de lectures de cartographie à chaque emplacement d'insertion transposon unique, que nous déduisons tous provenaient de cellules d'un clone mutant d'insertion transposon unique. La somme de toutes ces valeurs provenant d'une seule bibliothèque est appelée le nombre total de lectures cartographiées pour cette bibliothèque.
- Dans les cas où il ya plusieurs insertions de cartographie dans 3 paires de base de l'autre, les combiner tous à un seul point d'insertion, l'attribution de toutes les lectures à l'emplacement unique avec le plus grand nombre de lecture. Cette valeur, ninsert, représente l'abondance de ce clone d'insertion dans le granule cellulaire à partir de laquelle gDNA a été séquencé. À ce stade, il y aura des listes de ninsérer, chacun l'abondance d'une insertion transposon cartographiée unique, une liste pour chaque cellule granule séquencé.
REMARQUE : Le transposon PiggyBac s'insère dans les séquences TTAA dans le génome, une séquence de 4 paires de base. Ainsi, nous en déduisons que la cartographie des insertions dans 3 paires de base les unes des autres doit provenir du même site TTAA. - Étant donné qu'il y aura un nombre légèrement différent de lectures totales provenant de chaque bibliothèque séquentielle, normalisez les valeurs d'insertion n dans tous les fichiers si elles doivent être comparées. Faites-le en pigulant le nombre total de lectures cartographiées de chaque bibliothèque individuelle, ngranule, et prendre la moyenne de tous lesn granules dans toutes les bibliothèques, 'lt;ngranule'gt;. Multipliez chaqueinsère n dans les données d'une bibliothèque individuelle par le rapport de 'lt;ngranule'gt; / ngranule pour calculer uninsert, l'abondance normalisée d'un clone d'insertion transposon donné.
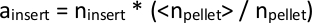
Alternativement, la taille de la bibliothèque peut être estimée à l'aide d'outils disponibles comme DESeq28 (nom du script : total-reads-and-normalize.py). - Tabulate l'ensemble de toutes les insertions cartographiées dans toutes les bibliothèques. Pour les insertions trouvées dans certaines bibliothèques, mais pas dans d'autres, définir unencart 1 pour les calculs en aval.
- Filtrer les lectures pour trouver les insertions qui entrent dans les gènes selon le fichier d'annotation (Nom du script: remove-NC-and-plasmid-inserts.py).
- Pour chaque insertion unique, calculez l'abondance moyenne à travers les répliques techniques de chaque sélection (chaque culture à 28 'C ou 39 'C), 'lt;ainsert'gt; technique (Nomdu script: combine-tech-reps'V2.py).
- Pour chaque insertion unique, calculer l'abondance moyenne à travers les répliques biologiques de chaque température, lt;ainsert'gt;total, en prenant la moyenne de tous les 'lt;ainsérer'gt;technique à chaque température. Dans le même temps, calculer le coefficient de variation pour chaque insertion,insertion CV,total à travers l'insert 'lt;a 'gt;technique (Nom du script: combine-bio-reps.py).
REMARQUE : À ce stade, pour chaque température, 28 oC et 39 oC, il y a une liste d'insertions de transposon uniques, leur abondance moyenne et le coefficient de variation entre les répliques biologiques pour chacune d'elles. Ces données pour notre expérience sont rapportées ailleurs3. - Filtrer la liste de toutes les insertions pour ceux qui ont, à 28 ou 39 c, lt;ainsert'gt;total 'gt; 1.1, et CVinsert,total 1.5 (Nom de script: filter inserts.py).
- Pour chaque insertion unique, calculez le journal2(lt;ainsert'gt;total,28 'C / 'lt;ainsert'gt;total,39 'C). Cette valeur représente la « thermotolérance » d'un clone mutant d'insertion de transposon donné (Nom de script : fitness-ratios.py).
- Trier toutes les insertions uniques par gène et par allèle(S. cerevisiae ou S. paradoxus), et compiler le nombre d'insertions dans chaque allèle. Filtrer les gènes de sorte que seuls les gènes qui ont au moins 5 insertions dans chaque allele sont analysés (Nom du script: organize-and-filter-genes.py).
REMARQUE : De multiples insertions uniques dans chaque allet permettent une mesure plus précise de la thermotolérance de cet hémizygote réciproque. Il est possible de réduire le nombre d'insertions requises par allèle, mais cela compromettra l'exactitude de cette mesure et augmentera la charge de test multiple en permettant à plus de gènes d'être testés. En outre, le filtrage des gènes avec trop peu d'insertions par allèle aidera à réduire l'impact sur les résultats des tests de tout clone hémizygote individuel hébergeant une mutation du site secondaire qui confère un phénotype très disparate. - Pour chaque gène restant dans l'ensemble de données après le filtrage ci-dessus, comparez les thermotolérances (rapports de journal 2) de toutes les insertions dans l'allèle S. cerevisiae à ceux de l'allèle S. paradoxus à l'aide d'un test Mann-Whitney U. Alternativement, un modèle de régression pourrait être mis en œuvre, adapté de DESeq28 (Nom de script: mann-whitney-u.py).
- Corriger lesvaleurs p-pour les tests multiples à l'aide de la méthode Benjamini-Hochberg.
- Les gènes ayant des valeurs p-valeurs significatives (disons 0,01) sont des candidats pour des gènes importants pour les différences de thermotolérance entre les deux espèces.
Résultats
Nous avons accouplé S. cerevisiae et S. paradoxus pour former un hybride stérile, que nous avons soumis à la mutagénèse transposon. Chaque clone mutagénaire était un hémizygote, un hybride diploïde dans lequel un allèle d'un gène est perturbé (Figure 1A, Figure 2). Nous avons rivalisé les hemizygotes les uns contre les autres par la croissance à 39 oC et, dans une expérience distincte comme un contrôle, à 28 oC...
Discussion
Les avantages de RH-seq par rapport aux méthodes statistiques-génétiques précédentes sont plusieurs fois. Contrairement à l'analyse des liens et des associations, RH-seq offre une résolution de cartographie monogène; en tant que tel, il sera probablement d'une utilité significative, même dans les études de la variation des traits entre les individus d'une espèce donnée, ainsi que des différences interspécifiques. En outre, les tentatives précédentes à l'analyse réciproque de l'hémizygosité à l'éche...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous remercions J. Roop, R. Hackley, I. Grigoriev, A. Arkin et J. Skerker pour leur contribution à l'étude originale, F. AlZaben, A. Flury, G. Geiselman, J. Hong, J. Kim, M. Maurer et L. Oltrogge pour l'assistance technique, D. Savage pour sa générosité avec la microscopie et B. Blackman, S. Coradetti, A. Flamholz, V. Guacci, D. Koshland, C. Nelson et A. Sasikumar pour les discussions; nous remercions également J. Dueber (Department of Bioengineering, UC Berkeley) pour le plasmide PiggyBac. Ces travaux ont été soutenus par R01 GM120430-A1 et par le projet de séquençage communautaire 1460 à RBB au U.S. Department of Energy Joint Genome Institute, un bureau du DOE de l'installation des utilisateurs des sciences. Les travaux menés par ce dernier ont été appuyés par le Bureau des sciences du département de l'Énergie des États-Unis en vertu du contrat no. DE-AC02-05CH11231.
matériels
| Name | Company | Catalog Number | Comments |
| 1-2 plasmid Gigaprep kits | Zymo Research | D4204 | The number of kits required depends on how efficient your preps are in each kit. This kit comes with 5 individual plasmid prep columns. Run 1 L of saturated E. coli culture through each prep column, as using more than 1 L per column can cause clogging of the prep filter, leading to low yield and poor quality DNA. |
| 10X Tris-EDTA (TE) buffer (100 mM Tris-HCl and 10 mM EDTA) | Any | N/A | Filter sterilize through a 0.22 μm filter before use. |
| 1M LiOAc | Any | N/A | Filter sterilize through a 0.22 μm filter before use. |
| 300 mg/mL Geneticin (G418) | Gibco | 11811023 | |
| 52% polyethylene glycol (PEG) 3350 | Sigma | 1546547 | Dissolve in water and filter sterilize through a 0.22 μm filter before use. 1X trafo mix: 228 uL 52% PEG, 36 uL 1M LiOAc, 36 uL 10X TE buffer |
| Autoclaved LB liquid broth | BD Difco | 244620 | Make LB liquid broth using your powder from any brand, and milliQ water. Autoclave it before use. |
| Carbenicillin stock in water (100 mg/mL) | Any | N/A | Filter sterilize through a 0.22 μm filter before use. |
| Complete synthetic agar plates (24.1cm x 24.1cm) with 5-fluoroorotic acid (5-FOA) [0.2% drop-out amino acid mix without uracil or yeast nitrogen base (YNB), 0.005% uracil , 2% D-glucose, 0.67% YNB without amino acids, 0.075% 5-FOA] | 5-FOA: Zymo Research, Drop-out mix: US Biological, Uracil: Sigma, D-glucose: Sigm), YNB: Difco | 5-FOA: F9001-5, Drop-out mix: D9535, Uracil: U0750, D-glucose: G8270, YNB: DF0919 | |
| DMSO | Any | N/A | |
| E. coli strain carrying pJR487 (CEN-/ARS+ piggyBac-containing plasmid) | N/A | N/A | Request from Brem lab. |
| Hybrid yeast strain JR507 (S. cerevisiae DBVPG1373 x S. paradoxus Z1, URA-/URA-) | N/A | N/A | Request from Brem lab. |
| Illumina Hiseq 2500 | used for SE-150 reads | ||
| Large shaking incubators with variable temperature settings | Any | N/A | |
| LB + carbenicillin agar plates (100 μg/mL) | Agar: BD Difco | Agar: 214010 | Make LB agar plates as normal and add carbenicillin to 100 μg/mL before drying. |
| Nanodrop spectrophotometer | Thermo Scientific | ND-2000 | |
| Qubit Fluorimeter | Thermo Scientific | Q33240 | |
| Salmon sperm DNA | Invitrogen | 15632011 | |
| Water bath at 39°C | Any | N/A | |
| Yeast fungal gDNA prep kit | Zymo Research | D6005 | |
| Yeast peptone dextrose (YPD) liquid media | BD Difco | Peptone: 211677, Yeast Extract: 212750 | Add filter-sterilized D-glucose to 2% after autoclaving. |
| YPD + G418 agar plates (300 μg/mL) | Agar: BD Difco | Agar: 214010 | Make YPD agar plates as normal and add G418 to 300 μg/mL before drying. |
| YPD agar plates | Agar: BD Difco | Agar: 214010 |
Références
- Flint, J., Mott, R. Finding the molecular basis of quantitative traits: successes and pitfalls. Nature Reviews Genetics. 2, 437-445 (2001).
- Allen Orr, H. The genetics of species differences. Trends in Ecology and Evolution. 16, 343-350 (2001).
- Weiss, C. V., et al. Genetic dissection of interspecific differences in yeast thermotolerance. Nature Genetics. 50, 1501-1504 (2018).
- Stern, D. L. Identification of loci that cause phenotypic variation in diverse species with the reciprocal hemizygosity test. Trends in Genetics. 30, 547-554 (2014).
- Steinmetz, L. M., et al. Dissecting the architecture of a quantitative trait locus in yeast. Nature. 416, 326-330 (2002).
- Scannell, D. R., et al. The Awesome Power of Yeast Evolutionary Genetics: New Genome Sequences and Strain Resources for the Saccharomyces sensu stricto Genus. G3 (Bethesda). 1, 11-25 (2011).
- Wetmore, K. M., et al. Rapid quantification of mutant fitness in diverse bacteria by sequencing randomly bar-coded transposons. MBio. 6, e00306-e00315 (2015).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15, 550 (2014).
- Wilkening, S., et al. An evaluation of high-throughput approaches to QTL mapping in Saccharomyces cerevisiae. Genetics. 196, 853-865 (2014).
- Kim, H. S., Huh, J., Riles, L., Reyes, A., Fay, J. C. A noncomplementation screen for quantitative trait alleles in saccharomyces cerevisiae. G3 (Bethesda). 2, 753-760 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon