Method Article
Utilisation des données d'imagerie par résonance magnétique et de biopsie pour orienter les procédures d'échantillonnage pour la biobanque du cancer de la prostate
Dans cet article
Résumé
Cette méthode implique l'utilisation de données diagnostiques cliniques pour les patients atteints de cancer de la prostate afin de guider les procédures d'échantillonnage, lorsque le tissu biobancaire suivant la prostatectomie radicale. Cela permet de surmonter les problèmes avec des méthodes publiées précédemment autour de l'efficacité et la disponibilité de tissus frais pour un plus large éventail d'applications en aval.
Résumé
Les méthodes précédentes pour le tissu de prostate de biobanking, suivant la prostatectomy radicale, ont généralement impliqué l'échantillonnage aléatoire. Afin d'augmenter l'efficacité, et de permettre une plus grande gamme d'applications en aval, une méthode plus ciblée d'échantillonnage du tissu prostatique a été développée. Ici, nous utilisons à la fois l'imagerie par résonance magnétique (IRM) et les données de biopsie pour cibler des zones spécifiques de l'organe pour l'échantillonnage. La méthode consiste à utiliser un dispositif de découpe de la prostate précédemment publié qui enlève une tranche transversale de 5 mm d'une région prédéterminée de la prostate, suivie par l'élimination des biopsies de poinçon de 6 mm des zones prédéterminées de cette tranche. Ces échantillons peuvent être stockés congelés ou fixés à des fins biobancaires, ou utilisés frais immédiatement avec 70% de confiance de la teneur en tumeur, par rapport à 10% de confiance de l'approche d'échantillonnage aléatoire. Cela permet l'utilisation de toutes les techniques standard en aval telles que la génomique, la protéomique ou le travail histologique, mais aussi le travail qui nécessite des tissus frais tels que l'imagerie tissulaire vivante ou la culture ex vivo.
Introduction
L'accès à des tissus humains de haute qualité contre le cancer de la prostate est une condition essentielle pour stimuler une recherche efficace dans le domaine. Il existe un certain nombre de méthodes existantes pour échantillonner le tissu de prostate suivant la prostatectomie radicale pour la recherche. En général, il s'agit d'utiliser des biopsies de poinçon pour prélever des échantillons aléatoires à partir d'une tranche fraîche, congelée ou fixe de tissu de la prostate, et de confirmer rétrospectivement si la tumeur est présente dans chaque échantillon par l'hématoxyline et l'éosine (H et E) tel qu'évalué par un uropathologiste1,2,3,4,5. Un examen récent a compilé un aperçu de ces méthodes existantes6. Ces méthodes sont utiles pour certaines applications en aval, où les tissus peuvent être stockés et évalués pour le contenu tumoral à une date ultérieure, tels que des analyses génomiques à grande échelle comme l'International Cancer Genome Consortium (ICGC) et The Cancer Genome Atlas (TCGA) 4,7. Cependant, ces méthodes pourraient être améliorées dans si nous devions employer l'imagerie par résonance magnétique (MRI) et/ou des données de biopsie pour cibler des secteurs spécifiques de la prostate pour l'échantillonnage. Cela améliorerait la méthodologie de deux façons; d'une part, en réduisant le nombre d'échantillons de tissus prélevés, en augmentant l'efficacité et en réduisant la pression sur les services de pathologie et le coût de stockage, et d'autre part, en permettant l'utilisation immédiate de tissus frais sans qu'il soit nécessaire de confirmer immédiatement contenu de tumeur, pour de nouvelles technologies en aval de l'état de l'art telles que l'imagerie de tissu vivant, la génération d'organoïdes ou la culture ex vivo. Ce besoin de recherche a conduit au développement de la méthode PEOPLE (PatiEnt prOstate samPLes for rEsearch), et les résultats des 84 premiers cas biobancaires à l'aide de PEOPLE ont été récemment publiés8. Une variante de cette méthode a également été publiée avec un appareil de découpe imprimé en trois dimensions (3D) et un moule spécifique au patient, afin de faciliter l'IRM ex vivo sur le tissu pré- et post-fixation9,10.
Protocole
Le protocole respecte les lignes directrices locales et est approuvé par le Comité d'éthique de la recherche biobancaire de l'UCL/UCLC (référence 15/YH/0311).
REMARQUE: Comme cette méthode implique l'échantillonnage des tissus humains, toutes les procédures locales concernant l'éthique et le consentement doivent être observées avant le début du protocole. Des cas radicaux de prostatectomie peuvent être inclus si les données de MRI et de biopsie sont disponibles avant la chirurgie, avec le diamètre de tumeur 5 mm. Les cas devraient être exclus si la lésion d'index n'est pas bien définie, c.-à-d., seulement des changements diffus sont visibles par MRI.
1. Appareil de découpage de prostate
- Acheter l'appareil de découpe de la prostate (Tableau des matériaux). Alternativement, imprimez une poignée de lame à l'aide d'une imprimante 3D comme précédemment publié10.
REMARQUE: L'appareil et les lames jetables utilisés ici ont été achetés en vertu d'un accord de transfert de matériel de l'Institute of Cancer Research, Londres, Royaume-Uni.
2. Ciblage tumoral
- Examiner les notes cliniques pour identifier la lésion de l'indice telle qu'indiquée par biopsie diagnostique, par exemple, postérieure gauche.
- Passez en revue des images de MRI pour mesurer l'emplacement de la tumeur ci-dessus.
- Trouvez la séquence où la tumeur est la plus visible dans le plan axial, par exemple, pondérée par T2.
- Faites défiler les images axiales pour trouver l'image où la tumeur est la plus grande et imprimez l'image pour référence.
- Dans l'image coronale correspondante, mesurez la distance entre la base de la prostate et la position axiale sélectionnée, et toute la longueur de la prostate de l'apex à la base (mm), et imprimez pour référence.
3. Collection de pProstate
- Vérifiez les notes des patients pour s'assurer qu'un consentement éclairé approprié a été obtenu pour cette procédure et pour toute demande de recherche en aval.
- Après la prostatectomie radicale, recueillir la prostate dans un pot sec. Assurez-vous qu'aucun formalin ou autre fixatif n'a été ajouté à la prostate.
- Transférer dans un endroit stérile approprié pour l'échantillonnage, par exemple, une hotte à débit laminaire dans un laboratoire de pathologie.
- Procéder à l'échantillonnage dès que possible si des tissus frais sont nécessaires.
REMARQUE: Pour certaines applications (p. ex., évaluation de l'ADN qui ne devrait pas se dégrader aussi rapidement que l'ARN), il peut être approprié de réfrigérer le spécimen et de prélever des échantillons le lendemain.
4. Préparation des spécimens
- Préparer le capot d'écoulement laminaire et l'appareil de découpage de prostate selon des procédures locales de décontamination, utilisant la technique stérile. Ici, vaporisez 70% d'éthanol et essuyez sur toutes les surfaces. Utilisez des aiguilles et des scalpels stériles à usage unique. Utilisez des lames de trancheur jusqu'à trois fois; laver après chaque utilisation dans de l'eau chaude savonneuse, puis vaporiser et essuyer avec 70% d'éthanol.
- Peser la prostate (g) à l'aide d'une balance standard.
- Encre la prostate. Peignez le côté gauche avec de l'encre bleue et le côté droit avec de l'encre noire. Couvrez la capsule complète et les vésicules séminales avec de l'encre pour dénoter plus tard les marges chirurgicales.
REMARQUE: Les procédures d'encrage peuvent varier localement et peuvent être modifiées en conséquence.
5. Découpage de la prostate
- Assembler l'appareil de tranchage en insérant les murs perpendiculairement dans la base du support (Figure 1A).
- Placez la prostate de sorte que la base et le sommet soient orientés vers les murs opposés, avec le côté postérieur vers le bas et antérieur vers le haut. Placez des épingles d'or autour de la prostate. Poussez légèrement la prostate vers l'intérieur si nécessaire pour obtenir un ajustement serré, qui soutiendra la prostate pendant le découpage.
- Mesurer la longueur de la prostate de la base à l'apex, à l'aide d'une règle, et comparer avec la longueur de la prostate mesurée par IRM. Si la prostate a rétréci, appliquez une correction ad hoc à la distance prévue de la tranche transversale de base à la tranche transversale cible. Par exemple, si la longueur complète de la prostate dans l'image IRM est de 50 mm, mais lorsqu'il est mesuré avec une règle à ce stade, il a rétréci à 45 mm, réduire la position de tranchage prévue de 10%.
- Mesurer de la base à la tranche transversale désirée. Choisissez la broche qui se trouve le plus près de cette mesure pour trancher autour.
- Porter des gants de chaîne pour prévenir les blessures, tenir le dispositif de découpe (Figure 1B), placer les lames de chaque côté de la broche identifiée et utiliser l'espaceur pour garder les lames à 5 mm d'intervalle. Prendre la tranche en déplaçant lentement et fermement les lames vers le bas, vers l'avant et vers l'arrière avec de longs traits (Figure 1C). Assurez-vous qu'une tranche complète a été séparée avant le démontage de l'appareil.
- Retirez les murs et les épingles et retirez soigneusement la tranche sur une feuille stérile de planche de liège à l'aide de gants.
6. Échantillonnage de tissus
- Inspectez visuellement la tranche transversale et comparez-la à l'image irm axiale. Dans certains cas, la région tumorale peut sembler plus pâle que le tissu environnant.
- Palpate la tranche transversale doucement. Dans certains cas, la tumeur peut se sentir plus ferme que le tissu environnant.
- En utilisant l'image IRM axiale comme guide, sélectionnez une ou plusieurs zones à échantillonner.
-
Prenez les poinçons de biopsie de la zone désirée du tissu.
- À l'aide d'un poinçon de 6 mm, appuyez sur la zone désirée du tissu.
- Tournez le poinçon de tissu sur place et vers le bas contre le bouchon pour assurer la séparation complète et utilisez un scalpel pointu pour séparer si nécessaire.
- Retirez le poinçon et placez-le dans des tubes/moules au besoin en éjectant à l'aide du piston.
- Répétez pour d'autres échantillons de tumeur et bénins au besoin, avec des poinçons stéroïdes séparés de biopsie. Encrez les trous où les poinçons étaient pris en rouge.
- Notez l'emplacement de chaque poinçon avec le poids de la prostate et toutes les observations sur la couleur des tissus / fermeté.
7. Soumission de la prostate pour les diagnostics locaux
- Épingler la prostate en liège avec des aiguilles stériles à usage unique avant la fixation afin d'empêcher le rétrécissement et la déformation des tissus, ce qui pourrait altérer l'apparence des marges chirurgicales.
- Après l'épinglage au liège, soumettez la prostate au département d'histopathologie pour le diagnostic clinique standard.
8. Décontamination de l'Apparatus
- Jetez tout l'équipement jetable dans les flux de déchets biomédicaux et/ou les contenants de pointes désignés localement.
- Décontaminer le capuchon à débit laminaire et l'appareil de découpage de la prostate conformément aux évaluations locales des risques appropriées aux tissus humains (p. ex., en pulvérisant avec 70 % d'EtOH et en essuyant).
Résultats
Le tissu prostatefrais échantillonné à l'aide de la méthode PEOPLE peut être utilisé pour une variété de techniques en aval, y compris le séquençage génomique et la culture ex vivo. Les 59 premiers cas échantillonnés à l'aide de cette méthode ont déjà été publiés en comparaison avec une version antérieure de la méthode, ainsi que les données initiales en aval8. Le temps de la première tranche de la prostate à la congélation / fixation des biopsies de poinçon ici était d'environ 1 min, qui a été maintenu à un minimum pour éviter la dégradation de l'ARN. Le temps de l'ablation de la prostate au découpage de prostate devrait également être maintenu à un minimum, bien qu'ici ceci ait pris approximativement 20 min dû à nos laboratoires de théâtre et de pathologie étant dans différents endroits.
Selon l'application en aval, généralement au moins deux échantillons sont prélevés : un d'une zone de tissu tumoral prévu et un d'une zone de tissu bénin prévu. La mesure clé du succès pour la méthode d'échantillonnage elle-même est d'évaluer le contenu tumoral dans un échantillon donné.
Pour l'entrée dans le projet de 100 000 génomes, une section de tissus tachés de H et E doit être évaluée par un uropathologiste, et l'échantillon doit contenir au moins 40 % de cellules tumorales. Les échantillons qui contiennent moins de 40% de tumeur peuvent encore être inclus dans le projet s'ils sont macrodissés avec succès. Sur les 92 premiers cas échantillonnés de cette manière, 64% contenaient au moins 40% de tumeur et ont été soumis au projet 100.000 génomes sans macrodissection. L'ADN a été extrait et était de rendement et de qualité suffisants dans tous les cas (tableau 1). Un premier sous-ensemble de 59 de ces échantillons a déjà été publié en comparaison avec une méthode antérieure8.
Pour la culture ex vivo, la tumeur assortie et le tissu bénin doivent être de qualité suffisante pour résister à la culture de 72 h sans dégradation significative. Des échantillons multiples de tissu d'un total de trois patients ont été cultivés avec succès8.
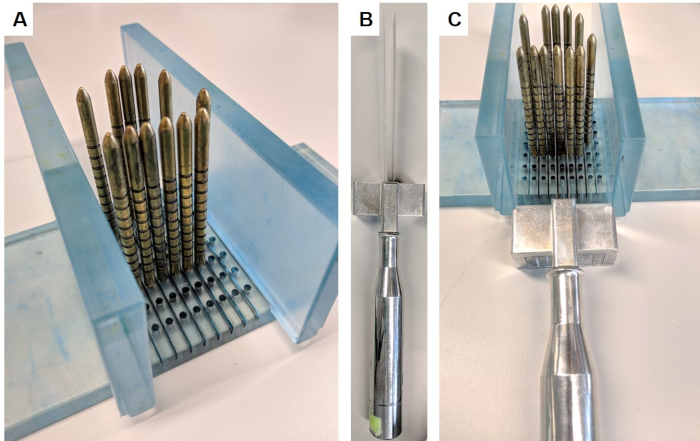
Figure 1 : Appareil de découpe de la prostate. Cet appareil a été obtenu en vertu d'un accord de transfert de matériel de l'Institut de recherche sur le cancer. (A) Les murs sont insérés perpendiculairement à la base, et des broches d'or sont insérées dans la base entourant la prostate (prostate non illustrée). (B) Les lames parallèles remplaçables sont insérées dans la poignée de la lame. (C) Les lames passent entre les broches d'or afin de trancher une section de 5 mm de la prostate. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| n (%) | |
| Hit (tumeur de 40%) | 59 (64%) |
| Coup partiel (5-30% tumeur) | 6 (7%) |
| Miss (0% tumeur) | 27 (29%) |
| total | 92 (100%) |
Tableau 1 : Taux de réussite tumorale. Le taux de traitement des tumeurs a été déterminé par un pathologiste consultant spécialisé dans le cancer de la prostate, à la suite de l'examen des tissus tachés de H et E. La teneur en cellules tumorales de 40 % a été jugée appropriée pour être incluse dans le projet 100 000 génomes, conformément aux lignes directrices de Genomics England.
Discussion
Les étapes critiques dans ce protocole incluent l'identification de la région de tumeur pour l'échantillonnage, la mesure de la prostate, et l'échantillonnage de tissu. Tout d'abord, la mesure de l'IRM pour identifier la zone correcte de l'échantillonnage est essentielle. Nous démontrons cette méthode dans la vidéo d'accompagnement; cependant, nous recommandons également de confirmer des mesures avec un radiologiste dans un premier temps. Des notes cliniques claires qui pointent le chercheur vers la zone des images D'IRM qui contient la lésion d'index sont idéales. Deuxièmement, la mesure de la prostate doit être effectuée avec soin, en veillant à ce que la règle est tenue à un angle pour mesurer toute la longueur de la base à l'apex, parallèle à l'antérieur de la prostate. Troisièmement, les zones tumorales doivent être confirmées avant l'échantillonnage en inspectant visuellement la tranche de tissu par rapport à l'image originale de l'IRM, en palpant le tissu (dans certains cas, la zone tumorale peut se sentir plus dense), et en évaluant visuellement la couleur du tissu (dans certains les cas la tumeur sembleront plus pâles que le tissu bénin environnant).
Ce protocole a été réalisé en entier à l'UCL/UCLH par des chercheurs postdoctoraux non cliniques, un boursier en pathologie, des consultants en pathologie et des techniciens de recherche. D'après notre expérience, toutes les étapes du protocole peuvent être apprises dans moins de dix cas, indépendamment de leur bagage technique. Cependant, nous recommandons la formation d'un radiologiste concernant la mesure de MRI et la formation d'un pathologiste concernant le tranchage dans le premier cas. Le protocole peut être modifié en utilisant une poignée imprimée en 3D, comme précédemment publié10.
Les limites potentielles de la technique incluent le risque d'entraver le diagnostic. Le découpage de la prostate est une étape clé, qui pourrait entraver le classement ou les taux de marge positifs si elle est mal faite. Il y a deux problèmes potentiels ici. Tout d'abord, si toute la lésion d'index est enlevée et employée pour l'expérimentation fraîche de tissu immédiatement, les diagnostics cliniques courants ne seront pas exécutés pour cette lésion et le patient peut être mal diagnostiqué en tant qu'ayant un cancer inférieur de catégorie. Pour éviter cela, le chercheur devrait discuter du plan d'échantillonnage avec le pathologiste consultant qui examinera régulièrement le cas, avant l'échantillonnage, et s'entendre sur le nombre et l'emplacement des échantillons à prélever. De petites tumeurs peuvent être exclues localement pour cette raison. Deuxièmement, si la capsule prostatique n'est pas épinglée correctement à la planche de liège avant la fixation, ceci pourrait permettre au tissu intérieur de gonfler vers l'extérieur pendant la fixation, modifiant les marges chirurgicales. Ceci pourrait mener à une marge faussement positive, où la tumeur restante semble résider à la capsule purement due à la déformation de tissu.
L'importance de cette technique par rapport aux méthodes existantes réside principalement dans le ciblage tumoral. Une série de méthodes pour l'échantillonnage des spécimens radicaux de prostatectomie a été éditée jusqu'ici ; cependant, ceux-ci reposent tous sur une approche d'échantillonnage entièrement ou partiellement aléatoire1,2,3,4,5,6,7. L'utilisation de la biopsie et en particulier des données d'IRM ici a amélioré l'efficacité, permettant l'échantillonnage réduit avec la confiance accrue d'obtenir le tissu de tumeur8.
Les applications futures de cette méthode permettent l'adoption d'un plus large éventail de techniques en aval qu'avec les méthodes d'échantillonnage précédentes. Par exemple, la disponibilité de tissus frais qui a une forte probabilité d'être tumeur signifie que des techniques de tissus frais plus coûteuses et/ou à forte intensité de main-d'œuvre peuvent être utilisées, car de nombreux échantillons ne sont pas nécessaires pour assurer la présence de la tumeur. Cela peut inclure et n'est pas limité à, la culture ex vivo, IRM ex vivo, imagerie avancée et transcriptomique.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs souhaitent reconnaître le cancer de la prostate au Royaume-Uni pour le financement de SH dans le cadre de la prostate Cancer UK Centre of Excellence and Travelling Prize Fellowship (TLD-PF16-004) et HP dans le cadre d'INNOVATE (PG14-018-TR2). Ce travail a été soutenu par des chercheurs du National Institute for Health Research University College London Hospitals Biomedical Research Centre.
matériels
| Name | Company | Catalog Number | Comments |
| 6 mm biopsy punch | Fisher Scientific | 13404607 | Disposable biopsy punches for removing 6 mm tissue samples |
| Black Ink | Leica Biosystems | 3801753 | Tissue marking & margin dye |
| Blue Ink | Leica Biosystems | 3801751 | Tissue marking & margin dye |
| Chainmail hand glove | Arco | 1456803 | Chainmail gloves to protect hand during slicing |
| Cork board | Fisher Scientific | 12396447 | Cork board for pinning prostate to following sampling procedure |
| Needles | SLS (Scientific Laboratory supplies) | SYR6112 | Sterile needles to use to pin tissue to cork board following sampling |
| Prostate slicing aparatus | Insitute of Cancer Research, London | NA - must be obtained under MTA | A kit containing the slicer handle, blades, spacer, base, walls and pins |
Références
- Sooriakumaran, P., Henderson, A., Denham, P., Langley, S. E. A novel method of obtaining prostate tissue for gene expression profiling. International Journal of Surgical Pathology. 17 (3), 238-243 (2009).
- Jhavar, S. G., et al. Processing of radical prostatectomy specimens for correlation of data from histopathological, molecular biological, and radiological studies: a new whole organ technique. Journal of Clinical Pathology. 58 (5), 504-508 (2005).
- Wheeler, T. M., Lebovitz, R. M. Fresh tissue harvest for research from prostatectomy specimens. The Prostate. 25 (5), 274-279 (1994).
- Esgueva, R., et al. Next-generation prostate cancer biobanking: toward a processing protocol amenable for the International Cancer Genome Consortium. Diagnostic Molecular Pathology. 21 (2), 61-68 (2012).
- Dev, H., et al. Biobanking after robotic-assisted radical prostatectomy: a quality assessment of providing prostate tissue for RNA studies. Journal of Translational Medicine. 9, 121(2011).
- Tolkach, Y., et al. Blind Biobanking of the Prostatectomy Specimen: Critical Evaluation of the Existing Techniques and Development of the New 4-Level Tissue Extraction Model With High Sampling Efficacy. The Prostate. 77 (4), 396-405 (2017).
- Warren, A. Y., et al. Method for sampling tissue for research which preserves pathological data in radical prostatectomy. The Prostate. 73 (2), 194-202 (2013).
- Heavey, S., et al. PatiEnt prOstate samPLes for rEsearch, a tissue collection pathway utilizing magnetic resonance imaging data to target tumor and benign tissue in fresh radical prostatectomy specimens. The Prostate. 79 (7), 768-777 (2019).
- Bailey, C., et al. VERDICT MRI validation in fresh and fixed prostate specimens using patient-specific moulds for histological and MR alignment. NMR in Biomedicine. 32 (5), 4073(2019).
- Bourne, R. M., et al. Apparatus for Histological Validation of In Vivo and Ex Vivo Magnetic Resonance Imaging of the Human Prostate. Frontiers in Oncology. 7, 47(2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon