Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une image guidée Transapical Mitral Valve Leaflet Perforation Modèle de surcharge de volume contrôlé de la régurgitation mitrale dans le rat
Dans cet article
Résumé
Un modèle de rongeur de surcharge de volume de coeur gauche de la régurgitation mitrale est rapporté. La régurgitation mitrale de la sévérité contrôlée est induite en avançant une aiguille de dimensions définies dans le dépliant antérieur de la valve mitrale, dans un coeur battant, avec le guidage d’ultrason.
Résumé
La régurgitation mitrale (MR) est une lésion de valve cardiaque largement répandue, qui provoque le remodelage cardiaque et mène à l’arrêt du coeur congestif. Bien que les risques de M. non corrigé et de son pronostic pauvre soient connus, les changements longitudinals dans la fonction cardiaque, la structure et le remodelage sont incomplets compris. Cette lacune de connaissance a limité notre compréhension du moment optimal pour la correction de MR, et l’avantage que la correction tôt versus tardive de MR peut avoir sur le ventricule gauche. Pour étudier les mécanismes moléculaires qui sous-tendent le remodelage ventriculaire gauche dans le cadre du MR, des modèles animaux sont nécessaires. Traditionnellement, le modèle de fistule aorto-caval a été utilisé pour induire la surcharge de volume, qui diffère des lésions cliniquement pertinentes telles que MR. MR représente un stress hémodynamique de surcharge de volume de basse pression, qui exige des modèles animaux qui imitent cette condition. Ici, nous décrivons un modèle de rongeur de M. grave dans lequel le dépliant antérieur de la valve mitrale de rat est perforé avec une aiguille 23G, dans un coeur battant, avec la conduite d’image échocardiographique. La sévérité du MR est évaluée et confirmée par échocardiographie, et la reproductibilité du modèle est rapportée.
Introduction
La régurgitation mitrale (MR) est une lésion commune de valve de coeur, diagnostiquée dans 1.7% de la population générale des USA et dans 9% de la population âgée supérieure à 65ans. Dans cette lésion de valve de coeur, fermeture incorrecte des folioles mitrales de valve dans le systole, cause la régurgitation du sang du ventricule gauche dans l’oreillette gauche. LE MR peut se produire en raison de diverses éétiologies; cependant, les lésions primaires de la valve mitrale (MR primaire) sont diagnostiquées et traitées plus fréquemment comparées au M.2secondaire. Le MR primaire isolé est souvent le résultat de la dégénérescence des myxomatous de la valve mitrale, ce qui entraîne l’allongement des folioles ou des tendineae d’accords, ou la rupture de certains chordae, qui contribuent tous à la perte de la coaptation systolique de la valve.
M. résultant de telles lésions de valve élève le volume sanguin remplissant le ventricule gauche dans chaque battement de coeur, augmentant le stress diastolique de fin de mur et fournissant un stresseur hémodynamique qui incite l’adaptation cardiaque et le remodelage. Le remodelage cardiaque dans cette lésion est souvent caractérisé par l’agrandissement significatif de chambre3,4, hypertrophie douce de mur, avec la fonction contractile préservée pendant des périodes prolongées de temps. Puisque la fraction d’éjection est souvent préservée, la correction de MR utilisant des moyens chirurgicaux ou transcatheter est souvent retardée, jusqu’à l’apparition de symptômes tels que la dyspnée, l’insuffisance cardiaque, et les arythmies. Cependant, le MR non corrigé est associé aux risques élevés des événements indésirables cardiaques, bien que la connaissance actuellement concernant les changements ultrastructuraux sous-jacents à ces événements soient inconnues.
Les modèles animaux de MR fournissent un modèle précieux pour étudier de tels changements ultrastructuraux dans le coeur, et étudier la progression longitudinale de la maladie. Auparavant, les chercheurs ont induit le MR chez les grands animaux, y compris les porcs, les chiens et les moutons, en créant un shunt ventriculo-atrial externe5, rupture d’accords intracardiques6, ou perforation de feuille de piste7. Bien que les techniques chirurgicales soient plus faciles chez les grands animaux, ces études se sont limitées au suivi sous-chronique dans une petite taille d’échantillon, en raison des coûts élevés de l’exécution de telles études chez les grands animaux. En outre, l’analyse moléculaire des tissus de ces modèles est souvent difficile en raison de l’alignement des anticorps spécifiques aux espèces et des bibliothèques annotées du génome.
Les petits modèles animaux de MR peuvent fournir une alternative appropriée pour étudier cette lésion de valve et son impact sur le remodelage cardiaque. Historiquement, le modèle de rat de la fistule aorto-caval (ACF) de surcharge de volume cardiaque a été utilisé. Décrite pour la première fois en 1973 par Stumpe et coll.8, une fistule artério-venous est chirurgicalement créée pour contourner le sang artériel à haute pression de l’aorte descendante dans le cava de vena inférieure à basse pression. Le taux d’écoulement élevé dans la fistule induit une surcharge de volume drastique des deux côtés du coeur, causant l’hypertrophie ventriculaire droite et gauche significative et le dysfonctionnement se produisant dans les jours suivant la création de l’ACF9. Malgré son succès, ACF n’imite pas l’hémodynamique du MR, une surcharge de volume à basse pression, qui élève la précharge mais réduit également après la charge. En raison de ces limitations du modèle ACF, nous avons cherché à développer et caractériser un modèle de MR qui imite mieux la surcharge de volume à basse pression.
Ici, nous décrivons le protocole pour un modèle de perforation de feuillet de valve mitrale pour créer le MR grave chez les rats10,11. Une aiguille hypodermique a été introduite dans le coeur de rat battant, et avancée dans le dépliant antérieur de valve mitrale sous la conduite échocardiographique en temps réel. La technique est hautement reproductible et un modèle relativement bon qui imite LE MR comme vu dans les patients. La sévérité de MR est contrôlée par la taille de l’aiguille utilisée pour perforer le dépliant mitral et la sévérité du MR peut être évaluée à l’aide d’échocardiographie transesophagienne (TEE).
Protocole
Les procédures ont été approuvées par le Programme de soins et d’utilisation des animaux de l’Université Emory en vertu du numéro de protocole EM63Rr, date d’approbation 06/06/2017.
1. Préparation pré-chirurgicale
- Stériliser à la vapeur les instruments chirurgicaux avant l’intervention.
- Le jour de la procédure, transférer les rats du logement à la chirurgie, et les peser.
- Dessiner des médicaments préopératoires et postopératoires selon le poids : deux doses de carprofène (2,5 mg/kg chacune), une dose de Gentamycine (6 mg/kg) et une dose de buprénorphine (0,02 mg/kg).
- Assurer un volume adéquat d’isoflurane dans le mélangeur à gaz, et de l’oxygène dans les réservoirs sont disponibles pour la chirurgie. Un réservoir plein d’oxygène (24 pi3) est souvent adéquat.
2. Préparation des animaux
REMARQUE : Des rats mâles adultes Sprague-Dawley pesant 350-400 g ont été utilisés dans cette étude. Les techniques chirurgicales sont agréables à des animaux légèrement plus petits ou plus grands, si désiré.
- Sedate le rat dans une chambre d’induction avec 5% d’isoflurane mélangé en 1 LPM (litre par minute) de 100% d’oxygène. Déterminer un niveau adéquat de sédation à partir d’un taux respiratoire plus lent sous observation visuelle, et la perte de secousses lors du pincement de l’art du rat.
- Intubate le rat avec un angiocath de 16 G, équipé pour une utilisation comme tube endotrachéal.
- Visualisez la trachée et les cordes vocales à l’aide d’un otoscope, et utilisez un applicateur à pointe de coton pour effacer les sécrétions pharyngées.
- Introduire le tube endotrachéal sur un guidon de 0,034 pouce, dans les cordes vocales. Une fois que le tube est placé convenablement dans la trachée, poussez le tube vers l’intérieur et retirez le fil(figure1).
- Placez le rat sur le coussin chirurgical chauffé maintenu à 37 oC et connectez le tube endotrachéal à un ventilateur mécanique. Insinez le poids du rat dans le logiciel de contrôle du ventilateur, qui calcule le taux de ventilation et le volume des marées. 66 respirations par minute avec un volume de marée de 1 ml/100 g de poids corporel ont été utilisés dans cette étude(figure 1D).
- Utilisez 100% d’oxygène (1 LPM) mélangé avec 2-2,5% d’isoflurane comme anesthésique inhalant et confirmer le niveau d’anesthésie avec une perte de tonus de la mâchoire et une perte de réponse à la pince d’attisation.
- Notez que si le mouvement de la poitrine est correctement intubé, le mouvement thoracique doit se synchroniser avec le ventilateur.
- S’il est intubé, le mouvement thoracique ne se synchronise pas avec le ventilateur. Pour tester l’intubation incorrecte, comprimez l’abdomen du rat, ce qui crée une rétropression sur le ventilateur, générant une alarme de surpression. Dans ce scénario, rétractez doucement l’angiocath et retournez le rat à la chambre d’induction avec 5% d’isoflurane pendant quelques minutes pour s’assurer que le rat est suffisamment anesthésié et réintuber le rat.
- Une fois correctement intubated, fixer le tube endotrachéal en suturant l’extrémité proximale du tube à la joue du rat avec une suture de soie 4-0 pour éviter l’extubation pendant la procédure.
- Insérez une sonde de température rectale pour surveiller la température corporelle et un électrocardiogramme à quatre terminaux pour surveiller ECG pendant toute la procédure.
- Utilisez une lampe chauffante aérienne si la chaleur de la plate-forme chirurgicale est insuffisante. Éteignez la lampe si la température du corps dépasse 37 oC.
- Évaluer visuellement l’électrocardiogramme pour toute arythmie ou signes d’ischémie myocardique. Si aucun n’est présent, enregistrez l’électrocardiogramme de base.
- Effectuer l’échocardiographie transthoracique (TTE) pour la fonction cardiaque de base(figure 2A).
- Tourner le rat vers une position de supine et raser le côté gauche du thorax. Pour obtenir des vues d’écho claires, retirez les cheveux à l’aide d’une crème dépilatoire.
- Utilisez n’importe quel système d’échographie avec une fréquence adéquate pour l’imagerie à taux cardiaque élevé. Dans cette étude, nous avons utilisé le système Visualsonics 2100 avec une sonde de 21 MHz, qui est approprié pour l’imagerie cardiaque chez les rats.
- Obtenez des images en mode B dans le plan parasternal à axe long, pour calculer les volumes ventriculaires gauches. Dans le même plan, obtenir des images en mode M pour mesurer les dimensions du mur.
- Tournez la sonde de 90 degrés et obtenez des vues à axe court parasternal de mode B et M au niveau papillaire moyen pour mesurer les dimensions transversales des murs.
- Effectuer l’échocardiographie transesophagienne (TEE) pour l’imagerie de base(figure 2B).
- Placez le rat dans la position du decubitus droit et insérez une sonde à ultrasons intracardique 8 Fr (8 MHz) dans l’œsophage du rat avec une petite quantité de gel appliquée sur la pointe. La fréquence de la sonde ICE (échocardiographie intracardique) est suffisante pour obtenir 4-6 images par battement de cœur, qui sont suffisantes pour visualiser le mouvement de la valve.
REMARQUE : Un système de premier choix GE Vivid I ou Siemens SC2000 peut être utilisé pour l’imagerie ICE. - Obtenez une vue oesophagienne élevée pour obtenir une vue à deux chambres du côté gauche du cœur. Cette vue est idéale pour visualiser l’oreillette gauche, la valve mitrale et le ventricule gauche. Positionnez la sonde de telle sorte que les folioles antérieures et postérieures soient visualisées et la coaptation est centrale. Cet angle permet également des mesures Doppler à travers la valve mitrale, sans correction d’angle.
- Mesure gauche zone auriculaire et dimensions annulus de valve mitrale dans cette vue.
- Effectuez l’imagerie couleur Doppler pour confirmer la compétence de valve et le manque de MR à la ligne de base. Effectuez l’imagerie Doppler d’ondes pulsées et d’ondes continues pour quantifier l’afflux mitral et confirmer l’absence de flux régurgitant.
- Effectuez l’imagerie Doppler en mode B et à ondes pulsées de l’aorte pour mesurer le diamètre de la racine aortique et calculer le débit aortique.
- Effectuez l’imagerie Doppler d’onde pulsée de la veine pulmonaire pour mesurer le flux veineux pulmonaire.
- Placez le rat dans la position du decubitus droit et insérez une sonde à ultrasons intracardique 8 Fr (8 MHz) dans l’œsophage du rat avec une petite quantité de gel appliquée sur la pointe. La fréquence de la sonde ICE (échocardiographie intracardique) est suffisante pour obtenir 4-6 images par battement de cœur, qui sont suffisantes pour visualiser le mouvement de la valve.
- Injecter une seule dose de carprofène (2,5 mg/kg, SQ, anti-inflammatoire non stéroïdien), de Gentamycine (6 mg/kg, SQ, antibiotique) et saline stérile (1 ml, SQ) pour compenser préventivement la perte de sang pendant l’intervention.
- Raser le côté gauche du thorax au besoin pour enlever tous les cheveux restants du champ chirurgical. Le rasage de la région inférieure du cou au xyphoide, et du bras gauche jusqu’au mid-sternum devrait être suffisant pour assurer un champ qui est dépourvu de cheveux et réduire le risque de contamination du site chirurgical.
- Frotter la zone chirurgicale avec une gaze trempée dans betadine, suivie d’une gaze trempée dans 70% d’éthanol. Frotter la zone en mouvements circulaires sur la peau, de sorte que la gaze ne contacte pas une zone précédemment nettoyée.
- Répétez cette étape trois fois pour atteindre un champ suffisamment stérile pour la chirurgie.
- Draper l’animal avec des couvertures stériles, en ouvrant une fenêtre pour accéder à la zone chirurgicale stérile.
3. Thoracotomy gauche
- Effectuer l’intervention chirurgicale entière en utilisant des techniques aseptiques, avec l’isoflurane maintenu à 2-2,5% dans 1 LPM de l’oxygène. Placer tous les instruments dans un plateau stérile et remettre dans le plateau après chaque utilisation.
- Portez des gants stériles, un masque et une casquette chirurgicale par le chirurgien pendant toute la procédure. Une robe chirurgicale stérile peut être portée aussi bien, mais elle est facultative à moins que la contamination ne soit prévue.
- Utilisez un scalpel chirurgical avec une lame No #15 pour faire une incision de la peau sur le côté gauche du thorax, environ 1 cm proximal au xyphode. Utilisez une pointe de dissection émoussée ciseaux pour séparer la couche de la peau de la couche musculaire et faire une incision longitudinale.
- Disséquer les couches musculaires de la même manière jusqu’à ce que les côtes soient exposées.
- Faites soigneusement une incision longitudinale de 2-3 cm dans le cinquième espace intercostal, suffisante pour insérer des rétracteurs et exposer le coeur.
- Utilisez de fines pointes de forceps pour soulever le péricarde, et micro ciseaux pour l’exciser dans la région entourant le sommet du cœur. Cette étape aide à éviter les adhérences post-chirurgicales du cœur aux parois thoraciques et au diaphragme.
REMARQUE : Évitez les incisions chirurgicales près du sternum pour minimiser les saignements. Transecting les artères mammaires internes qui courent le long du sternum, peut causer des saignements excessifs. Si vous êtes confronté à un tel saignement, identifiez le saigneur et cautérisez-le.
4. Procédure mr guidée Echo(figure 3 et figure 4)
- Utilisez une suture de prolène 6-0 et un support de micro-étourne, pour placer une suture de cordon de sac à main sur le sommet du ventricule gauche. Si nécessaire, utilisez des micro-forceps pour stabiliser le cœur.
- Attachez doucement la suture apicale pour stabiliser le sommet et insérer une aiguille de 23 G (rincée avec du salin, et avec un volant à son extrémité distale) au centre de la suture de la corde de sac à main, dans la cavité ventriculaire gauche.
- Utilisez une main pour tenir et guider l’aiguille, et l’autre main pour manipuler simultanément la sonde écho transesophagienne pour obtenir une vue d’écho optimale pour visualiser l’aiguille, comme décrit ci-dessus.
- Avec le guidage d’ultrason en temps réel, avancez l’aiguille vers le côté ventriculaire du dépliant mitral antérieur. Une fois que la position de l’aiguille est confirmée à l’échographie, faites avancer l’aiguille en un seul mouvement fin à travers le dépliant de la soupape. Si une résistance est ressentie, tordez l’aiguille au fur et à mesure qu’elle est avancée dans le dépliant pour la perforer.
REMARQUE : Avancer l’aiguille trop loin dans l’oreillette gauche pourrait entraîner une perforation auriculaire gauche, causant des saignements excessifs et la mort animale. L’aiguille doit être visualisée à l’échographie en tout temps. - Rétractez l’aiguille dans la chambre ventriculaire gauche, loin de la valve mitrale, et confirmez MR en allumant l’imagerie de couleur Doppler.
- Si le MR n’est pas vu sur l’imagerie Doppler couleur, répétez les étapes 4.4 et 4.5. Ajuster la sonde d’écho si nécessaire pour obtenir une meilleure vue. Après la pratique chez peu de rats, il est possible d’induire une perforation de feuillet en un seul mouvement de l’aiguille, induisant un trou qui est la taille du diamètre externe de l’aiguille. Ceci a été confirmé après autopsie des coeurs de rat.
- Une fois que le MR est confirmé, retirez l’aiguille de la cavité ventriculaire gauche et attachez doucement la suture de la corde de sac à main.
- Utilisez une gaze stérile pour tremper tout sang sur le sommet et dans la cavité thoracique.
REMARQUE : Toucher la sonde d’écho avec les gants chirurgicaux peut entraîner la contamination de l’environnement stérile. Vaporisez vos gants avec 70 % d’éthanol ou remplacez-les par de nouveaux, de façon appropriée.
5. Récupération animale et soins postopératoires
- Après 5-10 minutes de fonction cardiaque stable (ECG normal et fréquence cardiaque), fermez la thoracotomie en couches avec 4-0 vicryl, tout en réduisant l’isoflurane par étapes.
- Utilisez une suture interrompue pour approximer les côtes, avec l’isoflurane maintenu à 2%. Insérez un tube thoracique dans le sixième espace intercostal et fixez-le aux rideaux stériles pour éviter l’avancement involontaire du tube dans la cavité thoracique.
- Utilisez une suture continue pour fermer la couche musculaire avec l’isoflurane maintenu à 1,5%.
- Utilisez une suture continue pour fermer la couche de peau avec de l’isoflurane maintenu à 1%.
- Connectez une seringue à écluse à serrure Luer de 10 ml au tube thoracique et égouttez de 10 à 12 ml d’air de la cavité thoracique, puis retirez le tube thoracique.
- Administrer une dernière dose de carprofène (2,5 mg/kg, SQ) et éteindre l’isoflurane.
- Continuer la ventilation mécanique pendant que le rat se se lamente de l’anesthésie, en surveillant les signes vitaux (SpO2 et fréquence cardiaque). Au début de la respiration spontanée, éteignez la ventilation pour tester la capacité du rat à maintenir une telle respiration et une bonne SpO2.
- Si les niveaux spO2 commencent à tomber en dessous de 90%, allumez le ventilateur. Une fois que le rat est capable de maintenir les niveaux spO2 sans ventilation, la suture d’ancrage au tube endotrachéal est coupée, et l’animal est préparé pour l’extubation.
- Une fois que le rat montre des signes de vigilance, y compris des mouvements de moustache ou d’oeil, extuber l’animal.
- Placer un cône de nez avec 100% d’oxygène jusqu’à ce que le rat soit ambulatoire.
- Transférer le rat dans une cage propre avec une literie minimale et continuer à surveiller les signes vitaux à l’aide d’un moniteur SpO2 portatif, placé sur le pied ou la queue du rat, jusqu’à ce que le rat soit ambulatoire.
REMARQUE : Si des effets indésirables de la chirurgie sont observés, les animaux peuvent avoir un temps de récupération plus long et peuvent prendre plus de temps pour tenir des niveaux élevés de SpO2. Si cela se produit, un cône de nez avec 100% d’oxygène peut être appliqué jusqu’à ce que les niveaux de SpO2 soient stables. - Pour réduire le risque de blessure au site chirurgical et éviter le risque d’infection, les rats d’une seule maison après la chirurgie.
- Administrer la buprénorphine dans les 3 h après que le rat soit éveillé et suffisamment ambulatoire. La buprénorphine peut causer une détresse respiratoire lorsqu’elle est administrée tôt dans la période de récupération périopératoire, retardant ainsi jusqu’à ce que le rat respire sans difficulté.
- Après chirurgie, tous les animaux reçoivent les médicaments suivants : gentamicine (6 mg/kg, SQ, SID POD 1-3) et rimadyl (5 mg/kg, SQ, SID POD 1-3). Tous les animaux sont observés une fois par jour pendant cinq jours après la chirurgie pour l’examen des sites d’incision, et une fois par jour pendant les deux premières semaines après la chirurgie pour l’évaluation de douleur.
6. Validation de la sévérité MR avec échocardiographie (Figure 5)
- Répétez le TEE à deux semaines après la chirurgie, en utilisant les mêmes étapes spécifiées dans la section 2.7. Deux semaines après la chirurgie est un temps suffisant pour que l’hémodynamique se stabilise.
- Obtenez l’imagerie de Doppler de couleur sur une vue de 2-chambre utilisant l’imagerie transesophagienne d’ultrason, visualisant le ventricule gauche et l’oreillette gauche. Mesurer la zone de l’oreillette gauche et du jet MR. Calculer la fraction de la zone de jet MR à l’aide
 (1)
(1)
Le MR sévère est défini comme la zone de jet de MR ' 30%. - Approximative de la zone de l’orifice régurgitant en calculant la zone de l’aiguille de 23 G, en utilisant le diamètre externe de l’aiguille. Cette équation suppose que la zone de l’orifice régurgitant est égale à la zone de l’aiguille 23G.
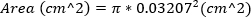 (2)
(2) - Obtenez l’imagerie Doppler à ondes continues avec la porte Doppler à l’orifice du jet régurgitant. Tracez la forme d’onde pour calculer VTI du jet régurgitant. Le volume de MR peut être estimé à l’aide
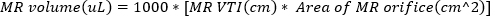 (3)
(3)
Le MR sévère est défini comme le volume de MR à 95 lil. - Obtenir l’image Doppler d’onde d’impulsion de la veine pulmonaire en tournant la sonde d’écho latéralement, dans le sens des aiguilles d’une montre. Mesurez les vitesses d’onde systolique et diastolique et utilisez l’équation suivante pour calculer le rapport.
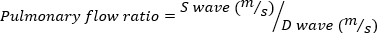 (4)
(4)
Un rapport de flux pulmonaire négatif indique le MR grave.
7. Chirurgie de sham
- Effectuer les sections 1-3 comme décrit.
- Modifier l’article 4 a été modifié de telle sorte que l’aiguille de 23 G est insérée dans la chambre ventriculaire gauche, par une suture de cordon de sac à main sur le sommet ventriculaire gauche, mais pas avancée dans la valve mitrale pour créer M. Insérez l’aiguille dans la chambre ventriculaire gauche et rétractez immédiatement, suivant en serrant et en coupant le sommet ventriculaire.
- Effectuer l’article 5 tel que décrit.
- Effectuez l’évaluation des valves mitrales telle que décrite à la section 6. Cependant, le MR ne devrait pas être présent chez l’un ou l’autre des animaux, de ce fait, la quantification telle qu’elle est décrite n’est pas nécessaire.
Résultats
Faisabilité et reproductibilité
Le modèle MR proposé est hautement reproductible, avec un trou bien défini dans le dépliant mitral réalisé dans 100% des rats utilisés dans cette étude. La figure 6A représente la direction de l’aiguille telle qu’elle est insérée dans la valve mitrale. La figure 6B représente un trou dans le dépliant de soupape mitrale d’un ...
Discussion
Un modèle reproductible de rongeur de MR grave avec la bonne survie (93.75% survie après chirurgie) et sans complications postopératoires significatives est rapporté. L’imagerie en temps réel avec l’échocardiographie transesophagienne et l’introduction d’une aiguille dans le cœur battant pour perforer le dépliant mitral sont faisables et peuvent être enseignées. Le MR grave a été produit avec la taille d’aiguille de 23 G dans cette étude, qui peut être variée comme désiré utilisant une aiguille...
Déclarations de divulgation
M.P est conseiller auprès de Heart Repair Technologies (HRT), pour laquelle il a reçu des honoraires de consultation. HRT n’a joué aucun rôle dans cette étude, et n’a pas fourni de financement pour appuyer ce travail.
Remerciements
Ce travail a été financé par des subventions 19PRE34380625 et 14SDG20380081 de l’American Heart Association à D. Corporan et M. Padala, respectivement, accordent HL135145, HL133667 et HL140325 des National Institutes of Health à M. Padala, et le financement de l’infrastructure du Carlyle Fraser Heart Center de l’Hôpital universitaire Emory midtown jusqu’à M. Padala.
matériels
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
Références
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation?. The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon