Method Article
Un modèle biomimétique pour le cancer du foie pour étudier les interactions tumeur-stroma dans un environnement 3D avec tunable propriétés bio-physiques
Dans cet article
Résumé
Ce protocole présente un modèle biomimétique 3D avec compartiment stromal fibrotique d’accompagnement. Préparé avec des hydrogels physiologiquement pertinents dans des rapports imitant les propriétés biophysiques de la matrice extracellulaire stromal, un médiateur actif des interactions cellulaires, de la croissance tumorale et de la métastase.
Résumé
Le carcinome hépatocellulaire (HCC) est une tumeur primaire de foie se développant dans le sillage de la maladie hépatique chronique. La maladie hépatique chronique et l’inflammation mènent à un environnement fibrotique soutenant activement et conduisant l’hépatocarcinogenèse. La perspicacité dans l’hépatocarcinogenèse en termes d’interaction entre le micro-environnement stroma de tumeur et les cellules de tumeur est donc d’une importance considérable. Les modèles tridimensionnels (3D) de culture cellulaire sont proposés comme chaînon manquant entre les modèles actuels de culture cellulaire 2D in vitro et les modèles animaux in vivo. Notre objectif était de concevoir un nouveau modèle 3D biomimétique HCC avec compartiment stromal fibrotique et vascularisation qui l’accompagne. Des hydrogels physiologiquement pertinents tels que le collagène et le fibrinogen ont été incorporés pour imiter les propriétés bio-physiques de l’ECM de tumeur. Dans ce modèle, les cellules LX2 et HepG2 intégrées dans une matrice d’hydrogel ont été ensemencées sur l’insert transmembrane inversé. Les cellules HUVEC ont ensuite été ensemencées sur le côté opposé de la membrane. Trois formulations composées d’ECM-hydrogels incorporés avec des cellules ont été préparées et les propriétés bio-physiques ont été déterminées par rhéologie. La viabilité cellulaire a été déterminée par un essai de viabilité cellulaire sur 21 jours. L’effet de la doxorubicine de drogue chimiothérapeutique a été évalué dans la co-culture 2D et notre modèle 3D pour une période de 72h. Les résultats de rhéologie montrent que les propriétés biophysiques d’un foie fibrotique, cirrhotic et HCC peuvent être imitées avec succès. Dans l’ensemble, les résultats indiquent que ce modèle 3D est plus représentatif de la situation in vivo par rapport aux cultures 2D traditionnelles. Notre modèle de tumeur 3D a montré une réponse diminuée aux chemotherapeutics, imitant la résistance de drogue typiquement vue dans les patients de HCC.
Introduction
Le carcinome hépatocellulaire (HCC) comprend 90% de tous les cancers primaires dufoie 1,2. Avec 810 000 décès et 854 000 nouveaux cas signalés chaque année, il se classe actuellement au cinquième rang mondial des cancers les plus fréquents avec l’une des incidences de mortalité les plusélevées 1. Le développement de HCC est principalement attribué à l’inflammation liée aux maladies hépatiques chroniques à savoir, hépatite virale, prise excessive chronique d’alcool, syndrome métabolique,obésité et diabète 1,3,4. L’inflammation associée à ces conditions pathologiques a comme résultat des dommages d’hepatocyte et la sécrétion de diverses cytokines qui activent et recrutent les cellules stellates hépatiques et les cellules inflammatoires pour initier lafibrose 5. Les cellules stellaires hépatiques sont connues pour leur rôle clé dans l’initiation, la progression et la régression de la fibrose hépatique. Lors de l’activation, ils se différencient en myofibroblaste comme les cellules avec des propriétés contractiles, pro-inflammatoires et pro-fibrinogenic6,7,8. La fibrose qui en résulte provoque à son tour la dysrégulation de la matrice extracellulaire remodelant l’activité enzymatique, créant un environnement caractérisé par une rigidité globale accrue accompagnée de la sécrétion de facteurs de croissance, ce qui contribue en outre à la pathogénie HCC9,10. C’est cette boucle continue de rétroaction pathogène entre les hépatocytes et l’environnement stromal, qui alimente l’initiation de cancer, les transitions épithéliales à mésenchymales (EMT), l’angiogenèse, le potentiel métastatique, et la réponse altérée dedrogue 11,12,13. La perspicacité dans l’hépatocarcinogenèse en termes d’interaction entre la tumeur et le micro-environnement de tumeur est, par conséquent, d’une importance considérable non seulement d’un mécaniste mais également d’un point de vue de traitement.
Les modèles de culture cellulaire in vitro bidimensionnels (2D) sont principalement utilisés par 80 % des biologistes des cellules cancéreuses14. Cependant, ces modèles ne sont pas représentatifs du vrai micro-environnement de tumeur, qui affecte des réponses chemotherapeutic14,15,16. Actuellement, 96% des médicaments chimiothérapeutiques échouent lors des essaiscliniques 14. Cette incidence élevée dans les taux d’attrition des médicaments peut être attribuée au fait que les modèles de pré-dépistage in vitro disponibles ne représentent pas pleinement notre perspicacité et notre compréhension actuelles de la complexité du HCC et du microenvironnement16. Inversement, les modèles animaux in vivo présentent des systèmes immunitaires compromis et des divergences dans les interactions entre la tumeur et le microenvironnement par rapportà l’homme 16,17. En moyenne, seulement 8 % des résultats obtenus à partir d’études sur des animaux peuvent être traduits de façon fiable du milieu précliniquesau milieu clinique 16,17. Par conséquent, il est clair que l’évaluation de HCC nécessite le développement d’une plate-forme in vitro qui récapitule efficacement la complexité non seulement de la tumeur, mais aussi le microenvironnement. Les plateformes compléteraient les modèles de dépistage préclinique in vitro actuellement disponibles et réduiraient la quantité d’études sur les animauxà l’avenir 7,14.
L’une de ces plates-formes est avancée des modèles de culture cellulaire tridimensionnelle (3D). Une multitude de ces modèles 3D avancés pour étudier hcc ont émergé au cours de la dernière décennie et divers examens ont été publiés. Les modèles 3D disponibles pour étudier le HCC incluent les sphéroïdes multicellulaires, les organoïdes, les modèles à base d’échafaudages, les hydrogels, les microfluidiques et la bio-impression. De ce nombre, les sphéroïdes multicellulaires sont l’un des modèles les plus connus utilisés dans l’étude du développement tumoral. Sphéroïdes sont un modèle peu coûteux avec une faible difficulté technique tout en imitant efficacement l’architecture tumorale in vivo18,19,20. Les sphéroïdes multicellulaires ont contribué à une mine d’informations sur HCC17,21,22. Cependant, le temps normalisé de culture fait défaut car les sphéroïdes multicellulaires sont maintenus dans la culture entre 7 et 48 jours. L’augmentation du temps de culture est d’une importance considérable. Eilenberger a constaté que les différences dans l’âge sphéroïde influencent profondément sorafenib (un inhibiteur de kinase utilisé pour le traitement des cancers du foie) la diffusivité et latoxicité 23. Alors que Wrzesinski et Fey ont constaté que les sphéroïdes hépatocytes 3D nécessitent 18 jours pour rétablir les principales fonctions hépatiques physiologiques après la trypsinisation et continue d’afficher la fonctionnalité stable pour un jusqu’à 24 jours aprèscette récupération 24,25.
Certains des modèles 3D HCC les plus avancés incluent l’utilisation d’échafaudages de foie décellularisés humains et d’échafaudages bio-imprimés. Mazza et ses collègues ont créé un échafaudage 3D naturel pour la modélisation HCC à l’aide de foies humains décellulaires qui ne conviennent pas à la transplantation26. Ces échafaudages naturels pourraient être repeuplés avec succès pendant 21 jours avec une co-culture des cellules hépatiques d’stellate et d’hépatoblastoma, tout en maintenant l’expression des composants extracellulaires clés de matrice tels que le type de collagène I, III, IV et fibronectin. Outre la modélisation des maladies, ce modèle offre également l’avantage de la transplantation fonctionnelle d’organes et du dépistage préclinique des médicaments et de latoxicité 26. Avec les progrès de la bio-impression 3D, les échafaudages à matrice extracellulaire 3D peuvent désormais également être bio-imprimés. Ma et collègues, échafaudages de matrice extracellulaire bio-imprimés avec des propriétés mécaniques variables et microarchitecture biomimétique utilisant l’ingénieur d’hydrogels de la matrice extracellulaire décellularisée27. Sans aucun doute, ce sont tous d’excellents modèles 3D HCC. Cependant, l’indisponibilité des foies humains et le coût d’acquisition de l’équipement et des matériaux nécessaires désavantagent ces modèles. En outre, ces méthodes sont toutes techniquement avancées nécessitant une formation approfondie qui peut ne pas être facilement accessible à tous les chercheurs.
En fonction de la complexité du HCC et des modèles 3D actuellement disponibles, nous nous sommes efforcés de développer un modèle 3D HCC global. Nous avons visé un modèle capable de récapituler le microenvironnement prémalignant et tumoral en incorporant des valeurs réglables de rigidité d’hydrogel. En outre, nous avons également inclus les lignées cellulaires hépatocellulaires et stroma associées, qui jouent un rôle clé dans la pathogénie de HCC. Il s’agit notamment des cellules endothéliales, des cellules stellates hépatiques et des hépatocytes malins, cultivés dans un microenvironnement composé d’hydrogels physiologiquement pertinents. Avec les hydrogels choisis, le collagène de type I et le fibrinogène, incorporés dans des ratios comparables aux changements biophysiques observés dans la raideur hépatique lors de l’initiation et de la progression du HCC. En outre, nous voulions un modèle qui pourrait être maintenu dans la culture pendant une période prolongée. Nous avons envisagé un modèle modulaire et rentable qui peut être configuré avec de l’équipement de base, une formation et une expérience minimales, et des matériaux facilement disponibles.
Protocole
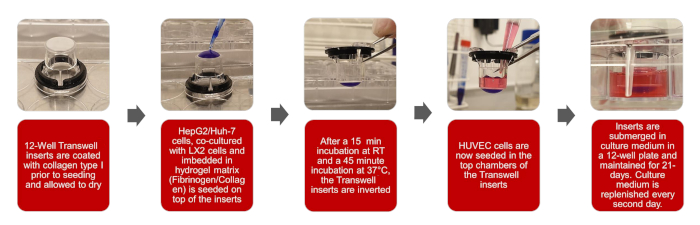
Figure 1 : Représentations graphiques de la création du modèle biomimétique 3D HCC Veuillez cliquer ici pour voir une version plus grande de cette figure.
REMARQUE : Le flux de travail global de ce protocole est énoncé dans les illustrations de la figure 1
1. Préparation de la solution de stock de fibrinogen
- Préparer une solution de bouillon de chlorure de calcium de 1 M (CaCl2),en pesant 2,21 g de CaCl2 et en l’ajoutant à de l’eau distillée de 20 mL (dH2O). La solution stock peut être stockée à température ambiante (RT).
- Préparer une solution de stock d’aprotinine de 20 mL (1218,75 KIU/mL) en pesant 5 mg d’aprotinine et en l’ajoutant à 20 mL dH2O. Aliquot en aliquots de 1 mL et en les stockant à -20 °C.
- Préparer une solution de stock de fibrinogen de 80 mg/mL de 10 mL.
- Dans un tube de 50 mL ajouter 7,849 mL de phosphate salin tamponné (PBS), 2,051 mL de stock d’aprotinine (1218,75 KIU/mL) pour une concentration finale d’aprotinine de 250 KIU/mL et 100 μL CaCl2 (1M) pour une concentration finale de CaCl2 de 10 mM.
- Peser 800 mg de fibrinogène.
- Pesez 200 mg de chlorure de sodium (NaCl) pour que la solution de stock contiendra 2% w/v NaCl.
- Ajouter le fibrinogen et le NaCl par incréments au tube de 50 mL contenant le PBS, l’aprotinine et le CaCl2. Ne pas remuer ou secouer vigoureusement car cela se traduira par un gelling fibrinogène et des grumeaux formant dans la solution.
- Placez le tube de 50 mL de la solution de stock de fibrinogen horizontalement sur un shaker et secouez à un réglage bas de 300 rpm.
- Une fois la solution dissoute, filtrez-la à l’aide d’un filtre à seringues de 0,22 μm ou d’un filtre du dessus de la bouteille selon le volume. Fait important, ne pas autoclave la solution fibrinogen car cela va détruire le fibrinogène.
REMARQUE: Cette partie du protocole peut prendre entre 2 à 5 h selon la quantité de solution de stock, cette fois doit être pris en considération lors de la configuration expérimentale.
2. Enrober les inserts de collagène avant l’ensemencement des hydrogels sur les inserts
- Dans une hotte d’écoulement laminaire ou une hotte de culture tissulaire, à l’aide d’une pince stérilisée, retirer les inserts de la plaque et les placer inversés sur le couvercle de la plaque.
- Préparer une solution de stock d’acide acétique glaciaire de 20 mM de 20 mM en ajoutant 115 μL d’acide acétique glaciaire à 25 mL de dH2O et ajuster à un volume final de 100 mL avec dH2O. Filtrer la solution à l’aide d’un filtre à seringues de 0,22 μm. La solution stock peut être stockée chez RT.
- Préparez 2 mL d’une solution de collagène de 100 μg/mL à partir d’une solution de collagène de 5 mg/mL en ajoutant 40 μL de la solution de collagène de 5 mg/mL à 1,960 mL de la solution de stock d’acide acétique glaciaire de 20 mM préparée en 2,2.
- Enduire les inserts de la solution de collagène de 100 μg/mL préparée en 2,3 en pipetant 100 μL de la solution sur chaque insert. Laissez sécher l’air dans le capot d’écoulement laminaire ou le capot de culture tissulaire pendant 2 à 3 h.
- Une fois que les inserts ont séché laver chaque insert 3x avec PBS. Ajouter 1 mL de PBS à chaque puits d’une plaque de 12 puits, placer les inserts avec revêtement de collagène orienté vers le bas dans les puits, retirer PBS du puits et répéter la procédure. Laissez sécher l’air dans le capot d’écoulement laminaire de 1 à 2 h.
ATTENTION : L’acide acétique est toxique pour les cellules et les inserts doivent être lavés à fond avec du PBS. - Ajoutez un espaceur imprimé 3D personnalisé sur les inserts, ce qui sera nécessaire une fois que les gels sont suspendus à l’insert pour les empêcher de toucher le puits inférieur de la plaque (Figure 2).

Figure 2 : Espaceur imprimé 3D personnalisé Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
- Couvrir les inserts inversés de la partie inférieure de la plaque et les placer dans l’incubateur jusqu’à ce que les cellules soient intégrées dans les hydrogels et prêtes à être ensemencées.
3. Cellules d’ensemencement intégrées dans les hydrogels sur les inserts
REMARQUE : Le tableau 1 fournit une description de 3 formulations avec des concentrations variables de fibrinogène qui seront préparées. Formulation on correspond au foie pendant le début de la fibrose, deux cirrhose et trois HCC, les valeurs de rigidité pour chacune de ces formulations ont été déterminées avec la rhéologie pendant l’optimisation de protocole.
| Formulation | Concentration finale de Fibrinogen (mg/mL) | Concentration finale de collagène (mg/mL) | Cellules (LX2 + HepG2 Co-culture 1:1) | Étape du foie | Valeurs de rigidité hépatique de littérature (kPa) | Valeur de rigidité de modèle de rhéologie (kPa) | Formulation | Fibrinogen ajouter (mL) | Collagène à ajouter (mL) | 10 % DMEM (mL) | Thrombine (μL) | Références |
| 1 | 10 | 2 | 2 x 106 cellules/mL | Fibrose | ≥2 | 3 | 1 | 1 | 0.8 | 0.2 | 4 | 28; 29; 30 |
| 2 | 30 | 2 | 2 x 106 cellules/mL | Cirrhose | 6 | 2 | 0.75 | 0.8 | 0.45 | 3 | ||
| 3 | 40 | 2 | 2 x 106 cellules/mL | Hcc | ≥10 | 10 | 3 | 0.25 | 0.8 | 0.95 | 1 | 28; 31; 32 |
Tableau 1 : Description des formulations pour les cellules d’ensemencement intégrées dans les hydrogels sur les inserts
- Préparer 1 M de solution de stock d’hydroxyde de sodium en ajoutant 3,99 g de NaOH à 100 mL de dH2O. La solution peut ensuite être filtrée à l’aide d’un filtre à seringues de 0,22 μm. Stockez la solution stock chez RT.
- Déposer le collagène de 5 mg/mL et 10 mL de 1 M naoh sur la glace.
- Préchauffer 50 mL de PBS, 15 mL trypsine, 70 mL 10% DMEM, et solution de stock de fibrinogen, préparée dans la section 1, à 37 °C pendant 20 min dans un bain d’eau.
- Préparez les suspensions cellulaires.
- Laver les cellules stellates hépatiques (LX2) et les cellules du carcinome hépatique (HepG2) dans les flacons de culture T175 deux fois avec 10 mL de PBS.
- Essayez les cellules avec une trypsine de 6 mL pendant 4 min à 37 °C.
- Inactivez la trypsine avec 6 mL de 10% de DMEM.
- Recueillir la suspension cellulaire en tube de 15 mL et centrifugeuse pendant 3 min à 300 x g.
- Après centrifugation, aspirer le supernatant et resuspendre chaque lignée cellulaire en 5 mL de 10% DMEM.
- Comptez les cellules à l’aide d’un compteur cellulaire automatisé : Ajoutez 10 μL de chaque suspension cellulaire à la glissière de la chambre de comptage et insérez la diapositive dans le compteur cellulaire. Le nombre de cellules est affiché sous forme de cellules/mL.
- Diluer les cellules de chaque lignée cellulaire à 1 x 106 cellules par mL en utilisant le nombre de cellules à l’étape 3.4.6 dans des tubes clairement marqués de 15 mL. Centrifugeuse les dilutions pendant 3 min à 300 x g.
- Après centrifugation, aspirer le supernatant et ajouter 10 % de DMEM à chaque tube de 15 mL selon le tableau 1,les valeurs fournies dans le tableau sont de 2 mL de chaque formulation.
- Neutraliser la quantité de collagène avec 10 μL/mL NaOH (1 M), et ajouter le collagène neutralisé à la suspension cellulaire, le présent 10% DMEM deviendra jaune, une fois que la suspension est mélangée à fond par pipetting avec une pointe coupée, il deviendra un rose vif.
- Ajouter le fibrinogen à la suspension cellulaire de collagène selon le tableau 1, à l’aide d’une pointe de pipette coupée, bien mélanger la suspension.
- Enfin ajouter la thrombine à la suspension cellulaire collagène-fibrinogen, 0,1 THRU thrombin pour chaque 10 mg de fibrinogen.
- Retirer les inserts inversés pré-enduits préparés dans la section 2 de l’incubateur et à l’aide d’une pointe de pipette coupée de 200 μL, pipette 200 μL de la suspension préparée sur les inserts désignés. Laissez les gels se croiser pendant 15 min dans le capot d’écoulement laminaire.
- Après 15 min, placer délicatement la partie inférieure de la plaque sur les gels et les déplacer vers l’incubateur pour permettre aux gels de se croiser à 37 °C pendant 45 min.
- Une fois que les gels se sont croisés, inverser à nouveau les inserts et ajouter 2 mL de 10% de DMEM à chacun des puits du bas de la plaque.
4. Semis de cellules endothéliales
- Préchauffer 25 mL hanks solution de sel équilibré (HBSS), trypsine de 10 mL, inhibiteur de trypsine de 10 mL et milieu de croissance endothéliale de 50 mL, à 37°C pendant 20 min dans un bain d’eau.
- Préparer la suspension cellulaire endothéliale (HUVEC).
- Laver les cellules HUVEC dans des flacons de culture T175 deux fois avec 10 mL HBSS.
- Essayez les cellules avec une trypsine de 6 mL pendant 4 min à 37 °C. Inactivez la trypsine avec un inhibiteur de la trypsine de 6 mL. Recueillir la suspension cellulaire dans 15 mL de tube et centrifugeuse pendant 3 min à 200 x g.
- Après centrifugation aspirer le supernatant et suspendre les cellules dans 5 mL milieu de croissance endothéliale.
- Comptez les cellules comme précédemment décrit dans 3.4.6 utilisant un compteur automatisé de cellules.
- En utilisant le nombre de cellules du compteur cellulaire, préparer la densité d’ensemencement de 1,0 x10 4 cellules/mL dans le milieu de croissance endothéliale.
- Graine 500 μL de la suspension cellulaire HUVEC dans chaque puits de la partie supérieure de l’insert pour avoir un volume final de 5,0 x 103 cellules par insert.
5. Entretien
- Remplacer le milieu de croissance tous les deux jours, aspirer le milieu de croissance dépensé à la fois à partir du puits et de l’insert. Ajouter 2 mL 10% DMEM aux puits contenant le gel et 0,5 mL de milieu de croissance endothéliale aux inserts contenant les cellules HUVEC.
- Maintenez le modèle pendant 21 jours avant l’expérimentation.
6. Rhéologie
- Mesurez le moduli de stockage des formulations de gel pour indiquer les valeurs de rigidité à l’aide d’un rhéomètre, en effectuant des balayages de fréquence de 0,1 à 20 Hz à 0,267 % et 37 °C, avec une force axiale constante de 0,1 N à l’aide d’une géométrie parallèle d’acier inoxydable de plaque de 8 mm de diamètre.
7. Viabilité et réponse aux médicaments
- Déterminer la réponse et la viabilité des médicaments dans les co-cultures 2D et le modèle 3D.
- Graines HepG2 (5,0 x 103 cellules/mL) et LX2 (5,0 x 103 cellules/mL) cellules dans un rapport de 1:1 pour la co-culture 2D dans un fond clair noir 96-puits plaques à une densité d’ensemencement de 1,0 x 104 cellules / mL. Laissez les cellules se fixer pendant la nuit.
- Configurer le modèle 3D pour correspondre à un environnement cirrhotic avec une valeur de rigidité de 6 kPa. Maintenir le modèle pendant 21 jours avant le traitement à la doxorubicine.
- Deux heures avant le traitement à la doxorubicine, aspirez le milieu de culture du modèle 2D et 3D. Lavez les deux modèles deux fois avec PBS. Ajouter le milieu de famine (DMEM complété par une solution antibiotique antimycotique v/v à 1% ) à la co-culture 2D (200 μL par puits) et au modèle 3D (2 mL aux puits contenant l’hydrogel et 500 μL à l’insertion).
- Administrer la doxorubicine à la fois à la 2D et au modèle 3D. Les dosages sont les suivants : 0,5, 1 et 1,5 mM correspondant aux valeurs IC25, 50 et 75, respectivement. Traiter les deux modèles pendant 72 h.
REMARQUE : La doxorubicine, inhibiteur de la topoisomerase II, est l’un des premiers agents chimiothérapeutiques utilisés pour le HCC et est également l’un des agents chimiothérapeutiques les plus actifs dans le traitement du HCC33,34. - Après 72 h, milieu de culture aspiré à la fois du modèle 2D et 3D. Assurez-vous que tout milieu de culture restant est enlevé en lavant les deux modèles deux fois avec PBS.
- Préparer AlamarBlue selon les recommandations du fabricant et ajouter aux puits du modèle 2D et 3D. Ajouter 150 μL par puits pour la culture 2D et 2 mL par puits et 500 μL par insert pour la culture 3D. Incubé toute la nuit à 37°C.
- Après le transfert d’incubation 150 μL de l’AlamarBlue de chaque puits de la configuration 3D dans une plaque noire à fond clair de 96 puits. AlamarBlue peut être lu directement à partir de la plaque pour le modèle 2D.
- Lisez la fluorescence avec un lecteur de microplaque à la longueur d’onde d’excitation et à la longueur d’onde d’émission de 485 et 550 nm, respectivement.
- Calculez le pourcentage de viabilité cellulaire dans les deux modèles à l’aide de la formule suivante :
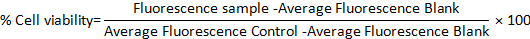
Résultats
Plages de concentration et volume d’ensemencement
L’optimisation du protocole pour obtenir le protocole de fonctionnement final s’est produite selon le diagramme schématique présenté à la figure 3. Deux hydrogels physiologiquement pertinents, collagène de type I et Fibrinogen, ont été identifiés au moyen d’une recherchedocumentaire 35,36. En commençant par le collagène de queue de rat de type I, une gamme de concentrations (4, 3, 2 et 1 mg/mL) a été ensemencée sur des inserts inversés pour déterminer leur capacité à adhérer avec succès à l’insert une fois inversé à nouveau. Toutes les concentrations dans cette fourchette ont pu former des gels, mais les gels de collagène semblaient aplatis et avaient diverses bulles d’air piégées à l’intérieur en raison de la manipulation et du pipetage, voir la figure 4 et la figure 5. Afin de déterminer le volume optimal d’ensemencement pour améliorer la qualité du gel de collagène, une gamme de volumes d’ensemencement (100, 150 et 200 μL) a été ensemencée sur des inserts inversés, voir la figure 5. Le volume d’ensemencement n’a eu aucune influence sur l’apparence du gel ou la présence de bulles dans le gel. Par conséquent, il a été décidé que 200 μL était le volume d’ensemencement optimal produisant les gels les plus complets. Fibrinogen a également été évalué pour sa capacité à produire un gel qui pourrait adhérer à un insert pendant une période prolongée. Une plage de concentration (70, 50, 40, 30, 20, 10, 5, 1 mg/mL) a été préparée et ensemencée à un volume de 200 μL sur le couvercle d’une plaque de 12 puits, voir figure 6. Dans les 20 minutes suivant l’ensemencement, toutes les concentrations ont pu former avec succès un gel. Cependant, les concentrations 5 et 1 mg/mL ont été exclues car les gels formés avaient un fluide comme la consistance et avaient commencé à se détacher du couvercle après avoir été maintenus pendant la nuit à 37 °C.
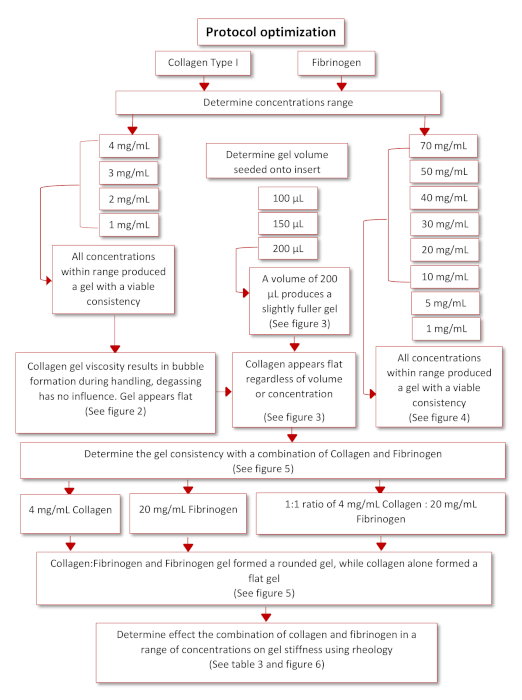
Figure 3 : Diagramme schématique de l’optimisation du protocole. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4 : Gels de collagène 4 mg/mL contenant 1,0 x 105 cellules/mL ensemencées sur des inserts montrant des bulles présentes dans le gel. Insert sur la gauche a été dégazé sur la glace pendant 15 min, tandis que l’insert sur la droite n’a pas été dégazé. Le dégazage n’a eu aucun effet sur les bulles présentes dans les gels. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Figure 5 : Gels de collagène 4 mg/mL contenant 1,0 x 105 cellules/mL ensemencées sur des inserts en différents volumes. (A) Insérer sur la gauche 100 μL, milieu 150 μL et à droite 200 μL, directement après l’ensemencement. Des bulles dans les gels étaient encore présentes. (B) Insérer sur la gauche 200 μL, milieu 150 μL et à droite 100 μL, après 60 min de liaison croisée. Tous les gels, quel que soit leur volume, semblent toujours plats. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 6 : Fibrinogen (200 μL) dans une concentration de 70 à 1 mg/mL ensemencée sur le couvercle d’une plaque de 12 puits. ( A )Gelsdirectement après l’ensemencement. (B) Gels 20 min après l’ensemencement. (C) Gels conservés toute la nuit. Tous les gels semblent bien arrondis, les gels de 5 mg/mL et 1 mg/mL ont été exclus car ils semblaient avoir une consistance plus fluide 20 min après l’ensemencement et avaient commencé à se détacher du couvercle après avoir été conservés pendant la nuit. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Combinaison collagène et fibrinogen
Basé sur les résultats des gammes de concentration de collagène et de fibrinogen l’effet de combiner le collagène et le fibrinogen a été évalué. Trois inserts ont été configurés avec le collagène suivant, 4 mg/mL de collagène, 20 mg/mL de fibrinogen et une ration de collagène (4 mg/mL) et de fibrinogen (20 mg/mL), voir la figure 7. Directement après l’ensemencement des hydrogels, nous avons observé que l’insert avec du collagène seul avait encore un aspect plat combiné avec l’apparition de bulles dans le gel. Les inserts avec le fibrinogen ont produit un gel complet et arrondi, ainsi que l’insert avec la combinaison du collagène et du fibrinogen. Après une liaison croisée à 37 °C pendant 60 min, tous les gels s’étaient attachés à l’insert et étaient restés attachés après l’incubation pendant la nuit à 37 °C.

Figure 7 : Effet de la combinaison du collagène et du fibrinogen. (A) Collagène 4 mg/mL ensemencé sur insert sur la gauche, fibrinogen 20 mg/mL ensemencé sur insert au milieu et collagène 4 mg/mL, fibrinogen 20 mg/mL (1:1 ration) ensemencé sur insert sur la droite. Tous les gels ensemencés à un volume de 200 μL contenant 1,0 x 105 cellules/mL, tous les gels ont été reliés entre eux pendant 60 min à 37 °C. (B) Collagène 4 mg/mL 60 min après liaison croisée, gel est apparu plat et avait des bulles. (C) Insert sur le fibrinogen gauche 20 mg/mL, gel apparaissent arrondis, pas de bulles présentes, insérer sur le collagène droit 4 mg/mL, fibrinogen 20 mg/mL gel, gel est bien arrondi sans bulles. (D) Collagène 4 mg/mL gel après avoir été conservé toute la nuit à 37 °C, gel contenait encore une grande quantité de bulles, un certain gonflement du gel s’est produite. (E) Fibrinogen 20 mg/mL conservé pendant la nuit à 37 °C. (F) Collagène 4 mg/mL, fibrinogen 20 mg/mL gel conservé pendant la nuit à 37 °C. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Détermination de la densité d’ensemencement cellulaire
Sur la base de l’expérience antérieure de travail avec les hydrogels, une expérience a été mise en place pour déterminer la densité optimale d’ensemencement cellulaire (données non montrées)37. Les cellules ont été incorporées dans une combinaison de collagène et de fibrinogen dans la gamme de concentration suivante (7,5 x10 5, 8,5 x10 5, 9,5 x 105, 1,0 x 106, 1,5 x 106 et 2,0 x 106 cellules/mL), 2,0 x 106 cellules/mL se sont révélés être la densité optimale d’ensemencement.
Rhéologie
Dix formulations des combinaisons de fibrinogen et d’hydrogel de collagène ont été évaluées au moyen de rhéologie, voir le tableau 2. L’objectif était de déterminer laquelle de ces formulations pouvait imiter la raideur hépatique observée lors du développement du HCC. La littérature a fourni des valeurs connues de rigidité du foie pour les rats, les souris et les humains pendant la fibrose, la cirrhose et le HCC et le but était de se rapprocher le plus possible deces valeurs 28,29,30,31,32. Les dix formulations énoncées dans le tableau 2 ont été préparées en triplicate et les modules de stockage de chacun ont été déterminés à l’aide d’un rhéomètre, résultats indiqués à la figure 8.
| Formulation | Fibrinogen (mg/ml) | Collagène (mg/ml) |
| 1 | 60 | 2 |
| 2 | 50 | 2 |
| 3 | 40 | 2 |
| 4 | 30 | 2 |
| 5 | 20 | 2 |
| 6 | 10 | 2 |
| 7 | 20 | 5 |
| 8 | 20 | 4 |
| 9 | 20 | 3 |
| 10 | 20 | 1 |
Tableau 2 : Combinaisons de collagène et de fibrinogène dans diverses concentrations évaluées avec rhéologie pour déterminer les valeurs de rigidité
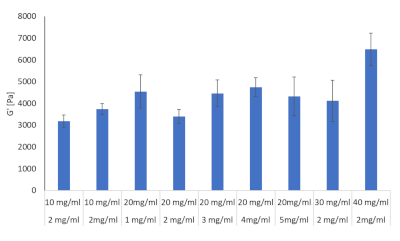
Figure 8 : Valeurs de rigidité hydrogel pour les combinaisons de collagène et de fibrinogen dans diverses concentrations évaluées avec rhéologie. Modulus de stockage et modulus de perte ont été déterminés à 37 °C et 1Hz au moyen d’un rhéomètre hybride Discovery HR-2 (n = 3, barres d’erreur = SD). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
De ces dix formules, trois ont été choisies pour aller de l’avant. Il s’agissait notamment de 2 mg/mL de collagène de type I et de 10 mg/mL fibrinogen correspondant aux valeurs de raideur hépatique au début de la fibrose, 2 mg/mL de collagène de type I et 30 mg/mL fibrinogen correspondant à la cirrhose et 2 mg/mL de collagène de type I et 40 mg/mL fibrinogen correspondant à HCC, voir figure 9.
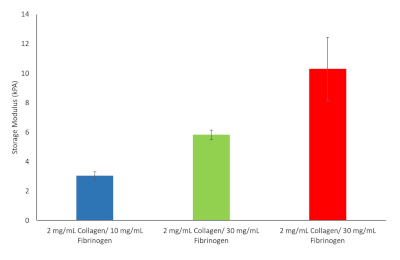
Figure 9 : Valeurs de rigidité hydrogel pour diverses formulations d’hydrogel fibrinogen/collagène choisies pour continuer. Modulus de stockage et modulus de perte ont été déterminés à 37 °C et 1 Hz (n = 3, barres d’erreur = SD). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Viabilité, réponse aux médicaments et potentiel métastatique
Les résultats de l’analyse AlamarBlue ont montré une viabilité cellulaire globalement réduite au sein de la co-culture 2D, inférieure aux attentes sur la base des valeurs IC 25, 50 et 75 signalées connues, par rapport au contrôle non traité, voir la figure 10. Ceci peut être attribué aux cellules de LX2 dans notre co-culture qui sont plus sensibles au traitement de Doxorubicin. Cependant, dans notre modèle 3D nous avons remarqué et augmenté dans la résistance de doxorubicine, confirmant la diminution du potentiel chimiothérapeutique souvent vu dans les systèmes de modèle 3D. La signification statistique par rapport aux témoins a été évaluée à l’aide du test de l’élève T (à deux queues), le P<0,05 étant considéré comme significatif.
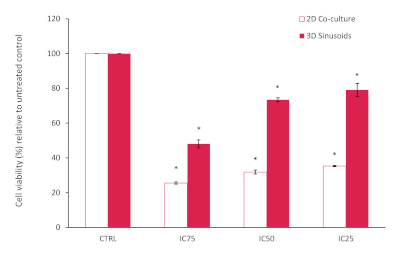
Figure 10 : Viabilité cellulaire en pourcentage d’un modèle de co-culture 2D par rapport au modèle 3D après traitement par Doxorubicine à diverses concentrations pendant une période de 72h. Résultats normalisés par rapport au contrôle non traité (n=3, barres d’erreur = DD) (* = p<0,0001). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Les constructions de gel ont été inspectées visuellement quotidiennement à l’aide d’un microscope léger pour suivre la croissance cellulaire dans différentes concentrations des hydrogels. Les cellules ont rempli les hydrogels d’une manière homogène et compacte, à partir du jour 7 sphéroïdes ont commencé à assembler dans la matrice.
Discussion
Ce protocole décrit le développement d’une méthode pour créer un modèle biomimétique pour HCC. Un flux de travail clair a été établi et les étapes critiques impliquées ont été identifiées. Ces étapes critiques comprennent la préparation de la solution de stock de fibrinogen, le revêtement des inserts avec du collagène et l’ensemencement des cellules imbriquées dans l’hydrogel. Pendant la préparation de la solution de stock de fibrinogen il est important d’ajouter le fibrinogen dans de plus petits incréments à des concentrations plus élevées. Cela permettra non seulement de réduire le temps qu’il faut pour que le fibrinogène se dissolve, mais aussi d’empêcher le fibrinogène de geler de façon incohérente et prématurée, comme on le voit à la figure 11. La préparation du gel de fibrinogen prend beaucoup de temps et ceci peut influencer le succès expérimental global. Les résultats indiquent qu’une fois que le gel de fibrinogen commence à geler de façon incohérente, il est préférable de le jeter. Les inserts doivent être recouverts de collagène, lavés avec du PBS et séchés dans le capot d’écoulement laminaire avant d’ensemencer les cellules encastrées dans les hydrogels. Si vous ne vous assurez pas que les inserts sont secs, les hydrogels se déversent sur les bords de l’insert, ce qui entraîne un gel inégal. L’inégalité du gel influencera en fin de compte les résultats où la diffusion est un facteur.
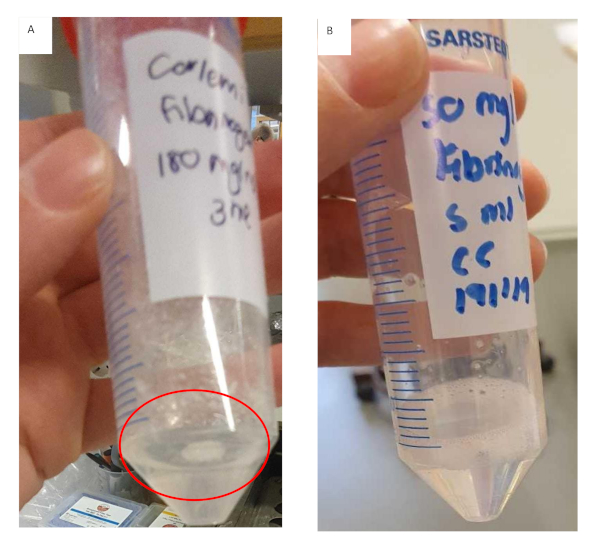
Figure 11 : Préparation du gel de fibrinogen pour les formulations d’hydrogel de fibrinogen/collagène. (A) Solution de gel fibrinogen qui a formé des touffes et a commencé à geler prématurément avec fibrinogen non résolu adhérant au tube. (B) Solution de gel fibrinogen qui s’est complètement dissoute, la solution est claire et légèrement plus visqueuse. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Il est recommandé de travailler aussi vite que possible lors de l’ensemencement de la suspension cellulaire hydrogel sur les inserts, comme le composant fibrinogen va commencer à se croiser avec l’ajout de thrombine. Préparez de plus petits volumes de travail à la fois lorsque vous travaillez avec des suspensions de gel à des concentrations plus élevées pour empêcher le gel de se croiser pendant l’ensemencement. Ce dernier aura un effet sur la distribution et la quantité de gel ensemencée sur chaque puits. L’ordre d’ajout des composants est essentiel, dans ce protocole, nous avons fourni un flux de travail rationalisé pour empêcher les gels de se croiser prématurément. En raison de la viscosité de la suspension gel hydrogel travailler avec une pointe de pipette coupée est conseillé pendant le mélange et la mesure. Lors du mélange de la suspension assurez-vous que cela est fait rapidement et uniformément pour créer une suspension homogène. Le mélange inégal se traduira par un gel hétérogène qui affectera négativement les résultats, voir la figure 12.
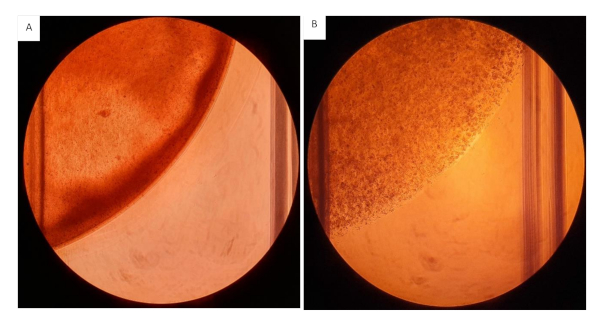
Figure 12 : Gels de collagène/fibrinogen ensemencés sur 12 plaques de puits. Tous les gels ensemencés à un volume de 200 μL contenant 2mg/mL collagène et 20 mg/mL Fibrinogen avec 2,0 x 106 cellules/mL. (A) Gel Hydrogel avec consistance hétérogène, distribution inégale visible des hydrogels. (B) Hydrogels homogènement mélangés. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
À la suite de l’optimisation du protocole, le modèle a été évalué afin de déterminer les propriétés biophysiques des modèles. Les données de rhéologie ont prouvé que notre modèle, composé des composants physiologiquement pertinents de matrice extracellulaire à savoir le type de collagène I et le fibrinogen, a pu imiter les propriétés bio-physiques d’un foie fibrotique, cirrhotic et HCC28,29,30,31,32. La récapitulation de la raideur hépatique dans les modèles 3D pour HCC est d’une importance considérable et est souvent négligée pendant le développement du modèle. La rigidité accrue de foie est liée à la résistance chimiothérapeutique, à la prolifération, à la migration, et à la dormance dans HCC38. Tandis que l’activation des cellules stellates hépatiques dans HCC est associée à la rigidité extracellulaire accrue de matrice, avec plusieurs voies de signalisation liées à ces cellules stellates hépatiques montrant la méchanosensibilité39.
L’inclusion de cellules associées au stroma telles que les cellules stellaires hépatiques et les cellules endothéliales dans le développement de modèles 3D pour HCC est devenue de plus en plus pertinente. Des études montrent que les sphéroïdes multicellulaires composés de cellules stellates hépatiques et HCC ont entraîné une résistance chimiothérapeutique accrue et une migration invasive, tout en imitant l’apparence tumorale HCC in vivo, par rapport à un modèle de souris PXT et des échantillons humains de tissu HCC17. Une étude similaire menée par Jung et coll., 2017 a trouvé le sphéroïde multicellulaire se composant du carcinome hépatocellulaire (Huh-7) et des cellules endothéliales (HUVEC) ont favorisé la vascularisation et l’agressivité22. Ces sphéroïdes ont montré la viabilité à des concentrations significativement plus élevées de doxorubicine et de sorafenib par rapport aux sphéroïdes de monoculture huh-722. L’évaluation de la viabilité et de la réponse de notre modèle à la doxorubicine, avec des valeurs de rigidité correspondant à celle de HCC et l’inclusion des cellules associées au stroma (LX2 et HUVEC), a montré une diminution similaire en réponse à la chimiothérapie par rapport à un modèle de co-culture 2D. Ainsi, imitant efficacement la résistance aux médicaments généralement observée chez les patients et d’autres modèles 3D HCC.
Comme il s’agit d’un système modulaire, le modèle peut être fortifié par l’ajout d’autres composants de matrice extracellulaire, à savoir la laminine et l’acide hyaluronique. Alternativement, les hydrogels actuels utilisés dans ce modèle peuvent être remplacés par des hydrogels synthétiques tels que l’alginate de sodium ou le chitosan. D’autres modifications au modèle actuel peuvent être la substitution des lignées cellulaires avec des cultures cellulaires primaires pour produire un modèle encore plus physiologiquement pertinent ou en utilisant des combinaisons d’autres lignées tumorales et stromales.
Nous avons ainsi développé avec succès un modèle 3D avec des propriétés biophysiques tunable pour étudier les interactions tumeur-stroma dans HCC. Nous avons trouvé notre modèle plus représentatif de la situation in vivo par rapport aux cultures 2D traditionnelles en réponse à la doxorubicine. Cependant, il reste encore beaucoup à faire, nous espérons caractériser largement ce modèle et explorer le modèle comme une plate-forme métastatique possible pour répondre à des questions plus complexes et urgentes qui restent dans l’étude HCC.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par des subventions obtenues de la Fondation suédoise contre le cancer (Cancerfonden, CAN2017/518), de la Société suédoise de recherche médicale (SSMF, S17-0092), de la fondation O.E. och Edla Johanssons et de la fondation Olga Jönssons. Ces sources de financement n’ont pas participé à la conception de l’étude; la collecte, l’analyse et l’interprétation des données; rédaction du rapport; et dans la décision de soumettre l’article pour publication. L’impression 3D d’espaceurs personnalisés utilisés dans ce protocole a été effectuée à U-PRINT : l’installation d’impression 3D de l’Université Uppsala au Domaine disciplinaire de la médecine et de la pharmacie, U-PRINT@mcb.uu.se. Nous tenons à remercier Paul O’Callaghan pour sa précieuse contribution à notre projet.
matériels
| Name | Company | Catalog Number | Comments |
| AlamarBlue (Resazurin sodium salt) | Sigma | 211-500 | Prepare according to manufacturesr recommendations |
| Antibiotic Antimycotic Solution (100×), Stabilized | Sigma | A5955-100ML | |
| Aprotinin Protease Inhibitor | Thermo Fisher Scientific | 78432 | |
| Calcium chloride (CaCl2) | Sigma | C1016-2.5KG | Anhydrous, granular, ≤7.0 mm, ≥93.0% |
| CO2 Incubator | Kebo Biomed Sweden | ||
| Corning Black, clear flat bottom 96-well plate | Sigma | CLS3904-100EA | |
| Corning HTS Transwell-24 well permeable supports | Sigma | CLS3396-2EA | HTS Transwell-24 units w/ 0.4 μm pore polycarbonate membrane and 6.5 mm inserts, TC-treated, sterile, 2/cs |
| Discovery Hybrid Rheometer 2 | TA instruments, Sollentuna, Sweden | ||
| DMEM, high glucose, GlutaMAX supplement (LX2 and HepG2 cells) | Thermo Fisher Scientific | 61965059 | Supplemented with 10% v/v FBS and 1% v/v antibiotic antimycotic solution |
| Endothelial Cell Growth Medium (500 ml) (HUVEC) | Cell Applications, Inc | 211-500 | |
| Fetal Bovine Serum, qualified, One Shot format, New Zealand | Thermo Fisher Scientific | A3160902 | |
| Fibrinogen type I-S from bovine plasma | Sigma | F8630-10G | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| Hanks' balanced salt solution | Sigma | H9394-500ML | Modified, with sodium bicarbonate, without calcium chloride and magnesium sulfate |
| Labogene scanspeed 416 centrifuge | Labogene, Sweden | ||
| Laminar flow hood | Kebo Biomed Sweden | ||
| Mettler Toledo AG245 Analytical Balance | Mettler Toledo | ||
| Nikon TMS Light microscope | Nikon, Japan | ||
| Phosphate buffered saline tablet | Sigma | P4417-100TAB | Prepare according to manufacturers recommendation |
| Rat tail Collagen Type I 5 mg/mL | Ibidi | 50201 | |
| Sodium chloride (NaCl) | Sigma | S7653-1KG | |
| Sodium Hydroxide (NaOH) | Merck | B619298 | |
| TC20 Automated cell counter | BioRad | ||
| TC20 cell counter counting slides | BioRad | ||
| Thrombin from bovine plasma | Sigma | T9549 | Powder, suitable for cell culture, ≥1,500 NIH units/mg protein (E1%/280 = 19.5) |
| Trypsin (2.5%) 10x | Thermo Fisher Scientific | Dilute to 1x in PBS | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T6414-100ML | Solution, sterile-filtered |
Références
- Galle, P. R., et al. EASL Clinical practice guidelines: Management of hepatocellular carcinoma. Journal of Hepatology. 69, 182-236 (2018).
- Marquardt, J. U., Andersen, J. B., Thorgeirsson, S. S. Functional and genetic deconstruction of the cellular origin in liver cancer. Nature Reviews Cancer. 15, 653-667 (2015).
- Balogh, J., et al. Hepatocellular Carcinoma: A review. Journal of Hepatocellular Carcinoma. 3, 41-53 (2016).
- Perumpail, R. B., Womg, R. J., Ahmed, A., Harrison, S. A. Hepatocellular carcinoma in the setting of non-cirrhotic non-alcoholic fatty liver disease and the metabolic syndrome: US experience. Digestive Diseases and Science. 60, 3142-3148 (2016).
- Baglieri, J., Brenner, D. A., Kisseleva, T. The role of fibrosis and liver associated fibroblasts in the pathogenesis of hepatocellular carcinoma. International Journal of Molecular Sciences. 20, 1723 (2019).
- Arriazu, E., et al. Extracellular matrix and liver disease. Antioxidants & Redox Signaling. 21 (7), 1078-1097 (2014).
- Malarkey, D. E., Johnson, K., Ryan, L., Boorman, G., Maronpot, R. R. New insight into functional aspects of liver morphology. Toxicologic Pathology. 33, 27-34 (2005).
- Moreira, R. K. Hepatic stellate cells and liver fibrosis. Archive of Pathology and Lab Medicine. 131, 1728-1734 (2007).
- Hernandez-Gea, V., Toffanin, S., Friedman, S. L., Llovet, J. M. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma. Gastroenteroloy. 144, 512-527 (2013).
- Amicone, L., Marchetti, A. Microenvironment and tumor cells: two targets for new molecular therapies of hepatocellular carcinoma. Translational Gastroenterology and Hepatology. 3, 24 (2018).
- Rawal, P., et al. Endothelial cell-derived TGF-B promotes epithelial-mesenchymal transition via CD133 in Hbx-Infected Hepatoma cells. Frontiers in Oncology. 9 (308), 1-9 (2019).
- Yoo, J. E., et al. Progressive enrichment of stemness features and tumour stromal alterations in multistep hepatocarcinogenesis. PLoS One. 12 (3), 0170465 (2017).
- Landry, B. D., et al. Tumor-stroma interactions differentially alter drug sensitivity based on the origin of stromal cells. Molecular Systems Biology. 14, 8332 (2018).
- Le, B. D., et al. Three-dimensional hepatocellular carcinoma/fibroblast model on a nanofibrous membrane mimics tumor cell phenotypic changes and anticancer drug resistance. Nanomaterials. 8 (64), 1-11 (2018).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14, 6999-7010 (2017).
- Hoarau-Véchot, J., Rafii, A., Touboul, C., Pasquier, J. Halfway between 2D and animal models: Are 3D cultures the ideal tool to study cancer-microenvironment interactions. International Journal of Molecular Sciences. 19 (181), 1-24 (2018).
- Khawar, I. A., et al. Three Dimensional Mixed-Cell Spheroids Mimic Stroma-Mediated Chemoresistance and Invasive Migration in hepatocellular carcinoma. Neoplasia. 20, 800-812 (2018).
- Elliott, N. T., Yuan, F. A review of three-dimensional in vitro tissue models for drug discovery and transport studies. Journal of Pharmaceutical Sciences. 100 (1), 59-74 (2010).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: focus on tumor spheroid model. Pharmacology Therapy. 163, 94-108 (2016).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Jung, H. R., et al. Cell spheroids with enhanced aggressiveness to mimic human liver cancer in vitro and in vivo. Scientific Reports. 7, 10499 (2017).
- Eilenberger, C., Rothbauer, M., Ehmoser, E. -. K., Ertl, P., Küpcü, S. Effect of spheroidal age on sorafenib diffusivity and toxicity in a 3D hepg2 spheroid model. Scientific Reports. 9, 4863 (2019).
- Wrzesinski, K., Fey, S. J. After trypsinisation, 3D spheroids of C3A hepatocytes need 18 days to re-establish similar levels of key physiological functions to those seen in the liver. Toxicology Research. 2 (2), 123-135 (2013).
- Wrzesinski, K., et al. Human liver spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation. Toxicology Research. 2 (3), 163-172 (2013).
- Mazza, G., et al. Decellularized human liver as a natural 3D-scaffold of liver bioengineering and transplantation. Scientific Reports. 5, 13079 (2015).
- Ma, X., et al. Rapid 3D bioprinting of decellularized extracellular matrix with regionally varied mechanical properties and biomimetic microarchitecture. Biomaterials. 185, 310-321 (2018).
- Mueller, S., Sandrin, L. Liver stiffness: a novel parameter for the diagnosis of liver disease. Hepatic Medicine: Evidence and Research. 2, 49-67 (2010).
- Wang, M. H., et al. In vivo quantification of liver stiffness in a rat model of hepatic fibrosis with acoustic radiation force. Ultrasound in Medicine & Biology. 35 (10), 1709-1721 (2009).
- Georges, P. C., et al. Increased liver stiffness of the rat liver precedes matrix deposition: implications for fibrosis. American Journal of Physiology - Gastrointestinal and Liver Physiology. 293, 1147-1154 (2007).
- Massironi, S., et al. et al. Liver stiffness and hepatocellular carcinoma: is it really useful. Journal of Hepatology. 58, 293 (2013).
- Singh, S., et al. Liver stiffness is associated with risk of decompensation, liver cancer, and death in patients with chronic liver diseases: A systematic review. Clinical Gastroenterology and Hepatology. 11, 1573-1584 (2013).
- Yang, T. S., Wang, C. H., Hsieh, R. K., Chen, J. S., Fung, M. C. Gemcitabine and doxorubicin for the treatment of patients with advanced hepatocellular carcinoma: a phase I-II trail. Annals of Oncology. 13, 1771-1778 (2002).
- Le Grazie, M., Biagini, M. R., Tarocchi, M., Polvani, S., Galli, A. Chemotherapy for hepatocellular carcinoma: the present and the future. World Journal of Hepatology. 9 (21), 907-920 (2017).
- Saneyasu, T., Akhtar, R., Sakai, T. Molecular cues guiding matrix stiffness in liver fibrosis. BioMed Research International. 2016, 1-11 (2016).
- Zuliani-Alvarez, L., Midwood, K. S. Fibrinogen-related proteins in tissue repair: how a unique domain with common structure controls diverse aspects of wound healing. Advances in Wound Care. 4 (5), 273-285 (2015).
- Smit, T., et al. Characterization of an alginated encapsulated LS180 spheroid model for anti-colorectal cancer compound screening. ACS Medicinal Chemistry Letters. 11 (5), 1014-1021 (2020).
- Schrader, J., et al. Matrix stiffness modulates proliferation, chemotherapeutic response, and dormancy in hepatocellular carcinoma cells. Hepatology. 53 (4), 1192-1205 (2011).
- Lachowski, D., et al. Matrix stiffness modulates the activity of MMP-9 and TIMP-1 in hepatic stellate cells to perpetuate fibrosis. Scientific Reports. 9, 7299 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon