Method Article
Imagerie optique basée sur des photodiodes pour l’enregistrement de la dynamique des réseaux avec une résolution mononeurone chez les invertébrés non transgéniques
Dans cet article
Résumé
Ce protocole présente une méthode d’imagerie de l’activité de la population neuronale avec une résolution unicellulaire chez des espèces d’invertébrés non transgéniques à l’aide de colorants sensibles à la tension d’absorbance et d’un réseau de photodiodes. Cette approche permet un flux de travail rapide, dans lequel l’imagerie et l’analyse peuvent être poursuivies au cours d’une seule journée.
Résumé
Le développement de préparations d’invertébrés transgéniques dans lesquelles l’activité d’ensembles spécifiques de neurones peut être enregistrée et manipulée avec la lumière représente une avancée révolutionnaire pour les études de la base neuronale du comportement. Cependant, un inconvénient de ce développement est sa tendance à concentrer les chercheurs sur un très petit nombre d’organismes « concepteurs » (par exemple, C. elegans et Drosophila),ce qui pourrait avoir un impact négatif sur la poursuite d’études comparatives sur de nombreuses espèces, ce qui est nécessaire pour identifier les principes généraux de la fonction du réseau. Le présent article illustre comment l’enregistrement optique avec des colorants sensibles à la tension dans le cerveau d’espèces de gastéropodes non transgéniques peut être utilisé pour révéler rapidement (c’est-à-dire au cours du temps d’expériences uniques) les caractéristiques de l’organisation fonctionnelle de leurs réseaux neuronaux avec une résolution unicellulaire. Nous décrivons en détail les méthodes de dissection, de coloration et d’enregistrement utilisées par notre laboratoire pour obtenir des traces de potentiel d’action de dizaines à ~ 150 neurones au cours de programmes moteurs pertinents sur le plan comportemental dans le SNC de plusieurs espèces de gastéropodes, dont une nouvelle en neurosciences - le nudibranche Berghia stephanieae. L’imagerie est réalisée avec des colorants sensibles à la tension d’absorbance et un réseau de photodiodes à 464 éléments qui échantillonne à 1 600 images / seconde, assez rapidement pour capturer tous les potentiels d’action générés par les neurones enregistrés. Plusieurs enregistrements de plusieurs minutes peuvent être obtenus par préparation avec peu ou pas de blanchiment de signal ou de phototoxicité. Les données optiques brutes recueillies par les méthodes décrites peuvent ensuite être analysées au moyen de diverses méthodes illustrées. Notre approche d’enregistrement optique peut être facilement utilisée pour sonder l’activité du réseau dans une variété d’espèces non transgéniques, ce qui la rend bien adaptée aux études comparatives de la façon dont le cerveau génère le comportement.
Introduction
Le développement de lignées transgéniques d’invertébrés tels que la drosophile et C. elegans a fourni des systèmes puissants dans lesquels les bases neuronales du comportement peuvent être interrogées et manipulées optiquement. Cependant, ces préparations spéciales peuvent avoir l’inconvénient de réduire l’enthousiasme pour les études des circuits neuronaux d’espèces non transgéniques, en particulier en ce qui concerne l’introduction de nouvelles espèces dans la recherche en neurosciences. Se concentrer exclusivement sur un ou deux systèmes modèles est préjudiciable à la recherche de principes généraux de la fonction réseau, car les études comparatives représentent une voie essentielle par laquelle de tels principes sont découverts1,2,3,4. Notre objectif ici est de démontrer une approche d’imagerie à grande échelle pour obtenir un aperçu rapide de la structure fonctionnelle des réseaux de neurones gastéropodes, dans le but de faciliter les études comparatives de la fonction des réseaux neuronaux.
Les mollusques gastéropodes tels que Aplysia, Lymnaea, Tritonia, Pleurobranchaea et d’autres ont longtemps été utilisés pour étudier les principes de la fonction des réseaux neuronaux, en grande partie parce que leurs comportements sont médiés par de grands neurones souvent identifiables individuellement situés à la surface des ganglions, ce qui les rend facilement accessibles aux techniques d’enregistrement5. Dans les années 1970, des colorants sensibles à la tension (VSD) pouvant s’intégrer dans la membrane plasmique ont été développés qui ont rapidement permis les premiers enregistrements sans électrode des potentiels d’action générés par plusieurs neurones6. Ici, nous démontrons notre utilisation des VSD pour examiner l’activité du réseau chez plusieurs espèces de gastéropodes, dont une nouvelle en neurosciences, Berghia stephanieae. Le dispositif d’imagerie est un réseau de photodiodes (PDA) à 464 éléments disponible dans le commerce qui échantillonne à 1 600 images/ seconde(Figure 1),qui, lorsqu’il est utilisé avec des VSD à absorption rapide, révèle les potentiels d’action de tous les neurones enregistrés7. Les signaux enregistrés par toutes les diodes sont affichés immédiatement après l’acquisition et superposés à une image du ganglion dans le logiciel d’acquisition PDA, ce qui permet d’étudier les neurones d’intérêt avec des électrodes pointues dans la même préparation8,9.
Dans les données PDA brutes, de nombreuses diodes enregistrent de manière redondante les plus gros neurones, et beaucoup contiennent également des signaux mixtes provenant de plusieurs neurones. Un tournant a été le développement d’une méthode automatisée de tri des pics utilisant l’analyse indépendante des composants pour traiter rapidement chaque ensemble de données PDA brutes à 464 canaux en un nouvel ensemble de traces, dans lequel chaque neurone enregistré apparaît dans une trace séparée contenant uniquement ses potentiels d’action10,11.
Dans cet article, nous décrivons les étapes essentielles impliquées dans l’obtention d’enregistrements de potentiel d’action à grande échelle à partir des systèmes nerveux des gastéropodes avec un réseau de photodiodes et des VSD à absorption rapide. Nous illustrons en outre des méthodes analytiques qui peuvent être utilisées pour regrouper et cartographier les neurones enregistrés optiquement par rapport à leurs ensembles fonctionnels, et pour caractériser des caractéristiques au niveau de la population qui ne sont souvent pas apparentes par une simple inspection des traces de tir12,13.
Protocole
REMARQUE : Le flux de travail décrit ci-dessous est résumé à la figure 2.
1. Minimiser les vibrations
- Si possible, assurez-vous que la plate-forme se trouve au rez-de-chaussée et utilisez une table d’isolation à ressort, qui amortit une plus large gamme de fréquences de vibration que les tables d’air.
- Si vous utilisez une table à ressort, assurez-vous qu’elle flotte (elle doit être ajustée chaque fois que l’on ajoute ou enlève quelque chose de la table).
- Réduisez autant que possible le bruit basé sur les vibrations dans la salle d’imagerie, même au point de couper le flux d’air pendant l’imagerie si nécessaire. Minimiser toute vibration provenant de la turbulence du fluide dans les systèmes de perfusion.
REMARQUE: La préparation neuronale ne doit pas bouger pendant l’acquisition. Les mouvements de toute nature produisent des décalages des bords de contraste à travers les diodes, conduisant à des signaux artéfactuels. Si la procédure implique un stimulus lors de l’acquisition, elle ne doit pas induire de mouvement de préparation.
2. Exécutez un test sténopé pour permettre un alignement correct des photos de ganglions avec les données PDA
- Placez un morceau de papier d’aluminium avec 3 petits trous percés sur une lame de microscope. Prenez une image des trois trous avec l’appareil photo numérique monté sur son photoport parfocal.
- À l’aide du logiciel d’imagerie fourni avec le PDA, acquérez un fichier court (par exemple, 5 s). Au milieu de l’acquisition, appuyez sur la table pour induire des artefacts de vibration qui seront très visibles autour des bords des trous d’épingle, ce qui permet à l’image des trous d’épingle d’être alignée avec précision avec les données optiques.
- Utilisez la fonction Superposition dans le logiciel d’imagerie, qui se trouve dans l’élément de menu «Afficher | | de superposition de page Superposition de traces avec | d’image externe Superposer l’image», pour superposer les données de la diode sur la photo des trous d’épingle, puis ajuster de manière itérative les paramètres x, y et de grossissement de la photo jusqu’à ce que les trous d’épingle se trouvent directement au-dessus des artefacts du sténopé dans les données de la diode.
- Enregistrez ces chiffres pour aligner les images de préparation prises avec l’appareil photo avec les données de la diode dans les expériences futures.
REMARQUE: L’alignement du sténopé du PDA ne doit être effectué qu’une seule fois après le montage du PDA sur le microscope, jusqu’à ce qu’il soit tourné ou retiré, après quoi il doit être refait.
- Enregistrez ces chiffres pour aligner les images de préparation prises avec l’appareil photo avec les données de la diode dans les expériences futures.
3. Dissections pour trois espèces de gastéropodes marins
- Pour les espèces qui atteignent une grande taille, telles que Tritonia et Aplysia, commencez par des individus plus petits, qui ont des ganglions plus minces et moins opaques, ce qui facilite l’obtention d’une lumière suffisante pour un signal-bruit optimal.
- Avoir de l’eau de mer artificielle filtrée prête à être utilisée comme solution saline pour les dissections et les expériences d’imagerie.
REMARQUE: Dans toutes les étapes ultérieures du protocole, « solution saline » désigne l’eau de mer artificielle. - Dissection de Tritonia diomedea
- Placez un animal au réfrigérateur pendant environ 20 minutes pour l’anesthésier.
- Pour les animaux plus gros, exposez le cerveau en tenant l’animal dans une main, en laissant la tête se draper sur l’index pour exposer le « cou ». Pour les petits animaux, épinglez-les sur la face dorsale dans un plat de dissection bordé de cire avant d’exposer le cerveau.
- À l’aide de ciseaux de dissection, faites une incision médiane de 3 à 4 cm sur la face dorsale de l’animal, au-dessus de la masse buccale (qui peut être ressentie à travers la paroi du corps).
REMARQUE: La partie nécessaire du SNC, composée de ganglions cérébropleuraires et pédaliers bilatéraux fusionnés, est orange et distincte en apparence du tissu environnant; il se trouve immédiatement postérieur aux rhinophores et au sommet de la masse buccale. - Excisez le SNC en coupant les nerfs qui innervent le corps de l’animal à l’aide de pinces et de ciseaux à microdissection, en gardant intacts tous ces nerfs reliant les ganglions centraux. Laissez une longue longueur de nerf de pédale 3 (PdN3), ou quel que soit le nerf qui sera stimulé.
- Utilisez des broches minutien pour fixer le SNC au fond d’un plat doublé d’élastomère rempli de solution saline pour une dissection ultérieure. Maintenez la température de préparation à 11 °C en perfusant le plat avec une solution saline fournie avec un système de refroidissement Peltier en ligne à rétroaction contrôlée à l’aide d’une pompe péristaltique.
- À l’aide de pinces et de ciseaux à microdissection, retirez soigneusement la couche lâche du tissu conjonctif autour du SNC. Laissez la gaine fine adhérer étroitement aux ganglions.
- Tremper brièvement (~10 s) les ganglions dans une solution de glutaraldéhyde à 0,5% dans une solution saline. Replacez les ganglions dans le plat tapissé d’élastomère perfusé de solution saline, ce qui permet à la solution saline de laver le glutaraldéhyde avant de commencer la coloration VSD.
REMARQUE: Cette fixation légère du tissu conjonctif et de ses muscles intrinsèques aidera à prévenir le mouvement pendant l’imagerie.
- Dissection d’Aplysia californica
- Anesthésier un animal d’environ 40 g en injectant environ 20 mL de MgCl2 de 350 mM dans le corps à travers la surface ventrale (pied).
- Utilisez des épingles pour positionner le côté ventral de l’animal vers le haut dans un plat de dissection bordé de cire.
- À l’aide de ciseaux à dissection, faites une incision médiane de 2 à 3 cm le long de l’étendue la plus antérieure du pied. Épinglez les lambeaux du pied de chaque côté de l’incision pour révéler une partie du SNC et de la masse buccale.
REMARQUE: La partie nécessaire du SNC, constituée de ganglions cérébraux fusionnés et de ganglions pleuraux et pédales bilatéraux étroitement apposés, est jaune-orange et distincte en apparence du tissu environnant; il repose dorsale et postérolère à la masse buccale musculaire bulbeuse. - Utilisez des pinces et des ciseaux à dissection pour disséquer soigneusement la masse buccale, révélant les ganglions cérébraux.
- Excisez le SNC en coupant les nerfs qui innervent le corps de l’animal à l’aide de pinces et de ciseaux à microdissection, en gardant intacts tous ces nerfs reliant les ganglions centraux. Laissez une longue longueur de nerf de pédale 9 (PdN9), ou quel que soit le nerf qui sera stimulé.
- Utilisez des broches de minutien pour positionner le SNC dans un plat tapissé d’élastomère rempli de solution saline. Maintenir la température de préparation à 15-16 °C en perfusant le plat avec une solution saline passant à travers un dispositif de refroidissement Peltier.
- À l’aide de pinces et de ciseaux à microdissection, retirez l’excès de tissu conjonctif du SNC et disséquez une partie superficielle de la gaine sur le ganglion ou les ganglions à imager. Faites attention pendant ce processus à ne pas faire de trou dans la gaine, ce qui entraînerait la débordement des neurones de l’intérieur.
- Tremper brièvement (~20 s) les ganglions dans une solution de glutaraldéhyde à 0,5% dans une solution saline. Replacez les ganglions dans le plat tapissé d’élastomère perfusé de solution saline, ce qui permet à la solution saline de laver le glutaraldéhyde avant de commencer la coloration VSD.
- Dissection de Berghia stephanieae
- Placez un animal au réfrigérateur pendant environ 20 minutes pour l’anesthésier.
- À l’aide d’un plat doublé d’élastomère rempli de solution saline à température ambiante, placez des épingles à minutien dans la tête et la queue.
- À l’aide de ciseaux à microdissection, faites une incision dorsale de 5 à 7 mm superficielle au SNC.
REMARQUE: Les yeux, les taches sombres qui résident dans l’animal à côté du SNC, marquent commodément la position de la partie nécessaire du SNC, qui se compose de ganglions cérébropleuraires et pédaux fusionnés bilatéralement et se trouve au sommet de la masse buccale. - Exciser le SNC en coupant les nerfs qui innervent le corps de l’animal à l’aide de pinces et de ciseaux à microdissection. Laissez tout nerf stimulé suffisamment longtemps pour une électrode d’aspiration.
4. Tachez la préparation avec un colorant sensible à la tension
- Préparez des solutions d’origine RH155 (également appelée NK3041) ou RH482 (également appelée NK3630 ou JPW1132).
- RH155 : Dissoudre 5,4 mg de colorant solide dans 1 mL de 100 % d’EtOH, en pipetant 29 μL dans chacun des 34 tubes de microcentrifugation. Avec le contenu de chaque tube exposé à l’air, laissez-les sécher pendant la nuit dans l’obscurité. Coiucher et placer les aliquotes solides résultantes de RH155, contenant chacune 0,15 mg, dans un congélateur à -20 °C.
- RH482 : Dissoudre 2 mg de colorant solide dans 100 μL de DMSO, diviser la solution en 20 aliquotes de 5 μL, contenant chacune 0,1 mg d’HR482, et conserver dans un congélateur à -20 °C.
REMARQUE: Pour Tritonia et Aplysia, la perfusion de bain ou l’application de pression peut être utilisée pour charger le VSD RH155 dans les membranes des neurones dans la préparation. L’application de pression a l’avantage d’exposer uniquement le ganglion imagé au VSD.
- Pour la perfusion au bain, ajouter 5 mL de solution saline à chacun des deux aliquotes ci-dessus de RH155 solide et de vortex en solution, produisant une solution combinée de 10 mL contenant 0,03 mg/mL d’HR155.
- Perfuser dans l’obscurité (pour éviter le photobleaching) pendant 1 à 1,5 h à 11 °C pour Tritonia et à 16 °C pour Aplysia. Maintenez la température en faisant passer la solution de perfusion à travers un système de refroidissement Peltier.
- Pour l’application sous pression, ajouter 500 μL de solution saline à une aliquote de RH155 et vortex pour produire une concentration de colorant de 0,3 mg/mL.
- Aspirer environ 200 μL de la solution dans un tube en polyéthylène à l’aide d’un microdissuquant portatif, en s’assurant qu’il y a une bonne correspondance entre le diamètre du tube et le diamètre du ganglion à entérier.
- Utilisez un micromanipulateur pour placer soigneusement l’extrémité du tube sur le ganglion cible, en l’abaissant jusqu’à ce qu’il forme un joint serré sur le ganglion. Utilisez le type de système de refroidissement décrit ci-dessus pour maintenir les ganglions à la température souhaitée.
- Atténuez les lumières de la pièce pour éviter le photopaiement et tournez le bouton de l’applicateur de microdispenseur toutes les 5 minutes pour forcer plus de colorant sur le ganglion.
- Vérifiez à 30 minutes pour confirmer qu’une bonne coloration se produit, puis continuez pendant une durée totale de coloration d’environ 1 h.
- Pour la coloration à Berghia, ajouter 1 mL de solution saline à une aliquote congelée de RH482, et vortex pour dissoudre.
- Transférer 200 μL de cette solution dans un tube de microcentrifugation contenant 800 μL de solution saline et de vortex dans une solution, produisant une solution de coloration finale de 0,02 mg/ml d’HR482 dans une solution saline avec 0,1% de DMSO.
- Placez tout le SNC dans le tube de microcentrifugation, enveloppez le tube dans du papier d’aluminium pour éviter le photobleachage, et serrez-le à la main toutes les 5-6 minutes pendant environ 1 h. Conservez les 800 μL restants de la première solution au réfrigérateur et utilisez-les jusqu’à 3 jours pour tacher les préparations ultérieures.
5. Aplatir la préparation et la mettre en place pour la stimulation nerveuse
REMARQUE: Les étapes de cette section doivent être effectuées sous un éclairage minimal ou avec une lumière verte pour minimiser le photobleachage.
- Après la coloration, immerger le SNC dans une solution saline dans la chambre d’imagerie et le placer sous un microscope à dissection.
- Placez des morceaux de silicone (pour Tritonia ou Aplysia)ou des taches de vaseline (pour Berghia)à gauche et à droite du ganglion/ganglion à imager.
- Appuyez sur un morceau de verre ou de plastique de taille appropriée sur la préparation pour l’aplatir. Appuyez fermement mais pas autant fort pour endommager les neurones.
REMARQUE: Aplatir la surface convexe de la préparation de cette manière rendra un plus grand nombre de neurones parafocaux, augmentant ainsi le nombre de neurones enregistrés, et aidera en outre à immobiliser la préparation pendant l’imagerie. - Si vous stimulez un nerf pour provoquer un programme moteur fictif, préparez une électrode d’aspiration dont l’extrémité avant est approximativement aussi large que le diamètre du nerf. Pour ce faire, faites fondre soigneusement un segment de tube en polyéthylène PE-100 au-dessus d’une flamme tout en tirant doucement les deux extrémités du segment de tube, puis en coupant la conicité résultante au point souhaité.
- Aspirer un petit volume de solution saline à travers l’extrémité effilée d’une électrode d’aspiration en polyéthylène, suivie de l’extrémité du nerf à stimuler, en attachant une longueur de tube en polymère souple à paroi épaisse à l’extrémité arrière de l’électrode et en utilisant l’aspiration buccale pour appliquer une pression négative.
- Confirmez que la solution saline dans l’électrode manque de bulles qui pourraient interrompre la conduction électrique.
6. Préparation et optimisation pour l’imagerie
- Déplacez la chambre vers la plate-forme d’imagerie. Démarrez la perfusion saline à travers la chambre d’enregistrement et placez la sonde de température près de la préparation. Réglez le régulateur de température pour la température souhaitée pour l’espèce imagée (pour Tritonia, 11 °C, pour Aplysia, 15-16 °C, ou pour Berghia, 26-27 °C).
- Placez un fil d’argent chloré le long de l’électrode d’aspiration, en vous assurant qu’il entre en contact avec la solution saline dans l’électrode, et placez l’autre fil Ag-AgCl (le chemin de retour) dans la solution saline du bain, près de l’électrode d’aspiration.
- Abaissez la lentille d’immersion dans l’eau dans la solution saline. Fermez le diaphragme de base, puis soulevez ou abaissez le condenseur de sous-étage et ajustez la mise au point jusqu’à ce que les bords du diaphragme soient nettement mis au point, créant ainsi un éclairage Köhler.
- Concentrez-vous sur la région de la préparation à imager. Biais se concentrant sur les petits neurones plutôt que sur les plus grands, car les signaux optiques provenant de neurones plus grands sont plus susceptibles que les plus petits d’être enregistrés même s’ils sont légèrement flous.
- Prenez une photo du ganglion à imager avec l’appareil photo numérique parfocal.
- Avec l’interrupteur de gain du panneau de commande réglé sur 1x, vérifiez l’intensité lumineuse au repos (RLI) dans le logiciel d’imagerie en cliquant sur le bouton « RLI »et en vérifiant le RLI moyen des diodes. Ajustez le niveau de tension envoyé par un stimulateur à l’alimentation de la lampe LED et continuez à vérifier le niveau RLI moyen jusqu’à ce qu’il soit dans la plage souhaitée (généralement autour de 3-4 V).
REMARQUE: Des RRI élevés, correspondant à environ 3-4 V sur le PDA, sont souhaitables. Plus la lumière est élevée, meilleur est le rapport signal/bruit des signaux optiques, mais cela doit être mis en balance avec un taux de photoblage plus rapide à des RPI plus élevés. Ce risque est minimisé en utilisant des objectifs à NA élevé. Les objectifs d’immersion dans l’eau utilisés sont 10x/0,6 NA, 20x/0,95 NA, 40x/0,8 NA et 40x/1,15 NA.
- Réglez le commutateur de gain du panneau de commande sur 100x pour l’enregistrement.
- Si vous stimulez un nerf, réglez la tension, la fréquence et la durée souhaitées sur un stimulateur distinct de celui utilisé pour régler le niveau de lumière. Vérifiez que le déclenchement TTL entre le panneau de commande et le stimulateur est correctement configuré.
REMARQUE: Les paramètres de stimulus nerveux de l’échantillon chez chaque espèce sont les suivants: Tritonia PdN3, 2 s, train d’impulsions de 10 Hz de 5 ms, impulsions de 10 V; Aplysie PdN9, 2,5 s, train d’impulsions 20 Hz de 5 ms, impulsions 8 V; un nerf de pédale Berghia, 2 s, train d’impulsions de 10 Hz de 5 ms, impulsions de 5 V. - Vérifiez que le ressort ou la table d’air flotte.
7. Enregistrement optique
- Éteignez ou éteignez les lumières de la pièce, y compris tout éclairage fluorescent aérien.
- Définissez la durée de fichier souhaitée, le chemin d’accès et le nom du fichier, puis cliquez sur le bouton "Prendre des données" dans le logiciel d’imagerie pour acquérir des fichiers jusqu’à la capacité de la RAM disponible de l’ordinateur. Restez immobile pendant l’enregistrement optique, car de petites vibrations peuvent introduire de gros artefacts dans les données d’enregistrement optique.
REMARQUE: Pour les acquisitions qui dépasseraient la RAM disponible de l’ordinateur, un programme d’acquisition C ++ sur mesure est disponible par l’intermédiaire du Dr Jian-young Wu de l’Université de Georgetown. - Pour visualiser les données immédiatement après l’acquisition, utilisez la fonction Superimpose du logiciel d’imagerie pour superposer les données collectées par les 464 diodes sur l’image du ganglion prise avant la préparation7. Cliquez sur l’une des diodes représentées dans le logiciel pour développer ce qu’elles ont enregistré sur un écran de trace séparé.
- Obtenez un alignement exact des diodes par rapport à la préparation en entrant les facteurs x, y et de grossissement tels que déterminés précédemment par le test du sténopé.
- Pour maximiser la visibilité du potentiel d’action et améliorer le rendement des neurones pour le tri ultérieur des pointes14,imposez un filtre Butterworth passe-bande avec des coupures de 5 Hz et 100 Hz (disponibles dans les logiciels d’imagerie) pour éliminer le bruit à basse et haute fréquence.
- Pour enregistrer les données optiques filtrées sous forme de fichier texte pour une analyse plus approfondie dans une plate-forme de calcul scientifique, sélectionnez d’abord la case "Filtre TP" juste sous l’écran "Page" dans le logiciel d’imagerie. Ensuite,sélectionnez" Enregistrer la page au format ASCII " dans l’onglet "Sortie" et entrez le nom de fichier souhaité dans la boîte de dialogue qui apparaît.
Résultats
Tritonie
Le contact cutané avec son prédateur d’étoile de mer déclenche la nage d’évasion de Tritonia diomedea, consistant en une série rythmique de flexions du corps entier qui la propulsent vers la sécurité(Figure 3A). Dans les préparations cérébrales isolées, un bref stimulus pour pédaler le nerf 3 (PdN3) provoque le programme moteur de natation rythmique (SMP) pour ce comportement, qui est facilement reconnaissable dans les enregistrements optiques des ganglions de la pédale. La figure 3B illustre la disposition d’une expérience d’imagerie VSD conçue pour enregistrer l’activité de déclenchement des neurones sur la surface dorsale du ganglion gauche de la pédale Tritonia, sur lequel le PDA a été positionné, alors qu’un stimulus vers le PdN3 controlatéral (droit) provoque le SMP. Les données brutes et filtrées (filtre Butterworth passe-bande, coupures de 5 et 100 Hz) provenant de 20 diodes enregistrant l’activité avant, pendant et après la stimulation de PdN3 sont présentées dans les figures 3C, D respectivement. Le stimulus nerveux a été délivré 20 s dans le fichier de 2 minutes. Immédiatement après l’acquisition, les signaux mesurés par les 464 diodes du réseau d’enregistrement peuvent être affichés topographiquement sur une image de la préparation dans le logiciel d’imagerie (Figure 3E). À ce stade, de nombreuses traces contiennent des pics enregistrés de manière redondante à partir des mêmes neurones, et certaines traces contiennent des pics de plus d’un neurone. Le tri par pointe des traces de diodes filtrées avec l’ICA a donné 53 traces neuronales uniques, dont 30 sont montrées à la figure 3F. La cinétique des pics individuels peut être appréciée dans la figure 3G, qui développe un extrait de quatre traces de la figure 3F (boîte rouge); la précision de l’algorithme de tri des pointes ICA a déjà été vérifiée à l’aide d’enregistrements d’électrodes pointues simultanées, qui ont montré que tous les pics dans les traces triées correspondent à des pics enregistrés intracellulairement à partir de neurones individuels11,14.
Aplysie
Un stimulus de queue fortement aversif à Aplysia californica provoque une réponse d’évasion rythmique stéréotypée en deuxparties 15. La première phase de la réponse est un galop de plusieurs cycles de fentes de tête et de tractions de la queue qui déplacent l’animal rapidement vers l’avant. Ceci est généralement suivi d’une période de rampement, impliquant des vagues répétées de contractions musculaires de la tête à la queue qui poussent l’animal vers l’avant à une vitesse plus lente pendant plusieurs minutes(Figure 4A). Pour capturer ces programmes de moteur d’échappement dans des enregistrements optiques, le PDA a été concentré sur la surface dorsale du ganglion de la pédale droite dans une préparation cérébrale isolée, et une électrode d’aspiration a été placée sur le nerf de pédale controlatéral (gauche) 9 (PdN9; Figure 4B). Une minute après un enregistrement optique continu de 20 minutes(Figure 4C),PdN9 a été stimulé pour provoquer la séquence de programme du moteur au galop. Les distributions spatiales gaussiennes probabilistes des signaux des 81 neurones enregistrés ont été cartographiées sur le ganglion(Figure 4D). La réduction de dimensionnalité appliquée à l’enregistrement complet a révélé que les phases de galop (cyan) et de rampement (bleu foncé) du programme d’évacuation occupaient des zones distinctes et formaient des trajectoires différentes, en spirale et en boucle, respectivement, dans l’espace des composants principaux(Figure 4E).
Trois vidéos basées sur l’enregistrement d’Aplysia illustré à la figure 4 montrent d’autres types d’analyses qui peuvent être effectuées sur de tels ensembles de données. La vidéo 1 anime le déclenchement de tous les neurones enregistrés pendant toute la durée de l’enregistrement. La période post-stimulante initiale du programme de moteur d’échappement a été caractérisée par un galop, dans lequel l’activité dans le ganglion a été marquée par l’éclatement alterné de différents groupes fonctionnels (Vidéo 2). Le galop est ensuite passé à un crawl, dans lequel l’activité à travers les groupes neuronaux est restée largement phasique mais a supposé une trajectoire de rotation dans le sens inverse des aiguilles d’une montre dans le ganglion (Vidéo 3). Les deux dernières vidéos intègrent également le regroupement consensuel, qui révèle séparément le tir et l’emplacement des différents ensembles fonctionnels pour les phases de galop et de rampement de la réponse d’évacuation. Notez que de nombreux neurones affectés au même groupe dans les phases de galop et de rampement présentaient une proximité physique les uns avec les autres dans le ganglion, ce qui est cohérent avec les résultats précédents12.
Berghia
Le nudibranche aeolidé Berghia stephanieae (Figure 5A) représente un nouveau système modèle pour les neurosciences. La configuration d’imagerie pour une expérience typique de Berghia est illustrée à la figure 5B. Pour provoquer une activité neuronale à grande échelle, une électrode d’aspiration a été placée sur le nerf de pédale gauche le plus proéminent, et un stimulus nerveux a été délivré 30 s dans un enregistrement de 2 minutes. Les traces traitées par l’ICA ont révélé une activité spontanée et évoquée par stimulus dans 55 neurones(Figure 5C). La détection communautaire par regroupement consensuel a identifié dix ensembles fonctionnels distincts, qui sont représentés à la figure 5D dans un graphique de réseau et à la figure 5E, qui réorganise les traces montrées à la figure 5C en fonction de leurs affectations de clustering. Les distributions gaussiennes des signaux de tous les neurones enregistrés sont superposées à une image de la préparation dans la figure 5F pour indiquer les positions des 55 neurones enregistrés.

Figure 1 : Vues de la plate-forme d’imagerie optique et du réseau de photodiodes (PDA). (A) La plate-forme d’imagerie optique, comprenant le PDA, l’appareil photo numérique, le microscope et la scène. (B) La conception interne du PDA, dans laquelle la fibre optique relie l’ouverture d’imagerie à 464 photodiodes. Une rangée d’amplificateurs est située au-dessus des photodiodes. (C) Face hexagonale de l’ouverture d’imagerie, sur laquelle la zone à imager est focalée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Organigramme illustrant le flux de travail essentiel pour obtenir des enregistrements optiques. Les étapes essentielles du protocole d’imagerie VSD, de la dissection et de la coloration aux détails de l’imagerie, sont décrites dans cet organigramme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
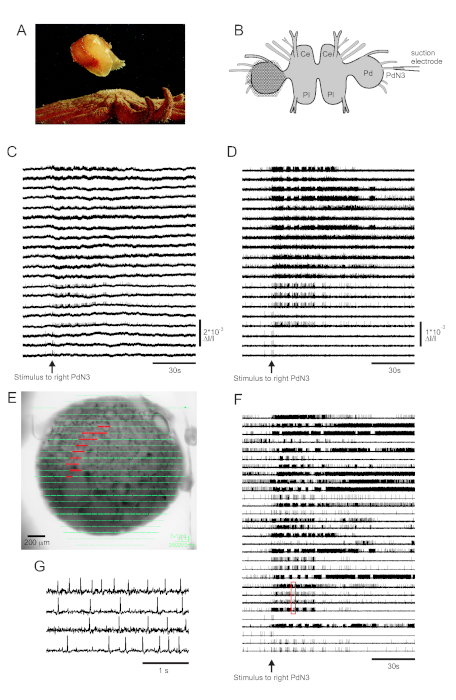
Figure 3 : Résultats de Tritonia diomedea, illustrant des données brutes, filtréeset triées par pics. (A) Tritonia s’échappant de l’étoile de mer prédatrice Pycnopodia helianthoides par sa nage, qui consiste en une alternance de flexions dorsales et ventrales du corps. (B) Schéma de la configuration de l’imagerie. Ce = lobe cérébral du ganglion cérébropleural; Pl = lobe pleural du ganglion cérébropleural; = ganglion de pédale. (C) Données brutes de 20 photodiodes, affichant l’activité dans le ganglion de la pédale gauche à la stimulation du PdN3 controlatéral (stimulus indiqué par la flèche). (D) Données filtrées provenant des mêmes diodes qu’en C (filtre Butterworth passe-bande de 5 et 100 Hz). (E) Sortie logicielle d’imagerie dans laquelle les traces compressées collectées par les 464 diodes sont superposées topographiquement sur une image de la préparation. Les positions des 20 diodes dont les traces sont représentées en C et D sont surlignées en rouge. (F) Trente traces sélectionnées d’un seul neurone générées par tri des pointes via ICA. (G) Une vue étendue de quatre traces d’un seul neurone, correspondant à la boîte rouge en F,affiche leurs potentiels d’action à une résolution temporelle plus élevée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
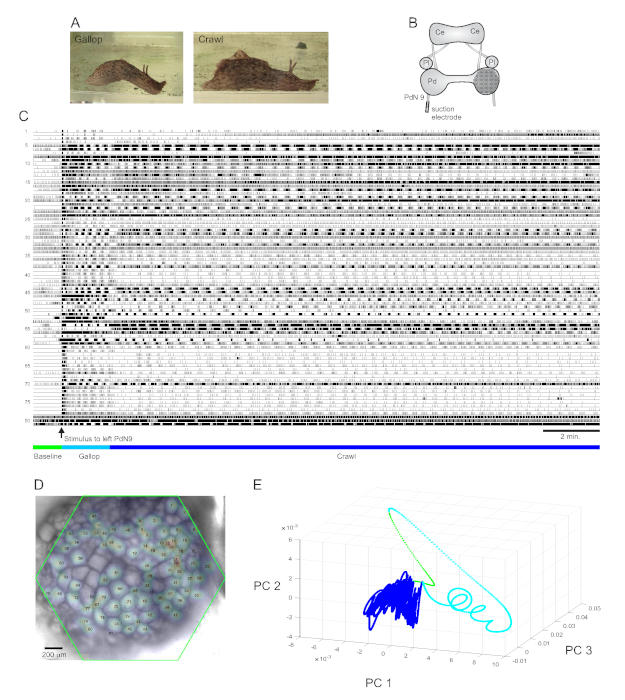
Figure 4: Résultats d’Aplysia californica, illustrant l’enregistrement de longue durée, la cartographie du signal et la réduction de la dimensionnalité. (A) Les deux phases du programme de moteur d’échappement séquentiel d’Aplysia, le galop et le crawl. (B) Schéma de la configuration de l’imagerie. Ce = ganglion cérébral; Pl = ganglion pleural; = ganglion de pédale. (C) Enregistrement de 20 min de 81 neurones dans le ganglion de la pédale droite répondant à un stimulus au PdN9 controlatéral (indiqué par la flèche). Les barres vertes, cyan et bleu foncé sous les traces indiquent respectivement la période de pré-stimulus, le galop et les phases de rampement du programme de moteur d’échappement. (D) Une image de la préparation avec des distributions gaussiennes probabilistes cartographiées des emplacements des 81 sources de signaux neuronaux identifiées par l’ICA. Le contour vert représente la position de la face hexagonale du PDA par rapport au ganglion. Les nombres sur chaque gaussien correspondent aux nombres traces en C. (E) Réduction de la dimensionnalité à l’aide de l’analyse en composantes principales traçant les trois premières composantes principales les unes par rapport aux autres au cours du fichier de 20 minutes. Les époques de base pré-stimulante, de galop et de rampe sont indiquées en vert, cyan et bleu foncé, respectivement. Voir les vidéos 1-3 pour des animations de tir neuronal correspondant à cet enregistrement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
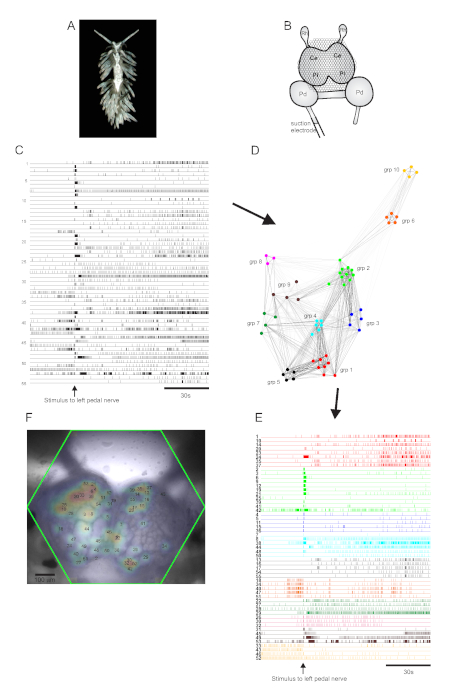
Figure 5: Résultats de Berghia stephanieae, une nouvelle espèce pour les neurosciences, illustrant la représentation graphique de réseau, le regroupement fonctionnelet lacartographie du signal bilatéral. (A) Un spécimen de Berghia. (B) Schéma de la configuration de l’imagerie. Ce = lobe cérébral du ganglion cérébropleural; Pl = lobe pleural du ganglion cérébropleural; = ganglion de pédale; Rh = ganglion rhinophore. (C) Traces montrant l’activité spontanée et évoquée par le stimulus de 55 neurones bilatéraux dans les ganglions cérébropléraux (la livraison du stimulus est indiquée par la flèche). (D) Un graphique de réseau affichant les dix ensembles fonctionnels, chacun assigné une couleur unique, identifiés par regroupement consensuel. Les nœuds de ce diagramme représentent les neurones, où la distance dans l’espace du réseau représente le degré de corrélation de tir à l’intérieur et entre les ensembles. (E) Les traces en C sont réarrangées et codées par couleur (suivant le schéma de couleurs de D) en ensembles fonctionnels. (F) Image de la préparation montrant les emplacements cartographiés des signaux de chaque neurone enregistré, et les nombres de traces en C et E auxquels ils correspondent. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1: Animation du programme locomoteur complet d’évasion Aplysia de 20 minutes. L’opacité des formes blanches sous-t-il de 81 neurones individuels dans le ganglion de la pédale de droite (panneau de gauche) était déterminée par les traces neuronales correspondantes (panneau de droite) et variait linéairement en fonction du taux de pointe moyen (biné par 0,61 s de temps réel dans l’enregistrement). Pour chaque neurone, l’opacité complète a été normalisée à sa vitesse de tir maximale pendant la durée de l’enregistrement. Une seconde de temps écoulé dans la vidéo représente 12,2 s de temps réel. La barre d’échelle correspond au temps réel, avec les lignes vertes, cyan et bleu foncé sous les traces indiquant la ligne de base de pré-stimulus, le galop et les phases de rampe du programme locomoteur d’échappement, respectivement. Les cases jaunes autour de la phase de galop et une partie de la phase de crawl indiquent les extraits d’enregistrement utilisés pour générer les animations dans les Vidéos 2 et 3. Veuillez cliquer ici pour visionner cette vidéo. (Cliquez avec le bouton droit de la souris pour télécharger.)
Vidéo 2 : Animation de la phase de galop du programme locomoteur d’évasion Aplysia. Le regroupement consensuel a été effectué sur les 81 neurones enregistrés dans la seule phase de galop du programme moteur pour dériver les ensembles fonctionnels, en utilisant l’approche et le logiciel décrits et mis à disposition dans la réf.12. Les ensembles neuronaux présentant des schémas de tir largement toniques ou irréguliers au cours de cette phase du programme d’évasion ont été omis de cette vidéo. Les potentiels d’action des neurones appartenant aux ensembles noir et vert olive peuvent être entendus dans la piste audio de la vidéo, avec les neurones et les traces correspondants mis en évidence. Les taux de pointe moyens ont été normalisés comme dans la vidéo 1 et avec un temps équivalent de binning; 1 s de temps écoulé dans la vidéo correspond à 6,1 s de temps réel. Veuillez cliquer ici pour visionner cette vidéo. (Cliquez avec le bouton droit de la souris pour télécharger.)
Vidéo 3 : Animation de la phase de crawl du programme locomoteur d’échappement Aplysia. Le regroupement consensuel a été effectué sur les 81 neurones enregistrés dans la seule phase de crawl du programme moteur pour dériver les ensembles fonctionnels. Les ensembles présentant des schémas de tir largement toniques ou irréguliers au cours de cette phase du programme moteur ont été omis de cette vidéo. Les taux de pointe moyens ont été normalisés comme dans les vidéos 1 et 2 et avec un temps équivalent de binning; 1 s de temps écoulé dans la vidéo correspond à environ 12,2 s de temps réel. Veuillez cliquer ici pour visionner cette vidéo. (Cliquez avec le bouton droit de la souris pour télécharger.)
Discussion
L’un des détails les plus importants dans la mise en œuvre de notre approche d’imagerie VSD à grande échelle est de minimiser les vibrations, ce qui produit des mouvements de bords de contraste à travers les diodes, ce qui entraîne de grands signaux artéfactuels. Parce que les VSD d’absorbance produisent de très faibles variations en pourcentage de l’intensité lumineuse avec des potentiels d’action, les artefacts vibratoires, s’ils ne sont pas empêchés, peuvent obscurcir les signaux neuronaux d’intérêt. Nous employons plusieurs méthodes pour minimiser les artefacts vibratoires. Tout d’abord, notre salle d’imagerie est située au rez-de-chaussée, ce qui isole la préparation des vibrations liées aux équipements de traitement de l’air du bâtiment et à de nombreuses autres sources. Deuxièmement, une table d’isolation à ressort a été utilisée, ce qui, selon d’autres utilisateurs de PDA, offre un meilleur amortissement des vibrations que le tableau d’air plus courant16. Troisièmement, des objectifs d’immersion dans l’eau ont été utilisés, qui éliminent les fluctuations d’image résultant des ondulations de surface. Quatrièmement, la préparation imagée a été légèrement pressée entre le fond du couvercle de la chambre et un fragment de couvercle pressé par le haut qui est maintenu en place par des bouchons de silicone ou de la vaseline, stabilisant davantage la préparation. Cela aplatit également la surface convexe du ganglion ou des ganglions imagés, ce qui entraîne plus de neurones dans le plan de focalisation de l’objectif, ce qui augmente le nombre de neurones enregistrés.
Pour maximiser le rapport signal/bruit pour les très petits changements dans le degré d’absorbance de la lumière VSD résultant d’un potentiel d’action, il est essentiel d’obtenir une lumière presque saturante grâce à la préparation au PDA, tout en minimisant le photoméchage du colorant. À cette fin, nous travaillons généralement à 3-4 V d’intensité lumineuse au repos, mesurée avec le commutateur de gain du panneau de commande PDA en position 1x (les 464 amplificateurs du PDA saturent à 10 V de lumière). Lors de l’acquisition des données, ce facteur de gain est passé à 100x. Obtenir suffisamment de lumière pour atteindre 3-4 V tel que mesuré par le PDA peut être accompli de plusieurs façons. Tout d’abord, utilisez une source de lumière LED ultralumineux qui délivre une longueur d’onde appropriée aux propriétés d’absorption du colorant d’absorbance utilisé. En conséquence, une lampe collimée à LED de 735 nm a été utilisée, qui chevauche les longueurs d’onde d’absorption optimales de RH155 et RH482. Deuxièmement, si nécessaire, utilisez un condenseur de sous-sol rabattable qui concentre la lumière de la source de lumière LED sur une zone plus petite. Troisièmement, ajustez la hauteur du condenseur pour obtenir un éclairage Köhler, ce qui garantit une luminosité élevée et uniforme et une qualité d’image maximale. Quatrièmement, assurez-vous qu’il n’y a pas de filtres thermiques dans la voie optique, ce qui peut atténuer la longueur d’onde de 735 nm de la lampe LED. Cinquièmement, retirez les diffuseurs, si plus de lumière est nécessaire, de la voie optique. Sixièmement, utilisez des objectifs à NA élevé, qui offrent une résolution spatiale élevée et permettent à des niveaux de lumière suffisants d’atteindre le PDA à des intensités de lampe plus faibles. Cela nous a permis de minimiser le photobleaching dans la mesure où nous pouvons obtenir plusieurs fichiers d’acquisition d’une durée de 10 à 20 minutes par préparation en utilisant la même intensité lumineuse dans tous les fichiers et sans perte significative d’amplitude du signal ou besoin de re-coloration. Surtout, si l’expérimentateur souhaite suivre les neurones à travers ces fichiers plus longs, assurez-vous que le plan focal ne change pas et que la préparation ne bouge pas. Enfin, un moyen supplémentaire d’acheminer suffisamment de lumière vers le PDA est d’utiliser des animaux plus jeunes, qui ont des ganglions plus minces et donc moins opaques.
De temps en temps, nous constatons que le rapport signal/bruit des signaux optiques se détériore et/ou que les rythmes du programme moteur sont sous-optimaux (par exemple, lents ou anormaux). Lorsque cela commence à se produire de manière constante, nous mélangeons de nouvelles solutions de VSD. Les aliquotes de VSD restent généralement viables pendant environ 6 mois dans un congélateur à -20 °C. Dans le même temps, il convient de noter que pour Berghia, les meilleurs résultats ont jusqu’à présent été obtenus avec l’absorbance VSD RH482. Comme RH482 est plus lipophile que RH155, il peut mieux colorer les neurones comparativement plus petits de Berghiaou rester dans les membranes neuronales plus efficacement à la température saline d’enregistrement plus élevée utilisée pour cette espèce tropicale.
Une limitation de l’imagerie de l’activité neuronale basée sur le PDA concerne le couplage AC des signaux de tension dans le matériel avant l’étape de préamplification 100x: bien que cela représente une caractéristique nécessaire pour éliminer le grand décalage DC produit par le niveau de lumière au repos élevé requis par cette technique, le couplage AC intrinsèque au PDA empêche la mesure des changements lents du potentiel membranaire, comme ceux associés aux entrées synaptiques. Si vous souhaitez enregistrer des changements potentiels lents ou à l’état d’équilibre, un système d’imagerie par caméra CMOS couplé à courant continu peut être utilisé pour capturer l’activité du sous-réseau. Byrne et ses collègues ont récemment utilisé une telle configuration avec RH155 pour imager l’activité des neurones dans le ganglion buccal d’Aplysia17,18. Nous avons utilisé les deux systèmes et constaté que la caméra CMOS, en raison de sa densité de détecteurs beaucoup plus élevée (128 x 128), génère des fichiers de données 50 fois plus volumineux pour le même temps d’imagerie7. Les fichiers plus petits du PDA facilitent un traitement et une analyse plus rapides. Cela permet également des enregistrements étendus d’essais uniques(Figure 4)et des études d’apprentissage, dans lesquelles les données de plusieurs essais sont concaténées en un seul fichier volumineux avant le tri des pics, ce qui permet de suivre l’organisation du réseau au fur et à mesure que l’apprentissage se développe19.
Dans d’autres enquêtes basées sur des caméras, des VSD fluorescents ont été utilisés par Kristan et ses collègues pour examiner la fonction du réseau dans les ganglions segmentaires de la sangsue. Dans une étude influente, cela a conduit à l’identification d’un neurone impliqué dans la décision de l’animal de nager ou de ramper20. Dans une autre étude, Kristan et al. ont examiné dans quelle mesure les comportements de nage et de rampement de la sangsue sont entraînés par des circuits multifonctionnels par rapport à des circuits dédiés21. Plus récemment, Wagenaar et ses collègues ont utilisé un microscope bilatéral pour l’imagerie de tension qui leur permet d’enregistrer à partir de presque tous les neurones d’un ganglion segmentaire de sangsue22. Contrairement à de nombreuses méthodes d’imagerie par caméra, l’un des avantages de notre méthode d’imagerie basée sur PDA est le tri rapide et impartial des pics par ICA, une forme de séparation de source aveugle qui n’implique aucune décision sur les limites neuronales pour le traitement des résultats.
En ce qui concerne le choix des VSD, l’un des avantages des colorants d’absorbance RH155 et RH482 est la phototoxicité faible ou nulle qui leur est associée23,24,permettant des temps d’enregistrement plus longs que ceux typiques des VSD fluorescents. De plus, les VSD à absorbance rapide que nous utilisons sont bien adaptés pour enregistrer les potentiels d’action somatique de dépassement dans les préparations de gastéropodes, qui ont généralement une amplitude de 80 mV. Comme le montre la figure 3G,notre méthode optique peut enregistrer les sous-plans du potentiel d’action (aucun de nos enregistrements n’est moyenné par des traces): cela suggère que les VSD que nous utilisons devraient être capables de discerner les potentiels d’action dans d’autres systèmes modèles qui s’atténuent dans une certaine mesure et ne dépassent donc pas au moment où ils atteignent le soma. Néanmoins, notre approche optique peut ne pas être idéale pour les espèces connues pour présenter des potentiels d’action très atténués lorsqu’elles sont enregistrées dans le soma.
Une grande partie de la recherche actuelle sur les réseaux de neurones se concentre sur un petit nombre d’espèces transgéniques de conception. Cependant, les neurosciences bénéficient de l’étude d’une grande variété d’espèces phylogénétiquement distinctes. L’étude de nombreuses espèces différentes donne un aperçu de la façon dont les circuits évoluent25,26, et éclaire les principes de la fonction de réseau qui peuvent être communs à travers les phyla1,2,3,4,27. Nous avons jusqu’à présent appliqué notre méthode d’imagerie à un certain nombre d’espèces de gastéropodes, y compris Aplysia californica8,11,12,13 , 14,28, Tritonia diomedea8,9,11,14,19,28, Tritonia festiva28, Pleurobranchaea californica (données non publiées), et plus récemment Berghia stephanieae (Figure 5). Un attrait de cette approche est qu’elle peut être facilement appliquée à de nombreuses espèces, sans avoir besoin d’animaux transgéniques. Nous tenons à reconnaître que notre utilisation de l’imagerie VSD avec des colorants à absorption rapide et un PDA suit les traces d’un travail de pionnier qui a accompli cela dans des préparations Navanax29 et Aplysia30 semi-intactes et au comportement. L’accent que nous mettons sur la rapidité de notre approche est en partie une réponse aux préoccupations selon lesquelles de nombreux chercheurs pourraient être de plus en plus réticents à lancer des études de réseau chez de nouvelles espèces en raison des craintes que des années d’études soient nécessaires pour caractériser l’organisation de base du réseau avant de pouvoir explorer des questions scientifiques d’intérêt général pour les neurosciences31. Par conséquent, notre objectif ici est de démontrer une technique qui accélère considérablement le processus – au point que des informations significatives le jour même sur l’organisation du réseau peuvent être obtenues à partir de préparations uniques.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par NSF 1257923 et NIH 1U01NS10837. Les auteurs tiennent à remercier Jean Wang pour son aide en laboratoire.
matériels
| Name | Company | Catalog Number | Comments |
| Achromat 0.9 NA swing condenser | Nikon | N/A | |
| Bipolar temperature controller | Warner Instruments | CL-100 with SC-20 | Controls perfusion saline temperature |
| Chamber thermometer | Physitemp | BAT-12 with IT-18 microprobe | |
| Digital camera | Optronics | S97808 | |
| Dissecting forceps | Dumont | #5 | |
| Dissecting scissors | American Diagnostic Corp. | ADC-3410Q | |
| Imaging microscope | Olympus | BX51WIF | |
| Imaging perfusion chamber | Siskiyou | PC-H | |
| Instant Ocean | Instant Ocean | SS6-25 | Makes 25 gallons at a time |
| Master-8 pulse stimulator | A.M.P.I. | Master-8 | |
| Microdispenser | Drummond Scientific | 3-000-752 | Dye applicator for pressure staining |
| Microdissection scissors | Moria | 15371-92 | |
| Minutien pins (0.1 mm) | Fine Science Tools | NC9677548 | For positioning and stabilizing CNS |
| Motorized microscope platform | Thorlabs | GHB-BX | Gibraltar platform |
| NeuroPlex imaging software | RedShirtImaging | NeuroPlex | Compatible with the WuTech photodiode array |
| Objective lenses | Olympus | XLPLN10XSVMP, XLUMPLFLN20XW, LUMPLFLN40XW, UAPON40XW340 | |
| PE-100 polyethylene tubing | VWR | 63018-726 | Tubing to make suction electrodes |
| Perfusion pump | Instech | P720 with DBS062SDBSU tube set | |
| Petroleum jelly | Equate | NDC 49035-038-54 | |
| Photodiode array with control panel | WuTech Instruments | 469-IV photodiode array | Contact jianwu2nd@gmail.com for ordering information |
| RH155 | Santa Cruz Biotechnology | sc-499432 | Voltage-sensitive dye |
| RH482 | Univ of Conn. Health Center | JPW-1132 | Voltage-sensitive dye; special order from Leslie Leow |
| Silicone earplugs | Mack's | Model 7 | To be use for preparation compression |
| Staining PE tubing | VWR | 63018-xxx | Different sizes depending on fit |
| Sylgard 184 silicone elastomer kit | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Thorlabs LED and driver | Thorlabs | M735L2-C1, DC2100 | LED lamp and driver |
| Tygon tubing | Fisher Scientific | 14-171-xxx | |
| Vibration isolation table | Kinetic Systems | MK26 | Spring-based |
Références
- Miller, C. T., Hale, M. E., Okano, H., Okabe, S., Mitra, P. Comparative Principles for Next-Generation Neuroscience. Frontiers in Behavioral Neuroscience. 13 (12), (2019).
- Brenowitz, E. A., Zakon, H. H. Emerging from the bottleneck: benefits of the comparative approach to modern neuroscience. Trends in Neuroscience. 38 (5), 273-278 (2015).
- Bolker, J. Model organisms: There's more to life than rats and flies. Nature. 491 (7422), 31-33 (2012).
- Carlson, B. A. Diversity matters: the importance of comparative studies and the potential for synergy between neuroscience and evolutionary biology. JAMA Neurology. 69 (8), 987-993 (2012).
- Chase, R. . Behavior and its neural control in gastropod molluscs. , (2002).
- Salzberg, B. M., Grinvald, A., Cohen, L. B., Davila, H. V., Ross, W. N. Optical recording of neuronal activity in an invertebrate central nervous system: simultaneous monitoring of several neurons. Journal of Neurophysiology. 40 (6), 1281-1291 (1977).
- Frost, W. N., et al. Monitoring Spiking Activity of Many Individual Neurons in Invertebrate Ganglia. Advances in Experimental Medicine and Biology. 859, 127-145 (2015).
- Frost, W. N., Wang, J., Brandon, C. J. A stereo-compound hybrid microscope for combined intracellular and optical recording of invertebrate neural network activity. Journal of Neuroscience Methods. 162 (1-2), 148-154 (2007).
- Frost, W. N., Wu, J. -. Y., Covey, E., Carter, M. Voltage-sensitive dye imaging. Basic Electrophysiological Methods. , 169-195 (2015).
- Brown, G. D., Yamada, S., Sejnowski, T. J. Independent component analysis at the neural cocktail party. Trends in Neuroscience. 24 (1), 54-63 (2001).
- Hill, E. S., Moore-Kochlacs, C., Vasireddi, S. K., Sejnowski, T. J., Frost, W. N. Validation of independent component analysis for rapid spike sorting of optical recording data. Journal of Neurophysiology. 104 (6), 3721-3731 (2010).
- Bruno, A. M., Frost, W. N., Humphries, M. D. Modular deconstruction reveals the dynamical and physical building blocks of a locomotion motor program. Neuron. 86 (1), 304-318 (2015).
- Bruno, A. M., Frost, W. N., Humphries, M. D. A spiral attractor network drives rhythmic locomotion. ELife. 6, 27342 (2017).
- Hill, E. S., Bruno, A. M., Vasireddi, S. K., Frost, W. N., Naik, G. R. ICA applied to VSD imaging of invertebrate neuronal networks. Independent Component Analysis for Audio and Biosignal Applications. , 235-246 (2012).
- Jahan-Parwar, B., Fredman, S. M. Neural control of locomotion in Aplysia: role of the central ganglia. Behavioral and Neural Biology. 27 (1), 39-58 (1979).
- Jin, W., Zhang, R. J., Wu, J. Y. Voltage-sensitive dye imaging of population neuronal activity in cortical tissue. Journal of Neuroscience Methods. 115 (1), 13-27 (2002).
- Neveu, C. L., et al. Unique Configurations of Compression and Truncation of Neuronal Activity Underlie l-DOPA-Induced Selection of Motor Patterns in Aplysia. eNeuro. 4 (5), 17 (2017).
- Cai, Z., Neveu, C. L., Baxter, D. A., Byrne, J. H., Aazhang, B. Inferring neuronal network functional connectivity with directed information. Journal of Neurophysiology. 118 (2), 1055-1069 (2017).
- Hill, E. S., Vasireddi, S. K., Wang, J., Bruno, A. M., Frost, W. N. Memory Formation in Tritonia via Recruitment of Variably Committed Neurons. Current Biology. 25 (22), 2879-2888 (2015).
- Briggman, K. L., Abarbanel, H. D., Kristan, W. B. Optical imaging of neuronal populations during decision-making. Science. 307 (5711), 896-901 (2005).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. Journal of Neuroscience. 26 (42), 10925-10933 (2006).
- Tomina, Y., Wagenaar, D. A. A double-sided microscope to realize whole-ganglion imaging of membrane potential in the medicinal leech. ELife. 6, 29839 (2017).
- Chang, P. Y., Jackson, M. B. Interpretation and optimization of absorbance and fluorescence signals from voltage-sensitive dyes. Journal of Membrane Biology. 196 (2), 105-116 (2003).
- Parsons, T. D., Salzberg, B. M., Obaid, A. L., Raccuia-Behling, F., Kleinfeld, D. Long-term optical recording of patterns of electrical activity in ensembles of cultured Aplysia neurons. Journal of Neurophysiology. 66, 316-333 (1991).
- Katz, P. S. Evolution of central pattern generators and rhythmic behaviours. Transactions of the Royal Society of London, Series B. 371 (1685), 20150057 (2016).
- Moroz, L. L. Biodiversity Meets Neuroscience: From the Sequencing Ship (Ship-Seq) to Deciphering Parallel Evolution of Neural Systems in Omic's Era. Integrative and Comparative Biology. 55 (6), 1005-1017 (2015).
- Frost, W. N., Tian, L. -. M., Hoppe, T. A., Mongeluzi, D. L., Wang, J. A cellular mechanism for prepulse inhibition. Neuron. 40, 991-1001 (2003).
- Hill, E. S., Vasireddi, S. K., Bruno, A. M., Wang, J., Frost, W. N. Variable neuronal participation in stereotypic motor programs. PLoS One. 7 (7), 40579 (2012).
- London, J. A., Zecevic, D., Cohen, L. B. Simultaneous optical recording of activity from many neurons during feeding in Navanax. Journal of Neuroscience. 7 (3), 649-661 (1987).
- Wu, J., Cohen, L. B., Falk, C. X. Neuronal activity during different behaviors in Aplysia: A distributed organization. Science. 263 (5148), 820-823 (1994).
- Marder, E., North, G., Greenspan, R. J. Searching for insight. In Invertebrate Neurobiology. , 1-18 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon