Method Article
Mise en service et dosimétrie des irradiateurs pour l’évaluation des paramètres de α et de β LQ, du schéma de dosage des rayonnements et du dépôt in vivo de la dose
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La dosimétrie des rayonnements fournit une technique pour améliorer l’exactitude des expériences précliniques et s’assurer que les doses de rayonnement administrées sont étroitement liées aux paramètres cliniques. Ce protocole décrit les étapes à prendre à chaque phase au cours d’expériences de rayonnement préclinique afin d’assurer une conception expérimentale appropriée.
Résumé
La dosimétrie des rayonnements est essentielle à la livraison et à la reproductibilité précises des systèmes de rayonnement dans les modèles précliniques à haute pertinence translationnelle. Avant d’effectuer des expériences in vitro ou in vivo, la production de dose spécifique pour l’irradiateur et les conceptions expérimentales individuelles doivent être évaluées. À l’aide d’une chambre d’ionisation, d’un électromètre et d’une installation d’eau solide, la sortie de dose de champs larges à l’isocenter peut être déterminée. À l’aide d’une configuration similaire avec des films radiochromiques à la place de la chambre d’ionisation, les taux de dose pour les champs plus petits à différentes profondeurs peuvent également être déterminés. Les tests de survie clonogénique in vitro des cellules cancéreuses en réponse à la radiothérapie sont des expériences peu coûteuses qui fournissent une mesure de la radio-sensibilité inhérente des lignées cellulaires en adaptant ces données au modèle linéaire-quadratique traditionnel. Les paramètres modèles estimés à partir de ces analyses, combinés aux principes des doses efficaces biologiques, permettent de développer des calendriers de fractionnement variables pour la radiothérapie qui fournissent des doses efficaces équivalentes dans des expériences sur des animaux porteurs de tumeurs. Il s’agit d’un facteur important à considérer et à corriger pour comparer les calendriers de radiothérapie in vivo pour éliminer la confusion potentielle des résultats en raison de la variance dans les doses efficaces livrées. Pris ensemble, cet article fournit une méthode générale pour la vérification de la production de dose irradiateurs précliniques d’animaux et d’armoires, l’évaluation in vitro de la radio-sensibilité, et la vérification de la livraison de rayonnement dans les petits organismes vivants.
Introduction
Les cancers représentent collectivement la deuxième cause de décès aux États-Unis et dans de nombreux pays à travers le monde1. La radiothérapie est une pierre angulaire du traitement pour de nombreux sous-types de tumeurs et est administrée à environ la moitié de tous les patients atteints de cancer2,3. Les résultats des patients pour presque tous les cancers se sont améliorés au fil du temps que l’équipement utilisé pour fournir des doses de rayonnement a régulièrement progressé et certaines approches efficaces de thérapie multimodale ontété développés 4,5,6, mais les taux de récidive et de mortalité pour les patients atteints de certains types de tumeurs restent élevés7,8,9. Ainsi, la radiothérapie pour le cancer continue d’être un domaine actif de la recherche fondamentale et clinique. De nombreuses études précliniques de radiothérapie utilisent des irradiateurs à petite échelle pour fournir des doses de rayonnement à des modèles in vitro ou animaux de cancers. Avec une multitude d’expériences potentielles pour mener à explorer des détails de radiobiologie mécaniste ou de nouveaux traitements, des pièges communs peuvent être rencontrés qui conduisent à des conclusions incorrectes, une mauvaise reproductibilité, et des ressources gaspillées. Ces pièges se trouvent dans trois domaines importants : la dosimétrie irradiatoire, la caractérisation in vitro des lignées cellulaires modèles et le calendrier et la configuration de dosage de l’irradiation in vivo. Les résultats précis et reproductibles d’expériences plus avancées sont difficiles à obtenir sans une attention préalable à ces aspects fondamentaux de la recherche en radiothérapie.
Le protocole détaillé dans le ci-après décrit une stratégie généralisée pour éviter ou atténuer ces problèmes et s’appuie sur plusieurs méthodologies précédemment développées destinées à un usage indépendant. Ces méthodes distinctes ont été fusionnées afin qu’un chercheur intéressé à commencer ou à améliorer des expériences de radiothérapie préclinique puisse l’utiliser comme une mise en page expérimentale robuste. Le cadre suggéré comprend une méthodologie pour la mise en service d’irradiateurs animaux à petite échelle, pour déterminer les propriétés radiologiques de base des lignées de cellules cancéreuses modèles, et pour concevoir et administrer de façon appropriée un calendrier de dosage et de fractionnement pour les modèles tumoraux in vivo.
Protocole
Toutes les étapes de ce protocole concernant l’utilisation d’animaux de laboratoire, y compris la manipulation et les procédures, ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux de l’Université de Virginie-Occidentale à Morgantown, en Virginie-Occidentale (numéro du Protocole : 1604001894).
1. Détermination de la production de dose
- Utilisez ce protocole, basé sur le protocole « Méthode fantôme » de l’American Association of Physicists in Medicine Task Group (AAPM TG) 6110 et similaire au protocole de mise en service établi par Xstrahl, pour déterminer la sortie du faisceau du petit irradiateur animal par rapport à une géométrie particulière dans les conditions d’installation suivantes.
- Réglez l’irradiateur pour délivrer les radiations à 220 kVp et 13 mA, avec un champ ouvert (17 cm par 17 cm) placé à l’isocenter, ou à 35 cm de la source. En outre, filtrer le faisceau avec un filtre Cu de 0,15 mm avec une large mise au point. Certains irradiateurs cellulaires ne contiennent qu’une source radioactive, ce protocole ne peut être utilisé que pour les irradiateurs à rayons X.
- Alignez les fantômes d’eau solide dans l’ordre suivant : dalle de 1 cm, dalle de 2 cm avec fente de chambre d’ionisation, dalle de 2 cm, dalle de 1 cm. Empiler les fantômes d’eau solide dans cet ordre positionne la chambre d’ionisation à une profondeur de 2 cm, permettant 4 cm ainsi pour la rétrocalisation. Voir figure 1 pour une représentation graphique de la configuration de dosimétrie.
REMARQUE : Pour accueillir la grande pile assez lourde d’eau solide, les auteurs recommandent l’acquisition d’un canapé imprimé 3D personnalisé avec un support variable pour s’assurer que la pile fantôme est de niveau et à la bonne distance de la source à travers la surface du matériau, et pas seulement au centre.
- Utilisez l’équipement de mesure (c.-à-d. chambre d’ionisation calibrée ADCL, électromètre) et une explication des facteurs de correction utilisés dans le tableau des matériaux et le tableau 1 respectivement.
REMARQUE : Que l’ADCL fournit des valeurs de Nk à quelques points pour différentes couches de demi-valeur (HVL, mesure de la qualité du faisceau). La valeur de Nk à utiliser dans le protocole doit être basée sur une interpolation des valeurs ADCL pour le HVL mesuré de l’unité. Le fabricant a mesuré le HVL de notre unité et nous l’avons utilisé dans notre détermination de sortie de taux de dose. - Configurez la pile fantôme et insérez la chambre d’ionisation dans le fantôme tel que spécifié à l’étape 1.1.2.
- Ajustez la pile fantôme de telle sorte que la source à la distance de surface (SSD), ou la distance entre la source de rayonnement et la première surface, soit de 33 cm lorsqu’elle est correctement niivelé.
REMARQUE : Les auteurs suggèrent de créer un canapé imprimé 3D personnalisé, suffisamment grand pour prendre en charge les dimensions des dalles d’eau solide. En outre, celui, utilisé dans ce protocole a un composant réglable pour niveler la pile fantôme.
- Ajustez la pile fantôme de telle sorte que la source à la distance de surface (SSD), ou la distance entre la source de rayonnement et la première surface, soit de 33 cm lorsqu’elle est correctement niivelé.
- Prenez la moyenne de trois expositions distinctes aux rayons X, des lectures d’une minute avec la tension de biais de l’électromètre réglée à 300 V. Le résultat sera appelé M+.
REMARQUE : Les irradiations sont effectuées avec l’instrument réglé pour délivrer des radiations à 220 kVp et 13 mA. Il en va de même pour les deux étapes suivantes (étapes 1.5-1.6). Pour la sécurité des utilisateurs, assurez-vous que les portes restent fermées pendant les traitements. - Effectuez un autre ensemble de trois expositions distinctes aux rayons X, des lectures de 1 min avec la tension de biais électromètre réglée à -150 V. Le résultat sera appelé ML.
- Effectuez un autre ensemble de trois expositions distinctes aux rayons X, des lectures de 1 min avec la tension de biais de l’électromètre réglée à -300 V. Le résultat sera appelé MH, ou aussi M-.
- Calculezl’ion P pol et Pà l’aide de l’équation 1 et de l’équation 2 respectivement comme décrit ci-dessous :
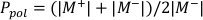 (Équation 1)
(Équation 1)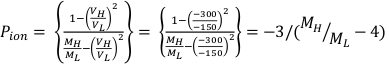 (Équation 2)
(Équation 2) - Mesurez la température, en Celsius, et la pression, en kPa, à l’intérieur de l’irradiateur à l’aide d’un thermomètre numérique calibré et d’un baromètre. Ensuite, calculer PTP comme indiqué ci-dessous dans l’équation 3.
REMARQUE : Ce calcul suppose que l’ADCL a utilisé des valeurs standard de température et de pression de 22 °C et 101,33 kPa lorsqu’elle a indiqué sa valeur pour le facteur d’étalonnage du kerma d’air.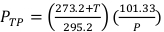 (Équation 3)
(Équation 3) - Calculer la lecture de chambre corrigée, M, en multipliant la lecture de chambre brute, MH, par Pelec, Ppol, Pion, et PTP. Cette équation se trouve ci-dessous dans l’équation 4.
REMARQUE : Ce calcul suppose que l’ADCL a effectué son étalonnage avec la tension de biais réglée à -300V, ce qui est une pratique assez courante.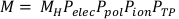 (Équation 4).
(Équation 4). - Multipliez encore la lecture de chambre corrigée par Nk, [(μen/p)wair]eau,PQ, cham,etgaine P. Lagaine P n’est nécessaire que pour les mesures obtenues dans l’eau. Par conséquent, pour ce protocole Pgaine est juste 1.
REMARQUE : En utilisant les conditions de ce protocole, les trois derniers éléments donnent une valeur de 1,0731. Cette valeur dépend de la qualité du faisceau, de sorte que le HVL doit être connu pour le déterminer. La valeur de 1,0731 est spécifique à notre unité et est donnée à titre d’exemple. Pour déterminer les valeurs de PQ, cham et [(μ en /p)wair] d’eaupropre à votre unité, utilisez le HVL mesuré et interpolez à partir du tableau VIIet du tableau VIII,et corrigez la taille du champderéférence selon la figure 3 et la figure 4 du protocole TG61 de l’AAPM10. Dans notre cas, la multiplication de Nk par 1,0731 fournit la dose à l’eau, Dw, en Gy pour un temps nominal de 1 min, en supposant que la valeur ADCL Nk est donnée dans Gy / Coulumbs. - Déterminer l’effet final de l’irradiateur utilisé. Lorsque les rayons X sont générés pour la première fois, la sortie augmente à sa pleine valeur sur un certain temps fini. De même, lorsque la source de rayons X est désactivée, la sortie diminue à zéro sur un certain temps fini.
- Comptez du temps pour cette transition, ou de l’effet final. Cela peut être fait en prenant la moyenne de trois lectures avec la tension de biais électromètre fixé à -300 V, pour une variété de paramètres de temps. Faites ceci pendant 6, 12, 18, 24, 30, et 60 secondes.
- Tracez les lectures de l’électromètre contre le temps et trouvez la meilleure ligne droite. Le temps total, t, pour un traitement d’une minute peut être calculé par équation 5 :
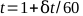 (Équation 5).
(Équation 5).
- Calculer le taux de dose d’un irradiateur donné par équation 6:
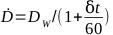 (Équation 6)
(Équation 6)
2. Création d’une courbe d’étalonnage de film radiochromique
- Pour une liste des matériaux nécessaires, voir Table of Materials.
- À l’aide d’une mise en place presque identique au protocole précédent, placez le film à une profondeur de 2 cm dans la pile fantôme d’eau solide. L’ordre des fantômes d’eau solide est insignifiant tant qu’il y a 2 cm d’eau solide au-dessus et 4 cm d’eau solide ci-dessous pour les effets d’accumulation et de rétroscation.
- À l’aide de la dose déterminée commandée dans le protocole 1, déterminer les temps de traitement des doses énumérées dans le tableau 2 à l’aide de l’équation 7:
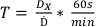 (Équation 7)
(Équation 7) - Préparez plusieurs morceaux de film en veillant à ce que chaque film soit de la même taille et reste dans la même orientation du traitement par l’acquisition de scans. Cela peut être fait en plaçant une petite coupe diagonale dans le coin inférieur gauche. Chaque film à partir de ce point doit être du même lot de film.
REMARQUE : Préparez 3 répliques distinctes pour chaque point de dose à évaluer. - Numérisez les morceaux coupés à l’aide d’un scanner photo couleur 48 bits avec toutes les corrections désactivées. Assurez-vous que chaque film est placé au centre exact du lit à balayage. Les valeurs obtenues sont les scans pré-exposition utilisés pour déterminer la densité optique non exposée11,12. Enregistrer toutes les images dans le . Format de fichier Tiff pour éviter la compression des données clés.
REMARQUE : Les auteurs recommandent de numériser les films trois fois et d’utiliser la moyenne obtenue comme valeur unique pour un film donné. - Commencez l’irradiation des films en plaçant un morceau de film sur le dessus de 4 cm d’eau solide et positionné les 2 cm restants d’eau solide au-dessus, comme décrit précédemment dans cette section.
- Ajustez l’ensemble fantôme de sorte que le film soit à la même distance de la source que la chambre d’ionisation lors de la détermination de la sortie de la dose. C’est le point isocentrique de l’irradiateur.
- Programmez le temps de traitement calculé à l’étape 2.3 ci-dessus pour une dose prescrite.
- Répétez le traitement pour chacune des doses énumérées dans le tableau 2.
- Laissez les films reposer pendant 24 heures à l’abri de la lumière.
- Obtenez les scans de films post-exposition de la même manière que ci-dessus.
- Importez des images sur le logiciel d’analyse ImageJ et effectuez toutes les mesures sur le canal rouge.
- Faites glisser l’image dans . Format de fichier Tiff en ImageJ.
- Cliquez sur le menu De chute d’image vers le bas. Sélectionnez Couleur du menu Baisse d’image. Sélectionnez les canaux fractionnaux de l’option Couleur.
- En utilisant uniquement le canal d’image rouge, dessiner une région d’intérêt en utilisant l’outil rectangle. Appuyez sur Ctrl+M. Transcrire la valeur moyenne à partir de la fenêtre de résultats.
- Répétez les étapes 2.12.1-2.12.4 pour tous les films numérisés.
- Obtenez la valeur pixel dans un carré central de 1 cm sur 1 cm pour les films non exposés et exposés. Ces valeurs seront indiquées comme PVU(D) et PV(D) respectivement, et peuvent être utilisées pour calculer la densité optique nette décrite dans l’équation 8.
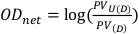 (Équation 8) 13 Ans
(Équation 8) 13 Ans
- Répétez l’étape 2.13 pour chaque paire d’images de film, à la fois avant l’exposition et après l’exposition.
- Tracer un graphique de la dose par rapport à la densité optique nette et adapter la courbe à un polynomial cubique dans le format de y = hache3 + bx2 + cx + d. Un exemple peut être trouvé dans la figure 2B.
3. Détermination de la valeur α/β pour des lignées spécifiques de cellules cancéreuses par l’intermédiaire de l’essai clonogenic
REMARQUE : Le protocole suivant est une version modifiée des méthodes décrites par Franken etcoll. 14 et peut être vu à la figure 3.
- Faire croître les cellules à ~80% de confluence. Évitez d’utiliser des sources de cellules trop confluentes pour cette expérience, car il est nécessaire que les cellules soient en phase de connexion de la croissance cellulaire. Pour les résultats d’analyse clonogénique représentatifs affichés dans la figure 3C,les cellules cancéreuses du sein MDA-MB-231 du cerveau-tropicales ont été cultivés dans le milieu modifié d’aigle (DMEM) de Dulbecco complétés avec le sérum bovin foetal de 10% et la pénicilline/streptomycine et ont été incubés à 37 °C et 5% de dioxyde de carbone dans un incubateur humidifié.
- Ensemencer les cellules à la densité désirée pour l’essai de la colonie. Des dilutions précises pendant l’ensemencement sont cruciales pour déterminer l’efficacité du placage de l’essai. Assurez-vous de plaquer plusieurs répliques.
- Procédez à cette étape si la radiothérapie précédera le placage cellulaire (Figure 3A). Alternativement, passez à l’étape 3.4 si le placage cellulaire précédera la radiothérapie.
- Effectuer la radiothérapie désirée sur les flacons de culture. Tous les traitements supplémentaires (c.-à-d. les traitements médicamenteux) peuvent être effectués à tout moment avant ou après cela. Pour les résultats représentatifs de la figure 3C, la radiothérapie s’est produite après le placage des cellules, détaillée à l’étape 3.4.
- Extraire les cellules en utilisant la méthode de trypsinisation préférée et créer une suspension cellulaire unique. Retirez les médias de culture et ajoutez l’enzyme recombinante (p. ex., TrypLE Express) pour détacher les cellules du flacon. Incuber les cellules avec l’enzyme pendant environ 3 minutes jusqu’à ce que les cellules ont été détachées comme détecté à l’aide d’un microscope léger. Neutraliser l’enzyme à l’aide d’un volume égal de médias de culture cellulaire. Cellules centrifugeuses à 300 x g pendant 10 min et résuspendez à la concentration désirée dans le milieu de culture.
- Plaquez les cellules à des densités désirées en plusieurs répliques.
- Remplacer par des supports frais après les 24 premières h.
- Continuez à remplacer les médias tous les 2-3 jours.
- Continuer à culturer les cellules jusqu’à ce que les colonies de contrôle dépassent 50 cellules par colonie, ~9-14 jours. Les colonies de contrôle sont les groupes de traitement qui ne reçoivent aucune dose de rayonnement. Pour les expériences utilisant des traitements médicamenteux ainsi, un autre groupe témoin avec dosage de médicaments, mais aucune radiothérapie sera également nécessaire.
- Procédez à cette étape lors de l’ensemencement des cellules avant la radiothérapie ( Figure3B).
- Extraire les cellules en utilisant la méthode de trypsinisation préférée et créer une suspension cellulaire unique.
- Placez les cellules aux densités désirées en plusieurs répliques.
- Permettre aux cellules d’adhérer à la plaque pendant la nuit.
- Effectuez les doses de rayonnement désirées. D’autres traitements, tels que le dosage de médicaments, peuvent être effectués à tout moment avant ou après cette étape, tant que les cellules se sont attachées à leurs plaques de traitement. Pour les résultats représentatifs de la figure 3C, 1250 cellules MDA-MB-231 sous-tropiques du cerveau ont été plaquées avant le traitement (étape 3.4). Puis, les cellules ont été traitées avec 15 nM doxorubicine 3 heures avant l’irradiation avec 3 Gy de rayons X.
- Remplacez les supports après les 24 h initiaux.
- Remplacez les médias tous les 2-3 jours.
- Culture des cellules traitées jusqu’à ce que les colonies du groupe témoin dépassent 50 cellules, ~ 9-14 jours. Les colonies de contrôle sont les groupes de traitement qui ne reçoivent aucune dose de rayonnement. Pour les expériences utilisant des traitements médicamenteux ainsi, un autre groupe témoin avec dosage de médicaments, mais aucune radiothérapie sera également nécessaire.
- Retirer les supports culturels des puits ou de la vaisselle et les laver avec du PBS.
- Fixer les cellules pendant 15 minutes dans une solution 1:7 (v:v) d’acide acétique glaciaire et de méthanol.
- Retirez la solution de fixation.
- Après fixation, colorer les cellules pendant 30 minutes, ou 2 h si le temps est disponible, à température ambiante avec une solution de 2,5-5,0 mg/mL de violette cristalline dans une solution 4:1 (v:v) d’eau distillée et de méthanol.
- Enlever la solution de coloration et laver les cellules dans un grand bain d’eau à température ambiante.
REMARQUE : Ne vous lavez pas sous l’eau courante. - Comptez le nombre de colonies qui en résulte dans chaque groupe de traitement et calculez la fraction de survie de chaque plaque.
- Tracez la fraction de survie par rapport à la dose correspondante fournie, et adapter la courbe avec un ajustement exponentiel.
- Pour estimer la valeur α/β, utilisez un ajustement exponentiel de la parcelle ci-dessus pour estimer les valeurs de chacun des paramètres réglables de l’équation linéaire-quadratique ci-dessous :
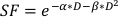 (Équation 9)
(Équation 9)
REMARQUE : L’irradiation des cellules peut généralement se faire à l’isocenter sans aucune collimation à condition que la taille du champ soit suffisamment grande pour accueillir des assiettes de puits ou des boîtes de Pétri. Les pièges potentiels dans ce protocole peuvent inclure des rendements tels qu’aucune formation de colonie, migration cellulaire significative avec la croissance claire de cellules mais aucune vraie colonies, ou contamination due au traitement dans une chambre non stérile d’irradiateur.
4. Détermination de la production de dose spécifique pour les conceptions expérimentales variables
- Décidez de la taille du champ désirée et de la distance par rapport à la source.
REMARQUE : La collimation modifiera le taux de dose, peu importe la taille ou la distance du collimateur par rapport à la source des rayons X. - En utilisant des fantômes d’eau solide pour fournir l’accumulation et rétro-dissquer, placez un morceau de film dans l’orientation correcte qui dépeint le mieux la conception expérimentale.
REMARQUE : Pour toute configuration expérimentale, l’eau solide peut ne pas fournir la représentation la plus précise d’une conception donnée. Au lieu de cela, nous recommandons d’utiliser les vaisseaux de l’expérience réelle (c.-à-d. boîte de Pétri, plaques de puits, petits fantômes animaux, etc.). - Irradier les films pendant 1 (N=3) et 2 (N=3) minutes.
- Laissez les films reposer pendant 24 heures à l’abri de la lumière.
- Déterminer la densité optique nette de chacun des films suivant les procédures de la section 2. Utilisez la courbe d’étalonnage du film pour déterminer la dose de la densité optique nette.
- Déterminez la dose à 1 minute, D1, comme le taux de dose de sortie, Ḋ, pour cette configuration expérimentale définie par l’équation 10 comme suit:
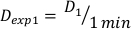 (Équation 10)
(Équation 10) - De même, caluclate la dose à 2 minutes par l’équation 11 comme suit:
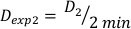 (Équation 11)
(Équation 11) - En raison de l’effet final, le taux de dose pour les calculs ci-dessus peut être légèrement différent. Pour cette raison de calculer Dexp pour la conception expérimentale souhaitée, utilisez une moyenne de l’exp Dindividuel comme indiqué dans l’équation 12:
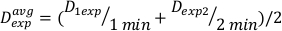 (Équation 12)
(Équation 12) - En utilisant cette moyenne, définissez le temps de traitement de n’importe quelle dose désirée pour cette configuration particulière dans l’équation 13:
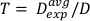 (Équation 13)
(Équation 13)
5. Traiter des souris portant des tumeurs dans l’endroit anatomique d’intérêt
- Anesthésier la souris avec des techniques d’anesthésie sûres et humaines approuvées par l’IACUC de l’établissement.
- Placer l’animal anesthésié dans la retenue comme indiqué dans la conception expérimentale désirée.
- Cette étape est facultative, si elle n’est pas disponible procéder à l’étape 5.6. Obtenez un radiogramme, à l’aide d’une caméra portail à bord, de la souris sans collimation à l’aide d’un filtre en aluminium.
- Obtenez un deuxième radiogramme avec collimation en place.
- Superposition de radiogrammes dans ImageJ pour démontrer le positionnement du faisceau.
- À l’aide de la valeur α/β prédéterminée, déterminer le schéma de dose qui fournit l’approche la plus raisonnable pour répondre à une question de recherche (c.-à-d. si vous voulez modéliser les effets d’une dose de 30Gy administrée en 10 fractions de 3 Gy, mais que vous souhaitez seulement donner quatre fractions). En utilisant l’équation 14, avec une valeur α/β présumée de 10 (cette valeur peut être déterminée pour les lignées individuelles de cellules cancéreuses dans le protocole 3) et un LIT similaire à celui de 30 Gy/10 F, traiter avec 24 Gy en 4 fractions de 6 Gy.
- Traiter l’animal pour le temps prescrit donné pour la dose désirée.
6. Confirmation histologique du dépôt de dose in vivo
- Suivant le protocole 5, recueillir les tissus d’intérêt dans les 1 heures suivant letraitement 15,16. Après la récolte de tissu, procédez avec le protocole préféré d’immunohistochimie. Un exemple est donné ci-dessous.
- Perfuser l’animal avec le froid glacial 4% paraformaldéhyde (PFA).
- Post-correction en PFA à 4 °C.
- Après fixation, fixer les tissus séquentiellement en 10%, 20%, et 30% saccharose pendant 24 heures chacun à température ambiante.
- Intégrer le tissu dans la gélatine et fixer séquentiellement dans 4% PFA et à nouveau dans 10-30% saccharose pendant 24 heures chacun à température ambiante.
- Couper le bloc et placer à -80 °C pendant 30 minutes.
- Couper le tissu en sections de 20 à 30 μm.
- Immunostain glisse sous forme de sections flottantes libres dans un six puits17,18.
- Laver trois fois et perméabiliser pendant 30 minutes sur un shaker avec 1,83% de lysine dans 1% de Triton, et 4% de sérum de chèvre inactivé par la chaleur.
- Incuber les sections avec anticorps anti-γH2AX pendant 24 heures, suivies d’une incubation de 2 heures avec l’anticorps secondaire désiré.
- Glissades coverslip avec des couvertures en verre à l’aide de supports de montage préférés.
- Image sur un microscope fluorescent.
Résultats
Suivant le protocole 1 fournira un taux de dose dans Gy / min, qui est spécifique à l’irradiateur utilisé. Toutefois, quel que soit le type d’irradiateur, avec un taux de dose connu, une courbe d’étalonnage peut être générée à l’aide du protocole 2 donnant des films similaires et d’une courbe d’étalonnage similaire à celle de la figure 2A-B. Un essai réussi du protocole 3 donnera des colonies distinctes et bien délimitées de cellules qui tachent homogénéement violet. L’estimation de α/β peut être comparée aux valeurs de la littérature ou à d’autres groupes de traitement pour interpréter la radio-sensibilité de la lignée cellulaire donnée. En utilisant la courbe d’étalonnage élaborée selon le protocole 2 et affichée à la figure 2B,le protocole 4 donnera deux échantillons de film ressemblant à la figure 2A qui peuvent être utilisés pour estimer les temps d’irradiation expérimentale requis. Si une caméra d’imagerie du portail à bord est disponible pour l’irradiateur utilisé, des radiogrammes de petits animaux peuvent être obtenus avec et sans collimation. La superposition de ces images démontrera le positionnement exact du faisceau de rayonnement collimé par rapport au petit animal traité tel qu’il est représenté à la figure 4A. Le dépôt réussi de dose dans le protocole 5 peut être confirmé suivant le protocole 6. Une indication que le rayonnement est déposé dans un système in vivo ou in vitro est par la détection de ruptures d’ADN doubles échoués. Illustrée dans la figure 4B, la même souris traitée uniquement par l’hémisphère droit de la figure 4A, ne démontre une coloration positive de γH2AX que dans l’hémisphère traité. Dans ce chiffre, les noyaux sont tachés de DAPI pour montrer deux choses; 1) l’ensemble sont du cerveau que l’anticorps anti γH2AX a été appliqué à pendant l’analyse histologique, et 2) l’hémisphère non traité du cerveau reste non taché.
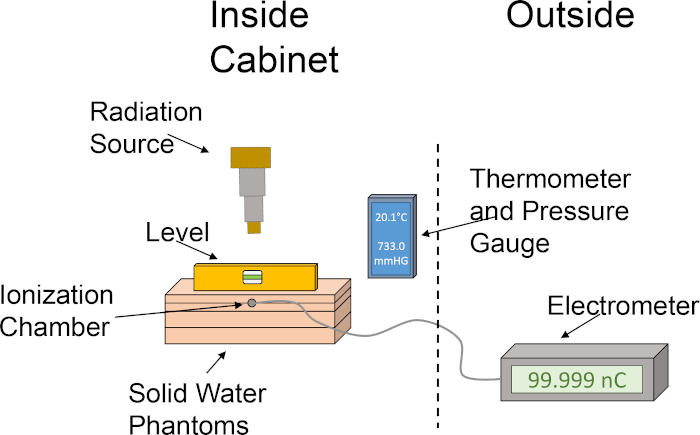
Figure 1 : Mise en place approximative d’une chambre d’ionisation et d’un fantôme d’eau mis en place pour déterminer la production de dose. Le pictogramme illustre une configuration de base utilisant les différents composants nécessaires à la dosimétrie à l’aide d’une chambre d’ionisation et de fantômes d’eau solide dans l’armoire de l’irradiateur. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : Génération d’une courbe d’étalonnage à l’aide d’un film radiochromique. (A) Changement représentatif de couleur du film radiochromique avec une dose croissante. En haut à gauche (0 cGy); en bas à droite (2000 cGy). (B) Courbe potentielle d’étalonnage des films radiochromiques comparant la densité optique nette et la dose. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
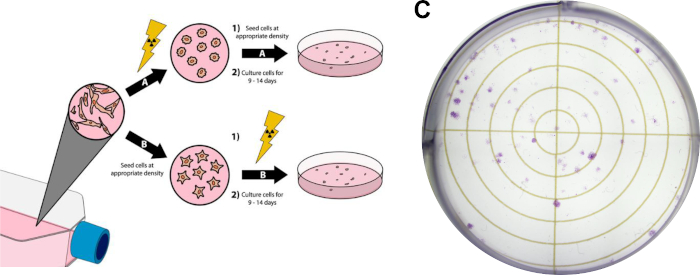
Figure 3 : Analyse clonogène des cellules cancéreuses. La radiothérapie des cellules peut être effectuée avant le placage dans six assiettes de puits/boîtes de Pétri (A), ou après (B). Dans le panneau (C), une image représentative est affichée d’un essai clonogène réussi avec des cellules cancéreuses de sein de MDA-MB-231 après avoir suivi la section 3 de protocole. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
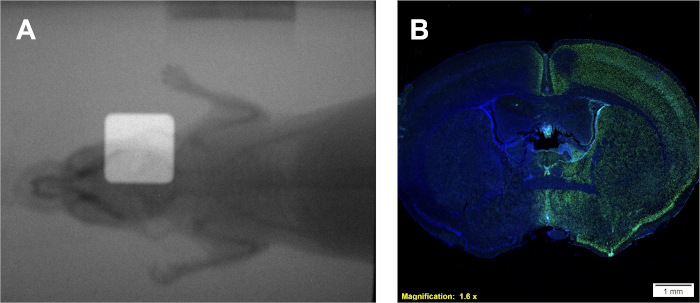
Figure 4 : Utilisation de radiogrammes à double superposition pour le positionnement (le cas s’il y a lieu) et de taches immunohistochimiques positives γH2AX pour la confirmation du dépôt de dose. (A) Radiogrammes superposés représentatifs représentant le placement du faisceau de rayonnement. (B) Résultats représentatifs indiquant le dépôt de dose à l’hémisphère droit comme démontré par l’intensité accrue de γH2AX. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| Facteur de correction | Explication | |
| Nν (Nン) | Facteur d’étalonnage du kerma d’air | |
| [(μen/ρ)Wair] l’eau | Ration des coefficients d’absorption d’énergie de masse de l’eau à l’air; environ 1,05 | |
| Pq,Cham | Correction de la tige de chambre affectant la perterbation de fluence de photon par chambre ; environ 1.022 | |
| GaineP | Correction de la comptabilité de la gaine protégeant la chambre d’ionisation; valeur de 1, car la chambre est imperméable à l’eau | |
| Pol P | Facteur de correction tenant compte de la polarité; déterminé dans le Protocole 1 | |
| Pion | Facteur de correction tenant compte de la recombinaison irationnelle; déterminé dans le Protocole 1 | |
| PTp | Acocunting de facteur de correction pour la temerpature et la pression le jour de l’expérience ; déterminé dans le Protocole 1 | |
Tableau 1 : Facteurs de correction nécessaires à la détermination du taux de dose dans le Protocole 1.
| Dose | ¡n |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| * Seulement nécessaire pour les doses supérieures à 10 pour les expériences individuelles. | |
Tableau 2 : Doses à utiliser dans la génération de courbes d’étalonnage de films radiochromiques.
Discussion
Le protocole ci-dessus décrit une approche conviviale pour la dosimétrie des radiations, la détermination des valeurs de α/β dans les lignées de cellules cancéreuses, et un bref exemple d’une approche pour l’irradiation dans un modèle préclinique de métastase cérébrale du cancer du sein. Ces méthodes peuvent être utilisées pour étudier n’importe quel modèle de cancer et ne se limitent pas aux métastases cérébrales du cancer du sein. Dans cette section, nous discuterons des subtilités pertinentes sous-jacentes aux expériences de radiothérapie préclinique.
La dosimétrie comporte deux parties : 1) calibrer la sortie avec une chambre d’agriculteur, de sorte que le taux de dose de l’unité de rayon X soit établi, et 2) préparer un système pratique de mesure de dosimétrie utilisant le film radiochromique. En ce qui concerne l’étalonnage des sorties, le TG-61 fournit une méthode reproductible dans l’eau. Le protocole utilise ici gammex RMI 457 eau solide, comme recommandé par XStrahl, le fabricant de l’irradiateur. Bien que l’analyse de la dosimétrie relative (profils ou courbes de dose de profondeur normalisées à dose maximale) avec de l’eau solide, accepte de mieux que 1% avec celle de l’eau, il ya une différence d’environ 3 à 4% en dose absolue en raison d’un coefficient d’absorption d’énergie de masse plus élevé pour l’eau solide par rapport à l’eau. Cependant, comme toutes les installations du système XStrahl utilisent le protocole d’eau solide pour l’étalonnage de sortie, nous n’avons pas correct pour ces différences. Connaître la sortie permet de calcul du temps d’exposition requis pour fournir une dose désirée. Placer le film dans la même configuration que la chambre d’agriculteur nous permet de livrer des doses connues pour le film. La numérisation du film fournit alors des densités optiques. La dose au film peut ensuite être graphique par rapport à la densité optique nette correspondante (différence de densité optique après et avant l’exposition). Cela produit une courbe d’étalonnage du film. Lorsque nous changeons de configuration expérimentale, le taux de dose dans cette situation pourrait changer, puisque le taux de dose dépend de la taille du champ, de la profondeur et du matériau irradié. Exposer le film avec la configuration expérimentale nous fournit une densité optique nette, et en utilisant la courbe d’étalonnage du film, nous pouvons alors déterminer la dose correspondante. En divisant cette dose au moment où le film a été irradié, nous obtenons le taux de dose. Ce taux de dose peut ensuite être utilisé pour calculer le temps d’exposition pour fournir une dose désirée pour la configuration expérimentale donnée. Le protocole décrit ci-dessus gère plusieurs nuances associées à la dosimétrie cinématographique. Par exemple, après exposition, le film nécessite environ 24 heures pour que les réactions chimiques dans la couche active du film soient pratiquement complètes. Ne pas attendre cette quantité de temps conduira à une densité optique plus faible.
Pour que toute étude ait une dosimétrie reproductible, il est important de connaître et de comprendre plusieurs des éléments clés d’un irradiateur donné. En particulier, il est crucial de connaître et de détailler à d’autres chercheurs la le type de source (rayons X, radioactifs, etc.), l’énergie, la couche de demi-valeur, la taille du champ, la source à la surface et la source aux distances isocenter, la taille des matériaux irradiés, l’atténuation avant et rétro-dissquer après le matériau irradié, le taux de dose spécifique à l’expérience, le schéma de fractionnement, l’équipement de dosimétrie exacte utilisé et le protocole de dosimétrie utilisé. Tous ces points d’information sont ce qui décrit de façon cohérente la qualité du faisceau d’un irradiateur donné avant de fournir une dose à n’importe quel animal oucellule 19. Un autre point d’information pertinent de ce protocole et d’autres est que le taux de dose atteint dans le protocole 1 est simplement la sortie de l’irradiateur utilisé. Pour toute expérience donnée, il est important de définir le taux de dose pour cette configuration particulière (Protocole 4) par rapport à une courbe d’étalonnage de film radiochromique généré (Protocole 2).
L’expérimentation in vitro fournit des détails importants sur le comportement radiologique des lignées cellulaires cancéreuses. Les analyses de survie des cellules clonogéniques in vitro estiment et quantifient avec précision la sensibilité radio inhérente d’une lignéecellulaire 20,ce qui aide à la conception de calendriers de fractionnement dans des expériences cellulaires ou sur de petits animauxsubséquentes 21. Plus précisément, ces analyses des valeurs approximatives pour les paramètres α et β qui sont utilisés dans le modèle linéaire-quadratique pour prédire la mort cellulaire en réponse à la radiothérapie selon l’équation:
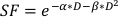 (Équation 9)
(Équation 9)
où SF est la fraction survivante des cellules clonogènement viables, D est dose de rayonnement dans Gy, et α et β sont des paramètresmontés 22. Le rapport α/β fournit une mesure inhérente de la radio-sensibilité cellulaire, avec des valeurs plus élevées se corrélant avec une sensibilité accrue d’une lignéecellulaire 22. Puisque cette relation fonctionnelle est non linéaire en ce qui concerne la dose, les effets biologiques d’un régime de fractionnement de radiothérapie sont non seulement liés à la dose totale livrée mais également au nombre et à la taille des fractions23. La dose biologique efficace (BED) est une mesure de la vraie dose biologique fournie à un tissu et permet la comparaison directe des différents schémas de fractionnements24,25. L’équation bed ne nécessite qu’une estimation α/β, et s’affiche ci-dessous :
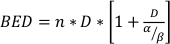 (Équation 14)
(Équation 14)
où n est le nombre de fractions de dose D. Tests de survie des cellules clonégéniques estimer α/β et faciliter la comparaison directe des schémas de fractionnement de radiothérapie via l’équation bed. Des conclusions erronées peuvent être tirées concernant une réponse tissulaire ou organique à la radiothérapie (ou des combinaisons de radiothérapie avec d’autres modalités) si le BED dans les groupes de traitement n’est pas équitable à l’intérieur ou entre les expériences. Par exemple, 2 fractions de 10 Gy contre 4 fractions de 5 Gy ne donnent pas le même BED, et donc ces schémas de dosage ne peuvent pas être directement comparés en termes de réponse biologique. L’équation bed, bien qu’imparfaite en raison des limitations inhérentes au modèle linéaire-quadratique, estime de manière fiable les effets équitables pour un large éventail de conditions detraitement expérimental 24,25.
Les tests de survie des cellules clonogènes jouent clairement un rôle important dans l’étude des effets de la radiothérapie dans les modèles de cancer, mais l’expérimentation in vitro offre un certain nombre d’options supplémentaires pour explorer davantage les détails mécanistes de la radiobiologie des cellules cancéreuses. De simples modifications de l’analyse de survie des cellules clonogéniques ont été utilisées pour déterminer les modes d’action de certaines chimiothérapies radio-sensibilisantes, comme le paclitaxel ou l’étoposide26,27. D’autres options expérimentales in vitro incluent des études d’immunocytochimie pour examiner des voies cellulaires spécifiques de réparation, telles que des foyers de γ-H2AX et/ou la coloration 53BP1 pour la réparation double-brin de ruptured’ADN 28. Ces expériences peuvent être d’un intérêt particulier lorsque l’on compare la radiothérapie comme une modalité unique avec des thérapies combinées, en particulier lors de l’enquête des détails mécanistes pour une lignée cellulaire donnée. D’autres options expérimentales incluent des mesures de cytokine pour examiner le rôle inné de la réponse inflammatoire d’une cellule à l’irradiation ou des analyses du mode de mort cellulaire (c.-à-d., apoptose, nécrose, catastrophe mitotique, etc.) dans différentes conditions thérapeutiques29,30,31. Ce type d’expérimentation peut compléter ou remplacer l’expérimentation animale et fournir une compréhension plus complète de la radiobiologie d’une lignée de cellules cancéreuses. Indépendamment du choix des expériences additionnées à mener, un essai clonogène standard de survie de cellules tel que décrit dans le protocole 3 est une évaluation radiologique initiale importante d’une ligne cellulaire.
Les essais clonogéniques et la dosimétrie des radiations fournissent au chercheur un moyen de planifier avec précision des expériences qui ressemblent plus directement à des scénarios cliniques. Avec l’ajout de modèles précliniques de petits rongeurs atteints de cancer, il est possible d’étudier la réponse aux radiations seules ou dans le cadre d’un plan de traitement in vivo. Avant d’utiliser des animaux, il est important de déterminer la dose relative de sortie de la configuration spécifique si elle diffère de la configuration utilisée pour la détermination de la sortie de dose32,33. Lorsqu’il s’agit de déterminer un taux de dose pour les tailles de champ de <10 mm, l’utilisation d’une chambre d’ionisation devient moins précise en raison de l’alignement dans un petit champ et des effets moyens partiels de volume33. L’utilisation du film radiochromique pour déterminer la sortie en combination avec des expériences immunohistochimiques in vivo a été employée pour déterminer la sortie et le dépôt de dose dansles 16derniers ,34,35,36,37,38.
Déclarations de divulgation
Les auteurs n’ont aucune divulgation à faire.
Remerciements
Les auteurs remercient les faciliteurs d’imagerie microscope et modèles animaux de la WVU pour l’utilisation de leur équipement appuyé par le numéro de subvention P20GM103434. En outre, ces travaux ont été soutenus par le numéro de subvention P20GM121322 de l’Institut national des sciences médicales générales, par le numéro de subvention de l’Institut national du cancer F99CA25376801, et le Fonds de dotation de la chaire Mylan.
matériels
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
Références
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5(2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001(2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104(2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. Radiobiology for the radiologist. Eighth edition. , Wolters Kluwer. (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96(2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251(2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204(2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134(2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon