Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Échantillonnage et traitement du brossage nasal à l’aide de la vidéomicroscopie ciliaire numérique à grande vitesse – Adaptation à la pandémie de COVID-19
Dans cet article
Résumé
Pour garantir une analyse fonctionnelle ciliaire réussie et de haute qualité pour le diagnostic de la DCP, une méthode précise et minutieuse d’échantillonnage et de traitement de l’épithélium respiratoire est essentielle. Afin de continuer à fournir des services de diagnostic de la DCP pendant la pandémie de COVID-19, le protocole de vidéomicroscopie ciliaire a été mis à jour pour inclure des mesures appropriées de contrôle des infections.
Résumé
La dyskinésie ciliaire primitive (DCP) est une ciliopathie mobile génétique, entraînant une maladie otosinopulmonaire importante. Le diagnostic de la DCP est souvent manqué ou retardé en raison de défis liés aux différentes modalités de diagnostic. La vidéomicroscopie ciliaire, utilisant la vidéomicroscopie numérique à grande vitesse (DHSV), l’un des outils de diagnostic de la DCP, est considérée comme la méthode optimale pour effectuer une analyse fonctionnelle ciliaire (CFA), comprenant l’analyse de la fréquence des battements ciliaires (CBF) et du diagramme de battement (CBP). Cependant, le DHSV ne dispose pas de procédures opérationnelles normalisées et publiées pour le traitement et l’analyse des échantillons. Il utilise également l’épithélium respiratoire vivant, un problème important de contrôle des infections pendant la pandémie de COVID-19. Afin de continuer à fournir un service de diagnostic pendant cette crise sanitaire, le protocole de vidéomicroscopie ciliaire a été adapté pour inclure des mesures adéquates de contrôle des infections.
Nous décrivons ici un protocole révisé pour l’échantillonnage et le traitement en laboratoire des échantillons respiratoires ciliés, en soulignant les adaptations apportées pour se conformer aux mesures de contrôle des infections COVID-19. Les résultats représentatifs de l’ACF provenant d’échantillons de brossage nasal obtenus chez 16 sujets sains, traités et analysés conformément à ce protocole, sont décrits. Nous illustrons également l’importance d’obtenir et de traiter des bandelettes ciliées épithéliales de qualité optimale, car les échantillons ne répondant pas aux critères de sélection de la qualité permettent maintenant la CFA, ce qui peut diminuer la fiabilité diagnostique et l’efficacité de cette technique.
Introduction
La dyskinésie ciliaire primitive (PCD) est une ciliopathie motile hétérogène héréditaire, dans laquelle les cils respiratoires sont stationnaires, lents ou dyskinétiques, entraînant une altération de la clairance mucociliaire et une maladie oto-sino-pulmonaire chronique 1,2,3,4. Les manifestations cliniques de la DCP sont la toux grasse chronique et la congestion nasale chronique débutant dès la petite enfance, les infections récurrentes ou chroniques des voies respiratoires supérieures et inférieures entraînant une bronchectasie, ainsi que l’otite moyenne et la sinusite récurrentes ou chroniques 5,6,7. Environ la moitié des patients atteints de DCP présentent des défauts de latéralité d’organe tels que situs inversus ou situs ambiguus. Certains patients présentent également des problèmes d’infertilité dus au sperme immotile chez les hommes et aux cils immotiles dans les trompes de Fallope chez les femmes 1,2,8. La DCP est rare, mais sa prévalence est difficile à définir et varie de 1:10 000 à 1:20 000 9,10. Cependant, la prévalence réelle de la DCP est considérée comme plus élevée en raison des difficultés de diagnostic et de l’absence de suspicion clinique. Les symptômes de la DCP imitent les manifestations respiratoires courantes d’autres affections respiratoires aiguës ou chroniques, et les difficultés diagnostiques liées à la confirmation du diagnostic sont bien connues, ce qui entraîne un traitement et un suivi inadéquats 2,5,9,11.
La vidéomicroscopie ciliaire, utilisant la vidéomicroscopie numérique à grande vitesse (DHSV), est l’un des outils de diagnostic de la DCP 4,8,12,13. Le DHSV est considéré comme la méthode optimale pour effectuer une analyse fonctionnelle ciliaire (CFA), comprenant l’analyse de la fréquence des battements ciliaires (CBF) et du diagramme de battement (CBP) 2,14,15,16. Le DHSV utilise un épithélium respiratoire vivant, généralement obtenu par brossage nasal13.
Compte tenu de l’épidémie actuelle de COVID-19, la confirmation d’un diagnostic de DCP est désormais encore plus importante, car les preuves suggèrent que la maladie respiratoire sous-jacente peut entraîner de pires résultats après une infection à COVID-19 17,18. Un service de diagnostic sûr et efficace de la DCP pendant la pandémie actuelle permettra également aux patients atteints de DCP confirmés de bénéficier de mesures de protection supplémentaires, par rapport à la population générale19.
La transmission de la COVID-19 se produit principalement par la propagation de gouttelettes20. Le potentiel élevé de transmission chez les patients asymptomatiques (ou peu symptomatiques) est suggéré par la charge virale élevée dans l’échantillon nasal20. De plus, si les particules virales deviennent aérosolisées, elles restent dans l’air pendant au moins 3 heures21. Par conséquent, les travailleurs de la santé respiratoire sont exposés à un réservoir élevé de charge virale lorsqu’ils prodiguent des soins cliniques et prélèvent des échantillons pour les techniques de diagnostic22. De plus, la manipulation d’échantillons respiratoires vivants expose le technicien à la contamination par la COVID-19. Alors que les recommandations de pratiques exemplaires pour les médecins respiratoires et les chirurgiens ORL qui soignent des patients atteints de COVID-19 sont mises en œuvre23, il y a un manque de recommandations pour effectuer le DHSV pendant la pandémie de COVID-19.
Afin de continuer à fournir un service de diagnostic de la DCP, tout en assurant la sécurité du travailleur de la santé (effectuant le prélèvement d’échantillons) et du technicien (effectuant le traitement des échantillons), le protocole de vidéomicroscopie ciliaire a dû être adapté pendant la pandémie de COVID-19. La technique de la vidéomicroscopie ciliaire est actuellement limitée au service de recherche et aux centres de diagnostic spécialisés, car le CFA nécessite une formation et une expérience approfondies. En outre, il existe actuellement un manque de normalisation et de procédures opérationnelles précises pour le traitement et l’analyse des échantillons à l’aide du DHSV 4,13.
L’objectif de cet article est de décrire les procédures opérationnelles normalisées pour le DHSV, en particulier les mesures de contrôle des infections et la sécurité lors de l’échantillonnage et du traitement de l’épithélium nasal vivant. Cela permettra de poursuivre le diagnostic et les soins de haute qualité de la DCP, malgré l’épidémie actuelle de COVID-19.
Protocole
L’approbation a été obtenue du comité d’éthique hospitalo-facultaire de Liège et du Département universitaire d’hygiène et de protection de la santé au travail.
1. Prélèvement d’épithélium cilié respiratoire
- Assurez-vous que les sujets sont exempts d’infection pendant au moins 4 à 6 semaines et exempts de médicaments nasaux et inhalés avant l’échantillonnage.
- Préparer la préparation M199 supplémentée : Supplément Cell Culture Medium 199 (M199) (500 mL) avec une solution antibiotique (5 mL de streptomycine/pénicilline (50 μg/mL)) et une solution antifongique (5 mL d’amphotéricine B (2,5 μg/mL)).
- Préparer 2 tubes coniques (un pour chaque narine) de 15 mL avec des couvercles et remplir chacun d’eux avec 3 mL de M199 supplémenté.
- Préparez une brosse de cytologie bronchique (épaisseur: 2 mm et longueur: 11 mm). Coupez l’extrémité du fil pour vous assurer que la brosse mesure environ 15 cm de long (Figure 1A,B). Pour tenir la brosse lors du brossage nasal, utilisez une pince nasale Weil-Blakesley (Figure 1B).
- Adaptation à la COVID-19 : Évitez de traiter un échantillon d’épithélium nasal vivant de statut inconnu pour la COVID-19, testez le patient pour la COVID-19 48 à 72 heures avant le brossage nasal pour la vidéomicroscopie ciliaire. Ce test COVID-19 consiste en une réaction en chaîne de la polymérase à partir d’un échantillon d’écouvillonnage nasopharyngé24,25. Comme le statut du patient pour la COVID-19 est inconnu à ce stade, le médecin et les membres du personnel doivent être adéquatement protégés23,26, y compris un masque FFP2, des gants, un écran facial ou des lunettes de protection, et une blouse à manches longues résistante à l’eau. En cas de test PCR indisponible, impossible ou douteux, effectué tout le traitement du brossage nasal dans le laboratoire de biosécurité L2. En cas de statut COVID-19 positif, reporter le test de diagnostic de DCP et envisager d’autres approches pour prendre en charge le patient.
PRUDENCE: Cet échantillonnage par écouvillonnage nasopharyngé pour le dépistage de la COVID-19 pourrait induire une dyskinésie ciliaire secondaire en endommageant l’épithélium ciliaire respiratoire nasal27,28. Pour éviter cela, introduisez un coton-tige mince dans la cavité nasale jusqu’au nasopharynx sous contrôle endoscopique rigide, en évitant de blesser les cornets ou le septum. L’échantillon est ensuite prélevé dans le nasopharynx et retiré le coton-tige sous le contrôle de l’endoscope rigide. Avec un équipement adéquat, une endoscopie rigide 0° est facilement réalisée chez les adultes et les enfants sans traumatisme.
2. Obtention d’échantillons d’épithélium cilié respiratoire
Adaptation à la COVID-19: Même si le statut COVID-19 du patient est négatif, en raison du taux de faux négatifs, le patient est invité à garder un masque chirurgical sur sa bouche pendant la procédure, et des gants, un masque FFP2 et un écran facial sont portés par le médecin.
- Préparation au brossage nasal
- Demandez au patient de se moucher.
- Effectuer un brossage nasal sous endoscopie nasale ou en aveugle. Si vous utilisez une endoscopie nasale, examinez les 2 narines avant le brossage nasal (ne pas répéter si vous avez déjà fait 48-72 pour un écouvillonnage nasal COVID-19). L’examen permet de vérifier l’état de la muqueuse (un degré élevé d’inflammation peut provoquer des saignements lors du brossage nasal, ...), l’état du cornet inférieur (pour exclure la présence de télangiectasies par exemple), et si le septum nasal est droit (Figure 1C).
- Demandez au patient de s’allonger ou de s’asseoir confortablement, la tête reposant en arrière sur la chaise (car le brossage nasal provoque un réflexe de recul de la tête). Un deuxième soignant tient la tête pendant le brossage nasal, en particulier chez les enfants.
- Agiter la brosse dans le M199 complété avant le brossage nasal (humidifier la brosse réduit l’irritation causée par le brossage).
REMARQUE: La brosse peut être humidifiée dans le M199 complété; Si le patient est allergique aux antibiotiques (la pénicilline et la streptomycine sont présentes dans le milieu de culture cellulaire supplémenté), humidifiez la brosse dans une solution saline.
- Brossage nasal
- Insérez délicatement le brossage nasal sans anesthésie locale ou générale13. Si vous utilisez l’endoscopie nasale, placez l’endoscope à l’entrée du nez pour visualiser le trouble nasal inférieur, puis insérez la brosse cytologique dans le nez. Si vous effectuez un brossage nasal « aveugle », insérez la brosse dans le nez, en suivant le plancher nasal (Figure 1D).
REMARQUE: Certains centres de diagnostic utilisent une anesthésie locale avec un tampon de naphazoline pour effectuer le brossage nasal. - Déplacez la brosse postérieurement et antérieurement plusieurs fois sur la partie postérieure du cornet nasal inférieur, puis retirez-la. L’opérateur doit sentir que la brosse frotte l’épithélium et que le patient peut ressentir un œil larmoyant unilatéral sur le côté du brossage.
REMARQUE: Si le brossage nasal est effectué trop antérieurement, aucune cellule ciliée ne sera obtenue, car la cavité nasale antérieure est tapissée d’un épithélium transitionnel non cilié. - Après l’échantillonnage, placer immédiatement les échantillons de brossage nasal dans le milieu de culture. Les bandelettes épithéliales respiratoires obtenues sont délogées en agitant la brosse dans le tube contenant le M199 supplémenté, puis ferment le tube (Figure 1E).
- Adaptation à la COVID-19 : Ne pas déloger les bandes épithéliales en agitant la brosse dans le M199 supplémenté immédiatement après l’échantillonnage. Placez la brosse dans le tube, coupez le fil pour qu’il puisse s’adapter complètement à l’intérieur du tube et fermez immédiatement le tube. Placez l’échantillon dans un double sac hermétique.
- Insérez délicatement le brossage nasal sans anesthésie locale ou générale13. Si vous utilisez l’endoscopie nasale, placez l’endoscope à l’entrée du nez pour visualiser le trouble nasal inférieur, puis insérez la brosse cytologique dans le nez. Si vous effectuez un brossage nasal « aveugle », insérez la brosse dans le nez, en suivant le plancher nasal (Figure 1D).
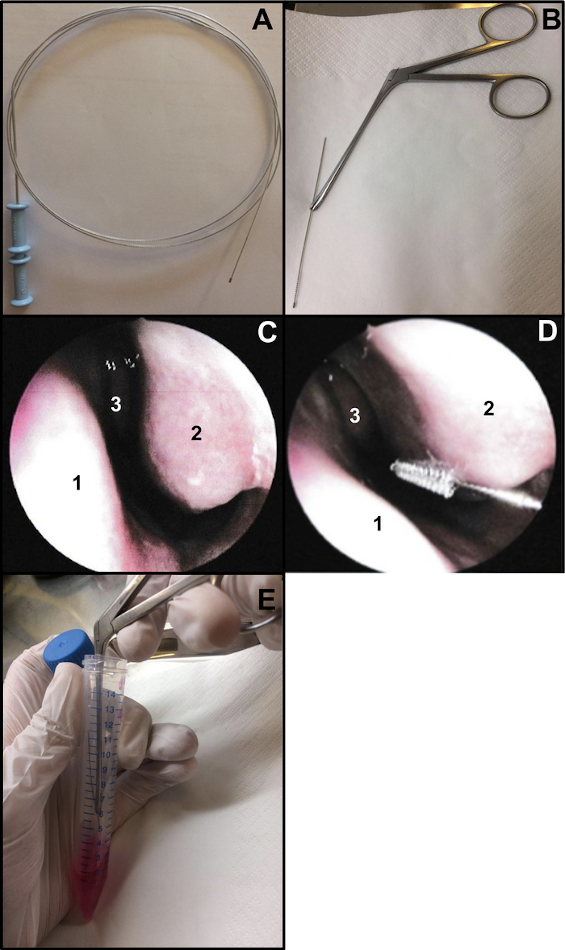
Figure 1 : Technique de brossage nasal. (A) Brosse cytologique bronchique entière (B) Prêt à brosser: l’extrémité de brossage du fil est coupée (environ 15 cm de long) et maintenue par une pince nasale Weil-Blakesley (C) Vue endoscopique de la cavité nasale: septum (1) cornets inférieurs (2) et cornets moyens (3) (D) Le brossage nasal est effectué sur la partie postérieure du cornet inférieur (2). Cloison nasale (1) Cornets moyens(3). (E) Les bandelettes épithéliales respiratoires sont délogées en secouant la brosse dans le milieu de culture cellulaire M199 supplémenté. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Traitement de l’épithélium cilié respiratoire
- Analyser les échantillons de brossage nasal au microscope dans les 9 heures suivant l’échantillonnage, car le CBF et le CBP sont stables dans ce laps de temps (données non publiées).
- Utilisez un microscope à lumière verticale ou inversée, avec un contraste de phase par immersion dans l’huile x100 ou une lentille de contraste interférentiel. Idéalement, placez le microscope sur une table antivibratoire, car les battements ciliaires peuvent être sujets à des artefacts dus à des vibrations externes (p. ex. provenant de la paillasse de laboratoire)13.
Adaptation à la COVID-19 : L’opérateur utilise un équipement de protection individuelle pour effectuer le traitement nasal, y compris un masque FFP2, des gants et une blouse à manches longues résistante à l’eau.
- Préparez la chambre de visualisation.
- Suspendez les bandes épithéliales ciliées dans une chambre de visualisation ouverte construite en laboratoire, permettant aux cils de battre librement tout en étant analysés au microscope. Cette chambre est créée par la séparation d’un glissement de couvercle (22 mm x 40 mm) et d’une lame de verre par deux glissières de couverture carrées adjacentes (20 mm x 20 mm), séparées par une distance de 15 mm, et collées sur la lame de verre12 (Figure 2, Figure 4A).
Adaptation à la COVID-19 : La chambre construite en laboratoire décrite ci-dessus est ouverte et permet l’échange de gaz et d’humidité entre l’échantillon et l’environnement13. Dans le contexte de la pandémie de COVID-19, il est possible d’utiliser une chambre de visualisation fermée à l’aide d’une entretoise collée double face, profondeur de 0,25 mm (Figure 3, Figure 4B). L’entretoise est collée sur la lame de verre, puis un couvercle (22 mm x 40 mm) est collé sur le dessus de l’entretoise.

Figure 2 : Montage de la chambre ouverte construite en laboratoire. (A) Les 2 lamelles carrées (20 mm x 20 mm) sont placées sur la lame de verre. (B) Les lamelles carrées du couvercle sont séparées par une distance d’environ 15 mm et collées sur la lame de verre. (C) La chambre est remplie entre les deux lamelles de couverture carrées adjacentes avec un petit échantillon (environ 60 μL) d’épithélium cilié dans le M199 supplémenté. (D) Une longue lamelle rectangulaire (22 mm x 40 mm) est placée sur les deux lamelles de couverture carrées adjacentes et recouvre la chambre. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Montage de la chambre fermée à l’aide d’une entretoise collée double face. (A) La glissière de verre et l’entretoise collée double face. (B) La protection est retirée d’un côté de l’entretoise et l’entretoise est ensuite collée sur la lame de verre. (C) La protection est retirée de l’autre côté de l’intercalaire collé double face, puis l’espaceur est rempli d’un petit échantillon (environ 60 μL) d’épithélium cilié dans du M199 supplémenté. (D) Une longue glissière rectangulaire (22 mm x 40 mm) est collée sur l’entretoise et ferme la chambre. Veuillez cliquer ici pour voir une version agrandie de cette figure.
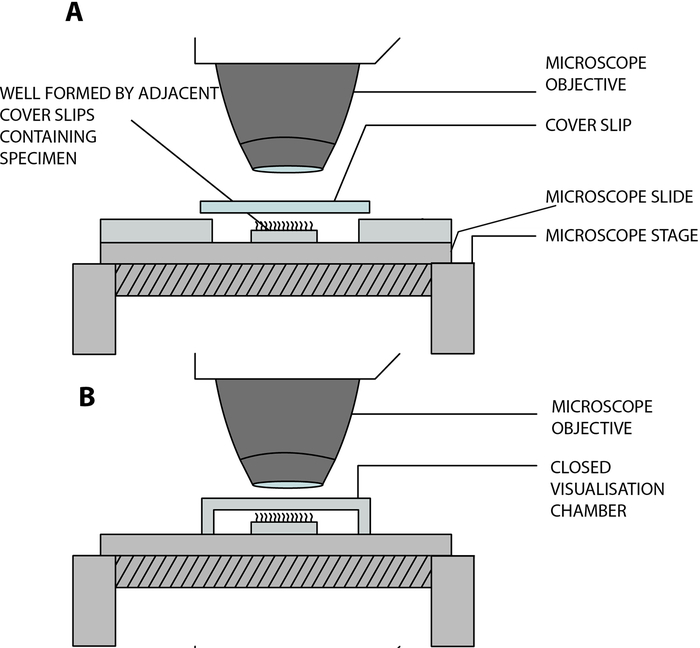
Figure 4 : Schéma de principe montrant les principales chambres de visualisation utilisées pour effectuer la vidéomicroscopie ciliaire à l’aide de la vidéomicroscopie numérique à grande vitesse (DHSV). (A) La technique de la goutte suspendue ouverte: l’échantillon cilié est suspendu dans une goutte de milieu de culture cellulaire dans une chambre ouverte créée par la séparation d’une lame de couverture et d’une lame de verre par deux lamelles de couverture adjacentes. (B) La technique de la goutte suspendue fermée: l’échantillon cilié est suspendu dans une goutte de milieu de culture cellulaire dans une chambre fermée créée par une entretoise prise en sandwich entre un côté en verre et un couvercle. L’entretoise colle fermement à la fois sur la lame de verre et sur le couvercle. Reproduit et modifié à partir de Kempeneers et al.13. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Contrôle de la température
- Entourez le microscope de papier bulle (Figure 5A,B).
- Fixez le chauffage de l’objectif autour de l’objectif à l’aide d’une bande velcro (Figure 5C)
- Allumez le contrôleur de chauffage de l’objectif 1 heure avant d’effectuer la vérification de la température de contrôle.
- Allumez le microscope et vérifiez que la configuration du microscope est terminée, car la quantité de lumière à travers l’échantillon peut modifier la température sur la lame.
- Mettez le contrôleur du boîtier chauffant (Figure 5D).
- Vérifiez que la sonde de référence fonctionne correctement avant de commencer. Tenez l’extrémité de la sonde de référence entre les doigts; Il devrait mesurer la température corporelle.
- Placez le média libre au milieu de la diapositive, entre les deux lamelles de couverture carrées adjacentes (20 mm x 20 mm) collées dessus.
- Placez la pointe de la sonde de référence dans le M199 complété. Couvrir avec une lamelle rectangulaire (22 mm x 40 mm). Assurez-vous que la sonde est complètement entourée de fluide (sinon la température pourrait baisser).
- Adaptation à la COVID-19 : Pour effectuer le contrôle de la température dans la chambre fermée à l’aide d’une entretoise, coupez un côté de l’entretoise (ce trou doit être de la même taille que la sonde de référence). Collez l’entretoise sur la lame de verre, placez le média libre au milieu de l’entretoise. Placez l’extrémité de la sonde de référence dans la solution, à travers le trou de l’entretoise, puis collez une lame rectangulaire (22 mm x 40 mm) sur l’entretoise.
- Placez la glissière dans la plaque de la boîte chauffée. Fermez la boîte chauffée avec le couvercle.
- Ajouter de l’huile sur l’objectif d’immersion dans l’huile.
- Placez la boîte chauffée sur la platine du microscope.
- Régler la température de la plaque et du couvercle (la température du couvercle doit être supérieure de 2 °C à la température de la plaque pour éviter la condensation) pour mesurer 37 °C avec la sonde de référence dans le milieu.
- Attendre 5 minutes (temps nécessaire pour élever la température de l’échantillon à 37 °C).
- Ajustez l’objectif en le rapprochant de la diapositive jusqu’à toucher le capot avec la pointe de l’objectif.
- Déplacez l’objectif afin de voir le milieu de la sonde dans le microscope.
REMARQUE: Assurez-vous que la sonde est visible sur l’écran de l’ordinateur (afin de vérifier que le système de caméra fonctionne avant de regarder l’échantillon cilié). Lors de la visualisation du milieu de la sonde, l’écran est complètement noir. - Ajustez la température du chauffage de l’objectif (pour compenser la perte de température lorsque la lentille à immersion dans l’huile est en contact avec la lamelle de couverture). Assurez-vous de mesurer 37 °C avec la sonde de référence dans le milieu lorsque l’objectif touche le couvercle.
REMARQUE: Idéalement, travaillez dans une pièce avec une température contrôlée, de sorte que ces températures configurées ne changent pas. Si la température de la pièce n’est pas contrôlée, vous devez effectuer ce contrôle de température tous les jours avant d’effectuer la vidéomicroscopie ciliaire. - Après avoir vérifié la température, retirez la lame de la boîte chauffée.
- Nettoyez la lame et la pointe de la sonde de référence avec de l’alcool et rangez.
- Nettoyez la lentille avec de l’isopropanol et les tissus de nettoyage des lentilles avec des mouvements circulaires.

Figure 5 : Équipement utilisé dans le laboratoire DHSV. (A) Le microscope équipé d’une lentille de contraste de phase par immersion dans l’huile 100x est placé sur une table antivibratoire pour éviter que les vibrations externes ne provoquent des artefacts pour l’analyse fonctionnelle ciliaire (B) Le microscope est entouré de papier bulle pour empêcher la perte de chaleur de l’air ambiant. (C) L’objectif d’immersion dans l’huile crée une perte de chaleur. Cela peut être évité à l’aide d’un appareil de chauffage à lentilles (flèches). (D) L’échantillon est chauffé à l’aide d’un boîtier chauffant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Préparation des échantillons épithéliaux ciliés respiratoires
- Secouez doucement le tube pour permettre aux cils de s’étaler dans tout le tube (pour éviter que les cils ne restent collés sur d’autres bandes ciliées, du mucus ou des débris, qui les empêchent de battre librement).
NOTE : Cette étape est essentielle pour obtenir des « bords optimaux » de l’épithélium cilié (Figure 12). - Prélever environ 50 μL d’épithélium cilié dans du M199 supplémenté au milieu du tube à l’aide d’une pipette.
- Placer l’échantillon sur la chambre construite en laboratoire (entre les deux lamelles de couverture carrées adjacentes (20 mm x 20 mm)) et couvrir avec une lamelle rectangulaire (22 mm x 40 mm). Attention à ne pas ajouter de bulles.
- Adaptation à la COVID-19 : Effectuer les étapes 4.1 à 4.3 dans une enceinte de sécurité microbiologique. Procédure dans l’armoire de sécurité microbiologique.
- Allumez l’enceinte de sécurité microbiologique 10 minutes avant de préparer l’échantillon (pour vous assurer que l’environnement est stérile).
- Avant toute manipulation, désinfectez toute l’enceinte de sécurité microbiologique avec de l’éthanol à 70%.
- Désinfectez tout le matériel nécessaire avec de l’éthanol à 70% avant de le placer dans l’enceinte de sécurité microbiologique.
- Ouvrez les tubes coniques de 15 ml contenant les échantillons une seule fois sous l’enceinte de sécurité microbiologique, puis délogez les bandes épithéliales en agitant la brosse (à l’aide d’une pince nasale Weil-Blakesley) dans du M199 supplémenté.
- Collez l’entretoise sur la lame de verre et retirez la protection de l’entretoise collée double face.
- Secouez doucement le tube pour permettre aux cils de s’étaler dans tout le tube.
- Prélever un petit échantillon d’épithélium cilié dans du M199 supplémenté du milieu du tube à l’aide d’une pipette (environ 60 μL) et remplir l’espaceur.
- Collez le couvercle rectangulaire (22 mm x 40 mm) sur l’entretoise pour fermer la chambre.
- Désinfectez la lame avant de sortir de l’enceinte de sécurité microbiologique.
- Retirez la lame de l’enceinte de sécurité microbiologique.
- Changez de gants en sortant de l’enceinte de sécurité microbiologique.
- Attendez 10 minutes avant d’éteindre l’enceinte de sécurité microbiologique après utilisation (pour vous assurer que l’environnement de l’enceinte de sécurité microbiologique est stérile avant de fermer la porte).
- Placez la glissière dans la plaque de la boîte chauffée. Fermez la boîte chauffée avec le couvercle.
- Ajouter de l’huile sur l’objectif d’immersion dans l’huile.
- Placez la boîte chauffée sur la scène du microscope.
- Allumez la boîte chauffante et le chauffage de lentilles.
REMARQUE: Le chauffage de l’objectif doit être allumé 1 heure avant utilisation. - Ajustez les réglages de température de la boîte chauffante et des contrôleurs de chauffage de l’objectif en fonction des valeurs obtenues à l’étape 3.4.
- Attendez 5 minutes (temps nécessaire pour augmenter la température de l’échantillon jusqu’à 37 °C en utilisant des réglages prédéterminés pour la boîte chauffée et l’objectif chauffant).
- Approchez l’objectif de la diapositive jusqu’à toucher le capot avec la pointe de l’objectif.
5. Visualisation des bords ciliés respiratoires
- Fixez la caméra vidéo haute vitesse sur le microscope, connectez la caméra à l’ordinateur et allumez la caméra.
- Allumez l’ordinateur.
- Connectez la caméra de vidéomicroscopie numérique haute vitesse à l’ordinateur (de sorte que l’image visualisée à travers les lentilles oculaires soit projetée sur le moniteur) via le logiciel.
- Ouvrez le logiciel, puis le menu principal s’ouvre automatiquement (Figure 6A).
REMARQUE: Le logiciel est le programme utilisé dans le laboratoire pour l’acquisition et le traitement d’images. Le système permet d’enregistrer et de lire des séquences vidéo à une fréquence d’images réduite ou image par image. Il peut être téléchargé gratuitement. - Ouvrez la caméra (Figure 6A).
- Lorsque le filtre d’énumération de la caméra s’affiche , choisissez OK (Figure 6B).
- Sélectionnez Actualiser la liste; sélectionnez le nom de la caméra; choisissez Interface : Expert, puis sélectionnez Ouvrir (Figure 6C).
- Sur la ligne de commande de la caméra en haut du menu de la boîte de dialogue ancrée, sélectionnez En direct (Figure 6D).
- Choisissez Lecture pour afficher l’image et Arrêter pour terminer la visualisation (Figure 6D).
- Ouvrez le logiciel, puis le menu principal s’ouvre automatiquement (Figure 6A).

Figure 6 : Description de l’utilisation du logiciel : visualisation des bords respiratoires ciliés sur le moniteur. (A) Le menu principal apparaît directement lors de l’ouverture du logiciel. (b) Fermez le filtre d’énumération de la caméra. (C) Choisissez la caméra et sélectionnez Interface: Expert. (D) Le mode live permet de visualiser sur le moniteur l’image vue au microscope. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Réglez le paramètre d’acquisition de la caméra (dans le coin supérieur droit) (Figure 7).
- Dans Paramètres d’acquisition , choisissez Appareil photo, puis réglez la fréquence d’images : Taux (Hz) : 500 (voir ci-dessous) (Figure 7A).
- Dans Paramètres d’acquisition, choisissez Caméra, puis ajustez la région d’intérêt (ROI) (Figure 7A).
REMARQUE: Le retour sur investissement est calculé à l’aide d’une échelle graduée visualisée avec l’objectif d’immersion dans l’huile x100 et projetée sur le moniteur, pour définir le nombre de pixels correspondant à 50 μm (car vous souhaitez enregistrer des bords ciliés mesurant environ 50 μm (voir ci-dessous)). - Dans Paramètres d’acquisition, choisissez Enregistrer, puis ajustez la durée de la vidéo et le nombre total d’images enregistrées (une durée de 2 secondes, correspond à 1000 images si la fréquence d’images choisie est de 5OO Hz) (Figure 7B).
REMARQUE: D’après notre expérience, une durée vidéo minimale de 2 secondes est nécessaire pour permettre une analyse complète du CBF et du CBP. - Choisissez Fichier puis Save Camera Cfg pour enregistrer le nouveau paramètre d’acquisition (entrez un nom et, si nécessaire, un commentaire pour cette nouvelle configuration) (Figure 7C,D).
- Pour ouvrir cette nouvelle configuration de caméra, ouvrez Fichier et chargez la caméra Cfg (Figure 7C).
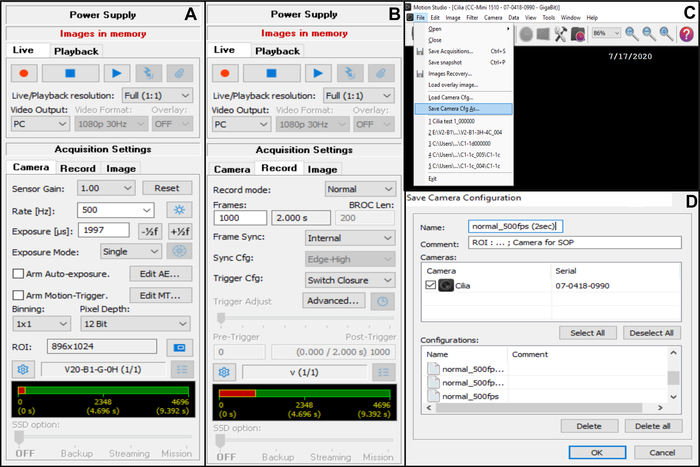
Figure 7: Description de l’utilisation du logiciel: réglage des paramètres d’acquisition de la caméra pour l’enregistrement vidéo des bords ciliés battants. (A) Sur le paramètre d’acquisition Caméra, ajustez la région d’intérêt (ROI) et la fréquence d’images pour l’enregistrement vidéo (Taux). (B) Sur le paramètre d’acquisition Enregistrement, ajustez la durée de l’enregistrement vidéo (nombre d’images nécessaires pour la durée d’enregistrement choisie, en fonction de la fréquence d’images choisie précédemment). (C) Ces nouveaux paramètres de configuration de caméra peuvent être enregistrés à l’aide de la fonction Save camera Cfg . Load Camera Cfg permet de rouvrir les paramètres de configuration enregistrés pour une utilisation ultérieure. (D) Les nouveaux paramètres de configuration de la caméra peuvent être nommés et un commentaire peut être ajouté si nécessaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Regardez à travers les lentilles oculaires et recherchez des cellules ou des débris dans l’échantillon, puis faites la mise au point.
- Vérifiez que l’image est visible sur le moniteur et améliorez la qualité de l’image en ajustant le condensateur (et le prisme DIC si vous utilisez une lentille de contraste d’interférence) et ajustez la mise au point si nécessaire.
- Rechercher des bandes d’épithélium cilié.
6. Sélection des bords ciliés respiratoires
NOTE: Le système expérimental permet de voir les cils battants dans trois plans distincts: un profil latéral, battant directement vers l’observateur et directement au-dessus (Figure 8).
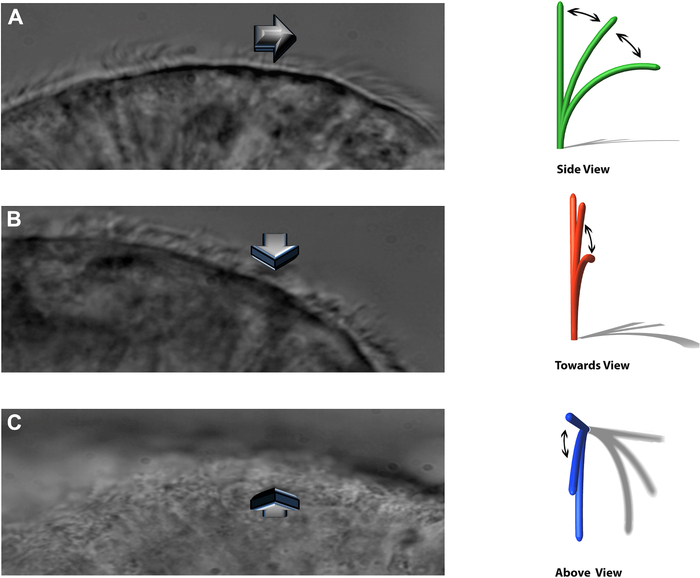
Figure 8 : La technique DHSV permet de voir les cils battants dans trois plans distincts. (A) dans le profil latéral. (B) frapper directement vers l’observateur et. (C) directement au-dessus. Reproduit d’après Kempeneers et al.16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- N’enregistrer que les bords épithéliaux ciliés intacts et non perturbés qui mesurent au moins 50 μm de longueur.
- Pour les enregistrements effectués sur le profil latéral, déterminer la qualité du bord selon le système de notation de Thomas et al.29 (figure 9). N’utiliser que des arêtes normales (figure 9A) ou des arêtes avec des projections mineures (figure 9B) pour l’analyse fonctionnelle ciliaire. Exclure les cellules isolées (figure 9E).

Figure 9 : Image représentative du système de notation par Thomas et al29 pour la qualité différente des bords épithéliaux ciliés. (A) Bord normal : défini comme une bande d’épithélium cilié uniforme intacte > 50 μm de longueur (B) Bord cilié avec projections mineures: défini comme un bord de >50 μm de longueur, avec des cellules faisant saillie hors de la ligne de bord épithéliale, mais sans point de la membrane cellulaire apicale faisant saillie au-dessus des extrémités des cils sur les cellules adjacentes (C) Bord cilié avec projections majeures: défini comme un bord de >50 μm de longueur, avec des cellules faisant saillie hors de la ligne de bord épithéliale, avec au moins un point de la membrane cellulaire apicale faisant saillie au-dessus des extrémités des cils sur les cellules adjacentes (D) Cellule ciliée isolée: définie comme la seule cellule ciliée sur un bord épithélial >50 μm de longueur (E) Cellules individuelles: définies comme des cellules ciliées qui n’ont aucun contact entre elles ou tout autre type de cellule. Barre d’échelle : 5,5 μm. Reproduit à partir de Thomas et al.29Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Effectuer la CFA en utilisant uniquement des cils exempts de mucus et de débris, et en battant dans le profil choisi pour le bord enregistré. Sélectionnez uniquement les arêtes ciliées qui permettent un minimum de 2 évaluations CBF et CBP (voir ci-dessous) le long de la bordure.
- Utiliser uniquement pour les échantillons CFA qui donnent un minimum de 6 arêtes battant dans le profil latéral et répondant aux critères ci-dessus; Analysez un maximum de 20 arêtes dans le profil latéral.
- Utiliser un minimum de 1 bord supplémentaire de cils battant au-dessus du profil de l’observateur pour caractériser le CBP.
7. Enregistrement du bord cilié
- Enregistrez le bord des cils battant à l’aide d’une fréquence d’images de caméra de 500 images par seconde et projetez-la sur un moniteur haute résolution. Une fréquence d’images minimale de 400 Hz est requise pour permettre l’analyse du CBF et du CBP13. Enregistrez un bord à une fréquence d’images de 30 images par seconde pour évaluer l’efficacité de l’élimination des particules.
- Sélectionnez En direct sur la ligne de commande de la caméra en haut du menu de la boîte de dialogue ancrée (Figure 6D).
- Choisissez Lecture pour afficher l’image et Arrêter pour terminer la visualisation (Figure 6D).
- Pour enregistrer une arête, appuyez sur Enregistrer (Figure 6D). Pour afficher l’enregistrement avant de l’enregistrer, allez sur la ligne de contrôle de l’appareil photo en haut du menu de la boîte de dialogue ancrée et sélectionnez Lecture. Choisissez Lecture pour visionner la vidéo enregistrée et Arrêter pour terminer la visualisation (Figure 10A).
REMARQUE: Arrêtez d’afficher le bord enregistré avant d’enregistrer.
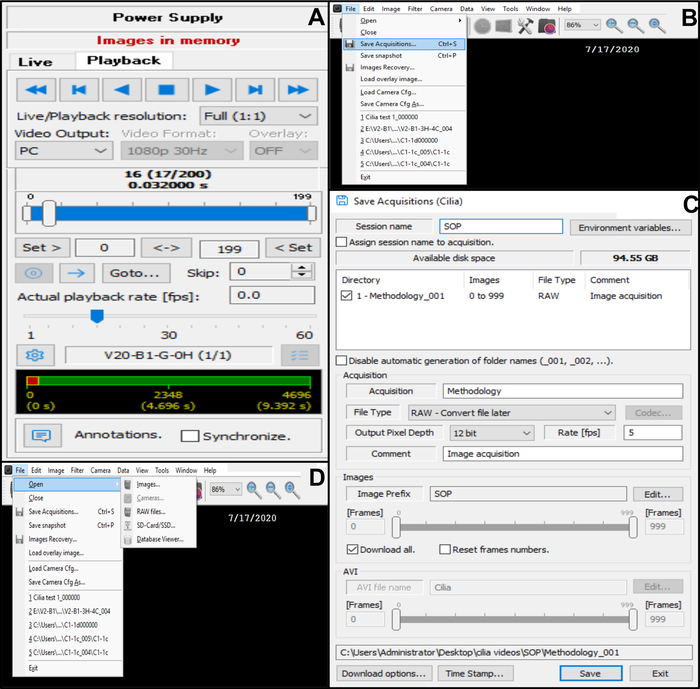
Figure 10 : Description de l’utilisation du logiciel. (A) Mode de lecture. Pour revoir une séquence vidéo enregistrée de battement de bord cilié, choisissez le mode de lecture. Choisissez Lecture pour afficher l’image et Arrêter pour terminer la visualisation. Le taux de renommée peut être ajusté pour améliorer l’analyse de la fonction ciliaire (B, C) Enregistrement des enregistrements vidéo des bords ciliés battants (B) Pour enregistrer la vidéo, choisissez Fichier puis Enregistrer les acquisitions. (C) Entrez le nom de la vidéo enregistrée et choisissez l’emplacement où la vidéo est enregistrée. Assurez-vous que l’enregistrement est enregistré au format . Fichier RAW (D) choix d’un enregistrement de battement de bords ciliés à analyser : Pour ouvrir un enregistrement vidéo, choisissez Fichier, puis Ouvrir, puis Images. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Enregistrez la vidéo dans la base de données (Figure 10B,C).
- Ouvrez Fichier dans le coin supérieur gauche, puis enregistrez les acquisitions (Figure 10B).
- Dans Enregistrer les acquisitions, entrez le nom de la vidéo enregistrée et assurez-vous que l’enregistrement est enregistré au format de type de fichier RAW (Figure 10C).
- Lorsque la vidéo est enregistrée, revenez au mode direct (revenez à la ligne de commande de la caméra en haut du menu de la boîte de dialogue ancrée et sélectionnez en direct) (Figure 6D).
- Répétez la procédure pour enregistrer le nombre d’arêtes répondant aux critères de sélection requis pour le CFA.
NOTE: Il est possible d’enregistrer plusieurs bords ciliés répondant aux critères de sélection d’une lame, dans un délai maximum de 20 minutes après la préparation de la lame (pour éviter la dessiccation). Après 20 minutes, s’il n’est pas possible d’obtenir suffisamment d’arêtes répondant aux critères de sélection, préparez une nouvelle diapositive. - Retirez la lame de la boîte chauffante.
- Retirez la housse rectangulaire et jetez-la dans le conteneur à déchets médicaux dangereux spécifique.
- Nettoyez la lame (avec les deux couvercles carrés collés dessus) avec de l’éthanol à 70% et du papier absorbant. Une fois la glissière propre, elle peut être réutilisée.
- Adaptation à la COVID-19 : Placez la glissière avec le couvercle et l’entretoise dans un sac hermétique, retirez les gants et le masque et placez-les dans le sac hermétique. Placez le sac hermétique dans le conteneur de déchets médicaux dangereux spécifique.
8. Analyse fonctionnelle ciliaire
- Préparation préliminaire pour effectuer l’évaluation manuelle du CBF et du CBP
- Ouvrez le logiciel.
- Ouvrez Fichier dans le coin supérieur gauche, puis Ouvrir , puis Images (Figure 10D).
- Choisissez la vidéo à analyser.
- Accédez à la ligne de commande de la caméra en haut du menu de la boîte de dialogue ancrée et sélectionnez Lecture (Figure 10A). Choisissez Lecture pour visionner la vidéo enregistrée et Arrêter pour terminer la visualisation.
- Analyse manuelle de la fréquence des battements ciliaires (CBF)
- Effectuez l’évaluation du CBF en utilisant uniquement les bords latéraux.
- Diviser les bords ciliés en environ 5 zones adjacentes, chacune mesurant environ 10 μm (figure 11).
- Identifiez et visualisez les cils ou les groupes de cils à une fréquence d’images réduite, et un maximum de 2 mesures CBF sont effectuées dans chaque zone, ce qui donne un maximum de 10 mesures CBF le long de chaque bord (Figure 11).
- Notez le nombre d’images nécessaires pour qu’un groupe de cils termine 5 cycles de battement.
- Convertissez en CBF par un calcul simple: (CBF = fréquence d’images d’enregistrement (Hz)/(nombre d’images pour 5 temps) x 5)13,16,30. Les cils immotiles sont signalés comme ayant un FBC de 0 Hz13.
REMARQUE: Ajustez la fréquence d’images lors de la lecture des vidéos enregistrées (Figure 10A). Ceci est particulièrement utile lorsque les cils analysés battent très lentement. L’augmentation de la fréquence d’images aide à définir si les cils battent très lentement ou sont immobiles. - Pour chaque échantillon, calculer le FBC moyen comme étant la moyenne (ET) ou (IC à 95 %) de tous les FBC enregistrés dans le profil latéral, y compris les cils statiques.
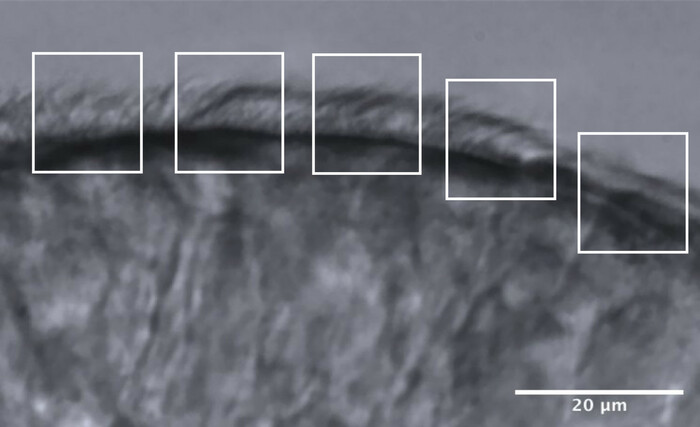
Figure 11 : Image représentative d’un bord de qualité optimal, et la division en 5 zones pour permettre l’analyse CFA. Un bord épithélial cilié de qualité optimale est fragmenté en 5 zones adjacentes mesurant chacune 10 μm. Un maximum de 2 mesures CBF (et 2 évaluations CBP) sont effectuées dans chaque zone, ce qui donne un maximum de 10 mesures CBF (et évaluations CBP) le long de chaque bord. Barre d’échelle = 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Analyse manuelle du rythme ciliaire (CBP)
- Pour évaluer les marqueurs de dyskinésie, utilisez uniquement le profil latéral; utiliser les plans vers l’observateur et d’en haut pour caractériser le type de CBP13. Il existe différentes méthodes et scores pour l’évaluation du CBP. Ci-dessous est décrite la méthode utilisée en laboratoire avec la définition des marqueurs de dyskinésie.
- Le pourcentage de chaque CBP distinct au sein de l’échantillon
- Pour chaque cils ou groupe de cils identifiés et utilisés pour une mesure CBF (Figure 11), effectuer une analyse CBP à une fréquence d’images réduite : comparer le chemin précis emprunté par les cils pendant un cycle de battement complet avec le CBP normal observé sur l’analyse DHSV12,30.
- Attribuer un CBP distinct (normal, immotile, rigide, circulaire, asynchrone (battements ciliaires non coordonnés) ou dyskinétique13) à chaque cils ou groupe de cils analysés.
- Pour chaque échantillon, calculer le pourcentage de chaque CBP distinct dans l’échantillon; le CBP attribué à l’échantillon est le CBP prédominant observé.
- Calculez les 3 marqueurs de dyskinésie.
- Calculer l’indice d’immotilité (IMI): le pourcentage de cils immotiles dans l’échantillon (nombre de CBF = 0 / nombre total de lectures CBF dans l’échantillon X 100). Exprimer l’IMI sous forme de moyenne (ET) ou (IC à 95 %)1,16,31.
- Calculez le score de dyskinésie (DKS). Divisez chaque arête ciliée en quadrants, et le nombre de quadrants avec des cils dyskinétiques (ou anormalement battants) est déterminé. Cela permet de calculer un DKS compris entre 0 et 4 (0 : CBP normal sur toute la tranche ; 1 : CBP anormal dans ≤ 25 % des cils ; 2 : CBP anormal dans ≤ 50 % des cils ; 3 : rythme anormal dans ≤ 75 % des cils ; et 4 : CBP anormal dans tous les cils). La médiane DKS (intervalle interquartile) est calculée pour l’échantillon16,29.
- Calculer le pourcentage de battements normaux : défini comme le pourcentage de cils avec un CBP normal dans l’échantillon (nombre de lectures normales du CBP/nombre total de lectures CBP pour l’échantillon x100).
Résultats
Pour illustrer l’efficacité de la technique, nous présentons les résultats du CFA dans une série de 16 volontaires adultes en bonne santé (5 hommes, tranche d’âge 22-54 ans).
Les échantillons de brossage nasal de 14 (4 hommes, tranche d’âge 24-54 ans) sur un total de 16 volontaires ont fourni suffisamment de bords épithéliaux appropriés qui répondaient aux critères de sélection nécessaires pour effectuer l’AFC. À partir de ces 14 échantillons de brossage nasal, un tota...
Discussion
Cet article vise à fournir une procédure opérationnelle standard pour la CFA utilisant des échantillons de brossage nasal, avec des ajustements effectués pour des considérations appropriées de contrôle des infections pendant la pandémie de COVID-19. Le diagnostic de la DCP est difficile et nécessite actuellement un panel de tests diagnostiques différents, selon les recommandations internationales, y compris la mesure nasale de l’oxyde nitrique, la CFA à l’aide du DHSV, l’analyse ultrastructurale ciliair...
Déclarations de divulgation
Ces auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier Jean-François Papon, Bruno Louis, Estelle Escudier et tous les membres de l’équipe du centre de diagnostic PCD de Paris-Est pour leur disponibilité et leur accueil chaleureux lors de la visite de leur centre de diagnostic PCD, et les nombreux échanges. Nous remercions également Robert Hirst et tous les membres de l’équipe du centre PCD de Leicester pour leur accueil, leur temps, leurs conseils et leur expertise.
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
Références
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon