Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dispositifs électriques et magnétiques de champ pour la stimulation des tissus biologiques
Dans cet article
Résumé
Ce protocole décrit le processus étape par étape pour construire des stimulateurs électriques et magnétiques utilisés pour stimuler les tissus biologiques. Le protocole comprend une ligne directrice pour simuler les champs électriques et magnétiques informatiques et la fabrication d’appareils stimulateurs.
Résumé
Les champs électriques (FE) et les champs magnétiques (MF) ont été largement utilisés par l’ingénierie tissulaire pour améliorer la dynamique cellulaire comme la prolifération, la migration, la différenciation, la morphologie et la synthèse moléculaire. Cependant, des variables telles que la force de stimulus et les temps de stimulation doivent être considérées en stimulant des cellules, des tissus ou des échafaudages. Étant donné que les FE et les MF varient selon la réponse cellulaire, il n’est pas clair comment construire des dispositifs qui génèrent des stimuli biophysiques adéquats pour stimuler les échantillons biologiques. En fait, il y a un manque de preuves concernant le calcul et la distribution lorsque des stimuli biophysiques sont appliqués. Ce protocole est axé sur la conception et la fabrication d’appareils pour générer des FE et des MF et la mise en œuvre d’une méthodologie computationnelle pour prédire la distribution des stimuli biophysiques à l’intérieur et à l’extérieur des échantillons biologiques. Le dispositif EF était composé de deux électrodes parallèles en acier inoxydable situées au sommet et au bas des cultures biologiques. Les électrodes étaient reliées à un oscillateur pour générer des tensions (50, 100, 150 et 200 Vp-p) à 60 kHz. L’appareil MF était composé d’une bobine, qui a été dynamisé avec un transformateur pour générer un courant (1 A) et la tension (6 V) à 60 Hz. Un support en méthacrylate polyméthyle a été construit pour localiser les cultures biologiques au milieu de la bobine. La simulation computationnelle a élucidé la distribution homogène des FE et des MF à l’intérieur et à l’extérieur des tissus biologiques. Ce modèle informatique est un outil prometteur qui peut modifier des paramètres tels que les tensions, les fréquences, les morphologies tissulaires, les types de plaques de puits, les électrodes et la taille des bobines pour estimer les FE et les MF pour obtenir une réponse cellulaire.
Introduction
Il a été démontré que les FE et les MF modifient la dynamique cellulaire, stimulant la prolifération et augmentant la synthèse des principales molécules associées à la matrice extracellulaire des tissus1. Ces stimuli biophysiques peuvent être appliqués de différentes façons en utilisant des paramètres et des dispositifs spécifiques. En ce qui concerne les dispositifs de générer des FE, les stimulateurs de couplage direct utilisent des électrodes qui sont en contact avec des échantillons biologiques in vitro ou implantées directement dans les tissus des patients et des animaux in vivo2; cependant, il y a encore des limitations et des insuffisances qui incluent la biocompatibilité insuffisante par les électrodes en contact, les changements dans le pH et les niveaux moléculairesd’oxygène 1. Au contraire, les dispositifs indirects de couplage produisent des EF entre deux électrodes, qui sont placées en parallèle aux échantillonsbiologiques 3,permettant une technique alternative non invasive pour stimuler les échantillons biologiques et éviter le contact direct entre les tissus et les électrodes. Ce type d’appareil peut être extrapolé aux applications cliniques futures pour effectuer des procédures avec une invasion minimale au patient. En ce qui concerne les appareils qui génèrent des MF, les stimulateurs de couplage inductifs créent un courant électrique variable dans le temps, qui traverse une bobine qui se trouve autour des culturescellulaires 4,5. Enfin, il existe des dispositifs combinés, qui utilisent des FE et des MF statiques pour générer des champs électromagnétiques transitoires1. Étant donné qu’il existe différentes configurations pour stimuler les échantillons biologiques, il est nécessaire de tenir compte de variables telles que la tension et la fréquence lorsque des stimuli biophysiques sont appliqués. La tension est une variable importante, car elle influence le comportement des tissus biologiques; par exemple, il a été démontré que la migration cellulaire, l’orientation et l’expression des gènes dépendent de l’amplitude de la tensionappliquée 3,6,7,8,9,10. La fréquence joue un rôle important dans la stimulation biophysique, car il a été démontré que ceux-ci se produisent naturellement in vivo. Il a été démontré que les fréquences élevées et basses ont des effets bénéfiques sur les cellules; en particulier, dans les canaux calciques à barrière de tension de membrane cellulaire ou le réticulum endoplasmique, qui déclenchent différentes voies de signalisation au niveau intracellulaire1,7,11.
Selon ce qui précède, un dispositif pour générer des FE se compose d’un générateur de tension relié à deux condensateurs parallèles12. Ce dispositif a été mis en œuvre par Armstrong et coll. pour stimuler à la fois le taux prolifératif et la synthèse moléculaire des chondrocytes13. Une adaptation de cet appareil a été réalisée par Brighton et coll. qui ont modifié les plaques de puits de la culture cellulaire en perçant leurs couvercles supérieur et inférieur. Les trous ont été remplis par des glissières de couverture, où les verres du bas ont été utilisés pour la culture des tissus biologiques. Des électrodes ont été placées sur chaque glissière de couverture pour générer desFE 14. Ce dispositif a été employé pour stimuler électriquement des chondrocytes, des osteoblastes et des explants de cartilage, montrant une augmentation dela prolifération cellulaire 14,15,16 et synthèse moléculaire3,17. L’appareil conçu par Hartig et coll. se composait d’un générateur d’ondes et d’un amplificateur de tension, qui étaient reliés à des condensateurs parallèles. Les électrodes étaient faites d’acier inoxydable de haute qualité situé dans un étui isolant. Le dispositif a été employé pour stimuler des osteoblastes, montrant une augmentation significative de la prolifération et de la sécrétion deprotéine 18. L’appareil utilisé par Kim et coll. se composait d’une puce stimulateur biphasique du courant, qui a été construite à l’aide d’un procédé de fabrication de semi-conducteurs complémentaires d’oxyde métallique à haute tension. Une plaque de puits de culture a été conçue pour la culture des cellules sur une surface conductrice avec stimulation électrique. Les électrodes étaient recouvertes d’or sur des plaques desilicium 19. Ce dispositif a été employé pour stimuler des osteoblastes, montrant une augmentation de la prolifération et de la synthèse du facteur de croissance endothélial vasculaire19,et stimulant la production de l’activité alcaline de phosphatase, du dépôt de calcium et des protéines morphogenicd’os 20. De même, ce dispositif a été employé pour stimuler le taux prolifératif et l’expression du facteur de croissance endothélial vasculaire des cellules souches mésenchymales de moelleosseuse humaine 21. L’appareil conçu par Nakasuji et coll. était composé d’un générateur de tension relié à des plaques de platine. Des électrodes ont été construites pour mesurer le potentiel électrique à 24 points différents. Ce dispositif a été employé pour stimuler des chondrocytes, montrant que les EF n’ont pas modifié la morphologie cellulaire et la prolifération accrue et la synthèse moléculaire22. L’appareil utilisé par Au et coll. se composait d’une chambre en verre équipée de deux tiges de carbone reliées à un stimulateur cardiaque avec des fils de platine. Ce stimulateur a été employé pour stimuler des cardiomyocytes et des fibroblastes, améliorant l’allongement cellulaire et l’alignement de fibroblaste23.
Différents dispositifs MF ont été fabriqués à partir de bobines Helmholtz pour stimuler plusieurs types d’échantillons biologiques. Par exemple, les bobines d’Helmholtz ont été employées pour stimuler la prolifération et la synthèse moléculaire des chondrocytes24,25,pour augmenter la synthèse protéoglycane des explants 26 de cartilagearticulaire,pour améliorer l’upregulation de gène liée à la formation d’os des cellules osteoblast-like27,et pour augmenter la prolifération et l’expression moléculaire des cellules endothéliales28. Les bobines Helmholtz génèrent des MFs sur deux bobines situées l’une devant l’autre. Les bobines doivent être placées avec une distance égale au rayon des bobines pour assurer un MF homogène. L’inconvénient d’utiliser les bobines Helmholtz réside dans les dimensions de bobine, parce qu’elles doivent être assez grandes pour générer l’intensité MF requise. En outre, la distance entre les bobines doit être suffisante pour assurer une distribution homogène des MF autour des tissus biologiques. Pour éviter les problèmes causés par les bobines Helmholtz, différentes études ont été axées sur la fabrication de bobines solénoïdes. Les bobines de solénoïde sont basées sur un tube, qui est enroulé avec du fil de cuivre pour générer des MFs. Les entrées de fil de cuivre peuvent être reliées directement à la prise ou à une alimentation électrique pour dynamiser la bobine et créer des MFs au centre du solénoïde. Plus la bobine tourne, plus le MF généré. La magnitude MF dépend également de la tension et du courant appliqués pour dynamiser la bobine29. Bobines séloïdes ont été utilisés pour stimuler magnétiquement différents types de cellules telles que HeLa, HEK293 et MCF730 ou cellules souches mésenchymales31.
Les dispositifs utilisés par différents auteurs n’ont pas considéré ni la taille adéquate des électrodes ni la longueur correcte de la bobine pour distribuer homogènement les FE et les MF. En outre, les appareils génèrent des tensions et des fréquences fixes, limitant leur utilisation pour stimuler des tissus biologiques spécifiques. Pour cette raison, dans ce protocole, une ligne directrice de simulation computationnelle est effectuée pour simuler à la fois les systèmes capacitifs et les bobines afin d’assurer une distribution homogène des FE et des MF sur les échantillons biologiques, en évitant l’effet de bord. En outre, il est démontré que la conception de circuits électroniques génère des tensions et la fréquence entre les électrodes et la bobine, la création d’EFs et MFs qui surmonteront les limitations causées par l’impedance de la culture cellulaire bien plaques et de l’air. Ces modifications permettront la création de bioréacteurs non invasifs et adaptatifs pour stimuler tout tissu biologique.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Simulation des FE et des MF
REMARQUE : La simulation des FE et des MF a été réalisée en multiphysique COMSOL.
- Sélectionnez une configuration 2D axisymétrique pour représenter à la fois les domaines électriques et magnétiques.
- Dans la configuration physic, sélectionnez soit l’interface Courant électrique pour calculer les EF dans des électrodes parallèles, soit l’interface Champ magnétique pour calculer les MF autour des bobines.
- Dans la configuration de l’étude, sélectionnez Domaine de fréquence pour calculer la réponse d’un modèle linéaire ou linéaire soumis à l’excitation harmonique pour une ou plusieurs fréquences.
- Une fois à l’intérieur de l’interface pour commencer à construire le modèle, suivez les prochaines étapes selon le modèle de l’intérêt.
- Construire un modèle pour les FE
- Créez des géométries. Dans le model builder, sélectionnez Géométrie. Ensuite, localisez la section Unités et choisissez mm. Sur la barre d’outils de géométrie, sélectionnez Rectangle et tapez les dimensions de chaque composant dans la boîte taille et forme des paramètres de fenêtre rectangle. La géométrie est composée par l’air, deux électrodes parallèles, une culture bien plaque, les médias de culture et un échantillon biologique, qui dans ce cas est représenté par un échafaudage d’acide hyaluronique - hydrogel gélatineux (voir les dimensions de chaque élément dans le tableau 1). Une fois que toutes les géométries sont construites, cliquez sur Construire tous les objets.
- Créez des sélections. Sur la barre d’outils Définitions, cliquez sur Explicit pour créer une sélection pour le domaine métal. Sélectionnez les géométries qui représentent les électrodes. Après, cliquez à droite sur Explicit 1 pour le renommer. Type Métal dans le nouveau champ de texte d’étiquette.
- D’autre part, sur la barre d’outils définitions, cliquez sur Complément. Localisez la section Entités d’entrée dans la fenêtre Paramètres complémentaires. Ensuite, sous Sélections à inverser, cliquez sur Ajouter et sélectionner metal dans les sélections pour inverser la liste de la boîte de dialogue Ajouter. Par la suite, cliquez à droite dans Complément 1 pour le renommer. Type de domaine modèle dans le nouveau champ texte d’étiquette.
- Créez des limites. Cliquez explicitement sur la barre d’outils Définitions. Après, localisez la section Entités d’entrée dans la fenêtre Paramètres pour explicite et à partir de la liste de niveau d’entité géométrique, choisissez Boundary. Ici, sélectionnez toutes les limites pour l’électrode inférieure. Cliquez à droite Explicite 2 pour le renommer. Typez les limites du sol dans le nouveau champ de texte d’étiquette. Répétez ces étapes, mais en sélectionnant toutes les limites pour l’électrode supérieure. Par la suite, cliquez à droite Explicite 3 pour le renommer. Type limites terminales dans le nouveau champ texte d’étiquette.
- Ajouter les courants électriques. Dans la fenêtre Model Builder, sous composant 1 cliquez sur Courants électriques (ec). Ensuite, localisez la section Sélection de domaine dans la fenêtre Paramètres des courants électriques. De la liste de sélection, choisissez le domaine modèle. Sur la barre d’outils physique,cliquez sur Limites et choisissez Ground. Après, localisez la section Sélection des limites dans la fenêtre Paramètres du sol et choisissez les limites du sol dans la liste de sélection.
- Par la suite, cliquez sur Limites et choisissez Terminal sur la barre d’outils physique. Enfin, localisez la section Sélection des limites dans la fenêtre Paramètres terminaux et choisissez les limites du terminal dans la liste de sélection; ici, localisez la section Terminal et choisissez Voltage dans la liste terminale et le type 100 V.
- Ajouter les matériaux. Cliquez sur Ajouter du matériel sur la barre d’outils d’accueil pour ouvrir la fenêtre Ajouter du matériel. Recherchez l’air et l’acier inoxydable et ajoutez-les à la fenêtre Model Builder. Cliquez ensuite sur Le matériel vierge sur la barre d’outils d’accueil et ajoutez trois nouveaux matériaux vierges pour les médias culturels, l’échafaudage (hydrogel) et le polystyrène (plaque de puits de culture).
- Sélectionnez un matériau vierge pour attribuer les propriétés diélectriques. Localisez la liste des propriétés matérielles dans la fenêtre paramètres matériels et sélectionnez la permistivité relative et la conductivité électrique à partir de la liste d’options propriétés de base. Les propriétés diélectriques pour les médias culturels, l’hydrogel et la culture sont dans le tableau 2. Répétez cette procédure pour tous les matériaux vierges.
- Attribuez chaque matériau aux géométries précédemment construites. Sélectionnez le matériau d’air de la fenêtre Model Builder; ensuite, sélectionnez les domaines qui correspondent à l’air à partir de la fenêtre Graphique. Répétez cette étape pour tous les matériaux créés. Assurez-vous que chaque domaine correspond au bon matériel. Pour vous assurer que tous les matériaux sont correctement attribués, cliquez sur chaque matériau de la fenêtre Model Builder et observez si les domaines sont mis en surbrillance en bleu dans la fenêtre Graphique.
- Construire le maillage. Cliquez à droite Sur Mesh 1 dans la fenêtre Model Builder et sélectionnez Triangulaire gratuit. Répétez cette étape en sélectionnant taille. Dans la fenêtre De réglage mesh sélectionnez Mesh Contrôlé par l’Utilisateur de la liste de type séquence. Ensuite, élargissez les options Mesh dans la fenêtre Model Builder et cliquez sur Taille.
- Localisez les paramètres de taille des éléments dans la fenêtre de réglage de taille et tapez 1 mm pour la taille maximale des éléments, 0,002 mm pour la taille minimale des éléments, 1,1 pour le taux de croissance maximal de l’article, 0,2 pour le facteur de courbure et 1 pour la résolution des régions étroites. Ensuite, élargissez les options Mesh dans la fenêtre Model Builder et cliquez sur Free Triangular 1. Ici, sélectionnez tous les domaines à m’ensehant. Enfin, cliquez sur Construire tous dans la fenêtre De réglage mesh.
- Créez une étude. Cliquez sur Étude 1 dans la fenêtre Model Builder. Ensuite, localisez la section Paramètres d’étude dans la fenêtre Paramètres d’étude et effacez la case à cochée générer par défaut. Élargissez le nœud Study 1 dans la fenêtre Model Builder et cliquez sur Étape 1 : Domaine de fréquence. Enfin, localisez la section Paramètres d’étude dans la fenêtre Paramètres de domaine de fréquence et tapez 60 kHz dans le champ texte Fréquences.
- Calculer l’étude. Cliquez sur Afficher le solveur par défaut sur la barre d’outils d’étude. Ensuite, élargissez le nœud de configurations de solveur Study 1 dans la fenêtre Model Builder. Étendre le nœud solution 1 (sol1) dans la fenêtre Model Builder; par la suite, cliquez sur Solveur stationnaire 1 dans la fenêtre Paramètres de solveur stationnaire et localisez la section Générale et tapez 1e-6 dans le champ texte tolérance relative. Enfin, cliquez sur Calculer sur la barre d’outils d’étude.
- Résultats de l’intrigue. Sélectionnez la section Résultats sur la barre d’outils Accueil et ajoutez 2D Plot Group. Ensuite, cliquez à droite 2D Plot Group 1 dans la fenêtre Model Builder et choisissez Surface. Ensuite, localisez la section Données dans la fenêtre Paramètres de surface et sélectionnez Précurseur. Après, localisez la section Expression dans la fenêtre Paramètres de surface; cliquez ici, cliquez sur le symbole plus (+) pour ouvrir une nouvelle fenêtre et localiser l’itinéraire de suivi de la liste de sélection (Modèle - Composant 1 - Courants électriques - Électrique). Ici, sélectionnez ec.normE - EF Norm. Enfin, cliquez sur Graphique dans la fenêtre Paramètres de surface pour tracer les résultats.
- Construire un modèle pour les MF
- Créez des géométries. Dans le model builder, sélectionnez Géométrie; ensuite, localisez la section Unités et choisissez mm. Sur la barre d’outils de géométrie sélectionnez Rectangle et tapez les dimensions de chaque composant dans la boîte taille et forme des paramètres de fenêtre rectangle. La géométrie est composée par l’air et le tonnelier (voir les dimensions de chaque élément du tableau 1). Une fois que toutes les géométries sont construites, cliquez sur Construire tous les objets.
- Ajouter les matériaux. Cliquez sur Ajouter du matériel sur la barre d’outils d’accueil pour ouvrir la fenêtre Ajouter du matériel. Recherchez l’air et le cuivre et ajoutez-les à la fenêtre Model Builder. Les propriétés diélectriques du cuivre se trouvent dans le tableau 2.
- Créez des limites. Cliquez sur Champ magnétique sur la fenêtre Model Builder. Ici, localisez la liste equation sur la fenêtre Paramètres des champs magnétiques et choisissez l’équation de domaine de fréquence à partir de la liste des formulaires d’équation. Dans la liste de fréquence choisir de solveur. Après, localisez la loi d’Ampere sur la liste des champs magnétiques dans la fenêtre Model Builder. Dans le type 293.15[K] dans temperature, 1[atm] dans Absolute Pressure from the Inputs Model list. Ensuite, choisissez Solid dans la liste de type Matériel dans la fenêtre Paramètres de loi de l’Ampère. Assurez-vous que la conductivité électrique, la permistivité relative et la perméabilité relative correspondent au matériau From de la liste.
- Localisez la symétrie axiale sur la liste des champs magnétiques dans la fenêtre Model Builder. Assurez-vous que la ligne de symétrie axiale est mise en surbrillance à la fois dans la liste de sélection des limites et dans la fenêtre graphique. Ensuite, localisez l’isolement magnétique sur la liste des champs magnétiques dans la fenêtre Model Builder. Assurez-vous que les limites de la géométrie sont mises en surbrillance à la fois dans la liste de sélection des limites et dans la fenêtre graphique.
- Localisez les valeurs initiales sur la liste des champs magnétiques dans la fenêtre Model Builder. Sélectionnez les géométries précédemment construites et incluez-les dans la sélection de domaine à partir de la fenêtre Paramètres de valeurs initiales.
- Introduisez des caractéristiques de bobine. Localisez la bobine multiple sur la liste des champs magnétiques dans la fenêtre Model Builder. Ici, sélectionne la géométrie qui représente la bobine et les inclure dans la sélection de domaine à partir de la fenêtre Paramètres de bobine multiple.
- Localiser la liste des bobines multiples sur la fenêtre de réglage de bobines multiples; ici, localisez la liste d’excitation de bobine et sélectionnez courant; par la suite, type 1[A] dans la liste actuelle de bobine, 450 dans le nombre de tours et 6e7[S/m] dans la conductivité de bobine.
- Localisez la zone transversale du fil de bobine et choisissez le diamètre du câble nord-américain (Brown & Sharpe) de la liste et le type 18 dans l’option AWG. Assurez-vous que la permistivité relative et la perméabilité relative correspondent à partir du matériel de la liste.
- Construire le maillage. Dans la fenêtre De réglage mesh sélectionnez Mesh Contrôlé par la physique de la liste de type séquence. Après, localisez les paramètres de taille des éléments dans la fenêtre de réglage mesh et sélectionnez Extrêmement fine. Enfin, sélectionnez tous les domaines à mailler et cliquez sur Construire tous dans la fenêtre De réglage mesh.
- Créez une étude. Cliquez sur Étude 1 dans la fenêtre Model Builder. Ensuite, localisez la section Paramètres d’étude dans la fenêtre Paramètres d’étude et effacez la case à cochée générer par défaut. Développez le nœud Study 1 dans la fenêtre Model Builder et cliquez sur Étape 2 : Domaine de fréquence. Enfin, localisez la section Paramètres d’étude dans la fenêtre Paramètres de domaine de fréquence et tapez 60 Hz dans le champ texte Fréquences.
- Calculer l’étude. Cliquez sur Afficher le solveur par défaut sur la barre d’outils d’étude. Ensuite, élargissez le nœud de configurations de solveur Study 1 dans la fenêtre Model Builder. Étendre le nœud solution 1 (sol1) dans la fenêtre Model Builder; par la suite, cliquez sur Solveur stationnaire 1 dans la fenêtre Paramètres de solveur stationnaire et localisez la section Générale et tapez 1e-6 dans le champ texte de tolérance relative. Enfin, cliquez sur Calculer sur la barre d’outils d’étude.
- Résultats de l’intrigue. Sélectionnez la section Résultats sur la barre d’outils Accueil et ajoutez 2D Plot Group. Ensuite, cliquez à droite 2D Plot Group 1 dans la fenêtre Model Builder et choisissez Surface. Ensuite, localisez la section Données dans la fenêtre Paramètres de surface et sélectionnez Précurseur.
- Localisez la section Expression dans la fenêtre Paramètres de surface. Cliquez ici dans le symbole plus (+) pour ouvrir une nouvelle fenêtre et localiser l’itinéraire de suivi de la liste de sélection (Modèle - Composant 1 - Champ Magnétique - Magnétique). Ici, sélectionnez mf.normB - Densité de flux magnétique Norm. Enfin, cliquez sur Graphique dans la fenêtre Paramètres de surface pour tracer les résultats.
- Construire un modèle pour les FE
2. Conception et fabrication des dispositifs de stimulation électrique et magnétique
- Le dispositif de stimulateur électrique
REMARQUE : Il est composé d’un circuit basé sur l’oscillateur du pont Wien et de deux électrodes parallèles en acier inoxydable. Le circuit est un oscillateur RC de décalage de phase, qui utilise une rétroaction positive et négative. L’oscillateur du pont Wien est composé d’un réseau de plomb-décalage, qui divise la tension d’entrée par la combinaison de deux bras du pont : une résistance R5 avec un condensateur C2 en série, et une résistance R6 avec un condensateur C3 en parallèle (Figure 1A). Ces composants modulent la fréquence de l’oscillateur. Pour construire le dispositif de stimulateur électrique, suivez les étapes suivantes :- Calculer la fréquence à l’aide de l’équation de fréquence résonnante (1).
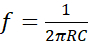
Lorsque R = R5 = R6 sont résistants et C = C2 = C3 sont condensateurs. R et C sont placés dans les deux bras du pont ( Figure1A). Utilisez R5 = R6 = 2,6 kΩ et C2 = C3 = 1 nF pour obtenir une fréquence de 60 kHz. Les résistances et les condensateurs peuvent être calculés si une fréquence différente est nécessaire. - Concevoir le circuit de manière à ce que le gain de tension de l’amplificateur compense automatiquement les changements d’amplitude du signal de sortie. Dans la figure 1A, il est possible d’observer le schéma du circuit, tandis que dans la section Tableau des matériaux sont énumérés les composants électroniques pour construire le circuit.
- Calculez la combinaison de résistances pour générer les quatre tensions de sortie. Comme le montre la figure 1A, utilisez une combinaison de résistances R11, R12, R13 et R14 (résistance équivalente de 154 Ω) pour générer une tension de 50 Vp-p; résistances R17, R18 et R19 en série (résistance équivalente de 47,3 Ω) pour obtenir une tension de 100 Vp-p; résistances R9 et R10 en série (résistance équivalente de 25,3 Ω) pour générer une tension de 150 Vp-p; et une combinaison de résistances R15 et R16 (résistance équivalente de 16,8 Ω) pour obtenir une tension de 200 Vp-p.
- Utilisez un transistor (TIP 31C) et un transformateur de noyau de ferrite pour implémenter un stade d’amplification du signal. Un noyau de ferrite toroïde a été utilisé pour enrouer un fil de cuivre AWG 24, complétant une relation 1:200. Utilisez deux condensateurs (C4 et C5) de 100 nF en parallèle avant le transformateur pour rectifier le signal (Figure 1A).
- Préparez le BPC à l’aide d’un service tiers de fabrication de BPC. Le diagramme schématique du circuit est fourni à la figure 1. Placez tous les composants sur le BPC avec une pince antistatique. Utilisez la soudure d’étain et le fer à souier pour soucouper tous les composants.
- Fabriquez un boîtier en plastique avec connecteurs d’entrée pour protéger le circuit. Implémentez trois connecteurs d’entrée pour dynamiser le circuit (12 V, -12 V et sol). Utilisez deux connecteurs d’entrée pour connecter les électrodes. Inclure trois interrupteurs pour changer la combinaison des résistances pour obtenir les quatre tensions de sortie. Assembler le circuit électronique dans le boîtier en plastique( Figure 1B).
- Fabriquez deux électrodes parallèles en acier inoxydable (200 x 400 x 2 mm) et des connecteurs d’entrée de soudeur à chaque bord. Les électrodes sont situées au-dessus du téflon ou des supports acryliques pour éliminer tout contact avec la surface métallique de l’incubateur (Figure 1C).
- Utilisez un autoclave à 394,15 K (121 °C) pendant 30 minutes pour stériliser les électrodes et utiliser les ultraviolets pendant la nuit pour stériliser les fils qui sont en contact avec l’incubateur.
- Testez le dispositif de stimulation électrique. Ajustez l’alimentation en série pour générer une tension de sortie de +12 V et -12 V entre le sol et les terminaux positifs et négatifs. Vérifiez la tension de sortie de l’alimentation électrique à l’l’l’moyen d’un multimètre. Connectez chaque sortie de l’alimentation dans l’entrée correcte du stimulateur électrique (+12 V, -12 V et sol). Connectez chaque électrode dans le connecteur d’entrée correct du stimulateur électrique. La polarité n’est pas importante, car nous travaillons sur ac courant. Placez une culture bien plaque entre les électrodes et vérifier le signal de sortie avec un oscilloscope. Ajustez les interrupteurs du stimulateur électrique pour générer les quatre tensions de sortie (50, 100, 150 et 200 Vp-p).
- Recommandations de sécurité. Pour éviter tout problème lors du transfert ou de l’enlèvement des électrodes de l’incubateur, assurez-vous que les câbles ne sont pas emmêlés. Déconnecter les câbles de l’oscillateur avant d’enlever les électrodes de l’incubateur. Ne placez jamais les électrodes sans les supports acryliques ou téflons.
- Calculer la fréquence à l’aide de l’équation de fréquence résonnante (1).
- Le dispositif de stimulateur magnétique
- Estimer le nombre de virages pour garantir un MF homogène à l’intérieur de la bobine à l’aide de l’équation (2), qui décrit le MF à l’intérieur d’une bobine solénoïde.
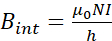
où μ0 est la perméabilité magnétique du vide (4π×10-7),N est le nombre de tours du fil de cuivre, je suis le courant, et h, qui devrait être supérieure à son diamètre, est la longueur de la bobine solénoïde. - Déterminez le nombre de virages en choisissant une longueur (h) de 250 mm, un courant de 1 A et unint B = 2mT.
- Fabriquez la bobine. Construire un tube de chlorure de polyvinyle (PVC) d’une longueur de 250 mm et d’un diamètre de 84 mm pour enrouler un fil de cuivre AWG 18 complétant 450 tours (Figure 2A). Les dimensions ont été choisies en fonction de l’espace disponible à l’intérieur de l’incubateur.
- Fabriquer un support de culture cellulaire bien plaque. Construire un support en méthacrylate polyméthyle (PMMA) pour s’assurer que les plaques de puits de 35 mm étaient toujours situées au milieu de la bobine où les MF sont homogènes (Figure 2A).
- Fabriquer un transformateur pour augmenter le courant du circuit. Construire un transformateur avec une sortie de 1 A - 6 V AC pour atteindre un MF maximum de 2 mT. La tension d’entrée du transformateur était de 110 V AC à 60 Hz. Ces paramètres correspondent à la tension de sortie et à la fréquence d’une prise en Amérique du Sud.
- Connectez le circuit. Le transformateur est relié directement à la prise. Utilisez une résistance variable (rhéostat) pour varier le courant et générer des MF de 1 à 2 mT. Connectez un fusible pour protéger le circuit( Figure 2B).
- Utilisez l’ultraviolet pendant la nuit pour stériliser les fils qui sont en contact avec l’incubateur. Envelopper la bobine d’un film extensible transparent et utiliser de l’éthanol pour stériliser la bobine.
- Testez l’appareil MF. Utilisez un teslamètre pour mesurer la magnitude MF à l’intérieur de la bobine. La sonde teslameter était située au centre de la bobine, permettant la mesure simultanée des MF et des courants.
- Varier l’ampleur MF. Utilisez un rhéostat pour modifier la résistance du circuit (Figure 2B). Une valeur de résistance de 0,7 Ω a été utilisée pour générer des MF de 1 mT.
- Recommandations de sécurité. Pour éviter tout problème lors du transfert ou de l’enlèvement du solenoïde de l’incubateur, assurez-vous que les câbles ne sont pas emmêlés. Déconnecter les câbles du transformateur avant d’enlever le solenoïde de l’incubateur. Ne placez jamais le solénoïde sans le support PMMA. Saisissez fermement le support PMMA de la base et le solenoïde lors du transfert ou de l’enlèvement de l’incubateur.
- Estimer le nombre de virages pour garantir un MF homogène à l’intérieur de la bobine à l’aide de l’équation (2), qui décrit le MF à l’intérieur d’une bobine solénoïde.
Access restricted. Please log in or start a trial to view this content.
Résultats
Simulation computationnelle
Les distributions de FE et de MF sont indiquées à la figure 3. D’une part, il a été possible d’observer la répartition homogène des FE dans le système capacitif (figure 3A). L’EF a été tracé pour observer en détail l’ampleur du champ à l’intérieur de l’échantillon biologique( figure 3B). Cette simulation a été utile pour paramétiser la taille des électrode...
Access restricted. Please log in or start a trial to view this content.
Discussion
Les traitements utilisés pour guérir différentes pathologies qui affectent les tissus humains sont des thérapies pharmacologiques32 ou des interventionschirurgicales 33, qui cherchent à soulager la douleur localement ou remplacer les tissus affectés par des explantations ou des greffes. Récemment, la thérapie cellulaire autologue a été proposée comme thérapie alternative pour traiter les tissus blessés, où les cellules sont isolées du patient et élargies, pa...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun conflit d’intérêts.
Remerciements
Les auteurs remercient le soutien financier apporté par « Fondo Nacional de Financiamiento para la Ciencia, la Tecnología, y la Innovación -Fondo Francisco José de Caldas- Minciencias » et Universidad Nacional de Colombia grâce à la subvention n° 80740-290-2020 et au soutien reçu par Valteam Tech - Recherche et Innovation pour fournir l’équipement et le soutien technique dans l’édition de la vidéo.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Electrical stimulator | |||
| Operational amplifier | Motorola | LF-353N | ---- Quantity: 1 |
| Resistors | ---- | ---- | 22 kΩ Quantity: 1 |
| Resistors | ---- | ---- | 10 kΩ Quantity: 3 |
| Resistors | ---- | ---- | 2.6 kΩ Quantity: 2 |
| Resistors | ---- | ---- | 2.2 kΩ Quantity: 1 |
| Resistors | ---- | ---- | 1 kΩ Quantity: 1 |
| Resistors | ---- | ---- | 220 Ω Quantity: 2 |
| Resistors | ---- | ---- | 22 Ω Quantity: 5 |
| Resistors | ---- | ---- | 10 Ω Quantity: 1 |
| Resistors | ---- | ---- | 6.8 Ω Quantity: 1 |
| Resistors | ---- | ---- | 3.3 Ω Quantity: 2 |
| Polyester capacitors | ---- | ---- | 1 nF Quantity: 2 |
| Polyester capacitors | ---- | ---- | 100 nF Quantity: 1 |
| VHF Band Amplifier Transistor JFET | Toshiba | 2SK161 | ---- Quantity: 1 |
| Power transistor BJT NPN | Mospec | TIP 31C | ---- Quantity: 1 |
| Zener diode | Microsemi | 1N4148 | ---- Quantity: 1 |
| Switch | Toogle Switch | SPDT - T13 | ---- Quantity: 3 |
| Toroidal ferrite core | Caracol | ---- | T*22*14*8 Quantity: 1 |
| Cooper wire | Greenshine | ---- | AWG – 24 Quantity: 1 |
| Relimate header with female housing | ADAFRUIT | ---- | 8 pin connectors Quantity: 1 |
| Relimate header with female housing | ADAFRUIT | ---- | 2 pin connectors Quantity: 1 |
| Female plug terminal connector | JIALUN | ---- | 4mm Lantern Plugs (Plug + Socket) 15 A Quantity: 1 |
| Aluminum Heat Sink | AWIND | ---- | For TIP 31C transistor Quantity: 1 |
| Led | CHANZON | ---- | 5 mm red Quantity: 1 |
| Integrated circuit socket connector | Te Electronics Co., Ltd. | ---- | Double row 8-pin DIP Quantity: 1 |
| 3 pin connectors set | STAR | ---- | JST PH 2.0 Quantity: 3 |
| 2 pin screw connectors | STAR | ---- | For PCB Quantity: 1 |
| 3 pin screw connectors | STAR | ---- | For PCB Quantity: 1 |
| Banana connector test lead | JIALUN | ---- | P1041 - 4 mm - 15 A Quantity: 7 |
| Bullet connectors to banana plug charge lead | JIALUN | ---- | 4 mm male-male/female-female adapters - 15 A Quantity: 1 |
| Case | ---- | ---- | ABS Quantity: 1 |
| Electrodes | ---- | ---- | Stainless – steel Quantity: 2 |
| Electrode support | ---- | ---- | Teflon Quantity: 2 |
| Printed circuit board | Quantity: 1 | ||
| Magnetic stimulator | |||
| Cooper wire | Greenshine | ---- | AWG – 18 Quantity: 1 |
| AC power plugs | ---- | ---- | 120 V AC – 60 Hz Quantity: 1 |
| Banana female connector test lead | JIALUN | ---- | 1Set Dual Injection - 4 mm – 15 A Quantity: 2 |
| Banana male connector test lead | JIALUN | ---- | 1Set Dual Injection - 4 mm 15 A Quantity: 1 |
| Cell culture well plate support | ---- | ---- | PMMA Quantity: 1 |
| Fuse | Bussmann | 2A | ---- Quantity: 1 |
| Transformer | ---- | ---- | 1A – 6 V AC Quantity: 1 |
| Tube | ---- | ---- | PVC Quantity: 1 |
| Variable rheostat | MCP | BXS150 | 10 Ω Quantity: 1 |
| General equipment | |||
| Digital dual source | PeakTech | DG 1022Z | 2 x 0 - 30 V / 0 - 5 A CC / 5 V / 3 A fijo Quantity: 1 |
| Digital Oscilloscope | Rigol | DS1104Z Plus | 100 MHz, bandwidth, 4 channels Quantity: 1 |
| Digital multimeter | Fluke | F179 | Voltage CC – CA (1000 V). Current CC – CA 10 A. Frequency 100 kHz Quantity: 1 |
Références
- Balint, R., Cassidy, N. J., Cartmell, S. H. Electrical Stimulation: A Novel Tool for Tissue Engineering. Tissue Engineering Part B: Reviews. 19 (1), 48-57 (2013).
- Ercan, B., Webster, T. J. The effect of biphasic electrical stimulation on osteoblast function at anodized nanotubular titanium surfaces. Biomaterials. 31 (13), 3684-3693 (2010).
- Brighton, C., Wang, W., Clark, C. The effect of electrical fields on gene and protein expression in human osteoarthritic cartilage explants. The Journal of Bone and Joint Surgery-American. 90 (4), 833-848 (2008).
- Baerov, R. M., Morega, A. M., Morega, M. Analysis of magnetotherapy effects for post-traumatic recovery of limb fractures. Revue Roumaine des Sciences Techniques- Série électrotechnique et énergétique. 65 (1-2), 145-150 (2020).
- Escobar, J. F., et al. In Vitro Evaluation of the Effect of Stimulation with Magnetic Fields on Chondrocytes. Bioelectromagnetics. 41 (1), 41-51 (2019).
- Brighton, C., Wang, W., Clark, C. Up-regulation of matrix in bovine articular cartilage explants by electric fields. Biochemical and Biophysical Research Communications. 342 (2), 556-561 (2006).
- Xu, J., Wang, W., Clark, C., Brighton, C. Signal transduction in electrically stimulated articular chondrocytes involves translocation of extracellular calcium through voltage-gated channels. Osteoarthritis and Cartilage. 17 (3), 397-405 (2009).
- Xia, Y., et al. Magnetic field and nano-scaffolds with stem cells to enhance bone regeneration. Biomaterials. 183, 151-170 (2018).
- Richter, A., Bartoš, M., Ferková, Ž Physical Analysis of Pulse Low-Dynamic Magnetic Field Applied in Physiotherapy BT. World Congress on Medical Physics and Biomedical Engineering 2018. , 239-245 (2019).
- Miyakoshi, J. Effects of static magnetic fields at the cellular level. Progress in Biophysics and Molecular Biology. 87, 213-223 (2005).
- Zhang, K., Guo, J., Ge, Z., Zhang, J. Nanosecond Pulsed Electric Fields (nsPEFs) Regulate Phenotypes of Chondrocytes through Wnt/β-catenin Signaling Pathway. Scientific Reports. 4 (5836), 1-8 (2014).
- Brighton, C. T., Unger, A. S., Stambough, J. L. In vitro growth of bovine articular cartilage chondrocytes in various capacitively coupled electrical fields. Journal of Orthopaedic Research. 2 (1), 15-22 (1984).
- Armstrong, P. F., Brighton, C., Star, A. M. Capacitively coupled electrical stimulation of bovine growth plate chondrocytes grown in pellet form. Journal of Orthopaedic Research. 6 (2), 265-271 (1988).
- Brighton, C., Townsend, P. Increased cAMP production after short-term capacitively coupled stimulation in bovine growth plate chondrocytes. Journal of Orthopaedic Research. 6 (4), 552-558 (1988).
- Brighton, C. T., Jensen, L., Pollack, S. R., Tolin, B. S., Clark, C. Proliferative and synthetic response of bovine growth plate chondrocytes to various capacitively coupled electrical fields. Journal of Orthopaedic Research. 7 (5), 759-765 (1989).
- Brighton, C. T., Okereke, E., Pollack, S. R., Clark, C. In vitro bone-cell response to a capacitively coupled electrical field. The role of field strength, pulse pattern, and duty cycle. Clinical Orthopaedics and Related Research. 285, 255-262 (1992).
- Wang, W., Wang, Z., Zhang, G., Clark, C., Brighton, C. T. Up-regulation of chondrocyte matrix genes and products by electric fields. Clinical Orthopaedics and Related Research. 427, 163-173 (2004).
- Hartig, M., Joos, U., Wiesmann, H. P. Capacitively coupled electric fields accelerate proliferation of osteoblast-like primary cells and increase bone extracellular matrix formation in vitro. European Biophysics Journal. 29 (7), 499-506 (2000).
- Kim, I. S., et al. Biphasic electric current stimulates proliferation and induces VEGF production in osteoblasts. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763 (9), 907-916 (2006).
- Kim, I., et al. Novel Effect of Biphasic Electric Current on In Vitro Osteogenesis and Cytokine Production in Human Mesenchymal Stromal Cells. Tissue Engineering Part A. 15, 2411-2422 (2009).
- Kim, I., et al. Novel action of biphasic electric current in vitro osteogenesis of human bone marrow mesenchymal stromal cells coupled with VEGF production. Bone. 43, 43-44 (2008).
- Nakasuji, S., Morita, Y., Tanaka, K., Tanaka, T., Nakamachi, E. Effect of pulse electric field stimulation on chondrocytes. Asian Pacific Conference for Materials and Mechanics. 1, Yokohama, Japan. 13-16 (2009).
- Au, H. T. H., Cheng, I., Chowdhury, M. F., Radisic, M. Interactive effects of surface topography and pulsatile electrical field stimulation on orientation and elongation of fibroblasts and cardiomyocytes. Biomaterials. 28 (29), 4277-4293 (2007).
- Vanessa, N., et al. In vitro exposure of human chondrocytes to pulsed electromagnetic fields. European Journal of Histochemistry. 51 (3), 203-211 (2007).
- Pezzetti, F., et al. Effects of pulsed electromagnetic fields on human chondrocytes: An in vitro study. Calcified Tissue International. 65 (5), 396-401 (1999).
- De Mattei, M., et al. Effects of electromagnetic fields on proteoglycan metabolism of bovine articular cartilage explants. Connective Tissue Research. 44 (3-4), 154-159 (2003).
- Sollazzo, V., Massari, L., Caruso, A., Mattei, M., Pezzetti, F. Effects of Low-Frequency Pulsed Electromagnetic Fields on Human Osteoblast-Like Cells In Wtro. Electromagnetobiology. 15, 75-83 (2009).
- Martino, C. F., Perea, H., Hopfner, U., Ferguson, V. L., Wintermantel, E. Effects of weak static magnetic fields on endothelial cells. Bioelectromagnetics. 31 (4), 296-301 (2010).
- Wada, K., et al. Design and implementation of multi-frequency magnetic field generator producing sinusoidal current waveform for biological researches. 2016 18th European Conference on Power Electronics and Applications (EPE'16 ECCE Europe). 2016, 1-8 (2016).
- Cho, H., Kim, S., Kim, K. K., Kim, K., Kim, K. Pulsed Electromagnetic Fields Stimulate Cellular Proliferation in Different Types of Cells. IEEE Transactions on Magnetics. 52 (7), 1-4 (2016).
- Yan, J., Dong, L., Zhang, B., Qi, N. Effects of extremely low-frequency magnetic field on growth and differentiation of human mesenchymal stem cells. Electromagnetic Biology and Medicine. 29 (4), 165-176 (2010).
- Enoch, S., Grey, J. E., Harding, K. G. ABC of wound healing. Non-surgical and drug treatments. BMJ. 332 (7546), 900-903 (2006).
- Bhosale, A. M., Richardson, J. B. Articular cartilage: Structure, injuries and review of management. British Medical Bulletin. 87 (1), 77-95 (2008).
- Al Hamed, R., Bazarbachi, A. H., Malard, F., Harousseau, J. -L., Mohty, M. Current status of autologous stem cell transplantation for multiple myeloma. Blood Cancer Journal. 9 (4), 44(2019).
- Massari, L., et al. Biophysical stimulation of bone and cartilage: state of the art and future perspectives. International Orthopaedics. 43 (3), 539-551 (2019).
- Naskar, S., Kumaran, V., Basu, B. Reprogramming the Stem Cell Behavior by Shear Stress and Electric Field Stimulation: Lab-on-a-Chip Based Biomicrofluidics in Regenerative Medicine. Regenerative Engineering and Translational Medicine. 5 (2), 99-127 (2019).
- Hunckler, J., de Mel, A. A current affair: electrotherapy in wound healing. Journal of Multidisciplinary Healthcare. 10, 179-194 (2017).
- Henry, S. L., Concannon, M. J., Yee, G. J. The effect of magnetic fields on wound healing: experimental study and review of the literature. Eplasty. 8, 393-399 (2008).
- Hiemer, B., et al. Effect of electric stimulation on human chondrocytes and mesenchymal stem cells under normoxia and hypoxia. Molecular Medicine Reports. 18 (2), 2133-2141 (2018).
- Chao, P. H., et al. Chondrocyte translocation response to direct current electric fields. Journal of Biomechanical Engineering. 122 (3), 261-267 (2000).
- Zhao, M., Bai, H., Wang, E., Forrester, J., McCaig, C. Electrical stimulation directly induces pre-angiogenic responses in vascular endothelial cells by signaling through VEGF receptors. Journal of Cell Science. 117 (3), 397-405 (2004).
- Li, X., Kolega, J. Effects of direct current electric fields on cell migration and actin filament distribution in bovine vascular endothelial cells. Journal of Vascular Research. 39 (5), 391-404 (2002).
- Singh, B., Dixit, A. Multistage amplifier and tuned amplifier. Analog Electronics. , Laxmi publications (P) LTD. Boston, MA. 87-131 (2007).
- Esfandiari, E., et al. The effect of high frequency electric field on enhancement of chondrogenesis in human adipose-derived stem cells. Iranian Journal Basic Medical Sciences. 4 (3), 571-576 (2014).
- Mardani, M., et al. Induction of chondrogenic differentiation of human adipose-derived stem cells by low frequency electric field. Advanced Biomedical Research. 5 (97), 1-7 (2016).
- Karaman, O., Gümüşay, M., Demirci, E. A., Kaya, A. Comparative assessment of pulsed electromagnetic fields (PEMF) and pulsed radio frequency energy (PRFE) on an in vitro wound healing model. International Journal of Applied Electromagnetics and Mechanics. 57, 427-437 (2018).
- Glinka, M., et al. Test chambers for cell culture in static magnetic field. Journal of Magnetism and Magnetic Materials. 331, 208-215 (2013).
- Vacek, T. P., et al. Electrical stimulation of cardiomyocytes activates mitochondrial matrix metalloproteinase causing electrical remodeling. Biochemical and Biophysical Research Communications. 404 (3), 762-766 (2011).
- Okutsu, S., et al. Electric Pulse Stimulation Induces NMDA Glutamate Receptor mRNA in NIH3T3 Mouse Fibroblasts. The Tohoku Journal of Experimental Medicine. 215 (2), 181-187 (2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon