Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie calcique in vivo des réponses des neurones ganglionnaires géniculés de souris aux stimuli gustatifs
Dans cet article
Résumé
Nous présentons ici comment exposer le ganglion géniculé d’une souris de laboratoire vivante et anesthésiée et comment utiliser l’imagerie calcique pour mesurer les réponses d’ensembles de ces neurones aux stimuli gustatifs, permettant ainsi de multiples essais avec différents stimulants. Cela permet des comparaisons approfondies de quels neurones répondent à quels tastants.
Résumé
Au cours des dix dernières années, les progrès des indicateurs de calcium codés génétiquement (GECI) ont favorisé une révolution dans l’imagerie fonctionnelle in vivo. En utilisant le calcium comme indicateur de l’activité neuronale, ces techniques fournissent un moyen de surveiller les réponses des cellules individuelles au sein de grands ensembles neuronaux à une variété de stimuli en temps réel. Nous, et d’autres, avons appliqué ces techniques pour imager les réponses des neurones ganglionnaires géniculés individuels aux stimuli gustatifs appliqués aux langues de souris anesthésiées vivantes. Le ganglion géniculé est composé des corps cellulaires des neurones gustatifs innervant la langue antérieure et le palais ainsi que de certains neurones somatosensoriels innervant le pavillon de l’oreille. L’imagerie des réponses évoquées par le goût de neurones ganglionnaires géniculés individuels avec GCaMP a fourni des informations importantes sur les profils de réglage de ces neurones chez les souris de type sauvage ainsi qu’un moyen de détecter les phénotypes de mal câblage du goût périphérique chez les souris génétiquement manipulées. Ici, nous démontrons la procédure chirurgicale pour exposer le ganglion géniculé, l’acquisition d’images de fluorescence GCaMP, les étapes initiales pour l’analyse des données et le dépannage. Cette technique peut être utilisée avec des GCaMP codés transgéniquement, ou avec une expression GCaMP médiée par AAV, et peut être modifiée pour imager des sous-ensembles génétiques particuliers d’intérêt (c.-à-d. expression GCaMP médiée par Cre). Dans l’ensemble, l’imagerie calcique in vivo des neurones ganglionnaires géniculés est une technique puissante pour surveiller l’activité des neurones gustatifs périphériques et fournit des informations complémentaires aux enregistrements plus traditionnels des tympans de la corde du nerf entier ou aux tests de comportement gustatif.
Introduction
Un élément clé du système gustatif périphérique des mammifères est le ganglion géniculé. En plus de certains neurones somatosensoriels qui innervent le pavillon de l’oreille, le géniculé est composé des corps cellulaires des neurones gustatifs innervant la langue antérieure et le palais. Semblables à d’autres neurones sensoriels périphériques, les neurones ganglionnaires géniculés sont pseudo-unipolaires avec un long axone projetant périphériquement vers les papilles gustatives, et au centre du noyau du tronc cérébral du tractus solitaire1. Ces neurones sont activés principalement par la libération d’ATP par les cellules réceptrices du goût répondant aux stimuli gustatifs dans la cavité buccale2,3. L’ATP est un neurotransmetteur essentiel pour la signalisation du goût, et les récepteurs P2rx exprimés par les neurones ganglionnaires gustatifs sont nécessaires à leur activation4. Étant donné que les cellules réceptrices du goût expriment des récepteurs gustatifs spécifiques pour une modalité gustative particulière (sucré, amer, salé, umami ou acide), on a émis l’hypothèse que les réponses des neurones ganglionnaires gustatifs aux stimuli gustatifs seraient également étroitement accordées5.
Des enregistrements de nerfs entiers ont montré à la fois que la chorda tympani et les nerfs pétrosaux supérieurs plus grands conduisent des signaux gustatifs représentant les cinq modalités gustatives du ganglion géniculé6,7. Cependant, cela laissait encore des questions sur la spécificité des réponses neuronales à un tastant donné: s’il existe des neurones spécifiques à la modalité du goût, des neurones polymodaux ou un mélange des deux. Les enregistrements de fibres uniques donnent plus d’informations sur l’activité des fibres individuelles et leurs sensibilités chimiques8,9,10, mais cette méthodologie se limite à la collecte de données à partir d’un petit nombre de fibres. De même, les enregistrements électrophysiologiques in vivo de neurones ganglionnaires géniculés individuels de rats donnent des informations sur les réponses des neurones individuels11,12,13, mais perdent toujours l’activité de la population et produisent relativement peu d’enregistrements de neurones par animal. Afin d’analyser les schémas de réponse des ensembles neuronaux sans perdre de vue l’activité des neurones individuels, de nouvelles techniques devaient être utilisées.
L’imagerie calcique, en particulier en utilisant des indicateurs de calcium génétiquement codés comme GCaMP, a fourni cette percée technique14,15,16,17,18. GCaMP utilise le calcium comme indicateur de l’activité neuronale, augmentant la fluorescence verte à mesure que les niveaux de calcium dans la cellule augmentent. De nouvelles formes de GCaMP continuent d’être développées pour améliorer le rapport signal/bruit, ajuster la cinétique de liaison et s’adapter aux expériences spécialisées19. GCaMP fournit une résolution de neurone unique, contrairement à l’enregistrement de nerfs entiers, et peut mesurer simultanément les réponses d’ensembles de neurones, contrairement à l’enregistrement d’une seule fibre ou d’une seule cellule. L’imagerie calcique des ganglions géniculés a déjà fourni des informations importantes sur les profils de réglage de ces neurones chez les souris de type sauvage16,20, et a identifié des phénotypes périphériques de mauvais câblage du goût chez des souris génétiquement manipulées18.
Une difficulté majeure à l’application de techniques d’imagerie calcique in vivo au ganglion géniculé est qu’il est encapsulé dans la bulle tympanique osseuse. Afin d’obtenir un accès optique au géniculé, une intervention chirurgicale délicate est nécessaire pour enlever les couches d’os, tout en gardant le ganglion intact. À cette fin, nous avons créé ce guide pour aider d’autres chercheurs à accéder au ganglion géniculé et à imager les réponses fluorescentes médiées par GCaMP de ces neurones pour goûter les stimuli in vivo.
Access restricted. Please log in or start a trial to view this content.
Protocole
Les protocoles animaux ont été examinés et approuvés par les comités institutionnels de soins et d’utilisation des animaux de l’Université du Texas à San Antonio.
1. Configuration préopératoire
REMARQUE: Veuillez noter que la configuration initiale de l’équipement n’est pas abordée ici, car elle variera en fonction du système de pompe, du microscope, de la caméra et du logiciel d’imagerie utilisés. Pour obtenir des instructions d’installation, veuillez consulter le matériel didactique fourni par le fournisseur de l’équipement. Pour l’équipement utilisé par les auteurs, veuillez consulter le Tableau des matériaux.
- S’assurer que le liquide circule à travers tous les véhicules (eau) et les conduites de tastant. Si la ligne est bloquée, débranchez et rincez avec de l’eau. Si la ligne est plissée, massez jusqu’à ce que le liquide s’écoule. Assurez-vous que le liquide démarre et s’arrête sur le signal.
- Une fois que toutes les lignes sont confirmées débloquées, faites fonctionner le véhicule pendant 10 s, puis fermez toutes les vannes.
- Assurez-vous que le logiciel d’imagerie est prêt avec toutes les variables requises (par exemple, la durée de l’essai, les noms de fichiers, la fréquence d’images, etc.). À l’aide de μManager, un logiciel d’acquisition d’images open source, entrez 200 ms dans le champ intitulé Temps d’exposition pour une image par seconde de 5 Hz, sélectionnez x2 sous binning, puis appuyez sur le bouton intitulé Live. Lorsque la vidéo démarre, appuyez sur le bouton sur le côté gauche intitulé ROI. Cela se traduira par un champ de vision de 512x512.
2. Anesthésie et immobilisation de l’animal
REMARQUE: Le protocole suivant est une procédure terminale optimisée pour les souris des deux sexes pesant 18-35 g. Il est recommandé d’utiliser avec des animaux âgés de 10 à 12 semaines. Il peut être utilisé avec des animaux transgéniques exprimant des indicateurs de calcium génétiquement codés (GECI) tels que les Snap25-GCaMP6, ou des animaux injectés stéréotaxiquement avec des GECI viraux. Les gants, le manteau de laboratoire et le masque facial doivent être portés pendant toute la durée du protocole.
- Scruff animal et effectuer une injection intrapéritonéale de kétamine (100 mg / kg) et de xylazine (10 mg / kg). Évaluez la profondeur de l’anesthésie par pincement des orteils avant de continuer.
- Rasez le haut de la tête et la zone chirurgicale à l’avant du cou.
- Allumez le coussin chauffant et placez l’animal couché sur le coussin.
- Appliquez une pommade sur les yeux de l’animal pour éviter le dessèchement des yeux.
- Faites une incision (~1 cm) à la ligne médiane de la tête pour exposer le crâne de l’animal. Retirez le tissu conjonctif à l’aide d’un écouvillon stérile afin que l’os nu soit accessible. Utilisez un applicateur à pointe de coton pour vous assurer que le crâne est sec.
- Appliquez une liaison vétérinaire sur le crâne. Assurez-vous de couvrir le crâne exposé. Attendez que la colle sèche.
- Dans un couvercle de boîte de Pétri, mélanger et appliquer une couche de ciment dentaire sur le crâne. L’extrémité arrière de l’applicateur à pointe de coton utilisé à l’étape 2.5 fonctionnera bien pour ce processus. Placez le poteau de tête sur le dessus du ciment dentaire et appliquez une deuxième couche de ciment dentaire pour prendre en sandwich le poteau en place sur le crâne.
- Laissez-le reposer jusqu’à ce que le ciment dentaire soit sec et solide. Cassez l’applicateur à pointe de coton en deux et utilisez les extrémités pointues pour piquer le ciment dentaire à tester. Si le ciment dentaire ne cède pas à être piqué, l’animal peut être tourné en position couchée.
3. Trachéotomie
- Appliquer un gommage pré-chirurgical sur la zone chirurgicale. Après le gommage, faites une incision médiane ~ 2 cm dans la peau de la gorge du sternum au menton.
- Rétractez la peau et les glandes sous-maxillaires, en veillant à exposer complètement les muscles digastriques.
- Trouvez la couture dans la musculature paratrachéale, séparez-la par une dissection émoussée et ouvrez-vous.
- Coupez soigneusement une ouverture dans le haut de la trachée suffisamment grande pour s’adapter à un tube en polyéthylène (I.D. 0,86 mm, O.D. 1,27 mm). Ne coupez pas plus de la moitié du diamètre de la trachée. Insérez un tube dans la trachée vers les poumons.
- Repositionnez les rétracteurs pour libérer la musculature paratrachéale et rétracter les glandes sous-maxillaires.
- Collez la musculature paratrachéale ensemble sur un tube avec une quantité minimale de colle vétérinaire (voir Figure 1A).
4. Ouvrir la bulle tympanique
- Taquinez doucement le muscle digastrique désiré (gauche ou droit) vers le haut et séparez le tissu conjonctif. Coupez à l’extrémité antérieure du muscle, en évitant les vaisseaux sanguins, et tirez vers l’arrière jusqu’à ce qu’il soit dégagé de la bulle tympanique.
- Inclinez légèrement la tête vers l’arrière pour soulever la bulle tympanique. Localisez la branche de l’artère carotide antérieure au point d’insertion postérieur du muscle digastrique. Sentez-vous juste postérieur à ce vaisseau sanguin pour la structure convexe de la bulle tympanique.
- Recherchez une couture dans la musculature à cet endroit (voir la figure 1B). À l’aide de deux ensembles de pinces fines, disséquer émoussé à la couture jusqu’à ce que l’os de la bulle tympanique soit visible. Utilisez des rétracteurs pour garder une vue claire de la bulle tympanique.
- Trouvez la couture allant de l’avant vers l’arrière sur la bulle (voir Figure 1C). À l’aide d’une sonde chirurgicale, percez un trou dans l’os au centre de cette couture. Utilisez un ensemble de ciseaux fins pour couper une zone circulaire dans l’os, en prenant soin de ne pas couper les vaisseaux sanguins antérieurs, postérieurs et profonds sous l’bulle.
5. Exposer le géniculé
- Dans ce trou se trouve un morceau d’os convexe, c’est la cochlée. Antérieur à la cochlée est un muscle, le tympan tensorien (voir Figure 1D). À l’aide des ciseaux à ressort, coupez le tymbrique tensorier et retirez-le.
- Effectuez un pincement des orteils. Si l’animal répond, donner un mélange kétamine/xylazine à une dose de 1/3 pour le redosage.
- Préparez le liquide d’irrigation et une conduite d’aspiration. À l’aide de la sonde chirurgicale, percez un trou dans le promontoire cochléaire. Irriguez immédiatement le liquide qui s’écoule et retirez-le par aspiration. Ce liquide s’écoulera plus ou moins continuellement à partir de ce point et devra être traité périodiquement.
- Agrandir le trou dans la cochlée. Faites attention au vaisseau sanguin qui entoure la cochlée jusqu’au bord postérieur et latéral.
- Inclinez la tête de la souris vers l’avant. Localiser le trou dans l’os temporal sous ce qui était la cochlée (voir la figure 1E). Prenez note de la crête antérieure à ce trou, cette crête se trouve directement au-dessus du septième nerf.
- Insérez une sonde chirurgicale dans le trou et soulevez soigneusement l’os temporal pour exposer le septième nerf (voir figure 1F). Faites le point sur la quantité de septième nerf visible et si le géniculé n’est pas complètement exposé, inclinez la tête de l’animal vers l’arrière et essayez de tirer l’os de l’avant vers le nerf.
- Si le ganglion n’est toujours pas entièrement visible, tirez plus d’os par en dessous. Faites très attention à ne pas placer la sonde profondément sous l’os, car cela pourrait endommager le géniculé.
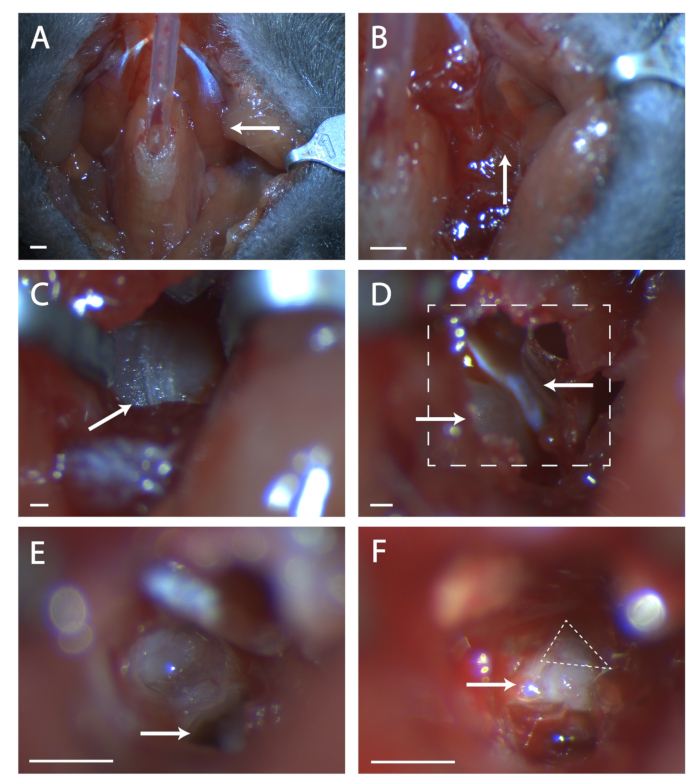
Figure 1: Exposition chirurgicale du ganglion géniculé. (A) Image de la cavité du cou de la souris après la trachéotomie. Arrow pointe vers le muscle digastrique couché sur la zone chirurgicale explorée dans le reste de la figure. (B) Image de la région sous le muscle digastrique indiqué précédemment. La flèche indique la couture dans la musculature pour la dissection contondante. (C) Image de la bulle tympanique. Flèche indique la couture dans l’os à rompre avec une sonde chirurgicale. (D) Image de la zone chirurgicale après ouverture de la bulle. La flèche inférieure gauche indique la cochlée, la flèche supérieure pointe vers le tenseur tympani. La ligne encadrée indique la zone dans (E) et (F). (E) Image de la zone chirurgicale après que la cochlée a été cassée et le contenu enlevé. La flèche blanche indique où placer la sonde chirurgicale référencée à l’étape 5.6 du protocole. (F) Image du ganglion géniculé exposé. Flèche indique le corps du septième nerf, le triangle pointillé entoure le ganglion géniculé. Panneaux A-B, Échelle = 5 mm. Panneaux C-F, Échelle = 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Exécutez le panneau tastant
- Utilisez l’aspiration pour éliminer le liquide de l’eau de géniculation. Placez éventuellement un point absorbant pour atténuer les infiltrations et faciliter la navigation au microscope.
- Placez l’animal sur un tampon absorbant sous le microscope. Localisez le ganglion géniculé: les points de repère utiles comprennent le trou laissé dans la bulle, le trou dans l’os temporal et le septième nerf. À l’aide du filtre FITC/GFP sur la portée d’épifluorescence, vérifiez la recherche de neurones ganglionnaires géniculés exprimant GCaMP. Un objectif 10x (distance de travail 10mm) fournira une résolution suffisante pour suivre l’activité des cellules individuelles, mais un objectif 20x (distance de travail 12 mm) peut également être utilisé.
- Placez l’aiguille de distribution pour la ligne de tastant fermement dans la bouche de l’animal. Placez une boîte de Petri sous la bouche de l’animal pour attraper le liquide.
- Assurez-vous que la caméra regarde le champ de vision du microscope. Synchronisez le début de l’enregistrement vidéo avec le début de la présentation de tastant.
- Pendant l’enregistrement, regardez le flux en direct pour les réponses, la dérive et l’infiltration.
- En cas d’infiltration, aspirez le liquide jusqu’à ce que la vue du géniculé soit claire et répétez. En cas de dérive, vérifiez que toutes les parties du poteau de tête sont fermement serrées. Si aucune réponse ne se produit, vérifiez que le liquide s’écoule et que le microscope et la caméra sont focalés sur le bon emplacement sans que rien n’obscurcisse le champ de vision.
- Répétez l’opération jusqu’à ce que le nombre souhaité de vidéos ait été obtenu. Assouplissez doucement les rétracteurs, puis répétez les étapes 3 à 6 du côté opposé.
- Une fois que les vidéos souhaitées ont été obtenues pour tous les ganglions souhaités, euthanasier l’animal via une luxation cervicale.
Access restricted. Please log in or start a trial to view this content.
Résultats
Selon le protocole, un animal transgénique Snap25-GCaMP6s a été sédédé, des ganglions géniculés ont été exposés et un tastant a été appliqué sur la langue pendant l’enregistrement de la vidéo. Le but de l’expérience était de définir quels tastants suscitaient des réponses de chaque cellule. Les tastants (30 mM AceK, 5 mM quinine, 60 mM NaCl, 50 mM IMP + 1 mM MPG, 50 mM d’acide citrique)18 ont été dissous dans de l’eau DI et ont été appliqués sur la langue pendant 2 ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Ce travail décrit un protocole étape par étape pour exposer chirurgicalement le ganglion géniculé et enregistrer visuellement l’activité de ses neurones avec GCaMP6s. Cette procédure est très similaire à celle décrite précédemment17, à quelques exceptions notables près. Tout d’abord, l’utilisation d’un poteau de tête permet un ajustement facile du positionnement de la tête pendant la chirurgie. Deuxièmement, en ce qui concerne l’administration de stimuli, l’approche de...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à signaler.
Remerciements
Les auteurs remercient S. Humayun pour l’élevage de souris. Le financement de ce travail a été fourni en partie par le Brain Health Consortium Graduate and Postdoctoral Seed Grant (B.E.F.) de l’UTSA et niH-SC2-GM130411 à L.J.M.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
Références
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon