Method Article
Activation 3D du cerveau entier et cartographie de la connectivité fonctionnelle chez la souris à l’aide de l’imagerie échographique fonctionnelle transcrânienne
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit la quantification des variations hémodynamiques cérébrales volumétriques dans le cerveau de la souris à l’aide d’ultrasons fonctionnels (uAp). Les procédures pour la carte d’activation fonctionnelle 3D suivant la stimulation sensorielle ainsi que la connectivité fonctionnelle à l’état de repos sont fournies à titre d’exemples illustratifs, chez des souris anesthésiées et éveillées.
Résumé
L’imagerie par ultrasons fonctionnels (fUS) est une nouvelle modalité d’imagerie cérébrale qui repose sur la mesure de haute sensibilité du volume sanguin cérébral obtenue par angiographie Doppler ultrarapide. Comme la perfusion cérébrale est fortement liée à l’activité neuronale locale, cette technique permet la cartographie 3D du cerveau entier de l’activation régionale induite par la tâche ainsi que de la connectivité fonctionnelle à l’état de repos, de manière non invasive, avec une résolution spatio-temporelle et une simplicité opérationnelle inégalées. Par rapport à l’IRMf (imagerie par résonance magnétique fonctionnelle), l’un des principaux avantages de l’imagerie fUS consiste à permettre une compatibilité complète avec les expériences sur les animaux éveillés et se comportant. De plus, la cartographie cérébrale de l’IRMf chez la souris, le modèle préclinique le plus utilisé en neurosciences, reste techniquement difficile en raison de la petite taille du cerveau et de la difficulté à maintenir des conditions physiologiques stables. Nous présentons ici un protocole simple, fiable et robuste pour l’imagerie fUS du cerveau entier chez des souris anesthésiées et éveillées utilisant un système fUS commercial prêt à l’emploi avec un transducteur linéaire motorisé, produisant une activation corticale significative après une stimulation sensorielle ainsi qu’un modèle de connectivité fonctionnelle 3D reproductible pour l’identification du réseau.
Introduction
Au cours des deux dernières décennies, la neuroimagerie est devenue un outil important pour étudier le fonctionnement et l’organisation du cerveau, permettant aux chercheurs de faire d’importantes découvertes dans le domaine des neurosciences. Aujourd’hui, l’imagerie par résonance magnétique fonctionnelle (IRMf) est devenue la technique de neuroimagerie clinique de référence pour évaluer l’activation cérébrale évoquée par une tâche ou un médicament et pour cartographier la connectivité fonctionnelle au repos. Alors que l’IRMf humaine a une fiabilité et une sensibilité élevées, l’IRMf de la souris reste techniquement difficile pour de nombreuses raisons1. Premièrement, l’IRMf a une faible résolution spatiale et temporelle. La petite taille du cerveau de la souris nécessite l’utilisation de champs magnétiques puissants utilisant des scanners coûteux pour atteindre une résolution spatiale raisonnable. Deuxièmement, le maintien de paramètres physiologiques stables dans la plage étroite permettant un couplage neuro-vasculaire efficace est très difficile chez les souris anesthésiées. Enfin, le signal dépendant du niveau d’oxygène dans le sang (BOLD) sur lequel s’appuient les études d’IRMf a une sensibilité relativement faible, ce qui conduit à un faible rapport signal/bruit lorsqu’il est appliqué à des souris et nécessite souvent une présentation répétée des stimuli sur une longue acquisition pour détecter de petites variations. La souris étant le modèle animal le plus largement utilisé dans la recherche préclinique biomédicale, ces limitations sont en partie responsables de la lacune translationnelle en neuropsychiatrie, empêchant de nouvelles cibles thérapeutiques prometteuses sur le banc d’être transposées en traitements efficaces au chevet du patient.
L’échographie fonctionnelle (fUS) est une technique de neuroimagerie récemment développée basée sur le doppler2ultrarapide. En échantillonnant directement le volume sanguin cérébral, cette technique permet de sonder l’activité cérébrale en temps réel grâce au couplage neurovasculaire. Par rapport à d’autres techniques de neuroimagerie, fUS donne une résolution spatiale de 100 μm et une résolution temporelle de quelques dizaines de millisecondes. Cette technique permet l’imagerie cérébrale complète de sections coronales complètes du cerveau de la souris, de manière totalement non invasive. De plus, il est entièrement compatible avec les animaux conscients et se comportant3,4,5. L’une des principales limitations actuelles de fUS est sa fonction 2D, permettant d’enregistrer un seul plan coronal en même temps. Alors que le fUS 3D volumétrique utilisant des transducteurs matriciels 2D a déjà été démontré avec succès chez le rat6 et confirmé chez la souris7,son manque actuel de sensibilité nécessite une craniotomie complète ainsi qu’une moyenne d’un nombre important d’essais pour détecter un léger changement d’activité. Alternativement, les transducteurs linéaires peuvent être échelonnés sur plusieurs positions et effectuer une imagerie fonctionnelle plan par plan pour couvrir l’ensemble du cerveau. Cependant, cette technique nécessite de nombreuses répétitions de paradigmes expérimentaux et à ce titre de longs temps d’acquisition (3-4 heures pour le cerveau de la souris)8,9.
Dans le présent travail, nous décrivons une plate-forme expérimentale robuste comprenant un échographe fonctionnel disponible dans le commerce et un transducteur linéaire à commutation de plan rapide avec des procédures pour acquérir des données fUS 3D chez des souris anesthésiées et éveillées, permettant une cartographie fonctionnelle volumétrique et transcrânienne du cerveau de la souris, de manière non invasive, sans agent de contraste et dans des temps d’acquisition courts. Nous illustrons cette caractéristique en cartographiant l’activation du cortex somatosensoriel suite à la stimulation des moustaches ainsi que la connectivité fonctionnelle à l’état de repos. Outre la préparation des animaux et la collecte de données, nous décrivons également la procédure de visualisation, d’enregistrement de l’atlas et d’analyse des signaux fUS en temps réel.
Protocole
Toutes les procédures présentées ici ont été réalisées en accord avec la Directive du Conseil de la Communauté Européenne du 22 septembre 2010 (010/63/UE) et notre comité d’éthique local (Comité d’éthique en matière d’expérimentation animale numéro 59, 'Paris Centre et Sud', projet #2017-23). Les souris adultes (mâles C57BL/6 Rj, âgés de 2 à 3 mois, 20 à 30 g, de Janvier Labs, France) ont été logées 4 par cage avec un cycle lumière/obscurité de 12 h, une température constante à 22 °C et de la nourriture et de l’eau ad libitum. Avant le début des expériences, les animaux bénéficient d’une période d’acclimatation minimale d’une semaine aux conditions de logement.
1. Préparation animale pour l’imagerie fUS anesthésisée
- Anesthésie
- Pesez la souris.
- Préparer un mélange de kétamine et de xylazine à 10 mg/mL et 2 mg/mL, respectivement, dans une solution saline stérile. Administrer 0,2 mL de la solution de kétamine/xylazine par voie intrapéritonéale à l’aide d’une aiguille de calibre 26 et d’une seringue jetable de 1 mL. Après quelques minutes, positionnez l’animal sur le cadre stéréotaxique, en vous assurant que la tête est plate.
- Administrer un deuxième volume d’anesthésiques pour atteindre une dose totale de 100 mg/kg de kétamine et 20 mg/kg de xylazine (en tenant compte de la dose initiale).
REMARQUE: L’anesthésie devrait durer 1 h. Pour maintenir une sédation stable plus longtemps, injecter 0,05 mL du mélange kétamine/xylazine toutes les 30 minutes par voie intrapéritonéale.
-
Préparation animale pour la séance d’imagerie anesthésique
- Appliquez une pommade pour les yeux (par exemple, Ocry-Gel) sur les yeux de souris pour éviter toute formation de cataracte pendant la séance d’imagerie. Rasez la tête de la souris à l’aide d’une tondeuse. Appliquez un peu de crème dépilatoire et rincez après quelques minutes. Répétez l’opération jusqu’à ce que les poils soient complètement enlevés.
- Insérez des broches sous-cutanées dans les membres pour l’enregistrement par électrocardiogramme (ECG). Placez le gel à ultrasons centrifuge (1500 tr/min, 5 min) sur la tête.
- Surveiller la profondeur de l’anesthésie pendant toute la durée des expériences (induction d’anesthésie incluse). Maintenir la température des animaux à 37 °C à l’aide d’une couverture chauffante couplée à une sonde rectale.
- Surveillez les paramètres physiologiques suivants qui sont des indicateurs indirects de la profondeur de l’anesthésie: fréquence cardiaque (220-250 battements par minute - surveillés par l’électrocardiogramme électrodes minces implantées par voie sous-cutanée) et fréquence respiratoire (130-140 respirations par minute - surveillée à l’aide d’un spiromètre connecté au système d’acquisition ECG).
REMARQUE : Une description de la configuration expérimentale est illustrée à la figure 1.
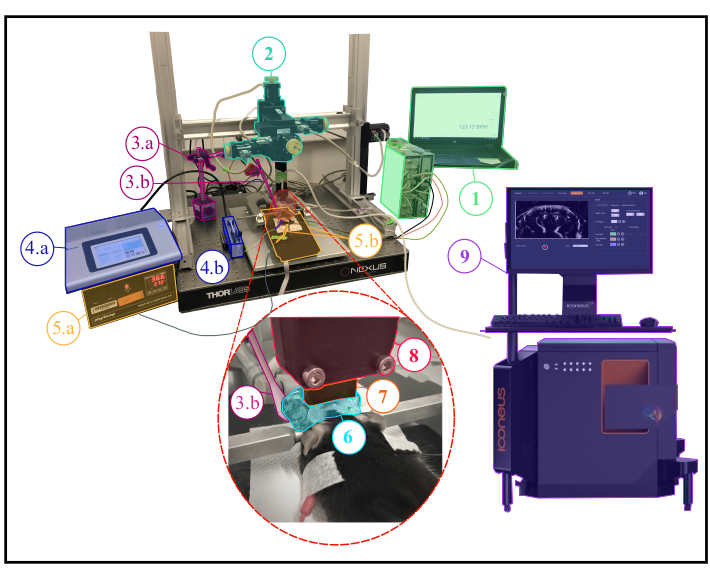
Figure 1: Configuration expérimentale pour les expériences fUS anesthésisées. Description de la configuration expérimentale montrant tout l’équipement scientifique nécessaire lors d’une expérience anesthésisée. 1. Surveillance physiologique : affichage en direct des fréquences respiratoires et cardiaques. 2. Module moteur à quatre axes (trois translations et une rotation) surveillé par le système Iconeus One (9) et permettant d’effectuer des scans tomographiques 3D transcrâniens ou des acquisitions 4D. 3a. Servo-moteur entraînant le stimulateur à moustaches (3b.) Le servomoteur est contrôlé par une carte arduino uno qui est interfacée avec le système Iconeus One (9) afin de synchroniser les schémas de stimulation avec les séquences d’imagerie. 4.a. Contrôleur de pompe à seringue. 4.b. Porte-seringue. 5.a. Moniteur de plaque de température contrôlant la plaque chauffante. 5.b. Plaque chauffante et thermomètre rectal interfacés avec le moniteur de plaque de température (5.a.). 6. Gel à ultrasons placé entre la tête de l’animal et la sonde à ultrasons, fournissant un couplage acoustique entre eux. 7. Sonde à ultrasons de 15 MHz. 8. Porte-sonde reliant la sonde (7) au module moteur (2). 9. Équipement et logiciel Iconeus One, permettant de programmer différentes séquences d’imagerie et de contrôler le module moteur (2) pilotant la sonde (7). Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Préparation des animaux pour les expériences sur les souris éveillées à tête fixe
- Chirurgie de la plaque frontale
- Placer l’animal anesthésique (étapes 1.1-1.2) dans le cadre stéréotaxique sur un coussin chauffant (37 °C). Appliquer un gel protecteur pour les yeux et administrer de la lidocaïne s.c. (0,2 mL, 2 %) sous la peau du cuir chevelu à l’aide d’une aiguille de calibre 26 et attendre quelques minutes.
REMARQUE: Surveillez le niveau d’anesthésie toutes les 10-30 minutes en réponse (absence de) à un pincement ferme de l’orteil. - Effectuer une incision après la suture sagittale de l’arrière de l’os occipital jusqu’au début de l’os nasal. À l’aide de ciseaux chirurgicaux, excisez la peau sur les deux hémisphères.
- Nettoyez le crâne avec une solution d’iode à 1% et retirez tout périoste restant. En utilisant la plaque frontale comme gabarit, percez deux trous (1 mm de diamètre) dans le crâne pour positionner les vis d’ancrage.
ATTENTION: Veillez à ne pas percer complètement le crâne pour éviter toute lésion cérébrale ou inflammation de la dura - Positionnez la plaque frontale avec les vis. Utilisez du ciment dentaire pour fixer les vis et la plaque frontale à l’avant et à l’arrière du cadre afin de maintenir une bonne adhérence de l’implant.
ATTENTION: Veillez à ne pas appliquer de ciment à l’intérieur de la fenêtre du cadre, car cela diminue considérablement la qualité du signal. Couvrez le crâne avec une fine couche de colle chirurgicale pour protéger l’os et sceller les plaies sur le côté de la fenêtre d’imagerie. - Retirer l’animal du cadre stéréotaxique une fois le ciment sec et inverser l’anesthésie par une injection sous-cutanée d’atipamezole à 1 mg/kg. Une administration prophylactique de méloxicam (5 mg/kg/jour, s.c.) est administrée pour la douleur postopératoire.
- Placer l’animal dans une cage de récupération sur un coussin chauffant (37 °C). La souris peut retourner sa cage d’origine avec des compagnons de litière en quelques heures. Placez un capuchon magnétique imprimé en 3D (matériau d’acide polyactique avec inserts magnétiques) sur la plaque de tête pour la protection (Figure 2A). Laissez la souris récupérer pendant 4 à 6 jours avant le début de l’accoutumant à la cage de maison mobile (CMH).
REMARQUE: Le poids total du capuchon et de la plaque frontale est de 2,8 g.
- Placer l’animal anesthésique (étapes 1.1-1.2) dans le cadre stéréotaxique sur un coussin chauffant (37 °C). Appliquer un gel protecteur pour les yeux et administrer de la lidocaïne s.c. (0,2 mL, 2 %) sous la peau du cuir chevelu à l’aide d’une aiguille de calibre 26 et attendre quelques minutes.
- Manipulation et accoutumant
- Le jour 1 après la récupération (PR), tenez doucement la souris à la main pendant 5 à 10 minutes plusieurs fois par jour.
- Le jour 2 PR, répétez la manipulation comme au jour 1 et laissez l’animal pendant 5 à 10 minutes explorer librement le CMH.
REMARQUE: Jouer de la musique de fond dans la pièce peut aider à réduire le stress des animaux. - Le jour 3 PR, laissez l’animal explorer librement le CMH pendant 5 à 10 minutes. Ensuite, attrapez soigneusement la plaque frontale et placez-la doucement dans la pince, en déplaçant manuellement la cage en carbone pour accompagner la souris. Habituez l’animal en position fixe pendant 5 à 10 minutes. Nettoyez le CMH entre les séances d’entraînement avec une solution d’éthanol à 70% et rincez à l’eau du robinet.
REMARQUE: Assurez-vous que le CMH reçoit un débit d’air suffisant comme recommandé par le fabricant. La hauteur de la pince de tête doit être ajustée manuellement pour fournir une position confortable. - Les jours 4 et 5 PR, serrez à plusieurs reprises le CMH de la souris et augmentez progressivement le temps fixé par la tête, à partir de 5 min et jusqu’à 30 min. Appliquez un peu de solution saline et de gel à ultrasons sur la fenêtre d’imagerie pour vous habituer.
- Le jour 6 PR, répétez le protocole à partir du jour 4/5 PR et placez la sonde au-dessus de la tête de l’animal après l’étape 3.1.
- Le jour de l’expérience, procédez comme décrit ci-dessus. Ensuite, humidifiez la fenêtre d’imagerie avec une solution saline et appliquez un peu de gel à ultrasons. Commencez le suivi de l’animal et passez au positionnement de la sonde (voir ci-dessous).
REMARQUE: Le serrage dans le CMH peut également être effectué en enveloppant la souris dans un chiffon. Dans ce cas, les souris doivent être habituées à la procédure d’emballage avant la fixation de la tête. Une description d’une configuration expérimentale complète pour l’imagerie éveillée est fournie à la figure 2B.
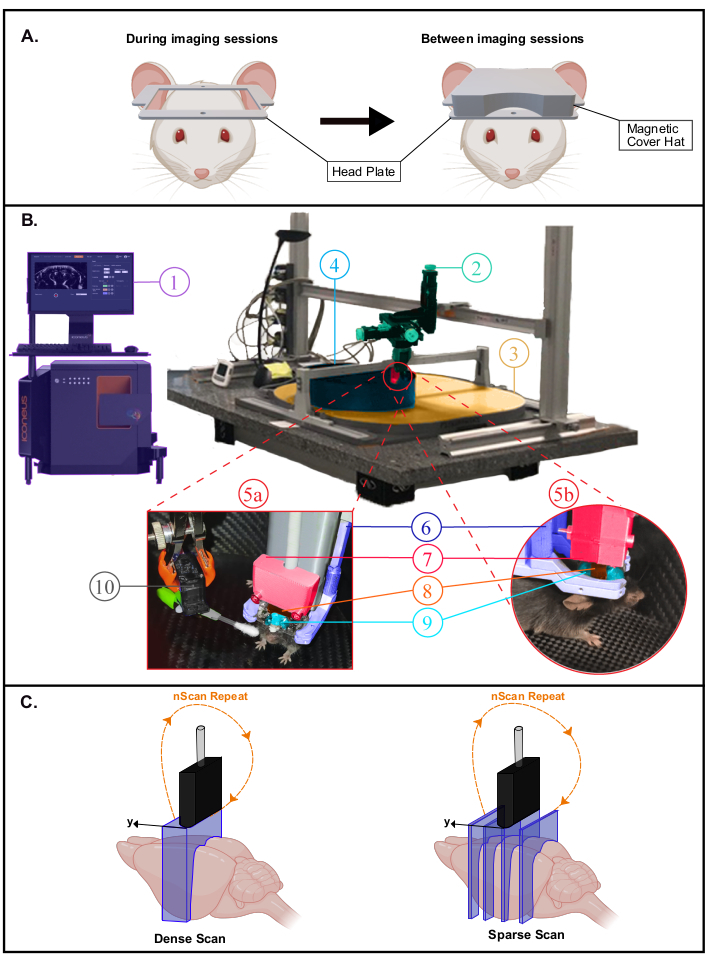
Figure 2: Configuration expérimentale pour les expériences fUS éveillées. Un. Illustration schématique du couvercle magnétique de la plaque frontale protégeant la fenêtre d’imagerie (créée avec BioRender.com). Pendant les séances d’imagerie (à gauche), le couvercle est retiré pour scanner le cerveau dans la grande ouverture offerte par la plaque de tête. B. Photographie de la configuration expérimentale pour l’imagerie éveillée transcrânienne chez des souris à comportement libre fixées à la tête. 1. Système et logiciel Iconeus One, permettant de configurer différentes séquences d’imagerie et de contrôler le module moteurs. 2. Module de moteurs à quatre axes (trois translations et une rotation) surveillé par le système Iconeus One (1) et permettant des scans tomographiques 3D ou des acquisitions 4D. 3. Table de distribution d’air. 4. Cage de maison mobile (CMH). 5a,5b. Photographies montrant des vues plus rapprochées de l’environnement de l’animal à l’intérieur du CMH. 6. Système de fixation de la tête serrant la plaque de tête. 7. Support de sonde reliant la sonde au module moteur (2). Sonde à ultrasons 8. 15 MHz. 9. Gel à ultrasons placé entre la tête de la souris et la sonde à ultrasons, fournissant un couplage acoustique entre eux. 10. Servo-moteur entraînant le stimulateur à moustaches. Le servomoteur est contrôlé par une carte Arduino Uno qui est interfacée avec le système Iconeus One via un signal TTL (1) afin de synchroniser les schémas de stimulation avec les séquences d’imagerie. C. Illustration des différentes possibilités d’échantillonnage spatial (créées avec BioRender.com): dans chaque cas, la sonde est échelonnée de la première à la dernière position et une image Doppler est enregistrée à chaque position pour reconstruire le volume empilé. Ce processus est répété en continu pendant toute la durée d’acquisition. Balayage dense (à gauche) : l’étape entre les tranches doit être suffisamment petite (généralement 400 μm, ce qui correspond à la résolution d’élévation) pour permettre l’imagerie volumétrique. Sparse Scan (à droite) : si des régions fonctionnelles éloignées sont ciblées (à différentes positions), il est également possible de diminuer l’échantillonnage spatial pour imager différentes tranches qui croisent ces régions sans compromettre l’échantillonnage temporel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Positionnement de la sonde
- Démarrez le logiciel (par exemple, IcoScan) et créez une session d’expérimentation. Accédez au menu Déplacer la sonde pour régler la position de la sonde à ultrasons à l’aide du clavier de navigation.
REMARQUE: La sonde doit être positionnée à environ 1 mm au-dessus de la tête de l’animal. Il est crucial de s’assurer que la sonde est en contact avec un gel à ultrasons avant de commencer toute séquence d’imagerie. - Démarrez l’acquisition Live View et ajustez la position de la sonde si nécessaire via l’imagerie en temps réel du CBV (volume sanguin cérébral) de l’animal. Alignez le cerveau au centre de l’image. Optimisez les paramètres d’imagerie pour capturer le rapport signal/bruit le plus élevé.
REMARQUE: Dans les expériences sur des souris éveillées, la taille de l’ouverture doit être réduite pour éviter les artefacts induits par la contraction des muscles latéraux.
4. Analyse angiographique et enregistrement de l’atlas
- Ouvrez l’option Angio 3D dans le logiciel d’acquisition. Sur le panneau prédéfini, ajustez les paramètres de numérisation (première tranche, dernière tranche et taille de l’étape) afin de scanner tout le cerveau(Figure 3A, B) et de démarrer l’acquisition.
REMARQUE: Lors de la configuration des paramètres de numérisation, assurez-vous que l’analyse couvrira la partie postérieure du cerveau - Laissez le logiciel d’acquisition ouvert et démarrez le logiciel pour l’analyse et la visualisation des données (par exemple, IcoStudio), puis chargez le scan 3D angio. Naviguez dans le volume d’acquisition à l’aide du panneau 3 vues et sélectionnez la direction de balayage coronale: antéro-postérieure ou postéro-antérieure.
- Accédez au panneau d’enregistrement du cerveau. Chargez le modèle de référence de la souris qui sera nécessaire pour le processus d’enregistrement. Enregistrez l’analyse sur Le cadre de coordonnées communes Allen Mouse à l’aide des modes d’enregistrement entièrement automatique ou manuel ( Figure3C).
- Vérifiez le résultat en regardant la superposition du scan 3D angio et du modèle de référence ou en regardant la superposition du scan et de l’atlas de référence Allen à l’aide du panneau Atlas Manager (Figure 3D). Enregistrez l’enregistrement en tant que fichier .bps.
REMARQUE: Le fichier d’enregistrement peut être réutilisé pour toute autre acquisition effectuée au cours de la même session d’expérience.
5. Système de positionnement du cerveau (BPS)
- Dans le logiciel IcoStudio, assurez-vous que l’analyse angiographique et son fichier .bps (généré à l’étape 4.4) sont chargés.
- Accédez au panneau de navigation cérébrale. Dans le panneau Atlas Manager, parcourez l’atlas cérébral Allen de la souris à l’aide de l’arborescence parent/enfant. Trouvez les régions anatomiques ciblées et sélectionnez-les pour les superposer à votre scan dans les 3 vues.
- Visualisez les régions ciblées dans le panneau à 3 vues et choisissez un plan d’imagerie qui chevauche les régions ciblées pour l’expérience. Pour ce faire, définissez manuellement deux marqueurs sur la position coronale qui inclut les régions d’intérêt.
- Cliquez sur Système de positionnement du cerveau (BPS) pour extraire les coordonnées motrices résultantes. Ces coordonnées correspondent à la position de la sonde qui permet d’imager le plan ciblé. Vérifiez l’aperçu de l’image qui est calculé à partir de l’angio scan.
- Dans le logiciel IcoScan, entrez dans le panneau de positionnement de la sonde et cliquez sur Entrer les coordonnées BPS. Appliquez les coordonnées indiquées à l’étape 5.4. La sonde se déplace et s’aligne sur le plan d’imagerie ciblé.
- Effectuez une acquisition en vue réelle et vérifiez que le plan d’imagerie actuel correspond à la prédiction donnée à l’étape 5.4.
REMARQUE: Il est également possible de sélectionner des plans parasagitals / non orthogonaux.
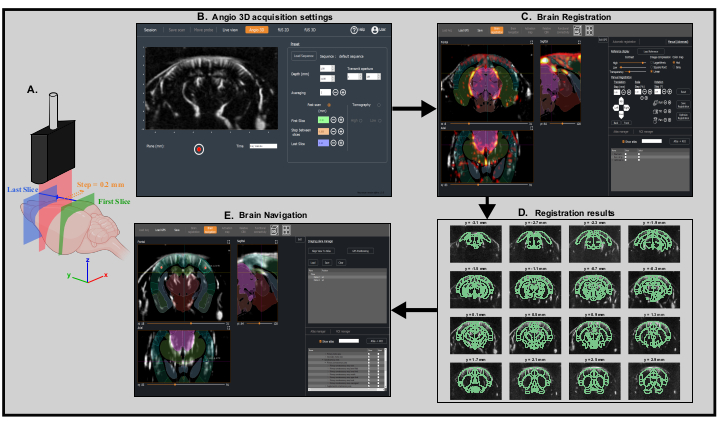
Figure 3: Analyse angiographique transcrânienne rapide et enregistrement cérébral pour un positionnement précis de la sonde. Un. Représentation schématique du cerveau de la souris scanné transcrâniennement par la sonde à ultrasons de la première tranche coronale (verte) à la dernière tranche coronale (bleue) lors d’une analyse angiographique rapide. La tranche imagée actuelle (représentée en rouge) se déplace pas à pas de l’arrière (vert) vers l’avant (bleu) du cerveau. Créé avec BioRender.com B. Capture d’écran du logiciel d’acquisition IcoScan dans le panneau Angio 3D. Les paramètres prédéfinis sur la droite configurent l’analyse rapide. Les positions en mm de la première tranche, de la dernière tranche et de la taille du pas doivent être bien choisies pour scanner linéairement l’ensemble du cerveau. C. Capture d’écran du logiciel de traitement IcoStudio. Le scan rapide Angio 3D est automatiquement enregistré dans un modèle de référence du cerveau de la souris. Les trois vues (à gauche) montrent la superposition de la vascularisation et du cerveau de la souris Allen atlas dans les vues coronale, sagittale et axiale. D. Mise en forme linéaire (montage) de 16 tranches (sur 31) du scan angio 3D, avec l’atlas de référence Allen enregistré superposé au vascularisation. E. Capture d’écran du panneau de navigation cérébrale montrant le plan d’imagerie prédit correspondant aux coordonnées motrices calculées par le logiciel grâce aux deux marqueurs placés au centre du cortex somatosensoriel primaire gauche et droit, région des champs de baril. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Expérience évoquée par une tâche : stimulation des moustaches
- Prédéfinissez la séquence de stimulation, y compris le temps de stimulation, le temps d’interstimulation et le nombre de répétitions.
- Exécutez une séquence 3D fUS en définissant le temps total d’acquisition, le nombre de positions ainsi que le temps mort entre les positions. En cas de stimulation automatique synchronisée avec le système d’acquisition via une entrée TTL, sélectionnez l’option Trig-IN avant de commencer l’acquisition.
NOTE: Pour les résultats présentés dans ce travail, la stimulation a été administrée à l’aide d’un coton-tige positionné de manière à permettre la déviation de la plupart des moustaches dans la direction dorsale / ventrale. Il a été fixé sur un servomoteur entraîné par une carte Arduino UNO, reliée au système Iconeus One pour assurer la synchronisation. Les paramètres recommandés pour la stimulation sont 30 s ON, 30 s OFF, amplitude de 20° et fréquence 4 Hz. Alternativement, la stimulation peut également être délivrée manuellement en déviant les moustaches aux moments définis lors de l’acquisition. - Ouvrez l’acquisition dans le logiciel IcoStudio et entrez dans le menu Carte d’activation. Remplissez le champ du modèle d’activation avec les heures de début et de fin et calculez la carte d’activation. Ajustez les paramètres d’affichage pour la visualisation. Exportez la carte d’activation sous forme de fichier .h5 pour une analyse hors ligne.
REMARQUE: L’activation est estimée à l’aide d’une approche de modèle linéaire généralisé (GLM) avec le stimulus convolu par une réponse hémodynamique de souris (HRF) par défaut. Alternativement, l’activation peut être visualisée directement en estimant la corrélation de Pearson entre le modèle de stimulation et le signal hémodynamique de chaque voxel.
7. Connectivité fonctionnelle 4D
- Exécutez une séquence fUS 3D en définissant le temps total d’acquisition, le nombre de positions du plan d’imagerie ainsi que le temps mort entre les positions.
REMARQUE: Pour la connectivité fonctionnelle 4D, nous recommandons un temps d’acquisition entre chaque volume < 2,5 s (fréquence d’échantillonnage d’au moins 0,4 Hz) et un temps d’acquisition total d’au moins 10 min (nombre de points de temps > 180). - Enregistrez l’acquisition et chargez-la dans le logiciel IcoStudio. Si nécessaire, chargez le fichier .bps et le cadre de coordonnées cérébrales de la souris Allen. Dans le gestionnaire Atlas, sélectionnez les régions de l’atlas en tant que régions d’intérêt (ROI).
- Entrez dans le menu Connectivité fonctionnelle et sélectionnez les régions souhaitées dans le gestionnaire de retour sur investissement. Visualisez les résultats sous forme de matrice de connectivité (analyse supervisée) ou de carte de corrélation basée sur les semences (non supervisée). Sélectionnez et ajustez les filtres de bande passante comme vous le souhaitez et exportez les résultats de corrélation pour une analyse statistique.
REMARQUE: En mode d’imagerie 3D fUS, les positions relatives de la sonde sont définies manuellement. Par conséquent, deux types de scans sont possibles et peuvent être choisis en fonction de l’application fonctionnelle : les scans denses versus les scans clairsemés (Figure 2C).
Résultats
Ce protocole décrit la quantification 3D des variations hémodynamiques cérébrales transcrâniennes dans le cerveau de la souris, au repos ou en réponse à une stimulation sensorielle. La stimulation des moustaches, un paradigme standard pour cartographier l’activation fonctionnelle du cerveau chez les rongeurs, a été choisie comme exemple de réponse évoquée par stimulation sensorielle. La figure 4 montre une carte d’activation représentative en réponse à la stimulation mécanique des moustaches chez une souris anesthésiée obtenue par imagerie transcrânienne de l’US. Le temps total d’essai était de 760 s, avec une ligne de base de 60 s (avant et après la stimulation), une stimulation de 80 s et un temps de récupération de 60 s, répété 5x. L’activation significative a été déterminée avec la résolution d’un modèle linéaire général (GLM) à l’aide d’une fonction de réponse hémodynamique de souris (HRF) par défaut. Les régions activées (scores Z avec une valeur de p >0,0000006 après une correction rigoureuse de Bonferroni pour une comparaison multiple) sont affichées sous forme de valeurs codées par couleur superposées au modèle de cadre de coordonnées communes Allen. L’évolution temporelle voxel du cortex somatosensoriel primaire controlatéral, région du champ de baril (S1BF) a révélé une augmentation de 15 à 20% du CBV par rapport à la ligne de base.
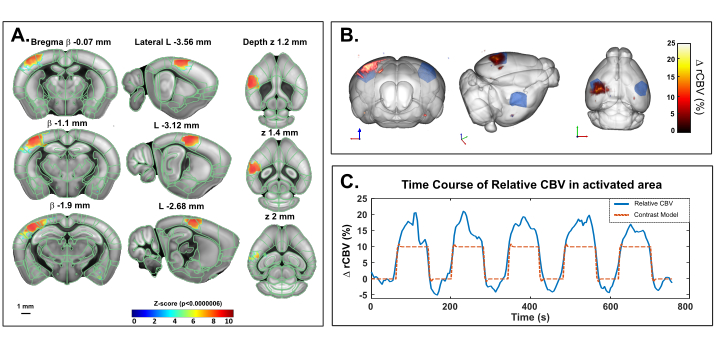
Figure 4: Cartes d’activation transcrânienne et évolution temporelle du rCBV suite à la stimulation des moustaches chez la souris anesthésiée à la kétamine/xylazine. Un. Carte d’activation montrant des voxels significativement activés suite à une stimulation mécanique des moustaches droites (80 s ON, 60 s OFF, 5x) sous anesthésie kétamine/xylazine. Les cartes ont été obtenues en calculant des scores Z basés sur l’analyse générale du modèle linéaire (GLM) avec correction de Bonferroni pour une comparaison multiple. Les scores Z (codés par couleur) sont superposés sur le modèle 3D du cerveau Allen (après enregistrement auprès du système de positionnement du cerveau) et affichés en trois vues: coronale (à gauche), sagittale (au milieu) et axiale (à droite). Les régions anatomiques du cadre de coordonnées communes du cerveau de la souris Allen sont affichées pour référence. Les voxels activés sont bien situés à l’intérieur du cortex S1BF gauche. Barre d’échelle: 1 mm. Chaque volume d’échantillon a été scanné sur 2,8 mm (correspondant à 7 tranches dans le sens de l’élévation) en 3,85 s permettant d’enregistrer 20 échantillons volumiques lors de chaque réponse fonctionnelle. B. Rendu 3D de l’augmentation du volume sanguin cérébral relatif (RCBV) évoquée par la stimulation des moustaches par rapport au niveau de référence. La délimitation anatomique du S1BF est indiquée en bleu. C. Évolution temporelle des variations cbV dans le S1BF gauche (bleu) et le stimulus correspondant appliqué (rouge). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le même paradigme a été appliqué dans une souris à comportement fixe dans la cage de la maison mobile en utilisant le préréglage éveillé d’IcoScan. La figure 5 présente la carte d’activation après une expérience de stimulation à plusieurs moustaches à l’aide de la configuration expérimentale décrite à la figure 2. Quelques moustaches postérieures et caudales ont été stimulées avec le schéma suivant : 30 s d’inclusion suivies de cinq essais consécutifs de 30 s ON (4 Hz) et 30 s OFF(Figure 5C). La stimulation a été fournie à l’aide d’un servomoteur entraîné par une carte Arduino UNO déclenchant la séquence d’acquisition d’image pour la synchronisation. L’activation significative a été déterminée avec la résolution d’un modèle linéaire général (GLM) à l’aide d’une fonction de réponse hémodynamique de souris (HRF) par défaut. Une correction de comparaison multiple a été effectuée avec la méthode Bonferroni. Le niveau alpha conventionnel de 0,05 a été normalisé par le nombre total de voxels dans le volume d’acquisition, ce qui a donné un seuil final strict de 0,000003.
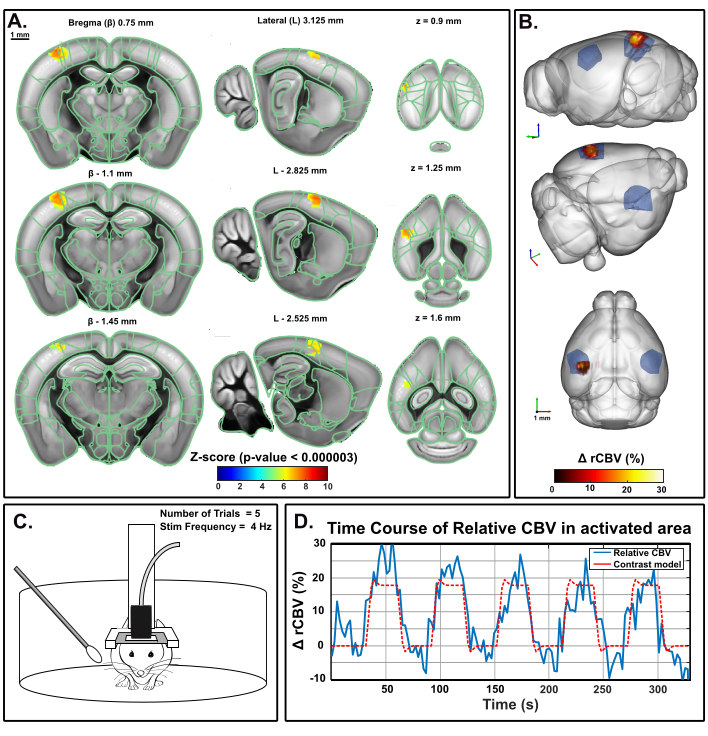
Figure 5: Cartes d’activation et cours temporel du rCBV suivant la stimulation des moustaches chez la souris au comportement éveillé. Un. Carte d’activation montrant des voxels significativement activés suite à une stimulation mécanique des moustaches droites (30 s ON, 30 s OFF, 5x) chez une souris éveillée dans la maison mobile. Les cartes ont été obtenues en calculant des scores Z basés sur l’analyse générale du modèle linéaire (GLM) avec correction de Bonferroni pour une comparaison multiple (normalisation par le nombre total de voxels). Les scores Z (codés par couleur) sont superposés sur le modèle 3D du cerveau Allen (après enregistrement auprès du système de positionnement du cerveau) et affichés en trois vues: coronale (à gauche), sagittale (au milieu) et axiale (à droite). Les régions anatomiques du cadre de coordonnées communes du cerveau d’Allen Mouse sont affichées à titre de référence. Les voxels activés sont bien situés à l’intérieur du cortex S1BF gauche. Barres d’écailles, 1 mm. Chaque volume d’échantillon a été scanné sur 1,6 mm (correspondant à 3 tranches dans le sens de l’élévation) en 3,85 s permettant d’enregistrer 17 échantillons volumiques lors de chaque réponse fonctionnelle. B. Rendu 3D de l’augmentation du volume sanguin cérébral relatif (rCBV) évoquée par la stimulation des moustaches par rapport au niveau de référence. La délimitation anatomique du S1BF est indiquée en bleu. C. Illustration de la souris dans la maison mobile lors de l’expérience de stimulation de la moustache droite, au cours de laquelle cinq essais de 30 s ont été réalisés pour un temps d’acquisition total de 330 s. D. Parcours temporel CBV relatif instantané extrait à l’intérieur de la zone activée (bleu), avec le stimulus correspondant superposé (rouge). Veuillez cliquer ici pour voir une version agrandie de cette figure.
La figure 6 montre les corrélations temporelles des fluctuations spontanées normalisées du CBV à basse fréquence (<0,2 Hz) entre les régions cérébrales 3D (identifiées depuis l’enregistrement dans le cadre de coordonnées communes d’Allen) chez une souris anesthésisée à la kétamine-xylazine. Le temps total d’acquisition était de 20 min (1200 s). L’analyse supervisée par Atlas a révélé de forts modèles de connectivité interhémisphérique, avec des valeurs de coefficient de corrélation résultantes allant jusqu’à 0,8. L’analyse basée sur les graines dans l’hippocampe dorsal a révélé une connectivité interhémisphérique significative entre l’hippocampe droit et gauche ainsi que les régions rétro-hippocampiques profondes et les cortex piriformes. Une région de semence sélectionnée dans le S1BF a également donné lieu à un modèle de corrélation symétrique (cortico-cortical), comme décrit précédemment.
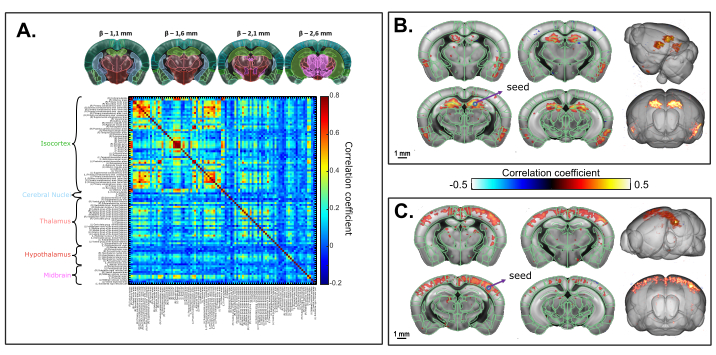
Figure 6: Connectivité fonctionnelle transcrânienne à l’état volumétrique au repos du cerveau de la souris sous anesthésie kétamine/xylazine évaluée sur une acquisition 3D fUS de 20 min. Un. Matrice de corrélation basée sur les régions 3D du cadre de coordonnées communes Allen enregistrées sur l’acquisition fonctionnelle transcrânienne. La matrice est obtenue en calculant la corrélation normalisée de Pearson des fluctuations spontanées des basses fréquences (<0,1 Hz) des signaux temporels moyens de tous les voxels inclus dans chaque roi identifié après correction de la synchronisation des tranches. Chaque volume échantillonné a été scanné sur 1,6 mm dans le sens d’élévation (correspondant à 4 tranches) acquis sur 2,2 s. B. Analyse basée sur les graines projetée sur un modèle 3D. La graine a été sélectionnée dans l’hippocampe dorsal droit à β - 2,1 mm. La carte de corrélation est obtenue en calculant le coefficient de corrélation de Pearson entre les signaux temporels de la graine et chaque voxel de l’ensemble de l’acquisition après correction de la synchronisation des tranches. C. Carte de corrélation 3D basée sur une analyse basée sur les semences avec la région de semence sélectionnée dans le S1BF à β - 2,1 mm. Barres d’échelle: 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Les méthodes d’imagerie du cerveau entier sont des outils cruciaux pour mieux comprendre la physiologie et la pathologie du cerveau. La méthode décrite ici permet la quantification précise des signaux hémodynamiques dans le cerveau vivant directement au banc. La sensibilité et la résolution spatio-temporelle inégalées de l’échographie fonctionnelle sont particulièrement bien adaptées à la physiologie de la souris. Les réponses fonctionnelles et les réseaux d’états de repos peuvent être cartographiés dans des temps d’acquisition courts, longitudinalement et sans avoir à faire la moyenne des essais ou des sujets pour obtenir une mesure fiable. La combinaison pertinente de sondes linéaires à ultrasons haute sensibilité et de configurations motorisées rapides permet d’effectuer une imagerie fUS volumétrique transcrânienne chez la souris dans des délais d’acquisition raisonnables. Ce protocole peut être effectué sur des souris anesthésiées ou éveillées à l’aide d’une cage de maison mobile.
La stimulation par moustaches, le stimulus sensoriel utilisé comme exemple illustratif dans ce manuscrit, est un paradigme d’activation fonctionnelle standard chez les rongeurs et une lecture fiable pour étudier le traitement sensoriel, le couplage neurovasculaire et leurs altérations5,6,10,11. Bien que le brossage manuel grossier des moustaches puisse être préféré pour sa facilité d’utilisation, cette méthode manque de précision spatiale et temporelle. L’utilisation d’un stimulateur automatique, tel que celui décrit ici déclenché avec le scanner d’imagerie fUS, permet un meilleur contrôle de plusieurs paramètres dont le moment d’apparition, le déplacement d’amplitude, la fréquence ainsi que l’angle du Q-tip/peigne, ce qui se traduit par une meilleure reproductibilité inter-animaux. De plus, un moment plus précis de la stimulation permet de modéliser la fonction de réponse hémodynamique (HRF) en déterminant le temps d’apparition et le temps de pic des paramètres12,13. Pour assurer une meilleure précision sur le nombre de moustaches déviées lors de la stimulation (et donc sur la zone de la région activée), des stimulateurs plus sophistiqués peuvent être adaptés à ce protocole. De nombreux autres stimuli tels que la lumière8,le son14 ou la présentation desodeurs 15 peuvent être mis en œuvre en utilisant le même protocole.
La compatibilité de l’échographie fonctionnelle avec les animaux éveillés et se comportant est un avantage important par rapport à d’autres techniques de neuroimagerie, permettant une cartographie de l’activation fonctionnelle sans biais d’anesthésie. L’utilisation d’une maison mobile à air est une bonne alternative aux autres appareils fixes existants tels que les tapis roulants linéaires ou sphériques. Tout en étant fermement fixé sur la tête, le mouvement de la homecage donne à la souris l’illusion de naviguer dans l’environnement, permettant à un large éventail de tests comportementaux d’être couplés à l’imagerie fUS16. Cependant, la procédure d’accoutumumabilité à la fixation de la tête constitue une étape importante pour réduire le stress, en particulier pour les expériences où il peut être considéré comme un facteur de confusion. La procédure détaillée ici (6 jours de manipulation et d’accoutumation à la fixation de la tête) donne des résultats robustes pour la stimulation sensorielle et la connectivité fonctionnelle à l’état de repos. Cependant, il pourrait être nécessaire de prolonger la période d’accoutumant pour des tests comportementaux plus raffinés17.
Déclarations de divulgation
Jeremy Ferrier et Bruno-Félix Osmanski sont des employés d’Iconeus. Thomas Deffieux, Zsolt Lenkei, Bruno-Félix Osmanski et Mickael Tanter sont co-fondateurs et actionnaires d’Iconeus.
Remerciements
Ce travail a été soutenu par la subvention avancée n° 339244-FUSIMAGINE du Conseil européen de la recherche (ERC), l’Agence nationale de la recherche finançant « Pinch » (ANR-18-CE37-005), l’accélérateur technologique de recherche Inserm en échographie biomédicale, le noyau technique ElfUS de l’IPNP, Inserm U1266, le programme de recherche européen FUSIMICE du Human Brain Project et la bourse à court terme EMBO 8439 à Andrea Kliewer.
matériels
| Name | Company | Catalog Number | Comments |
| BD Plastipak 1 mL syringes | Dutscher, France | 303172 | |
| BD Microlance 26 Gauge needles | Dutscher, France | 303800 | |
| Animal Temperature Controller (heating Plate coupled with a rectal probe) | Physitemp | TCAT-2DF | |
| Arduino | Arduino | Arduino Uno-Rev3 | |
| Atipamezole | Orion Pharma, France | Antisedan® | 5 mg/ml injectable solution |
| Dental Ciment | Sun Médical, Shiga, japan | Superbond C&B | |
| Depilatory cream | Klorane | N/A | |
| Eye Ointment | TVM, UK | Ocry-gel | |
| Hair trimmer | Wella Profesionnals | N/A | |
| Head plates | Neurotar, Finland | Model 14 | |
| Iconeus One standard package for fUS | Iconeus, France | Iconeus One | |
| IcoScan acquisition software (v1.0) | Iconeus, France | IcoScan | |
| IcoStudio analysis software (v1.0) | Iconeus, France | IcoStudio | |
| Isoflurane Anesthesia station | Minerve, Esternay, France | ||
| Ketamine | Virbac, France | Ketamine1000 | 100 mg/ml injectable solution |
| Lidocaine | Vetoquinol | Lurocaine® | 20 mg/ml injectable solution |
| Medetomidine | Orion Pharma, France | Domitor® | 1 mg/ml injectable solution |
| Meloxicam | Boehringer lingelheim | Metacam® | 0.5 mg/ml injectable solution |
| Mobile HomeCage Large with tracking capability | Neurotar, Finland | MHC-L-T-V4 | |
| Monitoring of ECG and breathing rate | AD Systems, (USA) and LabChart software | ||
| Servomotor | Feetech | FT90B | |
| Stereotaxic frame | David Kopf (Tujunga, USA) | 900-WA | Using Mouse Adaptor (Ref: 922) and Non-Rupture Ear Bars (ref: 922) |
| Surgical glue | 3M, USA | Vetbond | |
| Syringe Pump | KD Scientific, USA | Legato® 130, Cat# 788130 | |
| Ultrasound gel | DREXCO medical, France | Medi'Gel | |
| Xylazine 2% | Bayer, France | Rompun® | 20 mg/ml injectable solution |
Références
- Hoyer, C., Gass, N., Weber-Fahr, W., Sartorius, A. Advantages and challenges of small animal magnetic resonance imaging as a translational tool. Neuropsychobiology. 69 (4), 187-201 (2014).
- Deffieux, T., Demene, C., Pernot, M., Tanter, M. Functional ultrasound neuroimaging: a review of the preclinical and clinical state of the art. Current Opinion in Neurobiology. 50, 128-135 (2018).
- Rabut, C., et al. Pharmaco-fUS: Quantification of pharmacologically-induced dynamic changes in brain perfusion and connectivity by functional ultrasound imaging in awake mice. NeuroImage. 222, 117231 (2020).
- Tiran, E., et al. Transcranial functional ultrasound imaging in freely moving awake mice and anesthetized young rats without contrast agent. Ultrasound in Medicine and Biology. 43 (8), 1679-1689 (2017).
- Ferrier, J., Tiran, E., Deffieux, T., Tanter, M., Lenkei, Z. Functional imaging evidence for task-induced deactivation and disconnection of a major default mode network hub in the mouse brain. Proceedings of the National Academy of Sciences of the United States of America. 117 (26), 15270-15280 (2020).
- Rabut, C., et al. 4D functional ultrasound imaging of whole-brain activity in rodents. Nature Methods. 16 (10), 994-997 (2019).
- Brunner, C., et al. A platform for brain-wide volumetric functional ultrasound imaging and of circuit dynamics in awake mice. Neuron. 108 (5), 861-875 (2020).
- Gesnik, M., et al. 3D functional ultrasound imaging of the cerebral visual system in rodents. NeuroImage. 149, 267-274 (2017).
- Macé, &. #. 2. 0. 1. ;., et al. Whole-brain functional ultrasound imaging reveals brain modules for visuomotor integration. Neuron. 100 (5), 1241-1251 (2018).
- Macé, E., Montaldo, G., Cohen, I., Baulac, M., Fink, M., Tanter, M. Functional ultrasound imaging of the brain. Nature Methods. 8 (8), 662-664 (2011).
- Tiran, E., et al. Transcranial functional ultrasound imaging in freely moving awake mice and anesthetized young rats without contrast agent. Ultrasound in Medicine and Biology. 43 (8), 1679-1689 (2017).
- Claron, J., et al. Large scale functional ultrasound imaging of the spinal cord reveals in depth spatiotemporal responses of spinal nociceptive circuits in both normal and inflammatory state. Pain. , (2020).
- Aydin, A. K., et al. Transfer functions linking neural calcium to single voxel functional ultrasound signal. Nature Communications. 11 (1), 2954 (2020).
- Bimbard, C., et al. Multi-scale mapping along the auditory hierarchy using high-resolution functional ultrasound in the awake ferret. eLife. 7, 35028 (2018).
- Boido, D., et al. Mesoscopic and microscopic imaging of sensory responses in the same animal. Nature Communications. 10 (1), 1110 (2019).
- Kislin, M., et al. Flat-floored air-lifted platform: A new method for combining behavior with microscopy or electrophysiology on awake freely moving rodents. Journal of Visualized Experiments. (88), e51869 (2014).
- Juczewski, K., Koussa, J. A., Kesner, A. J., Lee, J. O., Lovinger, D. M. Stress and behavioral correlates in the head-fixed method: stress measurements, habituation dynamics, locomotion, and motor-skill learning in mice. Scientific Reports. 10 (1), 12245 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon