Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation fonctionnelle de la barrière de jonction serrée intestinale et de la perméabilité aux ions dans les tissus natifs par la technique de la chambre d’Ussing
Dans cet article
Résumé
L’épithélium intestinal confère non seulement l’absorption des nutriments, mais aussi une protection contre les substances nocives. La jonction intercellulaire épithéliale la plus apicale, c’est-à-dire la jonction serrée, régule le soluté paracellulaire et la perméabilité aux ions. Ici, un protocole pour la préparation des feuilles muqueuses et l’évaluation de la sélectivité ionique des jonctions serrées à l’aide de la technique de la chambre d’Ussing est décrit.
Résumé
La technique de la chambre d’Ussing a été inventée pour la première fois par le scientifique danois Hans Ussing en 1951 pour étudier le transport transcellulaire du sodium à travers la peau de grenouille. Depuis lors, cette technique a été appliquée à de nombreux tissus différents pour étudier les paramètres physiologiques du transport à travers les membranes. La méthode de la chambre d’Ussing est préférable à d’autres méthodes car le tissu natif peut être utilisé, ce qui le rend plus applicable à ce qui se passe in vivo. Cependant, comme le tissu natif est utilisé, le débit est faible, le temps est limité et la préparation des tissus nécessite des compétences et de la formation. Ces chambres ont été utilisées pour étudier des protéines transporteuses spécifiques dans divers tissus, comprendre la physiopathologie des maladies telles que la fibrose kystique, étudier le transport et l’absorption des médicaments, et surtout contribué à la compréhension du transport des nutriments dans l’intestin. Compte tenu de l’ensemble du processus de transport épithélial d’un tissu, non seulement les voies transépithéliales, mais aussi les voies paracellulaires sont importantes. Les jonctions serrées sont un déterminant clé de la perméabilité paracellulaire spécifique des tissus dans l’intestin. Dans cet article, la technique de la chambre d’Ussing sera utilisée pour évaluer la permsélectivité paracellulaire des ions en mesurant la conductance transépithéliale et les potentiels de dilution.
Introduction
La méthode de la chambre d’Ussing a été développée pour la première fois par le scientifique danois Hans Ussing. Ussing l’a utilisé pour la première fois pour mesurer le courant de court-circuit du transport du sodium à travers la peau de grenouille après avoir observé que le NaCl pouvait être transporté à travers la peau contre un gradient de concentration élevé1. Son système consistait en la peau de grenouille montée entre deux chambres avec accès de chaque côté de la peau. Chaque chambre contenait la solution de Ringer qui circulait et était aérée. Deux ponts étroits de sonnerie de gélose situés près de la peau et reliés à des électrodes saturées de KCl-calomel ont mesuré la différence de potentiel lue par un potentiateur. Une deuxième paire de ponts de sonnerie de gélose était située à l’extrémité opposée de chaque chambre reliée à des béchers avec du KCl saturé saturé saturé d’AgCl pour appliquer une force électromotrice fournie par une batterie. Un diviseur de potentiel a été utilisé pour ajuster la tension de sorte que la différence de potentiel à travers la peau reste nulle, créant ainsi des conditions de court-circuit. Un microampèremètre a également été connecté pour lire le courant traversant la peau (voir la figure en réf.1 pour la conception originale de la chambre).
Au cours des 70 dernières années, cette technique a été appliquée à de nombreux tissus différents, en particulier le tissu intestinal, pour étudier le transport des nutriments et des ions. Par exemple, le mécanisme de la diarrhée induite par le choléra a été étudié en montant l’iléon de lapin dans ces chambres, et il a été constaté que la diarrhée induite par la toxine du choléra est médiée par l’AMPc2. En outre, ces chambres ont également été utilisées pour étudier le mécanisme sous-jacent au transport du glucose via le cotransporteur Na+-Glucose 1 (SGLT1)3. Notre laboratoire se concentre sur le transport transcellulaire et paracellulaire dans les cellules épithéliales intestinales. En utilisant la méthode de la chambre d’Ussing, le transport peptidique a été évalué chez Claudin 15 souris knockout, qui ont altéré le transport paracellulaire du sodium, en utilisant des chambres d’Ussing pour mesurer l’absorption de la glycylsarcosine dipeptide non hydrolysable. Il a été constaté que l’homéostasie luminale Na+ est importante pour le transport peptidique couplé à des protons4. En outre, ces chambres ont également été utilisées pour étudier la sécrétion d’anions dans le caecum murin en réponse à l’activation sous-muqueuse du récepteur 1 activé par la protéinase par la sérine protéase trypsine5.
Les chambres d’ussing ont également été récemment utilisées pour évaluer les voies paracellulaires dans le tissu épithélial. Les voies paracellulaires sont régulées par des jonctions serrées, qui sont des complexes de protéines qui se forment au point où deux cellules ou plus se rencontrent6. La fonction barrière et la sélectivité ionique (si les anions ou les cations sont sélectivement capables de passer à travers la jonction serrée) sont déterminées par la présence de protéines de la famille des claudines; certains d’entre eux agissent comme des barrières (claudin 3 et 7), des pores anioniques (claudin 10a) ou des pores cationiques (claudin 2, 10b et 15)7. D’autres méthodes ont été utilisées pour évaluer la voie paracellulaire, telles que le gavage oral de FITC accompagné d’une concentration plasmatique de FITC8, ou EDTA-Cr9; cependant, ces techniques sont de résolution inférieure et ne peuvent pas évaluer la sélectivité ionique ou une section spécifique des sections du tractus intestinal. Les chambres d’ussage, cependant, peuvent être utilisées pour évaluer le potentiel de dilution des ions cibles et, par conséquent, déterminer la sélectivité ionique des jonctions serrées. Par exemple, avec naCl, la sélectivité des jonctions serrées pour Na+ et Cl- peut être calculée en diluant un côté de la membrane (généralement le côté muqueux) et en mesurant le changement de différence de potentiel transépithélial. Les perméabilités relatives de Na+ et Cl- peuvent être estimées par l’équation de Goldman-Hodgkin-Katz10 et la sélectivité de la jonction serrée peut être estimée à l’aide de l’équation de Kimizuka-Koketsu11. Ces chambres ont donc l’avantage de mesurer les paramètres électrophysiologiques des tissus et, par conséquent, de fournir plus d’informations sur le passage des ions à travers les jonctions serrées que d’autres méthodes de résolution inférieure.
La méthode de la chambre d’Ussing ne se limite pas seulement au tractus intestinal, bien qu’elle soit largement utilisée dans les études concernant l’intestin, elle a également de nombreuses autres applications. Par exemple, ces chambres ont été utilisées pour étudier la fibrose kystique, et plus particulièrement le régulateur de conductance transmembranaire de la fibrose kystique (CFTR)12 à canal chlorure. La fibrose kystique est causée par une mutation du CFTR13, qui entraîne une altération de la sécrétion de chlorure et du transport des liquides par les cellules épithéliales respiratoires, ainsi qu’une couche muqueuse plus épaisse et plus sèche14. L’étude du CFTR épithélial des voies respiratoires a été réalisée avec ces chambres non seulement pour comprendre la maladie, mais aussi pour découvrir des moyens de traiter la maladie. Par exemple, chez les patients présentant des mutations rares causant la fibrose kystique, l’analyse des cellules épithéliales respiratoires des patients a été utilisée pour tester des thérapies telles que Orkambi et une cothérapie amplificateur15.
Les chambres d’ussing ont également été utilisées pour étudier les voies d’administration des médicaments, par exemple avec le tissu de biopsie humaine pour étudier l’absorption des médicaments et la pharmacocinétique16. L’absorption intestinale n’est pas la seule voie d’administration du médicament. Ces chambres ont également été utilisées pour étudier les systèmes d’administration nasale de médicaments17. Des études d’administration de médicaments avec des chambres d’Ussing ont également été réalisées pour l’œil. Dans la cornée de lapin, des études de perméabilité et d’absorption ont été menées avec Labrasol, un médicament conçu pour augmenter l’absorption des médicaments dans les tissus18. Une autre étude a examiné l’effet du chlorure de benzylalkonium sur l’administration transsclérale de médicaments dans la sclérotique du lapin19.
La méthode de la chambre d’Ussing est utile car le tissu natif peut être utilisé. En tant que tel, il est préférable aux modèles in vitro tels que les lignées cellulaires Caco-2. Cependant, la technique nécessite des compétences et du temps pour préparer des échantillons, elle ne convient donc pas aux applications à haut débit. Les propriétés électrophysiologiques des monocouches cellulaires peuvent être étudiées à l’aide d’inserts de culture cellulaire dans ces chambres. Des découvertes récentes ont permis la culture d’organoïdes qui sont des mini-organes cultivés en culture à partir de la récolte de cellules souches épithéliales ou endothéliales20. La culture organoïde peut être manipulée pour être cultivée en monocouche, ce qui permet de monter des organoïdes dans une chambre d’Ussing21. Les organoïdes de divers tissus épithéliaux et endothéliaux peuvent être étudiés, ce qui réduit le nombre d’animaux nécessaires, car la culture organoïde peut être maintenue à long terme. Cela augmentera également le débit, car des étapes de dissection et de préparation des tissus fastidieuses et laborieuses ne seront pas nécessaires. À l’avenir, les études en chambre d’Ussing continueront d’être très utiles pour étudier le transport des tissus et elles seront particulièrement importantes dans le domaine de la médecine personnalisée.
Le protocole suivant démontre l’application de la méthode de la chambre d’Ussing pour évaluer la permsélectivité et la fonction barrière des jonctions serrées dans l’intestin grêle des souris knock-out Claudin 15 (Cldn15-/-) et des témoins de type sauvage (WT) en mesurant le potentiel de dilution du NaCl. Des jonctions serrées (TJ) se forment au point où deux cellules ou plus se rencontrent dans le tissu épithélial et endothélial. On pense que les jonctions serrées bicellulaires (bTJ), en particulier les protéines de la famille de la claudine présentes dans la bTJ, déterminent la fonction barrière et la permsélectivité de TJ7. Les souris Cldn15-/- ont un méga intestin grêle22 et une capacité d’absorption des nutriments réduite en raison de la perte de recyclage intestinal de Na+ qui se produit via la claudine 154,23,24. Les souris Cldn15-/- ont une homéostasie Na+ altérée, ce qui en fait un modèle intéressant pour étudier la permsélectivité du TJ. Le protocole suivant évalue la perméabilité du TJ au NaCl en mesurant le potentiel de dilution du NaCl (PNa/PCl) dans l’intestin grêle moyen. En bref, le changement de différence de potentiel membranaire qui se produit en diluant un côté de la membrane (côté M ou côté S, les deux sont mesurés dans le protocole ci-dessous) peut être utilisé pour calculer la perméabilité de Na+ (PNa) et Cl- (PCl), et le potentiel de dilution (PNa / PCl) montrera si la jonction serrée a une sélectivité cationique ou anionique.
Les expériences de ce protocole ont été menées à l’aide d’une chambre Ussing personnalisée (Figure 1A), qui se compose de deux moitiés, entre lesquelles la préparation intestinale est montée verticalement, amplificateur de serrage de tension, enregistreur électrique, électrodes, ponts salins, solution de Ringer, tampon HEPES (150 mM NaCl), tampon HEPES dilué (75 mM NaCl), préparation intestinale (pour plus de détails sur l’équipement, voir la Table des matériaux).
Protocole
Tous les animaux utilisés dans ces expériences ont été maintenus dans l’établissement de soins aux animaux de l’Université de Shizuoka et les expériences ont été menées conformément aux directives pour la recherche animale établies par l’Université de Shizuoka. Toutes les expériences ont été réalisées avec l’approbation du Comité de soins et d’utilisation des animaux de l’Université de Shizuoka (permis n ° 205272 et n ° 656-2303).
1. Préparation des électrodes NaCl
REMARQUE: Les électrodes utilisées dans ces expériences sont constituées de NaCl concentré ou KCl. Les électrodes KCl/calomel sont achetées dans le commerce. Avant de commencer l’expérience, assurez-vous que toutes les électrodes sont remplies jusqu’au sommet avec une solution concentrée de NaCl ou de KCl.
- Préparez de petits bocaux en verre avec des couvercles en plastique (volume 20 mL).
- Percer deux trous dans les couvercles en plastique, l’un pour le pont de sel NaCl (2,5 mm de diamètre) et l’autre pour le fil d’argent (1 mm de diamètre; Figure 1C, électrode NaCl).
- Remplir le bocal en verre avec une solution saturée de NaCl (environ 15 mL, jusqu’à ce qu’il soit plein).
- Insérez du fil d’argent (0,8 mm de diamètre, 7 cm de long) dans le pot, mais assurez-vous que la partie du fil à l’extérieur du pot peut être connectée via des clips en alligator (petite taille) au système d’amplification.
- Lorsqu’ils ne sont pas utilisés, enveloppez les électrodes et assurez-vous que les trous sont recouverts d’un parafilm pour éviter le séchage.
2. Préparation des ponts salins
REMARQUE: Préparez des ponts de sel au moins un jour avant l’expérience pour donner suffisamment de temps pour se solidifier. Les ponts salins peuvent être utilisés à plusieurs reprises, mais une utilisation après 2 mois n’est pas recommandée.
- Ponts de sel NaCl
- Préparer le tube en polyéthylène #7 (diamètre extérieur 2,3 mm, diamètre intérieur 1,3 mm), aiguille 19 G et seringue de type verrou, 200 mL de solution de NaCl 1 M, gélose 2 g, récipient en plastique scellable pour le stockage du pont salin.
- Préparez un nombre approprié de ponts de sel en coupant les tubes à la taille nécessaire à la mise en place de la chambre d’Ussing (chaque chambre nécessite deux ponts de sel).
- Avant l’injection de gélose, faites une forme en U avec les tubes et placez-les dans un bécher d’eau tiède (pour créer une forme facile pour la mise en place de ponts salins).
- Faire 200 mL de 1 M De NaCl en dissolvant 11,688 g de NaCl dans 200 mL dans de l’eau désionisée.
- Diviser 1 M de NaCl en portions de 100 mL : Faire 100 mL de gélose à 2 % dans 1 M de NaCl (mélanger 2 g de gélose dans du NaCl, chauffer au micro-ondes pour dissoudre).
- À l’aide d’une aiguille de 19 G et d’une seringue verrouillable, remplissez la seringue avec 1 M de solution de NaCl/agar. Commencez doucement à expulser la solution goutte à goutte et, ce faisant, insérez l’aiguille dans une extrémité du tube et remplissez jusqu’à ce que le mélange sorte de l’autre côté.
- Retirez lentement l’aiguille tout en exprimant la solution et répétez jusqu’à ce que tous les ponts salins nécessaires aient été faits. (Si la solution se solidifie dans la seringue ou l’aiguille, réchauffez-la brièvement dans de l’eau chaude jusqu’à ce que la solution puisse être exprimée à nouveau.)
- Vérifiez les ponts salins pour vous assurer qu’il n’y a pas de bulles et conservez dans la solution de NaCl restante de 1 M dans un récipient hermétique.
- Ponts de sel KCl
REMARQUE: Des tubes plus minces sont utilisés pour les ponts de gélose KCl afin d’éviter l’incrément de concentration de K + dans le tampon, car les pointes de pont de sel peuvent se dissoudre et K + peut s’infiltrer dans le tampon.- Préparer le tube en polyéthylène n ° 3 (diamètre extérieur 1,0 mm, diamètre intérieur 0,5 mm), seringue de type aiguille et serrure 23 G, 200 mL de solution 1 M KCl, gélose 2 g, récipient en plastique hermétique pour le stockage du pont salin.
- Préparez un nombre approprié de ponts de sel en coupant le tube à la taille nécessaire à la mise en place de la chambre d’Ussing (chaque chambre nécessite deux ponts de sel).
- Faire 200 mL de 1 M KCl en dissolvant 14,91 g de KCl dans 200 mL d’eau désionisée.
- Diviser en deux portions de 100 mL : Faire 100 mL de gélose à 2 % dans 1 M KCl (mélanger 2 g de gélose dans KCl, chauffer au micro-ondes pour dissoudre).
- À l’aide d’une aiguille de 23 G et d’une seringue de verrouillage, injecter le tube avec un mélange d’agar à 2% de 1 M KCl (assurez-vous que les tubes sont complètement remplis et qu’il n’y a pas de bulles) de la même manière qu’avec les ponts de sel NaCl.
- Vérifiez les ponts salins pour vous assurer qu’il n’y a pas de bulles et conservez-les dans la solution restante de 1 M KCl dans un récipient hermétique.
3. Préparation de la solution de Ringer et du tampon HEPES
REMARQUE: Selon le tissu monté dans la chambre d’Ussing, les composants de la solution de Ringer peuvent différer. Les recettes présentées ici sont spécifiques pour le petit et le gros intestin.
- Préparez la solution de Ringer le jour des expériences, comme décrit dans le tableau 1.
- Faites bouillonner la solution avec 95% o2/5% de CO2 pour fournir de l’O2 au tissu et une capacité tampon.
| Solution de Ringer (intestin grêle) | Solution de Ringer (gros intestin) |
| NaHCO3 – 21,0 mM | NaHCO3 – 21,0 mM |
| K2HPO4 – 2,4 mM | K2HPO4 – 2,4 mM |
| KH2PO4 – 0,6 mM | KH2PO4 – 0,6 mM |
| NaCl – 119,0 mM | NaCl – 119,0 mM |
| MgCl2 – 1,2 mM | MgCl2 – 1,2 mM |
| CaCl2 – 1,2 mM | CaCl2 – 1,2 mM |
| Indométacine – 10 μM (Faire 1 mM de bouillon dans 21 mM de NaHCO3, ajouter 10 mL de bouillon pour 1 L de solution de Ringer) | Indométacine – 10 μM (Faire 1 mM de bouillon dans 21 mM de NaHCO3, ajouter 10 mL de bouillon pour 1 L de solution de Ringer) |
| 1 mM de glutamine (0,146 g/L) | 10 mM de glucose |
Tableau 1 : Recette de la solution de Ringer. Pour fabriquer la solution de Ringer, mélangez tous les composants avec de l’eau désionisée. La solution de Ringer est mieux faite fraîche avant les expériences. Conserver au réfrigérateur ou sur la glace jusqu’à utilisation. Avant utilisation, gazez avec 95% O2/5% co2.
- Rendre le tampon HEPES frais le jour de l’expérience, comme décrit dans le tableau 2 , en mélangeant les ingrédients dans de l’eau désionisée.
- Ne réglez pas le volume final du tampon avant l’ajustement du pH.
- Tampon HEPES chaud à 37 °C et ajuster le pH à 7,4 en ajoutant lentement des gouttes de solution de Tris de 1 M en remuant.
- Ajuster au volume final en ajoutant la quantité appropriée d’eau désionisée.
| Tampon HEPES | Tampon HEPES de dilution |
| HEPES – 10 mM | HEPES – 10 mM |
| Glucose – 10 mM (gros intestin) | Glucose – 10 mM (gros intestin) |
| 1 mM de glutamine (0,146 g/L) (intestin grêle) | 1 mM de glutamine (0,146 g/L) (intestin grêle) |
| NaCl – 150 mM | NaCl – 75 mM + 150 mM de mannitol (pour tenir compte des différences d’osmolalité) |
| MgCl2 – 1 mM | MgCl2 – 1 mM |
| CaCl2 – 2 mM | CaCl2 – 2 mM |
| Indométacine – 10 μM (Faire 1 mM de bouillon dans 21 mM de NaHCO3, ajouter 10 mL de bouillon pour 1 L de solution de Ringer) | Indométacine – 10 μM (Faire 1 mM de bouillon dans 21 mM de NaHCO3, ajouter 10 mL de bouillon pour 1 L de solution de Ringer) |
| Ajuster à un pH de 7,40 (37 °C) à l’aide de 1 M Tris | |
Tableau 2 : Recette du tampon HEPES. Pour fabriquer un tampon HEPES et un tampon HEPES de dilution, dissoudre tous les ingrédients dans de l’eau désionisée. Les solutions doivent être ajustées au pH avec une solution de Tris de 1 M, alors n’ajoutez pas tout le volume d’eau (par exemple, lorsque vous faites 1 L, dissolvez tous les ingrédients dans environ 800 mL d’eau). Ensuite, chauffez la solution à 37 °C, ajustez le pH à 7,4 puis ajustez le volume final.
4. Configuration de la chambre d’ussing
REMARQUE: Les chambres Ussing utilisées dans ce protocole sont des chambres de perfusion continue sur mesure. Pour évaluer la fonction de barrière intestinale de la souris ou l’absorption des nutriments, des chambres avec une ouverture de 4 ou 5 mm de diamètre sont recommandées25 (Figure 1A-C).
- Pour réduire l’effet de bord26 et aider à sceller les chambres, fixez un film de paraffine perforé de 4 ou 5 mm (environ 4 cm2) avant de le mettre en place (Figure 1B).
- Mise en place dans des conditions de circuit ouvert pour la mesure du potentiel de dilution. Réglez en mode de serrage actuel. Réglez la sortie sur le courant et réglez l’impulsion de courant sur ±20 μA.
- Lors de la mise en place dans des conditions de court-circuit pour la mesure du courant de court-circuit et de la résistance transmuqueuse, réglé en mode de serrage de tension. Réglez la sortie comme tension et réglez l’impulsion de tension sur ±5 mV.
- Assurez-vous que de l’eau à 37 °C circule dans la veste d’eau.
- Remplissez chaque chambre avec la solution de Ringer ou le tampon HEPES (la quantité dépend du système utilisé, les chambres utilisées ici nécessitent 5 mL pour chaque côté) et assurez-vous qu’il n’y a pas de fuites.
- Connectez des ponts de sel et des électrodes.
- Assurez-vous que la tension est égale à 0 et stable, le courant d’impulsion pour s’assurer que les ponts de sel et les électrodes sont correctement configurés.
- Laisser le système et la température de la solution de Ringer s’équilibrer pendant au moins 20 min.
- Après l’équilibrage, corrigez la différence de tension asymétrique entre les électrodes KCl et compensez la résistance aux fluides en la changeant à zéro (consultez le manuel du système de chambre d’Ussing utilisé pour déterminer la bonne voie).
5. Dissection du tissu intestinal
NOTE: Toute expérimentation animale doit être effectuée dans le respect des règlements établis par le pays et l’université.
- Avant de prendre le tissu intestinal, préparez la solution fraîche et glacée de Ringer et faites-la bulle avec 95% d’O2 et 5% de CO2 pendant 15 min (étape 3).
- Anesthésier les souris selon les directives régissant l’utilisation des animaux dans la recherche. Pour cette expérience, des souris ont été anesthésiées avec 2% à 3% d’isoflurane administré par un anesthésiste. Vérifiez la bonne anesthésie en pinçant les orteils et en vous assurant qu’il n’y a pas de réponse à la douleur.
- Faites une incision dans l’abdomen avec des ciseaux du bassin au diaphragme; localisez l’estomac et coupez l’extrémité pylorique de l’estomac.
- Saisissez la partie de l’estomac attachée à l’intestin grêle avec une pince et tirez doucement l’intestin grêle tout en coupant les attaches mésentériques. Veillez à ne pas couper ou endommager le tissu intestinal de quelque manière que ce soit.
- Continuez à disséquer l’intestin jusqu’à l’anus. Pour l’élimination complète du gros intestin, coupez les os pelviens pour révéler la partie distale du gros intestin et retirez soigneusement le reste de l’intestin en coupant les attaches.
- Mesurez la longueur de l’intestin et divisez-la en segments souhaités. Pour cette expérience, divisez l’intestin grêle en trois segments et utilisez le segment intermédiaire.
- Placez les segments souhaités dans la solution de Ringer glacée et bouillonnée; ensuite, ouvrez chaque segment longitudinalement en coupant le long des attaches mésentériques. Coupez la graisse et le tissu conjonctif.
- Retournez les segments dans la solution glacée de Ringer et lavez-les soigneusement (même dans la solution glacée, l’oxygénation de l’épithélium luminal est importante pour maintenir la fonction épithéliale).
6. Décapage de la couche musculaire et préparation de la feuille intestinale
REMARQUE: L’élimination de la sérose (couche musculaire) est importante pour les études de transport utilisant l’intestin. Si la sérose reste, le tissu intestinal peut être soumis à des contractions musculaires aléatoires qui déformeront les données électrophysiologiques, et le transport peut être inhibé. Les tissus non découpés se détériorent rapidement lorsqu’ils sont montés dans des chambres d’Ussing, car la sérose est une barrière de diffusion importante pour le substrat et l’oxygène. Dans certains cas particuliers, il peut être nécessaire de conserver la couche musculaire, de sorte que la décision appartient au chercheur et à la conception expérimentale. Les feuilles intestinales peuvent être préparées de deux manières selon la couche à enlever (Figure 2). Pour cette expérience, des préparations de muqueuses et de sous-muqueuses sont nécessaires (Figure 2, 2e panneau).
- Préparer des plaques de dissection (10 cm de diamètre) recouvertes de caoutchouc de silicone, de broches (petites aiguilles d’acupuncture), de papier filtre perforé de 5 mm et de carrés de parafilm (2 cm x 2 cm; peuvent ne pas être nécessaires pour d’autres systèmes).
- Versez la solution fraîche, glacée et bouillonnée de Ringer dans la plaque de dissection (assez pour couvrir le tissu, environ 2-3 mL).
- Sous un stéréomicroscope, épinglez les extrémités du tissu intestinal (côté muqueux vers le bas).
- À l’aide de pinces fines, disséquez carrément la couche musculaire de la muqueuse sous-jacente.
- Veillez à ne pas déchirer ou introduire de trous dans les tissus.
- Une fois la couche musculaire retirée, coupez un morceau assez grand pour une ouverture de 5 mm de diamètre. Lors de la préparation de l’intestin grêle, l’élimination de la couche séreuse-musculaire doit être effectuée dans les 10 minutes, car l’oxygénation luminale est difficile dans ces conditions.
- Mouillez le carré de papier filtre perforé de 5 mm dans la solution de Ringer et placez le tissu intestinal dessus avec le côté muqueux vers le bas, car les préparations sous-muqueuses s’enroulent spontanément avec le côté muqueux à l’extérieur.
- Assurez-vous que l’ouverture est complètement recouverte par le tissu intestinal et qu’aucune ride n’est présente. Utilisez un tableau noir sous la préparation pour vérifier si l’ouverture est complètement couverte.
- Répétez cette procédure pour le nombre requis de préparations muqueuses (dans cette expérience, deux préparations sont nécessaires: une préparation sera utilisée pour mesurer le potentiel de dilution et l’autre sera utilisée pour mesurer les paramètres électriques de base).
7. Montage des préparations intestinales dans les chambres d’Ussing
REMARQUE: La configuration dépendra du type de système de chambre Ussing et du système d’enregistrement utilisés.
- Aspiration de la solution de Ringer/tampon HEPES de la chambre d’Ussing.
- Démontez la chambre d’Ussing et posez le papier filtre avec le côté muqueux de la préparation intestinale vers le bas sur la chambre latérale muqueuse et ajustez-le de manière à ce que la fenêtre de la chambre s’aligne avec le trou du papier filtre (Figure 1A, le marquage noir autour de la fenêtre de la chambre est utile pour l’alignement des préparations).
- Placez soigneusement la chambre latérale séreuse sur la chambre latérale muqueuse et fermez-la hermétiquement, mais assurez-vous que le drap intestinal n’a pas bougé pendant la connexion.
- Remplissez rapidement les deux chambres avec la solution de Ringer ou le tampon HEPES, et placez des baguettes bouillonnantes (solution de Ringer: 95% O2/5% CO2; Tampon HEPES : 100% O2) à l’extrémité opposée des chambres, loin de la membrane (bouillonner trop près de la préparation pourrait avoir un effet sur les mesures).
- Reconnectez les ponts salins et vérifiez si la tension est stable et le courant d’impulsion pour vous assurer que les connexions sont correctes (Figure 1C).
- Répétez l’opération pour chaque préparation intestinale.
- Laissez le système s’équilibrer pendant environ 15 min. Si vous utilisez un système d’enregistrement, laissez la conductance et la différence de potentiel Isc/membrane se stabiliser avant de commencer les expériences.
8. Expérience du potentiel de dilution (conditions en circuit ouvert)
- Lavez les deux côtés de la chambre en aspirant le tampon HEPES et en ajoutant 5 mL de tampon HEPES frais préchauffé de chaque côté.
- Mettez le système d’enregistrement sous tension. Réglez la portée sur 250 mV (le système utilisé ici amplifie la tension de sortie 10x), définissez les positions des marqueurs et réglez le système d’enregistrement sur mesure.
- Mettez les systèmes de chambre d’Ussing en mode pince et commencez à mesurer. Une fois que le potentiel membranaire s’est stabilisé (~15-20 min), l’évaluation peut commencer.
- Aspirer le tampon HEPES du côté muqueux et le remplacer rapidement par 5 mL de tampon HEPES de dilution chauffé contenant 75 mM de NaCl.
- Une fois que le potentiel membranaire a atteint son pic (5-10 min), retirez le tampon de dilution du côté « Muqueux » et remplacez-le par un tampon HEPES.
- Si nécessaire, répétez l’étape 3 pour le côté Serosal, en ajoutant un tampon HEPES de dilution au côté Serosal.
- Pour s’assurer que le tissu est viable, ajouter l’activateur adénylate cyclase Forskoline (concentration finale 10 μM) à la face sérologique.
- Une fois que la différence de potentiel membranaire a atteint un pic et a commencé à diminuer, l’expérience est terminée.
9. Mesure de la conductance électrique transépithéliale et de l’Isc de base (conditions de court-circuit)
- Lavez les deux côtés de la chambre en aspirant la solution de Ringer et en ajoutant 5 mL de solution de Ringer fraîchement bouillonnée de chaque côté.
- Mettez le système d’enregistrement sous tension. Réglez la plage à 2,5 V (le système utilisé ici amplifie la tension de sortie 10x), réglez les positions des marqueurs et réglez le système d’enregistrement sur mesure.
- Transformez les systèmes de chambre d’Ussing en mode pince et commencez à mesurer; une fois que l’Isc et la conductance se sont stabilisés (~15-20 min), des mesures de base peuvent être obtenues.
- Pour s’assurer que le tissu est viable, ajouter l’activateur adénylate cyclase Forskoline (concentration finale 10 μM) du côté séreux.
- Une fois que la différence de potentiel membranaire a atteint un pic et a commencé à diminuer, l’expérience est terminée.
10. Analyse des résultats
- Dans des conditions de circuit ouvert, calculer la conductance transmuqueuse à partir du changement de tension en réponse aux impulsions de courant selon la loi d’Ohm. Déterminer le courant de court-circuit équivalent (Isc) de la tension transmuqueuse et de la conductance en appliquant la loi d’Ohm.
- Utilisez le potentiel de dilution de NaCl pour calculer la sélectivité ionique relative (PNa/PCl) avec l’équation de Goldman-Hodgkin-Katz10.
- Estimer la sélectivité absolue de la jonction serrée pour chaque ion à l’aide de l’équation de Kimizuka-Koketsu11.
- Calculer PNa/PCl à l’aide de l’équation de Goldman-Hodgkin-Katz à partir des potentiels de dilution, et déterminer les perméabilités absolues PNa et PCl à partir de l’équation de Kimizuka-Koketsu telle que décrite par Yu et al.10 comme suit :
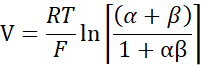

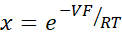

où, V: potentiel de dilution (mV); α : Ratio d’activité. L’activité calculée du NaCl dans le tampon HEPES divisée par l’activité calculée du NaCl dans le tampon HEPES de dilution (pour cette expérience, elle a été calculée comme 1,8966); e : Constante mathématique, 2,71828; GM : Conductance transmuqueuse (mS/cm2) ; F : constante de Faraday (96 485,3329 C/mol) ; R : Constante de gaz (8,314 J/mol K); T: Température (310.15 K)
Résultats
Les résultats présentés dans le présent document sont des résultats qui faisaient partie d’un projet plus vaste qui a été achevé (voir réf.4,23,24).
La conductance électrique transépithéliale de l’intestin grêle est diminuée chez les souris Cldn15-/-.
La conductance transmuqueuse de base (dans...
Discussion
Dans cette expérience, des chambres d’Ussing ont été utilisées pour mesurer les paramètres électriques de base et le potentiel de dilution du NaCl dans l’intestin grêle de souris Cldn15-/- et WT. Il est très important lors des expériences en chambre d’Ussing de vérifier que la préparation membranaire utilisée dans les expériences est viable. Cela se fait généralement en ajoutant du glucose ou de l’activateur de l’adénylate cyclase forskoline et en voyant s’il y a une augmen...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts potentiel à divulguer.
Remerciements
Ce travail est soutenu par 17K00860 (à HH) et 19K20152 (à NI). WH tient à remercier la Fondation des bourses d’études Otsuka Toshimi pour son soutien financier de 2018 à 2021.
matériels
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
Références
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907 (2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032 (2018).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, 1-19 (2017).
- Östh, K. . The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703 (2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376 (2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon