Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle de transplantation de membres postérieurs hétérotopiques partiels chez le rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article présente un protocole de transplantation de lambeau ostéocutané hétérotopique partiel chez le rat et ses résultats potentiels dans le suivi à moyen terme.
Résumé
Les allotransplantations composites vascularisées (VCA) représentent l’option de reconstruction la plus avancée pour les patients sans possibilités chirurgicales autologues après un défaut tissulaire complexe. Les transplantations faciales et faciales ont changé la vie des patients défigurés, leur donnant un nouvel organe social esthétique et fonctionnel. Malgré des résultats prometteurs, le VCA est toujours sous-performant en raison de comorbidités d’immunosuppression à vie et de complications infectieuses. Le rat est un modèle animal idéal pour les études in vivo portant sur les voies immunologiques et les mécanismes de rejet du greffon. Les rats sont également largement utilisés dans de nouvelles techniques de préservation de greffes de tissus composites, y compris les études de perfusion et de cryoconservation. Les modèles utilisés pour l’ACV chez le rat doivent être reproductibles, fiables et efficaces avec une morbidité et une mortalité postopératoires faibles. Les procédures de transplantation de membres hétérotopiques répondent à ces critères et sont plus faciles à effectuer que les greffes de membres orthotopiques. La maîtrise des modèles microchirurgicaux des rongeurs nécessite une solide expérience en microchirurgie et en soins aux animaux. Il est rapporté ici un modèle fiable et reproductible de transplantation partielle hétérotopique de lambeaux ostéocutanés chez le rat, les résultats postopératoires et les moyens de prévention des complications potentielles.
Introduction
Au cours des deux dernières décennies, le VCA a évolué en tant que traitement révolutionnaire pour les patients qui souffrent de défiguration sévère, y compris le visage1,les amputations des membres supérieurs2,le pénis3et d’autres défauts tissulaires complexes4,5. Cependant, les conséquences de l’immunosuppression à vie entravent encore une application plus large de ces chirurgies reconstructives complexes. La recherche fondamentale est cruciale pour améliorer les stratégies anti-rejet. L’augmentation du temps de conservation du VCA est également essentielle pour améliorer la logistique de la transplantation et augmenter le bassin de donneurs (car les donneurs de VCA doivent remplir plus de critères que les donneurs d’organes solides, y compris le teint de la peau, la taille anatomique, le sexe). Dans ce contexte, les transplantations de membres de rat sont largement utilisées dans les études sur le rejet immunitaire des allogreffes6,7,les nouveaux protocoles d’induction de tolérance8et les études de préservation9,10,11. Par conséquent, ces modèles VCA sont un élément clé à maîtriser pour la recherche translationnelle VCA.
Les lambeaux ostéo-cutanés ont été décrits dans la littérature comme des modèles fiables pour étudier le VCA chez les rats8,12,13,14. Bien que les transplantations orthotopiques de membres entiers permettent une évaluation à long terme de la fonction du greffon, il s’agit d’une procédure longue associée à des taux de morbidité et de mortalité postopératoires plus élevés14. En revanche, les modèles de transplantation hétérotopique de membres ne sont pas fonctionnels, mais permettent des études reproductibles sur l’ACV. Les résultats postopératoires peuvent être anticipés de manière fiable avant le début d’une étude de transplantation de VCA chez le rat. Cette étude rapporte un modèle de transplantation de lambeau ostéocutané hétérotopique partiel chez le rat qui comprend des résultats et des complications possibles fréquents pouvant survenir en peropératoire et postopératoire au cours d’une période de suivi de trois semaines.
Protocole
Tous les animaux ont reçu des soins sans frais conformément au Guide des NIH pour le soin et l’utilisation des animaux de laboratoire. Le Comité institutionnel de soins et d’utilisation des animaux (protocole IACUC 2017N000184) et le Bureau d’examen des soins et de l’utilisation des animaux (ACURO) ont approuvé tous les protocoles pour animaux. Des rats Lewis mâles consanguins (250-400 g) ont été utilisés pour toutes les expériences.
1. Chirurgie
- Anesthésier les rats Lewis par inhalation d’isoflurane. Induire une anesthésie avec 5% d’isoflurane dans la chambre d’induction et maintenir l’anesthésie avec une inhalation d’isoflurane de 1,5 à 3% à travers un cône respiratoire.
- Appliquer du lubrifiant pour les yeux avant la chirurgie dans les procédures de survie. Rasez le site chirurgical, traitez avec de la crème dépilatoire, frottez et drapez avec des rideaux stériles.
- Confirmez l’anesthésie totale avec un test de pincement des orteils avant l’incision et régulièrement pendant la procédure. Surveillez les fréquences cardiaque et respiratoire tout au long de la procédure. Pour toutes les chirurgies, maintenez des conditions stériles en utilisant des instruments, des fournitures, des rideaux et des gants stériles. Voir le tableau des matériaux pour la liste des instruments utilisés pour les procédures.
2. Obtention d’un membre postérieur partiel du droit du donateur
- Faites une incision circonférentielle de la peau au-dessus de la cheville au tiers distal de la jambe.
- Squelettiser et cautériser l’artère saphène et la branche terminale de l’artère poplitée à l’aide de pinces bipolaires. Cautériser et couper les muscles gastrocnémiens, soléaires, tibialis antérieurs et biceps fémoraux jusqu’à ce que l’os tibial soit exposé.
- Faites une incision de 2,5 cm au pli inguinal droit. Disséquez le coussinet de graisse inguinale et rétractez-le distalement pour exposer les vaisseaux fémoraux. Utilisez un rétracteur en hameçon pour saisir le ligament inguinal et une pince de serrage pour maintenir le coussinet de graisse inguinale de manière distue.
REMARQUE : Le coussinet de graisse inguinale est inclus dans la récolte du membre partiel. - Disséquer les vaisseaux fémoraux, individualiser les branches de Murphy (branches collatérales musculaires profondes généralement situées à mi-chemin entre le ligament inguinal et la branche épigastrique) et ligaturer avec 8-0 cravates en nylon.
- Hépariniser le rat donneur avec 100 UI/kg d’héparine, injectée dans la veine dorsale du pénis à l’aide d’une aiguille de 27,5 G.
- Complétez l’incision cutanée autour de la hanche.
- Cautériser les muscles biceps fémors et fessiers superficiels à l’aide de pinces bipolaires. Cautériser et couper le nerf sciatique à mi-longueur du fémur. Exposez le fémur par voie proximale au niveau de la crête fémorale postérieure.
REMARQUE: Les muscles des adducteurs et des quadriceps sont exclus de l’approvisionnement. Le pédicule innommé est préservé. - Ligaturez les vaisseaux fémoraux avec des attaches en nylon 8/0 au niveau du ligament inguinal. Effectuer une artériotomie sur l’artère fémorale juste en dessous de la ligature et dilater pour permettre l’insertion d’un angio-cathéter 24 G.
- Cautériser et couper le muscle restant sous le pédicule, exposant la face antérieure du fémur.
- Coupez le tibia et le fémur à l’aide d’un coupe-os aussi proximalement et distieusement que possible, respectivement (mi-longueur).
- Rincer le membre postérieur partiel avec 2 mL de solution saline d’héparine (100 UI/mL) pour obtenir un écoulement veineux clair. Conserver sur de la glace dans une gaze stérile jusqu’au transfert microvasculaire (Figure 1).
- Pendant que l’animal est sous anesthésie générale, effectuer l’euthanasie par exsanguination jusqu’à ce que l’animal ne montre aucun signe de vie (pas de mouvement respiratoire et pas de battement de cœur).

Figure 1: Membres postérieurs partiels de rat récoltés. Un angiocathe de 24 G est inséré dans l’artère fémorale, prêt pour le transfert microvasculaire hétérotopique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Chirurgie du receveur
- Avant l’incision, rasez l’arrière du cou et administrez de la buprénorphine 0,01 à 0,05 mg / kg par voie sous-cutanée. Placez le rat en position couchée sur un coussin chauffant.
- Faites une incision de 2,5 cm dans le pli inguinal droit. Disséquez le coussinet adipeux inguinal et inclinez-le distalement pour exposer les vaisseaux fémoraux. Utilisez un crochet pour rétracter le ligament inguinal et une pince de serrage pour maintenir le coussinet de graisse inguinale de manière distue.
- Disséquez les vaisseaux fémoraux, individualisez les branches de Murphy et ligatez avec des attaches en nylon 8/0.
- Ligaturez les deux vaisseaux au-dessus des vaisseaux épigastriques à l’aide d’attaches en nylon 8/0. Placez les pinces d’approximation proximalement et dilatez les extrémités des vaisseaux; rincer avec une solution saline à l’héparine.
- Faites une incision sur le flanc gauche au-dessus de la hanche et créez une poche sous-cutanée avec un tunnel sous-cutané jusqu’au pli inguinal.
REMARQUE: L’incision en médaillon est faite au-dessus de l’amplitude de mouvement de la hanche pour s’assurer que l’animal maintient un mouvement normal des membres postérieurs. De plus, le maintien d’un pont cutané entre l’encart du greffon et le site de transfert microvasculaire permet une meilleure fixation du greffon (Figure 2). - Placez la partie proximale du membre partiel et le coussinet adipeux inguinal à travers le tunnel sous-cutané pour le transfert microvasculaire. Effectuer des anastomoses veineuses et artérielles à l’aide de sutures en nylon 10/0. Retirez les deux pinces d’approximation et observez la revascularisation du membre. Effectuer un « test de traite » sur les deux vaisseaux pour évaluer la perméabilité de chaque anastomose.
REMARQUE: Huit à neuf sutures sont généralement nécessaires pour l’anastomose veineuse, 6 sutures en moyenne pour l’anastomose artérielle. - Faites une incision cutanée longitudinale sur le côté médial du membre transplanté et insérez le greffon. Enlevez l’excès de peau de la greffe et fermez la plaie avec des sutures séparées et une suture courante à l’aide de sutures résorbables 4/0.
- Suturer ensemble les coussinets graisseux inguinaux du membre transplanté et du receveur à l’aide de deux sutures résorbables séparées, et fermer le pli inguinal à la toute fin après un dernier examen des anastomoses microvasculaires.
REMARQUE: Les coussinets adipeux inguinaux sont suturés hermétiquement pour ajouter une couche protectrice de graisse au-dessus des anastomoses et assurer une position sécurisée du greffon et de son pédicule. Une fermeture méticuleuse est préférable pour la cicatrisation des plaies; il prévient également les saignements résiduels de la plaie et diminue le risque d’automutilation. - Compenser la perte de liquide par voie sous-cutanée avec 1-3 mL de solution saline en fonction de la quantité de saignement périopératoire.
- Placez un collier élisabéthain autour du cou de l’animal et appliquez 2 sutures lâches sur la peau pour la maintenir dans la bonne position.
- Arrêtez l’inhalation d’isoflurane et surveillez l’animal en permanence sur un coussin chauffant jusqu’à ce qu’il en soit pleinement conscient et ambulatoire.
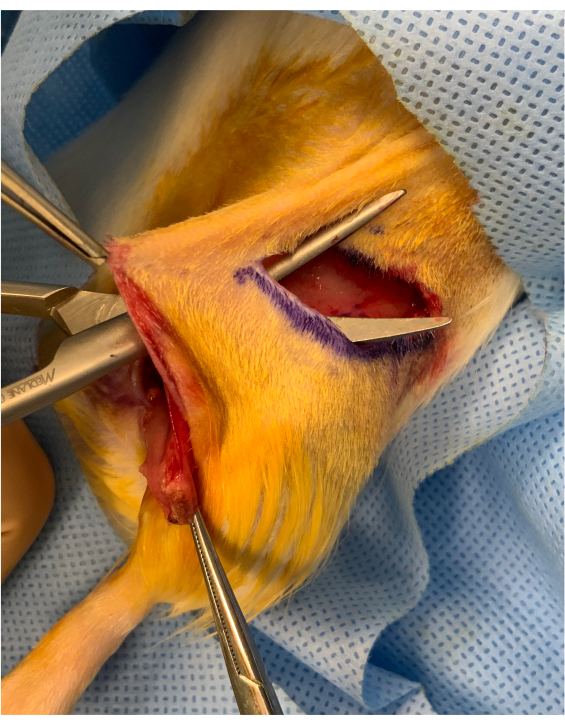
Figure 2: Image périopératoire avant l’encart du membre ostéo-cutané. Un pont cutané d’environ 1 cm est conservé entre l’incision du pli inguinal et l’encart de la greffe au-dessus de la hanche. Le greffon est placé sous le pont, le maintenant stable pour le transfert microvasculaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Soins postopératoires
- Surveillez l’animal deux fois par jour pendant 72 heures, puis une fois par jour jusqu’au jour postopératoire (POD) 7, puis deux fois par semaine.
REMARQUE: La surveillance doit être ajustée à l’état de l’animal et du greffon (les yeux pâles peuvent nécessiter des liquides supplémentaires, la coloration à la porphyrine comme indicateur de la douleur animale, la couleur / température anormale du greffon), et des soins supplémentaires doivent être discutés avec le vétérinaire. Un seul boîtier est nécessaire pour les rats receveurs pendant toute la période d’étude afin d’éviter tout dommage au greffon. - Effectuer une analgésie avec injection sous-cutanée de buprénorphine et / ou d’anti-inflammatoire non stéroïdien conformément aux directives de l’IACUC.
- Évaluez la greffe et effectuez un examen physique quotidiennement avec des images à l’aide du même appareil.
REMARQUE: L’utilisation d’une crème dépilatoire sur la peau du greffon est utile pour mieux évaluer la couleur de la peau de la greffe.
Résultats
Dans cette étude mono-opérateur, 30 greffes partielles hétérotopiques syngéniques de membres ont été réalisées. Le succès a été défini au jour 21 postopératoire comme l’absence d’échec du VCA ou de complications nécessitant une euthanasie. L’évolution normale du greffon est représentée à la figure 3. La durée moyenne de l’obtention partielle des membres et de l’encart du greffon chez le receveur était de 35 et 105 minutes, respectivement; le temps moyen d’is...
Discussion
Des modèles de transplantation de membres orthotopiques chez des rongeurs ont été décrits dans la littérature15,16,17; cependant, ils nécessitent une réparation nerveuse, une rattachement musculaire et une ostéosynthèse parfaite du fémur, ce qui peut être une étape très difficile. Ces modèles sont également associés à un taux de morbidité et de mortalité plus élevé chez les rongeurs14,
Déclarations de divulgation
Les auteurs n’ont aucune divulgation.
Remerciements
Ce travail a été soutenu par le Bureau du Secrétaire adjoint à la Défense pour les affaires de santé par le biais du Programme de recherche médicale dirigé par le Congrès sous le numéro de bourse. W81XWH-17-1-0680. Les opinions, interprétations, conclusions et recommandations sont celles des auteurs et ne sont pas nécessairement approuvées par le ministère de la Défense.
matériels
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
Références
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon