Method Article
Isolement et culture de kératinocytes oraux primaires du palais de souris adulte
Dans cet article
Résumé
Le présent protocole décrit l’isolement et la culture de kératinocytes oraux dérivés du palais de souris adulte. Une méthode d’évaluation utilisant l’immunocoloration est également rapportée.
Résumé
Pendant des années, la plupart des études impliquant des kératinocytes ont été menées en utilisant des kératinocytes épidermiques de peau humaine et de souris. Récemment, les kératinocytes oraux ont attiré l’attention en raison de leur fonction et de leurs caractéristiques uniques. Ils maintiennent l’homéostasie de l’épithélium buccal et servent de ressources pour des applications dans les thérapies régénératives. Cependant, les études in vitro qui utilisent des kératinocytes primaires oraux de souris adultes ont été limitées en raison de l’absence d’un protocole de culture efficace et bien établi. Ici, les kératinocytes primaires oraux ont été isolés des tissus palapatiaux de souris adultes et cultivés dans un milieu commercial à faible teneur en calcium complété par un sérum chélexé. Dans ces conditions, les kératinocytes ont été maintenus dans un état prolifératif ou semblable à celui des cellules souches, et leur différenciation a été inhibée même après une augmentation des passages. L’analyse de l’expression des marqueurs a montré que les kératinocytes oraux cultivés exprimaient les marqueurs basocellulaires p63, K14 et α6-intégrine et étaient négatifs pour le marqueur de différenciation K13 et le marqueur fibroblastique PDGFRα. Cette méthode a produit des cellules viables et cultivables adaptées à des applications en aval dans l’étude in vitro des fonctions des cellules souches épithéliales orales.
Introduction
L’épithélium buccal sert de première barrière pour protéger le corps contre les stress environnementaux, y compris les dommages chimiques ou physiques et les infections bactériennes et virales1,2. La muqueuse buccale comprend une couche externe d’épithélium squameux stratifié qui se compose de kératinocytes et de tissu conjonctif sous-jacent appelé lamina propria, qui se compose principalement de fibroblastes et de la matrice extracellulaire. La muqueuse buccale de la souris peut être largement divisée en trois sous-types : muqueuse masticatoire (palais dur et gencive), spécialisée (langue dorsale) et muqueuse (muqueuse buccale, langue ventrale, palais mou, lèvres)2,3 (figure 1A). L’épithélium buccal est kératinisé dans la muqueuse masticatoire et spécialisée et non kératinisé dans la muqueuse muqueuse. Malgré sa localisation anatomique, l’épithélium buccal est similaire à l’épiderme cutané en ce sens qu’il est constitué de cellules épithéliales étroitement emballées avec différents degrés de différenciation: couches basales contenant des cellules indifférenciées; les couches épineuses, granulaires et cornifiées qui forment l’épithélium kératinisé, ou les couches intermédiaires et superficielles qui forment l’épithélium non kératinisé4. Des modèles murins transgéniques ont facilité l’étude des caractéristiques cellulaires et moléculaires des cellules souches épithéliales orales dans le palais, la muqueuse buccale, la langue et la gencive5,6,7,8,9,10,11. Cependant, la plupart de ces études ont principalement utilisé des expériences in vivo sur des souris. Les systèmes de culture cellulaire n’étaient généralement pas utilisés en raison d’un manque de protocoles établis et efficaces.
Un système de culture in vitro peut être utilisé pour l’analyse moléculaire et biochimique des régulateurs de cellules souches, les tests cellulaires et le dépistage de médicaments. Actuellement, des protocoles pour la culture de kératinocytes primaires de l’épiderme cutané ont été développés, dans lesquels les kératinocytes basaux peuvent être isolés et cultivés avec succès à des fins cliniques et de recherche12,13,14,15. En 1980, Hennings et al. ont montré qu’une faible concentration de calcium (< 0,09 mM ca2+) dans le milieu de culture facilitait la prolifération et maintenait les cellules dans un état indifférencié. Un niveau plus élevé de calcium favorisait la différenciation cellulaire et réduisait la prolifération16. Par la suite, des méthodologies de culture pour les kératinocytes épidermiques murins néonatals et adultes ont été établies et largement appliquées à de nombreux modèles murins de différents antécédents génétiques pour des études in vitro17,18,19. Bien que la peau et l’épithélium buccal partagent des caractéristiques communes, ils présentent également des différences intrinsèques, par exemple dans leur statut de kératinisation, leur taux de renouvellement, l’expression des gènes et leur capacité de cicatrisation des plaies3,11,20,21,22,23,24,25,26.
Bien que la culture de kératinocytes par voie orale humaine ait été réalisée avec succès27,28,29, les publications sur la culture de kératinocytes par voie orale de souris30,31,32 sont limitées en raison de la petite taille du tissu cible et des caractéristiques distinctes des cellules par rapport aux kératinocytes épidermiques cutanés. Ce protocole décrit les techniques d’isolement et de culture à long terme des kératinocytes oraux primaires de souris.
Protocole
Toutes les expériences sur les animaux ont été effectuées conformément aux directives du Comité institutionnel d’expérimentation animale de l’Université de Kumamoto et de l’Université de Tsukuba.
1. Préparation des réactifs et des milieux de culture
- Préparer 40 mL de milieu de culture kératinocyte contenant 60 μM de calcium et 600 μL de solution antibiotique-antimycotique. Préparer 20 mL de trypsine à 0,025 % et 400 μL de solution antibiotique-antimycotique.
- Décongeler la solution d’inhibition de la trypsine à température ambiante et la maintenir à 4 °C jusqu’à utilisation à l’étape 4.1.
REMARQUE: Le réactif d’isolement est préparé pour l’isolement tissulaire de cinq souris.
- Décongeler la solution d’inhibition de la trypsine à température ambiante et la maintenir à 4 °C jusqu’à utilisation à l’étape 4.1.
- Pour préparer le milieu de culture, prendre 500 mL de milieu et ajouter 5 mL d’une solution de supplément de croissance (voir tableau des matériaux) (ci-après dénommé milieu complet) et 20 % de sérum bovin fœtal (FBS) appauvri en calcium(33 ) (ci-après dénommé chélexed-FBS).
2. Dissection du tissu du palais de la souris adulte
- Sacrifier une souris adulte C57BL/6J (mâle ou femelle) par luxation cervicale conformément à la réglementation de l’établissement relative au bien-être animal.
- Enlevez les poils autour de la bouche avec un rasoir. À l’aide de ciseaux, coupez de la joue vers la mâchoire, des deux côtés.
REMARQUE: La souris doit être anesthésiée avant le sacrifice. Un mélange anesthésique de méthétomidine, de midazolam et de butorphanol est utilisé (voir tableau des matériaux).
- Enlevez les poils autour de la bouche avec un rasoir. À l’aide de ciseaux, coupez de la joue vers la mâchoire, des deux côtés.
- Utilisez des pinces pour ouvrir grand la bouche et absorber tout sang à l’aide d’un coton-tige. Pour désinfecter le palais, essuyez l’intérieur de la bouche avec un coton-tige contenant 10% de povidone-iode.
- Pour récolter le palais de la souris, utilisez d’abord une lame de scalpel chirurgical pour faire une incision marginale de pleine épaisseur le long du côté palais des dents maxillaires. Ensuite, disséquez soigneusement tout le palais à l’aide d’un raspatorium.
REMARQUE : Un raspatorium est un outil utilisé pour élever un lambeau mucopériosté (voir tableau des matériaux) (figure 1B). - Transférer rapidement le tissu du palais dans un tube de 15 mL contenant 4 mL de milieu complet + solution antibiotique-antimycotique. Gardez les tissus sur la glace jusqu’à ce qu’ils soient prêts pour l’incubation.
REMARQUE: Pour la collecte de plusieurs souris, les tissus du palais peuvent être conservés sur de la glace jusqu’à 4 h.
3. Prétraitement du tissu palapien
- Dans une hotte à écoulement laminaire, transférer les tissus dans une boîte de 60 mm contenant 4 mL de milieu complet + solution antibiotique-antimycotique.
- À l’aide d’une pince courte et émoussée et d’une lame de scalpel, retirez doucement tout sang des tissus. Lavez les mouchoirs 10 fois en milieu complet.
- Transférer les tissus dans une boîte de 35 mm contenant 4 mL de trypsine à 0,025% + solution antibiotique-antimycotique, avec la surface épithéliale tournée vers le bas.
REMARQUE: La surface épithéliale, qui se courbe vers l’intérieur, doit être trempée dans la solution de trypsine; la lamina propria doit être tournée vers le haut. Le tissu doit être aplati autant que possible pour être incubé entièrement dans la solution de trypsine. - Incuber les tissus dans 0,025% de trypsine pendant environ 16 h à température ambiante dans la hotte de culture.
4. Collecte et culture de cellules primaires
- À l’aide d’une paire de pinces contondantes, prélever le tissu de la solution de trypsine (dans la boîte de 35 mm) et transférer dans la solution d’inhibiteur de la trypsine dans une boîte de 60 mm (4 ml par boîte) avec la surface épithéliale tournée vers le haut.
- À l’aide d’une pince pour s’accrocher au bord du palais, grattez doucement la couche épithéliale de la lamina propria sous-jacente à l’aide d’une lame de scalpel.
REMARQUE: Le tissu conjonctif n’est pas digéré par la trypsine, il ne se décolle donc pas pendant le grattage. - Pour recueillir la quantité maximale de cellules épithéliales des tissus, transférez le tissu dans un autre plat de 60 mm avec un milieu complet de 4 mL et répétez l’étape de raclage.
REMARQUE: Assurez-vous d’éviter de gratter le tissu avec la pointe de la lame; utilisez plutôt le bord de la lame. Le grattage est effectué pendant 5 à 10 minutes par tissu. - Placez une passoire cellulaire stérile de 100 μm sur le dessus d’un tube conique de 50 mL.
- À l’aide d’une pipette stérile, transférer 2 mL de solution de trypsine (à partir de l’étape 4.1) dans la crépine pour mouiller sa surface.
- À l’aide d’une pipette, mélanger la suspension cellulaire dans le plat de 60 mm (des étapes 4.2-4.3) plusieurs fois et filtrer les cellules à travers la passoire cellulaire de 100 μm préparée aux étapes 4.4-4.5.
- Comptez le nombre de cellules à l’aide d’un hémocytomètre. Préparer 15 μL de solution de bleu de trypan et ajouter 15 μL de suspension cellulaire (étape 4.6). Transférer 10 μL du mélange de bleu cellule-trypan à un hémocytomètre et compter le nombre de cellules.
REMARQUE: Un morceau de palais de souris peut produire jusqu’à 1 million de cellules. - Pendant le comptage, centrifugez le tube (à partir de l’étape 4.6) à 100 x g pendant 5 min à température ambiante.
- Aspirer le surnageant avec une pipette. Ajouter 2 mL de milieu complet + chelexed-FBS au tube. Remettre en suspension la pastille de la cellule en triturant plusieurs fois à l’aide d’une pipette de 5 mL.
- Plaque 2-5 x 105 cellules d’une souris dans un puits d’une plaque de 24 puits pré-enduite de collagène de type I (voir Tableau des matériaux).
- Incuber les cellules à 37 °C pendant 2 jours sans changer le milieu.
- Deux jours après l’ensemencement, remplacer la moitié du milieu de culture par le milieu complet + chelexed-FBS. Vérifiez la morphologie cellulaire au microscope. Cellules d’alimentation avec milieu complet + chelexed-FBS tous les 2 jours.
REMARQUE: Après l’ensemencement, des cellules de différentes tailles seront observées. Environ 3 à 5 jours après l’ensemencement, des kératinocytes à la morphologie pavée (Figure 2) peuvent être observés. Il faudra 1 à 2 semaines de culture avant que le premier passage puisse être effectué et 1 à 2 semaines supplémentaires sont nécessaires avant que les cellules ne soient prêtes pour les deuxième et troisième passages. Après cela, les cellules se développeront plus rapidement et pourront être préparées pour la cryoconservation. Les cellules peuvent être replaquées à un puits (d’une plaque de 24 puits) et à une plaque de 6 puits dans le premier et le deuxième passage, respectivement. Le passage suivant dépendra de la croissance et de la densité cellulaires. Un rapport de division cellulaire de 1:2 ou 1:3 peut être utilisé après le troisième passage.
5. Passage des kératinocytes
- Prélever 2 mL du surnageant dans la boîte de culture et distribuer dans un tube conique de 15 mL (sur glace). Lavez les cellules avec 1x PBS stérile deux fois.
REMARQUE: Lorsque les cellules atteignent environ 70% à 80% de confluence, elles sont prêtes à être passées. - Ajouter 1 mL de 0,05 % de trypsine-EDTA au plat dans le puits d’une assiette à 6 puits.
- Incuber pendant 5-15 min à 37 °C; vérifier après 5 min si les cellules se détachent du plat.
- Neutraliser la réaction en utilisant 1 mL de solution d’inhibition de la trypsine et 2 mL de milieu de culture complet + FBS chélexé par pipetage doux. Ensuite, transférez la suspension cellulaire dans le même tube conique de 15 mL qu’à l’étape 5.1.
- Centrifuger la suspension de la cellule à 100 x g pendant 5 min à 4 °C. Aspirer le surnageant à l’aide d’une pipette et remettre en suspension la pastille cellulaire dans 1 mL de milieu de culture complet.
- Comptez les cellules à l’aide d’un hémocytomètre. Ensuite, plaquez 1 mL de la suspension cellulaire dans une nouvelle plaque de culture de 24 ou 6 puits.
REMARQUE: Certaines des cellules des premiers passages peuvent être congelées dans un mélange de 70% de milieu de culture complet + 20% de FBS chélexé + 10% de DMSO. 1-2 cryoviales de cellules peuvent être collectées à partir d’une plaque de culture confluente.
6. Cryoconservation et récupération des kératinocytes
- Congélation cellulaire
- Cultiver les kératinocytes à 80% -90% de confluence.
REMARQUE: Ne laissez pas les cellules envahir, car cela pourrait réduire leur statut de prolifération et leur viabilité. - Traiter les kératinocytes dans le plat avec 0,05% de trypsine-EDTA, comme décrit aux étapes 5.1-5.5.
- Compter les kératinocytes à l’aide d’un hémocytomètre. Préparer des cryoviales en fonction du nombre de cellules calculé pour permettre le transfert de 1 x 106 cellules/mL dans chaque flacon.
- Centrifuger la suspension de la cellule à 100 x g pendant 5 min à 4 °C. Jeter le surnageant et remettre en suspension la pastille cellulaire dans une solution de 10 mL de DMSO à 10 % + FBS chélexed à 20 % + milieu de culture complet à 70 % (9 mL de milieu complet + FBS chélexed et 1 mL de DMSO).
- Distribuer les cellules en cryoviales à 1 mL de suspension par flacon. Placer les flacons dans un récipient de stockage cryogénique pendant la nuit à -80 °C. Transférer les flacons dans un réservoir d’azote liquide le lendemain.
- Cultiver les kératinocytes à 80% -90% de confluence.
- Récupération cellulaire
- Retirer un cryoviral du réservoir d’azote liquide et décongeler partiellement à température ambiante. Dans un tube de 15 mL, mélanger 1 mL de suspension cellulaire avec 3 mL de milieu de culture complet + FBS chelexed.
- Centrifuger le mélange pendant 5 min à 100 x g et 4 °C. Jeter le surnageant et remettre en suspension la pastille dans 1 mL de milieu de culture complet + FBS chélexed.
- Plaquez les suspensions cellulaires dans de nouveaux plats de culture enduits de collagène I de 60 mm. Remplacez le milieu de culture tous les 2-3 jours et passez les cellules une fois confluentes.
7. Coloration immunofluorescente
- Culture de kératinocytes oraux sur des couvertures carrées (22 mm x 22 mm) dans des plaques à 6 puits (5 x 105 cellules/puits) pendant 2 jours.
- Fixer les kératinocytes dans une solution de paraformaldéhyde (PFA) à 4% et de PBS pendant 20 min à température ambiante avant de les laver trois fois avec 1x PBS.
- Perméabiliser les cellules dans une solution de Triton à 0,1% dans le PBS. Incuber des cellules dans un réactif bloquant (2,5 % de sérum de chèvre, 2,5 % de sérum d’âne) pendant 1 h à température ambiante, suivie d’une incubation de nuit avec des anticorps primaires (voir tableau des matériaux) à 4 °C.
NOTE: Des anticorps primaires ont été utilisés aux dilutions suivantes: anti-K14 de lapin (1:1000), α6-intégrine de rat (1:100), anti-p63 de lapin (1:500), anti-K13 de lapin (1:100) et anti-PDGFRα de chèvre (1:100). - Laver les échantillons dans une solution de Triton à 0,1% dans du PBS, suivi d’une incubation avec des anticorps secondaires pendant 1 h à température ambiante.
REMARQUE: Les anticorps secondaires (Alexa 488 ou 555) ont été utilisés à une dilution de 1:300. - Contre-conservez tous les échantillons avec la solution Hoechst pendant 10 minutes et montez les cellules sur des lames de verre.
REMARQUE: La solution de Hoechst est utilisée pour colorer les noyaux des cellules. - Effectuer l’imagerie d’échantillons à l’aide d’un microscope confocal.
REMARQUE: La luminosité et le contraste sont ajustés à intensité égale à l’aide d’un logiciel de retouche d’image.
Résultats
Vue d’ensemble du processus de dissection et de l’isolement des kératinocytes oraux du palais de la souris adulte
Des kératinocytes oraux dissociés ont été prélevés dans le palais de la souris adulte et cultivés dans un FBS chélexé personnalisé à 20%. Le palais de la souris se compose du palais dur et du palais mou (Figure 1C). La procédure d’isolement des kératinocytes oraux de souris est résumée à la figure 1D. Le tissu du palais est disséqué et transféré dans un milieu contenant une solution antibiotique-antimycotique avant d’être incubé dans une solution de trypsine à 0,025 % à 4 °C pendant la nuit. Le lendemain, le tissu du palais est traité avec une solution d’inhibiteur de la trypsine et un milieu de culture complet en volumes égaux. Par la suite, les tissus sont grattés à l’aide d’une lame de scalpel chirurgical pour recueillir les kératinocytes oraux. La suspension cellulaire est filtrée à travers une crépine cellulaire de 100 μm et centrifugée. Les cellules sont ensuite ensemencées dans des plaques de 24 puits recouvertes de collagène I contenant 2 mL de milieu de culture complet + FBS chélexé.
Résultats représentatifs de l’isolement réussi des kératinocytes oraux de souris
Les kératinocytes oraux primaires se sont développés sous forme de monocouche et présentaient une morphologie pavée (Figure 2). De petites colonies de kératinocytes étaient visibles entre 3 et 5 jours (figure 2A, B); ceux-ci ont grossi et formé des colonies serrées à 1 semaine d’incubation (figure 2C). Les colonies de kératinocytes présentaient les caractéristiques morphologiques typiques des kératinocytes basaux, indiquant leur état de santé. Les kératinocytes oraux humains sont restés indifférenciés pendant plusieurs passages dans le milieu de culture complet contenant 0,06 mM ca2+16,28. Le premier passage a été effectué environ 2 semaines après le placage initial (Figure 2D). Aux passages ultérieurs, les kératinocytes ont montré une croissance stable avec une période de culture plus courte (Figure 2E-G). Les kératinocytes ont cessé de croître si une contamination importante des fibroblastes s’est produite pendant le processus d’isolement (Figure 2H).
Les kératinocytes oraux isolés de souris expriment des marqueurs basocellulaires
Pour confirmer l’état des kératinocytes oraux primaires, une immunocoloration a été réalisée à l’aide des marqueurs basocellulaires Keratin 14 (K14) et α6-intégrine34. K14 et α6-intégrine ont été exprimés dans les kératinocytes après la culture (Figure 3A,B). Les cellules ont également été colorées avec le marqueur de cellules souches p63 pour confirmer leur souche. Les cellules du passage précoce (passage 4) et du passage tardif (passage 7) ont montré une expression uniforme de p63 (Figure 3C,D). En revanche, les kératinocytes traités avec une teneur élevée en calcium (induction de 1,2 mM pendant 2 jours) ont présenté une diminution de l’expression de p63 (figure 3E), ce qui indique qu’un traitement à forte teneur en calcium supprime les gènes liés aux cellules souches dans les kératinocytes primaires, comme indiqué précédemment16. Le marqueur de différenciation Kératine 13 (K13) a montré une expression rare ou nulle dans les passages précoces et tardifs et une expression significative sous traitement à haute teneur en calcium (Figure 3F-H). Pour tester la possibilité de contamination par les fibroblastes dans la culture de kératinocytes, la coloration à l’aide du marqueur de fibroblastes PDGFRα a été effectuée avec le même ensemble de kératinocytes par rapport aux fibroblastes embryonnaires (MEF) de souris. Il n’y avait aucune expression de PDGFRα dans la culture de kératinocytes, par rapport à l’expression élevée observée dans les cellules MEF (Figure 3I-3L). Ces résultats ont indiqué que ce protocole pourrait isoler avec succès les kératinocytes basaux et maintenir ces cellules à l’état indifférencié.
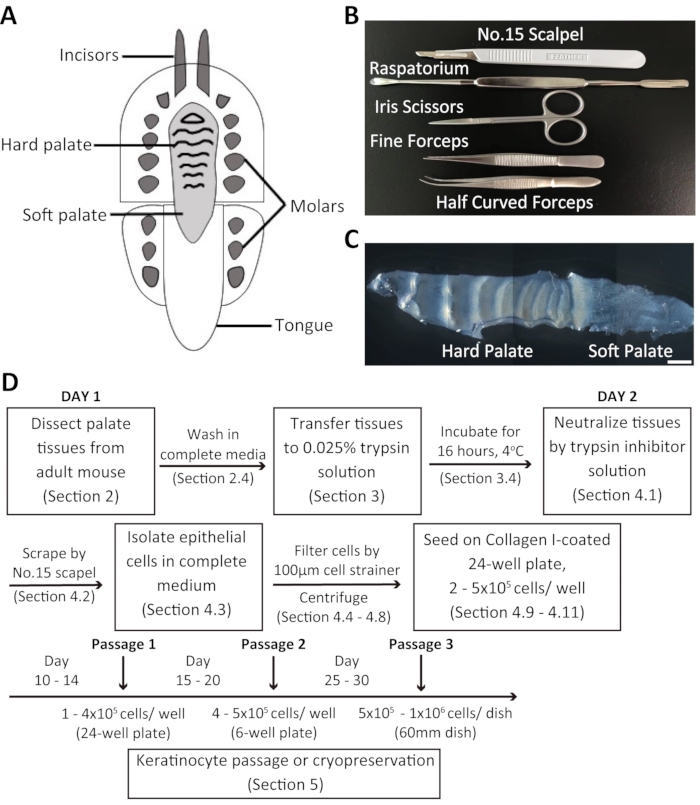
Figure 1 : Vue d’ensemble de la procédure de dissection et de l’isolement des kératinocytes oraux de souris. (A) Représentation schématique de la cavité buccale de la souris. (B) Instruments utilisés pour disséquer le palais et isoler les kératinocytes oraux de souris. (C) Image en champ clair du palais de la souris. Barre d’échelle : 100 μm. (D) Résumé du protocole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
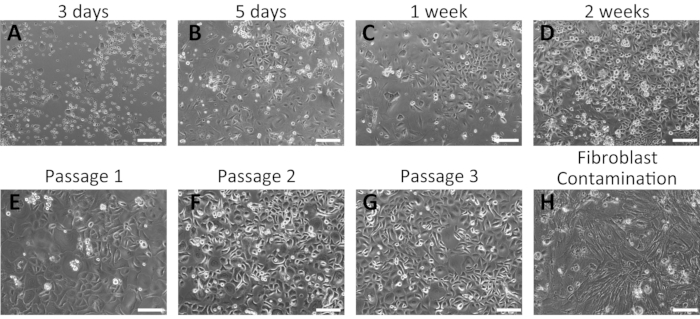
Figure 2 : Résultats représentatifs de l’isolement réussi des kératinocytes oraux de souris. (A-G) Images chronologiques de kératinocytes oraux primaires en culture à 3 jours (A), 5 jours (B), 1 semaine (C) et 2 semaines (D) de culture après l’isolement. Les morphologies des kératinocytes oraux de souris après les premier (E), deuxième (F) et troisième (G) passages sont montrées. (H) Exemple de contamination par les fibroblastes dans une culture orale de kératinocytes de souris. Barre d’échelle : 400 μm. Veuillez cliquer ici pour agrandir cette figure.
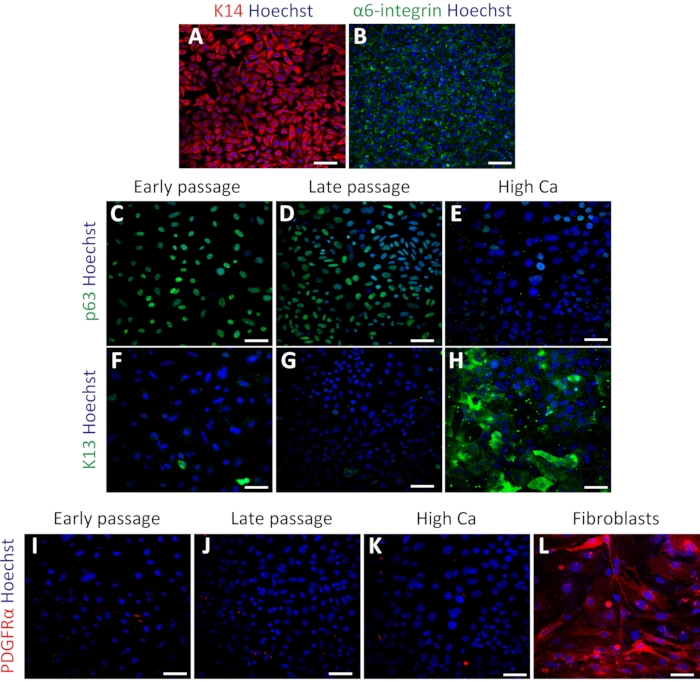
Figure 3 : Les kératinocytes oraux isolés de souris expriment des marqueurs basocellulaires. (A-B) Images représentatives de la coloration immunofluorescente de K14 (A; rouge) et d’α6-intégrine (B; vert) au passage 4. (C-E) Images représentatives de la coloration immunofluorescente de p63 (vert) dans le passage 4 (C), le passage 7 (D) et le traitement à haute teneur en calcium (E). (F-H) Images immunocolorantes de K13 (vert) dans le passage 4 (F), le passage 7 (G) et le traitement à haute teneur en calcium (H). (I-L) Images immunocolorantes de PDGFRα (rouge) dans le passage 4 (I), le passage 7 (J), le traitement à haute teneur en calcium (K) et les MEF (L). Les noyaux sont colorés avec Hoechst (bleu). Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les kératinocytes primaires isolés de l’épiderme de la peau humaine ou de souris sont utilisés depuis de nombreuses années dans la recherche et les applications cliniques12,13,15,18,27,28,29. En revanche, peu de protocoles ont été établis pour isoler et cultiver des kératinocytes oraux primaires de souris adultes30,31,32. La présente étude a utilisé un milieu de culture complet commercial et un FBS chélexé pour maintenir les kératinocytes dans un état prolifératif ou semblable à celui des cellules souches. Ce système de culture peut être utilisé dans des essais moléculaires et biochimiques pour mieux comprendre les caractéristiques des cellules souches épithéliales orales et leurs maladies connexes.
Plusieurs étapes critiques sont incluses dans ce protocole. Tout d’abord, la concentration de trypsine et le temps d’incubation sont essentiels pour produire des cellules viables pour les cultures ultérieures. Nous avons systématiquement utilisé des solutions de trypsine à 0,025 % et des périodes d’incubation de 16 h dans la hotte de la chambre à température ambiante. S’ils ne sont pas incubés pendant une durée suffisante, les kératinocytes ne se dissocieraient pas correctement du tissu, ce qui entraînerait un rendement cellulaire final inférieur. Deuxièmement, le pipetage doux de la suspension cellulaire le deuxième jour affecte notamment la viabilité cellulaire. Le grattage doit commencer doucement par le côté épithélial et ne pas dépasser 10 minutes par échantillon de tissu. Enfin, la première suspension cellulaire isolée contient des fibroblastes et d’autres types de cellules; ces cellules indésirables commenceront généralement à disparaître dans les cultures ultérieures.
Des limites potentielles ont été identifiées lors de l’isolement cellulaire et de la culture. Dans de rares cas, les fibroblastes peuvent être contaminés pendant le processus d’isolement, et les fibroblastes peuvent inhiber la croissance des kératinocytes dans les passages suivants (Figure 2H). Il est nécessaire de sélectionner un milieu commercial contenant un inhibiteur de croissance des fibroblastes pour éliminer une telle contamination dans la culture. Parce que le palais de la souris et d’autres muqueuses buccales ont des tailles relativement petites, le rendement cellulaire initial d’une souris peut être faible. Par conséquent, toute la période de culture de ce protocole - jusqu’à l’étape de cryoconservation - est plus longue que celle des kératinocytes cutanés primaires. Les kératinocytes oraux isolés sont mieux utilisés en 10 passages, car des périodes de culture plus longues pourraient modifier les propriétés cellulaires et réduire le nombre de cellules souches.
La méthode actuelle a montré que les kératinocytes oraux de souris présentaient une morphologie pavée serrée et formaient des colonies monocouches dans des conditions prolifératives. Ils ont également montré une expression élevée des marqueurs basaux α6-intégrine, K14 et marqueur de cellules souches p63. Dans les études futures, en plus de la coloration par immunofluorescence, le séquençage de l’ARN, la RT-PCR et les analyses par transfert de Western seront utilisées pour vérifier l’hétérogénéité cellulaire et la pureté des kératinocytes oraux, ce qui améliorera encore notre compréhension de la nature de ces cellules.
Après 2-3 passages, les kératinocytes oraux étaient suffisamment stables pour être utilisés dans d’autres expériences fonctionnelles. Il est important de noter que ce protocole de culture peut être combiné avec des lignées de souris transgéniques, y compris des systèmes gènes knockout, Cre-loxP et tet-inductibles, et peut également être utilisé dans des tests cellulaires et moléculaires. Ainsi, le présent protocole fournit aux chercheurs une méthode fondamentale et efficace qui pourrait être utilisée pour mieux comprendre la biologie des cellules souches kératinocytes par voie orale.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Ce travail a été soutenu par la subvention à la recherche scientifique (B) (20H03266) (à A.S.), la subvention pour les scientifiques en début de carrière (18K14709) (à A.S.), AMED sous les numéros de subvention JP21gm6110016 et 21bm0704067 (à A.S.), et des subventions de recherche de la Takeda Science Foundation (à A.S.). Nous remercions le Centre des ressources animales et du développement de l’Université de Kumamoto et le Centre de ressources animales de l’Université de Tsukuba pour leurs excellents soins aux souris. Nous remercions l’installation centrale de l’IRCMS de l’Université de Kumamoto pour son soutien en imagerie confocale.
matériels
| Name | Company | Catalog Number | Comments |
| 0.025% Trypsin/EDTA | Gibco | R001100 | |
| 0.05% Trypsin/EDTA, phenol red | Gibco | 25300062 | |
| 0.4w/v% Trypan Blue solution | Wako | 207-17081 | |
| 10 mL Serological pipet | Falcon | 357551 | |
| 100 µm Nylon cell strainer | Falcon | 352360 | |
| 15 mL sterile conical tube | Falcon | 352096 | |
| 2 mL Aspirating pipet | Falcon | 357558 | |
| 35 mm Cell culture dish | Corning | 353801 | |
| 50 mL sterile conical tube | Falcon | 352070 | |
| 60 mm Cell culture dish | Corning | 353802 | |
| 6-well Tissue Culture plate | Falcon | 353046 | |
| 96 Well Culture plate (U bottom) | Falcon | 353077 | |
| Antibiotic-Antimycotic 100x | Gibco | 15240062 | |
| Biocoat Collagen I cellware 60mm dish | Corning | 356401 | |
| Blunt Forceps | AS ONE | 1-8187-03 | |
| Butorphanol | Meiji Seika Pharma | Vetorphale | |
| CoolCell LX | Corning | 432002 | Cryogenic storage |
| Cotton | AS ONE | 63-1452-97 | |
| Cover slips 22 x 22 μm square | Matsunami Glass Ind. | C022221 | |
| Cryogenic Vial 1.2 mL | Thermo Scientific | 5000-0012 | |
| Defined Trypsin Inhibitor (DTI) | Gibco | R007100 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 276855-100ML | |
| Donkey anti-Rabbit IgG (H+L), Alexa Fluor 555 | Invitrogen | A31572 | |
| Donkey anti-Rat IgG (H+L), Alexa Fluor 488 | Invitrogen | A21208 | |
| Donkey serum | Sigma-Aldrich | D9663-10ML | |
| EpiLife Defined Growth Supplement (EDGS) | Gibco | S0120 | |
| EpiLife, with 60 µM calcium | Gibco | MEPI500CA | |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Fine forceps | BRC Bio Research Center | PRI13-3374 | |
| Goat anti-PDGF Receptor α | R&D Systems | AF1062 | |
| Goat serum | Sigma-Aldrich | G9023-10ML | |
| Half-curved forceps | BRC Bio Research Center | PRI13-3376 | |
| Hemocytometer | Hirschmann Laborgeräte | 8100204 | |
| Hoechst | Sigma-Aldrich | B2261 | |
| Iris Scissors | Muromachi Kikai | 14090-09 | |
| Medetomidine | Nippon Zenyaku Kogyo | Domitor | |
| Midazolam | Astellas Pharma | Dormicum | |
| No.15 Disposable scalpel | Feather | 219AABZX00136000 | |
| Paraformaldehyde | Wako | 162-16065 | |
| Phosphate Buffered Saline 1x, pH 7.4 | Gibco | 10010049 | |
| Povidone-iodine | Y's Square | 872612 | |
| Rabbit anti-Cytokeratin 13 antibody | Abcam | ab92551 | |
| Rabbit anti-K14 | BioLegend | 905301 | |
| Rabbit anti-p63 antibody | Abcam | ab124762 | |
| Raspatorium #14 | AS ONE | 8-4599-01 | |
| Rat α6-integrin | BD Biosciences | 553745 | |
| Triton X-100 | Wako | 581-81705 | |
| Type I Collagen coated 24-well plate | Corning | 354408 | |
| Type I Collagen coated 60mm dish | Corning | 356401 | |
| Type I Collagen coated 6-well plate | Corning | 355400 |
Références
- Presland, R. B., Jurevic, R. J. Making sense of the epithelial barrier: what molecular biology and genetics tell us about the functions of oral mucosal and epidermal tissues. Journal of Dental Education. 66 (4), 564-574 (2002).
- Squier, C. A., Kremer, M. J. Biology of oral mucosa and esophagus. Journal of the National Cancer Institute Monographs. (29), 7-15 (2001).
- Jones, K. B., Klein, O. D. Oral epithelial stem cells in tissue maintenance and disease: the first steps in a long journey. International Journal of Oral Science. 5 (3), 121-129 (2013).
- Winning, T. A., Townsend, G. C. Oral mucosal embryology and histology. Clinics in Dermatology. 18 (5), 499-511 (2000).
- Asaka, T., Akiyama, M., Kitagawa, Y., Shimizu, H. Higher density of label-retaining cells in gingival epithelium. Journal of Dermatological Science. 55 (2), 132-134 (2009).
- Bickenbach, J. R. Identification and behavior of label-retaining cells in oral mucosa and skin. Journal of Dental Research. 60, 1611-1620 (1981).
- Bickenbach, J. R., Mackenzie, I. C. Identification and localization of label-retaining cells in hamster epithelia. Journal of Investigative Dermatology. 82 (6), 618-622 (1984).
- Byrd, K. M., et al. Heterogeneity within stratified epithelial stem cell populations maintains the oral mucosa in response to physiological stress. Cell Stem Cell. 25 (6), 814-829 (2019).
- Jones, K. B., et al. Quantitative clonal analysis and single-cell transcriptomics reveal division kinetics, hierarchy, and fate of oral epithelial progenitor cells. Cell Stem Cell. 24 (1), 183-192 (2019).
- Willberg, J., Syrjanen, S., Hormia, M. Junctional epithelium in rats is characterized by slow cell proliferation. Journal of Periodontology. 77 (5), 840-846 (2006).
- Tanaka, T., et al. Identification of stem cells that maintain and regenerate lingual keratinized epithelial cells. Nature Cell Biology. 15 (5), 511-518 (2013).
- Compton, C. C., et al. Skin regenerated from cultured epithelial autografts on full-thickness burn wounds from 6 days to 5 years after grafting. A light, electron microscopic and immunohistochemical study. Laboratory Investigation. 60 (5), 600-612 (1989).
- Gallico, G. G., O'Connor, N. E., Compton, C. C., Kehinde, O., Green, H. Permanent coverage of large burn wounds with autologous cultured human epithelium. New England Journal of Medicine. 311 (7), 448-451 (1984).
- Guo, Z., et al. Building a microphysiological skin model from induced pluripotent stem cells. Stem Cell Research & Therapy. 4, 2 (2013).
- O'connor, N. E., Mulliken, J. B., Banksschlegel, S., Kehinde, O., Green, H. Grafting of burns with cultured epithelium prepared from autologous epidermal-cells. Lancet. 1 (8211), 75-78 (1981).
- Hennings, H., et al. Calcium regulation of growth and differentiation of mouse epidermal cells in culture. Cell. 19 (1), 245-254 (1980).
- Caldelari, R., Suter, M. M., Baumann, D., De Bruin, A., Muller, E. Long-term culture of murine epidermal keratinocytes. Journal of Investigative Dermatology. 114 (5), 1064-1065 (2000).
- Lichti, U., Anders, J., Yuspa, S. H. Isolation and short-term culture of primary keratinocytes, hair follicle populations and dermal cells from newborn mice and keratinocytes from adult mice for in vitro analysis and for grafting to immunodeficient mice. Nature Protocols. 3 (5), 799-810 (2008).
- Yano, S., Okochi, H. Long-term culture of adult murine epidermal keratinocytes. British Journal of Dermatology. 153 (6), 1101-1104 (2005).
- Iglesias-Bartolome, R., et al. Transcriptional signature primes human oral mucosa for rapid wound healing. Science Translational Medicine. 10 (451), (2018).
- Papagerakis, S., et al. Oral epithelial stem cells - implications in normal development and cancer metastasis. Experimental Cell Research. 325 (2), 111-129 (2014).
- Szpaderska, A. M., Zuckerman, J. D., DiPietro, L. A. Differential injury responses in oral mucosal and cutaneous wounds. Journal of Dental Research. 82 (8), 621-626 (2003).
- Chen, L., et al. Positional differences in the wound transcriptome of skin and oral mucosa. BMC Genomics. 11, 471 (2010).
- Chen, L., Gajendrareddy, P. K., DiPietro, L. A. Differential expression of HIF-1alpha in skin and mucosal wounds. Journal of Dental Research. 91 (9), 871-876 (2012).
- Simoes, A., et al. Differential microRNA profile underlies the divergent healing responses in skin and oral mucosal wounds. Scientific Reports. 9 (1), 7160 (2019).
- Turabelidze, A., et al. Intrinsic differences between oral and skin keratinocytes. PLoS One. 9 (9), 101480 (2014).
- Aasen, T., Izpisua Belmonte, J. C. Isolation and cultivation of human keratinocytes from skin or plucked hair for the generation of induced pluripotent stem cells. Nature Protocols. 5 (2), 371-382 (2010).
- Izumi, K., Tobita, T., Feinberg, S. E. Isolation of human oral keratinocyte progenitor/stem cells. Journal of Dental Research. 86 (4), 341-346 (2007).
- Liu, Z., et al. A simplified and efficient method to isolate primary human keratinocytes from adult skin tissue. Journal of Visualized Experiments: JoVE. (138), (2018).
- Hatakeyama, S., et al. Establishment of gingival epithelial cell lines from transgenic mice harboring temperature sensitive simian virus 40 large T-antigen gene. Journal of Oral Pathology & Medicine. 30 (5), 296-304 (2001).
- Ookura, T., et al. Fibroblast and epidermal growth factors modulate proliferation and neural cell adhesion molecule expression in epithelial cells derived from the adult mouse tongue. In Vitro Cellular & Developmental Biology - Animal. 38 (6), 365-372 (2002).
- Parikh, N., Nagarajan, P., Sei-ichi, M., Sinha, S., Garrett-Sinha, L. A. Isolation and characterization of an immortalized oral keratinocyte cell line of mouse origin. Archives of Oral Biology. 53 (11), 1091-1100 (2008).
- Brennan, J. K., Mansky, J., Roberts, G., Lichtman, M. A. Improved methods for reducing calcium and magnesium concentrations in tissue culture medium: application to studies of lymphoblast proliferation in vitro. In Vitro. 11 (6), 354-360 (1975).
- Cerqueira, M. T., Frias, A. M., Reis, R. L., Marques, A. P. Interfollicular epidermal stem cells: boosting and rescuing from adult skin. Methods in Molecular Biology. 989, 1-9 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon