Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement et sélection de champignons entomopathogènes à partir d’échantillons de sol et évaluation de la virulence fongique contre les insectes nuisibles
Dans cet article
Résumé
Nous présentons ici un protocole basé sur le système d’appât du ver de farine (Tenebrio molitor) qui a été utilisé pour isoler et sélectionner les champignons entomopathogènes (EPF) à partir d’échantillons de sol. Une formule de nombre de conidies efficaces (ECN) est utilisée pour sélectionner un EPF à haute tolérance au stress en fonction des caractéristiques physiologiques de la lutte microbienne des ravageurs sur le terrain.
Résumé
Les champignons entomopathogènes (FPE) sont l’un des agents de lutte microbienne pour la lutte intégrée contre les ravageurs. Pour lutter contre les ravageurs locaux ou envahissants, il est important d’isoler et de sélectionner les FPE indigènes. Par conséquent, la méthode de l’appât du sol combinée au système d’appât d’insecte (ver de farine, mouoliteur Tenebrio) a été utilisée dans cette étude avec quelques modifications. Les EPF isolés ont ensuite été soumis au test de virulence contre le ravageur agricole Spodoptera litura. De plus, les souches EPF potentielles ont été soumises à des identifications morphologiques et moléculaires. En outre, la production de conidies et le test de thermotolérance ont été effectués pour les souches EPF prometteuses et comparés; ces données ont ensuite été substituées dans la formule du nombre de conidies effectives (ECN) pour le classement en laboratoire. Le système appât-ver de farine du sol et la formule ECN peuvent être améliorés en remplaçant les espèces d’insectes et en intégrant plus de facteurs de stress pour l’évaluation de la commercialisation et l’application sur le terrain. Ce protocole fournit une approche rapide et efficace pour la sélection des FPE et améliorera la recherche sur les agents de lutte biologique.
Introduction
Actuellement, les champignons entomopathogènes (FPE) sont largement utilisés dans la lutte microbienne contre les ravageurs agricoles, forestiers et horticoles. Les avantages de l’EPF sont ses larges gammes d’hôtes, sa bonne adaptabilité environnementale, sa nature écologique et le fait qu’il peut être utilisé avec d’autres produits chimiques pour montrer l’effet synergique de la lutte intégrée contre les ravageurs1,2. Pour l’application en tant qu’agent antiparasitaire, il est nécessaire d’isoler un grand nombre d’EPF des insectes malades ou de l’environnement naturel.
L’échantillonnage de ces organismes à partir de leurs hôtes aide à comprendre la répartition géographique et le taux de prévalence de la FPE chez les hôtes naturels3,4,5. Cependant, la collecte d’insectes infectés par des champignons est généralement limitée par des facteurs environnementaux et des populations d’insectes sur le terrain4. Étant donné que les insectes hôtes meurent après une infection par le FPE et tombent ensuite dans le sol, l’isolement du FPE à partir d’échantillons de sol pourrait être une ressource stable3,6. Par exemple, les saprophytes sont connus pour utiliser l’hôte mort comme ressource pour la croissance. Les systèmes d’appâts de sol et de milieux sélectifs ont été largement utilisés pour détecter et isoler les FPE du sol3,4,7,8,9,10.
Dans la méthode du milieu sélectif, la solution de sol diluée est plaquée sur un milieu contenant des antibiotiques à large spectre (p. ex. chloramphénicol, tétracycline ou streptomycine) pour inhiber la croissance des bactéries2,3,9,11. Cependant, il a été rapporté que cette méthode peut déformer la diversité et la densité de la souche et peut provoquer une surestimation ou une sous-estimation de nombreuses communautés microbiennes6. De plus, les souches isolées sont moins pathogènes et rivalisent avec les saprophytes pendant l’isolement. Il est difficile d’isoler le PEF de la solution de sol diluée3. Au lieu d’utiliser un milieu sélectif, la méthode d’appât du sol isole l’EPF des insectes morts infectés, qui peuvent être stockés pendant 2-3 semaines, fournissant ainsi une méthode de séparation EPF plus efficace et standard3,4,7,6. Parce que la méthode est facile à utiliser, on peut isoler une variété de souches pathogènes à faible coût4. Par conséquent, il est largement utilisé par de nombreux chercheurs.
En comparant les différents types de systèmes d’appâts à insectes, Beauveria bassiana et Metarhizium anisopliae sont les espèces d’EPF les plus courantes que l’on trouve chez les insectes appartenant aux hémiptères, aux lépidoptères, aux blattella et aux coléoptères6,12,13,14. Parmi ces appâts d’insectes, Galleria mellonella (ordre des lépidoptères) et Tenebrio molitor (ordre des coléoptères) montrent des taux de récupération plus élevés de Beauveria et de Metarhizium spp., par rapport à d’autres insectes. Par conséquent, G. mellonella et T. molitor sont couramment utilisés pour l’appâtage des insectes. Au fil des ans, le Département de l’Agriculture des États-Unis (USDA) a créé une bibliothèque EPF (Agricultural Research Service Collection of EPF cultures, ARSEF) qui contient une grande variété d’espèces, dont 4081 espèces de Beauveria spp., 18 espèces de Clonostachys spp., 878 espèces de Cordyceps spp., 2473 espèces de Metarhizium spp., 226 espèces de Purpureocillium spp., et 13 espèces de Pochonia spp. entre autres15. Une autre bibliothèque EPF a été construite par le Laboratoire de recherche en entomologie (ERL) de l’Université du Vermont aux États-Unis pendant environ 30 ans. Il comprend 1345 souches d’EPF en provenance des États-Unis, d’Europe, d’Asie, d’Afrique et du Moyen-Orient16.
Pour lutter contre les ravageurs locaux ou d’invasion à Taïwan, l’isolement et la sélection des FPE indigènes sont nécessaires. Par conséquent, dans ce protocole, nous avons modifié et décrit la procédure de la méthode d’appât du sol et l’avons combinée avec le système d’appât d’insecte (ver de farine, Mouebrio molitor)17. Sur la base de ce protocole, une bibliothèque EPF a été créée. Deux cycles de dépistage (quantification de l’inoculation) ont été effectués pour les isolats préliminaires de FPE. Les isolats d’EPF ont montré une pathogénicité pour les insectes. Les souches potentielles ont été soumises à des identifications morphologiques et moléculaires et analysées plus avant par le test de thermotolérance et de production conique. En outre, un concept de nombre de conidies effectives (ECN) a également été proposé. À l’aide de la formule ECN et de l’analyse en composantes principales (APC), les souches potentielles ont été analysées sous pression environnementale simulée pour compléter le processus d’établissement et de criblage de la bibliothèque EPF. Par la suite, la pathogénicité des souches prometteuses de FPE a été testée pour le ravageur cible (p. ex., Spodoptera litura). Le protocole actuel intègre les données de thermotolérance et de production conique dans la formule ECN et l’analyse PCA, qui peuvent être utilisées comme système de classement standard pour la recherche liée à l’EPF.
Protocole
REMARQUE : L’organigramme complet est illustré à la figure 1.
1. Isolement et sélection des champignons entomopathogènes potentiels (FPE)
- Prélever l’échantillon de sol
- Retirez 1 cm du sol de surface, puis recueillez le sol à une profondeur de 5 à 10 cm à l’aide d’une pelle de chaque site d’échantillonnage.
NOTE : Les sites d’échantillonnage seraient des montagnes, des forêts ou des zones peu peuplées afin d’éviter la contamination des souches de FPE pulvérisées artificiellement. Assurez-vous que les zones de collecte des échantillons de sol sont recouvertes de mauvaises herbes à la surface. Un sol sec ou humide ne convient pas à cette expérience. - Consignez les détails de chaque site d’échantillonnage, y compris le GPS, l’altitude, le type de champ, la température annuelle, les précipitations annuelles, la période de collecte (saison), le type de sol et la valeur du pH.
- Prélever 100 g de l’échantillon de sol dans un sac en plastique et le maintenir à température ambiante s’il est soumis au protocole d’isolement fongique en laboratoire dans les 3 heures.
REMARQUE: Si l’échantillon ne peut pas être utilisé dans les 3 heures, stocker le sol à température ambiante dans des conditions sombres. Si l’expérience n’est pas effectuée immédiatement, l’échantillon de sol peut être conservé à 4 °C pendant 1 semaine jusqu’au début du protocole18,19.
- Retirez 1 cm du sol de surface, puis recueillez le sol à une profondeur de 5 à 10 cm à l’aide d’une pelle de chaque site d’échantillonnage.
- Appâter et isoler l’EPF avec le ver de farine (Tenebrio molitor)
- Placez 100 g de l’échantillon de sol dans un gobelet en plastique (diamètre du bouchon = 8,5 cm, hauteur = 12,5 cm), puis placez 5 vers de farine à la surface du sol à température ambiante dans l’obscurité pendant 2 semaines.
REMARQUE: D’autres types de récipients en plastique peuvent également être utilisés. Si les sols sont trop secs (fissurés ou sablonneux), vaporisez du ddH2O stérilisé (environ 5-10 mL) sur les sols. La longueur du corps d’environ 2,5 cm (14e stade) des larves de T. molitor aide à isoler les champignons20. - Observer et enregistrer quotidiennement les larves pour la mortalité et la mycose; garder les larves mortes dans la tasse jusqu’à 2 semaines pour l’isolement fongique.
REMARQUE: La spore de conidies fongiques dans les échantillons de sol se fixera aux larves de vers de farine au cours du processus ci-dessus. La mycose fongique sera observée à mesure que les hyphes se développent à partir de la membrane intersegmentale, puis tout le corps sera recouvert de mycélium. La sporulation commencera après 7 jours et la couleur de l’infection fongique changera en couleur de la masse de conidies. - Transférez les insectes morts sur un banc propre et utilisez un cure-dent stérile pour recueillir les conidies. Stroyez-les sur une plaque de milieu de gélose au dextrose Sabouraud (1/4 SDA) (55 mm) en laboratoire21. Incuber la plaque de culture à 25 °C pendant 7 jours pour obtenir la culture primaire de champignons.
NOTE: La plaque 1/4 SDA est préparée comme suit: Mélanger 1,5 g de bouillon de dextrose Sabouraud et 3 g de gélose dans 200 mL de H2O, puis stériliser pendant 20 min. Aliquote 1/4 SDA dans chaque boîte de Petri de 55 mm avant solidification. Les plaques SDA 1/4 solidifiées sont conservées à 4 °C jusqu’à utilisation. - Retracez chaque champignon de culture primaire sur une plaque SDA de 55 mm 1/4 dans un écoulement laminaire et incubez la plaque de culture à 25 °C pendant 7 jours pour obtenir des colonies uniques de champignons.
- Répétez ce ré-isolement ~ 2-3 fois et observez en microscopie optique pour obtenir des colonies fongiques morphologiques uniques et pures.
REMARQUE: Isolez tout EPF à l’aide de T. molitor-bait et conservez comme décrit dans la section suivante. La séparation, la conservation, la culture pure et les stries doivent être effectuées dans un flux laminaire dans les sections suivantes.
- Placez 100 g de l’échantillon de sol dans un gobelet en plastique (diamètre du bouchon = 8,5 cm, hauteur = 12,5 cm), puis placez 5 vers de farine à la surface du sol à température ambiante dans l’obscurité pendant 2 semaines.
- Stocker les isolats EPF
- Coupez 3 des blocs de gélose de 5 mm au bord de chaque plaque de culture fongique pure isolée avec un foreur de liège et placez-les dans un tube de microcentrifugation de 1,5 mL comme réplique.
REMARQUE: Trois répliques pour chaque isolat fongique sont recommandées pour le stockage des souches EPF après le 2e test de virulence. L’identification moléculaire est également recommandée si l’espace de stockage est limité. - Ajouter 250 μL de solution tensioactive à 0,03 % (table des matériaux) et 250 μL de glycérol à 60 % dans le tube de microcentrifugation de 1,5 mL à l’aide d’une micropipette; puis, vortex pendant 10 s.
- Scellez le tube de microcentrifugation de 1,5 mL avec un film de paraffine et prérefroidissez-le dans un réfrigérateur à -20 °C pendant 24 h. Ensuite, transférez les stocks fongiques prérefroidis dans un réfrigérateur à -80 °C pour la cryoconservation.
NOTE: Des plaques de culture fongique extra pures (à l’exception des échantillons cryoconservés) ont été utilisées à la section 1.4.
- Coupez 3 des blocs de gélose de 5 mm au bord de chaque plaque de culture fongique pure isolée avec un foreur de liège et placez-les dans un tube de microcentrifugation de 1,5 mL comme réplique.
- 1er dépistage de pathogénicité pour les isolats fongiques
- Placer cinq larves de T. molitor directement à la surface de chaque plaque de culture fongique pure à 25 °C.
- Observez et enregistrez la mycose et la mortalité pendant 10 jours. Sélectionnez l’isolat fongique pour une analyse plus approfondie.
REMARQUE: Les isolats fongiques causant une mortalité de 100% sont sélectionnés pour le 2ème test de virulence afin de confirmer leur virulence aux larves de T. molitor . Alternativement, le chercheur peut ajuster les critères selon sa propre étude.
- 2ème test de virulence des isolats fongiques
REMARQUE: Sur la base du 1er crible de pathogénicité, récupérer les isolats fongiques sélectionnés à partir de -80 °C pour le 2ème test de virulence. Le but du 2ème test de virulence est de quantifier la pathogénicité des isolats fongiques sélectionnés après le 1er tour de dépistage.- Récoltez les conidies de chaque isolat fongique en vortexant pendant 1 min et comptez le nombre de conidies à l’aide d’un hémocytomètre.
- Ajuster la suspension de conidies à une concentration de 1 x 107 conidies/mL dans une solution de tensioactif à 0,03 % (tableau des matériaux).
- Étaler 10 μL de la suspension fongique sur des plaques SDA de 55 mm 1/4 et croître pendant 7 jours à 25 °C dans l’obscurité.
- Placer cinq larves de T. molitor directement à la surface de chaque plaque de culture fongique pure (environ 6 x 107 conidies). Sceller les plaques avec un film de paraffine et incuber à 25 °C dans l’obscurité.
- Observez et enregistrez la mycose et la mortalité pendant 10 jours.
- Répétez le test (de l’étape 1.51 à l’étape 1.5.5) en trois exemplaires pour chaque isolat fongique.
REMARQUE: Les isolats fongiques causant une mortalité de 100% sont sélectionnés pour le 3ème test de virulence afin de confirmer leur virulence à cibler le ravageur.
- 3ème test de virulence d’isolats fongiques pour ravageur cible (Spodoptera litura à titre d’exemple)
- Répétez les étapes 1.5.2 à 1.5.6 avec des isolats sélectionnés de la 2e virulence pour tester la virulence contre les ravageurs cibles.
- Calculer le LT50 de chaque isolat fongique22.
REMARQUE: Le LT50 de chaque isolat fongique a été calculé à l’aide de modèles linéaires généralisés (GLM) à l’aide de R studio (version 3.4.1); la distribution d’erreur quasi-concriomiale et une fonction de liaison de journal peuvent être utilisées pour tenir compte de la surdispersion.
2. Identification moléculaire de l’EPF
- Extraction de l’ADN génomique fongique
- Collectez environ 1 cm2 d’EPF de la plaque 1/4 SDA de 7 jours.
- Extrayez l’ADN génomique fongique à l’aide d’un kit d’extraction d’ADN génomique fongique conformément aux instructions du fabricant23 (Table des matériaux).
- Amplification par PCR et séquençage de l’ADN
- Amplifier la région ITS fongique par PCR de l’échantillon d’ADN21 à l’aide du PCR Master Mix (2x), de l’ensemble d’amorces ITS1F/ITS4R24 (Tableau 1) avec le programme pcR suivant : 94 °C pendant 1 min, puis 35 cycles de 94 °C pendant 30 s, 55 °C pendant 30 s et 72 °C pendant 1 min, suivi d’une extension finale de 7 min à 72 °C.
REMARQUE: L’ensemble d’amorces ITS1F/ITS4R est destiné à l’identification au niveau du genre. - Séquencer la PCR par service de séquençage commercial.
- Utilisez la recherche NCBI BLAST pour des champignons similaires dans la base de données NCBI et sélectionnez les espèces de type fongique relatif pour l’analyse phylogénétique.
REMARQUE: Les espèces fongiques appartenant au genre Metarhizium ou Beauveria doivent être identifiées plus en détail au niveau de l’espèce avec l’ensemble d’amorces tef-983F/tef-2218R25 (répétez les étapes 2.1.1 à 2.2.3). Pour les champignons qui n’appartiennent pas aux genres Metarhizium ou Beauveria, d’autres marqueurs moléculaires peuvent être utilisés pour identifier l’espèce, notamment l’ADN lyase (APN2), la tubuline bêta (BTUB), la plus grande sous-unité de l’ARN polymérase II (RPB1), la deuxième plus grande sous-unité de l’ARN polymérase II (RPB2) et la partie 3' du facteur d’allongement de traduction 1 alpha (TEF)25,26 .
- Amplifier la région ITS fongique par PCR de l’échantillon d’ADN21 à l’aide du PCR Master Mix (2x), de l’ensemble d’amorces ITS1F/ITS4R24 (Tableau 1) avec le programme pcR suivant : 94 °C pendant 1 min, puis 35 cycles de 94 °C pendant 30 s, 55 °C pendant 30 s et 72 °C pendant 1 min, suivi d’une extension finale de 7 min à 72 °C.
- Analyse phylogénétique
- Utilisez ClustalX 2.1 software27 pour aligner les séquences multiples des étapes 2.2.2 et 2.2.3. Découpez manuellement la région des séquences conservées avec GeneDoc28.
- Effectuez l’analyse phylogénétique par MEGA7 software29 sur la base des méthodes d’évolution minimale (ME), de voisinage (NJ) et de probabilité maximale (ML).
REMARQUE: L’exécution des trois méthodes peut aider à confirmer et à conclure avec précision l’état de la classification. Les isolats fongiques criblés par le 1er crible de pathogénicité sont utilisés pour l’identification moléculaire au niveau du genre. Les isolats fongiques examinés par le 2ème test de virulence sont utilisés pour l’identification moléculaire et morphologique au niveau de l’espèce.
3. Identification morphologique du FPE
- Observation de la morphologie de la colonie fongique
- Utilisez un appareil photo pour capturer la croissance de la colonie de culture fongique pendant 7 jours et enregistrez la croissance, la forme (moelleuse, ferme) et la couleur des colonies.
- Observation des conidies et des conidiophores
- Gratter les conidies de la colonie fongique de culture pure avec une boucle d’inoculation et transférer les spores dans une lame de verre avec une solution Tween 80 à 0,1%. Ensuite, couvrez avec un couvercle pour l’observation microscopique légère des conidies.
- Utilisez un scalpel pour couper un bloc de gélose de 5 mm2 du brin hyphale au bord de la colonie fongique, puis transférez le bloc de gélose sur une lame de verre.
- Effectuez le nettoyage comme suit: Ajouter la solution Tween 80 à 0,1% sur le bloc de gélose avec un compte-gouttes en plastique et laver la plupart des conidies en excès à l’aide d’une pince à épiler. Ensuite, recouvrez-le d’un couvercle pour l’observation microscopique à la lumière.
REMARQUE: 0,1% Tween 80 peut être remplacé par un autre tensioactif plus puissant (Table des matériaux) en fonction des espèces fongiques et de l’hydrophobicité. - Mesurez et enregistrez la largeur et la longueur des conidies et des conidiophores pour comparer les différences entre différents isolats fongiques.
- Utilisez le test ANOVA de Welch et le test Games-Howell (test post-hoc) pour analyser la largeur et la longueur conidiales de chaque souche à l’aide de R studio (version 3.4.1).
REMARQUE: L’analyse des données des caractères morphologiques peut être ajustée par cas. Les isolats fongiques criblés avec le 3ème test de virulence sont utilisés pour la caractérisation physiologique et le classement ECN dans les sections 4 et 5.
4. Étude de la productivité condescendante et de la thermotolérante
- Essai de production conique
- Cultiver l’isolat fongique sélectionné sur un milieu 1/4 SDA à 25 ± 1 °C dans l’obscurité pendant 10 jours.
- Préparer 1 mL de la suspension conidiale de l’isolat fongique dans une solution de tensioactif à 0,03 % et ajuster à 1 x 107 conidies/mL comme décrit ci-dessus.
- Laisser tomber trois gouttelettes de 10 μL de suspension conidiale sur 1/4 de SDA et incuber à 25 °C dans l’obscurité pendant 7, 10 et 14 jours pour compter la sporulation des champignons.
REMARQUE: 10 μL est le meilleur volume pour collecter le bloc de 5 mm avec une sporulation fongique uniforme après la croissance fongique pendant 7 à 14 jours. - Utilisez l’agrile du liège pour détacher un bloc de gélose de 5 mm du centre de la colonie et transférez-le dans 1 mL de solution tensioactive à 0,03 % (table des matériaux) dans un tube de microcentrifugation de 1,5 mL à chaque point temporel.
- Vortex le tube à 3 000 tr/min à température ambiante pendant 15 min et utiliser un hémocytomètre pour compter le nombre de conidies.
REMARQUE: La formule utilisée pour le comptage est le nombre de conidies par 25 carrés de la plus petite cellule (taille = 0,025 mm2; profondeur de la chambre = 0,1 mm):
Nombre total de conidies en 5 carrés ÷ 80 × (4 × 106) - Répétez trois fois pour chaque isolat.
- Dosage de thermotolérance
- Cultiver l’isolat fongique sélectionné sur un milieu 1/4 SDA à 25 ± 1 °C dans l’obscurité pendant 10 jours.
- Préparer 1 mL de la suspension conidiale d’isolat fongique dans une solution de tensioactif à 0,03 % et ajuster à 1 x 107 conidies/mL comme décrit ci-dessus.
- Vortex la suspension conidiale et chauffez-la dans un bain sec à 45 °C pendant 0, 30, 60, 90 et 120 min. Déposer trois gouttelettes de 5 μL de la suspension conidiale sur un milieu de 55 mm 1/4 SDA à chaque point temporel après l’exposition à la chaleur et incuber à 25 ± 1 °C pendant 18 h.
REMARQUE: Évitez de répandre les gouttelettes fongiques pour pouvoir mieux vous concentrer sur la zone. - Comptez le nombre de spores de conidies germées avec cinq champs choisis au hasard sous microscopie optique 200x pour déterminer le taux de germination.
- Effectuez trois réplications pour chaque isolat.
5. Classement du nombre effectif de conidies (ECN)
- Calcul ecN
NOTE: Obtenir les données de production cidiosiale et de thermotolérance de chaque souche fongique potentielle avant de calculer le ECN21 total.- Calculer le changement de pli (FC) de la production conique à chaque point temporel :
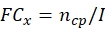
où, x = point temporel pour la collecte des données; ncp = nombre de conidies après chaque jour de croissance; et I = nombre initial de conidies ensemencées. - Calculer le nombre de conidies sous le traitement de contrainte à chaque point temporel en utilisant la formule suivante:

Où, y = l’ECN du point temporel sous traitement; TT0 = le taux de germination des conidies ne subissant pas de stress thermique (= taux de germination de 0 min de traitement thermique); TTz = coefficient de contrainte est le taux de germination des conidies à différents moments du traitement thermique (z). - Calculez l’ECN total à l’aide de la formule suivante :

- Comparez l’ECN de chaque souche fongique.
- Calculer le changement de pli (FC) de la production conique à chaque point temporel :
- Analyse en composantes principales (ACP) des souches fongiques
NOTE:L’analyse PCA confirme le classement de l’ECN et aide à comprendre la corrélation entre les valeurs de caractère physiologique. Comparez les valeurs ECN et sélectionnez les isolats EPF ayant des valeurs ECN plus élevées. - Utilisez le logiciel R pour créer un PCA en codant :
#Input fichier de données PCA
a = read.table(« PCA.csv »,sep=',',header=T)- # Traitement des exemples de données
row.names(a) <- c(« NCHU-9 »,"NCHU-11 », « NCHU-64 », « NCHU-69 », « NCHU-95 », « NCHU-113 »)
X=row.names(a)
df<- a[2:11] - #PCA calcul
pca <- prcomp(df, centre = VRAI, échelle = VRAI)
vars <- (pca$sdev)^2
pc1_percent = vars[1] / sum(vars)
pc2_percent = vars[2] / sum(vars)
valeur = pca$x - #Output fichier de visualisation PCA
png(file = 'pca.png', hauteur = 2000, largeur = 2000, res = 300)
REMARQUE: Utilisez une production condescendante de 7 à 14 jours et toutes les données de thermotolérance pour effectuer l’analyse en composantes principales (APC) afin de confirmer le classement ECN.
- # Traitement des exemples de données
- Sélectionnez les souches fongiques les plus performantes en fonction de l’ECN ou de l’APC et effectuez le test de virulence des parasites cibles pour des recherches ultérieures.
Résultats
Isolement et sélection de champignons entomopathogènes potentiels (EPF)
En utilisant la méthode de construction de la bibliothèque de champignons entomopathogènes à médiation molitoreuse (EPF) de Tenebrio, le nombre de champignons sans activité de destruction d’insectes serait exclu; ainsi, l’efficacité de l’isolement et la sélection du FPE pourraient être largement augmentées. Au cours de l’application de cette méthode, les informations ...
Discussion
Les champignons entomopathogènes (EPF) ont été utilisés pour la lutte contre les insectes. Il existe plusieurs méthodes pour isoler, sélectionner et identifier les FPE30,31,32. En comparant les différents types de méthodes d’appâts à insectes, Beauveria bassiana et Metarhizium anisopliae ont été couramment trouvés dans les appâts à insectes6,12,13,14.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas de conflit d’intérêts impliqué dans ce travail.
Remerciements
Cette recherche a été soutenue par la subvention 109-2313-B-005 -048 -MY3 du ministère de la Science et de la Technologie (MOST).
matériels
| Name | Company | Catalog Number | Comments |
| Agar Bacteriological grade | BIOMAN SCIENTIFIC Co., Ltd. | AGR001 | Suitable in most cell culture/molecular, biology applications. |
| AGAROSE, Biotechnology Grade | BIOMAN SCIENTIFIC Co., Ltd. | AGA001 | For DNA electrophoresis. |
| BioGreen Safe DNA Gel Buffer | BIOMAN | SDB001T | |
| Brass cork borer | Dogger | D89A-44001 | |
| Canon kiss x2 | Canon | EOS 450D | For record strain colony morphology |
| Constant temperature incubator | Yihder Co., Ltd. | LE-509RD | Fungal keeping. |
| cubee Mini-Centrifuge | GeneReach | MC-CUBEE | |
| DigiGel 10 Digital Gel Image System | TOPBIO | DGIS-12S | |
| Finnpipette F2 0.2 to 2 µL Pipette | Thermo Scientific | 4642010 | |
| Finnpipette F2 1 to 10 µL Pipette | Thermo Scientific | 4642030 | |
| Finnpipette F2 10 to 100 µL Pipette | Thermo Scientific | 4642070 | |
| Finnpipette F2 100 to 1000 µL Pipette | Thermo Scientific | 4642090 | |
| Finnpipette F2 2 to 20 µL Pipette | Thermo Scientific | 4642060 | |
| Finnpipette F2 20 to 200 µL Pipette | Thermo Scientific | 4642080 | |
| GeneAmp PCR System 9700 | Applied Biosystems | 4342718 | |
| GenepHlow Gel/PCR Kit | Geneaid | DFH100 | |
| Genius Dry Bath Incubator | Major Science | MD-01N | |
| Graduated Cylinder Custom A 100mL | SIBATA | SABP-1195906 | Measure the volume of reagents. |
| Hand tally counter | SDI | NO.1055 | |
| Hemocytometer | bioman | AP-0650010 | Calculate the number of spore |
| Inoculating loop | Dogger | D8GA-23000 | |
| lid | IDEAHOUSE | RS92004 | |
| Micro cover glass | MUTO PURE CHEMICALS CO.,LTD | 24241 | |
| Microscope imaging system | SAGE VISION CO.,LTD | SGHD-3.6C | |
| Microscope Slides | DOGGER | DG75001-07105 | |
| Mupid-2plus DNA Gel Electrophoresis | ADVANCE | AD110 | |
| Nikon optical microscope | SAGE VISION CO.,LTD | Eclipse CI-L | |
| Plastic cup | IDEAHOUSE | CS60016 | |
| Presto Mini gDNA Yeast Kit | Geneaid | GYBY300 | Fungal genomic DNA extraction kit |
| Sabouraud Dextrose Broth (Sabouraud Liquid Medium) | HiMedia Leading BioSciences Company | M033 | Used for cultivation of yeasts, moulds and aciduric microorganisms. |
| Scalpel Blade No.23 | Swann-Morton | 310 | |
| Scalpel Handle No.4 | AGARWAL SURGICALS | SSS -FOR-01-91 | |
| Shovel | Save & Safe | A -1580242 -00 | |
| Silwet L-77 | bioman(phytotech) | S7777 | Surfactant |
| Sorvall Legend Micro 17 Microcentrifuge | Thermo Scientific | 75002403 | |
| Steel Tweezers | SIPEL ELECTRONIC SA | GG-SA | |
| Sterile Petri Dish | BIOMAN SCIENTIFIC Co., Ltd. | 1621 | Shallow cylindrical containers with fitted lids, specifically for microbiology or cell culture use. |
| ThermoCell MixingBlock | BIOER | MB-101 | |
| Tween 80 | FUJIFILM Wako Pure Chemical Corporation | 164-21775 | |
| TwinGuard ULT Freezer | Panasonic Healthcare Holdings Co., Ltd. | MDF-DU302VX | -80°C sample stored. |
| Vertical floor type cabinet | Chih Chin | BSC-3 | Fungal operating culturing. |
| Vortex Genie II | Scientific | SIG560 | |
| Zipper storage bags | Save & Safe | A -1248915 -00 | |
| 100 bp DNA Ladder | Geneaid | DL007 | |
| -20°C Freezer | FRIGIDAIRE | Frigidaire FFFU21M1QW | -20°C sample and experimental reagents stored. |
| 2X SuperRed PCR Master Mix | TOOLS | TE-SR01 | |
| 50X TAE Buffer | BIOMAN | TAE501000 |
Références
- Wraight, S. P., Carruthers, R. I. . Biopesticides: use and Delivery. , 233-269 (1999).
- Chase, A., Osborne, L., Ferguson, V. Selective isolation of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae from an artificial potting medium. Florida Entomologist. , 285-292 (1986).
- Meyling, N. V. Methods for isolation of entomopathogenic fungi from the soil environment. University of Copenhagen. , 1-18 (2007).
- Zimmermann, G. The 'Galleria bait method'for detection of entomopathogenic fungi in soil. Journal of applied Entomology. 102 (1-5), 213-215 (1986).
- Schneider, S., Widmer, F., Jacot, K., Kölliker, R., Enkerli, J. Spatial distribution of Metarhizium clade 1 in agricultural landscapes with arable land and different semi-natural habitats. Applied Soil Ecology. 52, 20-28 (2012).
- Hallouti, A., et al. Diversity of entomopathogenic fungi associated with Mediterranean fruit fly (Ceratitis capitata (Diptera: Tephritidae)) in Moroccan Argan forests and nearby area: impact of soil factors on their distribution. BMC Ecology. 20 (1), 1-13 (2020).
- Meyling, N. V., Eilenberg, J. Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agriculture, Ecosystems and Environment. 113 (1-4), 336-341 (2006).
- Skalický, A., Bohatá, A., Šimková, J., Osborne, L. S., Landa, Z. Selection of indigenous isolates of entomopathogenic soil fungus Metarhizium anisopliae under laboratory conditions. Folia Microbiologica. 59 (4), 269-276 (2014).
- Veen, K., Ferron, P. A selective medium for the isolation of Beauveria tenella and of Metarrhizium anisopliae. Journal of Invertebrate Pathology. 8 (2), 268-269 (1966).
- Goettel, M., Inglis, D., Lacy, L. . Manual of Techniques in Insect Pathology. , 213-249 (1997).
- Luz, C., Netto, M. C. B., Rocha, L. F. N. In vitro susceptibility to fungicides by invertebrate-pathogenic and saprobic fungi. Mycopathologia. 164 (1), 39-47 (2007).
- Mantzoukas, S., et al. Trapping entomopathogenic fungi from vine terroir soil samples with insect baits for controlling serious pests. Applied Sciences. 10 (10), 3539 (2020).
- Goble, T., Dames, J., Hill, M., Moore, S. The effects of farming system, habitat type and bait type on the isolation of entomopathogenic fungi from citrus soils in the Eastern Cape Province, South Africa. BioControl. 55 (3), 399-412 (2010).
- Nishi, O., Iiyama, K., Yasunaga-Aoki, C., Shimizu, S. Isolation of entomopathogenic fungi from soil by using bait method with termite, Reticulitermes speratus. Enotomotech. 35, 21-26 (2011).
- Castrillo, L. . ARS Collection of Entomopathogenic Fungal Cultures (ARSEF). , (2014).
- Kim, J. C., et al. Tenebrio molitor-mediated entomopathogenic fungal library construction for pest management. Journal of Asia-Pacific Entomology. 21 (1), 196-204 (2018).
- Keyser, C. A., Henrik, H., Steinwender, B. M., Meyling, N. V. Diversity within the entomopathogenic fungal species Metarhizium flavoviride associated with agricultural crops in Denmark. BMC Microbiology. 15 (1), 1-11 (2015).
- Quesada-Moraga, E., Navas-Cortés, J. A., Maranhao, E. A., Ortiz-Urquiza, A., Santiago-Álvarez, C. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research. 111 (8), 947-966 (2007).
- Park, J. B., et al. Developmental characteristics of Tenebrio molitor larvae (Coleoptera: Tenebrionidae) in different instars. International Journal of Industrial Entomology. 28 (1), 5-9 (2014).
- Chang, J. -. C., et al. Construction and selection of an entomopathogenic fungal library from soil samples for controlling Spodoptera litura. Frontiers in Sustainable Food Systems. 5, 15 (2021).
- Podder, D., Ghosh, S. K. A new application of Trichoderma asperellum as an anopheline larvicide for eco friendly management in medical science. Scientific reports. 9 (1), 1-15 (2019).
- . Geneaid Biotech Ltd. Presto Mini gDNA Yeast, Ver. 04.27.17 Available from: https://www.geneaid.com/data/files/1605664221308055331.pdf (2021)
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR protocols: A guide to methods and applications. 18 (1), 315-322 (1990).
- Kepler, R. M., Humber, R. A., Bischoff, J. F., Rehner, S. A. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics. Mycologia. 106 (4), 811-829 (2014).
- Kepler, R. M. A phylogenetically-based nomenclature for Cordycipitaceae (Hypocreales). IMA Fungus. 8 (2), 335-353 (2017).
- Thompson, J. D., Gibson, T. J., Plewniak, F., Jeanmougin, F., Higgins, D. G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research. 25 (24), 4876-4882 (1997).
- Kumar, S., Stecher, G., Tamura, K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution. 33 (7), 1870-1874 (2016).
- Herlinda, S., Mulyati, S. I. Selection of isolates of entomopathogenic fungi and the bioefficacy of their liquid production against Leptocorisa oratorius nymphs. Microbiology Indonesia. 2 (3), 9 (2008).
- Herlinda, S., Irsan, C., Mayasari, R., Septariani, S. Identification and selection of entomopathogenic fungi as biocontrol agents for Aphis gossypii from South Sumatra. Microbiology Indonesia. 4 (3), 137-142 (2010).
- Montes-Bazurto, L. G., Peteche-Yonda, Y., Medina-Cardenas, H. C., Bustillo-Pardey, A. E. Selection of entomopathogenic fungi for the biological control of Demotispa neivai (Coleoptera: Chrysomelidae) in oil palm plantations in Colombia. Journal of Entomological Science. 55 (3), 388-404 (2020).
- Shin, T. -. Y., Choi, J. -. B., Bae, S. -. M., Koo, H. -. N., Woo, S. -. D. Study on selective media for isolation of entomopathogenic fungi. International Journal of Industrial Entomology. 20 (1), 7-12 (2010).
- Sharma, L., Oliveira, I., Torres, L., Marques, G. Entomopathogenic fungi in Portuguese vineyards soils: Suggesting a 'Galleria-Tenebrio-bait method'as bait-insects Galleria and Tenebrio significantly underestimate the respective recoveries of Metarhizium (robertsii) and Beauveria (bassiana). MycoKeys. (38), 1 (2018).
- Rodríguez, M., Gerding, M., France, A. Selección de Hongos Entomopatógenos para el Control de Varroa destructor (Acari: Varroidae). Chilean journal of agricultural research. 69 (4), 534-540 (2009).
- Yang, H., et al. Persistence of Metarhizium (Hypocreales: Clavicipitaceae) and Beauveria bassiana (Hypocreales: Clavicipitaceae) in tobacco soils and potential as biocontrol agents of Spodoptera litura (Lepidoptera: Noctuidae). Environmental entomology. 48 (1), 147-155 (2019).
- Muñiz-Reyes, E., Guzmán-Franco, A. W., Sánchez-Escudero, J., Nieto-Angel, R. Occurrence of entomopathogenic fungi in tejocote (C rataegus mexicana) orchard soils and their pathogenicity against R hagoletis pomonella. Journal of Applied Microbiology. 117 (5), 1450-1462 (2014).
- Lacey, L. A., et al. Goettel Insect pathogens as biological control agents: Back to the future. Journal of Invertebrate Pathology. 132, 1-41 (2015).
- Humber, R. A. . Manual of techniques in insect pathology. , 153-185 (1997).
- Rehner, S. A., Buckley, E. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia. 97 (1), 84-98 (2005).
- Quandt, C. A., et al. Phylogenetic-based nomenclatural proposals for Ophiocordycipitaceae (Hypocreales) with new combinations in Tolypocladium. IMA fungus. 5 (1), 121-134 (2014).
- Shah, F. A., Wang, C. S., Butt, T. M. Nutrition influences growth and virulence of the insect-pathogenic fungus Metarhizium anisopliae. FEMS Microbiology Letters. 251 (2), 259-266 (2005).
- Ignoffo, C. Environmental factors affecting persistence of entomopathogens. Florida Entomologist. , 516-525 (1992).
- Rodrigues, I. W., Forim, M., Da Silva, M., Fernandes, J., Batista Filho, A. Effect of ultraviolet radiation on fungi Beauveria bassiana and Metarhizium anisopliae, pure and encapsulated, and bio-insecticide action on Diatraea saccharalis. Advances in Entomology. 4 (3), 151-162 (2016).
- Paula, A. R., Ribeiro, A., Lemos, F. J. A., Silva, C. P., Samuels, R. I. Neem oil increases the persistence of the entomopathogenic fungus Metarhizium anisopliae for the control of Aedes aegypti (Diptera: Culicidae) larvae. Parasites and Vectors. 12 (1), 1-9 (2019).
- Morley-Davies, J., Moore, D., Prior, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research. 100 (1), 31-38 (1996).
- Rangel, D. E., Braga, G. U., Flint, S. D., Anderson, A. J., Roberts, D. W. Variations in UV-B tolerance and germination speed of Metarhizium anisopliae conidia produced on insects and artificial substrates. Journal of Invertebrate Pathology. 87 (2-3), 77-83 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon