Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthode à haut débit, robuste et très flexible dans le temps pour la stérilisation de surface des graines d’Arabidopsis
Dans cet article
Résumé
Un protocole à haut débit pour la stérilisation de surface des graines d’Arabidopsisthaliana (Arabidopsis) est fourni, optimisant les étapes de manipulation des liquides avec un simple dispositif d’aspiration construit avec une pompe à vide. Des centaines d’échantillons de semences peuvent être stérilisés en surface en une journée.
Résumé
Arabidopsis est de loin l’espèce modèle végétale la plus largement utilisée pour les études fonctionnelles. La stérilisation de surface des graines d’Arabidopsis est une étape fondamentale nécessaire à cette fin. Ainsi, il est primordial d’établir des méthodes de stérilisation de surface des graines d’Arabidopsis à haut débit pour traiter des dizaines à des centaines d’échantillons (par exemple, des lignées transgéniques, des écotypes ou des mutants) à la fois. Une méthode de stérilisation de la surface des graines basée sur l’élimination efficace du liquide dans les tubes avec un dispositif d’aspiration fait maison construit à partir d’une pompe à vide commune est présentée dans cette étude. En réduisant considérablement le temps de travail intensif avec cette méthode, il est possible de traiter plusieurs centaines d’échantillons en une journée avec peu d’effort. Les analyses chronologiques en série ont en outre indiqué une plage de temps très flexible de stérilisation de surface en maintenant des taux de germination élevés. Cette méthode pourrait être facilement adaptée à la stérilisation de surface d’autres types de petites graines avec une simple personnalisation du dispositif d’aspiration en fonction de la taille de la graine et de la vitesse souhaitée pour éliminer le liquide.
Introduction
Arabidopsis est une espèce de plante diploïde appartenant à la famille des Brassicaceae. Son cycle de vie relativement court (deux mois par génération dans des conditions de croissance de longue durée), sa petite taille de plante et son autopollinisation avec la production de centaines de graines par plante en ont fait la première espèce modèle végétale fondamentale1,2. De plus, son génome a été entièrement séquencé3,de vastes outils de génétique inverse (ADN-T saturé, transposon et populations chimiquement mutagénisées) sont disponibles4,5,6, et une transformation efficace médiée par Agrobacteriumest bien établie pour obtenir suffisamment de lignées transgéniques pour d’autres travaux en aval7 . Ainsi, au cours des deux dernières décennies, de grands progrès ont été réalisés en utilisant Arabidopsis comme espèce modèle pour disséquer divers aspects de la biologie végétale au niveau moléculaire, y compris la variation naturelle, génétique et phénotypique8,9.
Pour caractériser fonctionnellement les gènes d’intérêt pour Arabidopsis, la stérilisation de la surface des graines pour éliminer les contaminants fongiques et bactériens est l’étape préalable à de nombreux protocoles en aval nécessitant des cultures axeniques. La transformation génétique pour la surexpression10,le knock-down (ARN-I11)ou le knock-out (édition du génome12,13)de la fonction génique, la localisation subcellulaire14,l’activité promotrice15,16,l’interaction protéine-protéine17 et l’interaction protéine-ADN18,pour ne citer que les applications les plus courantes, nécessitent toutes une étape de stérilisation à la surface de la graine. Ainsi, malgré sa relative simplicité, la stérilisation de surface des semences joue un rôle fondamental dans de nombreuses analyses fonctionnelles.
Jusqu’à présent, deux grandes catégories de méthodes de stérilisation de surface des semences ont été développées sur la base de la stérilisation en phase gazeuse ou liquide19. Bien que le débit de stérilisation de surface des semences en phase gazeuse soit moyen à élevé, l’utilisation du réactif dangereux chlore gazeux comme agent de stérilisation de surface a entravé son application à grande échelle. Les méthodes basées sur la stérilisation en phase liquide, au contraire, reposent sur des produits chimiques plus doux comme l’éthanol et les solutions d’eau de Javel pour la stérilisation de surface, et elles sont plus largement utilisées malgré leur débit intrinsèquement inférieur à celui de la fumigation au chlore. En général, deux méthodes différentes qui utilisent des réactifs liquides sont couramment utilisées. Une méthode largement utilisée est basée sur le lavage à l’éthanol et à l’eau de Javel à différentes concentrations pour différentes durées de temps20,21. Une autre méthode est basée sur l’application d’eau de Javel seulement21,22. Les deux méthodes sont principalement appliquées pour la stérilisation de surface des semences à petite échelle. Cependant, dans de nombreuses expériences, il est nécessaire de dépister de nombreuses lignées transgéniques d’Arabidopsis dérivées d’une transformation15,23 ou de filtrer en parallèle de nombreuses lignées transgéniques générées à partir de différentes transformations24,25. À notre connaissance, aucune méthode à base de liquide pour la stérilisation de surface des semences à haut débit n’a été publiée, ce qui constitue, bien que peu reconnu, un goulot d’étranglement important pour les approches de génomique fonctionnelle. Par conséquent, le développement de méthodes sûres, robustes et à haut débit pour la stérilisation de la surface des semences est une étape nécessaire et critique vers le succès de la caractérisation fonctionnelle de nombreux gènes à la fois.
À cette fin, dans la présente étude, une méthode améliorée de stérilisation de surface des graines d’Arabidopsis est présentée. Cette méthode est sûre, peu coûteuse, très robuste et à haut débit, permettant de traiter 96 lignes indépendantes en une heure à partir du début de la stérilisation de la surface des graines jusqu’à la fin du semis dans des boîtes de Pétri. La méthode démontrée repose sur des instruments de laboratoire de base largement disponibles, tels qu’une pompe à vide, de la verrerie consommable et des articles en plastique. Cette méthode améliorée fournit à la communauté scientifique une approche sûre, simple et abordable pour rationaliser la stérilisation de la surface des semences avec un débit adéquat aux approches génomiques fonctionnelles modernes chez Arabidopsis et d’autres espèces végétales non modèles.
Protocole
1. Réactifs et préparation des milieux
- Préparer une solution d’éthanol à 70 % : Ajouter 737 mL d’éthanol technique à 95 % à 263 mL d’eau distillée. Mélanger.
REMARQUE: Préparer une solution d’éthanol à 70% sur un banc de travail non stérile.
ATTENTION : L’éthanol est très inflammable et peut causer une irritation grave des yeux. Tenir à l’écart des flammes et des sources de chaleur. En cas de contact avec les yeux, rincer abondamment à l’eau. - Préparer une solution d’eau de Javel à 5 % : Ajouter 5 mL d’eau de Javel domestique (contenant environ 3,5 % d’hypochlorite de sodium, NaClO) à 95 mL d’eau distillée stérile. Ajouter quelques gouttes de détergent non ionique (p. ex., Tween 20) et bien mélanger.
REMARQUE: Préparez une solution d’eau de Javel à 5% à l’intérieur de la hotte laminaire.
ATTENTION : L’hypochlorite de sodium, le composant actif de l’eau de Javel, est très irritant. Il est très corrosif et peut causer de graves dommages au tractus gastro-intestinal. En cas de contact, rincer immédiatement à l’eau abondante. En cas d’ingestion, appelez le centre antipoison ou un médecin pour obtenir des conseils de traitement. - Préparer le Murashige et le Skoog (1/2 MS) moyen26.
- Ajouter 2,2 g de poudre moyenne MS (y compris les vitamines) et 10 g de saccharose dans 800 mL d’eau distillée. Ajuster le pH de la solution à l’aide de 1 M KOH et porter le volume à 1 L à l’aide d’eau distillée. Aliquote 500 mL dans une bouteille de 1 L et ajouter 4g de gélose pour préparer un milieu solide. Autoclavez la solution.
- Après l’autoclavage, refroidir le fluide à 50-53 °C au bain-marie et le verser dans des boîtes de Pétri sous la hotte à flux laminaire. Pour préparer le milieu sélectif, ajouter 1000 μL/L de 50 mg/mL de solution mère de kanamycine (mélanger 500 mg de sulfate de kanamycine monohydraté dans 10 mL d’eau distillée, filtrer stériliser et conserver à -20 °C) au milieu (50-53 °C). Bien mélanger en tourbillonnant et verser dans des boîtes de Petri comme mentionné précédemment.
2. Configuration de l’aspirateur
REMARQUE : La configuration de l’instrument est résumée à la figure 1.
- Connectez l’entrée de la pompe à vide à une extrémité d’un tube en polyéthylène (PE) de taille appropriée. Connectez l’autre extrémité du tube à la sortie du couvercle bidirectionnel de la bouteille de décantation. Enveloppez hermétiquement la jonction du tube avec un film d’étanchéité(Table des matériaux)pour assurer une connexion étanche à l’air.
- Connectez un deuxième tube PE à l’entrée (le trou faisant saillie à l’intérieur de la bouteille) du bouchon à vis sur la bouteille de décantation. Placez l’autre côté du tube à la sortie d’une valve d’aquarium. Si nécessaire, enveloppez avec un film d’étanchéité le long de la jonction pour éliminer les fuites d’air.
- Juste avant utilisation, placez une pointe de pipette stérile de 200 μL à l’entrée du filtre de l’aquarium sous la hotte à flux laminaire.
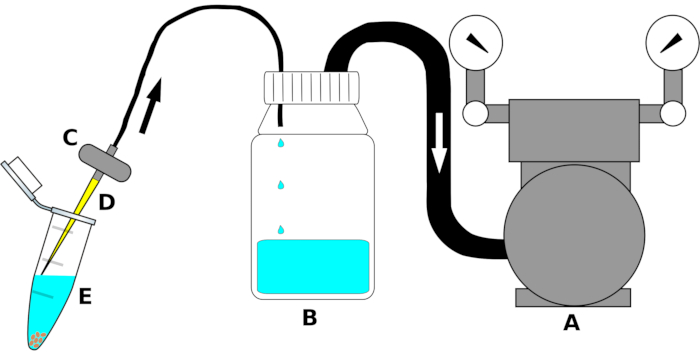
Figure 1: Schéma du dispositif d’aspiration pour l’élimination à haut débit des liquides de stérilisation. Pour plus de clarté, les parties individuelles ne sont pas dessinées à l’échelle. La lettre (A) indique la pompe à vide, (B) la bouteille réservoir pour recueillir les liquides (éthanol, eau de Javel ou eau stérile), (C) la valve pour éviter le reflux des liquides, (D) la pointe stérile de la pipette de 200 μL, et (E) le tube de microcentrifugation de 1,5 mL contenant des graines et du liquide de stérilisation. Les flèches indiquent la direction du flux d’air. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Stérilisation de surface liquide à haut débit des semences
REMARQUE : La procédure globale et le temps minimal requis pour la stérilisation de surface des graines d’Arabidopsis thaliana (L.) Heynh de type sauvage (Col-0) (Arabidopsis) avec 96 échantillons indépendants sont résumés à la figure 2.
- Étiqueter avec un marqueur permanent deux lots de tubes de microcentrifugation de 48 x 1,5 mL avec des numéros progressifs.
- Ajouter 100-200 graines d’Arabidopsis à chacun des 96 tubes stériles de 1,5 mL de microcentrifugation (environ 1-2 mm au-dessus du fond de l’extrémité conique du tube).
- Aliquote environ 1000 μL d’éthanol à 70% dans chaque tube à l’aide d’une pipette sérologique stérile de 10 mL à l’intérieur de la hotte à flux laminaire (lot de graines un, 48 tubes) et fermez soigneusement les couvercles.
REMARQUE: La distribution des solutions n’a pas besoin d’être extrêmement précise, tant que le volume distribué est plusieurs fois supérieur au volume des graines. Alternativement, effectuez cette étape à l’extérieur de la hotte laminaire (état non stérile). - Agiter les tubes à une fréquence d’oscillation de 8,0 Hz pendant au moins 3 min dans un agitateur.
- Retirez les adaptateurs du shaker et transférez-les dans le panier d’une microcentrifugeuse de paillasse.
- Faites tourner rapidement les graines à l’aide de la fonction d’impulsion (présente dans la plupart des centrifugeuses de paillasse) pour atteindre 1880 x g (~ 15 s).
REMARQUE: Des forces de centrifugation plus longues ou plus élevées affectent négativement la germination des graines. - Transférez les 48 tubes des adaptateurs dans un rack et ouvrez tous les tubes sous la hotte à flux laminaire. Évitez les contaminations en ne touchant pas la partie des couvercles qui s’insère dans les tubes. Si les couvercles sont trop proches les uns des autres, divisez les tubes en deux racks pour une manipulation plus facile.
- Installez une pointe jaune stérile de 200 μL sur l’entrée de la vanne d’aquarium de l’aspirateur fait maison sous la hotte à flux laminaire et allumez la pompe.
- Insérez la pointe jaune juste au-dessus du niveau des graines pour éviter de toucher les graines lors de la succion du liquide. Alternativement, positionnez rapidement la pointe au bas du tube; si une graine bloque l’aspiration du liquide, éliminez la pointe jaune et insérez-en une nouvelle.
- Aliquote dans chaque tube environ 1000 μL d’eau de Javel à 5% à l’aide d’une pipette sérologique stérile de 10 mL à l’intérieur de la hotte à écoulement laminaire.
- Fermez hermétiquement tous les couvercles et remettez tous les tubes dans les adaptateurs de secoueur. Agiter les tubes à une fréquence d’oscillation de 8,0 Hz pendant au moins 3 min dans le shaker.
- Faites tourner rapidement les graines à l’aide de la fonction d’impulsion de la centrifugeuse de paillasse pendant le temps nécessaire pour atteindre 1880 x g (~ 15 s).
- Installez une nouvelle pointe jaune stérile de 200 μL sur la vanne de l’aquarium connectée à la pompe à vide sous la hotte à flux laminaire et allumez la pompe.
- Insérez la pointe jaune au-dessus du niveau des graines pour éviter de toucher les graines lors de la succion de la solution d’eau de Javel.
- Aliquote dans chaque tube environ 1000 μL deH2O stérilisé à l’aide d’une pipette sérologique stérile de 10 mL dans la hotte à écoulement laminaire.
REMARQUE: Combinez les deux lots de graines pour minimiser le temps de fonctionnement. - Installez une nouvelle pointe jaune stérile de 200 μL sur la vanne de l’aquarium connectée à la pompe à vide sous la hotte à flux laminaire et allumez la pompe.
- Insérez la pointe jaune juste au-dessus du niveau des graines pour éviter de toucher les graines lors de la succion du H2O.
- Aliquote dans chaque tube environ 500 μL deH2O stérilisé à l’aide d’une pipette sérologique stérile de 10 mL et fermer tous les couvercles de la hotte à écoulement laminaire. Les graines sont prêtes à être semées. Si nécessaire, maintenez les tubes à température ambiante pendant quelques heures maximum ou à 4 °C pendant la nuit.
- Remplissez la bouteille de réservoir utilisée pour recueillir le liquide avec une quantité adéquate d’eau et autoclavez-la. Ensuite, jetez le liquide dans un évier normal.
REMARQUE: Autoclavez le liquide pour tuer toutes les graines à l’intérieur du réservoir.
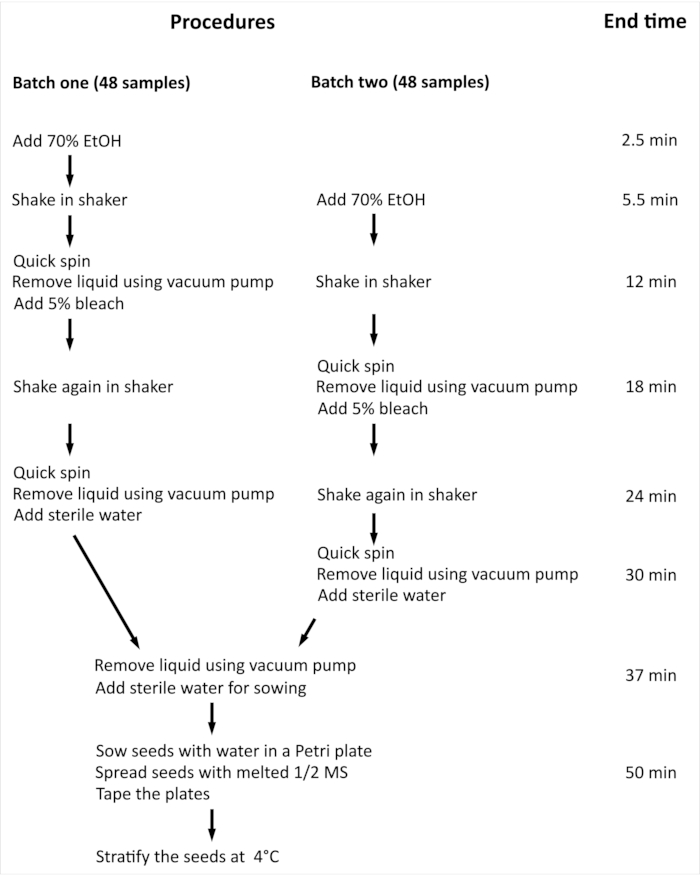
Figure 2: Vue d’ensemble de la procédure et temps minimal requis pour la stérilisation de surface des graines d’Arabidopsis avec 96 échantillons indépendants. Dans l’expérience présentée, 96 échantillons indépendants sont manipulés en deux lots de taille égale. L’ensemble de la procédure est le même pour les deux lots, et ils sont traités en parallèle, mais le lot deux est traité avec un délai d’une étape par rapport au lot un. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Placage et notation d’Arabidopsis sur 1/2 plaques MS
- Transférer les graines et 300-400 μL deH2Ostérile dans une boîte de Pétri par pipetage doux avec une pipette de 1000 μL.
- Après avoir transféré 10 tubes, verser dans chaque plaque environ 1,5 à 2,0 mL de milieu fondu 1/2 MS sans antibiotiques.
REMARQUE: Fondez à l’avance, puis conservez le milieu fondu 1/2 MS dans un bain thermostatique réglé à 50-53 ° C pour éviter la solidification. S’assurer que la température ne dépasse pas 58 °C pour éviter de diminuer la germinabilité des graines. - Faites tourbillonner rapidement la plaque pour répartir les graines à l’intérieur. Collez les plaques sur les côtés opposés.
- Enveloppez les assiettes dans une feuille de plastique ou d’aluminium, puis placez-les au réfrigérateur (4 °C) pendant 3 jours dans l’obscurité pour obtenir une germination uniforme.
- Transférer les plaques dans une chambre de croissance fixée à 23 °C dans des conditions de longue journée (16 h de lumière/8 h d’obscurité) avec une intensité lumineuse de 100-120 μmol·m-2·s-1 et 60 % d’humidité relative.
- Après deux jours, marquez les plantes par la présence de radicles. Détecter l’émergence de la radicle et la formation de cotylédon vert (ouverture complète des deux cotylédons) pour évaluer la germination des graines.
5. Analyses statistiques
REMARQUE: Ici, le test par paires de Tukey a été utilisé pour les analyses statistiques.
- Considérez les valeurs P inférieures à 0,01 comme statistiquement significatives. Effectuez toutes les expériences au moins avec cinq répliques biologiques.
Résultats
Afin d’évaluer le temps requis pour l’ensemble de la procédure de stérilisation des semences, les différences de temps pour la manipulation de liquides de 96 échantillons dans le protocole actuel ont été calculées et comparées aux méthodes de pipetage traditionnelles. Le résultat indique que le protocole actuel permet de gagner du temps, en réduisant le temps de manipulation du liquide à un quart de celui des protocoles traditionnels(tableau 1). Le tableau souligne en outre que le temps ...
Discussion
La stérilisation des graines est l’étape fondamentale des études fonctionnelles chez Arabidopsis. Bien qu’elle soit fréquemment réalisée à de nombreuses fins différentes, des études limitées sur la stérilisation de surface des semences à haut débit chez Arabidopsis sont disponibles.
Jusqu’à présent, l’une des méthodes avec le débit le plus élevé consiste à utiliser du chlore gazeux généré par le mélange d’eau de Javel avec du HCl concentré. Bien que cette mé...
Déclarations de divulgation
Tous les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Cette recherche a été financée par la province autonome de Trente grâce au financement de base du groupe Ecogenomics de la Fondazione E. Mach.
matériels
| Name | Company | Catalog Number | Comments |
| Aquarium valve | Amazon | B074CYC5SD | Kit including 2 valves and thin-walled tubings. The valve prevents the liquids to go back to the sterile tip |
| Arabidopsis Col-0 wild-type seeds | Nottingham Arabidopsis Stock Center | N1093 | Wild type seeds (sensitive to kanamycin) |
| Arabidopsis transgenic line AdoIspS-79 seeds | NA | NA | Transgenic line overexpressing an isoprene synthase gene from Arundo donax transformed in the Col-0 background, resistant to kanamycin (Li et al. (2017) Mol. Biol. Evol., 34, 2583–2599). Available on request from the authors |
| Microcentrifuge | Eppendorf | EP022628188 | Benchtop microcentrifuge used for spinning down the seeds |
| Murashige & Skoog medium including vitamins | Duchefa | M0222 | Standard medium for plant sterile culture |
| Pipette controller | Brand | 26300 | Used to operate the serological pipette |
| Polyethylene tube 1 | Roth | 9591.1 | Tube for connection from vacuum pump to decantation bottle (inner diameter: 7 mm; outer diameter: 9 mm) |
| Polyethylene tube 2 | Roth | 9587.1 | Tube for connection from decantation bottle to the aquarium valve (inner diameter: 5 mm; outer diameter: 7 mm) |
| Screw cap with connectors | Roth | PY86.1 | 2-way dispenser screw cap GL45 in polypropylene for decanting bottle |
| Serological pipette | Brand | 27823 | Graduated glass (reusable) serological pipette. Disposable pipettes can be used instead |
| Shakeret al. | Qiagen | 85300 | TissueLyser II bead mill used normally for tissue homogenization. Without the addition of beads to the tubes it works as shaker. |
| Technical ethanol | ITW Reagents (Nova Chimica Srl) | 212800 | Ethanol 96% v/v partially denatured technical grade |
| Tween 20 | Merck Millipore | 655205 | Non-ionic detergent acting as surfactant |
| Universal tubing connectors | Roth | Y523.1 | Can be used to improve/simplify tubing connections |
| Vacuum pump | Merck Millipore | WP6222050 | Used for making the suction device |
Références
- Somerville, C., Koornneef, M. A fortunate choice: The history of Arabidopsis as a model plant. Nature Reviews Genetics. 3 (11), 883-889 (2002).
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. Plant Journal. 61 (6), 909-921 (2010).
- Initiative, T. A. G. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283-2290 (1999).
- Speulman, E., et al. A two-component enhancer-inhibitor transposon mutagenesis system for functional analysis of the arabidopsis genome. Plant Cell. 11 (10), 1853-1866 (1999).
- Jander, G., et al. Ethylmethanesulfonate saturation mutagenesis in Arabidopsis to determine frequency of herbicide resistance. Plant Physiology. 131 (1), 139-146 (2003).
- Zhang, X., Henriques, R., Lin, S. -. S., Niu, Q. -. W., Chua, N. -. H. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method. Nature Protocols. 1 (2), 641-646 (2006).
- Togninalli, M., et al. AraPheno and the AraGWAS catalog 2020: A major database update including RNA-Seq and knock-out mutation data for Arabidopsis thaliana. Nucleic Acids Research. 48 (1), 1063-1068 (2020).
- Lan, Y., et al. AtMAD: Arabidopsis thaliana multi-omics association database. Nucleic Acids Research. 49 (1), 1445-1451 (2021).
- Xu, J., Trainotti, L., Li, M., Varotto, C. Overexpression of isoprene synthase affects ABA-and drought-related gene expression and enhances tolerance to abiotic stress. International Journal of Molecular Sciences. 21 (12), 1-21 (2020).
- Czarnecki, O., et al. Simultaneous knock-down of six non-family genes using a single synthetic RNAi fragment in Arabidopsis thaliana. Plant Methods. 12 (1), 1-11 (2016).
- Yan, L., et al. high-efficiency genome editing in arabidopsis using YAO promoter-driven CRISPR/Cas9 system. Molecular Plant. 8 (12), 1820-1823 (2015).
- Liu, Y., Gao, Y., Gao, Y., Zhang, Q. Targeted deletion of floral development genes in Arabidopsis with CRISPR/Cas9 using the RNA endoribonuclease Csy4 processing system. Horticulture Research. 6 (1), (2019).
- Grefen, C., et al. Subcellular localization and in vivo interactions of the Arabidopsis thaliana ethylene receptor family members. Molecular Plant. 1 (2), 308-320 (2008).
- Gazzani, S., et al. Evolution of MIR168 paralogs in Brassicaceae. BMC Evolutionary Biology. 9 (1), (2009).
- Lee, S., Korban, S. S. Transcriptional regulation of Arabidopsis thaliana phytochelatin synthase (AtPCS1) by cadmium during early stages of plant development. Planta. 215 (4), 689-693 (2002).
- Long, Y., et al. In vivo FRET-FLIM reveals cell-type-specific protein interactions in Arabidopsis roots. Nature. 548 (7665), 97-102 (2017).
- Freire-Rios, A., et al. Architecture of DNA elements mediating ARF transcription factor binding and auxin-responsive gene expression in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24557-24566 (2020).
- Rivero, L., et al. Handling arabidopsis plants: Growth, preservation of seeds, transformation, and genetic crosses. Methods in Molecular Biology. 1062, 3-25 (2014).
- Chen, J. H., et al. Drought and salt stress tolerance of an arabidopsis glutathione S-transferase U17 knock-out mutant are attributed to the combined effect of glutathione and abscisic acid. Plant Physiology. 158 (1), 340-351 (2012).
- Li, D. Z., et al. Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants. Proceedings of the National Academy of Sciences of the United States of America. 108 (49), 19641-19646 (2011).
- Mathur, J., Koncz, C. Establishment and maintenance of cell suspension cultures. Arabidopsis Protocols. Methods in Molecular Biology. 82, 27-30 (1998).
- Li, M., Cappellin, L., Xu, J., Biasioli, F., Varotto, C. High-throughput screening for in planta characterization of VOC biosynthetic genes by PTR-ToF-MS. Journal of Plant Research. 133 (1), 123-131 (2020).
- Li, M., et al. In planta recapitulation of isoprene synthase evolution from ocimene synthases. Molecular Biology and Evolution. 34 (10), 2583-2599 (2017).
- Li, M., et al. Evolution of isoprene emission in Arecaceae (palms). Evolutionary Applications. 14, 902-914 (2020).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods in Molecular Biology. 343, 87-104 (2006).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Tkacz, A., Cheema, J., Chandra, G., Grant, A., Poole, P. S. Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition. ISME Journal. 9 (11), 2349-2359 (2015).
- Singh, N., Gaddam, S. R., Singh, D., Trivedi, P. K. Regulation of arsenic stress response by ethylene biosynthesis and signaling in Arabidopsis thaliana. Environmental and Experimental Botany. 185, 104408 (2021).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized method for high-throughput sterilization of Arabidopsis seeds. Journal of Visualized Experiments: JOVE. (128), e56587 (2017).
- Acemi, A., Özen, F. Optimization of in vitro asymbiotic seed germination protocol for Serapias vomeracea. The EuroBiotech Journal. 3 (3), 143-151 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon