Method Article
L’uvéite mycobactérienne amorcée (UMP) comme modèle pour l’uvéite post-infectieuse
Dans cet article
Résumé
Ce protocole décrit les étapes pour induire une uvéite mycobactérienne amorcée (PMU) chez la souris. Cette méthode décrit les étapes pour aider à produire une inflammation oculaire fiable et robuste dans le système de modèle murin. En utilisant ce protocole, nous avons généré des yeux uvéitiques et des yeux non enflammés à partir d’animaux uniques pour une évaluation plus approfondie avec des tests immunologiques, transcriptomiques et protéomiques.
Résumé
Le terme « uvéite » décrit un ensemble hétérogène de conditions qui présentent toutes une inflammation intraoculaire. De manière générale, l’uvéite est définie par étiologie: infection ou auto-immunité. L’uvéite infectieuse nécessite un traitement avec les agents antimicrobiens appropriés, tandis que l’uvéite auto-immune nécessite un traitement avec des corticostéroïdes ou d’autres agents immunosuppresseurs. L’uvéite post-infectieuse est une forme d’uvéite chronique qui nécessite des corticostéroïdes pour contrôler les séquelles immunitaires suivant l’infection initiale. L’uvéite associée à une infection à Mycobacterium tuberculosis (Mtb) est une forme bien connue d’uvéite post-infectieuse, mais les mécanismes de la maladie ne sont pas entièrement compris. Pour comprendre le rôle que jouent les antigènes mycobactériens et les ligands innés dans la stimulation de l’inflammation oculaire chronique après une infection à tuberculose m, le modèle d’uvéite mycobactérienne amorcée (UMP) a été développé pour être utilisé chez la souris. Ce manuscrit décrit les méthodes de génération de PMU et de surveillance de l’évolution clinique de l’inflammation à l’aide du fond d’œil des couleurs et de la tomographie par cohérence optique (OCT). La PMU est induite par l’immunisation avec un extrait mycobactérien tué par la chaleur, suivie d’une injection intravitréenne du même extrait dans un œil sept jours plus tard. L’inflammation oculaire est surveillée longitudinalement à l’aide de l’imagerie in vivo et suivie d’un prélèvement d’échantillons pour un large éventail de tests, y compris l’histologie, la cytométrie en flux, l’analyse des cytokines, la qPCR ou le séquençage de l’ARNm. Le modèle murin de PMU est un nouvel outil utile pour étudier les réponses oculaires à la tuberculose m, le mécanisme de l’uvéite chronique et pour les tests d’efficacité précliniques de nouvelles thérapies anti-inflammatoires.
Introduction
Le terme « uvéite » décrit un ensemble hétérogène de conditions qui présentent toutes une inflammation intraoculaire1. Les modèles animaux d’uvéite sont importants pour comprendre les mécanismes de la maladie et pour les essais précliniques de nouvelles thérapies. Un certain nombre de modèles animaux d’uvéite ont été établis2. Les deux qui ont été les plus étudiées sont l’uvéite auto-immune expérimentale (ou uvéorétinite; EAU) et l’uvéite induite par les endotoxines (EIU). L’EAU est généralement générée par l’immunisation avec des antigènes oculaires ou peut survenir spontanément lorsque la tolérance centrale est perturbée en l’absence du gène AIRE 3,4. D’autres variantes du modèle ont depuis été développées 5,6,7 pour inclure différents peptides uveitogènes; Ceux-ci ont fait l’objet d’un examen approfondi 8,9,10. L’EAU est le principal modèle pour les formes d’uvéite auto-immune dépendante des lymphocytes T telles que la maladie de Vogt-Koyanagi-Harada et la choriorétinite chez l’homme. L’EIU est générée par injection systémique ou locale de lipopolysaccharide bactérien (LPS)10,11. EIU a été utilisé comme modèle d’uvéite aiguë générée par l’activation des voies de signalisation immunitaire innées12. Les deux modèles ont joué un rôle déterminant dans la compréhension actuelle de l’immunologie oculaire, mais aucun ne sont des modèles efficaces pour l’uvéite chronique post-infectieuse. Récemment établi chez la souris, le modèle d’uvéite mycobactérienne amorcée (PMU) fournit maintenant une approche pour interroger et évaluer les aspects cliniques et cellulaires de cette forme d’uvéite13.
La prévalence de l’infection mycobactérienne est élevée dans le monde, avec plus de 10 millions de nouveaux cas et plus de 1,4 million de décès signalés par l’Organisation mondiale de la santé en 201914. La manifestation extrapulmonaire de la tuberculose active (TB) comprend l’uvéite et est une cause bien connue d’uvéite infectieuse15,16. Les manifestations de l’uvéite associée à la tuberculose sont protéiformes, ce qui reflète probablement de multiples mécanismes distincts de la maladie, y compris une infection oculaire directe ainsi qu’une inflammation à médiation immunitaire moins bien comprise17,18,19. Les mécanismes proposés pour ces séquelles post-infectieuses comprennent une réponse inflammatoire chronique stimulée par la persistance d’une infection pauci-bacillaire dans l’épithélium pigmentaire rétinien (EPR), une réponse inflammatoire chronique stimulée par la présence de profils moléculaires associés à des agents pathogènes résiduels (PAMP) provenant d’une infection oculaire éliminée avec succès, et une activation inappropriée de la réponse immunitaire adaptative contre les antigènes oculaires par un processus de mimétisme moléculaire ou d’antigène propagation causée par une infection tuberculeuse systémique20,21,22,23.
Afin d’acquérir une meilleure compréhension mécaniste de l’uvéite chronique post-infectieuse et d’étudier le rôle des antigènes mycobactériens dans l’initiation de la maladie, le modèle PMU a été développé pour une utilisation chez la souris13,24. En conséquence, pour provoquer une inflammation, la souris reçoit d’abord une injection sous-cutanée d’antigène de la souche H37Ra de Mycobacterium tuberculosis tuée par la chaleur pour imiter l’infection systémique, suivie sept jours plus tard par injection intravitréenne du même antigène administré à l’œil gauche ou droit pour imiter l’infection oculaire locale. L’intensité et la durée de l’uvéite qui s’ensuit sont surveillées par tomographie longitudinale par cohérence optique (OCT) in vivo et imagerie fundique de l’œil25. La PMU est caractérisée par une panuvéite aiguë à dominante myéloïde qui se développe en une uvéite postérieure chronique à dominante lymphocytes T avec vitrite, inflammation périvasculaire de la rétine et zones focales de lésions rétiniennes externes26. La présence d’une inflammation granulomateuse dans le segment postérieur de l’œil suggère que le modèle PMU peut être utilisé pour étudier certaines formes d’uvéite antérieure (granulomateuse et non granulomateuse) et intermédiaire, observées chez des patients présentant des signes immunologiques d’infection passée à Mtb27. De plus, il a été suggéré que les composants du Mtb tué par la chaleur utilisés dans le modèle PMU déclenchent des réponses immunitaires sous-jacentes aux aspects de l’uvéite récurrente chez les patients atteints de tuberculose oculaire qui répondent au traitement antituberculeux (ATT)28. En raison des différences dans l’initiation de la maladie et l’évolution inflammatoire par rapport à l’EAU et à l’EIU, le PMU représente un nouveau modèle animal d’uvéite qui ne dépend pas de l’immunisation avec des antigènes oculaires et peut aider à élucider les mécanismes de la maladie chez les patients atteints d’uvéite chronique. Ce protocole décrit les méthodes de génération de PMU, de surveillance de l’évolution clinique de l’inflammation et de collecte d’échantillons oculaires pour analyse post-mortem par cytométrie de flux.
Protocole
Toutes les procédures effectuées ont été approuvées localement par le Comité de soin et d’utilisation des animaux de l’Université de Washington (protocole d’étude animale # 4481-02) ou en conformité avec la licence du ministère de l’Intérieur du Royaume-Uni (PPL 30/3281) et le groupe d’examen éthique de l’Université de Bristol. Les expériences menées dans les deux institutions concordaient avec la déclaration de l’Association for Research in Vision and Ophthalmology (ARVO) pour l’utilisation des animaux dans la recherche ophtalmique et visuelle. La PMU a été générée chez des souris C57BL/6J âgées de 6 à 10 semaines; toutes les souris pesaient au moins 18 g au moment de l’induction de l’uvéite et ont été confirmées négatives pour la mutation rd8 du gène Crb129. Les souris ont été maintenues avec du chow standard et de l’eau médicamenteuse (acétaminophène 200-300 mg / kg / jour) ad libitum dans des conditions spécifiques exemptes d’agents pathogènes. L’euthanasie animale a été réalisée à l’aide d’une méthode standard d’inhalation de dioxydede carbone 30.
1. Préparation d’antigène pour injection sous-cutanée
- Effectuez toutes les procédures de cette section à l’intérieur d’une hotte chimique pour éviter l’inhalation ou le contact cutané avec la poudre Mtb H37Ra. Manipulez selon les politiques de votre établissement pour l’adjuvant de Freund complet (généralement BSL-1). Cela comprend l’utilisation de gants résistant aux produits chimiques, de lunettes de sécurité et de vêtements de travail de protection (blouse de laboratoire).
- Utilisez une bonne technique stérile pour prévenir la contamination des réactifs qui seront introduits dans les animaux de laboratoire.
- Fabriquer la suspension de Mtb dans du PBS en mélangeant 5 mg de poudre H37Ra de M. tuberculosis lyophilisée et tuée par la chaleur avec 2,5 mL de PBS froid dans un tube microcentrifuge de 5 mL. Vortex une fois pendant 30 s, puis placer sur la glace.
- Pour générer une suspension fine du H37Ra dans PBS, sonicer la suspension sur glace pendant 5 min.
- Détachez le corps du convertisseur et nettoyez la sonde avec un tampon imbibé d’alcool à 70 % (v/v).
- Allumez le sonicateur, réglez le réglage de puissance sur 4 en tournant le bouton de contrôle de puissance et immergez la pointe de la sonde dans la poudre mycobactérienne contenant du PBS. Assurez-vous que l’extrémité de la sonde est immergée à au moins la moitié de la profondeur de l’échantillon et que l’extrémité de la sonde ne touche pas la paroi du tube de microcentrifugeuse.
- Sonicer le mélange sur glace pendant 30 s, arrêter 30 s et répéter pendant un total de 5 minutes pour disperser complètement la poudre en une suspension uniforme sans chauffer le liquide.
- Ajouter 2,5 ml d’adjuvant incomplet de Freund au mélange et répéter le processus de sonication sur la glace jusqu’à ce que l’émulsion forme une consistance semblable à celle d’un dentifrice.
- Réglez l’alimentation sur 0 à l’aide du bouton de commande et éteignez l’appareil pour mettre fin à la sonication. Retirez l’embout de la suspension et essuyez la sonde avec un tampon imbibé d’alcool.
- Conserver l’émulsion antigénique à 4 °C. La fabrication de lots de l’émulsion aidera à assurer la cohérence entre les expériences. L’émulsion peut être conservée à 4 °C jusqu’à 3 mois.
2. Injection sous-cutanée
- Effectuer l’injection sous-cutanée une semaine avant l’injection intravitréenne (désignée comme jour -7).
- Chargez une seringue de 1 mL (sans aiguille) avec l’émulsion mycobactérienne. En raison de la viscosité et de l’opacité de l’émulsion, des bulles d’air difficiles à voir peuvent remplir la seringue.
- Pour éviter les bulles d’air dans la seringue, après avoir chargé 0,2 à 0,3 mL d’émulsion, inverser la seringue (pointe vers le haut) et tapoter doucement la seringue à plusieurs reprises sur le bord d’un compteur pour ramener les bulles à la surface.
- Expulsez l’air de la seringue et continuez à remplir la seringue. Retourner et tapoter par intermittence jusqu’à remplissage.
- Placez une aiguille de 25 G sur la seringue et avancez l’émulsion pour remplir l’aiguille. Conservez la seringue sur de la glace jusqu’à ce qu’elle soit utilisée.
- Pour effectuer l’injection sous-cutanée en toute sécurité, anesthésiez la souris ou utilisez des méthodes de contention sans cruauté qui permettent un accès facile à l’arrière-train de l’animal31.
- Pour anesthésier en vue d’une injection sous-cutanée, placer l’animal dans une chambre d’induction d’isoflurane (3 % à 4 % pour l’induction et 1 % à 3 % pour l’entretien). Une fois anesthésiée, assurez-vous que la souris a une fréquence respiratoire lente et ne présente aucun signe de détresse respiratoire.
- Placez les injections sous-cutanées sur la surface dorsale des hanches ou sur la surface ventrale des jambes proximale à la région des ganglions lymphatiques inguinaux.
- Insérez soigneusement l’aiguille pour éviter l’injection dans le muscle. Injecter 0,05 mL de l’émulsion Mtb dans l’espace sous-cutané. Ne retirez pas l’aiguille immédiatement afin de permettre à l’émulsion épaisse d’être complètement injectée.
- Répéter l’injection sur les côtés gauche et droit pour un total de 0,1 mL par animal.
- Si elle est anesthésiée, placez la souris sur un coussin chauffant chaud jusqu’à récupération complète. Ne laissez pas la souris sans surveillance jusqu’à ce qu’elle ait repris suffisamment conscience pour maintenir la position couchée sternale.
- Remettez la souris dans sa cage une fois la récupération complète et étiquetez la carte de la cage avec la date d’injection sous-cutanée.
- Fournir de l’analgésie avec de l’acétaminophène oral (200 mg / kg / jour), mais pas d’AINS, car les agents anti-inflammatoires peuvent avoir un impact sur l’induction de l’uvéite.
3. Préparation du stock d’antigènes pour injection intravitréenne
- Effectuer toutes les procédures décrites dans cette section dans des conditions stériles appropriées pour prévenir la contamination de la suspension intravitréenne de Mtb.
- Faire les suspensions intravitréennes.
- Pour l’induction d’une panuvéite légère à modérée, préparer la suspension intravitréenne à une concentration de 5 mg / mL en ajoutant 5 mg de l’extrait de mycobactéries à 1 mL de 1x PBS.
- Pour l’induction d’une panuvéite modérée à sévère, préparer la suspension intravitréenne à une concentration de 10 mg/mL en ajoutant 10 mg d’extrait de mycobactéries à 1 mL de 1x PBS.
- Vortex une fois pendant 30 s, puis placer sur la glace.
- Pour générer une suspension fine du H37Ra dans PBS, sonicer la suspension sur glace pendant 10 minutes comme décrit à l’étape 1.4. Aliquote cette solution mère dans des volumes de 100 μL et conserver à -20 °C.
- Avant utilisation, décongeler à température ambiante et vortex à puissance élevée pendant 1 min. Conservez les aliquotes sur la glace pendant le transport vers l’animalerie.
4. Procédure d’injection intravitréenne au jour 0
- Préparation des animaux
- Portez des gants d’examen ajustés, placez la souris sur une balance de pesée pour obtenir son poids en grammes.
- Administrer une injection intrapéritonéale de 0,02 mL/g de poids corporel d’une solution contenant 100 mg/mL de kétamine et 20 mg/mL de xylazine mélangée à de l’eau stérile pour anesthésier l’animal. Une autre approche comprend l’induction à l’aide de ~1,5 % d’isoflurane (inhalé).
- Attendez environ 2 minutes que la souris s’endorme, puis placez la souris dans une boîte chauffante et couvrez le couvercle. Effectuer des tests réflexes de la douleur comme le pincement des oreilles, des orteils et de la queue pour évaluer la profondeur de l’anesthésie pour la procédure32.
- Une fois endormi, anesthésiez la cornée avec 1 goutte de tétracaïne à 0,5% (v/v). Évitez d’avoir de la tétracaïne près du nez ou de la bouche de la souris. Après 10 s, tamponner l’excès de liquide.
REMARQUE: Il a été observé que la dilatation de l’iris et la visualisation de la chambre antérieure (CA) sont améliorées lorsque l’anesthésie topique est administrée, peut-être en raison de l’amélioration de la suppression des réflexes cornéens avec l’anesthésie systémique et topique combinée. Cependant, cette étape pourrait être omise si vous le souhaitez. - Dilater la pupille avec 1 goutte de phényléphrine à 2,5% (v/v). Soyez prudent pour éviter tout excès de gouttelettes qui pourraient pénétrer dans le nez ou la bouche. Après 2-3 min, tamponnez l’excès de liquide.
- Pour diminuer le risque d’endophtalmie, ajoutez 1 goutte de bétadine à 5% à la surface des yeux et des cheveux environnants. Laisser sur l’œil pendant 2-3 min.
REMARQUE : Effectuer toutes les procédures décrites dans cette section dans des conditions stériles appropriées pour prévenir l’endophtalmie. - Retirer la bétadine et couvrir l’œil avec de l’hypromellose (0,3%) ou du gel pour les yeux de carbomère 0,2% p/p) pour prévenir la sécheresse sous anesthésie. Cela aidera également à prévenir la formation de cataracte.
- Mise en place du système de micro-injection
- Effectuer l’injection intravitréenne à l’aide d’une micropompe connectée à un contrôleur de pompe à microseringue et à une seringue d’injection (Figure 1A-C). Sinon, injecter avec une aiguille de 33 G fixée à une seringue Hamilton comme décrit à la sous-section 4.4.
- Connectez une aiguille de 34 G au support d’injection pour assembler l’injecteur. Desserrez le bouchon à vis argenté à l’extrémité avant du support d’injection et glissez l’aiguille dans le corps du support à peu près à mi-chemin. Serrez le bouchon à vis argenté avec le doigt.
- Raccordez le tube au support d’injection comme mentionné aux étapes 4.2.4-4.2.5.
- Pour insérer le tube sur le support d’injection, desserrez la vis en plastique à l’arrière du support, faites glisser le tube à travers le joint à l’intérieur et serrez la vis.
- Maintenez un léger espace avec l’extrémité de la tubulure pour éviter d’endommager la tubulure pendant l’injection. Voir la figure 1C.
- Décongeler une partie aliquote de 100 μL de la suspension mère de mycobacterium.
- Ajouter 3 μL d’une solution de fluorescéine sodique à 1% (AK-Fluor) et bien vortex.
- Charger une seringue de 10 μL avec le mélange antigène et fluorescéine sans inclure de bulles d’air.
- Retirez l’aiguille de chargement de la seringue et faites glisser le tube à travers le joint du bouchon à vis argenté jusqu’à ce que l’embout atteigne la marque zéro dans le corps de la seringue.
- Une fois que la pointe du tube est correctement alignée à la position souhaitée, serrez fermement le bouchon à vis.
- Rincer la solution dans la seringue à travers le tube d’injection pour charger complètement le système. Répétez ensuite les étapes 4.2.8-4.2.11 pour recharger la seringue pour injection.
- Pour installer la seringue chargée sur la micropompe, appuyez sur le bouton de déverrouillage de la pince à l’extrémité de la micropompe pour ouvrir les pinces de seringue.
- Placez le capuchon du piston dans le porte-capuchon du piston à l’extrémité arrière de la micropompe.
- Ensuite, faites glisser le collier de la seringue sur la butée du collier et le corps de la seringue dans la pince de la seringue.
- Relâchez le bouton de serrage et serrez la vis de retenue du piston. Voir la figure 1D.
- Faites glisser le porte-injection et l’aiguille à travers la pince o de l’appareil d’injection stéréotaxique. Il s’agit d’une plate-forme personnalisée; Alternativement, la seringue peut être tenue et positionnée manuellement.
- Régler le volume de perfusion et le débit de perfusion sur le contrôleur de la pompe à microseringue pour injecter 500 nL par cycle à un débit de 40 nL/s, respectivement.
REMARQUE: Des taux d’injection plus rapides peuvent être utilisés, cependant, plus de reflux peut être ressenti avant que le repositionnement de l’aiguille puisse être réalisé. - Testez le système pour vous assurer de son bon fonctionnement avant d’effectuer une injection intravitréenne.
REMARQUE: Lorsque le système d’injection fonctionne correctement, l’activation d’un cycle d’injection à l’aide de la pédale ou du pavé de commande produira un mouvement visible du porte-capuchon du piston et une petite gouttelette de liquide verdâtre sera vue à l’extrémité de l’aiguille. Dans le cas où aucun liquide n’est produit, activer des cycles supplémentaires ou rincer et recharger la seringue. - Avant d’injecter l’œil, essuyez doucement l’aiguille avec un tampon d’éthanol à 95%.
- Procédure d’injection intravitréenne
- La souris est placée sur un appareil stéréotaxique pour effectuer la procédure d’injection.
- Gardez la scène / plate-forme sur laquelle la souris repose au chaud en attachant 2-3 serviettes en papier sur sa surface.
- Placez la souris en position couchée sur la plate-forme. Utilisez les barres d’oreille droite et gauche pour fixer doucement la tête de l’animal. Voir la figure 1E.
- Positionnez la souris et orientez-la sous la lunette de sorte que l’aspect nasal supérieur de l’œil droit soit visible.
- Utilisez une aiguille de 30 G pour déplacer les cils et exposer la sclérotique. Visualisez le limbe et le vaisseau sanguin radial.
- Utilisez une aiguille stérile de 30 G pour faire un trou de guidage dans la sclérotique de 1 à 2 mm postérieure au limbe.
- Insérez l’aiguille de 34 G fixée au porte-injection dans l’œil à travers le trou de guidage à un angle qui évitera la lentille, mais placez la pointe de l’aiguille dans la cavité vitrée.
- À l’aide du contrôleur de pompe à microseringue, injectez délicatement 1 μL d’extrait de Mtb dans la cavité vitrée. En cas de reflux constant, augmenter le volume d’injection à 1,5 μL pour assurer une administration adéquate de la dose.
REMARQUE: Pour les contrôles fictifs, injecter 1 μL de PBS dans l’œil de l’animal. - Vérifier le placement intravitréen par visualisation d’un réflexe verdâtre dans l’œil. Voir la figure 1F.
- Après 10 s, retirez l’aiguille de l’œil. Notez tout reflux.
- Retirez la souris de la plate-forme, placez 0,3% d’hypromellose ou 0,2% p/p de pommade pour les yeux en carbomère sur les deux yeux pour la protection de la cornée, et passez à la boîte de réchauffement de récupération.
- Ne laissez pas la souris sans surveillance jusqu’à ce qu’elle ait repris suffisamment conscience pour maintenir la position couchée sternale. Ne retournez pas en compagnie d’autres animaux avant d’être complètement rétablis.
- Lorsque la souris est complètement réveillée, retourner dans la cage et ajouter une bouteille d’eau médicamenteuse d’acétaminophène (200-300 mg / kg / jour). Étiquetez la carte de cage avec la date d’injection IVT.
- Les injections intravitréennes sont généralement bien tolérées. Les signes cliniques qui peuvent indiquer la douleur et la nécessité de le retirer de l’étude comprennent l’alopécie périoculaire (indiquant un autotraumatisme), l’ulcération cornéenne, la perte de poids et la posture voûtée.
- Méthode alternative pour l’injection intravitréenne
REMARQUE: Cette procédure est effectuée à l’aide d’un microscope opératoire et d’une aiguille de 33 G sur une microseringue.- Proptose l’œil et maintenez-le en position avec une paire de pinces.
- Appliquez ensuite le gel pour les yeux carbomère à 0,2 % p/p ou le gel pour les yeux à 0,3 % d’hypromellose et placez un couvercle circulaire (7 mm de diamètre) sur l’œil.
- Montez une aiguille hypodermique de 33 G sur une seringue Hamilton de 5 μL et insérez-la circonférentielle d’environ 2 mm au limbe cornéen avec un angle d’injection de ~45°.
- Guidez le biseau de l’aiguille dans le vitré, en vous arrêtant entre le cristallin et le disque optique (du point de vue relatif du chirurgien, celui-ci est au-dessus / couvrant le disque optique - à environ 1,5 mm du site d’insertion), et injectez 2 μL de Mtb (à 2,5 μL dans PBS) lentement.
- Maintenez brièvement l’aiguille en place (pour réduire la quantité de reflux d’injecter), puis retirez-la.
- Après l’injection, reposez le globe en relâchant les forceps. Une goutte de 1% p/p de pommade au chloramphénicol peut être administrée à l’œil à ce moment-là pour fournir une protection supplémentaire contre l’endophtalmie post-injection.
- Après l’injection, passer à la boîte de réchauffement de récupération comme mentionné aux étapes 4.3.11-4.3.13.
5. Imagerie OCT pour détecter et quantifier l’uvéite
- Préparation des animaux
- Anesthésiez la souris comme décrit aux étapes 4.1.2-4.1.4
- Dilater la pupille avec 1 goutte de phényléphrine à 2,5%. Soyez prudent pour éviter tout excès de gouttelettes qui pourraient pénétrer dans le nez ou la bouche. Après 2-3 minutes, tamponnez l’excès de liquide.
- Placez 0,3 % d’hypromellose ou 0,2 % p/p de gel carbomère sur l’œil pour prévenir la sécheresse sous anesthésie. Cela aidera également à prévenir la formation de cataracte.
- Enveloppez la souris dans une couche de gaze chirurgicale pour maintenir la chaleur corporelle et placez-la sur la cassette de l’animal. Positionnez la tête avec la barre de morsure.
- Acquérir les images OCT des chambres antérieure et postérieure.
REMARQUE: Si vous obtenez des images de la chambre antérieure et postérieure, obtenez d’abord les images de la chambre postérieure (PC) pour éviter la dégradation de l’image après la formation de la cataracte. La formation de cataracte peut être évitée par une lubrification fréquente et l’application de 0,3% d’hypromellose ou de gel pour les yeux de carbomère à 0,2% p/p. Pour une imagerie prolongée (>10 min), garder la souris au chaud (grâce à l’utilisation d’un coussin chauffant) aide également.- Après avoir allumé le système d’imagerie OCT, fixez la lentille d’imagerie appropriée et ajustez la position du bras de référence si nécessaire.
- Ouvrez le logiciel de création d’images, créez l’ID de souris unique et commencez la création d’images conformément au protocole du fabricant de l’OCT.
- En utilisant l’option Free Run avec le protocole de balayage rapide, positionnez l’œil avec le nerf optique centré sur les images de la chambre postérieure ou l’apex de la cornée sur les images de la chambre antérieure.
REMARQUE : Le tableau 1 contient les paramètres du protocole d’imagerie pour deux systèmes d’imagerie pour petits animaux disponibles sur le marché. Reportez-vous au tableau des matériaux pour connaître les spécifications du produit. - Pour l’imagerie de la chambre postérieure, rapprochez l’OCT de la surface de l’œil. Soyez prudent pour éviter de mettre la surface de la lentille en contact avec l’œil.
- Une fois que l’œil est correctement positionné, arrêtez l’analyse rapide et sélectionnez le protocole de balayage du volume, puis activez l’analyse avec l’option Viser .
- Pour les images du segment postérieur, ajuster jusqu’à ce que le nerf optique soit centré dans l’image d’alignement horizontal B-Scan et que la rétine soit alignée avec l’axe d’alignement vertical
- Pour les images du segment antérieur, ajustez la position pour centrer l’apex de la cornée dans l’image d’alignement horizontal B-Scan et d’alignement vertical B-Scan. La présence d’un artefact de réflexion dans les deux images confirmera le bon alignement. Déplacez ensuite suffisamment l’image horizontale pour supprimer l’artefact de réflexion. Reportez-vous à la figure 2.
- Cliquez sur Snapshot pour capturer l’image de numérisation du volume, puis cliquez sur Enregistrer.
- Ensuite, obtenez le balayage moyen du cathéter central. Ouvrez le protocole d’analyse et cliquez sur Aim suivi de Snapshot. Cliquez avec le bouton droit sur le même panneau, puis cliquez sur Moyenne.
- Répétez les étapes 5.2.1-5.2.9 pour chaque œil avec les deux lentilles.
- Une fois toutes les images collectées, retirez la souris de la cassette et assurez la protection de la cornée pendant la récupération, comme indiqué aux étapes 4.3.11 à 4.3.13.
6. Évaluation de l’inflammation par OCT
- Noter les images de l’OCT à l’aide de niveleuses qui sont masquées par l’état de traitement.
REMARQUE : Pour les PMU du modèle murin, le système de notation fourni dans le tableau 2 est recommandé. - Si des images de la chambre antérieure (AC) et de la chambre postérieure (PC) ont été obtenues, combinez ces scores pour obtenir le score final pour chaque œil.
REMARQUE: L’inflammation de la chambre antérieure disparaît avant l’inflammation de la chambre postérieure.
7. Évaluation de l’inflammation par histologie post-mortem
- À la fin de l’expérience, prélever les yeux individuels par énucléation, fixer 4% de formaldéhyde pendant la nuit et procéder à l’incorporation de paraffine, à la section et à la coloration H & E33.
REMARQUE: Plusieurs sections de 4 à 8 μm le long de l’axe du nerf pupillaire-optique sont recommandées.
REMARQUE : Trois sections par œil sont notées par un niveleuse masqué à l’aide du système de notation fourni dans le tableau 3, et le score moyen des trois sections est indiqué comme le score final d’inflammation histologique.
Résultats
Ce protocole démontre l’induction de l’uvéite chez la souris à l’aide du modèle d’uvéite mycobactérienne amorcée (PMU). Assurer la cohérence de l’injection sous-cutanée et la précision de l’injection intravitréenne sont des étapes clés dans le développement du modèle d’uvéite mycobactérienne amorcée (PMU). La figure 1 illustre la procédure d’injection intravitréenne de souris à l’aide d’un appareil stéréotaxique. Les barres d’oreille aident à positionner doucement la tête au même endroit sous le microscope (Figure 1E). Ils maintiennent également la tête stable pendant la procédure d’injection intravitréenne, ce qui diminue le risque de traumatisme par injection. Après une injection réussie, la fluorescéine dans la solution d’injection produit une réflexion verdâtre de l’intérieur de l’œil qui peut être vue au microscope ou d’une vue latérale comme illustré à la figure 1F.
Lorsqu’il est exécuté comme décrit, le protocole génère une uvéite aiguë robuste qui peut être détectée à l’aide de l’OCT et de l’imagerie du fond d’œil dès 10 heures après l’injection intravitréenne. La figure 2 montre l’alignement correct de l’œil pour l’imagerie OCT. Le tableau 1A énumère les paramètres utilisés dans le protocole OCT. Une approche systématique pour obtenir des images fournira des images de haute qualité qui pourront être comparées au fil du temps. Les images de la chambre antérieure sont centrées sur l’apex de la cornée à l’aide de l’image SLO en face (Figure 2A) avec l’iris aligné parallèlement aux plans horizontal et vertical (Figure 2B,C). Les balayages de volume et de ligne sont capturés avec un alignement vertical de sorte que les régions inférieures et supérieures peuvent être visualisées simultanément. Les images du segment postérieur sont centrées sur le nerf optique à l’aide de l’image SLO en face (Figure 2D), et la bande lumineuse de l’EPR est utilisée pour aligner la rétine parallèlement aux plans horizontal et vertical (Figure 2E,F).
La figure 3 montre les résultats typiques de l’inflammation oculaire PMU à l’aide de l’imagerie OCT. Vingt-quatre heures après l’injection intravitréenne, des cellules inflammatoires sont observées dans l’aqueux et le vitré (Figure 3B). En présence d’une inflammation modérée ou sévère, un hypopyon sera vu dans l’angle inférieur dans le climatiseur. Le degré d’inflammation oculaire peut être évalué sur ces images de TCO à l’aide des critères énumérés dans le tableau 2. Des exemples représentatifs d’images démontrant les caractéristiques inflammatoires typiques de chaque score sont présentés à la figure 4. Les scores de chambre AC et PC peuvent être additionnés pour générer le score OCT combiné. Les scores combinés >0 mais ≤2,5 représentent une inflammation légère. L’inflammation modérée est déterminée par les scores >2,5 mais ≤4,5. Les scores >4,5 identifient une inflammation sévère. L’inflammation culmine généralement 48 heures après l’injection intravitréenne avec des scores OCT dans le CA et le PC entre 1 et 3 (scores combinés entre 2 et 6). Les scores AC et PC de 0,5 ou 4 sont moins fréquents. Dans le cas où les scores en dehors de la plage typique sont fréquemment rencontrés, un dépannage peut être nécessaire pour identifier les facteurs contribuant aux scores aberrants (voir la section discussion). Les scores d’inflammation dans la chambre antérieure ont tendance à revenir à zéro dans la semaine suivant l’injection intravitréenne. En revanche, les scores postérieurs ne reviennent pas à zéro; Au lieu de cela, une inflammation chronique de faible intensité persiste sous forme de vitrite et des lymphocytes périvasculaires s’infiltrent dans la rétine pendant 1 à 2 mois après l’injection intravitréenne.
Le score d’inflammation dans le PMU peut également être déterminé à l’aide de l’histologie. La figure 5 montre des sections H & E représentatives à utiliser pour évaluer la gravité de l’UAP par histologie. Le nombre de cellules inflammatoires dans l’aqueux et le vitré est compté et utilisé pour déterminer la gravité à l’aide des critères de score énumérés dans le tableau 3. L’infiltration de cellules inflammatoires du corps ciliaire est couramment observée d’un côté de la section histologique (atteinte unilatérale) dans une inflammation légère ou modérée. Lorsque l’inflammation est sévère, cela se traduit par la présence d’un infiltrat de cellules inflammatoires dans le corps ciliaire des deux côtés du cristallin (appelé atteinte bilatérale). Au cours des moments ultérieurs après l’injection intravitréenne, des manifestations inflammatoires chroniques, y compris la présence de leucocytes périvasculaires et intrarétiniens et de plis rétiniens externes, peuvent également être identifiées. L’histologie peut également être utile pour identifier les yeux touchés par de mauvaises techniques d’injection. Le traumatisme du cristallin pendant l’injection intravitréenne peut être identifié par la présence de protéines de cristallin colorées à l’éosine amorphe (rose) à l’extérieur de la capsule du cristallin adjacente à la zone du traumatisme. Le reflux de la tuberculose intravitréenne dans l’espace sous-conjonctival générera une inflammation à l’extérieur de l’œil qui peut être identifiée par un examen attentif des structures périoculaires présentes sur les sections. En raison de l’incapacité à retenir l’extrait de TBm dans les yeux, ces yeux auront généralement de faibles scores OCT d’inflammation.
L’imagerie du fond d’œil à fond clair peut également être utilisée pour identifier les aspects cliniquement pertinents de la PMU, y compris le développement d’une hypopyon, d’une vitrite et d’une infiltration de cellules inflammatoires rétiniennes ou périvasculaires. La figure 6 montre deux exemples où l’inflammation rétinienne et périvasculaire peut être observée sur les images du fond d’œil. Ces deux yeux montrent également la gamme d’inflammation qui est commune dans le modèle PMU. Le tableau 1B énumère les paramètres utilisés dans le système d’imagerie de la TCO du fond d’œil/rétine. Notez l’impact de l’inflammation sévère sur la qualité de l’image (Figure 6, jour 2, images OCT et du fond d’œil dans la rangée supérieure) et l’étendue de la maladie présente au jour 21. L’œdème cornéen peut également diminuer la qualité de l’image lors d’une inflammation aiguë; Cependant, il est rare que l’œdème cornéen soit sévère à cause de l’inflammation seule. Plus communément, la qualité de l’image sera dégradée par des dommages épithéliaux résultant d’une protection de surface incomplète pendant les événements d’imagerie et d’anesthésie.
Le modèle PMU peut être utilisé pour induire une uvéite chez n’importe quelle race ou génotype de souris. Dans les yeux albinos, l’OCT peut toujours être utilisée pour marquer l’inflammation, mais l’absence de pigment du fond d’œil rend la visualisation de l’inflammation difficile par imagerie en fond clair13,34. Les études post mortem peuvent être effectuées sur les tissus oculaires, les ganglions lymphatiques régionaux ou la rate. Quelques exemples incluent des tests de présence de cellules immunitaires tels que la cytométrie en flux et l’immunohistochimie et la mesure des cytokines inflammatoires. À tous les points temporels testés après le début de l’inflammation avec la PMU (du jour 1 au jour 56), il y a suffisamment de cellules inflammatoires CD45+ présentes dans les yeux individuels pour détecter de nombreuses populations majeures de leucocytes dans l’œil par analyse de flux multiparamétrique12,35. Les humeurs aqueuses (2-5 μL) et vitrées (5-10 μL) peuvent être collectées dans les yeux enflammés pour la détermination de la concentration en protéines, les études protéomiques ou la détermination de la concentration de cytokines36.

Figure 1 : Mise en place de l’injection intravitréenne chez la souris. L’injection intravitréenne est réalisée sur l’œil de souris à l’aide (A) d’un contrôleur de pompe à microseringue connecté à la micropompe (B) et (C) d’une seringue d’injection. La seringue est chargée et montée sur la micropompe (D). La tête de la souris est positionnée à l’aide de barres auriculaires (E) pour assurer la stabilité et la cohérence pendant la procédure d’injection intravitréenne. (F) La fluorescéine dans la solution injectable produit une réflexion verdâtre de l’intérieur de l’œil après une procédure réussie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
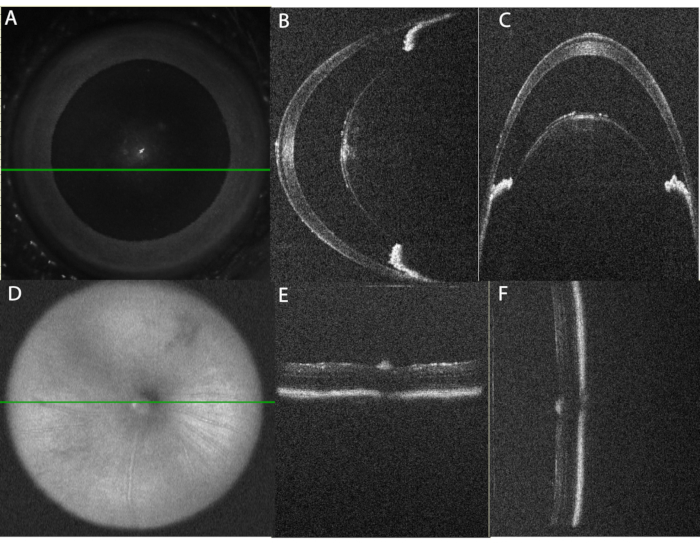
Figure 2 : Alignement correct de l’œil pour l’imagerie OCT. (A) À l’aide de l’image de l’ophtalmoscope laser à balayage du visage (SLO), l’œil est centré pour l’imagerie de la chambre antérieure. La ligne verte indique la position du balayage de la ligne horizontale illustrée dans le panneau (B). Notez que la cornée centrale est évitée pour diminuer l’artefact de réflexion. (C) B-Scan vertical à travers la chambre antérieure paracentrale. Ce balayage est obtenu à 90° à partir du balayage horizontal. Notez que l’alignement des sections de diaphragme de chaque côté de l’objectif est de niveau dans le balayage horizontal (panneau B) et disposé l’un au-dessus de l’autre dans le balayage vertical (panneau C). (D) En utilisant l’image SLO, l’image de la chambre postérieure est centrée sur le nerf optique. (e) alignement horizontal B-scan, (f) alignement vertical B-sscan. Veuillez cliquer ici pour voir une version agrandie de cette figure.
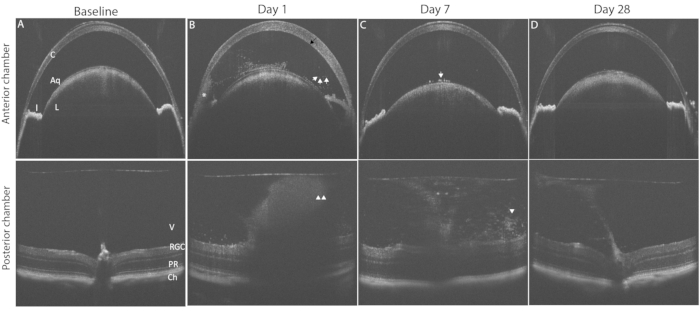
Figure 3 : L’induction de la PMU génère une panuvéite qui peut être surveillée par imagerie longitudinale de la OCT. La rangée du haut montre la chambre antérieure (AC); la rangée du bas montre des images de la CTO de la chambre postérieure (PC) pour mettre en évidence les changements pathologiques dans l’évolution de la maladie. (A) Image OCT de base de la CA (en haut) et du PC (en bas) avant l’induction de l’uvéite, les deux obtiennent un score de 0. (B) Jour 1 après injection intravitréenne montrant la présence d’un œdème cornéen (flèche noire), d’une hypopée (*) de multiples cellules inflammatoires flottantes dans le CA (flèches blanches) et d’une vitrite (pointes de flèches blanches) dans le PC. (C) Jour 7 après injection intravitréenne avec peu de cellules AC sur la capsule antérieure du cristallin (flèche blanche) et diminution de la vitrite (pointe de flèche blanche). (D) Jour 28 après l’injection intravitréenne chambre antérieure avec inflammation AC résolue et vitrite légère. Abréviations: C- cornée, L - lentille, I - iris, Aq - aqueux, V vitré, RGC - cellules ganglionnaires de la rétine, PR - photorécepteurs, Ch- choroïde. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Exemples de scores de l’OCT. Un score OCT compris entre 0 et 4 est attribué à chaque image AC et image PC à l’aide du système catégorique illustré dans le tableau 2. Les scores AC et PC sont combinés pour le score OCT final pour l’œil. (A,D) Exemples d’un score de zéro. (B, E) Exemples d’un score de 0,5. (C,F) Exemples d’un score de 1. (G,J) Exemples d’un score de 2. (H,K) Exemples d’un score de 3. (I,L) Des exemples d’un score de 4 sont présentés dans les panneaux I et L. Veuillez cliquer ici pour voir une version agrandie de cette figure.
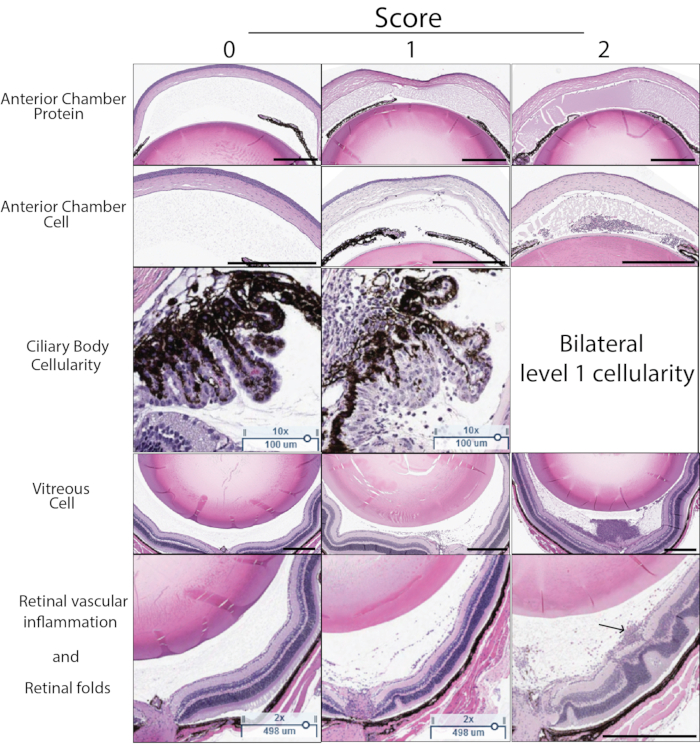
Figure 5 : Exemples de scores histologiques. Le score histologique est déterminé en fonction de cinq caractéristiques visibles dans les sections H & E: densité de protéines de la chambre antérieure, nombre de cellules de la chambre antérieure, infiltration de cellules immunitaires du corps ciliaire, densité cellulaire vitrée, inflammation vasculaire rétinienne et changements structurels de la rétine. Un score de 0-2 est attribué pour chaque caractéristique. La description de chaque score se trouve dans le tableau 3. Un exemple représentatif de score de 0-2 pour chaque caractéristique est montré dans cette figure. La colonne de gauche montre le score de zéro. La colonne centrale montre des exemples de score 1. La colonne de droite montre des exemples de score 2. Un score de 2 pour le score du corps ciliaire est attribué si le corps ciliaire de chaque côté de la lentille dans la même section présente une inflammation cellulaire. Le score histologique final est la somme du score pour chacun des cinq critères (score max 10). La flèche dans le panneau inférieur droit indique les leucocytes périvasculaires associés à un vaisseau rétinien superficiel. La barre d’échelle noire indique 500 μm. Les barres d’échelle ciliaires indiquent 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
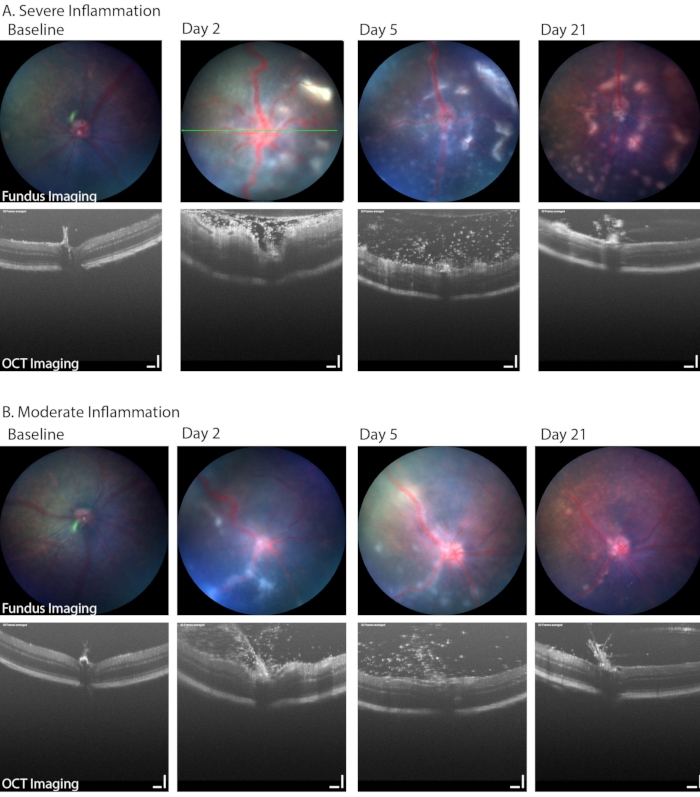
Figure 6 : L’imagerie longitudinale du fond d’œil dans l’UMP a permis d’identifier une gamme de gravité de la maladie. (A) Les yeux gravement enflammés présentent de multiples infiltrats blancs dans la rétine et une tortuosité vasculaire sur l’imagerie du fond d’œil couleur (rangée du haut) ainsi qu’une vitrite dense et un œdème rétinien sur OCT (rangée inférieure) le jour 2. Une progression du nombre de lésions rétiniennes peut être observée au fil du temps tandis que la vitrite s’améliore. La ligne verte indique la position de l’image de l’OPO. (B) Les yeux légèrement enflammés présentent des lésions linéaires moins nombreuses et plus discrètes dans le fond d’œil et un certain nombre de cellules infiltrantes dans l’espace vitré. Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Un | |||
| Chambre antérieure de souris | Analyse rapide | Analyse du volume | Balayage linéaire |
| Longueur x largeur | 4,0 mm x 4,0 mm | 3,6 mm x 3,6 mm | 3,6 mm |
| Angle | 0 | 90 | 90 |
| A-scan/B-Scan | 800 | 1000 | 1000 |
| # B-scans | 50 | 400 | 1 |
| Images/ B-scan | 1 | 3 | 20 |
| Chambre postérieure de souris | Analyse rapide | Analyse du volume | Balayage linéaire |
| Longueur x largeur | 1,6 mm x 1,6 mm | 1,6 mm x 1,6 mm | 1,6 mm |
| Angle | 0 | 0 | 0 |
| A-scan/B-Scan | 800 | 1000 | 1000 |
| # B-scans | 50 | 200 | 1 |
| Images/ B-scan | 1 | 3 | 20 |
| B | |||
| Chambre postérieure de souris | Analyse du volume | Balayage linéaire | |
| Longueur x largeur | 0,9 mm x 0,9 mm | 1,8 mm | |
| Angle | 0 | Tout (généralement 0 ou 90) | |
| A-scan/B-Scan | 1024 | 1024 | |
| # B-scans | 512 | 1 | |
| Images/ B-scan | 1 | 30 |
Tableau 1 : Paramètres d’analyse. (A) Paramètres d’analyse OCT. (B) Paramètres de scintigraphie du fond d’œil/de la rétine
| Descriptions des scores de l’OCT | ||||||
| Score | Chambre antérieure | Chambre postérieure | ||||
| NA | Pas de vue au-delà de la cornée antérieure | Pas de vue du segment postérieur | ||||
| 0 | Pas d’inflammation | Pas d’inflammation | ||||
| 0.5 | 1 à 5 cellules dans l’eau | Peu de cellules occupent moins de 10% de la surface vitrée | ||||
| OU œdème cornéen | Pas d’infiltrats sous-rétiniens ou intrarétiniens ou de perturbation de l’architecture rétinienne | |||||
| 1 | 6–20 cellules dans l’aqueux | Cellules diffuses (pas d’amas denses) occupant entre 10 et 50% de la surface vitrée. | ||||
| OU une seule couche de cellules sur la capsule antérieure du cristallin | Pas d’infiltrats sous-rétiniens ou intrarétiniens ou de perturbation de l’architecture rétinienne | |||||
| 2 | 20–100 cellules dans l’eau | Cellules diffuses (pas d’amas denses) occupant > 50% de la surface vitrée | ||||
| OU moins de 20 cellules et un hypopyon présent | Pas d’infiltrats sous-rétiniens ou intrarétiniens ou de perturbation de l’architecture rétinienne | |||||
| 3 | 20–100 cellules dans l’eau | Cellules diffuses égales aux grades 2 et 1 | ||||
| ET un hypopyon OU une membrane pupillaire | ET au moins une opacité vitrée dense occupant 10 % à 20 % de la surface vitrée OU la présence de cellules vitrées égales au grade 2 et d’opacités sous-rétiniennes ou ntrarétiniennes rares (≤ 2) | |||||
| 4 | N’importe quel nombre de cellules aqueuses | Opacité vitrée dense occupant > 20% de la surface vitrée. | ||||
| ET un grand hypopyon et une membrane pupillaire OU une perte de structure antérieure due à une inflammation sévère | OU cellules vitrées diffuses avec de grandes opacités sous-rétiniennes ou intrarétiniennes | |||||
Tableau 2 : Critères de score de l’UMP PTOM : Les images de l’OCO sont notées en fonction des critères énumérés dans le tableau. Les scores AC et PC sont additionnés pour obtenir le score final de l’œil. Dans les cas où une vue claire de l’œil n’a pas été acquise, un score de NA a été attribué aux images, et celles-ci ont été exclues de l’étude.
| Description du score histologique | |||
| Caractéristique | 0 | 1 | 2 |
| Protéine de la chambre antérieure (AC) | Particules acellulaires maigres colorées à l’éosine dans le courant alternatif | Coloration à l’éosine extracellulaire modérée, mais non confluente, n’importe où dans le courant alternatif | Coloration à l’éosine extracellulaire confluente ou quasi confluente dans tout le courant alternatif |
| Cellule de la chambre antérieure (CA) | Pas de cellules | 1–100 cellules, mais pas d’agrégations denses de cellules | >100 cellules, ou agrégations denses de cellules |
| Inflammation du corps ciliaire | Pas d’infiltration leucocytaire du corps ciliaire ou du vitré environnant | Présence unilatérale de leucocytes infiltrant le corps ciliaire et/ou le vitré environnant. | Présence bilatérale de leucocytes infiltrant le corps ciliaire et/ou le vitré environnant. |
| Inflammation vasculaire rétinienne | Pas de vaisseaux rétiniens avec des leucocytes périvasculaires | Un vaisseau par section avec des leucocytes périvasculaires | >1 vaisseau par section avec des leucocytes périvasculaires |
| Pli ou dommage rétinien | Pas de dommages rétiniens | 1 à 3 plis rétiniens par section | >3 plis rétiniens par section, ou toute autre destruction de la couche rétinienne ou hémorragie intrarétinienne |
Tableau 3 : Critères de score histologique de l’UPM : Les coupes H & E de l’œil ont été notées en fonction des critères énumérés dans le tableau. Trois sections du même œil ont été notées et moyennées pour obtenir le score histologique final de l’œil.
Discussion
Les modèles animaux de l’uvéite ont joué un rôle déterminant dans la compréhension des mécanismes de l’inflammation oculaire et de l’homéostasie, ainsi que dans l’évaluation préclinique des traitements médicaux et chirurgicaux pour les patients atteints d’uvéite37. Les variantes lapin et rat du modèle PMU ont démontré leur valeur dans la thérapie préclinique via des études de preuve de concept38,39,40. En raison de la disponibilité d’une gamme diversifiée de souches transgéniques chez la souris, l’établissement du système modèle PMU de souris permet maintenant des études mécanistes plus détaillées pour identifier des types cellulaires, des voies et des gènes spécifiques qui contribuent à la pathologie de cette maladie.
Les modèles animaux d’uvéite peuvent démontrer la variabilité d’un animal à l’autre dans l’incidence et l’intensité de l’inflammation41. Dans la souche de souris C57BL/6, la PMU est générée de manière fiable à l’aide du protocole décrit ici. Des variations spécifiques à la souche de l’évolution et de l’intensité de l’uvéite ont été rapportées pour l’EAU et l’EIU42,43. Bien que les impacts spécifiques à la souche sur la gravité et l’évolution de la PMU n’aient pas été mesurés expérimentalement, ce modèle a été utilisé chez les souris C57BL/6J de type sauvage ainsi que chez les souris albinos (B6(Cg)-Tyrc-2J/J) et a produit des réponses inflammatoires similaires. En générant le modèle PMU, le contrôle des considérations énumérées ci-dessous peut aider les nouveaux chercheurs à limiter la variabilité et à produire l’uvéite la plus cohérente et la plus reproductible.
Assurer la cohérence des injections sous-cutanées :
Pour fournir une injection sous-cutanée cohérente, assurez-vous que toutes les bulles d’air sont éliminées de l’émulsion. Les considérations incluent une centrifugeuse courte (30 s à 400 x g) de l’émulsion préfabriquée avant le chargement de la seringue. Cela éliminera l’air emprisonné dans l’émulsion. De plus, lors du chargement de la seringue, inversez périodiquement (basculez) et tapotez la seringue pour éliminer les bulles d’air. Pendant l’injection, ne placez pas la seringue trop profondément afin d’éviter l’injection intramusculaire. Inversement, une injection superficielle (intradermique) peut entraîner une érosion de l’émulsion à travers la peau. N’oubliez pas de faire une brève pause avant de retirer la seringue du site d’injection pour assurer une injection complète de l’émulsion visqueuse épaisse et pour prévenir le reflux de la peau.
Sept jours après la mise en place de l’injection sous-cutanée, confirmez la présence de nodules palpables de chaque côté des pattes postérieures. Si aucun nodule ne peut être identifié, il est possible que de l’air ait été injecté plutôt que de l’émulsion. Dans ce cas, l’inflammation aiguë peut ne pas être aussi robuste et l’inflammation chronique peut ne pas se développer.
Prévenir le développement de l’endophtalmie infectieuse:
L’endophtalmie bactérienne ou fongique générera une variable confondante si elle n’est pas évitée44. Afin de prévenir l’endophtalmie bactérienne, pratiquez toujours une bonne technique aseptique lors de la fabrication de la suspension intravitréenne, de la manipulation et du nettoyage de tous les outils réutilisables qui entreront en contact avec l’œil. L’utilisation d’articles stériles à usage unique, l’autoclavage ou le nettoyage avec des lavages ou des lingettes à l’alcool à 95% sont importants. L’utilisation appropriée de la bétadine appliquée sur la surface oculaire, les paupières et la fourrure périoculaire aidera également à prévenir l’endophtalmie45. Il est facile de reconnaître un œil infecté car les structures oculaires seront effacées par une inflammation extrême pendant le cours post-injection. Ce n’est pas typique pour PMU. La présence de saignements intraoculaires peut également suggérer une endophtalmie ou un traumatisme de l’injection. Dans de tels cas, exclure ces animaux de l’étude.
Assurer la cohérence de l’injection intravitréenne :
L’injection intravitréenne est une étape critique dans l’induction d’une inflammation fiable et reproductible dans la PMU. Fournir une quantité constante de suspension de Mtb à chaque injection, éviter les traumatismes et prévenir le reflux de la suspension sont tous des facteurs qui doivent être pris en compte lors de la réalisation des injections. Pour assurer une suspension uniforme, vortex soigneusement la suspension mère lors de la décongélation et avant de la charger dans la seringue. Comme cet extrait de Mtb utilisé ne forme pas de solution, la suspension peut subir une sédimentation au fil du temps. Pour assurer une concentration uniforme de l’extrait de Mtb dans chaque injection, utilisez ou expulsez et rechargez la seringue dans les 15 minutes suivant le chargement. La phényléphrine est utilisée pour la dilatation afin de fournir un plus grand champ de vision à l’œil postérieur et de réduire le risque de traumatisme oculaire pendant l’injection. Cette chute génère une rétraction naturelle de la paupière et une légère proptose du globe, permettant une bonne visualisation de la zone 1-2 mm postérieure au limbe sans avoir besoin de saisir l’œil avec une pince. L’utilisation de forceps pour immobiliser l’œil pourrait provoquer un traumatisme potentiel et augmenter transitoirement la pression intraoculaire et le risque de reflux de la suspension de Mtb. Un traumatisme peut également être causé par une tentative d’injecter trop de volume dans l’œil. Le volume d’injection est limité à 2 μL pour éviter une élévation significative et prolongée de la pression intraoculaire et un traumatisme oculaire. De plus, les animaux plus jeunes auront des yeux plus petits que les souris adultes. Typiquement, les souris de 6 à 8 semaines (20 à 25 g) fournissent une taille oculaire uniforme et assurent une plus grande cohérence de l’inflammation après l’injection de Mtb. Une fréquence plus élevée de reflux post-injection de la suspension mycobactérienne a été observée chez des souris plus petites. Ceci, à son tour, conduit à une inflammation aiguë moins que prévu. Une solution de fluorescéine diluée est utilisée pour fournir à l’injecteur novice un retour visuel sur le succès de sa technique d’injection. La dilatation au moment de l’injection permettra une visualisation directe du matériau injecté dans la cavité vitrée et la possibilité de noter tout signe de traumatisme du cristallin. Dans le cas d’un traumatisme du cristallin, il peut provoquer un changement de clarté du cristallin qui provoquera une cataracte qui peut être visualisée sur l’OCT. En cas de traumatisme oculaire, les yeux doivent être exclus de l’étude en raison de la possibilité d’uvéite induite par le cristallin46. Nous recommandons de faire une pause de 10 s avant de retirer la seringue de l’œil pour permettre la dispersion de la suspension de Mtb dans l’œil et diminuer le reflux.
Le modèle PMU peut être modifié pour modifier l’intensité de l’inflammation aiguë en faisant varier la concentration du Mtb dans l’injection intravitréenne. Différents dosages allant de 2,5 μg/μL à 15 μg/μL ont déjà été testés dans notre laboratoire. Cependant, des doses supérieures à 10 μg/μL se sont avérées causer de graves lésions oculaires, y compris une rupture spontanée du cristallin, un œdème cornéen sévère et des cicatrices, et un hyphéma. Ce degré de gravité n’est pas typique chez les patients humains atteints d’uvéite post-infectieuse et, par conséquent, ces concentrations ne sont pas recommandées. Une dose de 5 μg/μL s’est avérée produire de manière fiable une inflammation aiguë légère à modérée et une uvéite chronique légère; la dose de 10 μg/μL produit une maladie aiguë modérée à sévère et une maladie chronique plus notable. Ainsi, la variation de la concentration intravitréenne peut fournir d’autres sévérités de la maladie à utiliser au besoin en fonction de la question expérimentale. Les témoins doivent être choisis pour s’assurer que les résultats sont dus à la réponse à la tuberculose mM et non à un traumatisme associé aux injections sous-cutanées ou intravitréennes. Dans les contrôles d’injection simulée, le PBS peut être utilisé à la place de l’extrait mTB. Pour les comparaisons avec des animaux non exposés, les vrais échantillons naïfs doivent être pris en compte, car les autres yeux ne sont pas toujours équivalents.
En raison de la petite taille de l’œil de souris, la TCO peut être un test plus sensible pour détecter l’inflammation dans la chambre antérieure que la visualisation directe ou la photographie microscopique en champ clair. Des travaux antérieurs avec PMU chez le rat25 ont déterminé que plus de cellules peuvent être détectées par histologie que par OCT, mais qu’il existe une bonne corrélation entre les deux modalités. L’OCT a l’avantage supplémentaire de pouvoir être utilisée pour surveiller l’inflammation longitudinalement chez le même animal. D’autres grands modèles murins d’uvéite, tels que l’EAU et l’EIU, ont également utilisé l’OCT pour l’analyse quantitative 12,47,48. Dans le modèle PMU de souris, les cellules de la chambre antérieure ne sont visibles que sur OCT et ne peuvent pas être vues sur les examens cliniques à moins qu’un grand hypopyon ne soit présent. L’inflammation du vitré (vitrite) peut être observée avec l’imagerie du fond d’œil couleur, mais la détection d’un changement quantitatif n’est possible qu’avec l’imagerie OCT. D’autres aspects du modèle, tels que l’inflammation vasculaire rétinienne et les lésions rétiniennes, peuvent être facilement identifiés avec la photographie OCT et microscopique du fond d’œil en fond clair.
Lors de l’utilisation de l’OCT, il est important de considérer comment l’imagerie localisée peut être affectée par les différences régionales dans le degré d’inflammation. Des rapports antérieurs ont identifié une distribution inégale des cellules dans la chambre antérieure de l’homme, avec plus de cellules situées en dessous49. Chez la souris, une prédisposition similaire est courante. Ainsi, les balayages verticaux ou radiaux à travers le climatiseur aideront à garantir des images qui capturent la gamme d’inflammation. De plus, la réalisation d’images au même endroit assurera également la cohérence des images recueillies longitudinalement dans le même œil. Pour obtenir des images dans la même partie de l’œil, utilisez des repères stables et une approche systématique. Pour les images de la chambre antérieure, l’image est centrée immédiatement adjacente à l’apex de la cornée et orientée verticalement afin que la présence d’un hypopyon puisse être détectée dans l’angle inférieur. Pour les images du segment postérieur, l’image est centrée sur le nerf optique. Il est recommandé d’envisager d’utiliser au moins 3 balayages linéaires pour la notation afin de s’assurer que la variabilité régionale est capturée. Dans les cas où l’inflammation est limitée aux emplacements périphériques, l’acquisition de scans de volume peut être utile. La collecte d’analyses de volume peut également aider à capturer les variations régionales, mais augmentera les besoins de stockage des données.
D’autres tests in vivo qui peuvent être utilisés pour caractériser l’inflammation dans le modèle murin PMU comprennent l’imagerie par bioluminescence13,35. Des tests post-mortem tels que l’analyse cytométrique en flux multiparamétrique peuvent être effectués pour identifier et quantifier les populations de cellules immunitaires infiltrantes dans la chambre aqueuse et postérieure de l’œil12,26. Dans le modèle PMU, l’inflammation aiguë est caractérisée par une réponse innée avec un infiltrat de neutrophiles prédominant, suivie d’une réponse adaptative chronique et persistante à dominante des lymphocytes T qui persiste pendant plus d’un mois35. D’autres tests de la fonction immunitaire qui peuvent être effectués sur des tissus post-mortem comprennent l’analyse des cytokines du liquide oculaire. De plus, d’autres tests en aval comme le séquençage de l’ARNm et l’imagerie par immunofluorescence peuvent être utilisés pour évaluer les profils d’expression génique et protéique des populations de cellules immunitaires rétiniennes dans l’uvéite50,51.
Le modèle PMU peut être reproduit dans d’autres systèmes de rongeurs en utilisant des adaptations appropriées pour les différentes espèces. Le modèle PMU a déjà été utilisé chez les rats et les lapins38,39,40. Chez le rat, une panuvéite aiguë se développe suite à une injection intravitréenne qui disparaît spontanément en 14 jours sans développer de signes d’inflammation chronique par histologie24. Chez le lapin, l’induction de l’uvéite utilise deux cycles d’injection sous-cutanée avant l’injection intravitréenne, mais génère également une panuvéite robuste. L’un des avantages de l’utilisation du modèle murin est la disponibilité immédiate de nombreuses souches transgéniques et knockout qui peuvent aider à comprendre le mécanisme de base de l’uvéite52. Tous les modèles de rongeurs peuvent être utilisés pour les tests thérapeutiques précliniques si l’agent est administré par voie systémique ou sous forme de goutte topique. Cependant, en raison de leur plus grande taille, les yeux de rat et de lapin sont de meilleurs modèles pour une utilisation dans les études précliniques des options de traitement implantable ou par injection locale pour l’uvéite.
En résumé, ce protocole fournit aux chercheurs intéressés à étudier les mécanismes de l’inflammation oculaire chronique un nouvel outil qui ne dépend pas d’une immunisation préalable avec des antigènes oculaires.
Déclarations de divulgation
Les auteurs n’ont aucun conflit financier à divulguer.
Remerciements
Ce travail est soutenu par le financement des National Institutes of Health, Bethesda, Maryland, États-Unis (KP) K08EY0123998, (KP) R01EY030431, (KP) R21 EY02939, UW vision research core grant (NEI P30EY01730), des dons du Mark Daily, MD Research Fund et du Christopher and Alida Latham Research Fund, une subvention ministérielle sans restriction de Research to Prevent Blindness et une bourse de développement de carrière de Research to Prevent Blindness (KP). Les travaux menés à Bristol ont été soutenus par des fonds supplémentaires de Sight Research UK et The Underwood Trust.
matériels
| Name | Company | Catalog Number | Comments |
| AK-FLUOR | Akorn Pharmaceuticals, IL, USA | 10% Fluorescein sodium 100 mg/mL in 5 mL vial | |
| AnaSed | Akorn Animal Health, IL, USA | NDC 59399-110-20 | Xylazine 20 mg/mL |
| Betadine 5% Sterile Ophthalmic Prep Solution | Alcon, TX, USA | 8007-1 | |
| B-D Precision Glide Needles -25 G | Becton, Dickinson and Company, NJ, USA | 305122 | |
| B-D Precision Glide needle -30-G | Becton, Dickinson and Company, NJ, USA | 305106 | |
| Bond MAX, Bond Rx | Leica Biosystems, IL,USA | Automated IHC staining system | |
| Chloramphenicol ointment | Martindale Pharma, Romford, UK | 1% w/w Chloramphenicol | |
| EG1150H | Leica Biosystems, IL,USA | Tissue Embedding | |
| Envisu R2300 | Bioptigen/Leica | OCT Machine | |
| Freund's Incomplete Adjuvant | BD Difco, NJ, USA | 263910 | |
| GenTeal lubricant eye ointment | Alcon, TX, USA | --- | |
| GenTeal lubricant eye gel | Alcon, TX, USA | --- | |
| H37Ra lyophilized Mycobacteria extract | BD Difco, NJ, USA | 231141 | |
| Hamilton RN Needle (33/12/2)S | Hamilton, Reno, NV | 7803-05(33/12/2) | 33 G |
| Hamilton syringe | Hamilton, Reno, NV | CAL7633-01 | 5 µL |
| Insulin needle | Exel International, USA | 26029 | 1 mL |
| Isoflurane | |||
| Ketaset | Zoetis, USA | 377341 | Ketamine HCL 100 mg/mL |
| Microinjection Syringe Pump and Micro4Controller | World Precision Instruments, FL, USA | UMP3 | |
| Micron IV | Phoenix Research Laboratories, Pleasanton, CA | Alternative Imaging/OCT Machine | |
| Nanofil 10 µL syringe | World Precision Instruments, FL, USA | NANOFIL | |
| Nanofil Intraocular Injection Kit | World Precision Instruments, FL, USA | IO-KIT | |
| Olympus SZX10 | Olympus | Dissection scope | |
| PBS | Gibco | 14190 | |
| Phenylephrine Hydrochloride Ophthalmic Solution USP 2.5% Sterile 15 mL | Akorn Pharmaceuticals, IL, USA | 17478020115 | |
| RM2255 | Leica Biosystems, IL,USA | Tissue Sectioning | |
| TB Syringe | Becton, Dickinson and Company, NJ, USA | 309602 | 1 mL |
| Tetracaine 0.5% | Alcon, TX, USA | 1041544 | |
| Tissue Tek VIP series | Sakura Finetek USA, Inc.,CA. | Histology Tissue Processing | |
| Tropicamide 1% | Chauvin Pharmaceuticals, Romford, UK | Minims | |
| Tylenol | Johnson & Johnson Consumer Inc, PA, USA | NDC 50580-614-01 | Acetaminophen |
| Viscotears | Novartis Pharmaceuticals, Camberley, UK | Carbomer eye gel 0.2% w/w |
Références
- American Academy of Ophthalmology. Aao 2019-2020 Basic and Clinical Science Course, Section 09: Uveitis and Ocular Inflammation. American Academy of Ophthalmology. , (2019).
- Caspi, R. R. Animal models of autoimmune and immune-mediated uveitis. Drug Discovery today. Disease Models. 3 (1), 3-9 (2006).
- DeVoss, J., et al. Spontaneous autoimmunity prevented by thymic expression of a single self-antigen. The Journal of Experimental Medicine. 203 (12), 2727-2735 (2006).
- Caspi, R. R., et al. A new model of autoimmune disease. Experimental autoimmune uveoretinitis induced in mice with two different retinal antigens. Journal of Immunology. 140 (5), 1490-1495 (1988).
- Tang, J., Zhu, W., Silver, P. B., Su, S. -B., Chan, C. -C., Caspi, R. R. Autoimmune uveitis elicited with antigen-pulsed dendritic cells has a distinct clinical signature and is driven by unique effector mechanisms: Initial encounter with autoantigen defines disease phenotype. The Journal of Immunology. 178 (9), 5578-5587 (2007).
- Broekhuyse, R. M., Kuhlmann, E. D., Winkens, H. J. Experimental melanin-protein induced uveitis (EMIU) is the sole type of uveitis evoked by a diversity of ocular melanin preparations and melanin-derived soluble polypeptides. Japanese Journal of Ophthalmology. 40 (4), 459-468 (1996).
- Pennesi, G., et al. A humanized model of experimental autoimmune uveitis in HLA class II transgenic mice. The Journal of Clinical Investigation. 111 (8), 1171-1180 (2003).
- Caspi, R. R. Understanding autoimmune uveitis through animal models. The Friedenwald lecture. Investigative Ophthalmology & Visual Science. 52 (3), 1872-1879 (2011).
- Bansal, S., Barathi, V. A., Iwata, D., Agrawal, R. Experimental autoimmune uveitis and other animal models of uveitis: An update. Indian Journal of Ophthalmology. 63 (3), 211-218 (2015).
- Smith, J. R., Hart, P. H., Williams, K. A. Basic pathogenic mechanisms operating in experimental models of acute anterior uveitis. Immunology and Cell Biology. 76 (6), 497-512 (1998).
- Rosenbaum, J. T., McDevitt, H. O., Guss, R. B., Egbert, P. R. Endotoxin-induced uveitis in rats as a model for human disease. Nature. 286 (5773), 611-613 (1980).
- Chu, C. J., et al. Multimodal analysis of ocular inflammation using the endotoxin-induced uveitis mouse model. Disease Models & Mechanisms. 9 (4), 473-481 (2016).
- Gutowski, M. B., Wilson, L., Van Gelder, R. N., Pepple, K. L. In vivo bioluminescence imaging for longitudinal monitoring of inflammation in animal models of uveitis. Investigative Ophthalmology & Visual Science. 58 (3), 1521-1528 (2017).
- World Health Organization. Global tuberculosis report 2019. World Health Organization. , (2019).
- Biswas, J., Badrinath, S. S. Ocular morbidity in patients with active systemic tuberculosis. International Ophthalmology. 19 (5), 293-298 (1995).
- Donahue, H. C. Ophthalmologic experience in a tuberculosis sanatorium. American Journal of Ophthalmology. 64 (4), 742-748 (1967).
- El-Asrar, M. A., Abouammoh, M., Al-Mezaine, H. S. Tuberculous uveitis. Middle East African Journal of Ophthalmology. 16 (4), 188-201 (2009).
- Bodaghi, B., et al. Chronic severe uveitis: etiology and visual outcome in 927 patients from a single center. Medicine. 80 (4), 263-270 (2001).
- Cunningham, E. T., Forrester, J. V., Rao, N. A., Zierhut, M. Post-infectious uveitis. Ocular Immunology and Inflammation. 24 (6), 603-606 (2016).
- Wroblewski, K. J., Hidayat, A. A., Neafie, R. C., Rao, N. A., Zapor, M. Ocular tuberculosis: a clinicopathologic and molecular study. Ophthalmology. 118 (4), 772-777 (2011).
- Yeh, S., Sen, H. N., Colyer, M., Zapor, M., Wroblewski, K. Update on ocular tuberculosis. Current Opinion in Ophthalmology. 23 (6), 551-556 (2012).
- Tagirasa, R., Parmar, S., Barik, M. R., Devadas, S., Basu, S. Autoreactive T cells in immunopathogenesis of TB-associated uveitis. Investigative Ophthalmology & Visual Science. 58 (13), 5682-5691 (2017).
- Agrawal, R., et al. Insights into the molecular pathogenesis of ocular tuberculosis. Tuberculosis. 126, 102018(2021).
- Pepple, K. L., et al. Primed mycobacterial uveitis (PMU): Histologic and cytokine characterization of a model of uveitis in rats. Investigative Ophthalmology & Visual Science. 56 (13), 8438-8448 (2015).
- Pepple, K. L., Choi, W. J., Wilson, L., Van Gelder, R. N., Wang, R. K. Quantitative assessment of anterior segment inflammation in a rat model of uveitis using spectral-domain optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (8), 3567-3575 (2016).
- Pepple, K. L., Wilson, L., Van Gelder, R. N. Comparison of aqueous and vitreous Lymphocyte populations from two rat models of experimental uveitis. Investigative Ophthalmology & Visual Science. 59 (6), 2504-2511 (2018).
- Basu, S., Elkington, P., Rao, N. A. Pathogenesis of ocular tuberculosis: New observations and future directions. Tuberculosis. 124, 101961(2020).
- Basu, S., Rao, N., Elkington, P. Animal models of ocular tuberculosis: Implications for diagnosis and treatment. Ocular Immunology and Inflammation. , 1-7 (2020).
- Mattapallil, M. J., et al. The Rd8 mutation of the Crb1 gene is present in vendor lines of C57BL/6N mice and embryonic stem cells, and confounds ocular induced mutant phenotypes. Investigative Ophthalmology & Visual Science. 53 (6), 2921-2927 (2012).
- Underwood, W., Anthony, R. AVMA guidelines for the euthanasia of animals: 2020 edition. 2013 (30), 2020-2021 (2020).
- Donovan, J., Brown, P., et al. Handling and restraint. Current protocols in immunology. Coligan, J. E., et al. , John Wiley & Sons, Inc. Chapter 1, Unit 1.3 (2006).
- Tremoleda, J. L., Kerton, A., Gsell, W. Anaesthesia and physiological monitoring during in vivo imaging of laboratory rodents: considerations on experimental outcomes and animal welfare. EJNMMI Research. 2 (1), 44(2012).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor protocols. 2014 (6), 655-658 (2014).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- John, S., Rolnick, K., Wilson, L., Wong, S., Van Gelder, R. N., Pepple, K. L. Bioluminescence for in vivo detection of cell-type-specific inflammation in a mouse model of uveitis. Scientific Reports. 10 (1), 11377(2020).
- Fortmann, S. D., Lorenc, V. E., Hackett, S., Campochiaro, P. A. Murine Vitreous Tap (MurViTap): a novel technique to extract uncontaminated mouse vitreous humor, quantify retinal vascular permeability, and compare proteins secreted by diseased and normal retina. Investigative ophthalmology & visual science. 58 (8), 5978(2017).
- Caspi, R. R. Understanding autoimmunity in the eye: from animal models to novel therapies. Discovery Medicine. 17 (93), 155-162 (2014).
- Mruthyunjaya, P., et al. Efficacy of low-release-rate fluocinolone acetonide intravitreal implants to treat experimental uveitis. Archives of Ophthalmology. 124 (7), 1012-1018 (2006).
- Jaffe, G. J., Yang, C. S., Wang, X. C., Cousins, S. W., Gallemore, R. P., Ashton, P. Intravitreal sustained-release cyclosporine in the treatment of experimental uveitis. Ophthalmology. 105 (1), 46-56 (1998).
- Pepple, K. L., et al. Uveitis therapy with shark variable novel antigen receptor domains targeting tumor necrosis factor alpha or inducible t-cell costimulatory ligand. Translational Vision Science & Technology. 8 (5), 11(2019).
- Mattapallil, M. J., et al. Characterization of a New epitope of IRBP that induces moderate to severe uveoretinitis in mice with H-2b haplotype. Investigative Ophthalmology & Visual Science. 56 (9), 5439-5449 (2015).
- Silver, P. B., Chan, C. C., Wiggert, B., Caspi, R. R. The requirement for pertussis to induce EAU is strain-dependent: B10.RIII, but not B10.A mice, develop EAU and Th1 responses to IRBP without pertussis treatment. Investigative Ophthalmology & Visual Science. 40 (12), 2898-2905 (1999).
- Li, Q., Peng, B., Whitcup, S. M., Jang, S. U., Chan, C. C. Endotoxin induced uveitis in the mouse: susceptibility and genetic control. Experimental Eye Research. 61 (5), 629-632 (1995).
- Astley, R. A., Coburn, P. S., Parkunan, S. M., Callegan, M. C. Modeling intraocular bacterial infections. Progress in Retinal and Eye Research. 54, 30-48 (2016).
- Lau, P. E., Jenkins, K. S., Layton, C. J. Current evidence for the prevention of endophthalmitis in anti-VEGF intravitreal injections. Journal of Ophthalmology. 2018, 8567912(2018).
- Nche, E. N., Amer, R. Lens-induced uveitis: an update. Graefe's Archive for Clinical and Experimental Ophthalmology. 258 (7), 1359-1365 (2020).
- Chu, C. J., et al. Assessment and in vivo scoring of murine experimental autoimmune uveoretinitis using optical coherence tomography. PLoS ONE. 8 (5), 63002(2013).
- Harimoto, K., Ito, M., Karasawa, Y., Sakurai, Y., Takeuchi, M. Evaluation of mouse experimental autoimmune uveoretinitis by spectral domain optical coherence tomography. The British Journal of Ophthalmology. 98 (6), 808-812 (2014).
- Li, Y., Lowder, C., Zhang, X., Huang, D. Anterior chamber cell grading by optical coherence tomography. Investigative Ophthalmology & Visual Science. 54 (1), 258-265 (2013).
- Bell, O. H., et al. Single eye mRNA-seq reveals normalisation of the retinal microglial transcriptome following acute inflammation. Frontiers in Immunology. 10, 3033(2019).
- Lipski, D. A., et al. Retinal endothelial cell phenotypic modifications during experimental autoimmune uveitis: a transcriptomic approach. BMC Ophthalmology. 20 (1), 106(2020).
- Agarwal, R. K., Silver, P. B., Caspi, R. R. Rodent Models of Experimental Autoimmune Uveitis. Autoimmunity. Methods in Molecular Biology (Methods and Protocols). Perl, A. , Humana Press. Totowa, NJ. 443-469 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon