Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un test cellulaire basé sur un rapporteur pour surveiller l’efficacité de l’épissage
Dans cet article
Résumé
Ce protocole décrit un test rapporteur minigène pour surveiller l’impact des mutations du site de l’épissure 5'sur l’épissage et développe un suppresseur U1 snRNA pour le sauvetage de l’inhibition de l’épissage induite par mutation. Les constructions de l’ARNN U1 rapporteur et suppresseur sont exprimées dans les cellules HeLa, et l’épissage est analysé par extension d’amorce ou RT-PCR.
Résumé
Au cours de l’expression des gènes, l’étape vitale de l’épissage pré-ARNm implique la reconnaissance précise des sites d’épissure et l’assemblage efficace de complexes splicéosomiques pour joindre les exons et éliminer les introns avant l’exportation cytoplasmique de l’ARNm mature. L’efficacité de l’épissage peut être altérée par la présence de mutations sur les sites d’épissure, l’influence de facteurs d’épissage trans-agissants ou l’activité thérapeutique. Ici, nous décrivons le protocole pour un test cellulaire qui peut être appliqué pour surveiller l’efficacité d’épissage d’un exon donné. Le test utilise un rapporteur de minigène 3-exon/2-intron codé en plasmide adaptable, qui peut être exprimé dans les cellules de mammifères par transfection transitoire. Après la transfection, l’ARN cellulaire total est isolé et l’efficacité de l’épissage des exons dans l’ARNm rapporteur est déterminée par extension de l’amorce ou par réaction en chaîne semi-quantitative transcriptase inverse-polymérase (RT-PCR). Nous décrivons comment l’impact des mutations du site d’épissure 5′ associées à la maladie peut être déterminé en les introduisant dans le rapporteur; et comment la suppression de ces mutations peut être réalisée par co-transfection avec un petit ARN nucléaire U1 (snRNA) portant des mutations compensatoires dans sa région 5′ qui se base avec les sites d’épissure 5′ aux jonctions exon-intron dans les pré-ARNm. Ainsi, le rapporteur peut être utilisé pour la conception de particules thérapeutiques en U1 afin d’améliorer la reconnaissance des sites d’épissure mutants de 5′. L’insertion de sites régulateurs à action cis, tels que des séquences d’amplificateur d’épissage ou de silencieux, dans le rapporteur peut également être utilisée pour examiner le rôle du SNNP U1 dans la régulation médiée par un facteur d’épissage alternatif spécifique. Enfin, les cellules exprimant le rapporteur peuvent être incubées avec de petites molécules pour déterminer l’effet de thérapies potentielles sur l’épissage constitutif de l’ARNm ou sur les exons porteurs de sites d’épissure mutants de 5′. Dans l’ensemble, le test rapporteur peut être appliqué pour surveiller l’efficacité de l’épissage dans diverses conditions afin d’étudier les mécanismes fondamentaux d’épissage et les maladies associées à l’épissage.
Introduction
L’épissage pré-ARNm est une étape de traitement essentielle qui élimine les introns non codants et ligature avec précision les exons codants pour former de l’ARNm mature. La reconnaissance des séquences consensuelles aux jonctions exon-intron, appelées site d’épissure 5′ et site d’épissure 3′, par les composants de la machine d’épissage initie le processus d’épissage. La petite ribonucléoprotéine nucléaire U1 (snRNP) reconnaît le site d’épissure 5′ par appariement de base de l’ARNNc U1 au pré-ARNm1. Les mutations génétiquement héréditaires qui modifient les séquences du site d’épissure 5′ sont associées à de nombreuses maladies2,3. On prévoit que la perte de l’appariement de base de l’ARNN U1 avec les sites d’épissure 5′ mutants provoque un épissage aberrant, ce qui peut compromettre la traduction de la transcription affectée. Une approche thérapeutique potentielle pour corriger les défauts d’épissage implique la suppression des mutations par l’ARNN U1 modifié portant des changements nucléotidiques compensatoires dans sa région 5′ qui se base avec le site d’épissure 5′. De tels snRNA U1 modifiés, également appelés snRNA U1 spécifiques aux exons, se sont révélés efficaces pour inverser les défauts d’épissage, entraînant une augmentation de l’expression protéique de l’ARNm sauvé4,5,6,7,8.
Ici, nous décrivons le test de complémentation SnRNP U1, un test d’épissage cellulaire basé sur un rapporteur qui permet d’évaluer l’effet des mutations 5′-ss sur l’épissage d’un exon et peut également être utilisé pour le développement d’ARNs U1 modifiés pour permettre le sauvetage de l’inclusion d’exons. Nous fournissons également des protocoles pour la surveillance des transcriptions du rapporteur épissé par extension d’amorce et RT-PCR, et pour déterminer l’expression des snRNA U1 modifiés par extension d’amorce et RT-qPCR.
Protocole
1. Réactifs et tampons
REMARQUE: Toute stérilisation à l’aide de filtres à vide doit être effectuée avec une membrane de polyéthersulfone (PES) de 0,2 μm dans une armoire de biosécurité.
- Préparer de l’eau sans RNase en ajoutant 1,0 mL de diéthylpyrocarbonate (DEPC) à 1,0 L d’eau désionisée, mélanger pendant au moins 1 heure à température ambiante (RT), autoclaver deux fois, puis refroidir à RT avant utilisation.
- Préparez le milieu Eagle modifié (DMEM) de Dulbecco en mélangeant un sachet de poudre de DMEM (13,4 g), 3,7 g de bicarbonate de sodium, 100 mL de sérum fœtal bovin (FBS), de pénicilline et de streptomycine à environ 800 mL d’eau désionisée stérile. La concentration finale de pénicilline et de streptomycine dans le DMEM doit être de 50 U/mL et 50 μg/mL, respectivement. Ajustez le pH à 7,4 puis augmentez le volume à 1,0 L avec de l’eau désionisée stérile. Stériliser par filtration et conserver à 4 °C.
- Préparer 10x solution saline tamponnée au phosphate (10x PBS) en ajoutant 25,6 g d’hydrogène disodique heptahydraté (Na2HPO4· 7H2O), 2 g de dihydrogénophosphate de potassium (KH2PO4), 2 g de chlorure de potassium (KCl) et 80 g de chlorure de sodium (NaCl) à 800 mL d’eau désionisée. Mélanger pour dissoudre et porter le volume à 1,0 L. Stériliser par filtration et conserver à 4 °C.
- Préparer 0,5 M d’acide tétra-acétique d’éthylène diamine (EDTA) en dissolvant 186,1 g de Na2•EDTA•2H2O dans environ 800 mL d’eau désionisée. Ajustez le pH à 8,0, puis augmentez le volume à 1,0 L avec de l’eau désionisée stérile. Stériliser par filtration et conserver à 4 °C.
- Préparer 1x solution de trypsine-EDTA en mélangeant 100 mL de 10x trypsine (2,5%), 2 mL de 0,5 M EDTA, et ajouter 1x PBS jusqu’à 1,0 L. Stériliser par filtration et aliquote dans des tubes coniques de 50 mL. Conserver à 4 °C pendant 1-2 semaines ou congeler à -20 °C pour une utilisation à long terme.
- Préparer 2x colorant de charge d’ADN/ARN formamide en mélangeant 14,4 mL de formamide et 0,6 mL de 0,5 M EDTA pour un volume final de 15 mL. Ajouter le bleu de bromophénol et la poudre de cyanol de xylène à une concentration finale de 0,02 % et conserver à 4 °C.
REMARQUE: Le formamide est toxique et corrosif. Lisez les fiches de données de sécurité pour obtenir des recommandations de sécurité supplémentaires. - Préparer 5x tampon Tris/Borate/EDTA (5x TBE) en mélangeant 54,0 g de base tris, 27,5 g d’acide borique et 20 mL de 0,5 M EDTA dans environ 800 mL d’eau désionisée. Mélanger pour dissoudre et porter le volume à 1,0 L avec de l’eau désionisée.
- Préparer une solution d’électrophorèse sur gel d’urée-polyacrylamide (urea-PAGE) en mélangeant 200 mL de 5x TBE, 250 mL de 40% 19:1 bis/acrylamide et 450,5 g d’urée. Ajouter ensuite de l’eau désionisée jusqu’à 1,0 L. Mélanger jusqu’à dissolution complète des ingrédients, puis stériliser par filtration et conserver à 4 °C dans une bouteille en verre ambré.
REMARQUE: Le bis/acrylamide est toxique. Lisez les fiches de données de sécurité pour connaître les procédures de sécurité supplémentaires. - Préparer 10 % de persulfate d’ammonium (APS) en dissolvant 1 g d’APS dans 10 mL d’eau désionisée et conserver à 4 °C.
2. Cotransfection des cellules HeLa avec le rapporteur et les plasmides de l’ARNN U1
REMARQUE: La transfection des cellules Hela doit être effectuée dans des conditions stériles dans une armoire de sécurité biologique. La surface extérieure de tous les matériaux doit être pulvérisée avec de l’éthanol à 70 % avant d’être introduite dans l’armoire de sécurité biologique.
- Maintenir les cellules Hela dans le DMEM dans un incubateur à 37 °C avec 5% de CO2 en passant tous les 2-3 jours lorsque les cellules sont confluentes à environ 80-90%.
- Pour le passage des cellules HeLa, aspirer le milieu usé puis incuber les cellules avec 3 mL de trypsine à 0,25 % contenant 1 mM d’EDTA à 37 °C pendant 3 min.
- Après incubation, ajouter 7 mL de DMEM frais. Transférer la suspension de la cellule dans un tube de 10 mL, centrifuger à 1 000 x g pendant 5 min.
- Remettez en suspension la pastille cellulaire dans 10 mL de DMEM frais, puis plaquez les cellules sur une nouvelle boîte de culture tissulaire à 20% de confluence.
- Pour les transfections transitoires, compter les cellules Hela avec une lame d’hémocytomètre propre et préparer une suspension d’une densité de 2,5 x 105 cellules/mL.
- Ensemencez 1,0 mL de 2,5 x 105 cellules/mL de suspension de cellules Hela dans chaque puits d’une plaque de 12 puits et incubez pendant la nuit à 37 °C.
- Le lendemain, aspirer le milieu usé et ajouter 0,8 mL de DMEM frais avec du sérum.
- Préparer la solution I en ajoutant 0,2 μg de plasmide rapporteur Dup51 ou Dup51p, 1,8 μg d’ADCp, de plasmide pNS6U1 ou pNS6U1-5a et 100 μL de milieu de transfection dans un nouveau tube de microcentrifugation de 1,5 mL.
- Préparer un mélange maître de solution II pour tous les échantillons à transfecter en ajoutant 100 μL de milieu de transfection et 4,0 μL de réactif de transfection par échantillon.
- Préparer le mélange de transfection en ajoutant 100 μL de solution II dans chaque tube de microcentrifugation contenant la solution I.
- Vortex la transfection se mélange pendant 15 s, centrifuger dans une microcentrifugeuse de table à 3 000 x g pendant 10 s à RT, puis incuber à RT pendant 5 min.
- Ajouter les 200 μL du mélange de transfection dans un puits de la plaque cellulaire HeLa à 12 puits pour obtenir un volume final de 1,0 mL par puits et incuber la plaque à 37 °C pendant 48 heures.
- Après incubation, extraire l’ARN des cellules HeLa transfectées avec du thiocyanate de guanidine et une solution de phénol disponibles dans le commerce.
REMARQUE: Ce réactif contient du phénol et cette étape doit être effectuée dans une hotte. L’utilisation d’eau traitée au DEPC est recommandée pour la remise en suspension de l’ARN extrait.- Aspirer le milieu usé et ajouter 500 μL de réactif dans chaque puits. Incuber à RT pendant 5 min.
- Homogénéiser en pipetant de haut en bas. Transférer ensuite la solution dans un nouveau tube de microcentrifugation de 1,5 mL.
- Ajouter 100 μL de chloroforme et vortex pendant 15 s.
- Centrifuger à 12 000 x g pendant 15 min à RT.
- Transférer 200 μL de la couche aqueuse supérieure contenant de l’ARN dans un nouveau tube de microcentrifugation de 1,5 mL.
- Ajouter 2 μg de glycogène et 200 μL d’isopropanol à chaque échantillon d’ARN. Mélanger en inversant les tubes.
- Prélever le précipité d’ARN par centrifugation à 12 000 x g pendant 10 min à 4 °C.
- Retirer et jeter le surnageant sans perturber la pastille d’ARN.
- Lavez la pastille deux fois en ajoutant 1,0 mL d’éthanol à 70 %, en inversant les tubes et en centrifugant comme décrit à l’étape 2.13.7.
- Sécher la pastille à l’air libre pendant environ 10 à 20 minutes à TA et remettre en suspension l’ARN dans 10 à 20 μL d’eau sans RNase.
- Déterminer la concentration d’ARN en mesurant l’absorbance à 260 nm comme décrit par Desjardins et Conklin9.
- Procéder à l’extension de l’apprêt ou stocker les échantillons d’ARN à -20 °C. L’ARN isolé peut être stocké à -20 °C pendant 6 à 12 mois.
3. Marquage 32P des oligonucléotides
REMARQUE: Les étapes impliquant l’utilisation d’oligonucléotides marqués 32P-ATP et 32P doivent être effectuées derrière un bouclier acrylique par des personnes formées avec l’approbation d’entités institutionnelles autorisées. Le protocole décrit ci-dessous peut être utilisé pour le marquage des oligonucléotides, du Dup3r et de l’U17-26-R, ainsi que des marqueurs de l’urée-PAGE. L’utilisation d’eau traitée au DEPC est recommandée pour la remise en suspension d’oligonucléotides et de billes d’exclusion de taille.
- À un tube de microcentrifugation de 1,5 mL, ajouter l’oligonucléotide, la polynucléotide kinase T4 (T4 PNK), le tampon T4 PNK et le 32P-ATP comme décrit dans le tableau 1. Ajouter le 32P-ATP en dernier au mélange; C’est important.
REMARQUE: Pour l’ajout de solutions radioactives, l’utilisation d’embouts de filtre est recommandée. - Incuber au bain-marie à 37 °C pendant 30 min.
- Pendant que les réactions d’étiquetage sont en incubation, remettez en suspension les billes d’exclusion de taille avec un poids moléculaire de 25 kDa coupé en tourbillonnant doucement pendant environ 10 s.
REMARQUE: Les billes d’exclusion de taille doivent être préparées conformément aux instructions du fabricant et stockées sous forme de suspension à 50% dans de l’éthanol à 25% à 4 ° C. - Préparer les colonnes en transférant 600 μL des billes remises en suspension dans une mini-colonne jetable placée dans un tube de collecte de 1,5 mL et en ramenant le stock de billes à 4 °C.
- Centrifuger à 2 000 x g pendant 1 min à RT et jeter le flux à travers.
- Lavez les billes en ajoutant 300 μL d’eau sans RNase à la colonne.
- Répétez les étapes 3.5. et 3.6. deux fois et transférer la mini-colonne dans un nouveau tube de centrifugeuse de 1,5 mL.
- Ajouter le mélange de réaction kinase à la colonne de billes d’exclusion de taille et centrifuger à 5000 x g pendant 1 min à TA.
- Collectez et économisez le flux à travers, qui a l’oligonucléotide marqué 32P, et jetez tous les embouts et tubes dans une boîte à déchets en acrylique.
- Ajouter 20 μL d’eau sans RNase pour diluer l’oligonucléotide marqué 32P à une concentration finale de 2,5 μM.
REMARQUE: Diluer les marqueurs étiquetés au besoin pour le chargement sur les gels d’urée-PAGE. - Conservez l’oligonucléotide étiqueté dans une boîte à microtubes acryliques à -20 °C ou procédez à l’analyse de l’extension de l’apprêt.
4. Analyse des transcriptions épissées du journaliste par extension d’amorce
REMARQUE: Il est recommandé de nettoyer les surfaces et l’équipement avec un réactif inactivant la RNase avant utilisation.
- Ajouter 2,0 μg d’ARN extrait des cellules Hela dans des tubes de microcentrifugation séparés de 200 μL et ajouter de l’eau sans RNase pour augmenter le volume à 6,55 μL.
- Préparer le Mélange maître I avec le 32P-Dup3r dilué et les dNTP comme indiqué dans le tableau 2 et ajouter 0,9 μL du mélange à chaque tube pcR contenant des échantillons d’ARN.
- Incuber les tubes, d’abord à 65 °C pendant 5 min, puis sur de la glace pendant 1 min.
- Préparez master mix II avec 5x First Strand Buffer, du dithiothréitol (DTT), un inhibiteur de la RNase et une transcriptase inverse comme indiqué dans le tableau 2.
- Ajouter 2,55 μL du mélange à chaque tube contenant de l’ARN et Master Mix 1; le volume total de la réaction doit être de 10 μL. Maintenir les tubes à RT pendant 10 min.
- Transférer les tubes dans un bain sec ou un cycleur thermique et incuber, d’abord à 50 °C pendant 60 min, puis à 70 °C pendant 15 min.
- Après l’incubation, ajouter 10 μL de 2x colorant de chargement de l’ARN formamide à chaque échantillon et stocker dans une boîte en acrylique à -20 °C ou procéder à la séparation des fragments par l’urée-PAGE à l’aide d’un gel de 14 cm de long et visualisation de l’image du gel comme décrit ci-dessous à l’étape 8.
- Effectuez un balayage densitométrique de l’image du gel avec un logiciel d’analyse d’image et utilisez les intensités de bande des produits inclus et ignorés pour calculer le pourcentage d’inclusion de l’exon 2 comme indiqué ci-dessous.

5. Analyse des transcriptions épissées du rapporteur par RT-PCR fluorescente
REMARQUE: L’analyse RT-PCR décrite ci-dessous utilise des hexamères aléatoires pour la synthèse de l’ADNc et une combinaison d’oligonucléotides Dup8f et Dup3r marqués Cy5 non marqués pour l’amplification par PCR des produits épissés.
- Pour la synthèse de l’ADNc, ajoutez 2,0 μg d’ARN extrait des cellules Hela transfectées dans des tubes de microcentrifugation séparés de 200 μL et ajoutez de l’eau sans RNase pour augmenter le volume à 11,0 μL.
- Préparer le mélange principal I, contenant des hexamères aléatoires et du dNTP, comme indiqué dans le tableau 3 , et ajouter 2,0 μL du mélange à chaque échantillon. Incuber, d’abord à 65 °C pendant 5 min puis sur glace pendant 1 min.
- Préparer le Master Mix II, contenant le First Strand Buffer, l’inhibiteur de la RNase, la TNT et la transcriptase inverse comme indiqué dans le tableau 3 et ajouter 7,0 μL du mélange à chaque tube contenant de l’ARN et du Master Mix I.
- Maintenir les tubes à RT pendant 10 min, puis incuber à 50 °C pendant 60 min et 70 °C pendant 15 min.
REMARQUE : Les réactions d’ADNc terminées peuvent être conservées à -20 °C. - Pour la PCR, transférer 1,0 μL (100 ng/μL) de chaque échantillon d’ADNc vers de nouveaux tubes de PCR.
- Préparer un mélange maître composé de Dup8f, Cy5-Dup3r, dNTPs, tampon Taq, Taq polymérase et eau comme décrit dans le tableau 4 et ajouter 11,5 μL du mélange à chaque tube contenant de l’ADNc.
- Effectuer la PCR à l’aide d’un cycleur thermique avec une étape de dénaturation initiale à 94 °C pendant 3 min; suivi de 20 cycles de dénaturation (94 °C pendant 30 s), de recuit (65 °C pendant 30 s) et d’extension (72 °C pendant 15 s), et d’une étape de terminaison à 72 °C pendant 5 min.
- Ajouter 12,5 μL de 2x colorant de chargement d’ADN formamide dans chaque tube et chauffer à 95 °C pendant 5 min.
- Conservez la réaction pcr à -20 °C ou procédez avec de l’urée-PAGE comme décrit ci-dessous à l’étape 8.1-8.4.
- Après l’électrophorèse, retirez les plaques de verre de l’appareil d’électrophorèse et scannez à l’aide d’un imageur à fluorescence pour visualiser le gel.
- Effectuez un balayage densitométrique de l’image du gel et utilisez l’intensité de la bande des produits inclus et des produits sautés pour calculer le pourcentage d’inclusion de l’exon 2 comme décrit à l’étape 4.8.
6. Analyse de l’expression de l’ARNn de la variante U1 par extension d’amorce
- Ajouter 2,0 μg d’ARN extrait des cellules Hela dans des tubes de microcentrifugation séparés de 200 μL et ajouter de l’eau sans RNase pour augmenter le volume à 4,325 μL, puis ajouter du dATP, comme indiqué dans le tableau 5.
- Ajouter 10 000 CPM de l’oligonucléotide 32P-U17-26-R à chaque tube.
REMARQUE : Pour préparer une solution de 32P-U17-26-R à 10 000 cpm/μL (à partir de l’étape 3), diluer l’oligonucléotide marqué (dilution 1:20), déterminer le cpm dans 1,0 μL à l’aide d’un compteur de scintillation et diluer davantage avec de l’eau désionisée pour préparer une solution de 10 000 cpm/μL dans un nouveau tube de microcentrifugation de 1,5 mL. - Incuber à 65 °C pendant 5 min, puis sur glace pendant 1 min.
- Préparez un mélange principal avec 5x First Strand Buffer, un inhibiteur de RNase, un DTT et une transcriptase inverse comme indiqué dans le tableau 5 et ajoutez 1,8 μL du mélange à chaque échantillon.
- Incuber, d’abord à RT pendant 10 min, puis à 42 °C pendant 10 min.
- Après incubation, ajouter 10 μL de 2x colorant de chargement d’ARN formamide dans chaque échantillon et conserver dans une boîte en acrylique à -20 °C ou procéder à la séparation des fragments par urée-PAGE à l’aide d’un gel de 38 cm de long (voir étape 8).
7. Analyse de l’expression de l’ARNn de variante U1 par RT-qPCR
- Diluer le stock d’ADNc préparé comme décrit ci-dessus aux étapes 5.1 à 5.4 à une concentration de 0,2 ng/μL.
- Pipette 5,0 μL d’ADNc dilué dans des puits individuels d’une plaque de qPCR de 96 puits en triple. Ajoutez de l’eau désionisée au lieu de l’ADNc pour le contrôle sans gabarit (NTC).
- Préparer deux mélanges d’amorce distincts composés des amorces avant et arrière pour les SNRNA U1 et U2, et de l’eau comme indiqué dans le tableau 6.
REMARQUE : Les séquences pour les amorces spécifiques à l’ARNN U1 et U2 sont fournies dans le tableau 7. - Ajouter 5,0 μL du mélange d’amorce d’ARNnc U1 et U2 à l’échantillon et aux puits NTC.
- Ajouter 10,0 μL de mélange PCR en temps réel à chaque puits.
- Scellez les plaques avec un film optique, puis centrifugez à 1 000 x g pendant 2 min à RT pour recueillir les réactions au fond des puits.
- Effectuer la qPCR avec une étape de dénaturation initiale à 95 °C pendant 10 min, suivie de 40 cycles d’un protocole en 2 étapes comprenant la dénaturation (95 °C pendant 15 s) et le recuit/extension (62 °C pendant 60 s) tout en collectant les valeurs du cycle de quantification seuil (Cq) des amplicons cibles.
- Terminez la réaction qPCR en vérifiant la présence d’un seul pic dans la courbe de dissociation pour les réactions DNNC U1 et U2.
- À partir des valeurs Cq, calculez delta Cq (ΔCq) pour les SnRNA U1 et U2 par rapport au contrôle de l’ADPc.
- Déterminer l’expression de l’ARNn de la variante U1 en tant que quantité relative (QR) de U1 par rapport à U2 en utilisant la valeur ΔΔCq comme indiqué ci-dessous pour tous les échantillons.

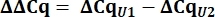
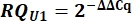
8. Configuration et fonctionnement des gels Urea-PAGE
REMARQUE: L’assemblage des plaques de verre et de l’appareil de fonctionnement du gel doit être effectué conformément aux instructions du fabricant. La coulée du gel 10% d’urée-PAGE peut être réalisée selon un protocole préalablement décrit par Summer et al.10. Les étapes impliquant la préparation de marqueurs et d’échantillons, ainsi que l’exécution et la visualisation de gels sont décrites ci-dessous. En option, pour empêcher le gel de coller aux plaques de verre, la surface intérieure peut être recouverte d’une solution de silicone en ajoutant 1 mL de la solution sur la surface et en s’étalant uniformément sur toute la surface avec du tissu. Une fois sèches, les plaques doivent être lavées à l’eau désionisée et séchées à nouveau.
ATTENTION : L’acrylamide non polylymérisé est neurotoxique et doit être manipulé avec les protections recommandées dans la fiche de données de sécurité.
- Préparer les échantillons d’extension d’apprêt et les marqueurs en chauffant à 95 °C pendant 5 min, puis en centrifugant dans une microcentrifugeuse de table à 3 000 x g pendant 5 s à TA.
- Avant de charger les marqueurs et les échantillons, rincer les puits avec 1 tampon TBE pour éliminer l’urée décantée.
- Chargez 10 μL / échantillon / puits et faites fonctionner le gel à 300-500V pendant 2-3 heures ou jusqu’à ce que le xylène cyanol atteigne le fond.
REMARQUE: Environ 1 000 cpm du marqueur étiqueté 32P peuvent être chargés. - Après l’électrophorèse, retirez les plaques de verre de l’appareil d’électrophorèse.
- Séparez soigneusement les deux plaques afin que le gel repose à plat sur l’une ou l’autre surface en verre et transférez le gel sur un papier filtre et recouvrez-le d’une pellicule de plastique.
- Sécher sous vide le gel sur le papier filtre à 80 °C pendant 30 min à l’aide d’un séchoir à gel.
- Placez le gel séché dans une cassette d’imagerie au phosphore et conservez-le à TA pendant la nuit.
REMARQUE: L’écran au phosphore doit être effacé à l’aide d’une boîte à lumière avant utilisation. - Pour visualiser l’image du gel, retirez l’écran et numérisez à l’aide d’un imageur au phosphore.
Résultats
Le rapporteur d’épissage Dup51, un minigène d’intron à trois exons-deux, a été dérivé du gène humain β-globine et a été décrit précédemment (Figure 1A)11,12 . Nous avons créé un rapporteur mutant, Dup51p, en introduisant des mutations du site d’épissure associées au syndrome d’Usher qui se produisent dans l’exon 3 du gène de la protocadhérine 15 (PCDH15)13. La séquence d...
Discussion
Le test peut être adapté pour l’analyse d’épissage dans des lignées cellulaires autres que HeLa, cependant, les facteurs affectant l’efficacité de la transfection, tels que la confluence cellulaire et la quantité d’ADN peuvent devoir être optimisés. Le rapport de construction rapporteur/U1 est un autre paramètre critique qui peut devoir être déterminé en fonction des niveaux d’expression observés dans d’autres types de cellules. La qualité de l’ARN extrait est essentielle pour l’analyse de l...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des fonds versés à S.S. par les National Institutes of Health (R21CA170786 et R01GM127464) et à l’American Cancer Society (l’Institutional Research Grant 74-001-34-IRG) et à S.S. et W.M. du Valley Research Partnership Program (P1-4009 et VRP77). Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les points de vue officiels des National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Reagent Grade Deionized Water | ThermoFisher Scientific | 23-751628 | |
| Diethyl pyrocarbonate (DEPC) | Sigma-Aldrich | D5758-25ML | |
| Dulbecco's Modified Eagle Medium (DMEM) powder packet | Gibco | 12100-046 | |
| Sodium Bicarbonate | ThermoFisher Scientific | S233-500 | |
| Fetal Bovine Serum (FBS), Australian Source, Heat Inactivated | Omega Scientific | FB-22 | |
| Penicillin-Streptomycin (P/S) | Sigma-Aldrich | P4458-100ML | |
| Sodium Hydroxide, Standard Solution 1.0N | Sigma-Aldrich | S2567-16A | |
| Hydrochloric Acid, Certified ACS Plus, 36.5 to 38.0% | ThermoFisher Scientific | A144-500 | |
| Disposable PES Bottle Top Filters | ThermoFisher Scientific | FB12566510 | |
| EDTA Disodium Salt Dihydrate | Amresco | 0105-2.5KG | |
| 2.5% Trypsin (10x), no phenol red | ThermoFisher Scientific | 15090046 | |
| Sodium Chloride | Fisher Bioreagent | BP358-212 | |
| Potassium Chloride | Fisher Bioreagent | BP366-1 | |
| Disodium Hydrogen Phosphate Heptahydrate | Fisher Bioreagent | BP332-1 | |
| Potassium Dihydrogen Phosphate | Fisher Bioreagent | BP362-1 | |
| Transfection medium - Opti-MEM™ I Reduced Serum Medium, no phenol red | ThermoFisher Scientific | 11058021 | |
| Transfection Reagent - Lipofectamine™ 2000 | ThermoFisher Scientific | 13778150 | |
| TRIzol™ Reagent | ThermoFisher Scientific | 15596018 | |
| Chloroform (Approx. 0.75% Ethanol as Preservative/Molecular Biology) | ThermoFisher Scientific | BP1145-1 | |
| Ethanol, Absolute (200 Proof), Molecular Biology Grade, Fisher BioReagents | ThermoFisher Scientific | BP2818-4 | |
| Isopropanol, Molecular Biology Grade, Fisher BioReagents | ThermoFisher Scientific | BP2618-212 | |
| Glycogen (5 mg/ml) | ThermoFisher Scientific | AM9510 | |
| Direct-zol RNA Miniprep Kit | Zymo Research | R2052 | |
| ATP, [γ-32P]- 6000Ci/mmol 150mCi/ml Lead, 1 mCi | PerkinElmer | NEG035C001MC | |
| T4 Polynucleotide Kinase | New England Biolabs | M0201L | |
| Size exclusion beands - Sephadex® G-25 | Sigma-Aldrich | G2580-10G | |
| Size exclusion mini columns | USA Scientific | 1415-0600 | |
| pBR322 DNA-MspI Digest | New England Biolabs | N3032S | |
| Low Molecular Weight Marker, 10-100 nt | Affymetrix | 76410 100 UL | |
| Rnase inactivating reagents - RNaseZAP™ | Sigma-Aldrich | R2020-250ML | |
| dNTP Mix (10 mM ea) | ThermoFisher Scientific | 18427013 | |
| RNaseOUT™ Recombinant Ribonuclease Inhibitor | ThermoFisher Scientific | 10777019 | |
| Reverse Transcriptase - M-MLV Reverse Transcriptase | ThermoFisher Scientific | 28025013 | used for primer extension |
| Taq DNA Polymerase | ThermoFisher Scientific | 10342020 | |
| Random Hexamers (50 µM) | ThermoFisher Scientific | N8080127 | |
| Real time PCR mix - SYBR™ Select Master Mix | ThermoFisher Scientific | 4472903 | |
| SuperScript™ III Reverse Transcriptase | ThermoFisher Scientific | 18080093 | used for cDNA preparation |
| Dithiothreitol (DTT) | ThermoFisher Scientific | 18080093 | |
| 5X First-Strand Buffer | ThermoFisher Scientific | 18080093 | |
| Formamide (≥99.5%) | ThermoFisher Scientific | BP228-100 | Review Material Safety Data Sheets |
| Bromophenol Blue sodium salt | Sigma-Aldrich | 114405-5G | |
| Xylene Cyanol FF | Sigma-Aldrich | 2650-17-1 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | ThermoFisher Scientific | BP152-5 | |
| Boric Acid (Crystalline/Electrophoresis) | ThermoFisher Scientific | BP168-500 | |
| Acrylamide: Bis-Acrylamide 19:1 (40% Solution/Electrophoresis) | ThermoFisher Scientific | BP1406-1 | Review Material Safety Data Sheets |
| Urea (Colorless-to-White Crystals or Crystalline Powder/Mol. Biol.) | ThermoFisher Scientific | BP169-212 | |
| Ammonium peroxodisulphate (APS) ≥98%, Pro-Pure, Proteomics Grade | VWR | M133-25G | |
| Sigmacote | Sigma-Aldrich | SL2-100ML | |
| N,N,N',N'-Tetramethylethylenediamine (TEMED) ≥99%, Ultrapure | VWR | 0761-25ML | Review Material Safety Data Sheets |
| Adjustable Slab Gel Systems, Expedeon | VWR | ASG-400 | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 14.5cm | VWR | NGP-125NR | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 22.0cm | VWR | NGP-200NR | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 38.7cm | VWR | NGP-400NR | |
| GE Storage Phosphor Screens | Sigma-Aldrich | GE28-9564 | |
| Typhoon™ FLA 7000 Biomolecular Imager | GE Healthcare | 28-9610-73 AB | |
| Beckman Coulter LS6500 Liquid Scintillation Counter | GMI | 8043-30-1194 | |
| C1000 Touch Thermal Cycler | ThermoFisher Scientific | ||
| QuantStudio 6 Flex Real-Time PCR Systems | ThermoFisher Scientific |
Références
- Zhuang, Y., Weiner, A. M. A compensatory base change in U1 snRNA suppresses a 5' splice site mutation. Cell. 46 (6), 827-835 (1986).
- Scotti, M. M., Swanson, M. S. RNA mis-splicing in disease. Nature Review Genetics. 17 (1), 19-32 (2016).
- Ward, A. J., Cooper, T. A. The pathobiology of splicing. Journal of Pathology. 220 (2), 152-163 (2010).
- Scalet, D., et al. Disease-causing variants of the conserved +2T of 5' splice sites can be rescued by engineered U1snRNAs. Human Mutatation. 40 (1), 48-52 (2019).
- Yamazaki, N., et al. Use of modified U1 small nuclear RNA for rescue from exon 7 skipping caused by 5'-splice site mutation of human cathepsin A gene. Gene. 677, 41-48 (2018).
- Yanaizu, M., Sakai, K., Tosaki, Y., Kino, Y., Satoh, J. I. Small nuclear RNA-mediated modulation of splicing reveals a therapeutic strategy for a TREM2 mutation and its post-transcriptional regulation. Science Reports. 8 (1), 6937 (2018).
- Balestra, D., et al. Splicing mutations impairing CDKL5 expression and activity can be efficiently rescued by U1snRNA-based therapy. International Journal of Molecular Sciences. 20 (17), 20174130 (2019).
- Donadon, I., et al. Exon-specific U1 snRNAs improve ELP1 exon 20 definition and rescue ELP1 protein expression in a familial dysautonomia mouse model. Human Molecular Genetics. 27 (14), 2466-2476 (2018).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments. (45), e2565 (2010).
- Summer, H., Gramer, R., Droge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). Journal of Visualized Experiments. (32), e1485 (2009).
- Dominski, Z., Kole, R. Selection of splice sites in pre-mRNAs with short internal exons. Molecular Cell Biology. 11 (12), 6075-6083 (1991).
- Amir-Ahmady, B., Boutz, P. L., Markovtsov, V., Phillips, M. L., Black, D. L. Exon repression by polypyrimidine tract binding protein. RNA. 11 (5), 699-716 (2005).
- Le Guedard-Mereuze, S., et al. Sequence contexts that determine the pathogenicity of base substitutions at position +3 of donor splice-sites. Human Mutation. 30 (9), 1329-1339 (2009).
- Sharma, S., Wongpalee, S. P., Vashisht, A., Wohlschlegel, J. A., Black, D. L. Stem-loop 4 of U1 snRNA is essential for splicing and interacts with the U2 snRNP-specific SF3A1 protein during spliceosome assembly. Genes and Development. 28 (22), 2518-2531 (2014).
- Steitz, J. A., et al. . Functions of the abundant U-snRNPs. Structure and function of major and minor small nuclear ribonucleoprotein particles. , 115-154 (1988).
- Fortes, P., et al. Inhibiting expression of specific genes in mammalian cells with 5' end-mutated U1 small nuclear RNAs targeted to terminal exons of pre-mRNA. Proceedings of the National Academy of Sciences U.S.A. 100 (14), 8264-8269 (2003).
- Roca, X., et al. Widespread recognition of 5' splice sites by noncanonical base-pairing to U1 snRNA involving bulged nucleotides. Genes and Development. 26 (10), 1098-1109 (2012).
- Roca, X., Krainer, A. R. Recognition of atypical 5' splice sites by shifted base-pairing to U1 snRNA. Nature Structural Molecular Biology. 16 (2), 176-182 (2009).
- Taladriz-Sender, A., Campbell, E., Burley, G. A. Splice-switching small molecules: A new therapeutic approach to modulate gene expression. Methods. 167, 134-142 (2019).
- Hamid, F. M., Makeyev, E. V. A mechanism underlying position-specific regulation of alternative splicing. Nucleic Acids Research. 45 (21), 12455-12468 (2017).
- Martelly, W., et al. Synergistic roles for human U1 snRNA stem-loops in pre-mRNA splicing. RNA Biology. , 1-18 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon