Method Article
Caractérisation des jonctions neuromusculaires chez la souris par microscopie confocale et super-résolution combinée
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit une méthode d’analyse morphométrique des jonctions neuromusculaires par microscopie confocale et STED combinée qui est utilisée pour quantifier les changements pathologiques dans les modèles murins de SMA et de CMS liés à ColQ.
Résumé
Les jonctions neuromusculaires (JNM) sont des synapses hautement spécialisées entre les motoneurones inférieurs et les fibres musculaires squelettiques qui jouent un rôle essentiel dans la transmission des molécules du système nerveux aux muscles volontaires, conduisant à la contraction. Ils sont affectés dans de nombreuses maladies humaines, y compris les troubles neuromusculaires héréditaires tels que la dystrophie musculaire de Duchenne (DMD), les syndromes myasthéniques congénitaux (CMS), l’amyotrophie spinale (SMA) et la sclérose latérale amyotrophique (SLA). Par conséquent, la surveillance de la morphologie des jonctions neuromusculaires et de leurs altérations dans les modèles murins de maladie représente un outil précieux pour les études pathologiques et l’évaluation préclinique des approches thérapeutiques. Ici, les méthodes de marquage et d’analyse de la morphologie tridimensionnelle (3D) des parties pré- et postsynaptiques des plaques d’extrémité motrices à partir de fibres musculaires murines taquinées sont décrites. Les procédures de préparation des échantillons et de mesure du volume, de la surface, de la tortuosité et de la morphologie/occupation terminale de l’axone par imagerie confocale, ainsi que la distance entre les plis jonctionnels postsynaptiques et la largeur de bande du récepteur de l’acétylcholine (AChR) par microscopie à déplétion par émission stimulée à super-résolution (STED) sont détaillées. Les altérations de ces paramètres NMJ sont illustrées chez des souris mutantes affectées par SMA et CMS.
Introduction
La jonction neuromusculaire (NMJ) est une structure complexe composée d’un axone moteur terminal, d’une cellule de Schwann périsynaptique et d’une partie de myofibre squelettique impliquée dans la transmission de l’information chimique et le couplage de l’activité des motoneurones inférieurs à la contraction musculaire. Chez les mammifères, la morphologie de la jonction neuromusculaire change au cours du développement, adoptant une forme typique de bretzel après la maturation, avec des différences de forme et de complexité entre les espèces, et montre un certain degré de plasticité en réponse à des processus physiologiques tels que l’exercice ou le vieillissement 1,2,3,4 . La plaque motrice postsynaptique forme des invaginations membranaires appelées plis jonctionnels, où la partie supérieure contenant les récepteurs de l’acétylcholine (AChR) est en contact étroit avec la branche5 de l’axone terminal présynaptique.
Les changements morphologiques et fonctionnels dans les jonctions neuromusculaires contribuent à la physiopathologie de plusieurs troubles neurodégénératifs tels que l’amyotrophie spinale (SMA) et la sclérose latérale amyotrophique (SLA), les myopathies comme la dystrophie musculaire de Duchenne (DMD), les syndromes myasthéniques congénitaux (CMS), la myasthénie grave (MG) et les myopathies centronucléaires (CNM), et la sarcopénie associée au vieillissement 3,6,7,8,9, 10,11,12. Dans ces maladies, on observe des altérations structurelles de la NMJ telles que la fragmentation de la plaque terminale, la réduction de la taille du pli jonctionnel postsynaptique et / ou la dénervation. La pathologie des NMJ peut être un événement primaire ou précoce au cours de la progression de la maladie ou apparaître plus récemment comme un événement secondaire contribuant aux manifestations cliniques. Dans tous les cas, le suivi de la morphologie des NMJ dans des modèles animaux de ces maladies représente un paramètre précieux pour étudier les changements pathologiques et évaluer l’efficacité des traitements potentiels.
La morphologie des jonctions neuromusculaires est généralement analysée par des techniques utilisant la microscopie confocale 2,13,14,15 ou la microscopie électronique 5,16, avec leurs limitations inhérentes telles que la résolution ou les difficultés techniques, respectivement. Plus récemment, la microscopie à super-résolution a également été utilisée pour visualiser des régions particulières de la NMJ, telles que les zones actives présynaptiques ou la distribution AChR sur la membrane postsynaptique16,17,18, comme approche alternative ou complémentaire à l’analyse ultrastructurale par microscopie électronique.
Ce protocole vise à fournir une méthode détaillée et reproductible pour évaluer les paramètres morphologiques NMJ en combinant la microscopie confocale à fluorescence et la microscopie à déplétion par émission stimulée (STED). Des caractéristiques importantes des plaques terminales présynaptiques et postsynaptiques, telles que le volume, la surface, la tortuosité relative, la largeur de la bande AChR et la distribution terminale de l’axone dans les fibres musculaires innervées de gastrocnémiens et tibiaux antérieurs de souris ont été quantifiées dans le contexte de conditions normales et malades. En particulier, les défauts de la NMJ ont été illustrés dans le modèle murin Smn 2B / - de l’amyotrophie spinale, une maladie neuromusculaire avec dégénérescence des motoneurones causée par des mutations du gène SMN1 11,19, et dans une sous-unité de queue semblable au collagène de souris asymétriques à knockout de l’acétylcholinestérase (ColQ Dex2 / Dex2 ou ColQ-KO), comme modèle du syndrome myasthénique congénital 20, 21,22.
Protocole
Les soins et la manipulation des souris ont été effectués conformément à la législation nationale et européenne sur l’expérimentation animale et approuvés par le comité d’éthique institutionnel. Les mâles et les femelles des souris Smn2B/- (fond C57Bl/6J) et ColQ Dex2/Dex2 (fond B6D2F1/J) à l’âge de 3 et 6 semaines, respectivement, ont été utilisés dans l’étude.
1. Euthanasie de souris et dissection des muscles : tibial antérieur et gastrocnémien
- Procéder à l’anesthésie de souris par injection intrapéritonéale d’une solution mixte de kétamine (87,5 mg/kg)/xylazine (12,5 mg/kg) (0,1 mL/20 g de poids corporel) avant l’euthanasie par luxation cervicale.
REMARQUE : Étant donné que l’AMS et le ColQ-CMS affectent les individus indépendamment de leur sexe, les souris mâles et femelles ont été utilisées dans le présent protocole. - Enlevez les poils des membres postérieurs à l’aide d’un petit rasoir électrique et rincez les jambes avec de l’éthanol à 70%.
REMARQUE: La procédure de dissection sera différente pour chaque muscle. Pour la dissection du tibial antérieur (TA), suivez les étapes 1.2.1 à 1.2.3, et pour le gastrocnémien (GA) (parties médiale et latérale), suivez les étapes 1.2.4 à 1.2.6. Manipulez les muscles doucement pour éviter d’endommager les tissus et de les écraser ou de les étirer pendant la dissection.- Placez la souris en décubitus dorsal.
- Faites une incision cutanée de 5 mm avec des ciseaux tranchants-émoussés le long de la partie antéro-externe du membre postérieur distal, parallèle au tibia, pour exposer le muscle. Utilisez des ciseaux extra-minces pour enlever le fascia.
- Coupez d’abord le tendon distal (près de la patte), puis le tendon proximal (près du genou) à l’aide de ciseaux extra-minces et d’une pince mince incurvée. Manipulez le muscle avec précaution pour éviter d’endommager les myofibres et les nerfs.
REMARQUE: Le tendon proximal doit être sectionné le plus près possible de l’os pour prélever tout le muscle. - Placez la souris en position couchée, utilisez des ciseaux tranchants et émoussés pour pratiquer une incision cutanée de la partie supérieure du compartiment postérieur distal jusqu’à la patte et retirez la peau.
- Saisissez le tendon d’Achille avec une pince dentelée moyenne, coupez-le avec un ciseau extra-mince et séparez doucement le GA du tissu environnant jusqu’à son insertion proximale.
- Du côté proximal, insérez la pince dentelée moyenne dans la poche formée entre le biceps fémoral (BF) et le GA. Séparez les deux muscles pour couper le tendon GA le plus près possible de l’insertion osseuse avec un ciseau extra-fin.
- Pour la fixation des tissus, placer chaque muscle dans un tube microcentrifuge de 2 mL contenant 1 mL de solution de paraformaldéhyde (PFA) à 4 % p/v diluée dans une solution saline tampon phosphate (PBS sans Ca 2+Mg 2+) et maintenir à 4 °C pendant 18-24 h.
ATTENTION : Le paraformaldéhyde et le formaldéhyde sont toxiques et doivent être manipulés dans une hotte chimique munie d’un équipement de protection adéquat. - Le lendemain, laver les muscles fixes 3x pendant 5 min avec du PBS dans des plaques à 12 puits en agitant doucement à température ambiante (RT) à l’intérieur d’une hotte chimique.
REMARQUE: Le protocole peut être arrêté à cette étape et poursuivi dans un délai d’un mois. Dans ce cas, ajouter du PBS supplémenté en azoture de sodium à 0,01 % pour conserver les échantillons à 4 °C. - Taquinez chaque muscle en petits faisceaux de fibres d’environ 1 mm de large à l’aide de deux pinces dentelées fines.
REMARQUE: Il est crucial de manipuler les muscles très doucement avec la pince, sans force excessive, pour éviter les dommages aux tissus pendant les taquineries.- Dissociez le muscle TA en 3 ou 4 faisceaux selon sa taille.
- Pour l’AG, séparez les parties médiale et latérale du muscle, puis dissociez chaque partie en 4-5 faisceaux en fonction de leur taille.
2. Immunomarquage
- Procéder à la perméabilisation des fibres musculaires : Transférer les faisceaux musculaires dans des plaques à 24 puits contenant 1 % (v/v) de Triton X-100 dans du PBS et les maintenir sous agitation douce (50 tr/min) pendant 1 h à TA ou 5 h à 4 °C.
REMARQUE: Divisez les faisceaux musculaires entre deux plaques pour procéder à des immunocolorations séparées et minimiser le risque de confusion des anticorps. Ne les divisez pas en plus de deux puits (1 puits/assiette); sinon, le nombre (N) de NMJ qui sont représentatifs de leur état général dans le muscle analysé peut être insuffisant. - Laver les échantillons 3x pendant 5 min avec du PBS à TA et les incuber avec une solution bloquante composée de 4% d’albumine sérique bovine (BSA) dans PBS/Triton X-100 1% pendant 4 h à 4 °C, sous agitation douce (50 rpm).
NOTE: N’utilisez pas de pompe d’aspiration pendant les étapes de lavage, mais aspirez plutôt la solution manuellement avec une pipette de 200 μL et des embouts de petite taille (la référence est indiquée dans le tableau des matériaux). - Incuber les échantillons pendant une nuit (O/N) à 4 °C sous agitation douce (50 rpm) avec la solution de blocage indiquée à l’étape 2.2 contenant des anticorps monoclonaux primaires dirigés contre le neurofilament M (NF-M, 2H3, dilution 1/200) ou la glycoprotéine 2 des vésicules synaptiques (SV2, dilution 1/200) pour marquer respectivement les terminaisons axonales présynaptiques ou les zones actives.
- Le lendemain, laver les faisceaux musculaires 3x pendant 5 min dans du PBS sous agitation (50 tr/min).
- Pour l’imagerie confocale: Incuber les faisceaux musculaires avec des anticorps anti-souris secondaires conjugués avec un fluorophore émetteur rouge (F594) (dilution 1/500) et α-bungarotoxine conjugué avec un fluorophore émettant du vert (α-BTX-F488) (dilution 1/1000) dans PBS pendant 2 h à TA sous agitation (50 rpm).
- Pour l’imagerie STED : Incuber les faisceaux musculaires avec des anticorps anti-souris secondaires conjugués à un fluorophore émetteur vert (F488) (dilution 1/500) et α-bungarotoxine conjugué à un fluorophore émetteur de rouge lointain caractérisé par une photostabilité élevée (α-BTX-F633) (dilution 1/1000) dans du PBS pendant 2 h à TA sous agitation (50 rpm).
REMARQUE: Ne pas exposer les échantillons à la lumière pendant l’incubation pour éviter le photoblanchiment.
- Lavez les faisceaux musculaires étiquetés 3x pendant 5 min avec du PBS sous agitation (50 tr/min) et placez-les sur une lame avec un support de montage.
REMARQUE: Placez un maximum de 4 à 5 faisceaux musculaires par lame pour permettre l’étanchéité. - Ajoutez un couvercle en verre de grade #1.5 (ou #1.5H) (0,17 mm d’épaisseur) sur le dessus et placez des aimants cylindriques des deux côtés de la glissière pour appliquer une pression et aplatir les muscles.
- Gardez les lames à l’abri de la lumière O/N à 4°C. Scellez les lames de façon permanente avec du vernis à ongles.
3. Acquisition d’images
- Acquisitions au microscope confocal
REMARQUE: Les images ont été collectées avec un microscope confocale à balayage laser inversé en utilisant un objectif d’immersion dans l’huile de magnitude 63x (HCX Plan Apo CS, ouverture numérique (NA) de 1,4%).- Pour l’analyse en aveugle, laissez une personne non impliquée dans l’analyse coder chaque diapositive avec un numéro donné. Rester en aveugle des groupes expérimentaux jusqu’à ce que la quantification des paramètres NMJ soit terminée pour tous les échantillons.
- Lancez le logiciel du microscope en mode Configuration > machine.xlhw (Figure 1 supplémentaire).
- Placez la lame sur la platine du microscope et trouvez le plan d’observation dans l’échantillon en regardant sous l’éclairage de fluorescence à grand champ DAPI avec le filtre DAPI.
- Cliquez sur Ouvrir le projet > Nouveaux projets et créez un dossier pour stocker les acquisitions d’images (Figure 1 supplémentaire).
Remarque : Créez un nouveau projet pour chaque NMJ pour limiter la taille du dossier et éviter les problèmes de mémoire de l’ordinateur. - Pour gérer les paramètres d’acquisition, cliquez sur la fenêtre de l’onglet Acquisition et réglez le trou d’épingle confocale sur 1,0 Airy unité et puissance laser pour optimiser les niveaux de gain et de décalage pour la fluorescence verte/F488 (α-BTX) à l’aide d’un laser de 488 nm à la plaque d’extrémité qui doit être imagé (mode Live ON).
- Ensuite, optimisez l’acquisition de fluorescence rouge/F594 (NF-M ou SV2) à l’aide d’un laser adapté à l’observation F594. Dans cette étude, un laser de 552 nm a été utilisé (mode Live ON). Réglez le spectre d’émission de colorant avec les plages suivantes pour chaque laser : laser 405 (DAPI) de 414 à 483 nm, laser 488 (F488-α-BTX) de 506 à 531 nm et laser 552 (NF-M/SV2) de 622 à 650 nm.
- Collectez des piles d’images de jonctions neuromusculaires dans chaque groupe expérimental avec les mêmes paramètres : taille d’image 1024 x 1024 pixels (73,7 x 73,7 μm) à une fréquence d’échantillonnage de 400 Hz, bidirectionnel X ON, facteur de zoom 2,5, taille Z-step 0,5 μm en mode Z-Wide.
REMARQUE : Pour chaque NMJ, le nombre de tranches est défini pour acquérir la jonction entière. Les paramètres d’acquisition décrits ci-dessus remplissent le théorème d’échantillonnage de Nyquist-Shanon. Cependant, l’utilisateur peut cliquer sur le bouton Optimiser le format , présent sur tous les logiciels d’exploitation confocaux récents, pour s’assurer que la taille des pixels et l’étape Z répondent au taux d’échantillonnage Nyquist idéal. Cette action évitera les images suréchantillonnées ou sous-échantillonnées, ce qui entraînera une perte de précision dans les mesures de volume. - Enregistrez le fichier d’origine (.lif) ou les images Z-stack (.tif) dans un dossier dont le nom inclut le nom de code de la diapositive, le type de coloration et le numéro de la plaque d’extrémité.
REMARQUE: Collectez séquentiellement (pas simultanément) les balayages à l’aide des lasers 488 nm et 552 nm (F488 et F594) pour éviter la diaphonie de la fluorescence F488 dans le canal F594 et vice versa (purge). NB : le trajet du faisceau peut être configuré avec l’assistant de colorant dans le logiciel de microscope. - Passez à la diapositive codée suivante et répétez les étapes 3.1.3 à 3.1.8 pour chaque NMJ.
- À la fin de la session, cliquez sur Ouvrir dans 3D Viewer et choisissez un NMJ représentatif d’un groupe expérimental pour visualiser l’étiquetage 3D.
Remarque : Ce mode d’affichage permet de vérifier que les paramètres d’acquisition sont corrects. - Fermez le logiciel du microscope, nettoyez les objectifs avec des mouchoirs en papier, puis éteignez le système.
- Acquisitions par microscopie STED
REMARQUE: Les images ont été collectées avec un microscope confocal à balayage laser inversé équipé de Gated STED à 775 nm en utilisant un objectif d’immersion dans l’huile 100x (HC PL APO CS2 1.4 NA).- Pour l’analyse en aveugle, laissez une personne non impliquée dans l’analyse coder chaque diapositive avec un numéro donné. Rester en aveugle des groupes expérimentaux jusqu’à ce que la quantification des paramètres NMJ soit terminée pour tous les échantillons.
- Lancez le logiciel du microscope en mode Configuration > machine.xlhw et STED ON (Figure 2 supplémentaire).
- Cliquez sur Ouvrir le projet > Nouveaux projets pour créer un dossier pour stocker les acquisitions d’images.
Remarque : Générer un nouveau dossier pour chaque diapositive pour limiter la taille du dossier et éviter les problèmes de mémoire de l’ordinateur. - Placez la lame sur la platine du microscope et visualisez-la sous éclairage de fluorescence à grand champ à l’aide du laser de 488 nm pour trouver le plan d’observation dans l’échantillon.
- Recherchez une JNM marquée avec des colorations de neurofilament M (NF-M) ou SV2 à l’aide du laser 488 nm avec une détection spectrale de 506-531 nm.
- Lorsqu’un NMJ a été identifié, cliquez sur Activer STED et commencez à acquérir des images dans une région qui contient plusieurs plis jonctionnels (Figure supplémentaire 3) en utilisant le laser 635 nm avec une détection spectrale de 640-750 nm.
REMARQUE: Faites attention à la table de consultation de saturation lors de l’acquisition d’image et cliquez sur le bouton LUT rapide pour éviter la surexposition (valeurs de gris >255; pour 8 bits). - Collectez les images de chaque groupe expérimental avec les mêmes paramètres : taille d’image 2048 x 2048 pixels (38,75 x 38,75 μm) à une fréquence d’échantillonnage de 400 Hz.
REMARQUE: La puissance du laser d’épuisement (STED) est réglée sur 65%. - Enregistrez les images avec un nom de fichier qui inclut le code de la diapositive.
REMARQUE: Il est possible de cliquer sur Format XY optimisé: Définir le format pour obtenir le meilleur réglage d’acquisition avec l’imagerie STED. - Passez à la diapositive codée suivante et répétez les étapes 3.2.3-3.2.8. Répétez cette procédure pour toutes les diapositives.
- À la fin de la session de microscopie STED, transférez les fichiers image sur un autre ordinateur et enregistrez les fichiers originaux (. lif) dans un lecteur ou un serveur externe.
- Éteignez le logiciel du microscope, nettoyez les objectifs avec les mouchoirs du cristallin, puis éteignez le système.
4. Analyse d’images - microscopie confocale
REMARQUE: Toutes les images ont été traitées avec des ordinateurs utilisant le système d’exploitation professionnel Microsoft Windows 10.
- Lancez ImageJ et une macro personnalisée pour calculer le volume de la plaque terminale NMJ postsynaptique, la zone de projection d’intensité maximale (MIP) et la tortuosité relative.
- Traitez les piles d’images NMJ à l’aide du freeware NIH ImageJ23, du plugin iGeodesic et de la macro personnalisée pour obtenir des mesures de paramètres NMJ. Lancez le logiciel ImageJ.
REMARQUE: La dernière version d’ImageJ est disponible gratuitement et peut être téléchargée24. Pour ouvrir les formats de fichiers propriétaires, le plugin Bio-Formats Package25 doit être téléchargé26 . Cette étape n’est pas nécessaire dans le cas où l’opérateur utilise Fidji car le plugin est déjà installé dans le logiciel. Le plugin iGeodesic27 pour calculer la tortuosité est également disponible en ligne28; vérifier la disponibilité de ce plugin dans la version ImageJ/Fiji qui sera utilisée. Les macros sur mesure sont également disponibles en ligne29. - Faites glisser et déposez le Macro_NMJ_VOL_Marinelloetal.ijm (personnalisé, fichier de codage supplémentaire 1) dans la fenêtre ImageJ; La macro sera ouverte dans une deuxième fenêtre. Dans cette nouvelle fenêtre, cliquez sur Macros > Exécuter la macro.
Remarque : la macro peut traiter à la fois les fichiers propriétaires et TIFF. Les fichiers doivent remplir les critères suivants : pour les formats de fichiers propriétaires, enregistrer une seule jonction (c’est-à-dire la pile d’images) par fichier, classés dans un dossier ; pour les images TIFF, les fichiers doivent être enregistrés dans un dossier contenant des sous-dossiers, chacun nommé JunctionX (X correspond à un numéro NMJ) avec les piles d’images d’une jonction donnée (RVB TIFF) (Figure supplémentaire 4). - Sélectionnez le dossier natif contenant les sous-dossiers Junction à analyser et cliquez sur Sélectionner.
- Dans le nouveau menu contextuel appelé Enregistrer le dossier, sélectionnez le dossier de stockage et cliquez sur Sélectionner.
- Dans le nouveau menu contextuel appelé Type d’image, sélectionnez le format des acquisitions Z-stack.
- Sélectionnez le canal RVB correspondant à la coloration d’intérêt et indiquez la taille de pixel XY et l’étape Z (z). La macro effectuera automatiquement l’analyse.
REMARQUE: Si des formats de fichiers propriétaires sont sélectionnés, la macro lit directement la taille des pixels et l’étape Z (z). Cependant, l’utilisateur doit toujours indiquer le canal d’intérêt (C1, C2 ou C3). La macro fournit une feuille de données (.csv) pour chaque paramètre de jonction (volume de la plaque d’extrémité, zone MIP et tortuosité) dans le dossier d’enregistrement. La macro génère également trois fichiers . TIF , qui correspondent au périmètre de Drawing_MaxprojX.tif de coloration α-BTX, DrawingJunctionX.tif et MIP MaxprojX.tif. Ces fichiers TIFF sont générés pour vérifier la qualité des acquisitions et pour s’assurer que le traitement de l’image a été effectué correctement.
Volume de la JNM postsynaptique (V) : La macro séparera les images d’une seule JNM et conservera le canal de la α-bungarotoxine F488 correspondant à la plaque terminale postsynaptique. La pile est segmentée à l’aide du seuil Otsu30 sur la tranche intermédiaire de la pile. L’image binaire résultante est dilatée de 1 pixel et la fonction Analyser les particules est utilisée pour mesurer la surface de la plaque d’extrémité de chaque objet détecté. Pour obtenir le volume NMJ postsynaptique, la macro additionne toutes les surfaces mesurées de la plaque terminale de la pile et le multiplie par la valeur Z-step (z) en μm.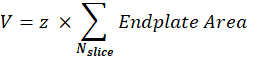
Zone de la plaque terminale de projection d’intensité maximale (MIP) : une fois la pile seuillée, la projection d’intensité maximale (MIP) est obtenue à l’aide de la fonction ImageJ du projet Z . La fonction Analyser les particules est ensuite utilisée pour quantifier la zone de la plaque terminale MIP.
Tortuosité NMJ MIP (T): La tortuosité NMJ, qui reflète le degré de complexité de la plaque d’extrémité du moteur postsynaptique, y compris les plis et les perforations31, est calculée sur la base de chaque MIP en utilisant la formule suivante, où d Obj(AB) est la distance entre A et B le long du périmètre de l’objet, et dEuc(AB) est la distance euclidienne entre A et B (ligne droite).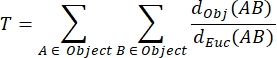
- Définissez la valeur de tortuosité la plus élevée dans le groupe de type sauvage de chaque condition expérimentale à 100%, et normalisez toutes les autres valeurs de la condition expérimentale à cette valeur afin d’obtenir la tortuosité NMJ relative.
- Traitez les piles d’images NMJ à l’aide du freeware NIH ImageJ23, du plugin iGeodesic et de la macro personnalisée pour obtenir des mesures de paramètres NMJ. Lancez le logiciel ImageJ.
- Lancez ImageJ et une macro personnalisée pour quantifier l’accumulation de neurofilaments présynaptiques et la coloration de la glycoprotéine 2 des vésicules synaptiques.
NOTE: L’accumulation de neurofilaments (ici, NF-M) et / ou la distribution altérée des vésicules synaptiques (ici, SV2) sont des marqueurs de transport axonal anormal et / ou de trafic de vésicules altéré et ont déjà été observés dans les NMJ de divers modèles de souris SMA32,33,34.- Faites glisser et déposez le Macro_NMJ_ACCU_Marinelloetal.ijm (personnalisé, fichier de codage supplémentaire 2) dans la fenêtre ImageJ; La macro s’ouvrira dans une deuxième fenêtre. Dans cette nouvelle fenêtre, cliquez sur Macros > Exécuter la macro.
Remarque : La macro peut traiter à la fois les formats de fichiers propriétaires et les fichiers TIFF. Les dossiers doivent remplir les critères indiqués dans la NOTE ci-dessous à l’étape 4.1.2. - Sélectionnez le dossier natif contenant les sous-dossiers Junction à analyser et cliquez sur Sélectionner.
- Dans le nouveau menu contextuel appelé Enregistrer le dossier, sélectionnez le dossier de stockage et cliquez sur Sélectionner.
- Dans le nouveau menu contextuel appelé Type d’image, sélectionnez le format des acquisitions Z-stack.
- Dans la fenêtre contextuelle Informations sur les taches , indiquez l’étiquette et la couleur présynaptiques et postsynaptiques et cliquez sur OK. Par exemple, étiquette présynaptique: SV2 ou NF, couleur présynaptique: R, étiquette postsynaptique: BTX, couleur postsynaptique: G.
REMARQUE: Pour les formats de fichiers propriétaires, les étiquettes et les canaux correspondants (C1, C2 ou C3) doivent être indiqués. - Dans la fenêtre contextuelle Taille des pixels , indiquez la taille de pixel XY 0,072 μm et l’étape Z 0,5 μm (z) et cliquez sur OK. La macro effectuera automatiquement l’analyse.
REMARQUE: Ce paramètre correspond à la taille d’image 1024 x 1024 pixels (73,7 x 73,7 μm) sélectionnée avant les acquisitions au microscope confocal, et il est corrélé aux paramètres d’objectif et de zoom. Si les formats de fichier propriétaires sont sélectionnés, la macro lit directement la taille des pixels et l’étape Z (z). La macro stockera, dans le dossier d’enregistrement, une DataSheet (.csv) des volumes présynaptiques et postsynaptiques, une image TIFF multipage de la détection actuelle pour chaque étiquetage (pré- et postsynaptique). Comme indiqué ci-dessus, ces fichiers TIFF sont générés pour vérifier la qualité des acquisitions et pour s’assurer que le traitement d’image a été effectué correctement.
La macro calcule le volume de coloration M du neurofilament axonal (volume NF) du canal NF-M-F594 qui colocalise avec le marquage de la α-bungarotoxine-F488 et le volume de coloration de la glycoprotéine 2 des vésicules synaptiques NMJ (volume SV2) du canal SV2-F594 qui colocalise avec le marquage α-BTX-F488. L’accumulation de NF-M est quantifiée en calculant le rapport entre le volume NF et le volume de la plaque terminale postsynaptique (α-BTX) et l’occupation terminale de l’axone NMJ par le rapport des volumes SV2 et α-BTX, comme indiqué ci-dessous.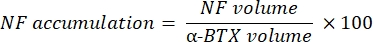
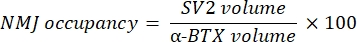
- Faites glisser et déposez le Macro_NMJ_ACCU_Marinelloetal.ijm (personnalisé, fichier de codage supplémentaire 2) dans la fenêtre ImageJ; La macro s’ouvrira dans une deuxième fenêtre. Dans cette nouvelle fenêtre, cliquez sur Macros > Exécuter la macro.
5. Analyse d’images - Microscopie STED
REMARQUE: Le traitement de l’image a été effectué avec le logiciel hors ligne du fabricant du microscope STED.
- Lancez le logiciel de microscope.
- Ouvrez le projet en cliquant sur le bouton Ouvrir le projet . Sélectionnez le fichier projet (.lif) et ouvrez-le. Les images sont affichées à l’écran avec leurs noms.
- Dans la fenêtre Processus : Cliquez sur Réduction du bruit > médiane. En bas de la fenêtre du milieu, définissez Rayon sur 5,00 et Itération sur 1,00, puis décochez Filtrage 3D.
- Sélectionnez ensuite l’onglet Ouvrir des projets en haut à gauche de la fenêtre et choisissez une image.
- Cliquez sur Appliquer pour valider les paramètres. Une nouvelle image appelée « nameofimage_median001 » est créée.
REMARQUE: Il est possible de cliquer sur Aperçu avant de Appliquer pour surveiller l’effet du filtre médian, ce qui améliorera le contraste de l’image et lissera les profils de ligne utilisés pour la quantification. - Appliquez le filtre à toutes les images comme indiqué aux étapes 5.4-5.5.
- Dans les onglets Ouvrir des projets, cliquez sur l’icône du lecteur de disquette pour enregistrer tous les projets , y compris les images filtrées nouvellement créées.
REMARQUE: L’étape suivante sera effectuée à l’aide de l’image filtrée nommée « nameofimage_median001 ». - Calculer la distance entre les bandes AChR
NOTE: Des changements dans la morphologie des plis postjonctionnels sont souvent observés dans les troubles neuromusculaires comme un signe de pathologie NMJ (immaturité ou dégénérescence). La distance (d) entre les bandes AChR, qui sont détectées par coloration à la α-bungarotoxine, est calculée en générant des profils d’intensité et en quantifiant la distance entre chaque pic d’intensité maximale en traçant un profil linéaire (figure supplémentaire 5).- À l’aide du logiciel de microscope, sélectionnez le menu Quantifier en haut de la fenêtre centrale.
- Cliquez sur l’onglet Outils en haut à gauche. Sélectionnez Intensité dans le panneau supérieur gauche et cliquez sur l’icône Profil de ligne . Définissez Suréchantillonnage sur 1 et cochez Trier les canaux.
- Cliquez sur les onglets Ouvrir les projets et sélectionnez l’image filtrée à analyser.
REMARQUE: Il est possible de zoomer sur l’image en faisant défiler avec la souris de l’ordinateur. La plage dynamique de l’image peut être modifiée à l’aide de la barre située à gauche à côté de l’image affichée, ce qui facilite la visualisation des bandes. - Ensuite, cliquez sur l’icône Tracer une ligne dans le menu supérieur de la fenêtre de droite et tracez une ligne traversant perpendiculairement plusieurs bandes / plis jonctionnels.
REMARQUE: Le profil d’intensité est affiché dans la fenêtre centrale. - Cliquez sur le haut du premier pic et déplacez le pointeur de la souris tout en maintenant le bouton gauche de la souris enfoncé jusqu’à ce que le prochain pic maximum soit atteint.
REMARQUE: L’information est affichée dans le profil d’intensité, tandis que la distance entre les deux pics est affichée sous le graphique avec la dénomination « dx ». - Cliquez à droite de la souris tout en étant dans l’image de la fenêtre de droite et sélectionnez Enregistrer les ROIs. Ouvrez les ROIs (Regions of Interest) enregistrés en cliquant sur Charger les ROIs.
- Cliquez sur l’icône en forme de flèche en haut à gauche de la fenêtre de droite, cliquez sur le ROI et supprimez-le en cliquant sur l’icône de la corbeille.
- Répétez cette opération autant de fois que nécessaire à partir de différents profils d’intensité pour obtenir le nombre prévu de distances de bande AChR qui représenteront la valeur globale dans le muscle analysé.
REMARQUE : La valeur N optimale peut être calculée à l’avance en fonction de la différence estimée entre les groupes, du risque α, de la puissance et du test unilatéral ou bilatéral. Dans le plan expérimental actuel, un test de Mann-Whitney unilatéral (risque α = 10%; puissance = 80%) a été appliqué, et la valeur N a été estimée à au moins cinq distances de bande AChR par JNM afin de comparer les deux groupes d’animaux.
- Largeur de bande AChR
REMARQUE : La largeur de bande (w) correspond à la demi-largeur pleine largeur (FWHM) du profil d’intensité, qui est la distance entre les points où la valeur de fluorescence du signal α-BTX est la moitié de son intensité maximale (Figure supplémentaire 5).- À l’aide du logiciel de microscope, sélectionnez le menu Quantifier dans la fenêtre centrale.
- Cliquez sur l’onglet Outils en haut à gauche. Sélectionnez Intensité dans le panneau supérieur gauche et cliquez sur l’icône Déterminer FWHM . Cochez Trier les canaux.
REMARQUE: Pour optimiser la détection de pic par le logiciel, le seuil et la largeur définis sur 50 et 3, respectivement. Adaptez ces valeurs à chaque expérience et demandez conseil à un chercheur expérimenté en imagerie. - Cliquez sur les onglets Ouvrir les projets et sélectionnez l’image filtrée à analyser.
REMARQUE: Il est possible de zoomer sur l’image affichée dans la fenêtre de droite en faisant défiler avec la souris de l’ordinateur. Comme indiqué ci-dessus (NOTE suivant l’étape 5.8.3), la plage dynamique de l’image peut être modifiée pour une visualisation optimale des bandes. - Ensuite, cliquez sur l’icône Dessiner un rectangle dans le menu supérieur de la fenêtre de droite. Sélectionnez une bande horizontale ou verticale et dessinez un rectangle perpendiculairement à la bande. Un profil apparaît dans la fenêtre centrale.
- Cliquez sur Vertical ou Horizontal dans le menu Projection moyenne situé dans le panneau de gauche, selon que l’orientation de la bande est verticale ou horizontale.
- Cliquez sur Statistiques dans la fenêtre centrale et lisez la valeur FWHM.
- Faites un clic droit avec la souris de l’ordinateur sur l’image affichée dans la fenêtre de droite et sélectionnez Enregistrer les retours sur investissement.
REMARQUE: Ouvrez les ROI enregistrés en cliquant sur Charger les ROIs. - Cliquez sur l’icône en forme de flèche en haut à gauche de la fenêtre de droite, cliquez sur le ROI et supprimez-le en cliquant sur l’icône de la corbeille.
- Répétez cette opération autant de fois que nécessaire à partir de différents ROI rectangulaires jusqu’à obtenir le nombre prévu de largeurs de bande AChR, qui sera représentatif de la valeur globale dans le muscle analysé.
6. Conception expérimentale et essais statistiques
- Effectuer des analyses statistiques à l’aide d’un logiciel spécifique.
NOTE: Les données ont été recueillies à partir de N ≥ 3 réplicats biologiques et d’au moins 20 NMJ par génotype pour l’imagerie au microscope confocal, et de N ≥ 5 réplicas biologiques et N = 5 NMJ par génotype pour l’imagerie STED, dans chaque groupe expérimental. La signification a été évaluée par un test de Mann-Whitney non apparié (non paramétrique), et les valeurs p sont indiquées dans les légendes correspondantes.
Résultats
Afin de faciliter l’analyse morphologique des jonctions neuromusculaires au niveau pré- et postsynaptique de manière reproductible, un flux de travail a été développé de la récolte musculaire à l’imagerie et à la quantification à l’aide du logiciel de microscope et des macros personnalisées ImageJ (Figure 1). Pour illustrer l’utilité de ce protocole, la morphologie des NMJ dans deux modèles murins de troubles génétiques, les souris Smn2B / - et ColQDex2 / Dex2 touchées par l’amyotrophie spinale (SMA) et une forme de syndrome myasthénique congénital (CMS), respectivement, ont été évaluées et les données ont été comparées à des compagnons de portée témoins appariés selon l’âge.
La structure de la NMJ a été évaluée à partir de muscles tibiaux antérieurs et gastrocnémiens de souris Smn2B/- âgées de 3 et 6 semaines (C57Bl/6 de fond) et ColQ Dex2/Dex2 (B6D2F1/J de fond), respectivement, lorsque des signes de la maladie sont déjà présents chez ces animaux. À l’âge de 3 semaines, les souris Smn2B/- présentent des signes de retard du développement des muscles squelettiques et de dénervation, tels que l’atrophie et la perte de NMJ35,36. Les souris CMS ont une pathologie primaire dans les JNM et manifestent une réduction du poids corporel dès la première semaine de vie et une faiblesse musculaire marquée20 (données non présentées). Comme le montre la figure 2A, la plaque d’extrémité motrice postsynaptique marquée par la α-bungarotoxine fluorescente est apparue plus petite et/ou fragmentée chez les mutants des deux lignées de souris par microscopie confocale. La quantification des piles Z NMJ à l’aide de ces macros ImageJ personnalisées a révélé des diminutions marquées du volume de la plaque terminale, de la projection de l’intensité maximale (MIP) et de la tortuosité relative chez les souris SMA et CMS par rapport aux témoins, comme signes de défauts de maturation NMJ32 (Figure 2B-D). Le volume postsynaptique de la plaque terminale et la MIP ont diminué chez les animaux malades (changement de pli de 2,7 et 2,0 pour le volume, et de 2,5 et 2,0 pour la MIP, chez les souris Smn2B/- et ColQ Dex2/Dex2, respectivement). La tortuosité relative était également plus faible dans les muscles déficients en SMN et ColQ que dans les souris WT (16,97% ± 1,33% dans SMA contre 48,84% ± 5,90% WT souris, et 13,29% ± 2,79% dans CMS contre 30,20% ± 4,44% souris témoins). De plus, la quantification de la distribution des branches terminales de l’axone présynaptique à l’aide de la macro personnalisée ImageJ a révélé une altération de la distribution des neurofilaments M dans les deux modèles animaux, avec une augmentation du marquage immunologique (84,65 % ± 0,32 % contre 16,57 % ± 2,03 % et 23,64 % ± 2,78 % contre 18,77 % ± 1,73 % chez les souris Smn2B/- et ColQDex2/Dex2 par rapport aux témoins, respectivement) (Figure 3A-D ). Par coloration SV2, une réduction de 43 % du taux d’occupation, c’est-à-dire le pourcentage de régions contenant de l’AChR avec des zones actives terminales nerveuses adjacentes, a également été observée chez les souris Smn2B/- (49,36 % ± 3,76 % chez les souris SMA contre 85,69 % ± 2,34 % chez les souris WT) (Figure 3E,F). Ce paramètre NMJ a également été calculé dans l’AG des mutants ColQ Dex2/Dex2, mais aucune différence statistiquement significative n’a été trouvée par rapport aux compagnons de portée témoins (données non présentées).
Nous avons ensuite analysé les caractéristiques de la membrane postsynaptique en quantifiant la distance entre les plis jonctionnels et la largeur des bandes AChR, qui sont situées à la crête de ces plis, dans les muscles déficients en ColQ en utilisant la microscopie à déplétion par émission stimulée à super-résolution (STED). Comme le montre la figure 4, l’aspect de ces structures peut être clairement visualisé par marquage par α-bungarotoxine fluorescente et analyse du profil d’intensité. Nous avons évalué ces paramètres NMJ et constaté une augmentation de la distance de pli jonctionnel (d) et de la largeur (w) des bandes AChR dans le muscle gastrocnémien des mutants (358,3 nm ± 11,97 nm et 320,8 nm ± 10,90 nm pour la distance, et 216,9 nm ± 10,51 nm et 186,3 nm ± 7,015 nm pour la largeur, chez ColQ Dex2 / Dex2 par rapport aux souris de type sauvage, respectivement, p < 0,05) (figure 4C,D).
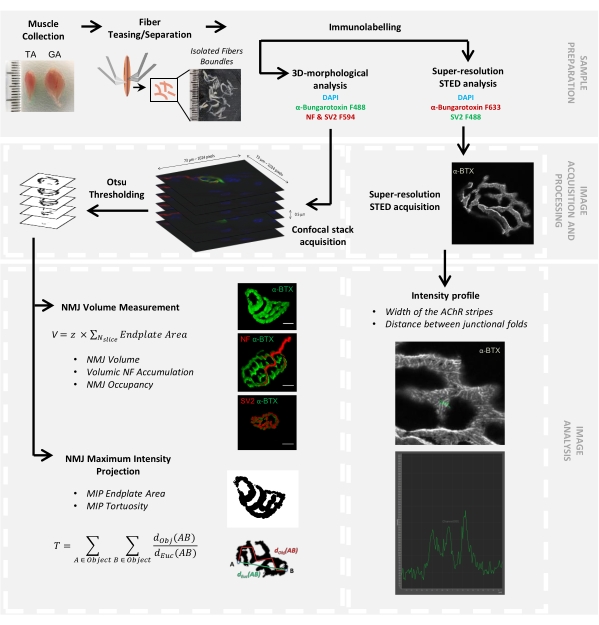
Figure 1 : Organigramme du protocole vidéo pour la caractérisation 3D multi-échelle de la JNM par microscopie confocale et STED. Les muscles tibiaux antérieurs (TA) et gastrocnémiens (GA) ont été prélevés chez des souris, et les fibres musculaires ont été taquinées avant d’être marquées avec α-bungarotoxine-F488 ou α-bungarotoxine-F633, DAPI, des anticorps primaires dirigés contre le neurofilament M (NF-M) et la glycoprotéine 2 des vésicules synaptiques (SV2), et des anticorps secondaires conjugués fluorophore (F488 ou F594). Les piles d’images ont été acquises par microscopie confocale et traitées pour mesurer le volume postsynaptique de la JNM, l’accumulation de NF-M présynaptique, l’occupation terminale de l’axone NMJ, la surface de la plaque terminale de projection d’intensité maximale postsynaptique (MIP) et la tortuosité (d Obj(AB) est la distance entre A et B le long du périmètre de l’objet (ligne rouge), tandis que dEuc(AB) est la distance euclidienne entre A et B (ligne verte)). Pour l’analyse microscopique STED, la largeur des bandes du récepteur de l’acétylcholine (AChR) et la distance entre les plis jonctionnels ont été quantifiées à partir des profils d’intensité de la coloration α-BTX-F633. Veuillez cliquer ici pour voir une version agrandie de cette figure.
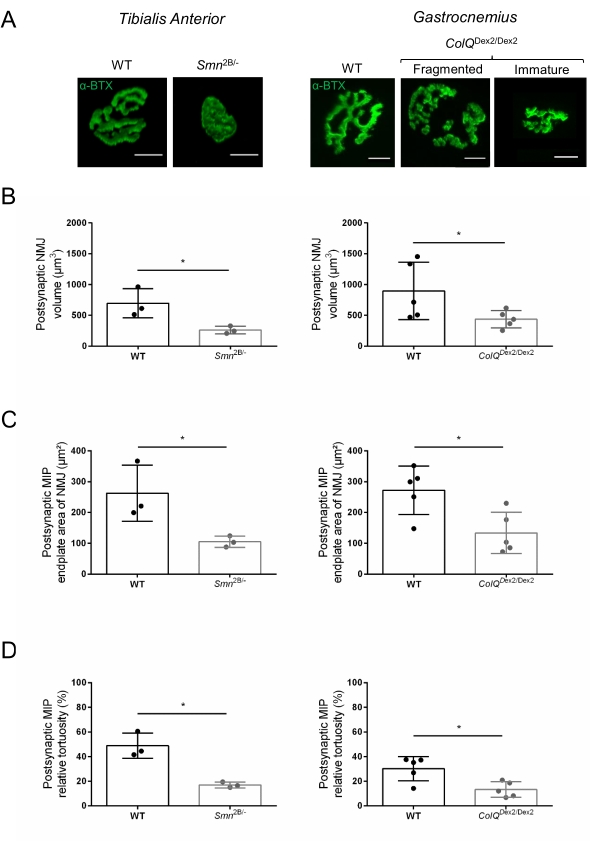
Figure 2 : Caractérisation multi-paramètres de la NMJ postsynaptique dans des modèles murins d’amyotrophie spinale (SMA) et de syndrome myasthénique congénital (CMS) lié à ColQ. (A) Images représentatives des plaques motrices postsynaptiques des muscles TA et GA marqués avec α-bungarotoxine-F488 (α-BTX). (B) Quantification du volume de la plaque terminale postsynaptique des NMJ, (C) zone de projection de l’intensité maximale (MIP) et (D) tortuosité relative chez les souris de type sauvage (WT) et Smn2B/- âgées de 3 semaines (graphiques de gauche, N = 3 animaux par génotype, n = 37 et n = 56 NMJ, respectivement) et WT et ColQ Dex2/Dex2 âgées de 6 semaines souris (graphiques de droite, N = 5 souris par génotype, n = 89 et n = 97 NMJ, respectivement). Les données sont exprimées sous forme de moyenne par souris (point) ± SEM. Les différences entre les groupes ont été analysées par test de Mann-Whitney (* p < 0,05). La barre d’échelle est de 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
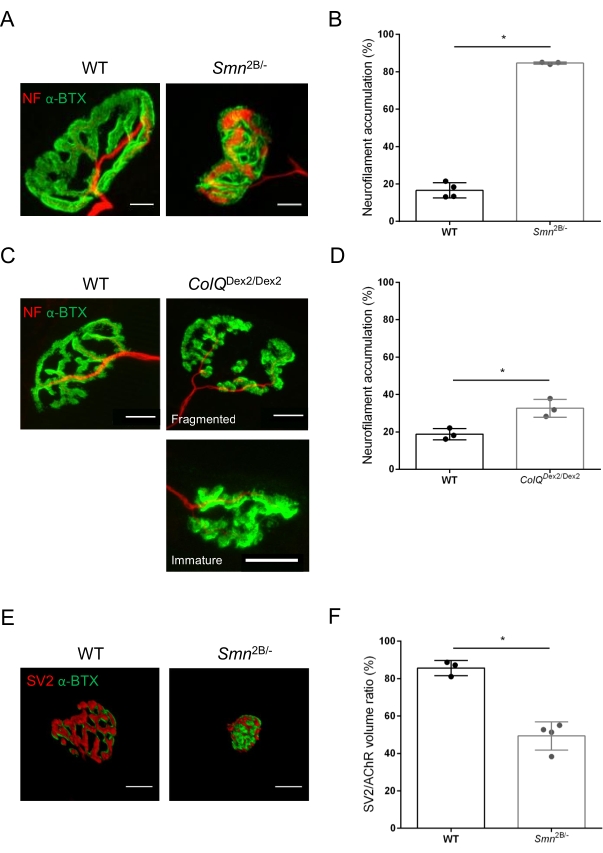
Figure 3 : Analyse morphométrique de la distribution terminale de l’axone présynaptique dans les muscles de souris WT et mutantes. Modèle d’innervation de la NMJ dans les muscles tibiaux antérieurs (TA) et gastrocnémiens (GA) de souris CMS de type sauvage, SMA et ColQ. (A, B) Jonctions neuromusculaires représentatives de TA de souris WT et Smn2B/- à l’âge de 21 jours marquées avec des anticorps contre le neurofilament M (NF-M, rouge) et la α-bungarotoxine-F488 (α-BTX, vert) (A), et résultats de l’analyse quantitative de l’accumulation de neurofilaments (B); (C, D) Jonctions neuromusculaires représentatives de GA de souris WT et ColQDex2 / Dex2 âgées de 6 semaines marquées avec des anticorps contre le neurofilament M (NF-M, rouge) et α-bungarotoxine-F488 (α-BTX, vert), montrant des plaques terminales postsynaptiques fragmentées et immatures (C), et des résultats de l’accumulation de neurofilaments dans les deux groupes d’animaux (D). N = 4 (n = 34 NMJs) (B) et N = 3 (n = 54 NMJs) (D) WT animaux, et N = 3 (n = 36 NMJs) Smn2B/- et N = 3 (n = 55 NMJs) ColQ Dex2/Dex2 souris ont été analysées dans les expériences (B, D). (E, F) Images représentatives de l’occupation terminale des axones dans les JNM de TA de souris WT et Smn2B/- âgées de 3 semaines marquées avec des anticorps dirigés contre la glycoprotéine 2 des vésicules synaptiques (SV2, rouge) et la α-bungarotoxine-F488 (α-BTX, vert) (E), et les résultats de l’occupation des JNM (rapport volume SV2/AChR) (F). Les muscles de N = 3 (n = 50 NMJs) de type sauvage et de N = 4 (n = 62 NMJs) Smn2B/- souris ont été analysés. Les données sont exprimées sous forme de valeur moyenne par souris (point) ± SEM. Les différences entre les groupes ont été analysées par test de Mann-Whitney (* p < 0,05). Les barres d’échelle sont de 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
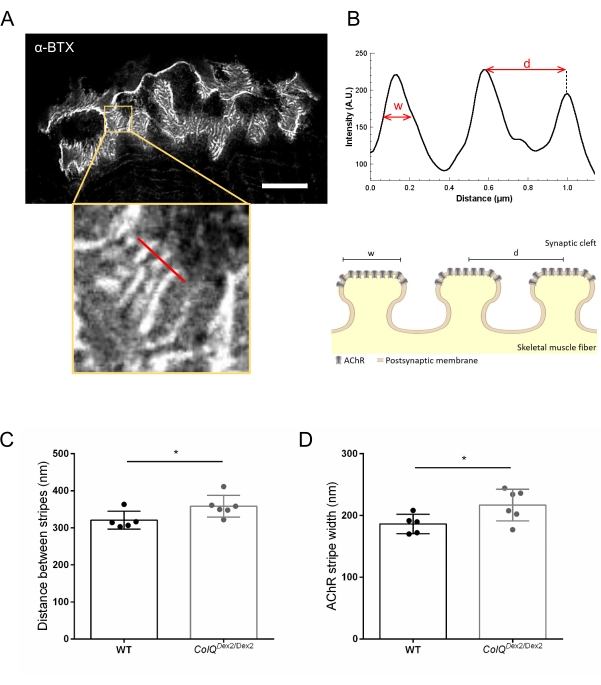
Figure 4 : Imagerie STED des plaques terminales postsynaptiques de la JNM. (A) Image STED représentative d’une JNM marquée à la α-bungarotoxine-F633 (α-BTX) provenant d’un gastrocnémien d’une souris de type sauvage âgée de 6 semaines présentant des rayures AChR post-jonctionnelles (la barre d’échelle est de 5 μm). (B) Grossissement plus élevé d’une région avec des bandes AChR (panneau inférieur) qui a été utilisée pour générer le profil d’intensité. La largeur (w) des bandes AChR et la distance entre deux bandes adjacentes (d) de cette région ont été quantifiées et présentées dans le graphique à barres. Représentation schématique de la plaque d’extrémité postsynaptique pour illustrer la largeur de bande AChR (w) et la distance (d). Ces paramètres, (C) distance de bande AChR et (D) largeur, ont été mesurés chez des souris ColQ Dex2/Dex2 et des compagnons de portée témoins à l’âge de 6 semaines. Les NMJ de 5 WT (total n = 29 NMJ) et de 6 ColQ Dex2/Dex2 (total n = 43 NMJ) ont été analysés à l’aveugle. Les données sont exprimées sous forme de moyenne par souris (point) ± SEM. Les différences statistiques entre les groupes ont été analysées à l’aide du test de Mann-Whitney (* p < 0,05). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Lancement du logiciel LAS X et paramètres pour les acquisitions confocales. Les différentes étapes d’acquisition d’images confocales sont décrites aux sections 3.1.2 à 3.1.7 du protocole. Pour chaque acquisition de pile NMJ, un projet est ouvert (étape 3.1.4) et les paramètres de taille d’image, vitesse d’acquisition, axes X, Y et Z sont sélectionnés (étape 3.1.7), avec chaque balayage séquentiel indiqué (Seq.1, laser 405 pour DAPI ; Seq.2, laser 488 pour α-BTX-F488; et Seq.3, laser 552 pour les anticorps secondaires conjugués F594). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Lancement du logiciel LAS X et paramètres pour les acquisitions de STED. Les étapes pour acquérir des images STED sont décrites dans les sections 3.2.2 à 3.2.8 du protocole. Le microscope est lancé en mode de configuration STED ON (étape 3.2.2), et un projet est ouvert (étape 3.2.3). Les paramètres d’acquisition d’image (étape 3.2.7) (taille de l’image, vitesse d’acquisition, facteur de zoom, axe X), à chaque balayage séquentiel, sont indiqués (Seq.1 pour α-BTX-F633; Seq.2 pour les anticorps secondaires conjugués F488). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Images de plis jonctionnels colorés au α-BTX obtenues par microscopie STED. Exemples d’images d’une plaque terminale postsynaptique marquée avec α-BTX-F633 d’une souris de type sauvage âgée de 6 semaines qui ont été acquises avec une mise au point correcte (à gauche) ou incorrecte (à droite). Veuillez cliquer ici pour télécharger ce fichier.
Figure 4 supplémentaire : fenêtres contextuelles Windows pour décrire les données d’entrée et de sortie obtenues par les macros ImageJ personnalisées. Des exemples de données d’entrée (fichiers .tif et .lif) d’images NMJ sont affichés dans la colonne de gauche. Les données de sortie des macros (colonne de droite) sont enregistrées dans des dossiers (Save_Volume, Save_Accu) contenant des images de la jonction (.tif) et des feuilles de données contenant les résultats (fichiers .csv). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 5 : Analyse de la distance et de la largeur des bandes AChR à partir d’une acquisition STED à l’aide du logiciel LAS X. Les étapes d’analyse des images NMJ STED sont décrites dans la section 5 du protocole. A) Image d’une région de plaque terminale postsynaptique étiquetée contenant des bandes AChR. La région d’intérêt pour l’analyse des bandes est sélectionnée en traçant une ligne perpendiculaire (ligne verte, pour la distance de bande) ou un rectangle perpendiculaire (rectangle violet, pour la largeur de la bande). (B, C) Les profils d’intensité des régions sélectionnées et les mesures permettant de calculer la distance entre les bandes AChR (B) et la largeur de bande AChR (C) sont affichés. Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 1 : Macro_NMJ_VOL_Marinelloetal. Macro personnalisée ImageJ pour extraire les mesures des paramètres NMJ (volume NMJ, zone de la plaque terminale MIP et tortuosité NMJ). Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 2 : Macro_NMJ_ACCU_Marinelloetal. Macro personnalisée ImageJ pour extraire l’accumulation NF-M et la coloration SV2. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le protocole vidéo décrit fournit une méthode détaillée pour quantifier la structure 3D des jonctions neuromusculaires en combinant la microscopie confocale et la microscopie STED qui peuvent être utilisées pour caractériser les changements pathologiques aux niveaux pré- et postsynaptique. La haute résolution de la microscopie STED permet la visualisation et l’analyse morphométrique de nanostructures qui ne sont pas identifiables par imagerie confocale conventionnelle. Cette procédure nous a permis de mesurer les altérations structurelles des JNM dans deux muscles appendiculaires, tibial antérieur et gastrocnémien, de souris CMS liées à la SMA et à la ColQ.
Pour obtenir des résultats fiables avec cette technique, il est essentiel de disséquer et de taquiner correctement les muscles, en accordant une attention particulière au fascia entourant le muscle et à la force appliquée pour séparer les faisceaux musculaires; sinon, le schéma d’innervation pourrait être perturbé empêchant une évaluation correcte de la JNM présynaptique. Bien que des informations détaillées soient fournies pour analyser les JNM de TA et GA, en principe, ce protocole pourrait être adapté à d’autres muscles, y compris les muscles plats, tels que le diaphragme ou les abdominaux transversaux37, qui ne nécessitent pas l’étape de taquinerie. La fixation tissulaire est également cruciale pour assurer une coloration de bonne qualité; par conséquent, il est recommandé d’utiliser du PFA de haute qualité à un volume approprié (15 à 20 fois celui du muscle). En outre, le temps d’exposition au fixateur est une étape importante car des artefacts, tels que le retrait et l’agglutination, peuvent apparaître en raison d’une fixation excessive et influencer les caractéristiques de la JNM. Compte tenu de la taille des échantillons et du taux de pénétration de la solution de paraformaldéhyde dans les tissus38, un temps de fixation de 18-24 h est recommandé pour ce type de muscle. Dans le cas où l’étape de coloration est prévue plus d’une semaine après le prélèvement des tissus, il est suggéré de garder les muscles fixés au PFA dans le PBS supplémenté en azoture de sodium à 4 ° C pour prévenir la prolifération bactérienne.
Ce protocole présente une approche utilisant α-BTX-F488 pour la confocale et α-BTX-F633 pour l’imagerie STED. Ces fluorophores ont été choisis pour s’adapter à la conception expérimentale décrite, mais peuvent être modifiés en fonction de l’équipement et des matériaux disponibles. Par exemple, l’étiquetage α-BTX F488 peut être sélectionné lors de l’utilisation d’un laser STED CW 592 nm pour l’acquisition et la quantification d’images. Cependant, il semble que la configuration qui a été appliquée dans la présente étude (STED à excitation pulsée fermée, épuisement de 775 nm) présente des performances et une meilleure résolution que d’autres approches, telles que STED39 à onde continue, ce qui la rend plus adaptée à l’application actuelle. Il est également important de sélectionner avec soin les réglages de puissance laser, en particulier pour STED (excitation et épuisement), car les caractéristiques d’un profil d’intensité ne peuvent pas être mesurées en cas de saturation, et donc tout signal saturé dans une image NMJ pourrait compromettre l’ensemble de l’analyse.
Ce flux de travail détaillé, y compris l’acquisition et l’analyse d’images à l’aide d’un logiciel de microscope et de macros ImageJ, a été développé pour faciliter l’analyse morphométrique NMJ autonome par microscopie confocale et STED à partir d’un seul muscle. Les flux de travail décrits précédemment pour l’analyse confocale NMJ, tels que NMJ-morph2 ou NMJ-Analyser14, ont ouvert la voie à la conception de méthodes semi-automatiques qui facilitent l’analyse morphologique des NMJ et les études comparatives. NMJ-morph (et sa version mise à jour aNMJ-morph15) est une plate-forme gratuite basée sur ImageJ qui utilise la projection d’intensité maximale pour mesurer 21 caractéristiques morphologiques, et NMJ-Analyser utilise un script développé en Python qui génère 29 paramètres pertinents à partir de l’ensemble de la structure 3D NMJ. Le seuillage manuel est la seule étape du traitement d’image dans ces deux méthodes qui nécessitent une analyse utilisateur. Ce protocole intégré détaille les étapes de préparation des tissus, d’acquisition d’images confocales 3D et de traitement basé sur ImageJ des NMJ de muscles squelettiques entiers et fournit un aperçu simplifié de cinq paramètres importants des plaques terminales postsynaptiques (volume, surface de projection maximale et tortuosité) et présynaptiques (occupation terminale axonale et accumulation de neurofilaments). Un paramètre supplémentaire de pertinence biologique, le schéma d’organisation AChR des plis jonctionnels postsynaptiques, a été incorporé pour l’analyse morphométrique à l’échelle nanométrique par microscopie STED à super-résolution (résolution 20-30 nm)40. Il est intéressant de noter que la préparation des tissus pour l’imagerie STED est plus simple que d’autres méthodes utilisées pour les études ultrastructurales NMJ, telles que la microscopie électronique à transmission conventionnelle (TEM)9, qui est une procédure plutôt complexe et longue qui nécessite un manipulateur qualifié afin d’obtenir des sections ultraminces de la région musculaire appropriée. En outre, les données quantitatives provenant de plis jonctionnels multiples peuvent être obtenues automatiquement à l’aide du logiciel associé à STED.
Ce protocole a été appliqué pour illustrer les défauts des JNM précédemment connus dans les muscles déficients en SMN et ColQ 20,36,41,42. Des changements communs ont été trouvés dans les deux modèles murins par microscopie confocale, tels qu’une diminution du volume de la plaque terminale postsynaptique, de la zone MIP et de la tortuosité relative, ainsi qu’une accumulation accrue de neurofilaments, tandis que certains résultats plus spécifiques (diminution de l’occupation de la NMJ) n’ont été observés que chez les souris SMA, comme indicateur du trafic de vésicules altérées36. Enfin, une augmentation de la distance et de la largeur de la bande AChR a été détectée dans ColQ-KO par l’analyse STED, qui sont des signes de défauts ultrastructuraux dans les plis jonctionnels postsynaptiques, comme observé précédemment par TEM20. Il est important de noter que ce protocole peut aider à une caractérisation morphologique plus approfondie des jonctions neuromusculaires au cours du développement, de l’entretien et dans diverses conditions pathologiques.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts lié à ce travail.
Remerciements
Nous remercions le « Cœur de l’Imagerie et de la Cytométrie » de Généthon, ainsi que le service d’histologie, qui sont soutenus en partie par des fonds d’équipement de la Région Ile-de-France, du Conseil Général de l’Essonne, de la Genopole Recherche d’Evry, de l’Université d’Evry Val d’Essonne et de l’INSERM, France. Nous remercions également le Dr Rashmi Kothary d’avoir fourni la lignée de souris Smn 2B/2B (Université d’Ottawa, Canada) et le Dr Eric Krejci pour la lignée de souris ColQDex2/+ (inédite, Université de Paris, France). Nous remercions Guillaume Corre pour son soutien en analyse statistique. Les anticorps monoclonaux 2H3 (développés par Jessel, T.M. et Dodd, J.) et SV2 (développés par Buckley, K.M.) ont été obtenus à partir de la Developmental Studies Hybridoma Bank (DSHB), créée par le NICHD des NIH et maintenue à l’Université de l’Iowa, Département de biologie, Iowa City, IA 52242. Ce travail a été soutenu par l’Association Française contre les Myopathies (AFM-Téléthon), l’INSERM et l’Université d’Evry Val d’Essonne.
matériels
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
Références
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304 (2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671 (2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677 (2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220 (2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251 (2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128 (2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, 253-261 (2013).
- . GitHUb Available from: https://github.com/Genethon/ImCy (2021)
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -. P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162 (2014).
- Baker, J. R. . Principles of biological microtechnique; a study of fixation and dyeing. , (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421 (2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644 (2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605 (2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon