Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Polyvalence des protocoles pour l’entraînement et l’évaluation de la résistance à l’aide d’échelles statiques et dynamiques dans des modèles animaux
Dans cet article
Résumé
Le présent protocole décrit l’entraînement et les tests de résistance à l’aide d’échelles statiques et dynamiques dans des modèles animaux.
Résumé
L’entraînement en résistance est un modèle d’exercice physique avec des avantages profonds pour la santé tout au long de la vie. L’utilisation de modèles animaux d’exercices de résistance est un moyen de mieux comprendre les mécanismes moléculaires sous-jacents qui orchestrent ces adaptations. Le but de cet article est de décrire des modèles d’exercice et des protocoles d’entraînement conçus pour l’entraînement en force et l’évaluation de la résistance dans des modèles animaux et de fournir des exemples. Dans cet article, l’entraînement en force et l’évaluation de la résistance sont basés sur l’activité d’escalade d’échelle, en utilisant des échelles statiques et dynamiques. Ces dispositifs permettent une variété de modèles d’entraînement et fournissent un contrôle précis des principales variables qui déterminent l’exercice de résistance: volume, charge, vitesse et fréquence. De plus, contrairement à l’exercice de résistance chez l’homme, il s’agit d’un exercice forcé. Ainsi, les stimuli aversifs doivent être évités dans cette intervention pour préserver le bien-être animal. Avant la mise en œuvre, une conception détaillée est nécessaire, ainsi qu’une période d’acclimatation et d’apprentissage. L’acclimatation aux dispositifs d’entraînement, tels que les échelles, les poids et le ruban clinique, ainsi qu’aux manipulations requises, est nécessaire pour éviter le rejet de l’exercice et minimiser le stress. Dans le même temps, les animaux apprennent à monter l’échelle, et non à descendre, jusqu’à la zone de repos au sommet de l’échelle. L’évaluation de la résistance peut caractériser la force physique et permettre d’ajuster et de quantifier la charge d’entraînement et la réponse à l’entraînement. En outre, différents types de résistance peuvent être évalués. En ce qui concerne les programmes d’entraînement, avec une conception et une utilisation appropriées de l’appareil, ils peuvent être suffisamment polyvalents pour moduler différents types de force. En outre, ils doivent être suffisamment flexibles pour être modifiés en fonction de la réponse adaptative et comportementale des animaux ou de la présence de blessures. En conclusion, l’entraînement en résistance et l’évaluation à l’aide d’échelles et de poids sont des méthodes polyvalentes dans la recherche animale.
Introduction
L’exercice physique est un facteur déterminant du mode de vie pour promouvoir la santé et réduire l’incidence des maladies chroniques les plus répandues ainsi que de certains types de cancer chez les humains1.
L’exercice de résistance a suscité l’intérêt en raison de sa pertinence écrasante pour la santé tout au long de la vie2, en particulier en raison de ses avantages dans la lutte contre les maladies liées à l’âge qui affectent le système locomoteur, telles que la sarcopénie, l’ostéoporose, etc.3. De plus, l’exercice de résistance affecte également les tissus et les organes qui ne sont pas directement impliqués dans l’exécution du mouvement, tels que le cerveau4. Cette pertinence au cours des dernières années a encouragé le développement de modèles d’exercices de résistance chez les animaux pour étudier les mécanismes tissulaires et moléculaires sous-jacents, lorsque cela n’est pas possible chez l’homme ou lorsque les animaux fournissent une meilleure compréhension et constituent un modèle plus contrôlé.
Contrairement à l’exercice de résistance chez l’homme, pour les modèles animaux, les chercheurs s’appuient généralement sur des procédures forcées. Cependant, les stimuli aversifs doivent être évités dans ce contexte, principalement pour préserver le bien-être animal, réduire le stress et diminuer la sévérité des procédures expérimentales5. Il convient de noter que les animaux aiment faire de l’exercice même dans la nature6. Pour ces raisons, il est nécessaire d’améliorer l’adaptation à l’expérience par une acclimatation prolongée par étapes.
Les dispositifs, matériaux et protocoles utilisés pour l’entraînement et l’évaluation de la résistance chez les animaux de laboratoire doivent permettre le contrôle précis et la modulation de nombreuses variables : charge, volume, vitesse et fréquence7. Ils doivent également permettre d’effectuer différents types de contractions musculaires: concentriques, excentriques ou isométriques. Compte tenu de ce qui précède, les protocoles utilisés devraient être en mesure d’évaluer ou de s’entraîner spécifiquement pour différentes applications de la force: force maximale, hypertrophie, vitesse et endurance.
Il existe plusieurs méthodes de musculation, telles que le saut dans l’eau8,9, la natation lestée dans l’eau 10 ou l’électrostimulation musculaire11. Cependant, les échelles statiques et dynamiques sont des dispositifs polyvalents qui sont largement utilisés12,13,14.
L’évaluation de la résistance dans des modèles animaux expérimentaux fournit des informations précieuses pour de nombreux contextes de recherche, tels que la description des caractéristiques phénotypiques des animaux génétiquement modifiés, l’évaluation de l’effet de différents protocoles d’intervention (supplémentation en composants alimentaires, traitements médicamenteux, transplantation de microbiote, etc.) ou l’évaluation de l’effet des protocoles de formation. Les modèles d’entraînement donnent un aperçu de la physiologie de l’adaptation à l’exercice de force, ce qui aide à mieux comprendre l’effet de l’exercice sur l’état de santé et la physiopathologie.
Par conséquent, il n’existe pas de protocole universel pour l’entraînement en résistance ou l’évaluation fonctionnelle de la force dans les modèles animaux, de sorte que des protocoles polyvalents sont nécessaires.
L’objectif de cette étude est d’identifier les facteurs les plus pertinents à prendre en compte lors de la conception et de l’application d’un protocole d’entraînement et d’évaluation de la résistance à l’aide d’échelles statiques et dynamiques dans des modèles animaux, ainsi que de fournir des exemples spécifiques.
Protocole
Les méthodes présentées dans ce protocole ont été évaluées et approuvées par le comité technique de recherche animale (référence PROAE 04/2018, Principado de Asturias, Espagne).
1. Planification
- Sélectionner soigneusement les animaux pour l’étude en fonction des caractéristiques d’intérêt (génétiquement modifiés, modèles pathologiques, âge, etc.) et appliquer des adaptations spécifiques au protocole (escalade sans poids, réduction du nombre d’échelons à gravir et inclinaison).
- Identifier la modalité de force à évaluer ou à entraîner : force maximale, endurance-résistance, vitesse, etc. en fonction des objectifs de l’étude.
- Ajustez soigneusement les paramètres lorsque l’évaluation fonctionnelle ou la formation est encadrée, en considérant si elle se concentre sur les résultats de ces tests ou s’ils sont complémentaires à d’autres types de déterminations cliniques, fonctionnelles, histologiques ou moléculaires.
- Planifiez toutes les questions liées à la formation, en particulier l’horaire, la durée de la période de formation et la fréquence des sessions, et dessinez un tableau de formation.
- Précisez les étapes d’échauffement et l’inclinaison de l’échelle, qui seront les mêmes tout au long de l’entraînement. Spécifiez les séries, les répétitions, la charge (en fonction des résultats des tests de résistance effectués avant la période d’entraînement) et reposez-vous entre les deux, en prêtant attention aux augmentations de charge en fonction de la session précédente.
- Modifier le plan, comme pour l’entraînement humain, en fonction du bien-être de l’animal. Les modifications comprennent la diminution des répétitions, l’augmentation du temps de repos entre les séries ou les répétitions et la diminution de la charge pour éviter le surentraînement et les blessures.
- Une fois terminé, soumettre le plan pour évaluation et approbation par le comité de recherche en éthique animale.
2. Dispositifs et matériaux pour l’exercice de résistance
- Dispositifs: échelles statiques et dynamiques
REMARQUE : Deux types d’échelles, appelées échelles statiques et dynamiques (voir la figure 1), peuvent être utilisées pour l’entraînement et l’évaluation de la résistance (voir le tableau des matériaux).- Utilisez une échelle verticale avec au moins 30 marches en fil d’acier de 1,5 mm de diamètre, séparées de 15 mm, et une aire de repos d’au moins 20 x 20 cm sur le dessus de l’échelle. La pente de l’échelle doit être réglable de 80° à 110° avec le plan horizontal (figure 1C). Délimitez deux voies pour éviter l’escalade non linéaire.
- Utilisez une échelle dynamique semblable à l’échelle statique, avec une barrière de filament en plastique au sommet, qui peut être ouverte pour contrôler l’accès à l’aire de repos, et une barrière de filament en plastique en bas, pour empêcher les animaux de descendre. L’angle d’inclinaison de l’échelle doit être réglable entre 80° et 100°, le plus courant étant 85°.
NOTE: L’échelle peut circuler au moyen d’un arbre supérieur et d’un arbre inférieur d’un diamètre de 8 cm. L’arbre inférieur est entraîné par un moteur électrique qui fait descendre les marches à l’avant et monter à l’arrière, créant une échelle sans fin. Il est équipé d’un réducteur et d’un régulateur de vitesse pour abaisser la vitesse de 11,6 cm/s à 3,3 cm/s, et la vitesse la plus courante est de 5,6 cm/s.
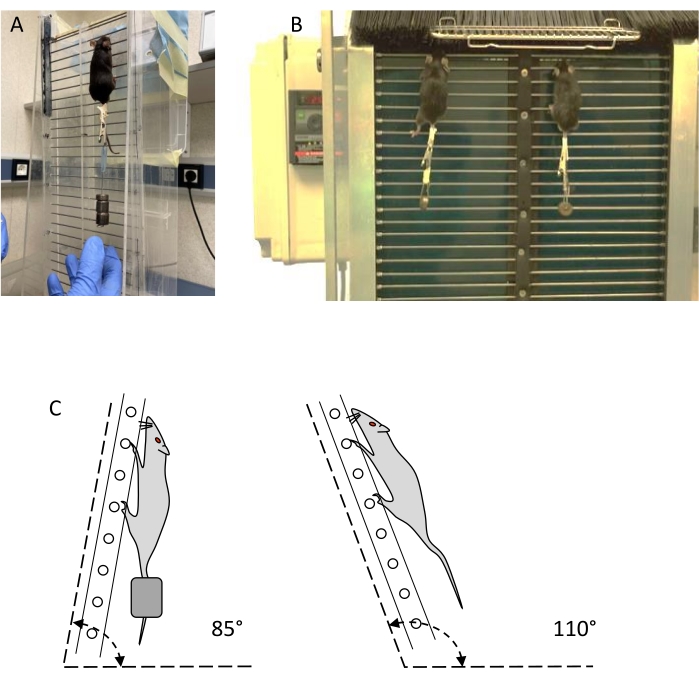
Figure 1 : Dispositifs de musculation : échelles statiques et dynamiques. (A) Entraînement de souris avec poids externe sur une échelle statique. (B) Deux souris s’entraînant avec du poids sur une échelle dynamique. (C) Représentation schématique des angles d’échelle pour la formation et l’évaluation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Matériaux
- Préparez les matériaux suivants : poids, fil pour maintenir les poids, pince à gators en acier et ruban adhésif clinique.
NOTE: Les poids sont des cylindres en acier de masse différente (5, 10, 15, 20, 25 et 50 g), avec un trou de 5 mm de diamètre au centre pour les enfiler sur un fil (Table des matériaux). Le fil pour contenir les poids est en acier d’un diamètre de 1 à 1,5 mm et d’une longueur de 5 à 10 cm, en fonction du nombre de poids à charger. - Coupez un morceau de bandage adhésif élastique (tableau des matériaux) d’environ 3,0-3,5 cm x 1,0-1,5 cm et attachez-le autour de la queue de l’animal pour maintenir les poids. Assurez-vous de ne pas trop serrer car cela pourrait entraîner une restriction du flux sanguin.
REMARQUE: Au début, le comportement des animaux sera de lutter contre le ruban adhésif et de le mordre, mais après quelques jours, ils le toléreront, se toilettant comme d’habitude et ne montrant aucun signe de stress. - Insérez les poids souhaités dans le fil et accrochez le clip gator (Tableau des matériaux: Clip gator en acier et fil pour maintenir les poids).
- Attachez le gator au ruban clinique attaché à la queue de l’animal.
- Immédiatement après avoir gravi les barreaux requis, retirez la pince et laissez l’animal se reposer avec le ruban clinique sur la queue, mais sans poids (figure 1).
- Préparez les matériaux suivants : poids, fil pour maintenir les poids, pince à gators en acier et ruban adhésif clinique.
3. Acclimatation
REMARQUE: Une bonne acclimatation est essentielle pour éviter le rejet de l’exercice et minimiser le stress. L’acclimatation est une étape cruciale avant la réalisation de tests d’évaluation de la résistance ou de protocoles d’entraînement. Un temps suffisant doit être consacré à l’obtention de signes comportementaux de confort chez les animaux. Les détails de l’acclimatation quotidienne avec les échelles statique et dynamique sont présentés dans les tableaux 1 et 2, respectivement.
- Habituez les animaux à rester dans l’aire de repos au sommet de l’échelle (statique ou dynamique). Laissez les animaux dans cet endroit par groupes de quatre, avec la litière de leur cage, pendant 15 minutes chaque jour. Habituellement, après 3-5 jours, les animaux ne montreront aucun signe de stress.
- Apprenez aux animaux à grimper, et non à descendre, l’échelle. À l’aide de l’échelle statique, placez les souris sur un barreau près du sommet, d’où elles peuvent voir l’aire de repos. Ils y iront instinctivement. Ensuite, apprenez-leur à monter progressivement de cinq échelons (3x) le premier jour, à 10 échelons (3x) le lendemain, jusqu’à 15 échelons (3x) (tableau 1).
Utilisez la même procédure avec l’échelle dynamique, d’abord sans mouvement, puis avec l’échelle se déplaçant à 5,4 cm/s et 6,6 cm/s et les animaux grimpant pendant 2 min, complétant cinq séries (tableau 2). - Adaptez les animaux pour porter des poids, à partir du troisième jour d’acclimatation. Collez un morceau de ruban adhésif clinique à la base de la queue qui sera utilisé pour maintenir les poids.
- À partir du septième jour d’acclimatation, attachez de petits poids (5-10 g) à la bande clinique avec un clip gator. Évitez de faire trop de séries, afin que l’adaptation ne se transforme pas en entraînement.
NOTE: L’acclimatation du groupe témoin est obligatoire dans le cas où ce groupe effectue l’essai de résistance. Après cette période, effectuez un rappel d’escalade une fois par semaine, avec du ruban adhésif mais sans poids.
4. Évaluation de la résistance
- Tests incrémentiels pour évaluer la résistance maximale
NOTE: Cet essai vise à déterminer la résistance maximale mesurée comme le poids maximal auquel les animaux peuvent monter 10 échelons sur l’échelle statique, qui définit le maximum de 10 répétitions (10 RM)4. Ce protocole a été adapté d’études antérieures (examinées dans Kregel et coll.15).- Pour l’échauffement, effectuez trois séries de 10 répétitions, 10 étapes / répétition, sans charge externe. Pour la première série, fixez la pente à 90°, puis à 85°. Prévoir une période de repos de 60 s entre les séries.
- Réglez la pente à 85° (pour éviter que les poids ne frôlent ou ne s’accrochent aux barreaux de l’échelle).
- Attachez le ruban autour de la queue de l’animal pour maintenir les poids et préparer les poids comme expliqué précédemment.
- Commencez le test avec une charge externe de 10 g et effectuez une série de 10 étapes.
- Enlevez le poids et prévoyez une période de repos de 120 s dans l’aire de repos.
- Effectuer des séries successives de 10 étapes en augmentant la charge externe de 5 g jusqu’à épuisement. Laisser reposer la période (120 s) entre les séries.
- Si un animal ne parvient pas à monter 10 marches avec une charge de poids particulière, permettre une autre tentative avec la même charge après 120 s de repos. S’il réussit à monter avec la charge, il continue le test avec la charge suivante. S’il échoue à nouveau, enregistrez la charge de poids de la dernière série terminée comme sa charge de poids maximale.
- Le résultat de l’essai peut être exprimé en poids externe absolu (g), en charge maximale par rapport au poids corporel (%), ou en masse soulevée par gramme de poids corporel, à la discrétion du chercheur.
NOTE: Le protocole précédent représente un modèle sur lequel de nombreuses modifications sont possibles par exemple, pour évaluer la résistance maximale de souris génétiquement modifiées présentant des handicaps neuromusculaires. Ces animaux ne sont pas capables de grimper avec des charges externes et ont des difficultés à monter 10 échelons avec l’échelle fixée à 90° de pente (données non publiées). Le protocole consistait à monter cinq marches sans charge externe, en commençant par une pente de 110°. La pente a diminué de 5° dans chaque série jusqu’à 85° avec 120 s de repos après chaque série. Dans ce cas, la résistance maximale a été exprimée comme le nombre cumulé de marches gravies (sans tenir compte des répétitions après les échecs). Le groupe témoin de type sauvage, après avoir atteint la pente de 85°, poursuivra l’essai en ajoutant un poids externe à la queue, conformément au protocole précédent, jusqu’à épuisement.
- Test d’endurance-résistance maximale avec l’échelle statique
- Pour l’échauffement, effectuez trois séries de 10 répétitions, 10 étapes / répétition, sans charge externe. Pour la première série, réglez la pente à 90°, puis à 85°. Prévoir une période de repos de 60 s entre les séries.
- Réglez la pente à 85°.
- Attachez le poids sur le ruban clinique placé autour de la queue de la souris.
REMARQUE : Selon l’âge et les caractéristiques des animaux, la charge externe peut être le poids maximal obtenu lors d’un essai élémentaire précédent, un pourcentage de celui-ci (p. ex., 50 %) ou un pourcentage du poids corporel (p. ex., 100 %-200 %). Si ce test est effectué après une période de formation, il est recommandé d’utiliser la même charge que lors du test initial pour évaluer les changements. - Effectuez des séries consécutives de 10 étapes jusqu’à épuisement. Aucun temps de repos n’est autorisé après chaque série.
- Le résultat du test est le nombre d’échelons montés.
- Test d’endurance-résistance maximale avec l’échelle dynamique
NOTE: L’utilisation de l’échelle dynamique permet au chercheur de contrôler la vitesse de montée.- Réglez la pente à 85°.
- Réglez la vitesse à 4,2 cm/s.
- Pour l’échauffement, effectuez trois séries de 100 étapes, sans charge externe. Prévoir une période de repos de 60 s entre les séries.
- Attachez le poids sur le ruban clinique placé autour de la queue de la souris.
REMARQUE : Selon l’âge et les caractéristiques des animaux, la charge externe peut être le poids maximal obtenu lors d’un essai élémentaire précédent, un pourcentage de celui-ci (p. ex., 50 %) ou un pourcentage du poids corporel (p. ex., 100 %-200 %). Si ce test est effectué après une période de formation, il est recommandé d’utiliser la même charge que lors du test initial pour évaluer les changements. - Commencez à 4,2 cm/s et augmentez la vitesse de 1,2 cm/s toutes les 60 s jusqu’à épuisement.
REMARQUE: Le résultat du test est le temps d’exercice, le nombre de barreaux montés ou la vitesse maximale.
5. Entraînement en résistance avec échelle statique
REMARQUE : Avant de commencer la période de formation, l’acclimatation (tableau 1) et la planification de la formation sont nécessaires. Pour réduire l’anxiété, adaptez et entraînez les souris en groupes de quatre animaux partageant la même cage.
- Pour l’échauffement quotidien, effectuez trois séries de 10 répétitions, 10 pas / répétition, sans charge externe. Pour la première série, fixez la pente à 90°, puis à 85°. Prévoir une période de repos de 60 s entre les séries.
- La séance d’entraînement commence dans la zone de repos. Clipser le gator avec le poids sur la bande clinique.
- Placez doucement la souris 10-20 barreaux sous le lieu de repos. Laissez la souris saisir l’échelon et grimper jusqu’à la zone de repos.
Répétez ce processus jusqu’à ce que le nombre d’échelons de cette série (p. ex., 10 échelons x 10 séries) soit terminé. - Retirez le poids de la queue de souris et attendez 120 s jusqu’à la prochaine série.
- Augmenter le nombre de pas et les charges de poids maximales de la série tout au long de la période d’entraînement, tout en maintenant l’horaire hebdomadaire.
REMARQUE : Un exemple de la variation des charges au cours d’une planification hebdomadaire est présenté dans le tableau 3. Bientôt, mardi et vendredi avec une charge de poids élevée (40-50 g) et un faible nombre de pas (500-400); lundi et jeudi avec une charge de poids intermédiaire (25-35 g) et un nombre intermédiaire de pas (800-600); et mercredi sans charge de poids mais un nombre élevé de pas (2 000). Cette conception facilite la récupération après les séances d’entraînement précédentes et évite les blessures et le surentraînement. Des exemples de 3 semaines de formation avec plusieurs conceptions utilisant l’échelle statique sont présentés dans le tableau 4 (au début, au milieu et à la fin de la période de formation, respectivement)4.
6. Entraînement en résistance avec échelle dynamique
NOTE: Après l’acclimatation, l’entraînement sur l’échelle dynamique est tout à fait similaire à l’échelle statique (tableau 2). L’entraînement est effectué sur 2-4 souris à la fois.
- Réglez la pente à 85°, fermez la porte de l’aire de repos et démarrez l’échelle à la vitesse souhaitée (par exemple, 5,4 cm/s).
- Pour l’échauffement, effectuez trois séries de 100 étapes, sans charge externe. Prévoir une période de repos de 60 s entre les séries.
- Avant le début des séances d’entraînement, lorsque la souris est dans la zone de repos, clipsez le gator avec le poids sur la bande clinique. Alternativement, le poids peut être attaché lorsque la souris est déjà sur l’échelle.
- Placez doucement la souris en haut de l’escalier mobile avec le poids sur la queue. Laissez les souris saisir l’échelon et grimper.
- Lorsque le nombre d’échelons de cette série est atteint (p. ex., 100), retirez les poids. Ensuite, la porte est ouverte pour que l’animal puisse aller à l’aire de repos. Le temps de repos est de 120 s avant la série suivante.
NOTE: Le nombre de marches montées est compté en fonction du temps de montée à la vitesse définie. - Répétez cette procédure jusqu’à ce que la séance de formation soit terminée. Le programme d’entraînement quotidien détaillé est présenté au tableau 5.
7. Évaluation de l’effet croisé de l’entraînement en résistance sur les performances d’endurance
NOTE: Pour cela, un test incrémental sur tapis roulant est effectué4, après 24 h de repos.
- Après un échauffement de 3 min à 10 cm/s, commencer l’essai incrémental à 10 cm/s et à un angle d’inclinaison de 10°.
- Augmentez la vitesse de 3,33 cm/s toutes les 3 minutes jusqu’à épuisement.
REMARQUE: Aucun choc électrique n’est utilisé, donc un pinceau de peintre est placé à l’arrière du tapis roulant pour empêcher les souris de s’en échapper.
8. Comportement des animaux pendant les procédures
REMARQUE : Une surveillance continue de l’adaptation des souris à l’entraînement doit être effectuée pour détecter une fatigue extrême, un surentraînement ou une blessure.
- Observez les signes de bien-être animal, en particulier le toilettage et le refus de formation. Le comportement normal de la souris, après une série d’entraînement intense, est de rester inactif pendant environ une minute en raison de la fatigue. Après cela, ils commencent à toiletter, à explorer ou à essayer d’enlever le ruban adhésif sur la queue.
- Dans le cas d’une souris refusant d’entraîner une série, essayez de donner des repos plus longs ou même de ne pas effectuer cette série pour éviter l’inhibition.
- De temps en temps, lorsque vous effectuez des exercices légers, poussez doucement la queue de l’animal pour l’encourager à terminer la série. Les animaux arrêtent de grimper parce que ce n’est pas une tâche exigeante. Inversement, lorsque les animaux portent une lourde charge, déplacez doucement le poids de l’animal pour alléger la charge et l’encourager à terminer la série, puis laissez l’animal se reposer jusqu’à la prochaine séance d’entraînement. Les animaux peuvent s’arrêter ou même tenter de descendre à cause de la lourde charge.
9. Procédures de sécurité
- Procédures de sécurité pour les chercheurs : Mener des recherches dans le laboratoire de l’animalerie et utiliser des couvre-chaussures, des combinaisons, des gants, des casquettes et des masques. Il n’y a pas d’exigences supplémentaires autres que celles spécifiques à la recherche animale.
- Sécurité pour les animaux: Pendant les séances d’exercice, une attention continue doit être accordée aux animaux, en raison des risques potentiels, tels que les chutes ou les sauts. Placez une main sous les poids pour attraper et tenir les souris en cas de chute due à l’épuisement, car sa capacité à tenir correctement les barreaux sera limitée.
Résultats
Résultats avec échelle statique
Le protocole d’entraînement en résistance progressive utilisé et décrit par Codina-Martinez et al.4 (tableau 4) a été testé dans une étude préliminaire consistant en 7 semaines d’entraînement sur une échelle statique avec des souris C57BL6J de type sauvage âgées de 6 mois (n = 4). Dans cette étude préliminaire, des tests incrémentiels pour évaluer la force maximale ont été effectués avant et après la p?...
Discussion
La formation est une intervention aux multiples applications en recherche, en dehors de l’étude de l’exercice lui-même. Ainsi, l’analyse de son effet sur le vieillissement20 ou certaines conditions pathologiques et la physiothérapie21 a reçu beaucoup d’attention ces dernières années. De plus, de nombreux auteurs ont analysé l’effet des interventions pharmacologiques22 ou diététiques21 sur la condition physiq...
Déclarations de divulgation
L’auteur correspondant s’assure que tous les auteurs n’ont pas de conflits d’intérêts.
Remerciements
Ce travail a été soutenu en partie par le Ministerio de Economía y Competitividad, Espagne (DEP2012-39262 à EI-G et DEP2015-69980-P à BF-G). Merci à Frank Mcleod Henderson Higgins du McLeod’s English Centre dans les Asturies, en Espagne, pour son aide linguistique.
matériels
| Name | Company | Catalog Number | Comments |
| Dynamic ladder | in-house production | ||
| Elastic adhesive bandage 6 cm x 2.5 m | BSN medical | 4005556 | |
| Gator Clip Steel NON-INSUL 10A | Digikey electronics | BC60ANP | |
| Static ladder | in-house production | ||
| Weights | in-house production | ||
| Wire for holding weigths | in-house production |
Références
- Pedersen, B. K., Saltin, B. Exercise as medicine - evidence for prescribing exercise as therapy in 26 different chronic diseases. Scandinavian Journal of Medicine & Science in Sports. 25, 1-72 (2015).
- Westcott, W. L. Resistance training is medicine: effects of strength training on health. Current Sports Medicine Reports. 11 (4), 209-216 (2012).
- Garatachea, N., et al. Exercise attenuates the major hallmarks of aging. Rejuvenation Research. 18 (1), 57-89 (2015).
- Codina-Martinez, H., et al. Autophagy is required for performance adaptive response to resistance training and exercise-induced adult neurogenesis. Scandinavian Journal of Medicine & Science in Sports. 30 (2), 238-253 (2020).
- Conner, J. D., Wolden-Hanson, T., Quinn, L. S. Assessment of murine exercise endurance without the use of a shock grid: an alternative to forced exercise. Journal of Visualized Experiments: JoVE. (90), e51846 (2014).
- Meijer, J. H., Robbers, Y. Wheel running in the wild. Proceedings of the Royal Society B: Biological Sciences. 281 (1786), 20140210 (2014).
- Suchomel, T. J., Nimphius, S., Bellon, C. R., Hornsby, W. G., Stone, M. H. Training for muscular strength: Methods for monitoring and adjusting training intensity. Sports Medicine. 51 (10), 2051-2066 (2021).
- Pousson, M., Perot, C., Goubel, F. Stiffness changes and fibre type transitions in rat soleus muscle produced by jumping training. Pflügers Archive. 419 (2), 127-130 (1991).
- Marqueti, R. C., et al. Biomechanical responses of different rat tendons to nandrolone decanoate and load exercise. Scandinavian Journal of Medicine & Science in Sports. 21 (6), 91-99 (2011).
- Cunha, T. S., Tanno, A. P., Costa Sampaio Moura, M. J., Marcondes, F. K. Influence of high-intensity exercise training and anabolic androgenic steroid treatment on rat tissue glycogen content. Life Sciences. 77 (9), 1030-1043 (2005).
- Heinemeier, K. M., et al. Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. The Journal of Physiology. 582, 1303-1316 (2007).
- Hornberger, T. A., Farrar, R. P. Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat. Canadian Journal of Applied Physiology. 29 (1), 16-31 (2004).
- Yarasheski, K. E., Lemon, P. W., Gilloteaux, J. Effect of heavy-resistance exercise training on muscle fiber composition in young rats. Journal of Applied Physiology. 69 (2), 434-437 (1990).
- Khamoui, A. V., et al. Aerobic and resistance training dependent skeletal muscle plasticity in the colon-26 murine model of cancer cachexia. Metabolism. 65 (5), 685-698 (2016).
- Kregel, K. C., et al. Resource book for the design of animal exercise protocols. American Physiological Society. 152, (2006).
- Marino, G., et al. Autophagy is essential for mouse sense of balance. The Journal of Clinical Investigation. 120 (7), 2331-2344 (2010).
- Figueiredo, V. C., de Salles, B. F., Trajano, G. S. Volume for muscle hypertrophy and health outcomes: The most effective variable in resistance training. Sports Medicine. 48 (3), 499-505 (2018).
- Gentil, P., et al. Using velocity loss for monitoring resistance training effort in a real-world setting. Applied Physiology, Nutrition, and Metabolism. 43 (8), 833-837 (2018).
- Fernández-Sanjurjo, M., et al. Is physical performance (in mice) increased by Veillonella atypica or decreased by Lactobacillus bulgaricus. Journal of Sport and Health Science. 9 (3), 197-200 (2020).
- Shiguemoto, G. E., et al. Effects of resistance training on matrix metalloproteinase-2 activity and biomechanics and physical properties of bone in ovariectomized and intact rats. Scandivavian Journal of Medicine & Science in Sports. 22 (5), 607-617 (2012).
- de Sousa Neto, I. V., et al. Effects of resistance training on matrix metalloproteinase activity in skeletal muscles and blood circulation during aging. Frontiers in Physiology. 9, 190 (2018).
- Ghosh, S., Golbidi, S., Werner, I., Verchere, B. C., Laher, I. Selecting exercise regimens and strains to modify obesity and diabetes in rodents: an overview. Clinical Science. 119 (2), 57-74 (2010).
- Mônico-Neto, M., et al. Resistance training minimizes catabolic effects induced by sleep deprivation in rats. Applied Physiology, Nutrition, and Metabolism. 40 (11), 1143-1150 (2015).
- Hawley, J. A., Hargreaves, M., Joyner, M. J., Zierath, J. R. Integrative biology of exercise. Cell. 159 (4), 738-749 (2014).
- Booth, F. W., Laye, M. J., Spangenburg, E. E. Gold standards for scientists who are conducting animal-based exercise studies. Journal of Applied Physiology. 108 (1), 219-221 (1985).
- Kruger, K., et al. Functional and muscular adaptations in an experimental model for isometric strength training in mice. PLoS One. 8 (11), 79069 (2013).
- Hendrickse, P. W., Krusnauskas, R., Hodson-Tole, E., Venckunas, T., Degens, H. Endurance exercise plus overload induces fatigue resistance and similar hypertrophy in mice irrespective of muscle mass. Experimental Physiology. 105 (12), 2110-2122 (2020).
- Knab, A. M., et al. Repeatability of exercise behaviors in mice. Physiology & Behavior. 98 (4), 433-440 (2009).
- Konhilas, J. P., et al. Loaded wheel running and muscle adaptation in the mouse. American Journal of Physiology-Heart and Circulatory Physiology. 289 (1), 455-465 (2005).
- Reiter, A., et al. Functional measures of grip strength and gait remain altered long-term in a rat model of post-traumatic elbow contracture. The Journal of Biomechanical Engineering. , (2019).
- Stieglitz, T., Schuettler, M., Schneider, A., Valderrama, E., Navarro, X. Noninvasive measurement of torque development in the rat foot: measurement setup and results from stimulation of the sciatic nerve with polyimide-based cuff electrodes. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 11 (4), 427-437 (2003).
- Seo, D. Y., et al. Humanized animal exercise model for clinical implication. Pflügers Archiv. 466 (9), 1673-1687 (2014).
- Tanaka, H., Swensen, T. Impact of resistance training on endurance performance. A new form of cross-training. Sports Medicine. 25 (3), 191-200 (1998).
- Hakkinen, K., Mero, A., Kauhanen, H. Specificity of endurance, sprint and strength training on physical performance capacity in young athletes. The Journal of Sports Medicine and Physical Fitness. 29 (1), 27-35 (1989).
- Vellers, H. L., Kleeberger, S. R., Lightfoot, J. T. Inter-individual variation in adaptations to endurance and resistance exercise training: genetic approaches towards understanding a complex phenotype. Mammalian Genome. 29 (1), 48-62 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon