Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle de perforation endovasculaire pour l’hémorragie sous-arachnoïdienne combinée à l’imagerie par résonance magnétique (IRM)
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici un modèle murin NORMALISÉ DH, induit par perforation de filament endovasculaire, combiné à l’imagerie par résonance magnétique (IRM) 24 h après l’opération pour assurer le bon site de saignement et exclure d’autres pathologies intracrâniennes pertinentes.
Résumé
Le modèle de perforation du filament endovasculaire pour imiter l’hémorragie sous-arachnoïdienne (HSA) est un modèle couramment utilisé - cependant, la technique peut entraîner un taux de mortalité élevé ainsi qu’un volume incontrôlable d’HSA et d’autres complications intracrâniennes telles que les accidents vasculaires cérébraux ou les hémorragies intracrâniennes. Dans ce protocole, un modèle murin normalisé d’HSA est présenté, induit par perforation de filament endovasculaire, combiné à l’imagerie par résonance magnétique (IRM) 24 h après l’opération pour assurer le bon site de saignement et exclure d’autres pathologies intracrâniennes pertinentes. En bref, les souris C57BL/6J sont anesthésiées avec une injection intrapéritonéale de kétamine/xylazine (70 mg/16 mg/kg de poids corporel) et placées en position couchée. Après l’incision du cou médian, l’artère carotide commune (ACC) et la bifurcation carotidienne sont exposées, et une suture en polypropylène monofilament non résorbable 5-0 est insérée de manière rétrograde dans l’artère carotide externe (ECA) et avancée dans l’artère carotide commune. Ensuite, le filament est invaginé dans l’artère carotide interne (ICA) et poussé vers l’avant pour perforer l’artère cérébrale antérieure (ACA). Après la récupération de la chirurgie, les souris subissent une IRM de 7,0 T 24 heures plus tard. Le volume des saignements peut être quantifié et classé par IRM postopératoire, ce qui permet à un groupe expérimental robuste d’HSA avec la possibilité d’effectuer d’autres analyses de sous-groupes en fonction de la quantité de sang.
Introduction
L’hémorragie sous-arachnoïdienne (HSA) est causée par la rupture d’un anévrisme intracrânien et constitue une urgence potentiellement mortelle, associée à une morbidité et une mortalité importantes, représentant environ 5% des accidents vasculaires cérébraux 1,2. Les patients atteints d’HSA présentent de graves maux de tête, un dysfonctionnement neurologique et une perturbation progressive de la conscience3. Environ 30% des patients atteints d’HSA meurent dans les 30 premiers jours suivant l’événement hémorragique initial4. Cliniquement, 50% des patients présentent une lésion cérébrale retardée (DBI) après une lésion cérébrale précoce. Le DBI se caractérise par une ischémie cérébrale retardée et des déficits neurologiques retardés. Des études actuelles ont montré que les effets synergiques de plusieurs facteurs différents entraînent la perte de la fonction neurologique, notamment la destruction de la barrière hémato-encéphalique, la contraction des petites artères, le dysfonctionnement microcirculatoire et la thrombose 5,6.
Un aspect unique de l’HSA est que la pathogenèse provient d’un emplacement extraparenchymateux mais conduit ensuite à des cascades néfastes à l’intérieur du parenchyme: la pathologie commence par l’accumulation de sang dans l’espace sous-arachnoïdien, déclenchant une multitude d’effets intraparenchymateux, tels que la neuroinflammation, l’apoptose des cellules neuronales et endothéliales, la dépolarisation de la propagation corticale et la formation d’œdème cérébral7, 8. L'
La recherche clinique est limitée par plusieurs facteurs, ce qui fait du modèle animal un élément essentiel pour imiter de manière cohérente et précise les changements pathologiques de la maladie. Différents protocoles modèles d’HSA ont été proposés, par exemple l’injection de sang autologue dans la cisterna magna (ACM). En outre, une méthode modifiée avec une double injection de sang autologue dans la citerne magna et la citerne de chiasme optique (APC) respectivement 9,10. Alors que l’injection de sang autologue est un moyen simple de simuler le processus pathologique de vasospasme et de réactions inflammatoires après une hémorragie sous-arachnoïdienne, l’augmentation suivante de la pression intracrânienne (PCI) est relativement lente et aucun changement notable dans la perméabilité de la barrière hémato-encéphalique n’est induit11,12. Une autre méthode, le placement sanguin périartérien, habituellement utilisé dans les grands modèles d’HSA (p. ex., les singes et les chiens), consiste à placer du sang autologue anticoagulé ou des produits sanguins comparables autour du vaisseau. Les changements de diamètre de l’artère peuvent être observés au microscope, servant d’indicateur de vasospasme cérébral après SAH13.
Barry et coll. ont décrit pour la première fois un modèle de perforation endovasculaire en 1979 dans lequel l’artère basilaire est exposée après avoir enlevé le crâne; l’artère est ensuite perforée avec des microélectrodes de tungstène, à l’aide d’une technique stéréotaxique microscopique14. En 1995, Bederson et Veelken ont modifié le modèle Zea-Longa de l’ischémie cérébrale et établi la perforation endovasculaire, qui a été continuellement améliorée depuis15,16. Cette méthode est basée sur le fait que les souris et les humains partagent un réseau vasculaire intracrânien similaire, connu sous le nom de cercle de Willis.
Pour l’évaluation postopératoire et la notation de l’HSA dans le modèle murin, différentes approches ont été proposées. Sugawara et al. ont développé une échelle de notation qui est largement utilisée depuis 200817. Cette méthode évalue la gravité de l’HSA en fonction des changements morphologiques. Cependant, pour cette méthode, la morphologie du tissu cérébral de la souris doit être examinée en vision directe et, par conséquent, la souris doit être sacrifiée pour évaluation. De plus, plusieurs méthodes pour déterminer la gravité de l’HSA in vivo ont été établies. Les approches vont de la simple notation neurologique à la surveillance de la pression intracrânienne (PCI) en passant par diverses techniques d’imagerie radiologique. En outre, la classification par IRM a été démontrée comme un nouvel outil non invasif pour classer la gravité de l’HSA, en corrélation avec le score neurologique18,19.
Ici, un protocole pour un modèle d’HSA causée par une perforation endovasculaire est présenté, combiné à une IRM postopératoire. Dans le but d’établir un système pour objectiver la quantité de saignement dans un contexte in vivo , nous avons également développé un système de classement et de quantification du volume sanguin total basé sur une IRM pondérée en T2 à haute résolution de 7,0 T. Cette approche assure l’induction correcte de l’HSA et l’exclusion d’autres pathologies telles que les accidents vasculaires cérébraux, l’hydrocéphalie ou l’hémorragie intracérébrale (ICH) et les complications.
Protocole
Les expériences ont été réalisées conformément aux directives et règlements établis par Landesamt fuer Gesundheit und Soziales (LaGeSo), Berlin, Allemagne (G0063/18). Dans cette étude, des souris mâles C57Bl/6J (âgées de 8 à 12 semaines) pesant 25 ± 0,286 g (moyenne ± m.a.) ont été utilisées.
1. Préparation des animaux
- Induire l’anesthésie en injectant de la kétamine (70 mg/kg) et de la xylazine (16 mg/kg) par voie intrapéritonéale. Maintenir une température corporelle normale, contribuant à l’induction rapide de l’anesthésie profonde. Testez la sédation adéquate avec un stimulus douloureux, comme un pincement des orteils, et vérifiez l’absence de réaction.
- Rasez soigneusement les poils du cou de la souris avec un rasoir, nettoyez-les avec de l’éthanol à 70% suivi de bétadine / chlorhexidine et appliquez 1% de lidocaïne sur la surface de la peau pour un contrôle local de la douleur.
- Placez la souris en position couchée. Utilisez du ruban adhésif pour fixer les membres et la queue, en étirant doucement la peau du cou du côté opposé de la chirurgie. Simultanément, élevez légèrement le cou.
- Utilisez une pommade ophtalmique (par exemple, 5% de dexpanthénol) pour prévenir la déshydratation des yeux pendant l’opération.
2. Induction de l’HSA
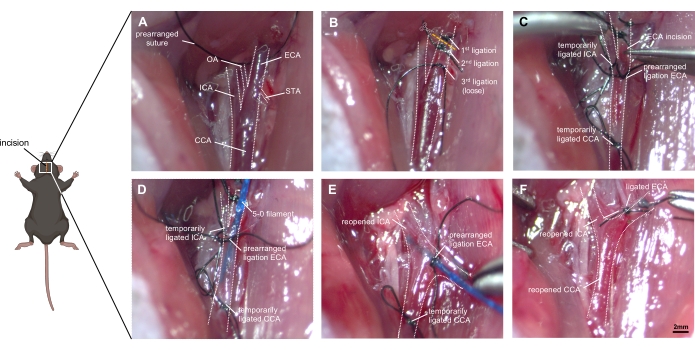
Figure 1: Images étape par étape de la technique chirurgicale. (A) Représentation de l’anatomie de l’artère carotide droite exposée: le CCA et sa bifurcation en ICA et ECA sont identifiés, ainsi que les petites branches de l’ECA (OA et STA). (B) La COUR est mobilisée à partir du tissu environnant et ligaturée avec deux sutures avant de le couper. Une troisième ligature doit être placée lâchement près de la bifurcation sans l’obstruer. (C) L’ICA et la CCA sont obstruées temporairement (avec ligature ou clips) pour éviter les saignements excessifs lorsque l’ECA est soigneusement incisée. (D) Le filament est inséré dans la Cour des comptes européenne et avancé dans la DCA. La ligature pré-arrangée doit être serrée avec soin afin qu’aucun épanchement sanguin ne se produise, mais que l’avancement du filament reste possible. (E) L’ICA et la CCA sont rouvertes, et le moignon de la CEA doit être ajusté à une direction crânienne. En poussant le filament ~9 mm vers l’avant dans l’ICA, la bifurcation ACA-MCA sera atteinte, et le récipient est ensuite perforé en poussant le filament ~3mm plus loin. (F) Le filament est retiré après avoir assuré une re-ligature temporelle de la DPA. La ligature préétablie de l’ECA est rapidement obstruée et le CCA est rouvert pour permettre la reperfusion. Abréviations : ACA = artère cérébrale antérieure, CCA = artère carotide commune, ECA = artère carotide externe, MCA = artère cérébrale moyenne, ICA = artère carotide interne, OA = artère occipitale, PPA = artère ptérygopalatine, STA = artère thyroïdienne supérieure. Barre d’échelle = 2 mm. Veuillez cliquer ici pour afficher une version agrandie de cette figure.
- Ouvrez la peau du cou avec un scalpel stérile, du menton au bord supérieur du sternum (1,5 cm), et séparez brutalement les glandes salivaires de leur tissu conjonctif environnant.
- Séparez le groupe musculaire le long d’un côté [dans ce cas, le côté droit] de la trachée, exposant la gaine de l’artère carotide commune (ACC) recouverte de vaisseaux sanguins nourrissants et de veinules. Le CCA et le nerf vagal sont situés à proximité l’un de l’autre.
- Dissocier le CCA et laisser un 8-0 libre suture de soie autour du CCA sans le ligaturer à l’avance. Faites attention à la protection du nerf vagal, car il est facilement endommagé (Figure 1A).
- Une triple bifurcation du CCA, de l’ICA et de l’ECA est visible le long du tiers postérieur inférieur de la diastase. Disséquer l’extrémité distale de l’ECA et ligaturer le vaisseau deux fois plus loin que possible.
- Débranchez l’ECA au milieu du segment ligaturé deux fois, créant ainsi un moignon de vaisseau.
- Préarrangez une ligature pour le filament autour du moignon ECA, ne le fermez pas avant une insertion réussie du filament.
- Utilisez une suture ou un micro-clip pour obstruer temporairement l’ICA et le CCA (Figure 1B).
- Faites une petite incision (environ la moitié du diamètre de l’ECA) dans l’ECA à l’aide de ciseaux microvasculaires. Insérez un filament de prolène 5-0 (ou 4-0) dans l’ECA et avancez-le dans le CCA.
- Fermez légèrement la ligature sur l’ECA tout en desserrant le micro-clip sur l’ICA et le CCA (Figure 1C).
- Tirez doucement sur le filament et ajustez le moignon ECA dans la direction crânienne, en invaginant le filament à travers la bifurcation dans l’ICA (Figure 1D).
- Pointez la pointe du filament médialement à un angle de ~30° par rapport à la ligne médiane trachéale et de ~30° par rapport au plan horizontal. Poussez le filament vers l’avant à l’intérieur de l’ICA. Après avoir atteint la bifurcation ACA-MCA, une résistance est rencontrée (~9 mm).
- Avancez le filament de 3 mm plus loin, en perforant l’ACA droit. Retirez rapidement le filament sur le moignon eca, ce qui permet au sang de circuler dans l’espace sous-arachnoïdien.
- Maintenez le filament dans cette position pendant environ 10 s (Figure 1E). La présence de tremblements musculaires, de miose ipsilatérale, de halètements, d’altération du rythme cardiaque et d’incontinence urinaire peuvent être des preuves de succès de la chirurgie.
- Fermez temporairement le CCA pour éviter une perte de sang excessive. Retirez le filament instantanément et ligaturez l’ECA avec la suture préarrangée. Rouvrez le CCA et permettez la reperfusion et l’épanchement supplémentaire du sang dans l’espace sous-arachnoïdien (Figure 1F).
- Après avoir vérifié s’il y a des fuites saignantes, désinfectez la peau entourant la plaie pour prévenir les infections cutanées postopératoires et suturez la plaie avec une suture en fibre de polyester 4-0 non résorbable.
- Placez la souris dans une boîte thermique jusqu’à ce que la conscience soit retrouvée. Attendez que l’animal soit complètement éveillé et assurez-vous qu’il a repris suffisamment de conscience pour maintenir la position couchée sternale. Ne retournez pas les animaux en compagnie d’autres souris jusqu’à ce qu’ils soient complètement rétablis.
- Administrer 200-300 mg / kg de paracétamol de poids corporel pour le soulagement de la douleur postopératoire.
- Vérifiez les souris tous les jours après la chirurgie.
3. Mesure IRM
- 24 heures après la chirurgie, effectuez une IRM à l’aide d’un scanner de rongeurs (Table des matériaux) et d’un résonateur de tête de souris dédié - ici, un résonateur de volume en quadrature d’émission / réception de 20 mm a été utilisé.
- Placez la souris sur une couverture d’eau chauffée pour assurer une température corporelle constante d’environ 37 ° C. Induire une anesthésie avec 2,5 % d’isoflurane dans un mélange O2/N2O (30 %/70 %) et maintenir avec 1,5-2 % d’isoflurane via un masque facial sous surveillance continue de la ventilation.
- Effectuez d’abord un balayage de référence rapide en acquérant 3 paquets de tranches orthogonales (Tri-Pilot-Multi, FLASH avec temps de répétition TR/temps d’écho TE = 200 ms/3 ms, 1 moyenne, angle de retournement FA = 30°, champ de vision FOV = 28 mm x 28 mm, matrice MTX = 256 x 256, épaisseur de tranche 1 mm, temps d’acquisition total TA = 30 s).
- Utilisez ensuite une séquence d’écho-spin turbo 2D pondérée T2 haute résolution pour l’imagerie (paramètres d’imagerie TR/TE = 5505 ms/36 ms, facteur RARE 8, 6 moyennes, 46 tranches axiales contiguës d’une épaisseur de tranche de 0,35 mm pour couvrir tout le cerveau, FOV = 25,6 mm x 25,6 mm, MTX = 256 x 256, TA = 13 min).
- Si le résultat n’est pas clair, utilisez une séquence d’écho de gradient T2* pondérée par respiration supplémentaire avec la même isodistance que le balayage T2w (FLASH 2D, TR/TE = 600 ms/6,3 ms, FA = 30°, 1 moyenne, 20 tranches axiales d’une épaisseur de 0,35 mm, FOV et MTX identiques à T2w, TA = 5-10 min selon la fréquence respiratoire).
- Transférez les données au format d’image DICOM et utilisez le logiciel ImageJ pour le classement SAH et la volumétrie des caillots sanguins. Les détails sur la quantification sont énumérés sous forme de guide étape par étape dans le matériel supplémentaire (figure supplémentaire 1).
Résultats
Mortalité
Pour cette étude, un total de 92 souris mâles C57Bl/6J âgées de 8 à 12 semaines ont été soumises à une opération de l’HSA; dans ceux-ci, nous avons observé un taux de mortalité global de 11,9 % (n = 12). La mortalité s’est produite exclusivement dans les 6 à 24 premières heures après la chirurgie, ce qui suggère que la mortalité périopératoire ainsi que les saignements d’HSA eux-mêmes sont les facteurs contributifs les plus probables.
Discussion
En résumé, un modèle murin normalisé d’HSA induit par une opération de perforation de filament endovasculaire est présenté avec une invasion mineure, un temps opératoire court et des taux de mortalité acceptables. L’IRM est réalisée 24 heures après l’opération pour assurer le bon site de saignement et l’exclusion d’autres pathologies intracrâniennes pertinentes. De plus, nous avons classé différents grades de saignement de l’HSA et mesuré les volumes de saignement, ce qui a permis d’autres ...
Déclarations de divulgation
Pas de conflits d’intérêts
Remerciements
SL a été soutenu par le Chinese Scholarship Council. KT a été soutenu par la bourse BIH-MD de l’Institut de la santé de Berlin et de la Sonnenfeld-Stiftung. RX est soutenu par le programme de cliniciens-chercheurs DE LA Bosnie-Herzégovine, financé par la Charité-Universitätsmedizin Berlin et l’Institut de la santé de Berlin. Nous reconnaissons le soutien de la Fondation allemande pour la recherche (DFG) et du Fonds de publication en libre accès de la Charité - Universitätsmedizin Berlin.
matériels
| Name | Company | Catalog Number | Comments |
| Eye cream | Bayer | 815529836 | Bepanthen |
| Images analysis software | ImageJ | Bundled with Java 1.8.0_172 | |
| Ligation suture (5-0) | SMI | Silk black USP | |
| Light source for microscope | Zeiss | CL 6000 LED | |
| Ketamine | CP-pharma | 797-037 | 100 mg/mL |
| MRI | Bruker | Pharmascan 70/16 | 7 Tesla |
| MRI images acquired software | Bruker | Bruker Paravision 5.1 | |
| Paracetamol (40 mg/mL) | bene Arzneimittel | 4993736 | |
| Prolene filament (5-0) | Erhicon | EH7255 | |
| Razor | Wella | HS61 | |
| Surgical instrument (Fine Scissors) | FST | 14060-09 | |
| Surgical instrument (forceps#1) | AESCULAP | FM001R | |
| Surgical instrument (forceps#2) | AESCULAP | FD2855R | |
| Surgical instrument (forceps#3) | Hammacher | HCS 082-12 | |
| Surgical instrument (Needle holder) | FST | 91201-13 | |
| Surgical instrument (Vannas Spring Scissors) | FST | 15000-08 | |
| Surgical microscope | Zeiss | Stemi 2000 C | |
| Ventilation monitoring | Stony Brook | Small Animal Monitoring & Gating System | |
| Wounding suture(4-0) | Erhicon | CB84D | |
| Xylavet | CP-pharma | 797-062 | 20 mg/mL |
Références
- Macdonald, R. L., Schweizer, T. A. Spontaneous subarachnoid haemorrhage. The Lancet. 389 (10069), 655-666 (2017).
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. The Lancet. 369 (9558), 306-318 (2007).
- Abraham, M. K., Chang, W. -. T. W. Subarachnoid hemorrhage. Emergency Medicine Clinics of North America. 34 (4), 901-916 (2016).
- Schertz, M., Mehdaoui, H., Hamlat, A., Piotin, M., Banydeen, R., Mejdoubi, M. Incidence and mortality of spontaneous subarachnoid hemorrhage in martinique. PLOS ONE. 11 (5), 0155945 (2016).
- Okazaki, T., Kuroda, Y. Aneurysmal subarachnoid hemorrhage: intensive care for improving neurological outcome. Journal of Intensive Care. 6 (1), 28 (2018).
- Kilbourn, K. J., Levy, S., Staff, I., Kureshi, I., McCullough, L. Clinical characteristics and outcomes of neurogenic stress cadiomyopathy in aneurysmal subarachnoid hemorrhage. Clinical Neurology and Neurosurgery. 115 (7), 909-914 (2013).
- de Oliveira Manoel, A. L., et al. The critical care management of spontaneous intracranial hemorrhage: a contemporary review. Critical Care. 20 (1), 272 (2016).
- Schneider, U. C., et al. Microglia inflict delayed brain injury after subarachnoid hemorrhage. Acta Neuropathologica. 130 (2), 215-231 (2015).
- Delgado, T. J., Brismar, J., Svendgaard, N. A. Subarachnoid haemorrhage in the rat: angiography and fluorescence microscopy of the major cerebral arteries. Stroke. 16 (4), 595-602 (1985).
- Piepgras, A., Thomé, C., Schmiedek, P. Characterization of an anterior circulation rat subarachnoid hemorrhage model. Stroke. 26 (12), 2347-2352 (1995).
- Suzuki, H., et al. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. Journal of Clinical Investigation. 104 (1), 59-66 (1999).
- Dudhani, R. V., Kyle, M., Dedeo, C., Riordan, M., Deshaies, E. M. A Low mortality rat model to assess delayed cerebral vasospasm after experimental subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (71), e4157 (2013).
- Iuliano, B. A., Pluta, R. M., Jung, C., Oldfield, E. H. Endothelial dysfunction in a primate model of cerebral vasospasm. Journal of Neurosurgery. 100 (2), 287-294 (2004).
- Barry, K. J., Gogjian, M. A., Stein, B. M. Small animal model for investigation of subarachnoid hemorrhage and cerebral vasospasm. Stroke. 10 (5), 538-541 (1979).
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26 (6), 1086-1092 (1995).
- Veelken, J. A., Laing, R. J. C., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26 (7), 1279-1284 (1995).
- Sugawara, T., Ayer, R., Jadhav, V., Zhang, J. H. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model. Journal of Neuroscience Methods. 167 (2), 327-334 (2008).
- Egashira, Y., Shishido, H., Hua, Y., Keep, R. F., Xi, G. New grading system based on magnetic resonance imaging in a mouse model of subarachnoid hemorrhage. Stroke. 46 (2), 582-584 (2015).
- Mutoh, T., Mutoh, T., Sasaki, K., Nakamura, K., Taki, Y., Ishikawa, T. Value of three-dimensional maximum intensity projection display to assist in magnetic resonance imaging (MRI)-based grading in a mouse model of subarachnoid hemorrhage. Medical Science Monitor. 22, 2050-2055 (2016).
- Kothari, R. U., et al. The ABCs of measuring intracerebral hemorrhage volumes. Stroke. 27 (8), 1304-1305 (1996).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71 (2018).
- Titova, E., Ostrowski, R. P., Zhang, J. H., Tang, J. Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm. Neurological Research. 31 (6), 568-581 (2009).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: Species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Marbacher, S., Fandino, J., Kitchen, N. D. Standard intracranial in vivo animal models of delayed cerebral vasospasm. British Journal of Neurosurgery. 24 (4), 415-434 (2010).
- Thompson, J. W., et al. In vivo cerebral aneurysm models. Neurosurgical Focus. 47 (1), 1-8 (2019).
- Frontera, J. A., et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: The modified fisher scale. Neurosurgery. 59 (1), 21-26 (2006).
- Fisher, C. M., Kistler, J. P., Davis, J. M. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery. 6 (1), 1-9 (1980).
- Wilson, D. A., et al. A simple and quantitative method to predict symptomatic vasospasm after subarachnoid hemorrhage based on computed tomography: Beyond the fisher scale. Neurosurgery. 71 (4), 869-875 (2012).
- Schüller, K., Bühler, D., Plesnila, N. A murine model of subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (81), e50845 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon