Method Article
Utilisation de la microscopie à 2 photons pour quantifier les effets de l’obstruction urétérale unilatérale chronique sur les processus glomérulaires
Dans cet article
Résumé
Ici, nous présentons un protocole utilisant la microscopie à 2 photons chez des rats Wistar Fromter de Munich avec des glomérules de surface pour quantifier les effets de l’obstruction urétérale prolongée sur la dynamique et la fonction glomérulaires.
Résumé
L’application de nouvelles méthodes de microscopie à des modèles de maladies animales appropriés pour explorer la physiologie dynamique du rein reste un défi. Les rats avec des glomérules de surface offrent une occasion unique d’étudier les processus physiologiques et physiopathologiques en utilisant la microscopie intravitale à 2 photons. La quantification du flux sanguin capillaire glomérulaire et la vasoconstriction et la dilatation en réponse aux médicaments, la perméabilité et l’inflammation ne sont que quelques-uns des processus qui peuvent être étudiés. De plus, les rats transgéniques, c’est-à-dire les podocytes marqués avec des colorants fluorescents et d’autres approches de biomarqueurs moléculaires, offrent une résolution accrue pour surveiller et quantifier directement les interactions protéine-protéine et les effets d’altérations moléculaires spécifiques.
Chez les souris, qui n’ont pas de glomérules de surface après l’âge de quatre semaines, l’obstruction urétérale unilatérale (UUO) pendant plusieurs semaines a été utilisée pour induire des glomérules de surface. Comme ce modèle d’induction ne permet pas d’études de base, nous avons quantifié les effets de l’UUO sur les processus glomérulaires dans le modèle UUO chez les rats Munich Wistar Frömter (MWF), qui ont des glomérules de surface dans des conditions physiologiques. Le modèle UUO pendant cinq semaines ou plus a induit des altérations significatives de la morphologie rénale globale, de la microvascularisation péritubulaire et glomérulaire, ainsi que de la structure et de la fonction des épithéliums tubulaires. Le flux de globules rouges (GR) glomérulaires et péritubulaires a diminué de manière significative (p < 0,01), probablement en raison de l’augmentation significative de l’adhérence des globules blancs (GB) dans les capillaires glomérulaires et péritubulaires. Le coefficient de tamisage glomérulaire de l’albumine est passé de 0,015 ± 0,002 chez les MWF non traités à 0,045 ± 0,05 chez les rats UUO MWF âgés de 5 semaines. Douze semaines d’UUO ont entraîné de nouvelles augmentations de la densité glomérulaire de surface et du coefficient de tamisage glomérulaire (GSC) pour l’albumine. L’albumine fluorescente filtrée à travers les glomérules n’a pas été réabsorbée par les tubules proximaux. Ces données suggèrent que l’utilisation de l’UUO pour induire des glomérules de surface limite la capacité d’étudier et d’interpréter les processus glomérulaires normaux et les altérations de la maladie.
Introduction
Comprendre les processus glomérulaires, en particulier la biologie des podocytes, est un objectif depuis plus de 50 ans. Les rats Wistar de Munich avec des glomérules de surface ont joué un rôle central dans ces études, y compris les études de microponction, pour comprendre de nombreux aspects des processus physiologiques et pathologiques 1,2,3. L’utilisation de la microscopie pour étudier les composants glomérulaires par voie intravitale était limitée en raison des effets de la phototoxicité jusqu’à l’avènement de la microscopie à 2 photons qui minimisait cette exposition toxique et augmentait la profondeur de pénétration 1,2. Parallèlement aux progrès rapides du matériel informatique et des logiciels, cela a permis des études tridimensionnelles (3D) et quadridimensionnelles (temps) pendant des heures dans un seul cadre 1,4,5.
La quantification du débit sanguin capillaire glomérulaire, la vasoconstriction et la dilatation en réponse aux médicaments, la perméabilité et les effets de la charge sur la perméabilité et l’inflammation ne sont que quelques-uns des processus glomérulaires étudiés. De plus, le segment S1 du tubule proximal est identifiable, et les différences de comportement de l’épithélium tubulaire S1 et S2 peuvent être quantifiées 1,4. Des études chez la souris, en particulier avec la disponibilité universelle d’installations transgéniques chez la souris, ont conduit à des progrès rapides dans la compréhension de la biologie moléculaire des processus de maladies glomérulaires. Les protéines individuelles sont responsables de la dysfonction glomérulaire dans les études knockout, en particulier en ce qui concerne la protéinurie 6,7,8. Cependant, l’utilisation de modèles murins pour les études d’imagerie glomérulaire a été limitée car les glomérules se trouvent à plus de 100 μm sous la surface dans les nombreuses souches étudiées9.
Cela a conduit les chercheurs à développer et à utiliser des modèles murins résultant en glomérules de surface qui peuvent être étudiés. Le modèle le plus courant est l’utilisation de UUO 10,11,12 complet. À la fin de la période UUO prolongée, il existe de nombreux glomérules de surface dans les reins de souris qui peuvent être et ont été étudiés13,14. Il n’y a pas eu d’étude de base ou de contrôle dans ces études sur la souris pour déterminer les effets de l’UUO prolongée sur la biologie glomérulaire. Comme il s’agit d’un modèle grave et prolongé de blessure entraînant une fibrose rapide et une destruction corticale10,11,12, nous avons émis l’hypothèse qu’il y aurait des effets sur les processus glomérulaires et la fonction. Pour répondre à cette question, des rats Wistar Fromter de Munich (MWF) avec des glomérules de surface ont été utilisés pour étudier les paramètres de contrôle / de base, et les résultats de base ont été comparés aux études glomérulaires chez les rats MWF après cinq semaines d’UUO. Nous avons également étudié des rats Sprague Dawley (SD) qui n’ont pas de glomérules de surface après UUO. Les résultats indiquent que 5 semaines d’UUO chez les rats MWF et SD augmentent effectivement le nombre de glomérules de surface. Cependant, il s’agissait de glomérules anormaux avec des changements marqués dans le flux sanguin glomérulaire, l’inflammation, la perméabilité et la taille des macromolécules.
Protocole
Toutes les expériences ont suivi le Guide for the Care and Use of Laboratory Animals et ont été approuvées par le Animal Care and Use Committee de l’Indiana University School of Medicine.
1. Préparation du rat Munich Wistar Frömter ou SD pour la chirurgie UUO
- Anesthésiez le rat à l’aide d’isofluorane (induction de 5 %, entretien de 1,5 à 2,5 %), puis rasez, lavez et désinfectez la zone chirurgicale plusieurs fois dans un mouvement circulaire avec un gommage à base d’iode ou de chlorhexidine et de l’alcool. Appliquer un analgésique à action prolongée / à libération lente pour la gestion de la douleur conformément aux directives institutionnelles de l’IACUC.
- Faire une incision le long de la ligne médiane à l’aide d’un scalpel; Localisez le rein gauche et libérez-le des organes péritonéaux environnants.
- Localisez soigneusement le pédicule rénal, qui comprend l’artère rénale, la veine rénale et l’uretère. Séparez l’uretère des autres structures, en prenant des précautions pour ne pas endommager la structure délicate.
- À l’aide d’une pince fine, bouclez soigneusement une suture 3-0 autour de l’uretère et attachez-le, en prenant soin de ne pas le déchirer. Répétez cette procédure de quelques millimètres de chaque côté du premier nœud pour nouer un deuxième nœud et assurer une obstruction complète.
- Une fois la procédure terminée, fermez soigneusement les couches musculaires successives. Avant de fermer la dernière couche, ajoutez 2 mL de solution saline chaude et stérile à 0,9 % dans l’abdomen avant de la fermer complètement. Fermez la peau externe avec des agrafes chirurgicales.
- Appliquez un analgésique à action prolongée / à libération lente pour la gestion de la douleur et observez de près la récupération conformément aux directives institutionnelles de l’IACUC. Surveiller périodiquement par la suite et se préparer à l’imagerie à la fin de la cinquième semaine.
2. Synthèse de l’albumine sérique de rat rouge du Texas (TR-RSA)
- Peser 100 mg d’albumine sérique de rat et la dissoudre dans 6,67 mL de tampon de bicarbonate de sodium 0,1 M à pH 8,4 dans un tube conique de 50 mL.
- Dans un flacon de 5 mg d’ester de Texas Red-X-succinimidyl, ajouter 100 μL de Dimethyl Formamide (DMF, haute qualité) et vortex jusqu’à ce que tout le colorant soit dissous.
- Placez la solution d’albumine sérique de rat sur un vortexer à un réglage faible/moyen, de sorte que le volume de la solution tourne bien en dessous du haut du tube ouvert.
- Ajouter le colorant dissous pendant que le tube est vortexé.
- Prenez le tube conique de 50 mL, enveloppez-le dans du papier d’aluminium, placez le tube sur une bascule ou un rouleau et agitez lentement pendant 1 h à température ambiante (RT).
- Dans un seau de 5 L de NaCl à 0,9 % muni d’une barre d’agitation sous agitation douce, mouiller les membranes d’un dialyseur de coupure de poids moléculaire approprié de 50 kDa (une membrane avec des clips, des tubes à membrane fermés ou des cassettes de dialyse conviennent tous).
- Chargez la solution TR-RSA dans le système à membrane et fixez-la aux accessoires de flottation généralement inclus avec le système. Placer le récipient de 5 L avec la solution saline à 0,9 % / TR-RSA pendant la nuit à 4 °C (dans une chambre froide) en agitant doucement sur une plaque d’agitation. Changez la solution de dialyse au moins trois fois au cours des 36 heures suivantes.
- Le gonflement de la membrane augmentera le volume de la solution TR-RSA maintenant claire. Divisez les 100 mg d’origine par le volume pour obtenir une concentration approximative : le rapport colorant:protéine sera de 1:1. Aliquote en volumes appropriés et lyophiliser pour un stockage à long terme.
3. Préparation à l’imagerie intravitale à 2 photons sur un microscope inversé
- Retirez le couvercle d’un plat inférieur de 50 mm (avec un diamètre de glissement de couverture de 40 mm) et placez 8 morceaux de ruban adhésif autoclave sur le fond intérieur le long du bord. Faites une fenêtre vide en forme de pyramide, en utilisant 4 pièces de chaque côté pour permettre au rein extériorisé de s’adapter parfaitement dans cet espace tout en maintenant le contact périphérique avec le ruban de l’autoclave, aidant ainsi à minimiser le mouvement. Ajustez l’espacement en fonction de la taille du rat pour assurer le meilleur contact avec le rein.
- Placer 1 tampon thermique de chaque côté du plat inférieur de 50 mm. Assurez-vous que le coussin chauffant couvre la scène.
- Utilisez un objectif d’immersion dans l’eau 40x avec un zoom de 0,75x et un zoom de 1,5x pour générer des images 30x et 60x, respectivement, ce qui permet d’obtenir des images à grossissement plus faible et plus élevé. Si nécessaire, ajoutez de l’eau à l’objectif à l’aide d’une seringue de 1 mL avec un long morceau de tube PE-200 qui peut atteindre le sommet de l’objectif à un angle vers le bas pour empêcher la gouttelette d’eau de s’évacuer dans le tube.
- Utilisez une transmissivité laser de 2 %, avec des détecteurs bleus, verts et rouges réglés à des niveaux prédéterminés pour assurer la cohérence des images entre les études. Réglez la longueur d’onde d’excitation à 800 nm sur le laser référencé (voir le Tableau des matériaux), ce qui excitera efficacement tous les fluorophores utilisés dans cette étude.
- Utiliser des détecteurs externes (non scannés) pour collecter les émissions bleues à l’aide d’un tube photomultiplicateur (PMT) (420-490 nm, gain 950).
- Utilisez un détecteur Hyd pour capter les émissions vertes (500-550 nm, gain 100).
- Utilisez un détecteur Hyd pour capturer les émissions rouges (590-660 nm, gain 200).
- Ajustez le décalage dans le PMT (émissions bleues) de sorte que seuls quelques pixels dans les zones vides du tissu aient une valeur de zéro.
REMARQUE: Les détecteurs HyD pour les émissions vertes et rouges ont un réglage automatique du décalage; Seul le gain peut être fixé. - Définissez la profondeur de bits sur 12 bits pour donner aux images une échelle d’intensité de 4 096 entre le noir et le blanc.
NOTE: Il est nécessaire de fixer les limites inférieures des détecteurs (décalage en PMT) pour ne pas exclure ces valeurs afin d’assurer la collecte des émissions de faible intensité dans l’espace de Bowman. Si le réglage de sensibilité est trop faible, les marqueurs d’avertissement visuels l’indiqueront; Ces valeurs reçoivent une valeur d’intensité de zéro.
- Diluer environ 6 mg d’albumine sérique Texas-Red-X-Rat jusqu’à un volume total de 1 mL, charger la solution dans une seringue de 1 mL et placer sur le cathéter intraveineux à demeure à l’étape 4.1 après perfusion de Hoechst 33342 à l’étape 9.1.
4. Préparation chirurgicale pour l’imagerie intravitale à 2 photons
- Placer le rat pré-anesthésié avec une ligne d’accès veineuse à demeure (fémorale ou jugulaire) sur le côté avec le flanc gauche rasé tourné vers le haut et droit sur la table. Assurez-vous que les pattes avant se touchent, tout comme les pattes arrière.
- Palper doucement le flanc gauche juste en dessous des côtes pour sentir le rein afin de déterminer la position naturelle dans l’abdomen. Si nécessaire, tracez une ligne à l’aide d’un marqueur permanent le long de la zone rasée, en divisant le centre du rein dans une orientation nez à queue.
- À l’aide d’une paire de pinces dentées, saisissez la peau et soulevez-la vers le haut pour faciliter le pincement de la ligne de marqueur permanente avec une paire d’hémostatiques pour écraser le système vasculaire sous-jacent et prévenir les saignements lors de l’incision avec une paire de ciseaux chirurgicaux. Répétez cette opération pour la fine couche musculaire externe afin de minimiser les saignements.
- Pour faire l’incision finale de la fine couche musculaire abdominale interne, repalper le rein pour estimer la taille et la position. Soulevez soigneusement la couche musculaire interne avec une paire de pinces et écrasez une ligne qui coupe la peau au-dessus du rein avec les hémostatiques qui est environ 1/3de la taille estimée du rein.
- En maintenant la prise sur la couche musculaire avec la pince, faites l’incision finale.
REMARQUE: Il est préférable de faire une incision plus petite et de l’agrandir au besoin que de la rendre trop grande, ce qui nécessitera une fermeture partielle avec une suture. - Saisissez doucement le rein par la graisse environnante. En utilisant les deux mains avec une pince dans chaque main, travaillez à saisir la graisse au pôle inférieur du rein en utilisant une technique main sur main pour saisir et tenir la graisse rénale, en travaillant vers le bas.
- Ayant une prise ferme sur la graisse au pôle inférieur du rein avec une main, tirez doucement la graisse et, si nécessaire, pressez très doucement le rein à travers l’incision. Si le rein ne passe pas facilement, élargissez l’incision.
5. Positionnement du rat pour l’imagerie
- Placez soigneusement le rein exposé contre le bord de la boîte, avec une légère rotation de sorte que le côté abdominal du rein entre en contact avec la lamelle de couverture et que le côté dorsal soit tourné vers l’extérieur du bord.
- Pour minimiser davantage le mouvement, prenez deux compresses de gaze stériles 2 x 2, humidifiez-les avec une solution saline et collez-les contre la face dorsale du rein, renforçant ainsi le contact de la face abdominale du rein avec le bord.
- Regardez à travers l’oculaire du microscope sous un éclairage par épifluorescence à l’aide d’un cube Rhodamine/FITC à double passage. Si un mouvement est détecté, faites des ajustements mineurs à la position et ajustez soigneusement la gaze, en vous assurant qu’elle ne pousse pas sous le rein. Pour réduire davantage le mouvement, roulez légèrement le rat, de sorte que le thorax soit plus éloigné du plat.
6. Acquisition d’images pour l’analyse quantitative
- Balayez la surface du rein à l’aide de l’éclairage par épifluorescence (étape 5.3) et marquez la ou les positions des glomérules à l’aide du logiciel associé au contrôleur de scène motorisé (une caractéristique des systèmes modernes).
- Pour chaque canal de couleur sous éclairage à 2 photons, prenez un volume 3D peu profond de la partie supérieure de chaque glomérule marqué, qui servira d’images d’arrière-plan. Utilisez une palette de pseudo-couleurs dans l’option d’affichage du logiciel d’imagerie pour mieux visualiser les faibles intensités de la fluorescence de fond des boucles capillaires glomérulaires.
- En utilisant un vaisseau sanguin superficiel comme point focal, infuser lentement l’albumine fluorescente, laissant le temps d’observer la montée et la baisse de la fluorescence due à la distribution systémique. Infuser suffisamment de TR-RSA pour atteindre une intensité dans le système vasculaire péritubulaire et les anses capillaires juste en dessous de la saturation.
NOTE: Il y a généralement un délai de 5 s entre la perfusion du matériel et son apparition dans la circulation sanguine lorsque la perfusion rénale est normale. - Attendez environ 10 minutes avant d’acquérir des volumes 3D (intervalles de 1 μm) pour tous les glomérules marqués et imagés à partir de l’étape 6.2.
REMARQUE: Les rats Wistar de Munich de Simonsen ont moins de glomérules de surface. Cependant, comme la souche Frömter de rats MW a un plus grand nombre de glomérules de surface, jusqu’à 10 glomérules peuvent souvent être imagés. - Euthanasier le rat via une surdose d’isoflurane à la fin de l’étude. Effectuer une double pneumothoracotomie pour assurer l’euthanasie.
7. Calcul de la perméabilité glomérulaire
- À l’aide du logiciel de visualisation d’images associé au système de microscope, exportez les images vers des images brutes 12 bits à des fins de traitement et d’analyse.
- Chargez les volumes 3D d’arrière-plan et le volume 3D brut contenant l’albumine fluorescente en circulation. Localisez le plan focal dans le volume 3D avec la boucle capillaire superficielle la plus brillante dans les glomérules avec suffisamment d’espace jusqu’au bord de la capsule de Bowman environnante.
- À l’aide de repères visuels, localisez le même plan focal que celui du volume d’arrière-plan. Sélectionnez une région dans la boucle capillaire et une dans l’espace de Bowman en notant les valeurs d’intensité moyennes de chacune. Utilisez ces valeurs d’intensité comme valeurs d’arrière-plan.
- Délimitez une région (au moins 20 x 20 pixels) dans l’espace de Bowman dans l’image contenant de l’albumine et notez la lecture de l’intensité (sélectionnez une zone qui n’est pas adjacente à une boucle capillaire ou à la capsule de Bowman pour assurer la mesure la plus propre des intensités spatiales de Bowman). Déplacez la région dessinée sur deux autres régions pour prendre une valeur moyenne de l’intensité moyenne dans l’espace de Bowman.
- Sélectionnez l’intensité fluorescente du plasma la plus brillante dans la section de la boucle capillaire et encerclez cette région. À l’aide de la fonction de seuil , mettez en surbrillance les valeurs lumineuses (généralement situées sur les bords des parois de la boucle capillaire), évitez de faire circuler les ombres RBC et notez la valeur.
REMARQUE: Comme les facteurs dans le sang entraîneront une sous-estimation des niveaux de fluorescence plasmatique, il est important de sélectionner les zones les plus brillantes. - Entrez les valeurs dans une feuille de calcul pour calculer la CGC à l’aide de l’égaliseur (1) :
CGC = (1)
(1)
8. Calcul du débit de globules rouges dans les anses capillaires glomérulaires de surface et le système vasculaire rénal à l’aide d’une fonction de balayage linéaire
- Trouvez un vaisseau approprié (soit une boucle capillaire, soit un vaisseau péritubulaire). Comme la fonction de balayage linéaire du logiciel d’acquisition d’images référencées (voir le tableau des matériaux) exige que le récipient soit perpendiculaire, faites pivoter l’image à l’aide de la fonction de rotation .
- Une fois le navire tourné et couché à plat, sélectionnez la fonction XT dans le menu d’acquisition . Configurez l’analyse de 4 000 lignes. Placer la ligne à travers le navire à examiner; Assurez-vous que le plan focal est au diamètre maximal du segment à imager.
- Cliquez avec le bouton gauche de la souris sur l’image composite couleur et sélectionnez Prendre un instantané pour générer une image de référence de la zone où le balayage linéaire a été pris. Cliquez immédiatement sur le bouton Démarrer pour capturer le balayage des lignes du navire.
- Pour déterminer le débit RBC, importez les balayages linéaires dans le logiciel de traitement d’image (voir le tableau des matériaux). Ouvrez la boîte de dialogue Afficher les statistiques de région dans le menu déroulant Mesurer . Sélectionnez l’outil de dessin au trait unique et tracez une ligne qui correspond à la pente des ombres RBC. Notez les valeurs de largeur et de hauteur.
REMARQUE: Les valeurs de pixels obtenues pour la largeur correspondront à la distance; Les pixels pour la hauteur correspondent au temps. - Utilisez la formule suivante (Eq (2)) pour calculer la vitesse.
Débit des globules rouges en μm/s =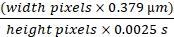 (2)
(2)
NOTE: Cela correspond à des paramètres d’acquisition à un grossissement de 60x et à une fréquence de balayage de 400 Hz avec le microscope référencé (voir le tableau des matériaux).- Faites au moins cinq calculs et faites la moyenne pour indiquer la vitesse de chaque balayage linéaire.
REMARQUE: Ces paramètres dépendent de la dimension en pixels et de la vitesse d’acquisition du système de microscope.
- Faites au moins cinq calculs et faites la moyenne pour indiquer la vitesse de chaque balayage linéaire.
9. Calcul de l’occlusion WBC dans les anses capillaires glomérulaires
- Administrer la coloration nucléaire Hoechst 33342 (à ~8 μg/kg de poids de rat) via une ligne d’accès veineux à demeure pour identifier les globules blancs logés dans les anses capillaires.
REMARQUE: La profondeur utilisable sera limitée en raison de la diffusion des photons et de l’absorption par l’hémoglobine, en particulier pour les émissions bleues de longueur d’onde plus courte. - Centrez un glomérule dans le champ d’imagerie et prenez un ensemble de données 3D commençant à la surface glomérulaire et terminant les données d’au moins 30 à 35 μm. Utilisez une taille de pas de 1 μm dans la direction Z.
- Identifier les WBC en comparant le canal bleu Hoechst avec le canal d’albumine Texas Red; rechercher l’exclusion du colorant rouge dans la boucle capillaire et une coloration nucléaire correspondante pour identifier positivement les globules blancs. Définissez les globules blancs comme « adhérents » s’ils apparaissent statiques sur 3 sections optiques. Déclarez les valeurs sous forme d’occurrence/10 coupes optiques à partir du sommet du glomérule, prises à des intervalles de 1 μm.
10. Marquer la présence de formations de Rouleaux dans les glomérules de surface
- Suivez les mêmes instructions pour l’étape 9.3 et acquérez un jeu de données 3D. Recherchez les formations de Rouleaux apparaissant sous forme de globules rouges empilés en paquets qui résistent à la dissociation lorsqu’ils se déplacent le long des boucles capillaires. Utilisez un fluorophore rouge pour une meilleure visualisation de la structure à de plus grandes profondeurs en raison de moins de diffusion de photons pour les émissions rouges de plus grande longueur d’onde. Déclarez les valeurs sous forme d’occurrence/25 coupes optiques à partir du sommet du glomérule, prises à des intervalles de 1 μm.
11. Isolement des glomérules
- Isoler trois groupes de glomérules de reins frais à l’aide d’une technique de tamisage standard qui permet d’obtenir une pureté de près de 90 % des glomérules de rat15.
- Placez le cortex rénal dans une solution saline tamponnée au phosphate froid (PBS) et hachez-le à l’aide de plusieurs ciseaux fins ou de lames de rasoir.
- Ajouter le tissu haché à une passoire à cellules stériles de 100 μm et poussez-le doucement à l’aide d’un piston de seringue de 5 ml et de 50 à 100 ml de PBS froid.
NOTE: La plupart des tubules sont retenus pendant le passage des glomérules. - Placez la fraction glomérules enrichie sur un filtre de 70 μm et lavez-les abondamment avec du PBS froid. Lavez le filtre avec 100 à 200 ml de PBS froid pour enlever la plupart des tubules restants.
- Prélever les glomérules du filtre à l’aide de 1 à 2 mL de PBS froid, centrifuger (10 000 × g, 2 min, 4 °C) et les congeler dans de l’azote liquide jusqu’à l’isolement de l’ARN.
NOTE: La pureté glomérulaire déterminée par microscopie à contraste de phase est de >90%, et le rendement est d’environ 10 mg de 2 reins.
12. Isolement de l’ARN glomérulaire
- Homogénéiser la pastille de glomérules congelée à l’aide du réactif d’isolement d’ARN en ajoutant 400 μL du réactif et en brisant la pastille à l’aide d’un embout de pipette de 200 μL, suivi d’un bref vortex et de 5 minutes d’incubation à RT16.
- Ajouter 40 μL de 1-bromo-3-chloropropane (BCP), vortex pendant 15 s et maintenir à TA pendant 15 min.
- Centrifuger à 12 000 × g, 15 min, 4 °C. Retirez la couche aqueuse, diluez la couche inférieure avec un volume égal d’éthanol à 70 % et chargez-la directement sur une colonne d’essorage (voir le tableau des matériaux).
- Après les lavages, chacun consistant à ajouter la solution respective à la colonne suivie d’une centrifugation à 12 000 x g, 15 s, 26 °C [3 au total, les 2 premiers avec 500 μL de RPE (tampon de lavage doux exclusif à l’éthanol pour éliminer les traces de sels, 3ème lavage avec 500 μL d’EtOH à 80%], éluer l’ARN par addition de 15 μL deH2 O et centrifugeuse, comme pour les lavages. Vérifier la concentration et la pureté de l’ARN et transporter les échantillons d’ARN à l’installation centrale pour l’analyse des nanocordes17,18.
REMARQUE : Le rendement total en ARN est d’environ 1 à 2 μg. Ici, les 24 échantillons contenaient 200 ng d’ARN à 30 ng / μL.
13. Analyse des nanocordes
REMARQUE: La technologie des nanocordes est basée sur la détection numérique et le codage moléculaire direct des molécules cibles qui utilisent des paires de sondes codées par couleur. La sonde Capture porte une fraction biotine à l’extrémité 3', et la sonde Reporter porte le signal à son extrémité 5'.
- Expédiez les paires de sondes génétiques Nanostring et les CodeSets à l’installation Genomic Core de l’État du Michigan et utilisez-les selon les instructions de NanoString.
REMARQUE: Il y a six positions pour les codes de couleur, et chaque position peut être l’une des quatre couleurs, permettant une grande diversité de balises qui peuvent chacune être résolues et identifiées individuellement lors de la collecte de données. - Obtenez les données recueillies par le personnel de l’installation Genomic Core à l’aide de l’analyseur exclusif Nanostring nCounter Digital, qui recueille les champs de vision à l’aide d’un objectif de microscope et d’une caméra CCD et tabule et affiche le nombre de codes à barres.
- Importez les données brutes dans le logiciel nSolver de Nanostring pour analyse. Normalisez les données normalisées à l’aide de leurs paramètres par défaut et comparez les données entre les groupes comme indiqué dans leur manuel.
NOTE: L’objectif était de surveiller les changements génétiques précédemment montrés comme étant altérés dans le tissu cortical à partir d’un modèle UUO19, maladie rénale 17,20,21,22,23,24,25,26. Un total de 126 gènes, y compris les témoins positifs et négatifs recommandés, ont été analysés dans chaque groupe de glomérules (CONT, SHAM ET UUO).
Résultats
Trois groupes de glomérules ont été isolés à l’aide d’une technique de tamisage standard qui permet d’obtenir une pureté de près de 90% des glomérules de rat15. Le premier groupe de glomérules provenait du rein gauche de rats SD qui ont subi une pince de l’uretère du rein gauche pendant 5 semaines, UUO (5 mâles, 3 femelles). Le deuxième groupe de glomérules a été isolé du rein témoin controlatéral du même rat, CONT (5 mâles, 3 femelles). Le troisième groupe de glomérules a été isolé chez des rats SD qui ont subi une chirurgie SHAM, et le rein gauche a été utilisé pour l’isolement des glomérules après 5 semaines, SHAM (4 mâles, 4 femelles).
Altérations morphologiques
L’extériorisation du rein obstrué pour l’imagerie a révélé un rein grossièrement élargi, environ quatre fois la taille normale, avec une fine épithélium visible à travers l’intérieur du rein rempli de liquide. Grâce à un objectif 20x, utilisant l’éclairage par épifluorescence et un cube FITC/Rhodamine à double passage, le changement le plus apparent a été l’amincissement de l’épithélium tubulaire et l’effondrement uniforme des lumières tubulaires sur toute la longueur tubulaire. L’histologie a été bien décrite et est sévère à une semaine d’UUO10,11,12. Le nombre de glomérules visibles à la surface chez les rats MWF et SD a augmenté après cinq semaines d’obstruction unilatérale de l’uretère. La figure 1A montre la méthode utilisée pour créer le modèle UUO. Le rein droit est intact et fournit un taux de filtration glomérulaire adéquat pour le rat. Le nombre de glomérules par champ utilisant un objectif 20x (363 μm x 363 μm) a été compté et illustré dans un graphique de la figure 1B. Le nombre de glomérules de surface chez les rats MWF est passé de 1,08 ± 0,11/champ chez les rats non traités à 2,97 ± 0,65/champ dans le groupe UUO de cinq semaines. Les rats SD sont passés de l’absence de glomérules de surface à 2,02 ± 0,37/champ après 5 semaines d’UUO.
Des images intravitales à 2 photons ont été prises de ces rats après injection de TR-RSA (rouge), d’un dextrane Cascade Blue de 10 kDa (10 kDa-CB) et de Hoechst 33342 pour marquer les noyaux (cyan). Ceux-ci sont montrés pour les rats MWF normaux (figure 1C), les rats MWF après cinq semaines d’UUO (figure 1D) et les rats SD après cinq semaines d’UUO (figure 1E). Ces images mettent en évidence les altérations spectaculaires qui se produisent dans les épithéliums tubulaires. Les lysosomes tubulaires proximaux, qui sont normalement de petites accumulations ponctuées de couleur orange chez les rats MWF et SD non traités, deviennent de grandes structures vacuolaires singulières qui remplissent la majorité de la cellule tubulaire rétrécie. Comme indiqué par l’albumine TR-RSA, le système vasculaire semblait redressé et, dans de nombreux vaisseaux, dépourvu de globules rouges, ne montrant que du plasma en flux. La fixation des reins a révélé que le cortex s’était aminci en une peau fibreuse pas plus épaisse qu’un millimètre. Ces observations concordent avec la littérature ancienne utilisant ce modèle 3,10,11,12.
Altérations de la dynamique vasculaire rénale et de la perméabilité glomérulaire
Le débit sanguin rénal a été significativement réduit dans les groupes UUO MWF et SD de cinq semaines par rapport aux rats non traités (Figure 2). Les rats MWF exploités par simulacre avaient un débit péritubulaire de globules rouges de 885 ± 25 μm/s. Le débit péritubulaire des globules rouges chez les rats UUO MWF et SD de cinq semaines a diminué à 250 ± 100 μm/s et 200 ± 125 μm/s, respectivement. Ces valeurs ont été calculées en recueillant des balayages de ligne à travers les vaisseaux péritubulaires pour calculer la vitesse des globules rouges. La figure 2D montre un graphique de ces données.
La vitesse des globules rouges dans les anses capillaires glomérulaires a été significativement diminuée chez les rats UUO MWF et SD de cinq semaines par rapport aux MWF non traités (Figure 3). Dans de nombreux cas, on a constaté que les glomérules avaient des anses capillaires complètement dépourvues de globules rouges. Les débits de globules rouges de la boucle capillaire étaient de 1 405 ± 425 μm/s, 250 ± 220 μm/s ± et 190 ± 200 μm/s ou MWF non traité, des rats UUO MWF à cinq semaines et des rats UUO SD à cinq semaines, respectivement (figure 3D). Dans les boucles capillaires des groupes UUO de cinq semaines, le débit lent des globules rouges a révélé la présence de globules blancs adhérents, ralentissant ou bloquant le débit, seul le flux plasmatique étant visualisé en aval de l’obstruction partielle ou totale. Pour quantifier cette observation, le nombre de globules blancs adhérents trouvés dans un volume 3D a été compté, puis normalisé à l’occurrence pour chaque 10 μm de profondeur de volume 3D. La structure des globules blancs adhérents a pu être discernée en utilisant la fluorescence du colorant nucléaire cyan de Hoechst 33342. Malheureusement, la plus grande diffusion de photons des lumières émettrices bleues a limité l’identification fiable des globules blancs par leurs noyaux aux 10 sections optiques supérieures à partir du haut, prises à des pas de 1 μm de volume glomérulaire. Les rats MWF non traités avaient moins de 0,125 ± 0,05 GB/10 coupes optiques à partir du haut, prises à un volume de pas de 1 μm, tandis que ce nombre augmentait à 1,5 ± 0,5 et 3,25 ± 0,7 chez les rats UUO MWF de 5 semaines et UUO SD de 5 semaines, respectivement (figure 3E).
Une autre altération vasculaire qui peut également expliquer la réduction du débit de globules rouges dans les groupes UUO de 5 semaines était l’apparition régulière de formations de Rouleaux (globules rouges groupés qui adhèrent dans une configuration de « pièces empilées », voir l’encart de la figure 3F). Les formations de Rouleaux s’écoulent plus lentement et peuvent être arrêtées par un WBC adhérent. Les rats WMF non traités n’ont pratiquement aucune formation de Rouleaux dans leurs capillaires glomérulaires, n’ayant que 0,05 ± 0,05 occurrences par 25 sections optiques à partir du sommet, prises par pas de 1 μm. Les rats UUO MWF et SD de cinq semaines ont connu une augmentation marquée des formations de Rouleaux de 2,27 ± 0,46 et de 1,46 ± 0,73 par 25 sections optiques partant du haut, prises par pas de 1 μm, respectivement (figure 3F).
En plus de la réduction des débits globules rouges observée avec UUO, une augmentation de la perméabilité à l’albumine a été observée. Il y avait une plus grande hétérogénéité dans la perméabilité de l’albumine entre les glomérules. Parfois, l’accumulation d’albumine dans l’espace de Bowman était suffisamment intense pour être clairement visible (figure 4B, astérisque). Le coefficient de tamisage glomérulaire de l’albumine est passé de 0,015 ± 0,002 chez les MWF non traités, à 0,045 ± 0,05 chez les MWF UUO de 5 semaines et à 0,052 ± 0,075 chez les rats UUO SD de cinq semaines.
Altération de la fonction tubulaire proximale
Fait intéressant, l’albumine filtrée n’a pas pu être détectée dans les cellules tubulaires proximales après UUO. Le segment S1 endocytose normalement de grandes quantités d’albumine27,28,29,30, comme le montrent ici dans des conditions physiologiques chez des rats MWF non traités (Figure 5A). Cette même absorption n’a pas pu être observée dans le MWF ou le SD PT après 5 semaines d’UUO (Figure 5B,C). Les tubules proximaux entourant les glomérules imagés entre 45 et 60 minutes après la perfusion de TR-RSA ont été notés pour la présence (1) ou l’absence (0) d’albumine. Il est important de noter que dans des conditions physiologiques, le segment S1 se lie et internalise avidement l’albumine avec peu ou pas d’albumine atteignant les tubules distaux ou les canaux collecteurs. Par conséquent, il va de soi que ces derniers segments tubulaires proximaux peuvent ne pas contenir d’albumine, ce qui entraîne une positivité fractionnée pour l’absorption d’albumine inférieure à 1,0. La figure 5D montre un graphique avec les résultats de la notation de l’absorption de l’albumine du tubule proximal. La MWF non traitée avait une valeur d’absorption fractionnelle du tubule proximal de 0,556 ± 0,126. Les rats UUO MWF et SD à cinq semaines avaient des valeurs significativement plus faibles de 0,049 ± 0,126 et 0,00 ±0,00, respectivement.
Des études ont également été réalisées sur des rats UUO MWF de 12 semaines (tableau 1). Douze semaines d’UUO est le temps standard utilisé pour les études sur la souris pour induire des glomérules de surface. Trois rats mâles UUO ont été imagés, et la densité glomérulaire a encore augmenté pour atteindre 6,16 ± 1,83 glomérules par champ 20x chez ces rats. Le débit des globules rouges était de 293 ± 67 μm/s, l’adhérence des globules blancs était de 1,47 ± 1,12, les deux étant similaires aux données UUO sur 5 semaines. La CGC de l’albumine a également augmenté par rapport aux rats UUO à 5 semaines à 0,109 ± 0,04.
Altérations de l’ARNm glomérulaire induites par l’UUO chronique
Le tableau 2 montre tous les gènes (sondes) avec leurs valeurs d’expression groupées et d’écart-type. Notez que les gènes ont été sélectionnés pour l’analyse en fonction de la documentation antérieure de l’altération de la maladie rénale, y compris l’UUO tel que décrit dans la note de la section 13 du protocole. La figure 6 est une carte thermique des données mettant en évidence les changements spectaculaires dans l’expression des gènes pour la plupart des gènes dans les glomérules UUO par rapport aux glomérules témoins ou fictifs.
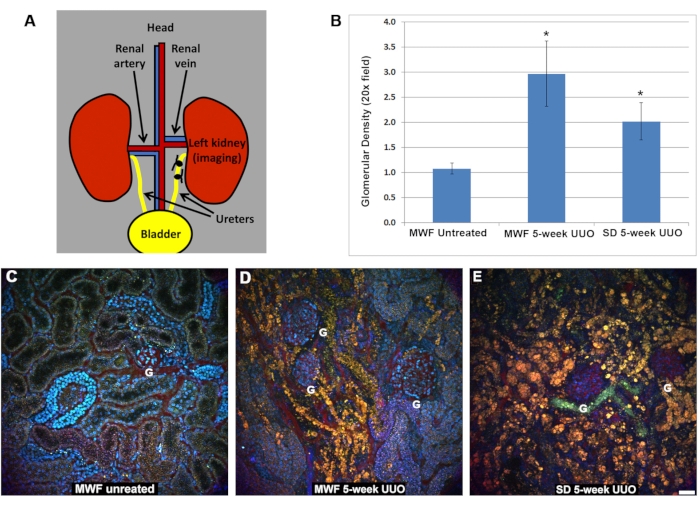
Figure 1 : Augmentation du nombre de glomérules de surface et induction de glomérules de surface chez les rats SD après une UUO de 5 semaines chez des rats MWF. (A) Un schéma chirurgical de l’uretère sur le rein gauche soigneusement libéré de l’artère et de la veine rénales avant d’être obstrué par deux attaches à l’aide d’une suture chirurgicale. (B) Un graphique indiquant l’augmentation du nombre de glomérules de surface présents chez les rats MWF avant et cinq semaines après UUO ainsi que le nombre de glomérules de surface chez les rats SD, qui n’ont normalement pas de glomérules de surface. Le nombre de glomérules de surface chez les rats MWF est passé de 1,08 ± 0,11/champ chez les rats non traités à 2,97 ± 0,65/champ dans le groupe UUO de 5 semaines. Les rats SD sont passés de l’absence de glomérules de surface à 2,02 ± 0,37/champ. Des images reconstruites en trois dimensions montrent la surface rénale pour le MWF (C) non traité, le MWF après 5 semaines UUO (D) et le SD après cinq semaines UUO (E). Notez l’apparition de grandes structures vacuolaires orange qui ont fusionné de petits lysosomes individuels en grands corps anormaux. L’UUO à 5 semaines chez les rats SD n’a pas donné lieu à des zones ressemblant à des épithéliums tubulaires normaux observés chez C et partiellement chez D. Le système vasculaire semblait redressé dans certaines régions et, dans de nombreuses régions, présentait des occlusions partielles qui permettaient au plasma mais pas aux globules rouges de circuler. (n = 3 rats mâles par groupe) Barres d’échelle = 40 μm. Les barres d’erreur indiquent l’écart type. Abréviations : UUO = obstruction urétérale unilatérale; ET = Sprague-Dawley; MWF = Munich Wistar Frömter; G = glomérule ; GR = globules rouges. Veuillez cliquer ici pour voir une version agrandie de cette figure.
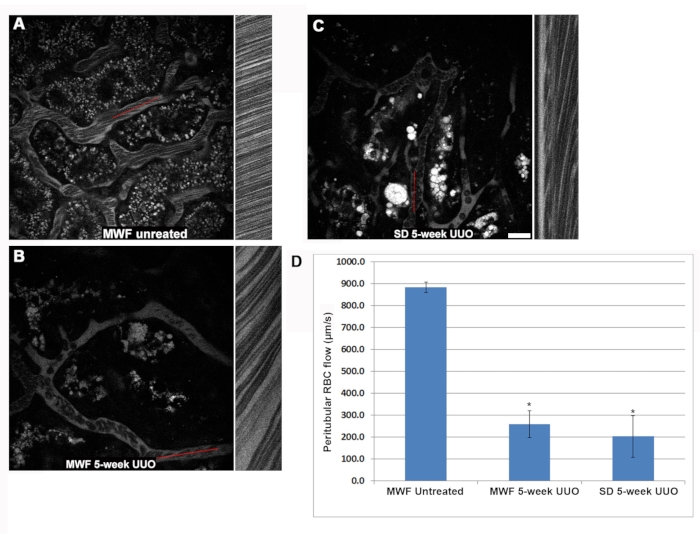
Figure 2 : Réduction du flux de globules rouges dans le système vasculaire péritubulaire superficiel après 5 semaines d’UUO. Des balayages linéaires ont été prélevés dans les vaisseaux sanguins péritubulaires pour déterminer la vitesse d’écoulement des globules rouges en μm/s. En bref, les lignes de référence rouges montrées en A, B et C représentent une petite région dans laquelle la même zone de pixel large a été balayée à plusieurs reprises, et les images empilées dans une colonne pour visualiser la distorsion causée par les globules rouges, qui voyagent plus vite que le microscope ne peut les acquérir. La colonne adjacente à la figure de référence est la ligne, la pente de la distorsion RBC étant utilisée pour calculer la vitesse (axe x = distance et axe y = temps). Ici, les pentes progressivement plus raides correspondent à des vitesses de globules rouges plus lentes, car elles restent plus longues dans la région des lignes. Notez la différence dans l’apparence des globules rouges chez les rats MWF (A) non traités par rapport aux images UUO à cinq semaines pour les rats MWF (B) et SD (C). Les vitesses d’écoulement des globules rouges pour les trois groupes de rats sont indiquées en D. Le débit péritubulaire des globules rouges dans les FMM non traitées était en moyenne de 885 ± μm/s. Ces valeurs ont chuté de façon significative cinq semaines après l’UUO chez les rats MWF et SD à 250 ± 100 μm/s et 200 ± 125 μm/s, respectivement. Barre d’échelle = 20 μm, n = 3 rats mâles par groupe. Les barres d’erreur indiquent l’écart type. Abréviations : UUO = obstruction urétérale unilatérale; ET = Sprague-Dawley; MWF = Munich Wistar Frömter; GR = globules rouges; WBC = globules blancs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
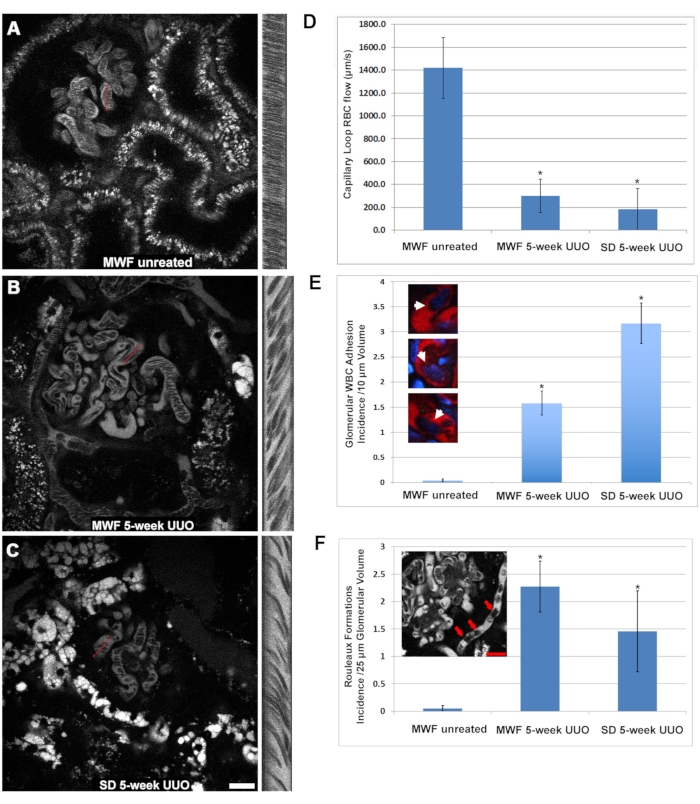
Figure 3 : Réduction significative du flux de globules rouges de la boucle capillaire glomérulaire et activation induite de l’adhésion des globules blancs par UUO à 5 semaines. La même approche de balayage linéaire utilisée pour déterminer le débit péritubulaire des globules rouges a été utilisée pour étudier les altérations du débit sanguin capillaire glomérulaire. Les panneaux A, B et C montrent une disposition similaire à celle de la figure 2 et se concentrent sur un glomérule dans les MWF exploités fictifs, les MWF UUO de cinq semaines et les SD UUO de cinq semaines, respectivement. (D) Un graphique révélant le débit physiologiquement élevé des globules rouges dans les boucles capillaires des rats MWF exploités simulés, en moyenne de 1 405 ± 425 μm/s ± 425, a diminué à 250 ± 220 μm/s et 190 ± 200 μm/s pour les rats UUO MWF de 5 semaines et UUO SD de 5 semaines, respectivement. Lors de l’examen des boucles capillaires glomérulaires, les globules blancs adhérents étaient facilement visibles lors de la focalisation à travers le glomérule. Des coupes optiques tridimensionnelles de glomérules individuels ont été prélevées, et les 10 premières sections optiques, espacées de 1 μm, ont été utilisées pour mesurer le nombre de globules blancs adhérents. Les rats MWF non traités n’avaient pratiquement aucun globule occidental universel visible dans leurs volumes, avec une moyenne inférieure à 0,125 ± 0,05 GB/10 sections optiques à partir du haut, prises par pas de 1 μm. Chez les rats UUO MWF et SD de 5 semaines, ces chiffres sont passés à 1,5 ± 0,5 et 3,25 ± 0,7 WBC/10 sections optiques à partir du haut, prises par pas de 1 μm, respectivement. Ces résultats sont présentés dans le graphique du panneau E, avec des insertions de couleur montrant les globules capillaires occlusant les globules capillaires. Les formations de Rouleaux (flèches, encadrées dans le panneau F) apparaissent comme des globules rouges étroitement liés entre eux dans une configuration de « pièces empilées » qui conservent en grande partie leur regroupement groupé même dans la turbulence du flux sanguin. Ces structures pathologiques étaient facilement discernables à de plus grandes profondeurs dans le glomérule. Les rats MWF exploités par simulacre étaient en grande partie dépourvus de ces structures, n’ayant que 0,05 ± 0,05 occurrences à 25 sections optiques du sommet, prises à des pas de 1 μm de volume glomérulaire. En revanche, l’UUO de 5 semaines chez les rats MWF et SD a eu une augmentation marquée des formations de Rouleaux avec des occurrences de 2,27± 0,46 et 1,46 ± 0,73/25 sections optiques à partir du haut, prises par pas de 1 μm, respectivement. Barres d’échelle = 20 μm, n = 3 rats mâles par groupe. Les barres d’erreur indiquent l’écart type. Abréviations : UUO = obstruction urétérale unilatérale; ET = Sprague-Dawley; MWF = Munich Wistar Frömter; GR = globules rouges; WBC = globules blancs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
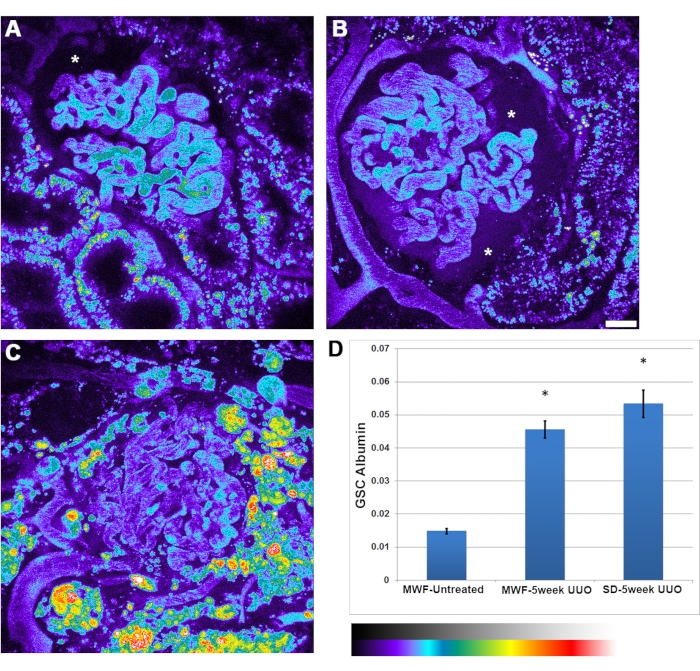
Figure 4 : Augmentation significative de la perméabilité de l’albumine capillaire glomérulaire après 5 semaines d’UUO. Les panneaux A, B et C montrent des images pseudo-colorées d’un volume 3D pour le canal de l’albumine sérique de rat chez des rats MWF non traités, UUO MWF 5 semaines et UUO SD de cinq semaines, respectivement. Les images sont présentées dans une palette de pseudo-couleurs pour mettre en évidence la quantité appréciable d’albumine filtrée observée dans l’espace du Bowman, en particulier dans le panneau B (astérisque). (A) L’espace de Bowman (astérisque) montre le niveau normal d’albumine généralement observé chez les rats MWF non traités, indiscernable à l’œil. Des images de glomérules ont été prises avant la perfusion d’albumine pour soustraire les valeurs de fluorescence de fond de celles prises après l’administration d’albumine. (D) Un graphique avec le coefficient de tamisage glomérulaire de l’albumine chez les rats MWF non traités, ayant une valeur de 0,015 ± 0,002. Cette valeur a augmenté de manière significative à 0,045± 0,05 chez les rats UUO MWF à 5 semaines et à 0,052 ± 0,075 chez les rats UUO SD de cinq semaines. Ce paramètre est une valeur rapportée des intensités fluorescentes de l’espace de Bowman divisée par la valeur du plasma et n’a pas d’unité de mesure associée. Barre d’échelle = 20 μm, n = 3 rats mâles par groupe. L’échelle d’intensité des pseudocouleurs est située sous le panneau D. Les barres d’erreur indiquent l’écart type. Abréviations : UUO = obstruction urétérale unilatérale; ET = Sprague-Dawley; MWF = Munich Wistar Frömter; GR = globules rouges; WBC = globules blancs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
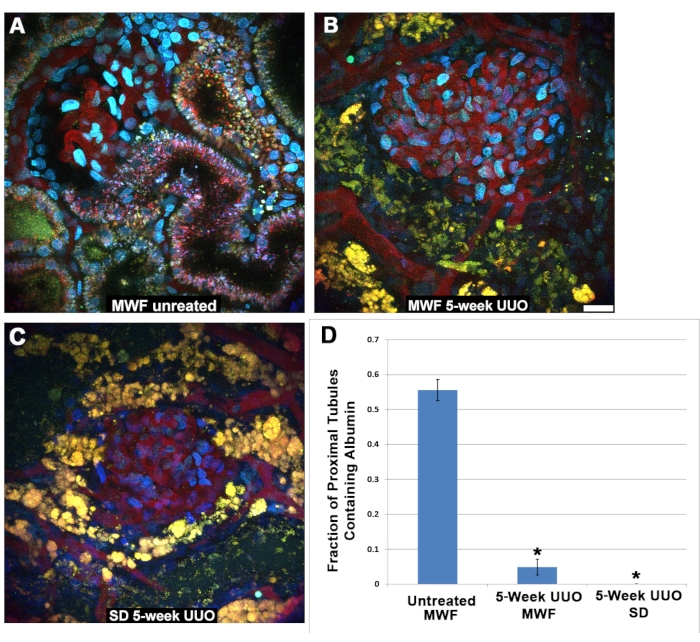
Figure 5 : Fonction réduite dans les tubules proximaux après une UUO de 5 semaines. (A) Image d’un glomérule superficiel et du segment S1 d’un rat Wistar Frömter normal de Munich prise 40 minutes après perfusion de TR-RSA et de dextran Cascade Blue. L’internalisation du TR-RSA peut être observée dans le segment S1 et le tubule proximal. En revanche, les rats MWF (B) et SD (C), soumis à une UUO de 5 semaines, présentent des tubules proximaux gravement altérés avec une absorption minimale ou nulle de TR-RSA. Les lysosomes autofluorescents (A) normalement petits et ponctués deviennent de grandes structures jaune-orange vacuolaires, souvent avec un effondrement complet de la lumière tubulaire, qui ne peut être trouvé dans les ensembles de données tridimensionnels. (C) Les tubules distaux normalement dépourvus de toute forme d’autofluorescence contiennent maintenant des accumulations autofluorescentes. La notation des tubules proximaux entourant les glomérules dans des images similaires prises 45 à 60 minutes après la perfusion, pour l’absorption d’albumine, a montré une différence significative entre le groupe MWF opéré par simulacre et les deux groupes UUO de 5 semaines. Les rats MWF non traités avaient une valeur d’absorption fractionnée du tubule proximal de 0,556 ± 0,126. Les rats UUO MWF et SD à cinq semaines avaient des valeurs significativement plus faibles de 0,049 ± 0,126 et 0,00 ±0,00, respectivement. Barre d’échelle = 20 μm, n = 3 rats mâles par groupe. Les barres d’erreur indiquent l’écart type. Abréviations : UUO = obstruction urétérale unilatérale; ET = Sprague-Dawley; MWF = Munich Wistar Frömter; GR = globules rouges; globules blancs = globules blancs; TR-RSA = albumine sérique de rat rouge du Texas. Veuillez cliquer ici pour voir une version agrandie de cette figure.
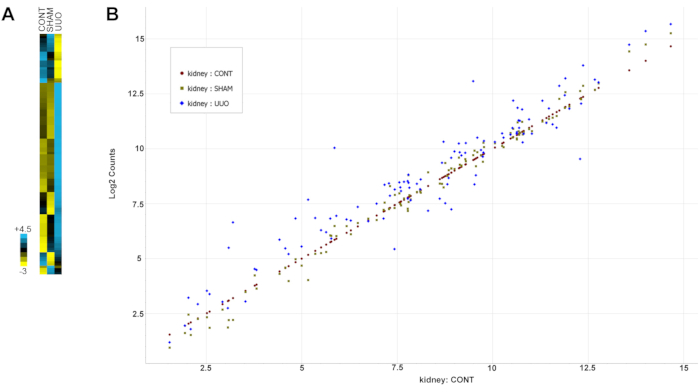
Figure 6: Altérations de l’expression génique avec UUO . (A) Une carte thermique des données. (B) Changements génétiques normalisés pour toutes les données d’un nuage de points. L’expression des gènes dans les reins témoins a été tracée de l’expression faible à élevée, et les gènes des reins SHAM et UUO ont été comparés aux niveaux d’expression du contrôle. Les points de données génétiques proches de la valeur diagonale des gènes témoins indiquent des niveaux d’expression similaires pour les deux groupes, tandis que les points de données au-dessus ou au-dessous de la diagonale indiquent des niveaux d’expression plus élevés ou plus faibles, respectivement. Notez que les gènes SHAM se regroupent plus près de l’expression diagonale de contrôle que les gènes UUO, qui sont plus variables. Abréviation : UUO = obstruction urétérale unilatérale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Progression de la blessure de 5 à 12 semaines d’UUO. Comparaison des paramètres d’imagerie UUO à 5 et 12 semaines chez trois rats MWF mâles et trois rats mâles SD à chaque point temporel. Les données sur cinq semaines sont les mêmes que dans les figures précédentes. Notez l’augmentation de la densité glomérulaire et de la CGC pour l’albumine avec UUO continue. Abréviations : UUO = obstruction urétérale unilatérale; ET = Sprague-Dawley; MWF = Munich Wistar Frömter; GSC = coefficient de tamisage glomérulaire. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Analyse des marqueurs d’inflammation dans les glomérules de l’UUO et des rats témoins. Les paires de sondes génétiques et les CodeSets ont été conçus et utilisés selon les instructions de NanoString. Plus de 100 gènes ont été analysés, ainsi que des contrôles positifs et négatifs tels que spécifiés par Nanostring. Tous les gènes (sondes) avec leur expression groupée et leurs valeurs SD sont indiqués dans le tableau. La figure 6A est une carte thermique des données, tandis que la figure 6B présente les changements génétiques pour toutes les données d’un nuage de points. Notez les similitudes entre les témoins et SHAM et les changements distincts pour la plupart des gènes dans l’UUO. Abréviations : UUO = obstruction urétérale unilatérale; ET = écart type. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
L’étude de la physiologie glomérulaire a vu de nombreuses approches différentes, notamment l’utilisation de la microponction, la perfusion de glomérules isolés et la microscopie. La disponibilité de glomérules de surface chez les rats Wistar de Munich, souches de Fromter et Simonsen, a permis des études dynamiques in vivo . Une note importante pour les chercheurs qui adoptent cette technologie est la nécessité de définir des paramètres d’acquisition pour maintenir des images cohérentes entre les études, afin que l’autofluorescence dans les tissus reste cohérente. L’utilisation d’un cube d’épifluorescence fluorescéine/rhodamine à double passage et l’ajustement des paramètres de gain aux canaux d’émission verts et rouges pour imiter sur l’écran de l’ordinateur ce qui est vu à travers les oculaires assureront une signature de couleur cohérente dans l’autofluorescence, même entre différents systèmes de microscope.
La souche de Fromter a été largement utilisée car elle a un nombre réduit de glomérules totaux, ~75% normal, et les mâles développent spontanément une hypertension vers l’âge de 12 semaines, avec protéinurie progressive et sclérose glomérulaire focale subséquente, mourant finalement d’insuffisance rénale12. L’utilisation de ces rats et l’ajout de la microscopie à 2 photons avec sa phototoxicité réduite, une profondeur de pénétration améliorée et la capacité de visualiser simultanément plusieurs sondes fluorescentes ont ouvert la voie à de nouvelles découvertes 1,4,5. Avec le développement du matériel informatique et des logiciels, les données quantitatives sont maintenant la norme pour tous les laboratoires à 2 photons. De multiples techniques quantitatives ont été développées et appliquées aux processus glomérulaires, tubulaires proximaux, vasculaires et interstitiels dans des conditions physiologiques et pathologiques 1,4,5,27,28,29,30.
Les installations de génération de souris transgéniques ont ajouté une nouvelle dimension à l’étude de la physiologie et de la pathologie rénales, et ce n’était qu’une question de temps avant que cela ne soit combiné avec la microscopie à 2 photons pour délimiter davantage l’importance de produits géniques spécifiques dans la structure et la fonction rénales. Cependant, les glomérules de souris, sauf chez les souris très jeunes, sont situés à plus de 100 μm de la surface du rein9. La microscopie à deux photons est mieux entreprise à une profondeur comprise entre 20 et 50 μm comme résolution, et l’intensité de la fluorescence diminue rapidement par la suite en raison de la diffusion de la lumière émise et de l’absorption de l’interaction avec l’hémoglobine. Par conséquent, il était nécessaire d’induire des glomérules de surface. L’approche couramment utilisée est un modèle d’obstruction unilatérale prolongée pendant 12 semaines. Comme ces modèles ne permettent pas de déterminer les valeurs de référence, il n’est pas possible de séparer les effets de l’UUO du procédé étudié.
En utilisant des rats MWF, on peut comparer la fonction glomérulaire de base avec celle suivant UUO. Ce modèle UUO est connu pour induire une inflammation et un taux rapide de fibrose et a été utilisé pour étudier la MRC et la fibrose10,11,12. Comme prévu, il y a eu une augmentation des glomérules de surface chez les rats MWF et SD. De plus, les résultats quantitatifs obtenus à la suite de l’UUO pour les rats MWF et SD étaient très comparables. La réduction du débit sanguin enregistrée ici avait déjà été rapportée en comparant les données microscopiques après UUO aux données de microponction3. Il était également bien connu que l’histologie tubulaire et interstitielle est nettement altérée et que les PT sont pour la plupart non fonctionnels, comme indiqué ici, avec un manque d’endocytose à l’albumine. Les études de la figure 2 et de la figure 3 montrent une réduction spectaculaire du débit des globules rouges dans les capillaires glomérulaires et péritubulaires et une meilleure adhérence au globule blanc. Les réductions du débit sont probablement dues au blocage capillaire dû à l’adhérence WBC et aux formations de rouleaux.
Pour évaluer davantage l’inflammation, nous avons quantifié la perméabilité de l’albumine et montré qu’elle était multipliée par dix. De plus, des glomérules isolés ont montré que l’expression de l’ARNm augmentait pour de nombreux gènes précédemment connus pour être augmentés dans l’inflammation rénale dans une variété d’états de maladie rénale 17,19,20,21,22,23,24,25,26 . Les augmentations de la densité de surface glomérulaire et de la perméabilité à l’albumine étaient progressives, comme le montrent les données UUO sur 12 semaines. Les données actuelles sont les premières à montrer directement que les glomérules subissent des dommages structurels importants, une inflammation et des changements moléculaires dans le modèle UUO. Les résultats sont cohérents avec une étude antérieure sur le tissu rénal entier qui a analysé des biopsies de rein de mouton après UUO, trouvant de multiples marqueurs d’inflammation élevés19. Les résultats actuels indiquent qu’une inflammation marquée existe dans les glomérules, auparavant connus uniquement pour le tissu cortical.
Les données actuelles diffèrent des études antérieures chez la souris où aucun changement n’a été observé dans l’expression des molécules d’adhésion, le dépôt du complément et l’infiltration des neutrophiles entre les glomérules posthydronéphrotiques et normaux de 12 semaines31. De plus, le laboratoire Hickey a utilisé le modèle UUO de 12 semaines pour étudier les réactions immunitaires dans les glomérules de souris. Ils n’ont trouvé aucune différence dans l’infiltration des neutrophiles entre les glomérules de souris âgés de quatre semaines et les glomérules postobstructifs32,33. Ces études ultérieures ont été menées après que le bassin du rein obstrué ait été vidé de l’urine. Nous ne l’avons pas fait car nous voulions déterminer l’effet de l’UUO sur la fonction glomérulaire telle qu’elle serait in vivo, sans éliminer artificiellement le fluide à l’origine de l’obstruction. Enfin, l’utilisation de l’UUO chez la souris est remplacée par l’imagerie des glomérules à plus de 100 μm sous la surface. Bien que possible, il y a un compromis entre la résolution et l’intensité, les deux étant considérablement réduits lorsque l’on dépasse 50 μm34.
Les résultats présentés ne sont pas surprenants si l’on rassemble les données de la littérature existante sur les changements histologiques, la formation de glomérules atubulaires, l’inflammation, la fibrose, l’hémodynamique10,11,12. Les données présentées, y compris l’adhésion WBC, les formations de rouleaux, les marqueurs d’inflammation moléculaire glomérulaire et l’augmentation de la perméabilité à l’albumine, indiquent en outre l’inflammation étendue qui se poursuit dans ce modèle UUO même à cinq semaines et également présente à douze semaines. De toute évidence, l’UUO chronique n’est pas un état physiologique, et l’utilisation de l’UUO pour induire des glomérules de surface représente un modèle de blessure. Les rats MWF, qui ont des glomérules de surface dans des conditions physiologiques, peuvent être étudiés longitudinalement au fur et à mesure que des blessures se produisent. Il est possible de générer des rats transgéniques, et de nombreux chercheurs les créent avec des biocapteurs pour poser des questions spécifiques. En particulier, le Medical College of Wisconsin a maintenant une colonie de rats MWF et a fabriqué des rats transgéniques dans le but d’étudier les processus glomérulaires dans des conditions physiologiques et pathologiques. Ces rats MWF offrent une excellente occasion d’étudier les processus glomérulaires chez les rats normaux, malades et génétiquement modifiés.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par les subventions RO1DK091623 et P30DK079312 de l’Institut national du diabète et des maladies digestives et rénales (à B.A.M.). Nous remercions le personnel de l’installation de base en génomique de l’installation de soutien à la technologie de la recherche (RTSF) de la Michigan State University pour avoir effectué l’analyse des nanocordes.
matériels
| Name | Company | Catalog Number | Comments |
| 70 µm sterile cell strainer | Corning | #421751 | |
| 100 µm sterile cell strainer | Corning | #421752 | |
| CA Micro scissors Model 1C300 | Electron Microscopy Sciences | Cat# 72930 | |
| Electric heating pad | Sunbeam | Kroger | |
| Handling Forceps | Electron Microscopy Sciences | Cat# 72962 | |
| Kelly Hemostatic Forceps (straight) | Electron Microscopy Sciences | Cat#72930 | |
| Leica Dive SP-8 Multi-Photon Inverted Microscope | Leica Microsystems | Note: Version 7.1r1 | |
| MaiTai DeepSee titanium-sapphire laser | Spectra-Physics | NA | |
| Mayo Dissecting Scissors | Electron Microscopy Sciences | Cat# 78180-1C3 | |
| Metamorph Image processing Software | Molecular Dynamics | Cat# 78266-04 | |
| Microsoft Excel | Microsoft Corportation | 2007 version | |
| Quant-iT RNA Assay Kit | Invitrogen/ThermoFisher | Q33140 | |
| Reptitherm Undertank Heater | Zoomed | Amazon | |
| RNeasy MinElute Cleanup Kit (Spin columns) | Qiagen | 74204 | |
| RPE buffer | Qiagen | 1018013 | |
| Strate-Line Autoclave Tape | Fisher Scientific | Cat# 11-889-1 | |
| TRI Reagent | Sigma | T9424 | |
| Willco-dish Coverslip Bottom Dishes (50 mm/40 mm coverslip) | Electron Microscopy Sciences | Cat# 70665-07 |
Références
- Dunn, K. W., Molitoris, B. A., Dagher, P. C. The Indiana O'Brien center for advanced renal microscopic analysis. American Journal of Physiology-Renal Physiology. 320 (5), 671-682 (2021).
- Dunn, K. W., et al. Functional studies of the kidney of living animals using multicolor two-photon microscopy. American Journal of Physiology-Cell Physiology. 283 (3), 905-916 (2002).
- Eisenbach, G., Liew, J., Boylan, J., Manz, N., Muir, P. Effect of angiotensin on the filtration of protein in the rat kidney: a micropuncture study. Kidney International. 8 (2), 80-87 (1975).
- Sandoval, R. M., Molitoris, B. A. Intravital multiphoton microscopy as a tool for studying renal physiology and pathophysiology. Methods. 128, 20-32 (2017).
- Sandoval, R. M., Molitoris, B. A., Palygin, O. Fluorescent imaging and microscopy for dynamic processes in rats. Methods in Molecular Biology. 2018, 151-175 (2019).
- Huber, T., et al. Molecular basis of the functional podocin-nephrin complex: mutations in the NPHS2 gene disrupt nephrin targeting to lipid raft microdomains. Human Molecular Genetics. 12 (24), 3397-3405 (2003).
- Kawachi, H., Koike, H., Kurihara, H., Sakai, T., Shimizu, F. Cloning of rat homologue of podocin: expression in proteinuric states and in developing glomeruli. Journal of the American Society of Nephrology JASN. 14 (1), 46-56 (2003).
- Roselli, S., et al. Early glomerular filtration defect and severe renal disease in podocin-deficient mice. Molecular and Cellular Biology. 24 (2), 550-560 (2004).
- Schießl, I., Bardehle, S., Castrop, H. Superficial nephrons in BALB/c and C57BL/6 mice facilitate in vivo multiphoton microscopy of the kidney. PloS One. 8 (1), 52499 (2013).
- Chevalier, R., Forbes, M., Thornhill, B. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney International. 75 (11), 1145-1152 (2009).
- Forbes, M., Thornhill, B., Chevalier, R. Proximal tubular injury and rapid formation of atubular glomeruli in mice with unilateral ureteral obstruction: a new look at an old model. American Journal of Physiology. Renal physiology. 301 (1), 110-117 (2011).
- Yang, H. -. C., Zuo, Y., Fogo, A. B. Models of chronic kidney disease. Drug Discovery Today. Disease Models. 7 (1-2), 13-19 (2010).
- Hackl, M. J., et al. Tracking the fate of glomerular epithelial cells in vivo using serial multiphoton imaging in new mouse models with fluorescent lineage tags. Nature Medicine. 19 (12), 1661-1666 (2013).
- Kitching, A., Kuligowski, M., Hickey, M. In vivo imaging of leukocyte recruitment to glomeruli in mice using intravital microscopy. Methods in Molecular Biology. 466, 109-117 (2009).
- Savin, V. J., Terreros, D. A. Filtration in single isolated mammalian glomeruli. Kidney International. 20 (2), 188-197 (1981).
- Chomczynski, P., Sacchi, N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nature Protocols. 1 (2), 581-585 (2006).
- El Karoui, K., et al. Endoplasmic reticulum stress drives proteinuria-induced kidney lesions via Lipocalin 2. Nature Communications. 7, 10330 (2016).
- VA, M., et al. Multiplexed measurements of gene signatures in different analytes using the Nanostring nCounter Assay System. BMC Research Notes. 2, 80 (2009).
- Springer, A., et al. A combined transcriptome and bioinformatics approach to unilateral ureteral obstructive uropathy in the fetal sheep model. The Journal of Urology. 187 (2), 751-756 (2012).
- Braun, F., Becker, J., Brinkkoetter, P. Live or let die: Is there any cell death in podocytes. Seminars in Nephrology. 36 (3), 208-219 (2016).
- Kim, W. The role of angiopoietin-1 in kidney disease. Electrolyte & Blood Pressure E & BP. 6 (1), 22-26 (2008).
- Liu, F., Zhuang, S. Role of receptor tyrosine kinase signaling in renal fibrosis. International Journal of Molecular Sciences. 17 (5), 972 (2016).
- Martini, S., et al. Integrative biology identifies shared transcriptional networks in CKD. Journal of the American Society of Nephrology: JASN. 25 (11), 2559-2572 (2014).
- Mühlberger, I., et al. Integrative bioinformatics analysis of proteins associated with the cardiorenal syndrome. International Journal of Nephrology. 2011, 809378 (2010).
- Satirapoj, B., et al. Periostin: novel tissue and urinary biomarker of progressive renal injury induces a coordinated mesenchymal phenotype in tubular cells. Nephrology, Dialysis, Transplantation. 27 (7), 2702-2711 (2012).
- Fengxin, Z., et al. Numb contributes to renal fibrosis by promoting tubular epithelial cell cycle arrest at G2/M. Oncotarget. 7 (18), 25604-25619 (2016).
- Sandoval, R. M., Molitoris, B. A. Quantifying glomerular permeability of fluorescent macromolecules using 2-photon microscopy in Munich Wistar rats. Journal of Visualized Experiments: JoVE. (74), e50052 (2013).
- Russo, L. M., et al. Impaired tubular uptake explains albuminuria in early diabetic nephropathy. Journal of the American Society of Nephrology: JASN. 20 (3), 489-494 (2009).
- Russo, L. M., et al. The normal kidney filters nephrotic levels of albumin retrieved by proximal tubule cells: retrieval is disrupted in nephrotic states. Kidney International. 71 (6), 504-513 (2007).
- Sandoval, R. M., Wang, E., Molitoris, B. A. Finding the bottom and using it: Offsets and sensitivity in the detection of low intensity values in vivo with 2-photon microscopy. Intravital. 2 (1), 23674 (2014).
- Kuligowski, M. P., Kitching, A. R., Hickey, M. J. Leukocyte recruitment to the inflamed glomerulus: a critical role for platelet-derived P-selectin in the absence of rolling. Journal of Immunology. 176 (11), 6991-6999 (2006).
- Devi, S., et al. Multiphoton imaging reveals a new leukocyte recruitment paradigm in the glomerulus. Nature Medicine. 19 (1), 107-112 (2013).
- Finsterbusch, M., et al. Patrolling monocytes promote intravascular neutrophil activation and glomerular injury in the acutely inflamed glomerulus. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 5172-5181 (2016).
- Shroff, U. N., Gyarmati, G., Izuhara, A., Deepak, S., Peti-Peterdi, J. A new view of macula densa cell protein synthesis. American Journal of Physiology. Renal Physiology. 321 (6), 689-704 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon